细胞冻存保护组合物、体系、方法及应用
文献发布时间:2024-04-18 19:58:30
技术领域
本发明属于生物细胞技术领域,具体涉及一种细胞冻存保护组合物、细胞冻存体系、细胞冷冻保存方法、经冷冻保存的细胞、由冷冻保存的细胞(例如经过复苏以及任选地孵育、培养和/或增殖后)获得的细胞及其应用等等。
背景技术
在生命科学研究中,细胞冻存是生物学研究中的重要环节之一。目前,冷冻保存是长期保存细胞最可靠的技术
在冻结细胞的过程中,细胞内外的水分会形成冰结晶而对细胞造成损害。因此,为了保护细胞不受由冰结晶引发的损害,本领域通常会通过添加冷冻保护剂来减少冷冻过程对细胞的损害。然而,目前最先进的冷冻保护剂(CPA)——有机溶剂二甲基亚砜(DMSO)存在固有毒性的瓶颈问题。据报道
因此,本领域亟需一种高效安全的、新的生物相容性的冷冻保存技术,其不仅可以实现细胞冻存过程中稳定高效的冷冻保护功效,且可以简化操作流程,在不去除冷冻保护剂的情况下完成被保存细胞的复苏、增殖以及下游应用,实现即取即用的快速流程。
发明内容
本发明的目的是提供一种无毒、高效,并且不需要繁琐冻存复苏步骤的新的细胞冷冻保存技术。具体而言,本发明一般涉及一种细胞冻存保护组合物、细胞冻存体系、细胞冷冻保存方法、经冷冻保存的细胞、由冷冻保存的细胞(例如经过复苏以及任选地孵育、培养和/或增殖后)获得的细胞及其制剂和其应用等等。
1.细胞冻存保护组合物
本发明的第一方面提供了一种细胞冻存保护组合物,其包含甜菜碱、海藻酸盐和金属离子(例如二价金属离子)。
在一些实施方案中,在使用本发明的组合物时,甜菜碱和海藻酸盐形成包裹细胞的微液滴,由此甜菜碱作为细胞内渗透保护剂而提供细胞内保护,随后金属离子(例如Ca
在一些实施方案中,本发明的组合物还包含细胞营养物料,其中在使用时,细胞营养物料与甜菜碱和海藻酸盐一起形成包裹细胞的微液滴。
在一些实施方案中,本发明的组合物还包含油相体系,例如含有石蜡油和/或氟化油或主要由石蜡油和/或氟化油组成的油相体系。当油相体系与包含细胞、甜菜碱和海藻酸盐的混合物(例如细胞悬液)接触时,形成包裹细胞的微液滴。在一些实施方案中,所述混合物还含有细胞营养物料。在一些实施方案中,所述接触发生在液滴微流控芯片(例如含有流动聚焦微结构的液滴微流控芯片)上。例如,将油相体系和所述混合物(例如细胞悬液)分别通过液滴微流控芯片而使其接触。
在一些实施方案中,本发明的组合物还包含至少一种表面活性剂,其中在使用时,至少一种表面活性剂被添加到油相体系中。在一些实施方案中,所述至少一种表面活性剂包括或者是非离子型表面活性剂。在一些实施方案中,所述非离子型表面活性剂选自span80、EM90、TtritonX-100、或其任何组合。
在一些实施方案中,本发明的组合物由甜菜碱、海藻酸盐、细胞营养物料、金属离子(例如CaCl
本发明还提供了一种细胞冻存保护组合物的使用溶液,其包含第一溶液和第二溶液,所述第一溶液包含约2-10wt%的甜菜碱和约0.5-2.0wt%海藻酸盐,所述第二溶液包含约0.5-4.0mol/L的金属离子。在一些实施方案中,所述第一溶液还包含细胞营养物料。任选地,所述使用溶液还包含油相体系和至少一种表面活性剂,其中任选地,所述至少一种表面活性剂存在于所述油相体系中。在一些实施方案中,所述第一溶液、所述第二溶液以及任选地所述油相体系(例如含有所述至少一种表面活性剂的油相体系)分开放置。
在一些实施方案中,海藻酸盐包括海藻酸钠、海藻酸钾、海藻酸铵或其任何组合,优选海藻酸钠。在一些实施方案中,当使用时,海藻酸盐的浓度为大约0.5-2.0wt%。在一些实施方案中,当使用时,甜菜碱的浓度为大约2-10wt%。
在一些实施方案中,金属离子是二价金属离子,例如包括钙离子、锌离子、铜离子和钡离子中的一种或多种。优选地,所述二价金属离子由选自以下中的一种或多种化合物提供:氯化钙、氯化锌、氯化铜、氯化钡、硫酸铜或硫酸锌,优选氯化钙。在一些实施方案中,当使用时,金属离子的浓度为大约0.5-4.0mol/L。
在一些实施方案中,本发明的组合物以试剂盒的形式提供。在一些实施方案中,试剂盒还包含使用说明书。
2.细胞冷冻保存方法
本发明的第二方面提供了一种细胞冷冻保存方法,所述方法包括:
(a)提供第一溶液,其包含甜菜碱和海藻酸盐;
(b)提供第二溶液,其包含金属离子;
(c)使细胞与所述第一溶液接触以形成细胞悬液,并利用细胞悬液制备包裹细胞的微液滴;以及,
(d)使所述第二溶液与所述微液滴接触,形成包裹细胞的海藻酸盐(例如海藻酸钙)水凝胶颗粒。
在一些实施方案中,所述第一溶液还包含细胞营养物料。
在一些实施方案中,本发明的方法还包括步骤(e):提供油相体系,例如含石蜡油和/或氟化油或主要由石蜡油和/或氟化油组成的油相体系。
在一些实施方案中,在步骤(c)中,利用液滴微流控芯片(例如含有流动聚焦微结构的液滴微流控芯片)制备包裹细胞的微液滴,其例如包括:将细胞悬液经由芯片上设置的第一入口(例如分散相进样入口)注入芯片中,将油相体系经由芯片上设置的第二入口(例如连续相进样入口)注入芯片中,使细胞悬液与油相体系在所述芯片中接触,从而形成包裹细胞的微液滴。在一些实施方案中,在步骤(d)中,包裹细胞的微液滴通过设置在芯片上的出口而加入到第二溶液中,形成包裹细胞的海藻酸盐水凝胶颗粒。
在一些实施方案中,在步骤(c)中形成的细胞悬液中,细胞的浓度为大约5X10
在一些实施方案中,本发明的方法还包括步骤(f):将步骤(d)产生的海藻酸盐水凝胶颗粒在大约-80℃至-196℃的温度冷冻保存。
在一些实施方案中,海藻酸盐包括海藻酸钠、海藻酸钾、海藻酸铵或其任何组合,优选海藻酸钠。在一些实施方案中,在第一溶液中,海藻酸盐的浓度为大约0.5-2.0wt%。在一些实施方案中,在第一溶液中,甜菜碱的浓度为大约2-10wt%。在一些实施方案中,金属离子为Ca
在一些实施方案中,油相体系还包含至少一种表面活性剂,例如非离子型表面活性剂。在一些实施方案中,所述非离子型表面活性剂选自span 80、EM90、TtritonX-100、或其任何组合。
在一些实施方案中,步骤(f)还包括在冷冻保存之前进行离心重悬,以得到高浓度的包裹细胞的海藻酸盐水凝胶颗粒。
3.冷冻保存的细胞
本发明的第三方面提供了一种冷冻保存的细胞,该细胞由本发明第一方面所述的组合物保存或由本发明第二方面所述的方法产生。
4.由冷冻保存的细胞经过复苏获得的细胞
本发明的第四方面提供了一种细胞,该细胞是本发明第三方面所述的细胞或由本发明第三方面所述的细胞经过复苏后得到。在一些实施方案中,所述细胞在复苏之前被洗涤。在一些实施方案中,所述细胞是在复苏之后经过稀释、孵育、增殖或其任何组合得到的细胞。
5.包含本发明的细胞的制剂
本发明的第五方面提供了一种制剂,其包含本发明第三方面或第四方面所述的细胞。
6.细胞冻存用试剂盒
本发明的第六方面提供了一种细胞冻存用试剂盒,其包含甜菜碱、海藻酸盐以及金属离子。在一些实施方案中,本发明的试剂盒被设计成容纳本发明第一方面所述的组合物中的各成分,例如甜菜碱、海藻酸盐、金属离子、任选的细胞营养物料、任选的油相体系、任选的表面活性剂、任选的溶剂(例如水)等,以及任选的使用说明。
在一些实施方案中,试剂盒中所包含的各成分是单独包装的。可选地,甜菜碱和海藻酸盐被包装在一起,例如,该组合可以以固体(例如粉末)或液体的形式提供。可选地,油相体系和表面活性剂(例如阴离子型表面活性剂)被包装在一起。可选地,细胞营养物料与甜菜碱和海藻酸盐被包装在一起。例如,该组合可以以液体或固体(例如粉末)的形式提供。
在一些实施方案中,本发明的试剂盒被设计成容纳本发明第一方面所述的使用溶液。
7.细胞冻存体系
本发明的第七方面提供了一种细胞冻存体系,其包含细胞、细胞营养物料、本发明第一方面所述的甜菜碱、由本发明第一方面所述的海藻酸盐和本发明第一方面所述的金属离子形成的海藻酸盐水凝胶颗粒。
在一些实施方案中,所述细胞分散在海藻酸盐水凝胶颗粒中,形成多个分散的包裹细胞的水凝胶颗粒,每个所述包裹细胞的水凝胶颗粒含有一个和/或多个细胞,所述海藻酸盐水凝胶颗粒中还含有甜菜碱和细胞营养物料。
在一些实施方案中,所述细胞冻存体系由本发明第二方面所述的方法产生。
在一些实施方案中,所述细胞冻存体系中,在所有形成的水凝胶颗粒中,大约3-55%的水凝胶颗粒中含有一个细胞;和/或,大约3-85%的水凝胶颗粒中含有一个或多个细胞。
8.应用
本发明的第八方面提供了本发明的细胞或制剂的应用。
在一些实施方案中,本发明还涉及本发明第三方面或第四方面所述的细胞或第五方面所述的制剂用于细胞生物学研究(如细胞培养、细胞增殖、细胞分选等)、药物释放、疾病诊断或治疗、组织工程、或者作为生物传感器用于环境污染物的检测等等的应用;或者,所述细胞或制剂在制备用于上述应用的试剂/试剂盒/药物中的用途。
在一些实施方案中,本发明还涉及本发明第一方面所述的组合物在细胞冷冻保存中的应用。
在本发明各个方面(例如第一方面和第六方面)的一些具体实施方案中,在使用时,细胞营养物料与甜菜碱和海藻酸盐(例如海藻酸钠)被配制成第一溶液。所述细胞营养物料是普通的培养基(例如MEM培养基)。所述第一溶液中,甜菜碱的浓度约为2-10wt%、海藻酸钠的浓度约为0.5-2wt%。第一溶液与细胞接触后形成细胞悬液,当细胞悬液与油相体系接触时,形成包裹细胞的微液滴。在一些实施方案中,通过液滴微流控芯片形成包裹细胞的微液滴,例如细胞悬液与油相体系的接触在液滴微流控芯片中发生。在一些实施方案中,所述第一溶液包含溶剂(例如水)、细胞营养物料、甜菜碱和海藻酸盐(例如海藻酸钠)或主要由其组成。
在本发明各个方面(例如第一方面和第六方面)的一些具体实施方案中,在使用时,通过添加溶剂(例如磷酸盐缓冲液)将金属离子(例如Ca
在本发明各个方面的一些实施方案中,细胞营养物料是细胞培养基,例如MEM(最低限量基础培养基)或者本领域常见的其他培养基例如DMEM、RPMI1640、DMEM/F12、M199、IMDM、L15培养基等以及其改良培养基。本领域技术人员能够根据冻存细胞的种类和/或针对具体应用而选择相应的细胞培养基或细胞营养物料的具体组成和配比。在一些实施方案中,细胞营养物料以液体形式提供,在这种情况下,细胞营养物料还含有溶剂例如水。在一些实施方案中,细胞营养物料以固体形式提供,因此在配制上文任何方面所述的第一溶液时,可以添加溶剂例如水,或者在甜菜碱和海藻酸盐的组合以液体形式提供时也可以不添加溶剂。
在本发明各个方面的一些实施方案中,在使用时(例如在第一溶液中),细胞营养物料与甜菜碱和海藻酸盐的重量比(wt%)约为1:0.06-0.1:0.01-0.02,优选约1:0.08:0.01。
在本发明各个方面的一些实施方案中,其中所述细胞是人类细胞或哺乳动物细胞,例如癌细胞、体细胞(例如免疫细胞)、干细胞或其任何组合。例如所述人类细胞或哺乳动物细胞包括肝癌细胞、肺癌细胞、宫颈癌细胞、乳腺细胞、造血干细胞、免疫细胞、脐带间质干细胞、骨髓间充质干细胞、淋巴癌细胞或其任何组合。在一些实施方案中,所述细胞不能发育成完整的个体。
在本发明各个方面的一些实施方案中,本发明的组合物、细胞冻存体系、方法或试剂盒不含二甲基亚砜(DMSO)或不使用DMSO。在一些实施方案中,第一溶液中不含DMSO。在一些实施方案中,细胞悬液中不含DMSO。
在本发明各个方面的一些实施方案中,在使用时或者在所述第一溶液中,海藻酸盐(例如海藻酸钠)的浓度为大约0.5-2.0wt%,例如大约0.6-1.9wt%、大约0.7-1.8wt%、大约0.8-1.7wt%、大约0.9-1.6wt%、大约1.0-1.5wt%、大约0.75-1.25wt%、大约1.0-1.2wt%,或者上述数值范围内的任何数值或端点值,优选1.0wt%。在一些实施方案中,在使用时或者在所述第一溶液中,甜菜碱的浓度为大约2-10wt%,例如大约3-9wt%、大约4-8wt%、大约5-8.5wt%、大约6-8wt%、大约6.5-8.5wt%,或者上述数值范围内的任何数值或端点值例如大约7wt%,优选8wt%。
在本发明各个方面的一些实施方案中,在使用时或者在所述第二溶液中,金属离子(例如Ca
在本发明各个方面的一些实施方案中,所述细胞悬液中所述细胞的浓度为大约5X10
在本发明各个方面的一些实施方案中,当存在时,所述至少一种表面活性剂(例如阴离子型表面活性剂)存在于所述油相体系中或在使用时添加到所述油相体系中。在一些实施方案中,在包含所述至少一种表面活性剂的情况下,所述油相体系包含大约1-10wt%(例如大约2-6wt%、大约2.5-5.5wt%、大约2.2-5.2wt%、大约2.8-4.5wt%、大约3.0-5.0wt%、大约3.2-4.5wt%、大约3.5-9.5wt%、大约4-8.5wt%、大约4.5-8wt%、大约6.5-9.0wt%、大约2.8-7.5wt%、大约3.2-7.0wt%,或者上述数值范围内的任何数值或端点值例如3wt%、4wt%)的至少一种表面活性剂。在一些实施方案中,所述至少一种表面活性剂包括或者是阴离子型表面活性剂(例如span 80、EM90、TtritonX-100或其任何组合)。
在本发明各个方面(例如第一方面)的一些实施方案中,本发明的组合物(或者使用溶液)还包含CaCl
在本发明各个方面(例如第二方面)的一些实施方案中,油相体系还包含CaCl
在本发明各个方面(例如第六方面)的一些实施方案中,本发明的试剂盒还包含CaCl
在涉及CaCl
在本发明各个方面的一些实施方案中,所述包裹细胞的微液滴的粒径为大约50-110μm,例如大约60-105μm、70-100μm、大约75-90μm、大约75-85μm、大约77-83μm、大约80-82μm,或者上述数值范围内的任何数值或端点值例如大约80.5μm、81μm等。
在本发明各个方面的一些实施方案中,所述包裹细胞的海藻酸盐水凝胶颗粒的粒径为大约50-250μm,例如大约60-190μm、大约65-185μm、大约70-180μm、大约75-175μm、大约80-170μm、大约85-165μm、大约90-160μm、大约95-155μm、大约100-150μm、大约105-145μm、大约110-140μm、大约115-135μm、大约120-130μm、大约125-220μm,或者上述数值范围内的任何数值或端点值例如大约74μm、75μm、80μm、90μm等。
在本发明各个方面的一些实施方案中,微液滴(例如包裹细胞的微液滴)通过液滴微流控芯片生成。在一些实施方案中,所述微液滴是高单分散性的。在一些实施方案中,所述海藻酸盐水凝胶颗粒是高单分散性的。例如,海藻酸盐水凝胶颗粒粒径的变异系数(CV值)远小于15%,例如小于12%,例如为约2-12%、约3-8%、约4-7%、约4.5-7.5%等。
在本发明各个方面的一些实施方案中,细胞(例如待冻存细胞)分散在所述微液滴中。在一些实施方案中,所述细胞分散在所述水凝胶颗粒中。
在本发明各个方面的一些实施方案中(例如在第七方面的细胞冻存体系的一些实施方案中,或者在第二方面所述的方法的一些实施方案中,或者在第一方面所述的组合物的一些实施方案中),在所有形成的微液滴中,高达约95.73%(例如约30-97%、约40-90%、约50-85%、约60-95%、约70-80%等)的微液滴中含有细胞(例如一个或多个);和/或,高达约55.4%(例如约5-55%、约10-50%、约15-45%、约20-32%、约25%、约30%等)的微液滴中含有一个细胞。
在本发明各个方面的一些实施方案中(例如在第七方面的细胞冻存体系的一些实施方案中,或者在第二方面所述的方法的一些实施方案中,或者在第一方面所述的组合物的一些实施方案中),在所有形成的水凝胶颗粒中,大约3-55%(例如约10-50%、15-45%、20-40%、25-35%、30%、31%、32%、33%、34%、38%、42%、48%、52%)的水凝胶颗粒中含有一个细胞;和/或,大约3-85%(例如约10-80%、15-75%、20-70%、25-65%、30-60%、35%、40%、45%、50%、55%、62%、78%、82%)的水凝胶颗粒中包含有一个或多个细胞。
通过阅读随后的描述,本发明的这些特征和优点以及其他特征和优点对于本领域技术人员而言将是显而易见的。
附图说明
现在将参考附图描述本发明的实例。应当理解,在不脱离如上所述的本发明的范围的情况下,各种变型都是可能的。
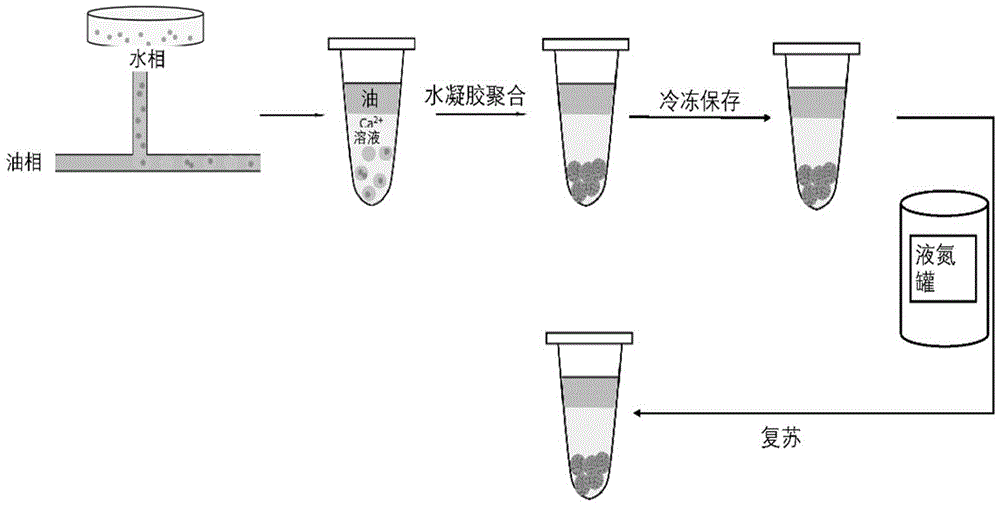
图1示出根据本发明的方法的流程设计图。
图2A示出微流控芯片结构和设计的示意图;图2B示出不同流速下液滴大小的分布。
图3示出海藻酸盐水凝胶形成前后的微粒。A.聚合前的海藻酸钠液滴,比例尺:100μm。B.聚合后的海藻酸钙水凝胶颗粒,比例尺:200μm。
图4显示在不同油相以及收集体系(如下面表1所示)中,得到的海藻酸钙水凝胶颗粒的直径、圆周率以及变异系数的分布(A、B、E、F)、以及显微镜图像(C、D、G、H)。A.油相体系为石蜡油+3%EM90+0.15%Triton X-100,收集体系为30wt%CaCl
图5显示液滴包裹细胞与海藻酸钙包裹细胞。A.不同细胞浓度下,液滴中的细胞包裹率;B.不同细胞浓度下,液滴包裹细胞的显微镜明场图像(红圈表示细胞被包裹),比例尺均为100μm;C.不同细胞浓度下,海藻酸钙凝胶颗粒中的细胞包裹率;D.藻酸钙凝胶颗粒包裹细胞的显微镜明场图像(右图是左图方框所示部分的放大图),比例尺为200μm(左图)和100μm(右图)。在图5A中,对于“单细胞”、“2细胞”、“无细胞”的情况,从左到右的柱子分别代表1*10
图6显示惯性排序下的细胞分布以及包裹率。A.不同细胞浓度下,细胞在通道中的纵向距离;B.不同细胞浓度下,细胞包裹率的分布。在图6A中,从左到右的框分别代表1*10
图7显示添加不同浓度的甜菜碱和不同孵育时间下的细胞存活率。A.在不同甜菜碱浓度下孵育2小时后,细胞的冻存存活率;B.在不同孵育时间下,冻存后细胞的存活率;C.荧光显微镜下细胞存活状态,比例尺为100μm。在图7A-B中,在每种情况下,从左到右的柱子分别代表10%DMSO、2%甜菜碱、4%甜菜碱、6%甜菜碱、8%甜菜碱、10%甜菜碱、MEM。
图8显示在海藻酸钠体系中,在不同甜菜碱浓度和不同时间的孵育下冻存细胞的存活率。A.在不同甜菜碱浓度下孵育2小时后细胞的冻存存活率;B.不同孵育时间下的冻存后存活率;C.荧光显微镜下细胞存活状态。在图8A-B中,在每种情况下,从左到右的柱子分别代表1%藻酸盐+2%甜菜碱、1%藻酸盐+4%甜菜碱、1%藻酸盐+6%甜菜碱、1%藻酸盐+8%甜菜碱、1%藻酸盐+10%甜菜碱、细胞和培养基、10%DMSO。对于空白对照,比例尺为100μm,其他情况下比例尺均为50μm。
图9显示冻存体系细胞的增殖速率。A.冻存复苏后,细胞的增殖速率;B.冻存细胞复苏后的活性。在图9B中,在每种情况下,左边的柱子代表阳性对照,右边的柱子代表8%B(甜菜碱)+1%A(藻酸盐)。
图10显示海藻酸钙-甜菜碱细胞冻存体系下冻存细胞复苏培养后的显微镜明场图像,比例尺为50μm。
图11显示不同体系下,冻存细胞复苏后的细胞状态。复苏后的细胞用AM/PI进行死活染色,比例尺均为1000μm。
具体实施方式
本发明的一些实施方案涉及一种利用微流控液滴技术制备海藻酸钙水凝胶颗粒,用于进行分散性细胞包裹,并进行冷冻保存的方法。本发明的方法可以将大量细胞快速分散到单个的水凝胶颗粒中,每个水凝胶颗粒可以视为独立的反应器,甜菜碱和水凝胶协同作用提供内外保护,包裹到水凝胶颗粒中的细胞可以直接进行冷冻保存。本发明的方法旨在解决细胞冻存过程中细胞冻存剂对于细胞的毒理性损伤以及复苏时复杂的洗涤步骤等问题,发明一种安全快速且高效的细胞冻存方法,使冻存后的细胞可以保持良好的活力以及增殖能力。本发明具体涉及这样一种方法,该方法:通过微流控液滴技术,利用甜菜碱和海藻酸盐水凝胶的协同作用,抑制冻存过程中冰晶形成对于细胞造成的损伤,从而保护细胞免受冻存过程中的损伤。该方法通过将细胞分散在海藻酸盐-培养基溶液中(例如形成上文所述的细胞悬液),之后聚合成海藻酸盐水凝胶颗粒骨架为细胞提供一个3D网络结构。由于细胞是分散在水凝胶颗粒中,3D网络结构模拟细胞外基质,为细胞提供了一个易于进行物质交换的环境。同时甜菜碱作为一种渗透保护剂,可以有效调节细胞渗透压提供胞内保护,降低冰冻伤害。复苏细胞时可直接通过添加培养液进行下一步培养或直接使用。本申请方法可以应用于不同细胞的快速冷冻保存。
水凝胶是交联的亲水聚合物网络,可以在水中迅速溶胀并维持在此状态
液滴微流控芯片技术的优势在于能够快速稳定地产生成大量尺寸可控,大小均一的液滴,其能够做到对液滴的粒径大小和单分散度的精细控制,实现均一稳定高通量的液滴阵列。单分散水凝胶可以更好地对外部刺激做出预期表现,可以广泛应用于检测、分析和建模等方面。
本发明的组合物和/或方法基于海藻酸钙水凝胶的细胞包裹基础骨架(即,包裹细胞的海藻酸盐水凝胶颗粒),由于它们的亲水性,海藻酸盐聚合物可以有效地结合水分子,进一步降低水的冰点以保护细胞。同时,如上所述,甜菜碱保护细胞免受冰晶和渗透损伤。冷冻保存后,由于甜菜碱和海藻酸钙水凝胶具有优异的生物相容性,对于细胞的生物活性没有直接的损伤影响,解冻时无需进行复杂的洗涤步骤。解冻后的细胞可以通过简单的稀释过程(例如添加培养液进行稀释)进行培养或直接使用(例如用于生物传感器检测),节约时间。且细胞在水凝胶中独立存在,可以实现单细胞分辨率的分析操作。
参考图1,当使用本发明的组合物或利用本发明的方法冷冻细胞时,涉及以下过程。首先利用微流控液滴芯片平台生成包裹细胞的海藻酸盐(例如海藻酸钠)液滴(该液滴可以含有甜菜碱),例如使用微量注射泵将含有疏水相(例如油相体系)和亲水相(例如细胞悬液)的两种不混溶流体注射到微流体装置中,海藻酸盐作为细胞悬浮液的载体注入分散相入口,油相体系(例如石蜡油)注入连续相入口。将生成的液滴(例如其中有高达95.73%的液滴中含有一个或多个细胞)收集到金属卤化物(例如CaCl
本发明采用外部聚合法进行海藻酸盐水凝胶颗粒的制备,即,使阳离子从较高浓度的收集液进入较低浓度藻酸盐的内部。实验中,将海藻酸盐(例如海藻酸钠)水溶液作为水相制备油包水液滴,随后液滴被分散到例如CaCl
本发明利用例如海藻酸盐水凝胶作为液相细胞载体,利用微流控液滴技术制备水凝胶颗粒,细胞呈高分散性包裹在液滴内,完成了细胞在具有高单分散性的海藻酸盐水凝胶颗粒中的封装及保存,且冻存前后细胞始终固定在水凝胶液滴中,为下游培养分析提供了高通量的方法。事实上,本发明的方法是一种基于藻酸盐水凝胶颗粒的冷冻保存方法。该方法产生的高度分散的含有细胞的水凝胶颗粒可直接用于后续分析,如环境检测或化学分析。
本申请中避免了使用有机溶剂,而是利用甜菜碱的渗透压调节机制为细胞提供胞内保护,利用海藻酸盐的骨架结构增加细胞外保护,两者协同作用保护细胞免受冻存过程中的冰晶损伤。为细胞提供了一个无毒无害的冻存环境。
在一些实施方案中,经本发明的方法或利用本发明的组合物保存的细胞,在孵育两小时后冻融细胞的存活率可高达约81.75%,例如约50-80%、约60-82%、约70-81%、约75-80%、约40-75%等。在一些实施方案中,经本发明的方法或利用本发明的组合物保存的细胞,在冻存复苏后的增殖率可达约100%,例如约50-100%、约60-99%、约65-98%、约70-97%、约75-96%、约80-95%、约85-90%等。
定义
如本文所使用,当提及“第一溶液/入口等”和/或“第二溶液/入口等”时,并不代表时间上的先后顺序。类似地,当提及步骤(a)、(b)…(e)等时,也不代表方法步骤的执行顺序,因此,例如步骤(b)可以先于步骤(a)。
本发明所述的“金属离子”也可以指提供所述金属离子的金属化合物例如金属氯化物,包括氯化钙、氯化锌、氯化铜、氯化钡等。
在本发明中,“液滴”和“微液滴”可互换使用,其是指例如通过液滴微流控芯片技术所形成的液滴。在一些实施方案中,至少一部分液滴(例如约5-95.73%)中包裹/包含细胞。而当提及“包裹细胞的微液滴”或类似表述时,是指所述液滴中含有细胞,除非另外指出。
本发明所述的“凝胶/水凝胶颗粒”、“凝胶/水凝胶微粒”等可互换使用,均是指通过海藻酸盐和金属离子聚合而成的水凝胶微粒。在一些实施方案中,至少一部分水凝胶微粒(例如约3-85%)中包裹/包含细胞。当提及“包裹细胞的凝胶/水凝胶颗粒”或类似表述时,是指所述水凝胶颗粒中含有细胞(例如一个或多个细胞),除非另外指出。
因此,当提及“约3-85%的水凝胶颗粒中含有一个和/或多个细胞”或类似表述时,是指在所有形成的水凝胶颗粒中,约有3-85%的水凝胶颗粒中含有一个和/或多个细胞,也就是说,在这3-85%的水凝胶颗粒中,每个水凝胶颗粒分别含有一个和/或多个细胞。以此类推。
在本发明中,当提及“包裹细胞的微液滴/水凝胶颗粒”或类似表述时,“包裹”和“包含/含有”等可互换使用。
在本发明中,当提及“包裹细胞的(海藻酸盐/海藻酸钠)微液滴/液滴”、“包裹细胞的(海藻酸盐/海藻酸钙)水凝胶颗粒/微粒”,或细胞悬液中的细胞,均是指待冻存的细胞,除非另外说明。而且,“包裹细胞的微液滴/液滴”可以指“包裹细胞的海藻酸盐或海藻酸钠微液滴/液滴”,同理,“包裹细胞的水凝胶颗粒/微粒”可以指“包裹细胞的海藻酸盐或海藻酸钙水凝胶颗粒/微粒”。
在本发明中,术语“任选(地/的)”是指该术语所限定的特征(例如组分、步骤等)可以存在或不存在。例如,当提及“任选地,所述组合物还包含油相体系”或者“本发明的组合物主要由甜菜碱…、以及任选的油相体系组成”时,是指油相体系可以存在于组合物中或不存在于组合物中;也就是说,所述组合物还包含油相体系,或者所述组合物不包含油相体系;以此类推。
在本发明中,当使用术语“主要由…组成”时,也包括“由…组成”的情况。
本发明的范围不限于本文所述的任何具体实施方案。提供以下实施例仅用于举例说明。
实施例
实验材料
海藻酸钠、甜菜碱和氯化钙均购自Sigma-Aldrich Chemicals(美国密苏里州)。石蜡油购自生工生物工程(上海)股份有限公司。SU-8光刻胶和显影液购自Microchem(美国马萨诸塞州)。聚二甲基硅氧烷(PDMS)购自Dow Corning(美国密歇根州)。肿瘤细胞为CBG2.8D。所有实验均使用Milli-Q水(18.2MΩcm
实施例1:微流控液滴芯片的制备
芯片模板是使用SU-8光刻胶在硅片上使用传统光刻法制造。将PDMS预聚物和固化剂的混合物(比例为10:1)充分搅拌,然后在真空烘箱中脱气。然后将脱气的PDMS混合物倒在硅母盘上并在65℃下固化。固化后,将包含微通道图案的PDMS复制品从硅母版上取下。冷却复制品后,在复制品上打孔以补充试剂管线。然后将PDMS复制品暴露在氧等离子体中120秒,然后结合到预固化的PDMS底片上。
具体而言,通过如下步骤制备微流控液滴芯片。
(1)微流控芯片模板的制作
采用通用的光刻技术,将硅片放置于旋涂机中,并在硅片中心滴加约5ml的SU-8光刻胶,选取合适的转速进行旋涂获取一定的厚度。静置5min后将硅片转移到加热板上进行前烘使之固化;
将设计的掩膜与SU-8光刻胶胶贴合,置于紫外光下曝光使之发生交联,后转移到加热板上后烘聚合然后缓慢冷却到室温;最后使用显影液显影,去除掉未交联的光刻胶得到所需芯片模板。
(2)微流控芯片的制作
配置一定量的PDMS(PDMS预聚物:交联剂为10:1),并充分搅拌混匀。将制作的芯片模板放于培养皿中,倒入一定量的PDMS,置于真空干燥器中脱气处理;将PDMS置于65℃的烘箱中烘烤至少2小时固化;
将PDMS图案层从硅片上剥离,在流体入口和出口打孔后,与另一块PDMS基底层进行等离子表面处理键合。65℃烘箱烘烤过夜备用。
实施例2:包裹细胞的海藻酸盐液滴的制备
1.细胞悬液的制备
制备前使用合适的基础培养液,并添加10%FBS和100U/mL青霉素与100μg/mL链霉素的混合物培养肿瘤细胞。使用时,倒掉培养皿内培养基,加入5mL PBS润洗细胞,吸走废液;加入1mL 0.25%胰酶/EDTA消化液,37℃孵育1min消化至细胞刚刚变圆浮起,加入5mL培养液终止消化,并转移至15mL离心管,1000rpm,离心3min吸走上清液。加入提前配置好的MEM培养液(含1%海藻酸钠,8%甜菜碱)重新悬浮,制成细胞悬液待用
2.海藻酸钠液滴的制备
利用实施例1制备的微流控液滴芯片(如图2A所示),采用流动聚焦(flow-focusing)的方式,将油相(石蜡油,含3%EM90以及0.15%Triton X-100)设置为连续相,水相(细胞悬液)为分散相,制备油包水(W/O)液滴。首先将油相注入芯片的连续相入口,对芯片进行表面润湿,随后通过分散相入口注入制备好的细胞悬液,调整油相以及水相的速度从而产生合适大小的包裹细胞的海藻酸钠液滴。
3.性能表征
为了表征微流控芯片生成液滴的尺寸分布,使用尼康AR软件对液滴的尺寸进行了测量,测得液滴的平均直径为90.41μm,变异系数为1.65%(见图2B)。证明该芯片可被用于产生高通量的、具有高度均一性的液滴。
还利用下面表1所示的不同油相体系(石蜡油,分别含:A:3%EM90以及0.15%Triton X-100;B:2%span 80;C:2%span 80+0.05M CaCl
对利用含有2%span 80+CaCl
实施例3:包裹细胞的海藻酸钙水凝胶颗粒的制备
1.海藻酸钠水凝胶颗粒的制备
根据实施例2中“2.海藻酸钠液滴的制备”部分所述制备包裹细胞的海藻酸钠液滴。将液滴收集到含0.8M CaCl
可将生成的水凝胶颗粒转移至离心管中,加入5ml培养液,1000rpm,离心3min,去除掉上层悬浮液以及油层。可加入新鲜培养液悬浮,使其在培养液中继续培养,或者可将其转移至冻存管中并放入受控速率冷冻容器中过夜冷冻保存(-80℃)。
2.性能表征
利用下面表1所示的不同油相体系(石蜡油,分别含:A:3%EM90以及0.15%TritonX-100;B:2%span 80;C:2%span 80+0.05M CaCl
图4A和C显示:水凝胶颗粒平均直径为70.52μm,变异系数为11.55%,显微镜下呈现椭圆状。图4B和D显示:水凝胶颗粒平均直径为72.22μm,变异系数为7.01%,显微镜下呈现椭圆状。图4E和G显示:水凝胶颗粒平均直径为75.15μm,变异系数为3.01%,显微镜下海藻酸钠水凝胶颗粒呈现均一的圆球状,但是因为油相体系还有氯化钙纳米颗粒,所以海藻酸钠水凝胶颗粒外表粗糙,有纳米颗粒吸附。图4F和H显示:水凝胶颗粒平均直径为75.04μm,变异系数为4.31%,显微镜下海藻酸钠水凝胶颗粒呈现均一透明的圆球状,整体形貌较好。
如下面表1和图4A-H所示,生成的水凝胶颗粒的直径为大约70-75μm。使用4%Span80加入到石蜡油里做表面活性剂,并收集到0.8M CaCl
表1:不同油相和收集体系下生成的液滴/水凝胶颗粒的尺寸及圆周率
/>
实施例4:细胞包裹率
微流控液滴芯片平台能够快速稳定地产生尺寸可控,大小均一的液滴,在高通量包裹单细胞中有巨大的应用潜力。
利用实施例1制备的液滴微流控芯片,根据实施例2-3所述的方法制备包裹细胞的海藻酸钠液滴和海藻酸钙水凝胶颗粒,评估不同细胞浓度(即,细胞悬液中的细胞浓度)下单细胞包裹率和细胞包裹率。单细胞包裹率指的是包裹有单个细胞的液滴在液滴总数中所占的比例。细胞包裹率指的包裹有细胞的液滴在液滴总数中所占的比例。结果示于图5A-D中。
如图5所示,液滴芯片微流控平台包裹细胞的分布符合泊松分布规律(PoissonDistribution)。如图5C所示,对于水凝胶颗粒,当细胞密度为2×10
基于检测灵敏度的考量,最大化实现单细胞微凝胶分散,本研究对分散相进样通道进行了高纵横比通道设计,旨在利用惯性排序方法提高封装效率。将分散相进样通道的纵横比设为1.54(宽度:高度)。如图6A所示,经过设计的高纵横比通道,细胞呈现均一有序的排布,细胞间纵向距离根据不同细胞浓度分布在500μm-2500μm范围内。细胞通过入口通道以相等的纵向间距进行流体动力学排序,进行高效的细胞分装。如图6B所示,经过有序排列后的单细胞包裹率提升至55.4%,相比于泊松分布包裹效率提高了一倍。
实施例5:细胞冻存后的活性
海藻酸钠水凝胶具有优异的生物相容性和吸水保湿性,利用海藻酸盐的骨架结构增加细胞外保护,同时甜菜碱的渗透压调节机制可以为细胞提供胞内保护,两者协同作用保护细胞免受冻存过程中的冰晶损伤。为细胞提供了一个无毒无害的冻存环境。
利用不同的冻存液(10%DMSO、2%甜菜碱、4%甜菜碱、6%甜菜碱、8%甜菜碱、10%甜菜碱、培养基、1%海藻酸钠+2%甜菜碱、1%海藻酸钠+4%甜菜碱、1%海藻酸钠+6%甜菜碱、1%海藻酸钠+8%甜菜碱、10%甜菜碱),利用本发明实施例1制备的液滴微流控芯片,根据实施例2-3所述的方法(油相体系和收集体系分别为石蜡油和氯化钙水溶液)制备包裹细胞的海藻酸钙水凝胶颗粒。对细胞冻融后的存活率和活性进行分析。结果示于图7-11中。
如图7A所示,使用10%DMSO的传统方法获得的存活率可以达到78.41%,使用8%甜菜碱作为冷冻保护剂在冻融后的存活率可以达到47.1%。根据图7B,孵育2h后冻融存活率达到51.87%,与孵育4h的存活率55.12%相差不多。
如图8A所示,使用10%DMSO冻存的细胞,在孵育后的存活率可以达到81.405%,而使用1%海藻酸钠+8%甜菜碱冻存的细胞在孵育后存活率可以达到79.178%。根据图8B,对于1%海藻酸钠+8%甜菜碱的组合,孵育2h后存活率达到80.963%,此时细胞存活率最高。图8C的荧光显微镜结果显示,使用本发明的冻存液冻存的细胞与传统冻存方法获得的细胞基本一致,细胞呈现比较好的形貌状态。
如图7-8所示,在仅有甜菜碱的体系中,当浓度为8%时,孵育两小时后,冻融细胞的存活率最高,达到57.87%。当使用1%海藻酸钠+8%甜菜碱共同制备海藻酸钙凝胶颗粒时,孵育细胞两小时后冻融细胞的存活率提高至81.75%,并且荧光显微镜结果显示,相比于传统的方法,本发明的方法对细胞几乎无明显冻存损伤。
图9显示本发明冻存细胞复苏后第三天的增殖率可达约98%,冻存细胞复苏后的活性也接近1。
上述实验结果表明,利用本发明的体系冻存后直接复苏的细胞仍具有良好的活性,并可进行长期培养增殖至少一周以上。复苏后细胞生物活性没有明显直接的损伤影响。解冻时也无需进行复杂的洗涤步骤,通过直接添加大量培养液稀释即可进行培养或直接使用,节约时间。且细胞依然保持着良好的增殖等生理功能,如图10所示,细胞状态和增殖相比常规方法冻存同样取得了良好的结果。
进一步地,如图11所示,在不同冻存液体系下,通过对复苏后的细胞使用AM/PI进行死活染色,可以看到在1%海藻酸钠+8%甜菜碱体系下细胞存活最好,在海藻酸钠水凝胶颗粒中呈现均一的分散性。
总结
在本发明中,利用微流控芯片制备包裹细胞的高单分散性海藻酸钙水凝胶颗粒。通过优化实验两相体系以及水凝胶颗粒制备流程,成功的制备了直径在50-250μm之间的均一海藻酸钙水凝胶颗粒。利用该海藻酸钙水凝胶颗粒包裹细胞,能够达到高达31.27%的单细胞包裹率或95.73%的细胞包裹率。另外,在冻存过程中,海藻酸盐聚合物骨架提供细胞外保护,两性离子甜菜碱通过膜转运蛋白进入细胞提供胞内保护,可以将包裹在水凝胶颗粒中的细胞进行直接冻存,复苏,以及后续培养分析检测,复苏细胞存活率高达81.75%。本研究避免使用有毒有机溶剂(例如DMSO)作为细胞内的冷冻保护剂,从而不必为了除去毒性试剂而进行多步洗涤程序,解冻后的细胞可以直接进行培养,或者通过简单的方法轻松回收,用于下游的分析应用,例如环境污染物检测,或者肿瘤细胞的培养研究等。
上述对实施例的描述是为方便本技术领域的普通技术人员能理解和应用本发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于本文公开的具体实施例,本领域技术人员根据本发明的原理,在不脱离本发明范畴的情况下所做出的改进和修改都应该在本发明的保护范围之内。
参考文献
1.Scudellari,M.Core Concept:Cryopreservation aims to engineer novelways to freeze,store,and thaw organs.Proc Natl Acad Sci U S A 114,13060-13062,doi:10.1073/pnas.1717588114(2017).
2.Shu,Z.,Heimfeld,S.&Gao,D.Hematopoietic SCT with cryopreservedgrafts:adverse reactions after transplantation and cryoprotectant removalbefore infusion.Bone Marrow Transpl 49,469-476,doi:10.1038/bmt.2013.152(2014).
3.Iwatani,M.et al.Dimethyl sulfoxide has an impact on epigeneticprofile in mouse embryoid body.Stem Cells 24,2549-2556,doi:10.1634/stemcells.2005-0427(2006).
4.Desai,A.,Kisaalita,W.S.,Keith,C.&Wu,Z.Z.Human neuroblastoma(SH-SY5Y)cell culture and differentiation in 3-D collagen hydrogels for cell-based biosensing.Biosensors&Bioelectronics 21,1483-1492,doi:10.1016/j.bios.2005.07.005(2006).
- 间充质干细胞冻存液、制备方法及其冻存方法
- 细胞冻存保护组合物、该组合物的用途以及细胞冻存的方法
- 细胞冻存保护组合物、该组合物的用途以及细胞冻存的方法
