用于治疗肥胖症的新型化合物
文献发布时间:2023-06-19 09:44:49
技术领域
本发明涉及用于治疗肥胖症和相关状况的新型化合物。
名称为“序列表(SEQUENCE LISTING)”的序列表为9676个字节,创建于2018年5月23日,并且通过引用并入本文。
背景技术
肥胖症是能量摄入超过消耗的长期正能量平衡的结果。中枢神经系统(CNS)在通过调节能量摄入将体重维持在较窄范围内起重要作用。为了调节能量摄入,参与食物摄入的周围器官所发出的神经元和体液信号都向大脑传递关于饥饿和/或饱腹感的信息。肠源性激素,如膳食分泌的胰高血糖素样肽1(GLP-1),已被确定为通过向大脑转达关于营养状态的膳食相关信息在进食调节中起作用(Journal of Endocrinology(2014),vol.221(1),p.T1-T16)。
GLP-1受体在CNS中的存在以及动物和人类研究中的发现表明,GLP-1受体激动剂(GLP-1RA)诱发的饱腹感和体重影响至少部分是由它们对大脑的作用介导的,然而,GLP-1和GLP-1RA的大脑渗透受到基本不可穿透的血脑屏障(BBB)的严重限制(Journal ofClinical Investigation(2014),vol.124(10),p.4473-4488)。
一种促进蛋白质治疗剂跨BBB递送的方法是利用受体介导的转胞吞作用,转胞吞是一种内源性内吞过程,其中配体跨过内皮细胞屏障转运。克服这一障碍的许多策略之一是利用在脑毛细血管内皮处表达的内源性受体如转铁蛋白受体(TfR)的转胞吞运输通路(Science Translational Medicine(2011),vol.3(84),p.1-8)。
WO 2004/019872 A2涉及包含与至少一种治疗性蛋白质或肽融合的显示糖基化减少的转铁蛋白(Tf)蛋白质的药物组合物,及其使用方法。预言性实施例1的标题为“GLP-1-转铁蛋白融合蛋白”。
Byung-Joon Kim等人在Journal of Pharmacology and ExperimentalTherapeutics,Vol.334No.3(2010),p.682-691中的文章“Transferrin FusionTechnology:A Novel Approach to Prolonging Biological Half-Life ofInsulinotropic Peptides”中披露了用GLP-1和毒蜥外泌肽-4的类似物制备转铁蛋白融合蛋白。这些融合体分别被称为GLP-1-Tf和Ex-4-Tf,并且用非糖基化形式的人转铁蛋白制成。根据摘要,GLP-1-Tf激活了GLP-1受体,对肽酶的灭活具有抗性,并且半衰期约为2天。摘要还清楚表明,这些融合蛋白没有穿过血脑屏障,而例如,GLP-1-Tf在糖尿病动物中保留了天然GLP-1的急性葡萄糖依赖性胰岛素分泌性质,并且对胰腺β细胞的增殖具有深刻影响。
US 2010/0077498 A1涉及用于在小鼠中进行血脑屏障递送的组合物和方法。
发明内容
本发明涉及新型化合物及其在治疗肥胖症和相关状况中的用途。
在一方面,本发明涉及构建体,其包含靶向大脑中参与体重调节的区域的化合物和针对位于血脑屏障(BBB)中的受体的变构配体,以及其药学上可接受的盐、酰胺或酯。
在其他方面,本发明涉及包含这样的构建体和至少一种药学上可接受的辅料的组合物,所述构建体通常用作药物,并且具体地用于预防或治疗肥胖症和相关状况。
在一方面,本发明的构建体表现出改善的与参与体重调节的脑区的结合。在被BBB保护的区域中,该结合特别得到改善。
在一方面,所述靶向大脑中参与体重调节的区域的化合物是GLP-1受体激动剂(GLP-1RA)。
因此,在一方面,本发明用于增加全身给药的GLP-1RA对大脑中的食欲调节区域的可及性。
另外,或备选地,本发明用于靶向大脑中另外的GLP-1受体(GLP-1R)群体,例如被BBB保护的那些群体。
在一方面,获得这些对食欲和体重的影响,同时以与采用经典GLP-1疗法(例如,采用诸如利拉鲁肽和司美鲁肽等GLP-1衍生物)的全身治疗相同的水平保持葡萄糖稳态。
另外,或备选地,本发明的构建体增强全身给药的GLP-1RA与表达GLP-1R的脑区的结合。例如,这可以通过实施例16中描述的研究得到证明(见图16A)。
另外,或备选地,本发明的构建体增强全身给药的GLP-1RA与被BBB保护的表达GLP-1R的脑区的结合。例如,这可以通过实施例16中描述的研究得到证明(见图16C)。
另外,或备选地,在一方面,所述构建体具有降低食物摄入量的效果。例如,这可以通过实施例20的部分I中描述的研究得到证明。
另外,或备选地,在一方面,所述构建体具有导致体重减轻的效果。例如,这可以通过实施例20的部分III中描述的研究得到证明。
在一方面,所述位于BBB中的受体是转铁蛋白受体(TfR)。
TfR在BBB内皮中高度表达,并且是转铁蛋白的载体蛋白。转铁蛋白是控制生物体液中游离铁(Fe)的水平的铁结合血浆糖蛋白。转铁蛋白是向细胞中输入铁所需的,并受细胞内铁浓度的调节。它通过经由受体介导的内吞作用使转铁蛋白-铁络合物内化而输入铁。因此,经由这种受体途径的完全转胞吞作用似乎不太可能,这是使用TfR作为递送系统所要克服的挑战之一。
附图说明
通过参考以下发明详述和附图,将会获得对本发明特征的更好的理解,在附图中:
图1A显示了如实施例1所述制备的抗TfR-Fab的结构,
图1B显示了在实施例19中使用的图1A中的Fab的荧光标记形式的结构,
图2显示了如实施例2所述制备的不与TfR结合的对照Fab的结构,
图3显示了如实施例3所述制备的抗TfR-Fab的结构,
图4显示了如实施例4所述制备的不与TfR结合的对照Fab的结构,
图5显示了如实施例5所述制备的对照Fab和GLP-1类似物的融合蛋白的结构,
图6显示了如实施例6所述制备的GLP-1抗TfR-Fab融合蛋白的结构,
图7显示了如实施例7所述制备的GLP-1对照Fab融合蛋白的结构,
图8显示了如实施例8所述制备的荧光标记的GLP-1抗TfR-Fab融合蛋白的结构,
图9显示了如实施例9所述制备的荧光标记的GLP-1对照Fab融合蛋白的结构,
图10显示了如实施例10所述制备的GLP-1类似物的结构,
图11显示了如实施例11所述制备的GLP-1抗TfR-Fab缀合物的结构,
图12显示了如实施例12所述制备的GLP-1对照Fab缀合物的结构,
图13显示了如实施例13所述制备的GLP-1类似物的衍生物的结构,
图14显示了如实施例14所述制备的GLP-1对照Fab缀合物的结构,
图15显示了如实施例15所述制备的GLP-1抗TfR-Fab缀合物的结构,
图16A显示了在向小鼠急性给药后,荧光标记的GLP-1Fab融合蛋白的体内成像结果,更具体地是对于与TfR结合的“活性”构建体以及不与TfR结合的“无活性”对照构建体,在表达GLP-1R的所有脑区中进行定量后的荧光信号的总强度,
图16B显示了在向小鼠急性给药后,荧光标记的GLP-1Fab融合蛋白的体内成像结果,更具体地是对于与TfR结合的“活性”构建体以及不与TfR结合的“无活性”对照构建体,在表达GLP-1R但缺乏BBB的室周器中进行定量后的荧光信号的总强度,
图16C显示了在向小鼠急性给药后,荧光标记的GLP-1Fab融合蛋白的体内成像结果,更具体地是对于与TfR结合的“活性”构建体以及不与TfR结合的“无活性”对照构建体,在被BBB保护的示例性脑结构中进行定量后的荧光信号的总强度,
图16D显示了在向小鼠急性给药后,荧光标记的GLP-1Fab融合蛋白的体内成像结果,更具体地是对于与TfR结合的“活性”构建体以及不与TfR结合的“无活性”对照构建体,在不表达GLP-1R的脑区中进行定量后的荧光信号的总强度,
图17A显示了在瘦小鼠中的急性体内研究的结果,更具体地是在施用“活性”GLP-1抗TfR-Fab缀合物后最长达24小时期间以g为单位的累积食物摄入量(FI),
图17B显示了在瘦小鼠中的急性体内研究的结果,更具体地是在“活性”GLP-1抗TfR-Fab缀合物给药后最长达24h期间测得的,以pM为单位的血浆暴露水平,
图18A显示了在瘦小鼠中的急性体内研究的结果,更具体地是在施用“活性”GLP-1抗TfR-Fab缀合物或“无活性”GLP-1对照Fab缀合物后24小时期间以g为单位的累积食物摄入量(FI),
图18B显示了在瘦小鼠中的急性体内研究的结果,更具体地是在“活性”GLP-1抗TfR-Fab缀合物或“无活性”GLP-1对照Fab缀合物给药后最长达24h期间测得的,以pM为单位的血浆暴露水平,
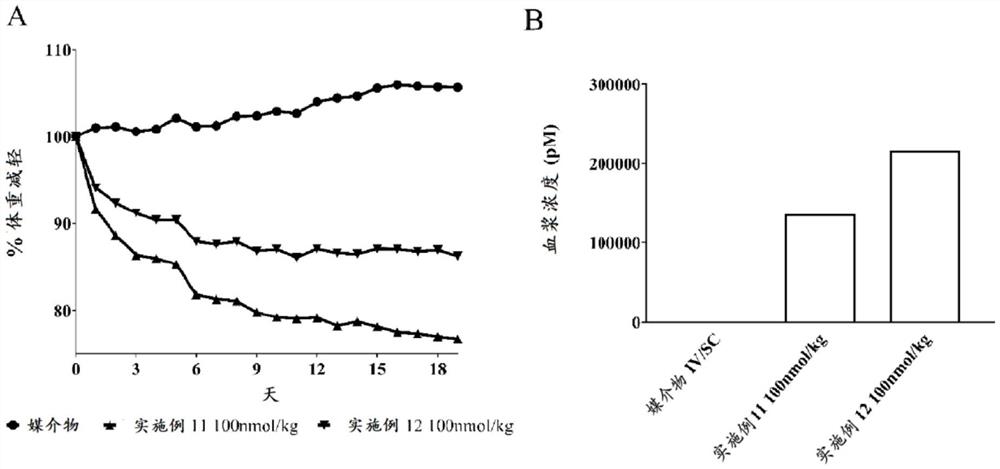
图19A显示了在饮食诱发的肥胖(DIO)小鼠中的亚慢性体内研究的结果,更具体地是在每天一次施用“活性”GLP-1抗TfR-Fab缀合物或“无活性”对照Fab缀合物的19天治疗期内测得的,以%为单位的体重减轻(更多细节,请参见实施例20的部分III),并且
图19B显示了在饮食诱发的肥胖(DIO)小鼠中的亚慢性体内研究的结果,更具体地是在每天一次施用“活性”GLP-1抗TfR-Fab缀合物或“无活性”对照Fab缀合物的19天治疗期的最后一天给药后2小时,以pM为单位的血浆暴露。
具体实施方式
在下文中,希腊字母可由其符号或相应的书写名称表示,例如:α=alpha;β=beta;ε=epsilon;γ=gamma;δ=delta;ω=omega,等等。此外,希腊字母μ也可用“u”表示,例如μl=ul或μM=uM。
在下文中,化学术语是本领域中的常规,例如名称-C(O)-是指二价的羰基基团:
化学式7:
并且,例如在名称-CH(COOH)-中使用的(COOH)是指化学式8的单价羧酸基团:
其连接到左侧(CH)所示的碳原子上。
当在本文中使用时,单词“一”通常表示“一个或多个”。例如,本发明的构建体(其被定义为包含“一个”靶向大脑中参与体重调节的区域的化合物和“一个”针对位于血脑屏障(BBB)中的受体的变构配体)可以并入一个或多个这样的化合物和配体。
除非在说明书中另有说明,否则以单数形式呈现的术语通常还包括复数情况。
本发明还涉及如本文所公开的构建体、化合物、配体、GLP-1RA、GLP-1类似物、制备方法、组合物及用途,其中诸如“包含”和“包括”等开放式术语可用诸如“由...组成”等封闭式术语代替。
本发明涉及新型化合物及其在治疗肥胖症和相关状况中的用途。本发明的化合物表现出改善的与参与体重调节的脑区的结合。在被血脑屏障(BBB)保护的区域中,该结合特别得到改善。
在一方面,本发明涉及构建体,其包含靶向大脑中参与体重调节的区域的化合物和针对位于BBB中的受体的变构配体,以及其药学上可接受的盐、酰胺或酯。
术语“构建体”——包含靶向大脑中参与体重调节的区域的化合物和针对位于BBB中的受体的变构配体——是指该化合物和配体任选地通过连接体共价连接在其中的化学实体(分子)。
在一个实施方案中,所述构建体由靶向大脑中参与体重调节的区域的化合物、针对位于BBB中的受体的变构配体和可选的连接体组成。
在一个实施方案中,所述化合物和配体彼此直接连接(不存在连接体)。
在另一个实施方案中,所述化合物和配体彼此通过连接体连接。
在一个实施方案中,所述构建体是融合蛋白。
融合蛋白是可以通过包括在宿主细胞中重组表达整个融合蛋白的步骤的过程所产生的化合物。
在一个实施方案中,融合蛋白的氨基酸序列仅由编码氨基酸组成。
在一个实施方案中,由重组表达步骤得到的蛋白质与所需融合蛋白相同,在这种情况下,融合蛋白是或者可以是通过“完全重组”过程产生的。在这种情况下,融合蛋白不需要进一步的化学修饰,并且可以分离并纯化所表达的融合蛋白,并构成最终的所需产物。
融合蛋白的一个非限制性实例是实施例6的融合蛋白(图6),其中GLP-1类似物通过肽连接体(4x(GlyGlyGlySer))与抗TfR-Fab的V
在一个实施方案中,所述构建体是缀合物。
在一个实施方案中,“缀合物”不是融合蛋白。
在一个实施方案中,所述靶向大脑中参与体重调节的区域的化合物、变构配体和可选的连接体之间的共价键可以通过任何化学过程形成,除了完全重组过程外。
在一个实施方案中,所述缀合物的结构式包括至少一种非编码氨基酸。非编码氨基酸的一个非限制性实例是氨基酸Aib(参见,例如,实施例11的缀合物(图11))。
另外,或备选地,所述缀合物的结构式包括至少一种不是氨基酸的元素。这类元素的一个非限制性实例是化学连接体,如化学式1:-CH
在一些实施方案中,缀合物通过或可以通过部分重组过程来产生(例如,所需缀合物的蛋白质部分在或可以在重组表达步骤中产生,而所需缀合物的其余部分在或可以在一个或多个单独的过程步骤中、在重组表达步骤之后、在宿主细胞外部的一个或多个化学反应步骤中添加。这样的生产过程可被称为“半重组”过程。
Bloemendaal等人在“Effects of glucagon-like peptide 1on appetite andbody weight:focus on the CNS",Thematic Review,Journal of Endocrinology(2014),221,T1-T16”(参见,例如,第T8页的图1)中提到了大脑中参与体重调节的区域的非限制性实例。
在一些实施方案中,大脑中参与体重调节的区域包括但不限于外侧隔核(LS)、齿状回(DG)、内侧缰核(MH)和/或臂旁核(PB)(参见图16C和实施例16)。
在一些实施方案中,大脑中参与体重调节的区域包括但不限于伏隔核(ACB)、下丘脑背内侧核(DMH)、下丘脑外侧区(LHA)和/或外侧缰核(LH)。
在一个实施方案中,体重的调节是指体重减轻。
在一个实施方案中,体重减轻可能是由于以下一种或多种原因:食物摄入减少、卡路里摄入减少、食欲下降、能量消耗增加和/或食物偏好改变。
因此,在一些实施方案中,本发明构建体的化合物部分靶向大脑中参与以下方面的区域:a)食物摄入减少,b)卡路里摄入减少,c)食欲下降,d)能量消耗增加,和/或e)食物偏好改变。
在一些实施方案中,本发明涉及体重管理方法。在一些实施方案中,本发明涉及降低食欲的方法。在一些实施方案中,本发明涉及减少食物摄入量的方法。
通常,所有罹患肥胖症的受试者也被认为罹患超重。在一些实施方案中,本发明涉及治疗或预防肥胖症的方法。在一些实施方案中,本发明涉及本发明的构建体在治疗或预防肥胖症中的用途。在一些实施方案中,罹患肥胖症的受试者是人,如成人或儿科病人(包括婴儿、儿童和青少年)。身体质量指数(BMI)是基于身高和体重的体脂肪量度。计算公式是BMI=以千克为单位的体重/以米为单位的身高
在一些实施方案中,本发明涉及任选地在至少一种体重相关共病的存在下治疗或预防超重的方法。在一些实施方案中,本发明涉及本发明的构建体任选地在至少一种体重相关共病的存在下治疗或预防超重的用途。在一些实施方案中,罹患超重的受试者是人,如成人或儿科病人(包括婴儿、儿童和青少年)。在一些实施方案中,罹患超重的人类受试者可具有≥25的BMI,如≥27的BMI。在一些实施方案中,罹患超重的人类受试者具有25至<30范围内的BMI或27至<30范围内的BMI。在一些实施方案中,所述体重相关共病选自高血压、糖尿病(如2型糖尿病)、血脂异常、高胆固醇和阻塞性睡眠呼吸暂停。
在一些实施方案中,本发明涉及减轻体重的方法。在一些实施方案中,本发明涉及本发明的构建体在减轻体重中的用途。根据本发明经历体重减轻的人可具有≥25的BMI,如≥27的BMI或≥30的BMI。在一些实施方案中,根据本发明经历体重减轻的人可具有≥35的BMI或≥40的BMI。术语“体重减轻”可包括肥胖症和/或超重的治疗或预防。
靶向大脑中参与体重调节的区域的化合物包括但不限于肠源性激素,已经确定肠源性激素通过向大脑转达关于营养状态的膳食相关信息在进食调节中起作用。
在一个实施方案中,所述靶向大脑中参与体重调节的区域的化合物是蛋白质。在一个实施方案中,该化合物是多肽。在一个实施方案中,该化合物是肽。
在一个实施方案中,所述靶向大脑中参与体重调节的区域的化合物是激素。在一个实施方案中,该化合物是肠源性激素。在一个实施方案中,该激素选自类花生酸、类固醇和氨基酸/蛋白质衍生物。在一个实施方案中,该激素是氨基酸/蛋白质衍生物。
在一个实施方案中,所述靶向大脑中参与体重调节的区域的化合物是GLP-1受体激动剂(GLP-1RA)。
在一个实施方案中,所述靶向大脑中参与体重调节的区域的化合物是促胰岛素剂。该术语是指启动信号转导通路,从而导致促胰岛素作用或本领域已知的生理效应的能力。
在一个实施方案中,所述靶向大脑中参与体重调节的区域的化合物靶向大脑中参与体重调节的通路。在一个实施方案中,该化合物靶向大脑中参与体重调节的受体。
位于血脑屏障(BBB)中的受体是在脑毛细血管内皮处表达的内源性受体。
在一个实施方案中,所述位于BBB中的受体是转铁蛋白受体(TfR)。
受体的“正构配体”是内源性或主要的配体,其调节该受体的活化。正构配体与受体结合的位点被称为该受体的“正构位点”。
受体的“变构配体”是指与内源性(正构)配体结合不同的受体位点(即,该受体的“变构位点”)的配体。
作为一个例子,转铁蛋白(Tf)是调节转铁蛋白受体(TfR)的活化的正构配体,并且Tf与TfR的正构位点结合。TfR的变构配体与正构配体(Tf)结合不同的受体位点(即,TfR的变构位点)。
受体激动剂可以被定义为与受体结合并引发天然配体的典型响应的化合物。完全激动剂可以被定义为引发与天然配体相同量级的响应的激动剂(参见例如“Principles ofBiochemistry”,AL Lehninger,DL Nelson,MM Cox,第二版,Worth Publishers,1993,第763页)。
因此,“GLP-1受体激动剂”(GLP-1RA)可以被定义为能够与GLP-1受体(GLP-1R)结合并能够将其激活的化合物。并且“完全”GLP-1RA可以被定义为能够引发与天然GLP-1相似量级的GLP-1受体响应的GLP-1受体激动剂。在一个实施方案中,该GLP-1受体是人GLP-1受体。
可以在含有表达人GLP-1受体的膜的培养基中,和/或在使用表达人GLP-1受体的全细胞的试验中适当地确定激活人GLP-1受体的能力。
例如,可以用所讨论的化合物刺激来自表达人GLP-1受体的稳定转染的细胞系的纯化质膜,并测量cAMP生产的效力,例如,基于内源形成的cAMP与外源添加的生物素标记的cAMP之间的竞争,其可以使用特异性抗体来捕获。
另外,或备选地,可以在报告基因试验中,例如在稳定转染的BHK细胞系中测量人GLP-1受体的响应,该细胞系表达人GLP-1受体并且含有与启动子偶联的cAMP响应元件(CRE)DNA以及萤火虫萤光素酶(CRE萤光素酶)基因。当cAMP由于GLP-1受体的激活而产生时,这进而导致萤光素酶得到表达。可通过添加萤光素来测定萤光素酶,该萤光素被该酶转化成氧化萤光素并产生生物发光,对该生物发光进行测量并将其作为体外效力的量度。这样的试验的一个非限制性实例在实施例17中描述。
术语半数最大有效浓度(EC
本发明的构建体和GLP-1RA化合物的体外效力可以如上所述确定,并且确定所讨论的化合物或构建体的EC
在一些实施方案中,本发明构建体的GLP-1RA是GLP-1类似物。在一些实施方案中,本发明构建体的GLP-1RA是GLP-1衍生物。
GLP-1类似物的非限制性实例是实施例6、10和13的那些GLP-1类似物(图6、图10、图13),即,分别为SEQ ID NO:11的氨基酸1-31、SEQ ID NO:13的氨基酸1-28和SEQ ID NO:15的氨基酸1-31。
实施例10和13(SEQ ID NO:13,SEQ ID NO:15)中公开了GLP-1衍生物的非限制性实例。它们是带有共价连接的连接体的GLP-1类似物。
本发明的构建体可包含连接体,该连接体连接靶向大脑中参与体重调节的区域的化合物与针对位于BBB中的受体的变构配体。换句话说,该连接体是可选的。
在一个实施方案中,所述连接体是肽连接体。肽连接体由氨基酸组成。在一个实施方案中,该肽连接体由氨基酸组成。在一个实施方案中,该连接体由编码氨基酸组成。
肽连接体的非限制性实例是:GQAPGQAPGQAPGQAPGQAPK(SEQ ID NO:13)和GGGSGGGSGGGSGGGS(SEQ ID NO:11的残基32-47),参见实施例11和6(分别见图11和图6)。
在另一个实施方案中,所述连接体是非肽连接体或化学连接体。尽管非肽连接体可以包含氨基酸残基,但是它并非完全由氨基酸组成。
非肽连接体的非限制性实例是:化学式1:-CH
氨基酸可以被定义为包含氨基和羧酸基团以及可选的一个或多个通常被称为侧链的额外基团的化合物。例如,胺基团可以是伯氨基或仲氨基。脯氨酸是包含仲氨基的氨基酸的一个非限制性实例。
氨基酸的一个亚组是α-氨基酸,其中伯氨基或仲氨基的氮原子与α-碳原子键合。
氨基酸残基是并入肽或蛋白质中的氨基酸的基团。
肽根据大小与多肽和蛋白质区分开。在本文中,除非另有说明,否则肽由至多并包括50个氨基酸残基组成,而多肽和蛋白质由超过50个氨基酸残基组成。蛋白质可由一条或多条可以以生物学功能方式排列的多肽链组成。在特定实施方案中,肽由(i)至少2个氨基酸残基,(ii)至少5个氨基酸残基,(iii)至少10个氨基酸残基,(iv)至少20个氨基酸残基,(v)至少30个氨基酸残基,或(vi)至少40个氨基酸残基组成。在进一步的特定实施方案中,多肽由(i)不超过2000个氨基酸残基,(ii)不超过1500个氨基酸残基,(iii)不超过1000个氨基酸残基,或(iv)不超过600个氨基酸组成。在更进一步的特定实施方案中,蛋白质由(i)不超过2000个氨基酸残基,(ii)不超过1500个氨基酸残基,(iii)不超过1000个氨基酸残基,(iv)不超过600个氨基酸,或(v)不超过500个氨基酸残基组成。
可以基于来源将氨基酸分类为编码氨基酸或非编码氨基酸。术语“编码”氨基酸(有时也称为“天然”氨基酸)可以参考IUPAC(第3AA-1节中的表1)来定义:(http://www.chem.qmul.ac.uk/iupac/AminoAcid/AA1n2.html#AA1),其中给出了这20种氨基酸的结构、俗名、系统名称、单字母和三字母符号。这些都是α-氨基酸。
非编码氨基酸的一个非限制性实例是Aib,也称为α-氨基异丁酸,具有以下结构:
化学式6:
如本文所用的术语“GLP-1肽”是指人胰高血糖素样肽-1(GLP-1(7-37))或其类似物,GLP-1(7-37)的序列以SEQ ID NO:16包含在序列表中。具有SEQ ID NO:16序列的肽也可以被称为“天然”GLP-1。
如本文所用的术语“GLP-1类似物”或“GLP-1的类似物”是指作为GLP-1(7-37)(SEQID NO:16)的变体的肽或化合物。
在序列表中,SEQ ID NO:16的第一个氨基酸残基(组氨酸)被指定为第1号。然而,在下文中,根据本领域已建立的实践,该组氨酸残基被称为第7号,随后的氨基酸残基被相应地编号,结束于第37号甘氨酸。因此,通常,在本文中对GLP-1(7-37)序列的氨基酸残基编号或位置编号的任何提及均指开始于位置7的His且终止于位置37的Gly的序列。
本发明的构建体和衍生物的GLP-1类似物可参照以下两方面来描述:i)天然GLP-1(7-37)中与改变的氨基酸残基相对应的氨基酸残基的编号(即天然GLP-1中的相应位置),和ii)实际改变。
换言之,GLP-1类似物是这样的GLP-1(7-37)肽,其中与天然GLP-1(7-37)(SEQ IDNO:16)相比,许多氨基酸残基已经发生改变。这些改变可独立地表示一个或多个氨基酸置换、添加和/或缺失。
从以上实例可以明显看出,氨基酸残基可以用其全名、其单字母代码和/或其三字母代码来表示。这三种方式完全等效。
表述“等同于...的位置”或“与...相对应的位置”可用来参照天然GLP-1(7-37)(SEQ ID NO:16)表征变异GLP-1(7-37)序列中的变化位点。等同或相应位置,以及变化编号,例如通过简单的书写和目测来容易地推断;以及/或者可使用标准蛋白质或肽比对程序,如基于Needleman-Wunsch算法的“align”。该算法在Needleman,S.B.和Wunsch,C.D.,(1970),Journal of Molecular Biology,48:443-453中描述,而align程序由Myers和W.Miller在"Optimal Alignments in Linear Space"CABIOS(computer applications inthe biosciences)(1988)4:11-17中描述。为了比对,可以使用默认的打分矩阵BLOSUM62和默认的单位矩阵(identity matrix),并可将空位中的第一残基的罚分设置为-12,或优选-10,而将空位中的其他残基的罚分设置为-2,或优选-0.5。
例如在本发明衍生物的GLP-1类似物的语境中使用的术语“肽”是指包含一系列通过酰胺(或肽)键相互连接的氨基酸的化合物。
本发明的GLP-1肽包含至少五个通过肽键连接的组成氨基酸。在特定实施方案中,GLP-1肽包含至少10个,优选至少15个,更优选至少20个,甚至更优选至少25个,或者最优选至少28个氨基酸。
在另外的特定实施方案中,所述肽a)包含i)29个、ii)30个、iii)31个或iv)32个氨基酸,或者b)由i)29个、ii)30个、iii)31个或iv)32个氨基酸组成。
在更进一步的特定实施方案中,所述肽由通过肽键相互连接的氨基酸组成。
在下文中,未说明其光学异构体的GLP-1肽的所有氨基酸都应被理解为意指L-异构体(除非另有说明)。
本发明的构建体可以是药学上可接受的盐、酰胺或酯的形式。其组成化合物和配体部分本身也是这样。
例如,通过碱与酸之间的化学反应来形成盐,例如:2NH
所述盐可以是碱式盐、酸式盐,或者其可以两者都不是(即,中性盐)。在水中,碱式盐产生氢氧根离子而酸式盐产生水合氢离子。
可通过分别在阴离子或阳离子基团之间添加阳离子或阴离子来形成盐。这些基团可以位于本发明构建体的化合物部分、配体部分和/或可选的连接体部分中。
本发明构建体的阴离子基团的非限制性实例包括游离羧基,例如该构建体的C末端氨基酸处的游离羧酸基团,以及内部酸性氨基酸残基如Asp和Glu处的游离羧基。
阳离子基团的非限制性实例包括在N末端处的游离氨基(若存在),以及内部碱性氨基酸残基如His、Arg和Lys的任何游离氨基。
本发明构建体的酯例如可通过游离的羧酸基团与醇或酚的反应形成,该反应导致至少一个羟基被烷氧基或芳氧基替代。
酯的形成可涉及在C末端的游离羧基,和/或在构建体内部的任何游离羧基。
本发明构建体的酰胺例如可以通过游离羧酸基团与胺或取代胺的反应,或者通过游离或取代的氨基与羧酸的反应而形成。
酰胺的形成可涉及在构建体的C末端的游离羧基、构建体内部的任何游离羧基、构建体的N末端的游离氨基,和/或构建体内部的任何游离或取代的氨基。
在特定实施方案中,所述构建体是药学上可接受的盐的形式。在另一个特定实施方案中,所述构建体是药学上可接受的酰胺的形式,优选地在C末端具有酰胺基团。在更进一步的特定实施方案中,所述构建体是药学上可接受的酯的形式。
生产过程
本文公开的诸如对照Fab、抗TfR-Fab和GLP-1类似物等蛋白质和肽的产生是本领域公知的。
例如,可以通过经典的肽合成,例如使用t-Boc或Fmoc化学法的固相肽合成或其他确立的技术,来生产GLP-1类似物,参见,例如,Greene和Wuts,“Protective Groups inOrganic Synthesis”,John Wiley&Sons,1999,Florencio Zaragoza
另外,或备选地,其可以通过重组方法来生产,即通过培养含有编码类似物的DNA序列并能够在允许该肽表达的条件下在合适的营养培养基中表达该肽的宿主细胞。适合表达这些肽的宿主细胞的非限制性实例是:大肠杆菌(Escherichia coli)、酿酒酵母(Saccharomyces cerevisiae)以及哺乳动物BHK或CHO细胞系。
例如,包含非编码氨基酸的本发明的那些构建体可以如实验部分所述产生。或者参见,例如,Hodgson等人:"The synthesis of peptides and proteins containing non-natural amino acids",Chemical Society Reviews,vol.33,no.7(2004),p.422-430;和名称为“Semi-recombinant preparation of GLP-1analogues”的WO 2009/083549A1。
实验部分中包括制备多种构建体的方法的具体实例。
药物组合物
在一个实施方案中,本发明的组合物是药物组合物。
包含本发明构建体或其药学上可接受的盐、酰胺或酯和药学上可接受的辅料的药物组合物可以如本领域已知的那样制备。
术语“辅料”宽泛地指除活性治疗成分外的任何组分。辅料可以是惰性物质、无活性物质和/或非药学活性物质。
辅料可用于各种目的,例如作为载体、媒介物、稀释剂、片剂助剂和/或用来改善活性物质的给药和/或吸收。
药学活性成分与各种辅料的配制是本领域已知的,参见例如Remington:TheScience and Practice of Pharmacy(例如第19版(1995)和任何后续版本)。
辅料的非限制性实例是:溶剂、稀释剂、缓冲液、防腐剂、张度调节剂、螯合剂和稳定剂。
制剂的实例包括液体制剂,即包含水的水性制剂。液体制剂可以是溶液或悬浮液。水性制剂通常包含至少50%w/w的水,或至少60%、70%、80%或甚至至少90%w/w的水。
或者,药物组合物可以是固体制剂,例如,冷冻干燥或喷雾干燥的组合物,其可以原样使用,或由医师或患者在使用前向其添加溶剂和/或稀释剂。
药物组合物可包含缓冲液。
药物组合物可包含防腐剂。
药物组合物可包含螯合剂。
药物组合物可包含稳定剂。
药物组合物可包含一种或多种表面活性剂。
药物组合物可包含一种或多种蛋白酶抑制剂。
本发明的构建体可以以药物组合物的形式施用。其可以施用至有需要的患者的数个部位。
给药途径可以是,例如,肠胃外。
组合物可以以若干剂型施用,例如,溶液;悬浮液;乳液;微乳液;多种乳液;注射溶液;输注溶液。
可借助于注射器(任选地笔状注射器)或借助于输注泵,通过皮下、肌肉内、腹膜内或静脉内注射进行全身或肠胃外给药。
采用根据本发明的构建体的治疗也可以与一种或多种另外的药理学活性物质联合。
使用根据本发明的构建体的治疗还可以与影响葡糖糖水平和/或脂质稳态的手术如胃囊带术或胃旁路术联合。
具体实施方案
通过以下非限制性实施方案进一步描述本发明。
1.构建体,其包含靶向大脑中参与体重调节的区域的化合物和针对位于血脑屏障(BBB)中的受体的变构配体;或其药学上可接受的盐、酰胺或酯。
2.实施方案1的构建体,其中所述化合物靶向大脑中参与体重调节的通路。
3.实施方案1-2中任一项的构建体,其中所述化合物靶向大脑中参与体重调节的受体。
4.实施方案1-3中任一项的构建体,其中所述化合物是肽、多肽或蛋白质。
5.实施方案1-4中任一项的构建体,其中所述化合物是激素。
6.实施方案5的构建体,其中所述激素选自类花生酸、类固醇和氨基酸/蛋白质衍生物。
7.实施方案5的构建体,其中所述激素是氨基酸/蛋白质衍生物。
8.实施方案1-7中任一项的构建体,其中所述化合物是肠源性激素。
9.实施方案1-8中任一项的构建体,其中所述化合物是促胰岛素剂。
10.实施方案1-9中任一项的构建体,其中所述化合物是GLP-1受体激动剂(GLP-1RA)。
11.实施方案1-10中任一项的构建体,其中所述位于BBB中的受体是转铁蛋白受体(TfR)。
12.实施方案11的构建体,其中与TfR结合的变构配体是肽、多肽或蛋白质。
13.实施方案11-12中任一项的构建体,其中与TfR结合的变构配体是抗转铁蛋白受体Fab(抗TfR-Fab)。
14.实施方案1-13中任一项的构建体,其为融合蛋白或缀合物。
15.实施方案1-14中任一项的构建体,其进一步包含连接体。
16.实施方案15的构建体,其中所述连接体是肽连接体或非肽连接体。
17.实施方案1-16中任一项的构建体,其为GLP-1RA。
18.实施方案1-17中任一项的构建体,其为完全GLP-1RA。
19.实施方案1-18中任一项的构建体,其具有与等于或低于1000pM的EC
20.实施方案1-19中任一项的构建体,其能够与GLP-1R结合。
21.实施方案1-20中任一项的构建体,其具有与等于或低于100nM的IC
22.实施方案1-21中任一项的构建体,其能够与转铁蛋白受体(TfR)结合。
23.实施方案1-22中任一项的构建体,其能够抑制TfR靶向抗体的摄取。
24.实施方案23的构建体,其抑制TfR靶向抗体的摄取对应于等于或低于100nM的IC
25.实施方案24的构建体,其IC
26.实施方案11-25中任一项的构建体,其表现出相比于对照构建体增加的与表达GLP-1R的脑区的结合,所述对照构建体与所述构建体的不同仅在于并入了不与TfR结合的配体。
27.实施方案26的构建体,其中所述与表达GLP-1R的脑区的结合使用荧光标记的构建体的体内成像来确定。
28.实施方案27的构建体,其在至少大多数表达GLP-1R的脑区中产生与对照构建体相比更高的荧光信号,其中所述表达GLP-1R的脑区如图16A所示。
29.实施方案28的构建体,其中在至少50%、60%、70%、80%或优选至少90%的表达GLP-1R的脑区中,所述荧光信号更高。
30.实施方案26-29中任一项的构建体,其中所述与表达GLP-1R的脑区的结合基本上如实施例16所述确定。
31.实施方案11-30中任一项的构建体,其表现出相比于对照构建体增加的与被BBB保护的表达GLP-1R的脑区的结合,所述对照构建体与所述构建体的不同仅在于并入了不与TfR结合的配体。
32.实施方案31的构建体,其在至少大多数BBB保护的表达GLP-1R的脑区中产生与对照构建体相比更高的荧光信号。
33.实施方案32的构建体,其中所述BBB保护的表达GLP-1R的脑区是如图16C所示的LS、DG、MH和PB。
34.实施方案32的构建体,其中所述BBB保护的表达GLP-1R的脑区是ACB、DMH、LHA和LH。
35.实施方案32-34中任一项的构建体,其中在至少50%、60%、70%、80%或至少90%的表达GLP-1R的脑区中,所述荧光信号更高。
36.实施方案32-35中任一项的构建体,其中所述荧光信号是对照构建体的荧光信号的至少两倍、三倍、四倍、五倍、六倍、七倍、八倍、九倍或至少十倍。
37.实施方案32-36中任一项的构建体,其中所述与被BBB保护的表达GLP-1R的脑区的结合基本上如实施例16所述确定。
38.实施方案1-37中任一项的构建体,其降低食物摄入量。
39.实施方案38的构建体,其依赖性地降低食物摄入剂量。
40.实施方案38-39中任一项的构建体,其导致与对照相比更低的食物摄入量,所述对照与所述构建体的不同仅在于并入了不与TfR结合的配体。
41.实施方案38-40中任一项的构建体,其中食物摄入量是24小时期间以g为单位的累积食物摄入量。
42.实施方案38-41中任一项的构建体,其中食物摄入量是在瘦小鼠的急性研究中确定的,基本上如实施例20的部分I或部分II所述。
43.实施方案1-42中任一项的构建体,其导致体重减轻。
44.实施方案43的构建体,其导致与对照相比更高的体重减轻,所述对照与所述构建体的不同仅在于并入了不与TfR结合的配体。
45.实施方案43-44中任一项的构建体,其中体重减轻是在DIO小鼠的亚慢性研究中确定的,基本上如实施例20的部分III所述。
46.组合物,其包含实施方案1-45中任一项的构建体和至少一种药学上可接受的辅料。
47.实施方案1-45中任一项的构建体或实施方案46的组合物,其用作药物。
48.实施方案1-45中任一项的构建体或实施方案46的组合物,其用于预防或治疗肥胖症。
49.预防或治疗肥胖症的方法,其包括施用实施方案1-45中任一项的构建体或实施方案46的组合物。
实施例
该实验部分开始于缩写列表,随后是包括检测和表征本发明构建体的通用方法的部分。然后是涉及制备具体构建体部分和构建体的多个实施例,最后包括涉及这些类似物和衍生物的活性和性质的多个实施例(标题为药理学方法的部分)。
这些实施例用来说明本发明。
Ac 乙酰基
ACB 伏隔核
ad lib 随意地
Ado 8-氨基-3,6-二氧杂辛酸
AOB 副嗅球
AP 最后区
APN 顶盖前核
ARH 下丘脑弓状核
AU 任意单位
AUC 曲线下面积
BBB 血脑屏障
BBB-R 血脑屏障受体
BGG 牛γ球蛋白
BHK 幼仓鼠肾
BMA 基底内侧杏仁核
BID 每天两次
Boc 叔丁氧羰基
BrAc 溴乙酰胺
BST 终纹床核
cAMP 环AMP
CeA 中央杏仁核
C
CHO 中国仓鼠卵巢
C
CLND 化学发光氮检测
CNS 中枢神经系统
COA 皮质杏仁区
CRE cAMP响应元件
CU 楔束核
CV 变异系数
Da 道尔顿
DAPI 4',6-二脒基-2-苯基吲哚
DBE 二苄醚
DCM 二氯甲烷
DF 渗滤
DG 齿状回
dH
DIC 二异丙基碳二亚胺
DIO 饮食诱发的肥胖
DMEM dulbecco改良eagle培养基
DMF 二甲基甲酰胺
DMH 下丘脑的背内侧核
DMSO 二甲基亚砜
DMX 迷走神经的运动背核
DPP-4 二肽基肽酶4
DR 背侧缝核
ECU 外楔束核
EDTA 乙二胺四乙酸
Fab 片段抗原结合(抗原结合片段)
FI 食物摄入量
Fmoc 9-芴基甲氧羰基
G418 遗传霉素
GENd 膝状群,背侧丘脑
gGlu 用于并入的谷氨酸/当通过涉及Glu侧链γ位的羧酸基团的酰胺键与另一个分子连接时
GLP-1 胰高血糖素样肽-1
GLP-1R 胰高血糖素样肽-1受体
GLP-1RA 胰高血糖素样肽-1受体激动剂
H 小时
HBSS Hanks平衡盐溶液
HEK 人胚肾
HEPES 4-(2-羟乙基)-1-哌嗪乙磺酸
HFIP 1,1,1,3,3,3-六氟-2-丙醇或六氟异丙醇
HPLC 高效液相色谱法
HSA 人血清白蛋白
IgG4 免疫球蛋白G的亚类4
IO 下橄榄核
i.v. 静脉内
L 升
LCMS 液相色谱质谱法
LH 外侧缰核
LHA 下丘脑外侧区
lib 随意
LOCI 发光氧通道免疫测定
LoQ 定量下限
LPO 外侧视前区
LRNm 外侧网状核,大细胞性
LS 外侧隔核
LSFM 光层照荧光显微术
ME 正中隆起
MH 内侧缰核
MM 乳头体内侧核
MPT 内侧顶盖前区
MQ 去离子水
dRN 中脑网状核
Mtt 4-甲基三苯甲基
MV 前庭内侧核
NaP 磷酸钠
NBF 中性缓冲福尔马林
NI 未定核(nucleus incertus)
NLL 外侧丘系核
NTS 孤束核
OEG 等同于Ado
O/N 过夜
OtBu 叔丁酯
OV 终板血管器
Oxyma
PB 臂旁核
Pbf 2,2,4,6,7-五甲基二氢苯并呋喃-5-磺酰基
PBS 磷酸盐缓冲盐水
Pen/Strep 青霉素链霉素
PFA 低聚甲醛
QC 质量控制
QD 每天一次
QW 每周一次
Rt 保留时间;
RT 室温
s.c. 皮下
SDS-PAGE 十二烷基硫酸钠聚丙烯酰胺凝胶电泳
SEM 平均值的标准误差
SEC-HPLC 大小排阻高效液相色谱法
SFO 穹窿下器官
SPPS 固相肽合成
tBu 叔丁基
TCEP 三(2-羧基乙基)膦
TEA 三乙醇胺
Tf 转铁蛋白
TFA 三氟乙酸
TfR 转铁蛋白受体
TFT 切向流过滤
THF 四氢呋喃
TIC 总离子计数
TIPS 三异丙基硅烷
TNP 2,4,6-三硝基酚
Tris 三(羟甲基)氨基甲烷或2-氨基-2-羟甲基-丙-1,3-二醇
Trt 三苯基甲基(三苯甲基)
吐温20 聚乙二醇失水山梨醇单月桂酸酯
UF 超滤
ULoQ 定量上限
V
WGA 麦胚凝集素
方法:LCMS_34
方法:LCMS_36
该方案概述了方案标题所描述的MS方法,并且用来将方法说明与分析结果相连接。该方法用于通过样品的色谱分离来测量分析物的纯度,并根据其质谱和总离子计数(TIC)来鉴定并量化组分。
LC-系统:Waters Acquity UPLC H级。阶梯梯度:5%至25%B 1min25-65%B 6min
实施例1:
抗TfR-Fab的瞬时表达
该实施例描述了图1A所示的抗Tfr-Fab(SEQ ID NO:3)的瞬时表达。
轻链(SEQ ID NO:1):
DIQMTQSPASLSASLEEIVTITCQASQDIGNWLAWYQQKPGKSPQLLIYGATSLADGVPS
RFSGSRSGTQFSLKISRVQVEDIGIYYCLQAYNTPWTFGGGTKLELKRTVAAPSVFIFPP
SDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLT
LSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
重链(SEQ ID NO:2):
EVQLVESGGGLVQPGNSLTLSCVASGFTFSNYGMHWIRQAPKKGLEWIAMIYYDSSKMNYADTVKGRFTISRDNSKNTLYLEMNSLRSEDTAMYYCAVPTSHYVVDVWGQGVSVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGCLTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESK
将抗TfR-Fab设计为具有如US 2010/0077498 A1中公开的可变域以及人C
将编码抗TfR-Fab的核酸序列克隆到pTT5衍生的表达载体中。为了表达Fab,将HEK293 6E细胞培养至细胞密度为1x10E6个细胞/ml,并使用lipofectin(Invitrogen,目录号12347-500)以表达载体质粒DNA进行转染。转染后5天,通过离心和过滤细胞培养物收获表达上清液。
将含有分泌的抗TfR-Fab的细胞培养上清液上样至在磷酸盐缓冲盐水(PBS)中平衡的蛋白G Sepharose 4FF亲和柱(GE Healthcare)上。用0.1M甘氨酸-HCl(pH 2.8)洗脱结合的Fab。收集级分,并立即用1/20体积的2M Tris-HCl(pH 9.0)中和。然后将合并的级分稀释到25mM NaOAc pH 5.0中,并上样至SP HP柱(GE Healthcare)。用25mM NaOAc pH 5.0中的100-400mM NaCl线性梯度洗脱结合的Fab,并在G25脱盐柱(GE Healthcare)上将缓冲液更换为PBS。通过经0.2mm过滤器单元(Sartorius)过滤对纯化的蛋白质进行除菌。通过SDS-PAGE和大小排阻HPLC分析抗TfR-Fab的纯度。通过质谱法确认Fab的身份。
根据SDS-PAGE,纯度高于95%,根据SEC-HPLC(A280 nm),纯度高于99.1%。观测到的质量为47198.3Da,与理论质量(47198.5Da)一致。
实施例2:
对照Fab的瞬时表达
该实施例描述了图2中所示的不与TfR结合的对照Fab的瞬时表达。图2的对照Fab具有SEQ ID NO:5的氨基酸序列。
轻链(SEQ ID NO:4):
DIVMTQTPLSLSVTPGQPASISCRSSQSLLHSNGNTYLHWYLQKPGQSPQLLIYKVSNRFSGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCSQSTHVPWTFGQGTKVEIKRTVAAPSV
FIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSL
SSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
将对照Fab设计为具有抗TNP抗体的轻链(SEQ ID NO:4)的可变域以及与实施例1的抗TfR抗体相同的重链(SEQ ID NO:2)。
使用与实施例1中所述类似的程序来克隆并表达对照Fab。
根据SDS-PAGE,纯度高于95%,根据SEC-HPLC(A280 nm),纯度高于99.2%。观测到的质量为47787.4Da,与理论质量(47787.0Da)一致。
实施例3:
表达抗TfR-Fab的稳定细胞系的生成
该实施例描述了表达图3中所示的抗TfR-Fab(与图1A中所示相同,SEQ ID NO:3)的稳定细胞系的生成。
使用具有GS选择的CHO K1SV GS KO细胞系(Lonza)生成表达实施例1的抗TfR-Fab的稳定细胞系。将具有N末端CD33信号肽(SEQ ID NO:17)的Fab轻链(SEQ ID NO:1)和重链(SEQ ID NO:2)亚克隆到pEE17.4载体(Lonza)中。对DNA进行线性化,并通过电穿孔转染到CHO K1SV GS KO细胞系中。将转染的细胞微池在含有浓度为25μM的MSX(Sigma-Aldrich)的CD CHO培养基(Thermo Fisher Scientific)中增殖两周。然后将细胞转移到没有MSX的96深孔板中,并使用蛋白G传感器(Fortebio)通过Fortebio分析选择表达最高的24个微池。
为了达到更高的表达稳定性,通过有限稀释用选定的高表达微池分离单细胞克隆。细胞生长2-3周,挑出96个单克隆,并通过Fortebio进行筛选。前24个克隆在24孔板中进一步增殖,并通过采用蛋白G传感器的Fortebio和SDS PAGE分析进行排名。六个最高表达的细胞克隆各自用于进一步的稳定性测试。增殖之前和增殖30天之后的细胞在补料分批培养物中培养,以通过HPLC进行表达水平评价(补料分批培养物是在第3天和第7天补充两种营养物的12天培养物)。两个单克隆是稳定的,30天传代后的表达水平高于70%。
使表达Fab的稳定细胞系复活并增殖。然后将细胞培养物接种到13L Sartorius生物反应器中初始体积为10.5L的CD-CHO培养基中,细胞密度为0.3x10E6个细胞/ml。将补料分批细胞培养物保持在36.5℃,溶解氧水平为40%,pH为7(±0.3)。根据细胞密度和葡萄糖水平进行营养物补料。13天后,使用Millipore深度过滤器MD0HC054H1收获细胞培养物。
抗TfR Fab如实施例1所述纯化、除菌并分析。
根据SDS-PAGE,纯度高于95%,根据SEC-HPLC(A280 nm),纯度高于96.7%。观测到的质量为47199.3Da,与理论质量(47198.5Da)一致。
实施例4:
表达对照Fab的稳定细胞系的生成
该实施例描述了表达图4中所示的对照Fab(与图2中所示相同,SEQ ID NO:5)的稳定细胞系的生成。
除了使用SEQ ID NO:4的Fab轻链代替SEQ ID NO:1的Fab轻链外,如实施例3所述生成表达实施例2的对照Fab的稳定细胞系。还遵循实施例3中描述的实现更高表达稳定性的措施。三个单克隆是稳定的,30天传代后的表达水平高于70%。
如实施例3所述,在13L Sartorius生物反应器中进一步培养表达对照Fab的稳定细胞系。
浓缩含有分泌的对照Fab的细胞培养上清液,并在切向流过滤(TFF)系统(Millipore)中使用超滤/渗滤(UF/DF)将缓冲液更换为25mM NaOAc pH 5.0,然后上样至SPHP柱(GE Healthcare)。用25mM NaOAc pH 5.0中的0-350mM NaCl线性梯度洗脱结合的Fab,并在TFF系统(Millipore)中使用UF/DF将缓冲液更换为PBS。
通过经0.2mm过滤器单元(Sartorius)过滤对纯化的对照Fab进行除菌。通过SDS-PAGE和大小排阻HPLC分析纯度。通过质谱法确认Fab的身份。
根据SDS-PAGE,纯度高于95%,根据SEC-HPLC(A280 nm),纯度高于98.7%。观测到的质量为47787.5Da,与理论质量(47787.0Da)一致。
实施例5:
GLP-1抗TNP-Fab融合蛋白的瞬时表达
该实施例描述了对照Fab和GLP-1类似物的图5所示融合蛋白(SEQ ID NO:8)的表达。对照Fab是抗TNP Fab,其中TNP是指2,4,6-三硝基酚。
轻链(SEQ ID NO:6):
HGEGTFTSDVSSYLEEQAAREFIAWLVKGRPGGGSGGGSGGGSGGGSDIVMTQTPLSLSVTPGQPASISCRSSQSLLHSNGNTYLHWYLQKPGQSPQLLIYKVSNRFSGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCSQSTHVPWTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
重链(SEQ ID NO:7):
QVQLQESGPGLVKPSETLSLTCTVSGGSISSGYWNWIRQPPGKGLEWIGTISYSGDTYYNPSLKSRVTISVDTSKNQFSLKLSSVTAADTAVYYCARYGSYVFDYWGQGTTVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKHHHHHHHHHH
双链Fab融合蛋白由轻链(SEQ ID NO:6)和重链(SEQ ID NO:7)组成。在轻链中,活性GLP-1类似物通过柔性4x(GlyGlyGlySer)连接体与实施例2的抗TNP-Fab的V
如实施例1所述,将编码抗TNP-Fab融合体的核酸序列克隆到pTT衍生的表达载体中。
为了表达融合蛋白,Expi293F细胞(ThermoFisher Scientific,目录号A14527)在Expi293 Expression
将含有分泌的GLP-1抗TNP-Fab融合蛋白的细胞培养上清液上样到在50mM NaP(磷酸钠)、300mM NaCl、10mM咪唑(pH 7.5)中平衡的2x 5ml HisTrap Excel柱(GEHealthcare)上。用50mM NaP、300mM NaCl、500mM咪唑(pH 7.5)洗脱结合的融合蛋白。合并级分,并上样到在PBS中平衡的Superdex 200 16_600柱(GE Healthcare)上。通过经0.2μm过滤器单元过滤对纯化的蛋白质进行除菌。通过非还原性SDS-PAGE分析融合蛋白的纯度,并产生指示纯度>90%的单一条带,且大小排阻HPLC显示12%的高分子量物质。通过质谱法确认融合蛋白的身份。测得的完整平均质量52977Da和胰蛋白酶消化肽的肽质量图谱(数据未示出)表明,V
实施例6:
GLP-1抗TfR-Fab融合蛋白的瞬时表达
该实施例描述了抗TfR-Fab和GLP-1类似物的图6所示融合蛋白(SEQ ID NO:11)的表达。
轻链(SEQ ID NO:9):
HGEGTFTSDVSSYLEEQAAREFIAWLVKGRPGGGSGGGSGGGSGGGSDIQMTQSPASLSASLEEIVTITCQASQDIGNWLAWYQQKPGKSPQLLIYGATSLADGVPSRFSGSRSGTQFSLKISRVQVEDIGIYYCLQAYNTPWTFGGGTKLELKRADAAPTVSIFPPSSEQLTSGGASVVCFLNNFYPKDINVKWKIDGSERQNGVLNSWTDQDSKDSTYSMSSTLTLTKDEYERHNSYTCEATHKTSTSPIVKSFNRNEC
重链(SEQ ID NO:10):
EVQLVESGGGLVQPGNSLTLSCVASGFTFSNYGMHWIRQAPKKGLEWIAMIYYDSSKMNYADTVKGRFTISRDNSKNTLYLEMNSLRSEDTAMYYCAVPTSHYVVDVWGQGVSVTVSSAKTTPPSVYPLAPGSAAQTNSMVTLGCLVKGYFPEPVTVTWNSGSLSSGVHTFPAVLQSDLYTLSSSVTVPSSTWPSETVTCNVAHPASSTKVDKKIVPRDCGHHHHHHHHHH
双链Fab融合蛋白由轻链(SEQ ID NO:9)和重链(SEQ ID NO:10)组成。在轻链中,活性GLP-1类似物通过柔性4x(GlyGlyGlySer)连接体与抗TfR-Fab的V
如实施例1所述,将编码抗TfR-Fab融合体的核酸序列克隆到pTT衍生的表达载体中。
如实施例5所述,该融合蛋白在expi293F细胞中表达,并且收获上清液。
如实施例5所述,将含有分泌的GLP-1抗TfR-Fab融合蛋白的细胞培养上清液上样到2x 5ml HisTrap Excel柱(GE Healthcare)上,并进一步纯化并除菌,其中在从HisTrapExcel柱上洗脱之前增加采用50mM NaP(磷酸钠)、300mM NaCl、30mM咪唑(pH 7.5)的严格性洗涤。
通过SDS-PAGE和大小排阻HPLC分析融合蛋白的纯度,显示出大于95%的纯度。通过质谱法确认融合蛋白的身份。通过质谱法测得平均完整质量为53243.7Da,从而证实了纯化的蛋白质的身份。
实施例7:
GLP-1对照Fab融合蛋白的瞬时表达
该实施例描述了另一种对照Fab和GLP-1类似物的图7所示融合蛋白(SEQ ID NO:12)的表达。
编码该蛋白质的轻链(SEQ ID NO:6)的质粒DNA与实施例5中使用的相同,而编码该蛋白质的重链(SEQ ID NO:10)的质粒DNA与实施例6中使用的相同。这导致杂合构建体,其没有TfR结合,尽管仍然具有类似于实施例6的GLP-1抗TfR Fab(SEQ ID NO:11)的活性GLP-1元件。
如实施例1所述,将编码对照Fab融合体的核酸序列克隆到pTT衍生的表达载体中。
如实施例5所述,该融合蛋白在expi293F细胞中表达,并且收获上清液。
如实施例5所述,将含有分泌的融合蛋白的细胞培养上清液上样至2x 5mlHisTrap Excel柱(GE Healthcare)上,并进一步纯化并除菌。
通过SDS-PAGE和大小排阻HPLC分析Fab融合蛋白的纯度,显示出大于95%的纯度。通过质谱法确认融合蛋白的身份。通过质谱法测得平均完整质量为53662.9Da,从而证实了纯化的蛋白质的身份。
实施例8:
荧光标记的GLP-1抗TfR-Fab融合蛋白的制备
该实施例描述了实施例6的GLP-1抗TfR-Fab融合蛋白(SEQ ID NO:11)的荧光标记。该荧光标记的化合物在图8中示出(请注意,标记是随机附接,而不是仅仅附接在所示的N末端上)。
向2ml实施例6的GLP-1抗TfR-Fab融合蛋白(含有约92nmol)中加入120nmolVivoTag750-NHS,后者是一种胺反应性(NHS酯)近红外荧光染料,其用于标记生物分子,以供体内成像应用,可从PerkinElmer商购获得。
通常,这种荧光标记相当定量地附接至Fab上,但在这种情况下,只能获得非常有限的标记。加入600nmol VivoTag750-NHS,并且偶联进行过夜。次日,将溶液上样到在PBS中运行的PD-10柱(GE Healthcare)上,并将标记的材料收集在1.6ml PBS中。大部分蓝色后来被洗脱为水解的标签。通过CLND(化学发光氮检测)确定浓度为32nmol/ml,并将溶液等分到5个Eppendorf管中,各320μL,并冷冻。
LCMS显示出每个分子0、1、2、3个标记(平均约1个)的混合物。
实施例9:
荧光标记的GLP-1对照Fab融合蛋白的制备
该实施例描述了实施例7的GLP-1对照Fab融合蛋白(SEQ ID NO:12)的荧光标记。该荧光标记的化合物在图9中示出(请注意,标记是随机附接,而不是仅仅附接在所示的N末端上)。
向2ml实施例7的GLP-1对照Fab融合蛋白(SEQ ID NO:12)(含有约138nmol)中加入160nmol VivoTag750-NHS(PerkinElmer)。
如实施例8所述,必须加入额外量的荧光染料,在这种情况下为900nmol。标记材料的偶联和收集如实施例8所述进行(在这种情况下,标记材料收集在2ml PBS中)。大部分蓝色后来被洗脱为水解的标签。如实施例8所述通过CLND确定浓度为49nmol/ml,并将溶液等分到5个Eppendorf管中,各400μL,并冷冻。
LCMS显示出每个分子0、1、2、3个标记(平均约1个)的混合物。
实施例10:
用于缀合的GLP-1肽的合成
该实施例描述了图10所示的GLP-1肽的合成。
在位置58的C末端Lys残基的ε氨基上没有溴乙酰胺(BrAc)衍生化的图10的肽具有SEQ ID NO:13(位置58对应于SEQ ID NO:13的位置52)。
SEQ ID NO:13的肽可以被定义为GLP-1(7-37)的类似物(8Aib,22E,26R,34R),其具有C末端肽连接体(即,添加到GLP-1(7-37)上的第38-58号残基),其中残基38-58对应于SEQ ID NO:13的残基32-52)。该肽连接体为:G-Q-A-P-G-Q-A-P-G-Q-A-P-G-Q-A-P-G-Q-A-P-K,并且具有SEQ ID NO:14。
使用的Fmoc保护的氨基酸衍生物是推荐的标准:例如由Anaspec、Bachem、IrisBiotech或NovabioChem供应的Fmoc-Ala-OH、Fmoc-Arg(Pbf)-OH、Fmoc-Asn(Trt)-OH、Fmoc-Asp(OtBu)-OH、Fmoc-Gln(Trt)-OH、Fmoc-Glu(OtBu)-OH、Fmoc-Gly-OH、Fmoc-His(Trt)-OH、Fmoc-lle-OH、Fmoc-Leu-OH、Fmoc-Lys(Boc)-OH、Fmoc-Phe-OH、Fmoc-Pro-OH、Fmoc-Ser(tBu)-OH、Fmoc-Thr(tBu)-OH、Fmoc-Trp(Boc)-OH、Fmoc-Tyr(tBu)-OH、Fmoc-Val-OH和Fmoc-Lys(Mtt)-OH、Fmoc-Aib-OH。在没有其他任何说明时,使用天然L型的氨基酸。N末端氨基酸在α氨基处采用N末端Boc保护(例如Boc-His(Trt)-OH)。使用基于Fmoc的化学法,在来自Protein Technologies(Tucson,AZ 85714U.S.A.)的SymphonyX Solid Phase PeptideSynthesizer上进行SPPS。将预加载的Fmoc-Lys(Mtt)-wang LL树脂(Novabiochem,加载量为0.33mmol/g)用于肽合成。用DMF中的20%哌啶实现Fmoc脱保护。在前20个循环中进行肽双偶联1h,在其余循环中进行包括加帽(使用乙酸酐)的单偶联2h。氨基酸/Oxyma Pure/DIC溶液的混合物(在DMF中为0.3M/0.3M/0.3M,4倍摩尔过量)用于所有偶联。
将树脂转移到配备有过滤器的玻璃反应器中。添加HFIP/DCM/TIPS75:22:3溶液(70ml),搅拌20min,过滤,再用60ml重复1次,并用DCM(3x65 ml)和DMF(3x65 ml)洗涤。
将溴乙酸(3.0g,12当量,22mmol)和DIC(1.39g,6当量,11mmol)在DMF/DCM 1:1(50ml)中的混合物静置10min,并倒在树脂上。静置过夜,搅拌。过滤,并用DMF(4x60ml)和DCM(4x60ml)洗涤。
通过在室温下在(95TFA:2.5TIPS:2.5水,80ml)的混合物中搅拌3h,从树脂上切下肽。过滤并用少量TFA洗涤树脂。
将该溶液分入12个塑料小瓶中,向每个小瓶中加入干冰冷却的乙醚(25ml),并用另外约20ml的乙醚填充。离心沉淀物。
除去上清液,并在制备型HPLC上纯化产物。
LCMS_34:Rt=2.37min,M/4=1378.3
实施例11:
GLP-1抗TfR-Fab缀合物的合成
该实施例描述了GLP-1肽和抗TfR-Fab的缀合物的合成。该缀合物的结构在图11中示出。
元件
图11的N末端部分(残基1-433)与SEQ ID NO:3的抗TfR-Fab相同(参见实施例1和3)。
图11的C末端部分(残基434-485)与SEQ ID NO:13相同(参见实施例10)。
如图11所示,Lys 485的ε氨基和Cys 377的巯基通过化学式1——-CH
向溶解于PBS缓冲液(pH 7.4)中的实施例3的抗TfR-Fab的溶液(41ml,含有252.4mg,5348nmol抗TfR-Fab)中加入522ul 200mM EDTA缓冲液。
将TCEP(5.05μmol/ml,1.05当量,1112μL,5615nmol)添加至蛋白质溶液中。
TCEP溶液的制备:TCEP,0.5M,pH 7,MW:286g/mol。
用2475μL缓冲液(20mM TEA,2mM EDTA,pH 8.5缓冲液)稀释25μL 0.5M TCEP溶液。静置约2-3h或直到完全还原。
将来自实施例10的3.6当量的肽溶解于DMSO(1.5ml)中,并添加到Fab溶液中,并用少量的TRIS缓冲液pH 9漂洗烧瓶。用TRIS缓冲液pH 9将pH调节至pH 8.3(起始pH=6.5),静置过夜。
通过在Vivaspin 20,10K过滤器中离心来浓缩反应混合物,得到13ml,并在得自GEHealthcare的
柱:Hiload 26/600,superdex 200pg SEC
缓冲液:PBS-缓冲液,pH 7.4
确定了所得产物的以下特性:
LCMS_36:Rt=3.52min;m/30=1751.4;m/32=1642.0
实施例12:
GLP-1对照Fab缀合物的合成
该实施例描述了GLP-1肽和对照Fab的缀合物的合成。该缀合物的结构在图12中示出。
元件
使用与实施例11所述相同的方案,通过用实施例10的溴乙酰基肽(图10)对实施例4的对照Fab进行Cys烷基化来制备该缀合物。
图12的N末端部分(残基1-438)与SEQ ID NO:5的对照Fab相同(参见实施例2和4)。
图12的C末端部分(残基439-490)与SEQ ID NO:13相同(参见实施例10)。
如图12所示,Lys 490的ε氨基和Cys 382的巯基通过化学式1——-CH
确定了所得产物的以下特性:
LCMS_36:Rt=3.01min;m/29=1832.1;m/31=1713.9
实施例13:
用于缀合的GLP-1肽的合成
该实施例描述了图13的GLP-1肽衍生物的合成。
图13并入了GLP-1(7-37)的GLP-1类似物(8G,22E,26R,34R,36K)(SEQ ID NO:15)。
图13还并入了非肽连接体,其可被定义为化学式5:-Ado-gGlu-Ado-,其中Ado是指8-氨基-3,6-二氧杂辛酸,且gGlu是指经由涉及Glu侧链γ位的羧酸基团的酰胺键与另一个分子连接的氨基酸Glu。Ado的双价基团具有化学式3:-NH-(CH
使用的Fmoc保护的氨基酸衍生物是推荐的标准:例如由Anaspec、Bachem、IrisBiotech或NovabioChem供应的Fmoc-Ala-OH、Fmoc-Arg(Pbf)-OH、Fmoc-Asn(Trt)-OH、Fmoc-Asp(OtBu)-OH、Fmoc-Gln(Trt)-OH、Fmoc-Glu(OtBu)-OH、Fmoc-Gly-OH、Fmoc-His(Trt)-OH、Fmoc-lle-OH、Fmoc-Leu-OH、Fmoc-Lys(Boc)-OH、Fmoc-Phe-OH、Fmoc-Pro-OH、Fmoc-Ser(tBu)-OH、Fmoc-Thr(tBu)-OH、Fmoc-Trp(Boc)-OH、Fmoc-Tyr(tBu)-OH、Fmoc-Val-OH和Fmoc-Lys(Mtt)-OH、Fmoc-Aib-OH。在没有其他任何说明时,使用天然L型的氨基酸。N末端氨基酸在α氨基处采用N末端Boc保护(例如,对于在N末端具有Tyr的肽,为Boc-Tyr(tBu)-OH)。使用基于Fmoc的化学法,在来自Protein Technologies(Tucson,AZ 85714U.S.A.)的SymphonyX Solid Phase Peptide Synthesizer上进行SPPS。用于制备C末端肽的树脂是Fmoc-Gly-wang LL树脂(Novabiochem,例如加载量为0.29mmol/g)。用DMF中的20%哌啶实现Fmoc脱保护。使用氨基酸/Oxyma Pure/DIC溶液(在DMF中为0.3M/0.3M/0.3M,4倍摩尔过量)进行肽偶联1h。在用DCM(5x 10mL)洗涤之前,通过用HFIP/TIS/DCM(75:2.5:22.5,v/v/v)(3x 10mL x 30min)洗涤树脂来除去Mtt基团。如上所述,用Fmoc-Ado-OH和Fmoc-gGlu(OtBu)-OH继续合成。将树脂转移到配备有过滤器的玻璃反应器中。
将溴乙酸(0.840g,12当量,6mmol)和DIC(0.400ml,5.2当量,2.6mmol)在DMF(16ml)中的混合物静置10min,并倒在树脂上。静置过夜。过滤,并用DMF(4x6 ml)和DCM(4x6ml)洗涤。
通过在室温下在(95TFA:2.5TIPS:2.5水,80ml)的混合物中搅拌3h,从树脂上切下肽。过滤并用少量TFA洗涤树脂。将该溶液分入12个塑料小瓶中,向每个小瓶中加入干冰冷却的乙醚(25ml),并用另外约20ml的乙醚填充。离心沉淀物。除去上清液,并在制备型HPLC上纯化产物。
LCMS_34:Rt=2.45min,M/3=1328.2
实施例14:
GLP-1对照Fab缀合物的合成
该实施例描述了GLP-1肽和对照Fab的缀合物的合成。该缀合物的结构在图14中示出。
除了以3.6当量的量使用实施例13的肽衍生物以外,使用与实施例11所述相同的方案,通过用实施例13的溴乙酰基肽衍生物(图13)对实施例4的对照Fab进行Cys烷基化来制备该缀合物。
图14的N末端部分(残基1-438)与SEQ ID NO:5的对照Fab相同(参见实施例2和4)。
图14的C末端部分(残基439-469)除了以下事实之外与图13相同:化学式5——-Ado-gGlu-Ado-的连接体的远端Ado,即图13中衍生化的溴乙酰胺,在此处经由化学式1化学连接体(化学式1:-CH
确定了所得产物的以下特性:
LCMS_36:Rt=3.14min;m/30=1720.0;m/32=1612.6
实施例15:GLP-1抗TfR-Fab缀合物的合成
该实施例描述了GLP-1肽和抗TfR-Fab的缀合物的合成。该缀合物的结构在图15中示出。
使用与以上针对实施例14所述相同的方案,通过用实施例13的溴乙酰基肽衍生物(图13)对实施例3的抗TfR-Fab进行Cys烷基化来制备该缀合物。
图15的N末端部分(残基1-433)与SEQ ID NO:3的抗TfR-Fab相同(参见实施例1和3)。
图15的C末端部分(残基434-464)除了以下事实之外与图13相同:化学式5——-Ado-gGlu-Ado-的连接体的远端Ado,即图13中衍生化的溴乙酰胺,在此处经由化学连接体(化学式1:-CH
确定了所得产物的以下特性:
LCMS_36:Rt=3.55min;m/30=1700.4;m/32=1594.2
实施例16:
荧光标记的GLP-1TfR融合蛋白的体内成像
该实施例检查了“活性”和“无活性”GLP-1-Fab融合蛋白(“活性”意味着它与TfR结合,“无活性”意味着它不与TfR结合)对大脑表达GLP-1受体的各个区域的接近。这两种融合蛋白包含一种相同的GLP-1受体激动剂化合物,但Fab部分不同。这是为了确定活性与无活性融合蛋白之间在其接近被血脑屏障(BBB)保护的脑区方面是否存在实质性差异。该研究是在小鼠中的急性研究。
化合物施用:
小鼠(C57BL/6J,雄性,Taconic,n=4/组)接受单个静脉内剂量的实施例8的荧光标记的GLP-1抗TfR-Fab融合蛋白(“GLP-1-活性TfR”),120nmol/kg,或实施例9的荧光标记的GLP-1对照Fab融合蛋白(“GLP-1-无活性TfR”),120nmol/kg。化合物给药后6小时(“6H”)用异氟烷麻醉小鼠,并通过先后经心脏灌注10ml肝素化(10U/ml)盐水和10ml 10%中性缓冲福尔马林(NBF)实施安乐死。取出大脑,将其浸入10%NBF中,并在4℃下保存过夜,直至进一步处理。
组织的清理:
使大脑脱水并在二苄醚(DBE)中饱和,以通过除去水并通过匹配折射率来使扫描过程中的光散射最小化。将脑组织在室温下用在脱矿质H
采用光层照荧光显微术(LSFM)的扫描:
使用UltraMicroscope II LSFM系统(Lavision Biotec,Bielefeld,德国)以10.32μm各向同性分辨率扫描脑样品。对于自发荧光成像,使用620/60nm激发滤光片和680/30nm发射滤光片,而对于特定信号成像,使用710/75nm激发滤光片和780/40nm发射滤光片,进行数据采集。
图像分析:
图像是z平面的单平面图像(2D)。进行光谱分解以最小化所呈现的特定信号的图像中组织自发荧光的贡献。在Imaris(版本7.6.5,苏黎世,瑞士)中,对输入的tiff文件进行分解。根据非特定记录中选定的体素(voxel)与特定通道中的相应体素之间的体素强度比,计算并去除特定通道中估计的自发荧光贡献。对基于非特定记录的直方图选择的40组体素计算比率。分解算法是用Matlab(2012b版,MathWorks,Natick,Massachusetts,美国)编写的,并在Imaris中用作XT插件。
使用Elastix软件库第4版(Klein,Stefan等人,"Elastix:a toolbox forintensity-based medical image registration."IEEE transactions on medicalimaging 29.1(2010):196-205),将图像配准到公共参考图集空间以供可视化和量化。通过找到使I
结果:
图像分析的结果在图16A、16B、16C和16D中示出。
在图16A中,在表达GLP-1受体(GLP-1R)的脑区中量化了荧光标记的化合物(“GLP-1-活性TfR”和“GLP-1-无活性TfR”)的总强度。总信号以任意单位(“AU”)报告,并代表平均值。图16B显示了荧光标记的化合物在表达GLP-1R但缺乏BBB的室周器的实例中的强度。图16C显示了荧光标记的化合物在被BBB保护的表达GLP-1R的脑结构的实例中的强度。图16D显示了荧光标记的化合物在不表达GLP-1R的脑区的实例中的强度。在缩写列表中定义了各个脑区的缩写。
图16A显示了在表达GLP-1R的区域中,与GLP-1-无活性TfR相比,来自GLP-1-活性TfR的荧光信号更高。
在表达GLP-1R但缺乏BBB的室周器中,活性与无活性TfR化合物之间的差异较小(图16B)。TfR在毛细血管和脑实质中均表达。因此,活性TfR化合物在这些区域中的贡献略高表明除了被GLP-1R结合外,还有来自化合物的TfR结合的贡献。
还对不表达GLP-1R的脑区中的信号进行了定量(图16D)。在这里,两种化合物的信号几乎相同,其中活性TfR化合物的贡献略高再次表明来自这些化合物的TfR结合的贡献。
被BBB保护的脑结构的实例在图16C中给出。与GLP-1-无活性TfR相比,来自GLP-1-活性TfR的信号高度增加,这表明GLP-1组分被携带到GLP-1本身不易接近的区域。尽管与TfR的结合也可能产生该信号,但这两种化合物之间在表达GLP-1R的区域中的差异比没有GLP-1R的区域中的差异大得多(图16D)。这提示大部分信号源自与GLP-1R的结合。
结论:
在被BBB保护的脑结构中所见的,活性与无活性TfR化合物之间在信号强度上明显且显著的差异(图16C)表明,GLP-1R激动剂与抗TfR Fab的偶联可用作将GLP-1R激动剂靶向到GLP-1R激动剂不易接近的脑区的手段。这些区域中的一些区域,如ACB、DMH、LHA和LH,已被证明在体重调节和与奖励有关的食物摄入方面至关重要。
实施例17:GLP-1体外效力
本实施例的目的是测试本文公开的活性和无活性GLP-1融合体和缀合物的GLP-1活性(其中术语活性/无活性是指分别与转铁蛋白受体(TfR)结合/不结合的能力)。GLP-1活性被确定为GLP-1的体外效力,并且是在全细胞试验中人GLP-1受体激活的量度。
原理:
通过在报告基因试验中测量人GLP-1受体的响应来确定体外效力。在表达人GLP-1受体并含有与启动子偶联的cAMP响应元件(CRE)DNA以及萤火虫萤光素酶(CRE萤光素酶)基因的稳定转染的BHK细胞系中进行该试验。当人GLP-1受体被激活时,其导致cAMP的产生,这进而导致萤光素酶蛋白质得到表达。当试验孵育完成时,添加萤光素酶底物(萤光素),并且该酶将萤光素转化成氧化萤光素从而产生生物发光。测量该发光作为该试验的读出。
为了测试化合物与白蛋白的结合,可以在不存在血清白蛋白的情况下以及在相当高浓度的血清白蛋白(1.0%最终测定浓度)的存在下进行该试验。在血清白蛋白的存在下体外效力EC
细胞培养和制备:
该试验中使用的细胞(克隆FCW467-12A/KZ10-1)是以BHKTS13作为亲本细胞系的BHK细胞。该细胞来源于表达人GLP-1受体的克隆(FCW467-12A),并且是通过用CRE萤光素酶进一步转染而建立的,从而获得本克隆。将细胞在细胞培养基中在5%CO
材料:
在该试验中使用了以下化学物质:Pluronic F-68(10%v/v)(Gibco2404)、人血清白蛋白(HSA)(Sigma A9511)、卵白蛋白(Sigma A5503)、不含酚红的DMEM(Gibco 11880-028)、1M Hepes(Gibco 15630)、Glutamax 100(Gibco 35050)和steadylite plus(PerkinElmer 6016757)。
缓冲液:
细胞培养基由含有10%w/v FBS(胎牛血清;Invitrogen 16140-071)、1mg/mlG418(Invitrogen 15140-122)、240nM MTX(氨甲蝶呤;Sigma M9929)以及1%w/v pen/strep(青霉素/链霉素;Invitrogen 15140-122)的DMEM培养基组成。
测定介质由不含酚红的DMEM、10mM Hepes和1x Glutamax组成。1%测定缓冲液由测定介质中的2%卵白蛋白、0.2%Pluronic F-68和2%HSA组成。0%测定缓冲液由测定介质中的2%w/v卵白蛋白和0.2%v/v Pluronic F-68组成。
程序:
1.将细胞储备液在37℃水浴中解冻。
2.将细胞在PBS中洗涤三次。
3.对细胞进行计数,并在测定介质中调节至5x10
4.对于0%HSA CRE萤光素酶试验在0%测定缓冲液中,对于1%HSA CRE萤光素酶试验在1%测定缓冲液中,将测试化合物的储备液稀释至0.2μM的浓度。将化合物稀释10倍,得到以下浓度:2x10
5.将50μl等份的化合物或空白从稀释板转移至测定板。在下列终浓度下测试化合物:1x10
6.将测定板在5%CO
7.将测定板从培养箱中取出,并使其在室温下静置15min。
8.向测定板的每个孔中添加100μl等份的steadylite plus试剂(试剂是光敏的)。
9.将每个测定板用铝箔覆盖以避光,并在室温下振摇30min。
10.在微量滴定板读板仪中读取每个测定板。
计算与结果:
将来自读板仪的数据传输至GraphPad Prism软件。该软件执行非线性回归(log(激动剂)相对于响应)。用该软件计算并以pM为单位报告的EC
表1:体内效力
所有化合物均具有证实它们是GLP-1受体激动剂的效力数据。所有化合物均具有良好的GLP-1体外效力,其对应于在0%HSA下低于1000pM的EC
实施例18:GLP-1受体结合
本实施例的目的是测试本文公开的活性和无活性GLP-1融合体和缀合物的体外GLP-1受体结合活性(其中术语活性/无活性是指分别与转铁蛋白受体(TfR)结合/不结合的能力)。受体结合是化合物对人GLP-1受体的亲和力的量度。
原理:
在竞争性结合试验中测量与人GLP-1受体的结合。在这种类型的试验中,使标记的配体(在这种情况下为
材料:
在该试验中使用以下化学物质:人血清白蛋白(HSA)(Sigma A1653)、不含酚红的DMEM(Gibco 11880-028)、Pen/strep(Invitrogen15140-122)、G418(Invitrogen 10131-027)、1M HEPES(Gibco 15630)、EDTA(Invitrogen 15575-038)、PBS(Invitrogen 14190-094)、胎牛血清(Invitrogen 16140-071)、EGTA、MgCl
缓冲液1由20mM Na-HEPES外加10mM EDTA组成,并且pH被调节至7.4。缓冲液2由20mM Na-HEPES外加0.1mM EDTA组成,并且pH被调节至7.4。测定缓冲液由补充有5mM EGTA、5mM MgCl
细胞培养和膜制备:
该试验中使用的细胞(克隆FCW467-12A)是以BHKTS13作为亲本细胞系的BHK细胞。该细胞表达人GLP-1受体。使细胞在DMEM、10%w/v胎牛血清和1%w/v pen/strep(青霉素/链霉素)中在5%CO
程序:
1.对于在低HSA(0.001%)的存在下的受体结合试验,向测定板的每个孔中添加50μl测定缓冲液。试验继续步骤3。
2.对于在高HSA(2.0%)的存在下的受体结合试验,向测定板的每个孔中添加50μl的8%白蛋白储备液。试验继续步骤3。
3.对测试化合物进行系列稀释,以得到以下浓度:8x10
4.将细胞膜等份解冻,并稀释至其工作浓度。将50μl添加至测定板的每个孔中。
5.将WGA SPA珠子以20mg/ml悬浮于测定缓冲液中。在临添加至测定板之前,将该悬浮液在测定缓冲液中稀释至10mg/ml。将50μl添加至测定板的每个孔中。
6.通过向测定板的每个孔中添加25μl的[
7.将测定板在30℃下孵育2h。
8.将测定板离心10min。
9.在Packard TopCount NXT仪器中读取测定板。
计算:
将来自TopCount仪器的数据传输至GraphPad Prism软件。该软件对重复测量的值取平均,并进行非线性回归。用该软件计算IC
结果:
获得以下结果:
表2:GLP-1受体结合
所有衍生物的IC
实施例19:转铁蛋白受体摄取抑制
本实施例的目的是测试本文公开的示例性活性和无活性GLP-1融合体和缀合物的体外转铁蛋白受体结合活性(其中术语活性/无活性是指分别与转铁蛋白受体(TfR)结合/不结合的能力)。转铁蛋白受体结合是化合物对小鼠转铁蛋白受体的亲和力的量度。
原理:
在竞争性摄取试验中测量了实施例11-12和14-15的缀合物抑制转铁蛋白受体靶向的抗体的摄取的能力。每组Fab缀合物中的两种化合物(实施例11和12;以及实施例15和14)包含相同的GLP-1R激动剂部分,但在Fab部分上有所不同,在与TfR结合方面分别是“活性的”和“无活性的”。
将每种化合物以一系列浓度与设定浓度的荧光标记的Fab片段(如下所述)一起添加至可商购获得的小鼠成纤维细胞系(MEF-1)。每种化合物对标记的Fab片段的细胞摄取的抑制被报告为获得半数最大信号时的浓度(IC
材料:
荧光标记的Fab片段的制备:
荧光标记的Fab片段是通过实施例1的抗TfR-Fab的Cy5标记制成的。Cy5标记的抗TfR-Fab在图1B中示出,其中显示Cy5染料附接至位置377的Cys上。
向实施例1的抗TfR-Fab溶液(6.15mg/ml,17.5ml)中加入226uL200mM EDTA缓冲液。用2475ul缓冲液(20mM TEA,2mM EDTA,pH 8.5)稀释25uL TCEP溶液(0.5M,pH 7.0)。将517uL(1.25当量,2.9umol)稀释的TCEP溶液添加至抗TfR-Fab溶液中。将该溶液在-80℃下保存。
将1mL等份(6.15mg,131nmol)的以上产生的溶液用氩气鼓泡,并添加溶解于100uL无水DMF中的1mg Cy5(Amersham Cy5马来酰亚胺单反应性染料)。将混合物在5℃和氩气下保持过夜。
使用以下方案在Zeba Spinn脱盐柱,7K MWCO,5ml上纯化产物:柱在1000G下旋转2min。洗出2.4ml。用2.4ml PBS缓冲液洗涤3次,每次以1000G旋转2min。3次后,将产物(1ml+0.7ml洗涤液)置于柱顶上,并以1000G旋转2min。收集产物(1.7ml)。计算的准确质量(m+z)/z(无量纲):47859.88。实测的准确质量(m+z)/z(无量纲):47859.83。
在该试验中使用了以下另外的化学物质:
DMEM(Gibco 31966-026),Pen/strep(Invitrogen 15140-122),G418(Invitrogen10131-027),1M HEPES(Gibco 15630),EDTA(Invitrogen 15575-038),胎牛血清(Invitrogen 16140-071),PFA 4%(Chem Cruz Sc-281692),人血清白蛋白(SigmaA9511),胶原蛋白包被的成像板(Becton Dickinson 734-0319),DAPI Hoechst 33342(Sigma B2261),麦胚凝集素-Alexa 488(Invitrogen W32464),HBSS(Gibco14025)。
程序:
1.在接种到细胞板中之前,使MEF-1细胞在DMEM、10%w/v胎牛血清和1%w/v青霉素/链霉素中在5%CO
2.在测定当天,将细胞用含有0.1%(w/v)HSA的HBSS洗涤。
3.对测试化合物进行系列稀释,得到以下浓度:2x10
4.向每个孔中添加荧光标记的Fab片段,至终浓度为5nM。
5.将板在37℃下孵育15min。孵育后,除去缓冲液,并用含有0.1%(w/v)HSA的HBSS洗涤细胞。
6.在通风柜中加入50μl的冷4%PFA。将板在室温下孵育10min,随后除去PFA。
7.将50μl标记溶液添加到板中,并孵育10min。该标记溶液含有1:200(v/v;来自10mg/ml储备液)的DAPI和1:200(v/v;来自5mg/ml储备液)的WGA-Alexa488。将测定板在室温下孵育10min。
8.用100μl HBSS洗涤测定板3次,并在洗涤步骤后将100μl HBSS加入到每个孔中。
9.在高含量成像仪器(IN Cell 2200仪器,GE)中读取测定板。
计算:
使用随仪器提供的软件分析来自IN Cell仪器的数据。使用DAPI染色的细胞核确定细胞核,并基于WGA-Alexa488染色构建细胞边界。通过定义在仪器的Cy5通道中可见并对应于内化Cy5标记的Fab片段的颗粒,计算内化的荧光量。计算每个细胞中颗粒的数目和强度。用于进一步计算的仪器的读出是颗粒的总面积除以每个采集区域中的细胞数。一个典型的实验使用20倍显微镜物镜每孔包含32个视野。将数据转移到GraphPad Prism软件,并绘制为浓度响应曲线,在x轴上为log M(M是测试化合物的摩尔浓度),在y轴上为每个细胞的总颗粒面积。该软件执行非线性回归。用该软件计算IC
结果:
获得以下结果:
表3:转铁蛋白受体摄取抑制
具有活性Fab(TfR-Fab)的所有衍生物的IC
实施例20:在小鼠中的体内研究
该实施例的目的是评估GLP-1抗TfR-Fab缀合物在体内是否具有生物学活性,焦点是与肥胖症有关的特征。
本实施例的部分I报告了本发明的“活性”GLP-1抗TfR-Fab缀合物在急性静脉内给药的瘦小鼠中降低食物摄入量的能力的研究。
部分II报告了该“活性”缀合物与“无活性”GLP-1对照Fab缀合物的比较,以确定TfR臂是否有助于在部分I中获得的结果。
部分III报告了在亚慢性治疗的饮食诱发的肥胖小鼠中的研究,目的是研究在部分I和部分II中观察到的食物摄入减少是否转化为体重减轻。
研究设计:
使用biodaq自动监测系统(Research Diets,New Brunswick,NJ,USA),在24小时期间,在用实施例11的GLP-1抗TfR-Fab缀合物急性静脉内给药(0-100nmol/kg)的雄性瘦C57Bl6J小鼠(Taconic,丹麦)中研究食物摄入。简言之,将小鼠保持在12小时的光暗周期下,食物(Altromin,目录号1314,Lippe,德国)和自来水可随意获得。在给药之前,将小鼠(每组n=4-6)分配到体重均匀匹配的5个治疗组之一,并在给药前8天置于biodaq系统中,以便适应测试和处理程序。在实验当天,在时间0时按照下表向小鼠静脉内施用媒介物或实施例11的化合物:
表4:组
*PBS+0.05%聚山梨醇酯80
血浆暴露:
24h后,经由舌下丛将血样采集到EDTA管中,管中含有蛋白酶抑制剂混合物(3.097g K3EDTA(MW 406.53),Fluka 03665,溶解于50ml Trasylol,10.000KIU(激肽释放酶灭活剂单位),0.5ml 20mM Val-Pyr(16.48mg Val-pyr/4ml H
通过LOCI(发光氧通道免疫测定)测量实施例11化合物(对于部分II和III,为实施例12化合物)的血浆浓度。简言之,LOCI试剂包括两种乳胶珠试剂(供体和受体珠)和识别GLP-1的N末端表位的生物素化单克隆抗体。用链霉抗生物素蛋白包被含有光敏染料的供体珠试剂。第二珠试剂——受体珠——与另一种对GLP-1的C末端具有特异性的单克隆抗体缀合,这构成了夹心结构。在测定过程中,将这三种反应物与实施例11化合物(或者,在部分II和III中,为实施例11化合物或实施例12化合物)在血浆中组合,以形成珠-聚集体免疫复合物。该复合物的激发从供体珠中释放出单线态氧分子,该分子被引导到受体珠中并触发化学发光反应,该反应在Envision读板器中进行测量。产生的光量(以每秒计数(cps)报告)与分析物的浓度成比例。
所有校准物、QC样品和EDTA血浆中的未知样品均一式四份进行分析确定。
分析程序如下:
在LOCI缓冲液中制备受体珠/生物素化抗体和供体珠的工作溶液。
每孔施加1μL血浆样品/校准物/QC。
将含有识别GLP-1的N末端表位的生物素化单克隆抗体的15μL工作溶液和用对GLP-1的C末端具有特异性的单克隆抗体包被的受体珠加入到每个孔中。
将板密封并用黑色盖子覆盖。
使该测定在18-22℃下孵育1小时。
在绿灯下添加在LOCI缓冲液中稀释的30μL链霉抗生物素蛋白包被的供体珠。
将板用黑色盖子覆盖,并在18-22℃下孵育30分钟。
最后,在Envision中读板。
使用由Envision软件控制的Envision阅读器进行分析。将仪器响应(每秒计数)输出到LOCI Calculator,在其中计算血浆浓度。
校准物:在涵盖400.000至42pmol/L范围的小鼠血浆池中制备了的一系列稀释的实施例11化合物校准物(对于部分II和III,为实施例12化合物校准物)。包含小鼠血浆池作为0pM校准物(空白)。将校准物在-18℃下储存在Micronic管中。
性能:
定量下限(LoQ)被确定为40pmol/L。定量上限(ULoQ)被确定为25.000pM。通过在12个连续分析运行中测量三个样品并在同一分析运行中对三个样品中的每个样品进行21次测定来评估不精确性(CV);总CV<10%。
材料:
试剂:
LOCI缓冲液:25mM Hepes(Sigma H-3375),50mM NaCl(Merck8.22184),10mM K-EDTA(Fluka 03664),2mg/ml葡聚糖(Pharmacosmos551005009007),0.5%卵白蛋白OA(Sigma-A 5573),0.05%BGG(Sigma G-7516),0.1%吐温20(Merck 8.22184),0.01%Proclin 300(Sigma-Aldrich48912-U),0.01%庆大霉素(Biol.Indust.03-035-1),0.2mg/ml HBR1(Scan.Lab.3KC533),pH 7.4
用于稀释和校准物的小鼠血浆:
来自Bioreclamation的雌性小鼠血浆(C57BL/6),K2 EDTA,Cat.MSEPLEDTA2-C57-F
测定板:
Perkin Elmer,PPN 6005359。
数据分析:
Graph
结果:
结果在图17中示出,其中图17A以克为单位显示了累积食物摄入量(FI),而图17B显示了给药后24小时测得的以pM为单位的血浆暴露。数据显示为平均值。
从图17A可以明显看出,实施例11的化合物以剂量依赖性方式降低食物摄入量。而图17B显示,剂量越高,血浆暴露越高。这证实了该化合物在体内具有生物学活性。
为了确定实施例11的GLP-1抗TfR-Fab缀合物中的TfR臂是否有助于如上确定的食物摄入降低能力,与实施例12的GLP-1对照Fab缀合物进行了面对面比较,其中将相同的GLP-1R激动剂与无活性Fab缀合,以充当对照化合物。
简言之,将瘦C57Bl6J小鼠维持在12h光暗周期下(上午11点熄灯),随意获取食物和水,如以上部分I所述。同样与以上部分I类似地,使小鼠适应biodaq食物摄入监测系统7天,之后将其分配至体重均匀匹配的3个治疗组之一。在实验当天,按照下表向小鼠施用媒介物或100nmol/kg的实施例11化合物或实施例12化合物:
表5:组
*PBS+0.05%聚山梨醇酯80
在接下来的24h内每小时监测一次食物摄入量,之后通过在麻醉下放血及随后进行颈脱位处死小鼠。
使用一组卫星小鼠生成每种化合物的暴露曲线。如以上部分I所述,经由舌下丛将血样采集到含有蛋白酶抑制剂混合物的EDTA管中,收集血浆并分析其暴露。对于每种化合物,静脉内给药后1h、4h、8h、10h、16h、18h和24h,通过稀疏采样进行抽血,每个时间点n=3只小鼠。如以上部分I所述,分析血浆样品的暴露。
数据分析:
Graph
结果:
结果在图18中示出,其中图18A以g为单位显示了累积食物摄入量(FI),而图18B显示了在24h内测得的血浆暴露水平(以pM为单位的血浆浓度)。
从图18A可以明显看出,在24小时观察期内,相对于经媒介物处理的小鼠,两种GLP-1化合物均减少了食物摄入量。然而,相对于用实施例12化合物治疗的小鼠,在用实施例11化合物治疗的小鼠中食物摄入降低显著更大。图18B显示在用实施例12的对照化合物处理的小鼠中,血浆暴露水平相似或更高,这暗示类似物之间食物摄入降低的差异与PK的差异无关。相反,这些数据表明,实施例11化合物中的活性TfR Fab有助于更大的食物摄入降低。
为了确定在肥胖症临床前模型中急性食物摄入量的减少是否转化为体重减轻,我们接下来在亚慢性治疗19天的DIO小鼠中比较了以上部分I和部分II中使用的化合物。简言之,雄性C57Bl6J小鼠(Charles River,法国)(n=79)从大约4周龄开始保持60%高脂饮食(D12492,Research Diets,New Brunswick,NJ,USA)。将肥胖小鼠在大约20周龄时运送到测试机构,并在12-12h明暗周期(晚上11:00熄灯)下圈养在温度和湿度受控的环境中,每笼n=10。4天后,将高脂饮食喂养组的小鼠从60%高脂饮食转换为45%高脂饮食(HFD D12451,Research Diets,New Brunswick,NJ,USA),以防止破碎和溢出,并更准确地测量食物摄入量。此时将所有小鼠单独圈养,并使其再适应新环境两周。食物和水随时随意获得。
在给药前第5天测量身体组成(Echo MRI 700,Houston,TX,USA),并在给药前第3天将小鼠分配到脂肪和瘦组织均匀匹配的3个治疗组之一。
从给药前一天开始,每天监测食物摄入量和体重。从第1天开始,并按照以下表6,每天从下午12:30开始每天施用化合物。小鼠最初在第1-4天静脉内给药,然后在第5-19天皮下给药。在第19天给药后2h收集血样以供检测血浆暴露,并如以上部分I所述进行分析。
表6:组
*PBS+0.05%聚山梨醇酯80
结果:
结果在图19中示出,其中图19A显示了平均体重减轻(%),图19B显示了在第19天给药后2h测得的平均血浆浓度(pM)。
从图19A可以明显看出,与媒介物处理的小鼠相比,这两种化合物均降低了体重。图19B显示各组之间血浆暴露水平的差异相似,然而,用实施例11的“活性”化合物治疗的DIO小鼠比用实施例12的“无活性”化合物处理的DIO小鼠有更多的体重减轻,表明与对照化合物相比,具有TfR Fab的“活性”化合物对体重降低提供额外的益处。
虽然本文已经阐述并描述了本发明的某些特征,但是本领域普通技术人员现在将会想到许多修改、替换、改变和等同方案。因此,应当理解,意欲以所附权利要求书涵盖所有这些落入本发明真正范围内的修改和改变。
- 用于治疗肥胖症的新型化合物
- 用于治疗肥胖症的化合物和其使用方法
