肽活化剂
文献发布时间:2023-06-19 09:57:26
技术领域
本发明涉及Lck(淋巴细胞特异性蛋白酪氨酸激酶)活性的刺激并且涉及用于防治或治疗各种疾病或病状的Lck活化剂。
背景技术
在分子生物学中,CD4(分化簇4)是在免疫细胞(诸如T辅助细胞、单核细胞、巨噬细胞和树突细胞)的表面发现的一种糖蛋白。CD4+ T辅助细胞是白细胞,其是免疫系统的重要部分并且可将信号发送到其它免疫细胞(诸如CD8杀伤细胞)以破坏感染性颗粒。当T细胞受体(TCR)和共受体结合抗原肽:主要组织相容性复合物(MHC)时,T细胞被活化,这会导致TCR复合物聚集并触发细胞内级联反应。在T细胞活化中,共受体CD4和CD8分别与II类或I类MHC分子结合,增加了T细胞对抗原的敏感性。
Lck是Src家族激酶的成员并且对于T细胞效应子潜能(即,发育中的胸腺细胞和成熟T细胞的增殖和分化以及有效的细胞因子转录)的形成至关重要(Lovatt M等人,Mol&Cell Biology,2006,26(22):8655-8665)。
Lck对TCR的磷酸化通过创建结合位点来启动下游信号传导,所述结合位点将细胞溶质激酶ZAP70(ζ链相关蛋白激酶70)募集到细胞膜上(Iwashima M等人,Science,1994,263:1136-1139)。更特别地,Lck受C-末端Src激酶(Csk)调节,该C-末端激酶使Tyr 505磷酸化,从而导致Lck失活,通过活性位点重新排列而激活Lck的激酶活性的Lck活化环Tyr 394的反式自体磷酸化,以及通过磷酸酶去磷酸化(Fulop T等人,Longevity&Healthspan,2012,1:6)。
在TCR刺激后,与CD4/CD8相关的Lck与TCR/CD3复合物接近,并且使CD3分子的基于免疫受体酪氨酸的活化基序(ITAM)磷酸化。然后ZAP70激酶被募集到磷酸化的ITAM上,随后被Lck活化。这导致多个途径的活化,多个途径的活化最终导致T细胞活化和IL-2产生(WangG等人,BioMed Research International,2014,doi.org/10.1155/2014/682010)。
另外,树突细胞(DC)介导的Lck活化导致“TCR许可”,这一过程极大地提高了TCR对同源肽-MHC II类抗原复合物的反应的敏感性和幅度(Meraner P等人,2007,J Immunol,178(4):2262-2271)。此类上皮内DETC细胞(树突状表皮T细胞)或γ/δT细胞在体内稳态、组织修复、炎症和防御恶性肿瘤方面起关键作用(Witherden DA和Havran WL,J LeukocBiol,2013,94(1):69-76)。
发明内容
在一方面,本发明提供了用于活化Lck的肽,其中所述肽包含式I的Lck活化多肽部分或其反向序列:
R/K’-x
其中:
每个R/K均独立地为精氨酸或赖氨酸氨基酸残基;
R/K’为精氨酸或赖氨酸氨基酸残基并且存在或不存在;
R/K”为精氨酸或赖氨酸氨基酸残基并且存在或不存在;
x
其中氨基酸x
在另一个实施方案中,氨基酸x
在另一个实施方案中,所述Lck活化多肽部分的序列选自由RSKAKNPLY、rskaknply、RVKVKVVVV和rvkvkvvvv组成的组。
在另一个实施方案中,用于活化Lck的肽进一步包含与所述Lck活化多肽部分的N-末端或C-末端偶联的式II的化合物;
其中:
n为所述化合物的单体单元的数目并且是1至5的整数;
每个m独立地为0至18的整数;并且
每个R基团独立地为H或C
在另一个实施方案中,每个单体单元的R基团独立地为C
在另一个实施方案中,每个R基团的长度独立地为18-m个碳原子,其中m的值为0至17。
在另一个实施方案中,用于活化Lck的肽进一步包含与所述Lck活化多肽部分的N-末端或C-末端偶联的化合物,其中所述化合物为至少一个脂肪酸。
在另一个实施方案中,至少四个脂肪酸与所述Lck活化多肽部分的C-末端偶联。
在另一个实施方案中,多于一个脂肪酸的偶联是线性的。
在另一个实施方案中,用于活化Lck的肽进一步包含如本文所述的肽,其中多于一个脂肪酸的偶联是支化的。
在另一个实施方案中,所述脂肪酸是饱和的。
在另一个实施方案中,所述脂肪酸选自由羊油酸(caproic acid)、羊脂酸(caprylic acid)、羊蜡酸(capric acid)(癸酸)和月桂酸(十二烷酸)组成的组。
在另一个实施方案中,最远端的脂肪酸被酰胺化。
在另一个实施方案中,所述氨基酸序列在所述Lck活化多肽部分的C-末端被酰胺化。
在另一方面,本发明提供了包含选自由以下组成的组的氨基酸序列的肽:RSKAKNPLYR-(2Adod)
在另一方面,本发明提供了由选自由以下组成的组的氨基酸序列组成的肽:RSKAKNPLYR-(2Adod)
在另一方面,本发明提供了药物组合物,所述药物组合物包含作为活性成分的如本文所述的肽以及药学上可接受的稀释剂或载剂。
在另一方面,本发明提供了增加Lck激酶活性的方法,所述方法包括使Lck激酶与包含如本文所述的肽的组合物或如本文所述的药物组合物接触。
在另一方面,本发明提供了增加Lck激酶的Y394磷酸化的方法,所述方法包括使Lck激酶与包含如本文所述的肽的组合物或如本文所述的药物组合物接触。
在另一方面,本发明提供了增加细胞或细胞群体的IL-2分泌的方法,所述方法包括使细胞或细胞群体与包含如本文所述的肽的组合物或如本文所述的药物组合物接触。
在另一方面,本发明提供了增加细胞上或细胞群体中的IL-2Ra(CD25)表达的方法,所述方法包括使细胞或细胞群体与包含如本文所述的肽的组合物或如本文所述的药物组合物接触。
在另一方面,本发明提供了增加细胞上或细胞群体中的IL-2RB(CD122)表达的方法,所述方法包括使细胞或细胞群体与包含如本文所述的肽的组合物或如本文所述的药物组合物接触。
在另一方面,本发明提供了增加细胞或细胞群体的IL-2反应性的方法,所述方法包括使细胞或细胞群体与包含如本文所述的肽的组合物或如本文所述的药物组合物接触。
在另一方面,本发明提供了增加细胞上或细胞群体中的IL-15R表达的方法,所述方法包括使细胞或细胞群体与包含如本文所述的肽的组合物或如本文所述的药物组合物接触。
在另一方面,本发明提供了增加细胞或细胞群体的IL-15反应性的方法,所述方法包括使细胞或细胞群体与包含如本文所述的肽的组合物或如本文所述的药物组合物接触。
在另一方面,本发明提供了增加细胞上或细胞群体中的CD28表达的方法,所述方法包括使细胞或细胞群体与包含如本文所述的肽的组合物或如本文所述的药物组合物接触。
在另一方面,本发明提供了增加细胞或细胞群体的IL-21分泌的方法,所述方法包括使细胞或细胞群体与包含如本文所述的肽的组合物或如本文所述的药物组合物接触。
在另一方面,本发明提供了增加细胞上或细胞群体中的IL-21R(CD360)IL-2RB表达的方法,所述方法包括使细胞或细胞群体与包含如本文所述的肽的组合物或如本文所述的药物组合物接触。
在另一方面,本发明提供了增加细胞或细胞群体的IL-21反应性的方法,所述方法包括使细胞或细胞群体与包含如本文所述的肽的组合物或如本文所述的药物组合物接触。
在另一方面,本发明提供了增加细胞上或细胞群体中的IL-12R表达的方法,所述方法包括使细胞或细胞群体与包含如本文所述的肽的组合物或如本文所述的药物组合物接触。
在一个实施方案中,IL-12R为IL-12RB1和/或IL-12RB2。
在另一方面,本发明提供了增加细胞或细胞群体的IL-12反应性的方法,所述方法包括使细胞或细胞群体与包含如本文所述的肽的组合物或如本文所述的药物组合物接触。
在另一方面,本发明提供了增加细胞或细胞群体的细胞因子分泌的方法,所述方法包括使细胞或细胞群体与包含如本文所述的肽的组合物或如本文所述的药物组合物接触。
在一个实施方案中,所述细胞因子为IFNg或TNFa。
在另一方面,本发明提供了诱导细胞或细胞群体的增殖的方法,所述方法包括使细胞或细胞群体与包含如本文所述的肽的组合物或如本文所述的药物组合物接触。
在另一方面,本发明提供了增加细胞群体的增殖的方法,所述方法包括使细胞群体与包含如本文所述的肽的组合物或如本文所述的药物组合物接触。
在另一个实施方案中,所述细胞是或所述细胞群体包含选自由以下组成的组的细胞:CD4+ T细胞、CD8+ T细胞、NK细胞或树突细胞。
在另一方面,本发明提供了增加CD8+ T细胞或NK细胞中的CD107a表达的方法,所述方法包括使CD8+ T细胞或NK细胞与包含如本文所述的肽的组合物或如本文所述的药物组合物接触。
在另一方面,本发明提供了增强T细胞功能的方法,所述方法包括使T细胞或T细胞群体与包含如本文所述的肽的组合物或如本文所述的药物组合物接触。
在一个实施方案中,所述细胞是或所述细胞群体包含原初细胞。
在另一方面,本发明提供了增强细胞毒性细胞功能的方法,所述方法包括使细胞毒性细胞或细胞毒性细胞群体与包含如本文所述的肽的组合物或如本文所述的药物组合物接触。
在另一方面,本发明提供了减少T细胞或T细胞群体的耗竭的方法,所述方法包括使T细胞或T细胞群体与包含如本文所述的肽的组合物或如本文所述的药物组合物接触。
在另一方面,本发明提供了增加T细胞上的CD40L表达的方法,所述方法包括使T细胞与包含如本文所述的肽的组合物或如本文所述的药物组合物接触。
在另一方面,本发明提供了增加CD8+ T细胞反应的方法,所述方法包括使CD4+ T细胞与包含如本文所述的肽的组合物或如本文所述的药物组合物接触。
在另一方面,本发明提供了降低细胞群体中Treg细胞的比例的方法,所述方法包括使含Treg的细胞群体与包含如本文所述的肽的组合物或如本文所述的药物组合物接触。
在一个实施方案中,所述Treg细胞为Foxp3+ Treg细胞。
在另一方面,本发明提供了在检查点抑制剂存在的情况下增加IL-2分泌的方法,所述方法包括使细胞或细胞群体与包含如本文所述的肽的组合物或如本文所述的药物组合物接触。
在另一方面,本发明提供了增加树突细胞存活能力的方法,所述方法包括使树突细胞与如本文所述的肽或如本文所述的药物组合物接触。
在一个实施方案中,所述接触是在体内或体外执行的。
在一个实施方案中,所述方法是离体执行的。
在另一方面,本发明提供了细胞或细胞群体,所述细胞或细胞群体源自如本文所述的方法。
在另一方面,本发明提供了细胞或细胞群体,所述细胞或细胞群体源自通过使细胞或细胞群体与包含如本文所述的肽的组合物或如本文所述的药物组合物接触而获得的细胞或细胞群体。
在另一方面,本发明提供了如本文所述的方法,其中将所述肽或药物组合物施用于受试者或细胞以增加体内Lck的活性。
在另一方面,本发明提供了增加受试者中的Lck活性的方法,所述方法包括向所述受试者施用包含如本文所述的肽的组合物或如本文所述的药物组合物。
在另一方面,本发明提供了诱导受试者中的免疫反应的方法,所述方法包括向所述受试者施用如本文所述的肽或如本文所述的药物组合物。
在另一方面,本发明提供了治疗和/或预防与以受试者中的Lck或Lck活性的抑制或下调为特征的疾病或病状相关的至少一种症状的方法,所述方法包括向所述受试者施用包含如本文所述的肽的组合物或如本文所述的药物组合物。
在另一方面,本发明提供了如本文所述的方法,其中以Lck或Lck活性的抑制或下调为特征的疾病或病症选自由以下组成的组:病原性感染、病原性感染引起的败血症(例如,慢性败血症)、免疫缺陷病症、免疫反应降低、T细胞计数降低、T细胞异常、T细胞耗竭和T细胞检查点阻断。
在另一方面,本发明提供了如本文所述的方法,其中所述疾病或病状为癌症。
在另一方面,本发明提供了对有需要的受试者进行疫苗接种的方法,所述方法包括将包含如本文所述的肽的组合物或如本文所述的药物组合物与疫苗同时或依序地施用给受试者。
在另一方面,本发明提供了治疗和/或预防有需要的受试者的癌症的方法,所述方法包括将包含如本文所述的肽的组合物或如本文所述的药物组合物与检查点抑制剂同时或依序地施用给受试者。
在另一方面,本发明提供了降低受试者中的免疫抑制的方法,所述方法包括向所述受试者施用包含如本文所述的肽的组合物或如本文所述的药物组合物。
在另一方面,本发明提供了治疗和/或预防受试者的年龄相关性免疫功能障碍的方法,所述方法包括向所述受试者施用包含如本文所述的肽的组合物或如本文所述的药物组合物。
在另一方面,本发明提供了诱导受试者中的Th1反应的方法,所述方法包括向所述受试者施用如本文所述的肽或如本文所述的药物组合物。
在另一方面,本发明提供了治疗受试者中的HIV感染的方法,所述方法包括向所述受试者施用包含如本文所述的肽的组合物或如本文所述的药物组合物。
在另一方面,本发明提供了治疗受试者中的结核分支杆菌(Mycobacteriumtuberculosis)感染的方法,所述方法包括向所述受试者施用包含如本文所述的肽的组合物或如本文所述的药物组合物。
在另一方面,本发明提供了用于治疗和/或预防与以Lck或Lck活性的抑制或下调为特征的疾病或病状相关的至少一种症状的剂量单位形式,所述剂量单位形式包含如本文所述的肽。
在另一方面,本发明提供了用于治疗和/或预防癌症的剂量单位形式,所述剂量单位形式包含如本文所述的肽。
在整个说明书中,词语“包含(comprise)”或诸如“包括(comprises)”或“含有(comprising)”的变型将被理解为暗示包括所陈述的要素、整数或步骤,或要素、整数或步骤的组,但不排除任何其它要素、整数或步骤,或要素、整数或步骤的组。
本说明书中所包括的对文件、法案、材料、装置、物品等的任何讨论仅是为了提供本发明的上下文。不得视为承认因为它在本申请的优先权日之前在澳大利亚或其他地方已经存在,任何或所有这些事项均构成现有技术基础的一部分或者是与本发明相关的领域中的公知常识。
通过以下对本发明示例性实施方案的详细描述以及附图,本发明的特征和优点将变得更加明显。
附图说明
图1显示当使Lck与多肽RSKAKNPLYR-(2Adod)
图2显示多肽RSKAKNPLY(“IK94000”)和RSKAKNPLYR-(2Adod)
图3显示在用PMA(10ng/ml)加上离子霉素(1μg/ml)刺激96小时的Jurkat T细胞中,当细胞暴露于与“4C10”聚酰胺部分(RSKAKNPLYR-(2Adod)
图4显示在CD4+和CD8+ T细胞中,CD360(IL-21R)的表达响应于用RSKAKNPLYR-(2Adod)
图5显示分离的CD3
图6显示在与/未与rIL-2一起培养的分离的NK细胞中,CD360(IL-21R)的表达响应于用RSKAKNPLYR-(2Adod)
图7显示在受刺激T细胞测定中,IL-21产生响应于用RSKAKNPLYR-(2Adod)
图8显示用RSKAKNPLYR-(2Adod)
图9显示用RSKAKNPLYR-(2Adod)
图10显示用RSKAKNPLYR-(2Adod)
图11显示用RSKAKNPLYR-(2Adod)
图12显示在未受刺激的PBMC测定中,用RSKAKNPLYR-(2Adod)
图13显示在受刺激T细胞测定中,用RSKAKNPLYR-(2Adod)
图14显示用RSKAKNPLYR-(2Adod)
图15显示由用RSKAKNPLYR-(2Adod)
图16显示rPD-L1对IL-2分泌的抑制可以用RSKAKNPLYR-(2Adod)
图17显示在耗竭CD4+ T细胞测定中,RSKAKNPLYR-(2Adod)
图18显示在耗竭CD4+ T细胞测定中,RSKAKNPLYR-(2Adod)
图19显示RSKAKNPLYR-(2Adod)
图20显示CD4+(图A)和CD8+ T细胞(图B)中的CD28响应于用RSKAKNPLYR-(2Adod)
图21显示与外周血NK细胞中的人重组IL-2相比,NK细胞活化受体NKp44和NKG2D的表达响应于用RSKAKNPLYR-(2Adod)
图22显示RSKAKNPLYR-(2Adod)
图23显示在Lewis肺癌(LCC)转移模型中,RSKAKNPLYR-(2Adod)
图24显示在Lewis肺癌(LLC)异种移植模型中,RSKAKNPLYR-(2Adod)
图25显示在TCR刺激后从用RSKAKNPLYR-(2Adod)
图26显示在对从用RSKAKNPLYR-(2Adod)
图27显示在用RSKAKNPLYR-(2Adod)
图28显示CD25(IL-2Rα)、CD215(IL-15R)、CD28和Ki67在来自于用RSKAKNPLYR-(2Adod)
图29显示在经由IP途径用RSKAKNPLYR-(2Adod)
图30显示将RSKAKNPLYR-(2Adod)
图31显示在受刺激PBMC测定中,RSKAKNPLYR-(2Adod)
图32显示在受刺激PBMC测定中,RSKAKNPLYR-(2Adod)
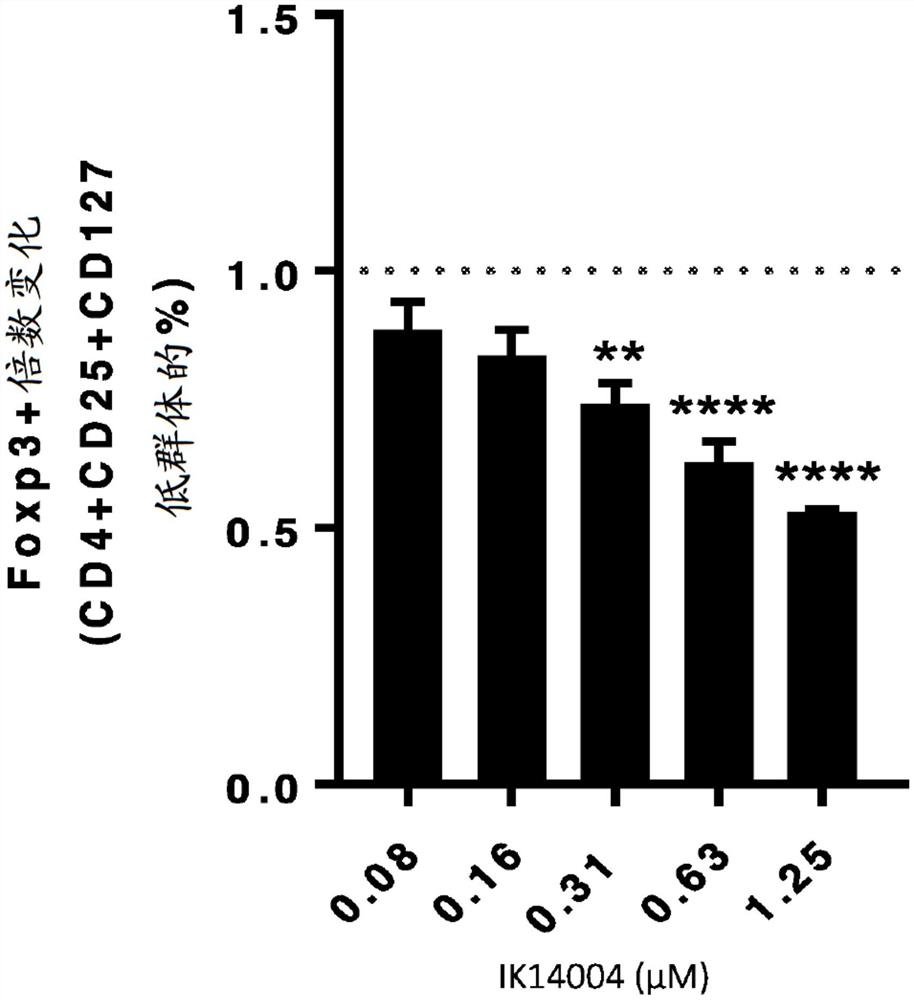
图33显示RSKAKNPLYR-(2Adod)4-NH2(“IK14004”)和rskaknplyr-(2Adod)4-NH2(“IKD14004”)增加CD8+ T细胞和NK细胞中脱粒标志物CD107a的表达。A和C:将PBMC用或不用肽(0.081.25μM)预处理48小时,然后与经钙黄绿素AM染色的K562细胞一起以5:1的比率共培养并且再孵育4小时。在培养结束时收集PBMC,并通过流式细胞术评估NK细胞和CD8+ T细胞中的CD107a表达(阳性%)。所示数据表示平均阳性表达百分比+/-SEM,n=4。通过重复测量双因素方差分析和Holm-Sidak事后检验分析数据,将肽处理与媒介物对照进行比较,*p<0.05,**p<0.01,***P<0.001,****p<0.0001。虚线表示同种型染色对照。B:将PBMC孵育48小时,然后与用或未用人重组IFN-α2A(5ng/mL)刺激的经钙黄绿素AM染色的K562细胞一起共培养4小时。在培养结束时收集PBMC,并通过流式细胞术评估NK细胞和CD8+ T细胞中的CD107a表达(阳性%)。所示数据表示阳性表达百分比+/-SEM,n=4。与媒介物对照相比,通过配对t检验分析数据,**p<0.01。
图34显示用RSKAKNPLYR-(2Adod)4-NH2(“IK14004”)预处理未活化的Jurkat细胞会增加在随后活化后的IL-2的产生,并且该IL-2诱导依赖于Lck。在两个独立的实验中,分别将500万个未受刺激的JCam1.6(Lck缺陷型)和500万个6.1(野生型)Jurkat细胞接种在T25烧瓶中。用RSKAKNPLYR-(2Adod)4-NH2以5μM、10μM和20μM的浓度处理细胞1小时,之后离心细胞悬液并用新鲜培养基洗涤两次。对于每个实验,将生物素-抗CD3和抗生物素蛋白(5:1.25ug)在500uL培养基中的混合物添加到12孔板的孔中。10分钟后,按每孔100万个细胞接种未受刺激的、经洗涤的细胞并且用培养基使细胞悬液达到2mL的体积。然后进一步用抗CD28(5ug/mL)刺激样品,之后在37℃下孵育样品48小时。然后分析上清液(100μL,n=3)的IL-2含量。
图35显示在扩增10天后,RSKAKNPLYR-(2Adod)4-NH2(“IK14004”)增加了PBMC内的CD8+细胞群体。将来自健康供体的PBMC或分离的CD8+ T细胞在RSKAKNPLYR-(2Adod)4-NH2(0.08-1.25μM)或媒介物对照的存在下经由TCR+IL-2刺激10天。在培养期结束时,收集细胞并通过流式细胞术针对CD8+细胞比例进行评估。数据显示为平均百分比表达+/-SEM,n=4。使用重复测量双因素方差分析和Holm-Sidak多重比较事后检验分析数据,将试验物质与媒介物对照进行比较,**p<0.01,***p<0.001,****p<0.0001。虚线表示未受刺激的样品中的平均表达。
图36显示RSKAKNPLYR-(2Adod)
图37显示在受刺激T细胞测定中,RSKAKNPLYR-(2Adod)
图38显示RSKAKNPLYR-(2Adod)
图39显示RSKAKNPLYR-(2Adod)
图40显示RSKAKNPLYR-(2Adod)
图41显示了肽RSKAKNPLYR-(2Adod)
图42A显示多肽RSKAKNPLYR(“IK14000”)和RSKAKNPLY(“IK94000”)增加人T淋巴细胞(Jurkat)细胞系中的IL-2分泌。图42B显示rskaknply(“IKD94000”,而RSKAKNPLYR(“IK14000”未能)增加人T淋巴细胞(Jurkat)细胞系中的IL-12分泌。
具体实施方式
在哺乳动物中非受体Src激酶家族(SKF)的成员包括以下八种激酶:Src、Fyn、Yes、Fgr、Lyn、Hck、Lck和Blk,而尚未鉴定出选择性Lck活化剂(Bae O-N等人,Journal ofNeuroscience,2012,32(21):7278-7286)。
在一个或多个实施方案中,本发明涉及如本文所述的式I的肽可刺激Lck的活性的发现。在至少一些实施方案中,根据本发明的Lck活化剂仅可以刺激SKF成员中Lck的活化。对Lck活化剂,尤其是特定的Lck活化剂的需求与宽范围的可能与年龄相关或与年龄无关的病状有关。
因此,在一个实施方案中,本发明提供了用于活化Lck的肽,其中所述肽包含式I的Lck活化多肽部分或其反向序列:
R/K’-x
其中:
每个R/K均独立地为精氨酸或赖氨酸氨基酸残基;
R/K'为精氨酸或赖氨酸氨基酸残基并且存在或不存在;
R/K”为精氨酸或赖氨酸氨基酸残基并且存在或不存在;
x
其中氨基酸x
如本文所用,术语“活化”一般是指增加至少一种靶蛋白的活性。在激酶的特定背景下,这种活化导致至少一种靶底物或位点的磷酸化增加。这种活化可以通过任何方式引起,所述方式包括(但不限于)增加蛋白激酶与蛋白激酶结合伴侣之间形成复合物的可能性,或增加一旦结合至其靶标时的激酶活性。此类活化可以在体内或体外发生。
如本文所用,“用于活化Lck的肽”与“Lck活化多肽”或“Lck活化剂”可互换使用。
Lck也称为:LCK原癌基因、白细胞C-末端Src激酶;淋巴细胞特异性蛋白酪氨酸激酶;蛋白质YT16;原癌基因Lck;T细胞特异性蛋白酪氨酸激酶;和p56-LCK。
人类中Lck的基因和蛋白质序列可从HUGO基因命名委员会(HGNC)(http://www.genenames.org/)获得。下表1列出了人类中Src(和剪接变体)的HGNC参考编号,以及GenBank登录号和基因标识符。
Lck具有许多活性。Lck在其正调节位点Tyr 394处自体磷酸化,并且使包括CD3受体、CEACAM1、ZAP-70、SLP-76、IL-2受体、蛋白激酶C、ITK、PLC、SHC、RasGAP、Cbl、Vav1和PI3K在内的许多蛋白质磷酸化。已证实Lck与ADAM15、CD2、CD44、CD4、COUP-TFII、DLG1、NOTCH1、PIK3CA、PTPN6、PTPRC、UNC119、SYK、UBE3A和ZAP70相互作用。
本发明人已经证明本文所述的活化剂可以增加Lck的活性,所述Lck的活性包括Lck在Y394处的磷酸化,以及增加的IL-2的产生。
因此,如本文所用,术语“Lck的活性”包括Lck在Y394处的磷酸化,IL-2的产生,CD3受体、CEACAM1、ZAP-70、SLP-76、IL-2受体、蛋白激酶C、ITK、PLC、SHC、RasGAP、Cbl、Vav1和/或PI3K的磷酸化;与ADAM15、CD2、CD44、CD4、COUP-TFII、DLG1、NOTCH1、PIK3CA、PTPN6、PTPRC、UNC119、SYK、UBE3A、ZAP70的相互作用,和/或TCR的磷酸化。
由本发明实施的Lck活化剂可以由单独的式I的肽(P)组成,或者在其它实施方案中,可以包含偶联至用于与所述肽组合刺激Lck活性的此外部分的肽。所述此外部分可以例如增强式I的肽的Lck刺激活性。在其他实施方案中,单独的所述肽可能不能刺激Lck活性,并且只有当所述肽与所述此外部分偶联时Lck活性才会受到刺激。通常,所述此外部分是至少一个脂肪酸。
在至少一些实施方案中,肽(P)包含如下的氨基酸序列或其反向序列:
R/K’-x
其中:
每个R/K均独立地为精氨酸或赖氨酸氨基酸残基;
R/K’为精氨酸或赖氨酸氨基酸残基并且存在或不存在;
R/K”为精氨酸或赖氨酸氨基酸残基并且存在或不存在;
x
其中氨基酸x
通常,在式I的肽(P)中:
x
x
在至少一些实施方案中,x
在其它实施方案中,x
在其它实施方案中,x
在另一些其它实施方案中,氨基酸x
如本文所述的Lck活化剂的聚阳离子肽的亲水性和疏水性氨基酸可以由遗传密码编码并且/或者包含合成氨基酸。通常,该氨基酸由遗传密码编码。聚阳离子肽的亲水性氨基酸可独立地选自极性氨基酸、碱性氨基酸和酸性氨基酸。
极性氨基酸可以例如选自由以下组成的组:丝氨酸(S)、苏氨酸(T)、酪氨酸(Y)、天冬酰胺(N)和谷氨酰胺(Q)氨基酸残基。
碱性氨基酸可以例如选自由以下组成的组:赖氨酸(K)、精氨酸(R)、组氨酸(H)和鸟氨酸。
酸性氨基酸可以例如选自由以下组成的组:谷氨酸(E)和天冬氨酸(D)。
非极性疏水性氨基酸可以例如选自由以下组成的组:丙氨酸(A)、缬氨酸(V)、亮氨酸(L)、异亮氨酸(I)、脯氨酸(P)、半胱氨酸(C)、蛋氨酸(M)、苯丙氨酸(F)、色氨酸(W)和甘氨酸(G)。通常,一种或多种疏水性氨基酸将选自丙氨酸(A)、缬氨酸(V)和苯丙氨酸(F)。
通常,在式I的肽(P)中,存在R/K’和R/K”中的至少一者。
最通常地,存在式I的氨基酸残基R/K'。
在至少一些实施方案中,式I的肽(P)包含选自由以下组成的组的氨基酸序列:
(a)R-x
(b)R-x
(c)K-x
通常,在式Ia的肽(P)中:
x
x
在式Ia的肽(P)的至少一些实施方案中:
x
x
通常,在式Ia的实施方案中:
x
x
x
x
x
x
最通常地,在式Ia的实施方案中,x
通常,在式Ib的肽(P)中:
x
x
在式Ib的肽(P)的至少一些实施方案中:
x
x
通常,在式Ib的实施方案中:
x
x
x
x
x
x
最通常地,在式Ib的实施方案中,x
可替代地,在式Ib的肽(P)的至少一些实施方案中:
x
x
通常,在式Ib的此类实施方案中:
x
x
x
x
x
x
最通常地,在式Ib的此类实施方案中,x
在式Ic的肽(P)的至少一些实施方案中:
x
x
通常,在式Ic的实施方案中:
x
x
x
x
x
x
在进一步的实施方案中,在式I的肽(P)中可包含以下:
x
x
x
x
x
x
在至少一些实施方案中,式I的肽(P)包含氨基酸序列R/K’-S-R/K-A-R/K-N-P-L-Y-R/K”(例如,R/K-SKAKNPLY-R/K”)或其反向序列。
在其它实施方案中,肽(P)包含以下或由以下组成:R/K’-x
在进一步的实施方案中,式R/K’-x
通常,式I的肽的氨基酸R/K”不存在。此类肽的实例包括RSKAKNPLY。
在至少一些实施方案中,氨基酸x
在至少一些实施方案中,氨基酸x
通常,R/K’存在。最通常地,R/K’为精氨酸。
通常,每个R/K均为相应的赖氨酸氨基酸。
在至少一些实施方案中,氨基酸x
在特别优选的实施方案中,氨基酸x
在再一个实施方案中,如本文所述的Lck活化剂的式I的肽包含如下所示的肽或其反向序列:
R/K'-x
其中:
R/K’为精氨酸或赖氨酸氨基酸残基;
每个R/K均独立地为精氨酸或赖氨酸氨基酸残基;并且
x
在至少一些实施方案中,式I或式I’的肽包含R-x
在特别优选的实施方案中,式I或Ia的肽的氨基酸x
因此,从上所述,肽(P)可包含式I或式I’的肽或者由式I或式I’的肽组成。因此,将理解的是,包含式I或式I'的肽的肽还可包含与式I或式I'的肽邻接的一个或多个另外的氨基酸。例如,该肽可包含分别与该肽的一个或两个末端(例如,N-末端和/或C-末端)偶联的一个或多个独立选择的氨基酸。
根据本发明的式I的肽(P)通常具有至多约40个氨基酸的长度。在至少一些实施方案中,肽(P)的长度可为至少5个氨基酸(例如,5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39或40个氨基酸)。在至少一些实施方案中,所述肽将具有约25个氨基酸或更少氨基酸,或更通常约20、15、14、13、12、11或10个氨基酸或更少氨基酸的长度。如还应理解的,本文还明确提供了从5至例如40个或更多氨基酸的所有长度范围。在特别优选的实施方案中,肽(P)将具有至少9个氨基酸的长度。
如本文所用,术语“反向序列”意指倒转的氨基酸序列。例如,RSKAKNPLY的反向序列为YLPNKAKSR。因此,反向序列的氨基酸序列处于逆序,由此例如原始序列的N-末端成为反向序列的C-末端,而原始序列的C-末端成为反向序列的N-末端。通常,将根据本发明的实施方案使用的肽至少在其羧基末端酰胺化或进行类似处理,以防御蛋白水解降解。然而,也可以采用任何合适的用于防御蛋白水解降解的N-末端或C-末端修饰(例如,甲基化)。
如本说明书中使用的术语“氨基酸序列”是指由通常通过酰胺键连接的氨基酸单体组成的分子。该术语包括在本公开的方法和使用中保留功能活性的该序列的“前药”,该序列的带电和非带电形式,该序列的药学上可接受的盐,以及该序列的任何其它变化形式、衍生物或对该序列的修饰(包括对该序列的主链和/末端的修饰)。
如本文所用,术语“序列”不应解释为隐含地指定可以形成分子的氨基酸数目的最大长度。在一些实施方案中,最大长度为10个氨基酸。在一些实施方案中,最大长度为9个氨基酸。
在一些实施方案中,所述序列是分离的或纯化的序列。
通过天然或重组技术产生的序列的“分离”和“纯化”方法在本领域,例如在C-HLee,A Simple Outline of Methods for Protein Isolation and Purification,Endocrinology and Metabolism;2017年3月;32(1):18中是已知的。进一步地,术语“分离的”或“纯化的”包括合成的和其它人工产生的序列。合成序列的方法是本领域已知的。一般来说,通过一个氨基酸的羧基与另一个氨基酸的氨基的缩合反应来化学地合成序列。序列的化学合成可以使用液相技术或固相技术进行。合成技术可允许掺有非天然氨基酸序列的序列的产生、主链修饰和D-异构体的合成。
在一些实施方案中,本发明的序列是经修饰的。在一些实施方案中,所述修饰是改变该序列的药理学性质的修饰。在一些实施方案中,所述修饰增加本发明的组合物或序列的半衰期。在一些实施方案中,所述修饰可以增加该序列(和/或本发明的组合物)的生物活性。在一些实施方案中,所述修饰可以是增加本发明的序列或组合物的选择性的修饰。
在一个实施方案中,所述修饰是添加保护基。该保护基可以是N-末端保护基、C-末端保护基或侧链保护基。本发明的序列可以具有这些保护基中的一种或多种。本领域的技术人员知道使氨基酸与这些保护基反应的合适技术。这些基团可以通过本领域已知的制备方法添加。所述基团可以保留在序列上,或者可以在使用或施用之前去除。保护基可以在合成期间添加。
本发明人已经证明,使Lck活化肽酰胺化令人惊讶地增加了Lck活性的水平。因此,在一个实施方案中,本发明提供了如本文所述的肽,其中最远端的脂肪酸被酰胺化。
如本文在多肽序列的上下文中所用,“NH
在一些实施方案中,所述序列在其C-端被酰胺化。酰胺化是指通过依序的内切蛋白酶解和外切蛋白酶解对甘氨酸延伸底物进行N-氧化裂解的过程。本领域已知用于在体外产生酰胺化序列的方法,例如:酶促酰胺化;对重组产生的序列和蛋白质的C-末端进行化学修饰;在固相序列合成中使用酰胺树脂;在氨存在下使用羧肽酶;以及使序列的C-端转化为甲酯并在低温下添加氨。合适技术的公开的实例包括DJ Merkler,C-terminal amidatedsequences:production by the in vitro enzymatic amidation of glycine-extendedsequences and the importance of the amide to bioactivity;Enzyme Microbialtechnology,1994年6月;16(6):450-6以及V Cerovsky和M-R Kula C-Terminal sequencesAmidation Catalyzed by Orange Flavedo sequences Amidase;Angewandte Chemie,1998年8月;37(13-14):1885。
C-末端的酰胺化导致C-末端不带电荷,因此经修饰的序列更严密地模拟天然蛋白质。这可能具有一系列优势,其包括序列进入细胞的能力增强;该序列在体内的代谢稳定性得到改善;由氨基肽酶、外肽酶和合成酶所导致的该序列的体内酶促降解减少;以及该序列的储存期限得到改善。
如本文所述,本发明人已经确定本文所述的Lck活化多肽可包含L氨基酸或D氨基酸并且具有生物活性。因此,在一个实施方案中,本发明描述了如本文所述的Lck活化剂,其中氨基酸序列包含L-精氨酸残基。在另一个实施方案中,本发明描述了如本文所述的Lck活化剂,其中氨基酸序列包含D-精氨酸残基。
如本领域中已知的,α氨基酸在α位置处包括手性碳。因此,除甘氨酸之外的所有α氨基酸可以以两种对映异构体中的任一种,即L-异构体或D-异构体存在。一般来说,在哺乳动物细胞中只有L-氨基酸被制造出来并且被掺入到蛋白质中。D-氨基酸可以人工合成或者可以在细菌蛋白质中被发现。L和D约定不是用来直接指氨基酸的立体化学,而是针对氨基酸构型使用的,并不是指氨基酸本身的旋光性,而是指可以用来合成氨基酸的甘油醛异构体的旋光性(D-甘油醛是右旋性的;L-甘油醛是左旋性的)。
如下文进一步所描述的,所述肽的氨基酸可以是L-氨基酸和/或D-氨基酸。因此,反向序列的氨基酸可以全部是L-氨基酸或者全部是D-氨基酸,并且术语“反向序列”延伸至逆反肽(retro-inverso peptides),其中所有氨基酸都是D-氨基酸,但是不限于此。
本文提到的序列用序列标识符编码(SEQ ID NO:)表示。表2中提供了序列标识符的汇总。
在至少一些实施方案中,如本文所述的Lck活化剂的肽(P)可包含选自由以下组成的组的肽活性物或者由选自由以下组成的组的肽活性物组成:RSKAKNPLY、RSKAKNPLYR、RSRARNPLY、RARAKNPLY、KEKLKNPLF、KEKLKNPLFK、RVKVKVVVV、RAKAKAAAA、RAKAKNPLF、RSKAK、RAKAK和RVKVK。
在其他实施方案中,肽(P)可以选自由以下组成的组:反向序列YLPNKAKSR、RYLPNKAKSR、YLPNRARSR、YLPNKARAR、FLPNKLKEK、KFLPNKLKEK、VVVVKVKVR、AAAAKAKAR、FLPNKAKAR、KAKSR、KAKAR和KVKVR。
最通常地,肽包含RSKAKNPLY、YLPNKAKSR、RSKAK或KAKSR或由其组成。
本发明人已经证明,如本文所述,至少一个脂肪酸与肽的偶联可以令人惊奇地赋予该肽增加的活化Lck的能力。
因此,在一些实施方案中,用于活化Lck的肽包含一个或多个连接的脂肪酸部分。在一些实施方案中,Lck活化剂包含四个连接的脂肪酸部分。这个结果令人惊讶,因为就其本身而言,包含1-4个连接的脂肪酸的脂肪酸部分不会活化Lck。在一些实施方案中,连接的脂肪酸部分包括至少一个氨基-十二烷酸部分。在一些实施方案中,所有脂肪酸部分都是氨基-十二烷酸。
在一个优选的实施方案中,本发明提供了包含选自由以下组成的组的氨基酸序列的肽:RSKAKNPLYR-(2Adod)
在另一个优选的实施方案中,本发明提供了由选自由以下组成的组的氨基酸序列组成的肽:RSKAKNPLYR-(2Adod)
可与如本文所述的式I的肽偶联的化合物的实例包括脂质、线性或支化脂肪酸(例如,具有8至18个碳原子的脂肪酸链长,诸如硬脂酸)和聚酰胺。
在另一个优选的实施方案中,多于一个脂肪酸偶联在式I的多肽部分的C-末端处。例如,2、3、4、5、6、7、8、9或10个或更多个脂肪酸与式I的多肽部分偶联。
所述至少一个脂肪酸可以通过如下方式提供:通过在一个脂肪酸链的氨基取代基与下一个脂肪酸的末端羧基之间连续地形成相应的酰胺键来将脂肪酸偶联在一起,从而提供偶联的脂肪酸。
因此,在脂肪酸的α碳或β碳上具有氨基(NH
在一个优选的实施方案中,本发明提供了如本文所述的用于活化Lck的肽,其中至少四个脂肪酸与该活化剂的C-末端偶联。
在另一个优选的实施方案中,本发明提供了如本文所述的用于活化Lck的肽,其中最远端的脂肪酸被酰胺化。
脂肪酸的偶联可以是线性和/或支化的。在一个实施方案中,本发明提供了如本文所述的用于活化Lck的肽,其中所述至少四个脂肪酸的偶联是线性的。在另一个实施方案中,本发明提供了如本文所述的用于活化Lck的肽,其中所述至少四个脂肪酸的偶联是支化的。
如上所讨论的,一个或多个脂肪酸部分可以在任何位置处与用于活化Lck的肽偶联以形成脂肽。然而,在优选的实施方案中,一个或多个脂肪酸部分在用于活化Lck的肽的C-末端处偶联。与氨基酸序列偶联的一个或多个脂肪酸部分可以是支化脂肪酸或线性脂肪酸。
在一些实施方案中,至少一个、两个、三个或四个脂肪酸部分是线性的。例如,当所述至少一个脂肪酸的偶联是线性偶联时,在一个实施方案中,至少一个脂肪酸经由酰胺键与用于活化Lck的肽的C-末端偶联。
如本文所用,术语“线性”是指脂肪酸的烃链掺入到用于活化Lck的肽的主链中。例如,该脂肪酸可以在ω碳上包含氨基取代基。在一个实施方案中,使用了12-氨基月桂酸脂肪酸酰胺(例如12-氨基十二烷酸;‘Adod’),因此可以在碳12处的氨基取代基与另一个基团(例如羧基)之间形成酰胺键。
因此,在另一个实施方案中,当所述至少一个脂肪酸的偶联是线性偶联时,使第一脂肪酸经由酰胺键与用于活化Lck的肽的C-末端偶联,并且通过在所述脂肪酸的末端羧基与进一步的脂肪酸(例如氨基十二烷酸)的氨基取代基之间形成酰胺键来使进一步的脂肪酸与所述脂肪酸偶联。在另一个实施方案中,通过在所述进一步的脂肪酸的末端羧基与第三脂肪酸的氨基取代基之间形成酰胺键来使所述第三脂肪酸与所述进一步酸偶联。在另一个实施方案中,通过在所述第三脂肪酸的末端羧基与第四脂肪酸的氨基取代基之间形成酰胺键来使所述第四脂肪酸与所述第三酸偶联。
通过在一个脂肪酸的末端羧基与待偶联至用于活化Lck的肽的另一个脂肪酸的氨基取代基之间形成酰胺键来由脂肪酸单体形成线性多聚脂肪酸链,如此可以使许多脂肪酸与用于活化Lck的肽的C-末端偶联。
在其它实施方案中,脂肪酸的烃链不是“线性的”,例如,脂肪酸的整个或部分烃链不是用于活化Lck的肽的主链的一部分(例如与用于活化Lck的肽的主链‘垂直’)。例如,该脂肪酸可以在该脂肪酸的α碳或β碳上包含氨基取代基。例如,在一个实施方案中,使用了2-氨基月桂酸脂肪酸酰胺(例如2-氨基十二烷酸;‘Adod’),因此可以在碳2处的氨基取代基与另一个基团(例如羧基)之间形成酰胺键。
为了便于描述,聚酰胺部分用“nCy”表示,其中n是聚酰胺部分的重复单元的数目,Cy是每个重复单元中R基团的碳原子数目,并且每个R基团是饱和的线性碳链。因此,在本实例中,“4C10”是指如方案1所示的具有4个重复单元(n=4)的聚酰胺部分,其中每个重复单元的R基团是饱和的碳侧链,其长度为10个碳原子(例如,四个2-氨基十二烷酸)。
如本文所用,术语Adod是指氨基十二烷酸,并且“2Adod”是指2-氨基十二烷酸;“12Adod”是指12-氨基十二烷酸等。在多于一个脂肪酸偶联的情况下,偶联的脂肪酸数目用下标表示。例如,“(2Adod)
在其它实施方案中,所述脂肪酸可以在所述脂肪酸的另一个碳上包含氨基取代基。
在其它实施方案中,其中氨基脂肪酸是手性的,具有一个手性中心,将存在两种可能的对映异构体(例如R和S)。因此,在一个实施方案中,本发明的用于活化Lck的肽可以包含氨基脂肪酸的一种对映异构体或另一种对映异构体,或者一种或多种氨基脂肪酸的一种或多种对映异构体。
因此,本发明提供了用于活化Lck的肽,该肽包含以线性和/或非线性方式(例如以支化方式)偶联的脂肪酸。
如本文所用,术语“支化的”包括多于一个脂肪酸与氨基酸残基或与第一脂肪酸偶联,以便不与用于活化Lck的肽的主链呈“线性的”或者与用于活化Lck的肽的主链“垂直”。
在一个实施方案中,所述至少一个脂肪酸是含有13-21个碳原子的长链脂肪酸、含有6至12个碳原子的中链脂肪酸或具有少于6个碳原子的短链脂肪酸。在优选的实施方案中,所述脂肪酸包含约6至16个碳原子的长度。例如,所述脂肪酸包含6至16个碳、8至14个碳或10至12个碳。
在一个实施方案中,所述脂肪酸包含6个碳,并且是羊油酸或己酸。例如,在一个实施方案中,所述脂肪酸是氨基己酸。
在另一个实施方案中,所述脂肪酸包含8个碳,并且是羊脂酸或辛酸。例如,在一个实施方案中,所述脂肪酸是氨基辛酸。
在另一个实施方案中,所述脂肪酸包含10个碳,并且是羊蜡酸或癸酸。例如,在一个实施方案中,所述脂肪酸是氨基癸酸。
在另一个实施方案中,所述脂肪酸包含12个碳,并且是月桂酸或十二烷酸。例如,在一个实施方案中,所述脂肪酸是氨基十二烷酸(例如(S)-2-氨基十二烷酸)。所述脂肪酸可以是饱和的,或者是不饱和的并具有一个或多个双键。优选地,所述脂肪酸是饱和的。
在一个实施方案中,本发明提供了用于活化Lck的肽,其中该肽进一步包含与Lck活化多肽的N-末端或C-末端偶联的化合物,其中该化合物为至少一个脂肪酸。
在一个实施方案中,本发明提供了如本文所述的用于活化Lck的肽,其中至少四个脂肪酸与Lck活化多肽部分的C-末端偶联。
在一个实施方案中,本发明提供了如本文所述的用于活化Lck的肽,其中多于一个脂肪酸的偶联是线性的。
在一个实施方案中,本发明提供了如本文所述的用于活化Lck的肽,其中多于一个脂肪酸的偶联是支化的。
在一个实施方案中,本发明提供了如本文所述的用于活化Lck的肽,其中脂肪酸是饱和的。
在一个实施方案中,本发明提供了如本文所述的用于活化Lck的肽,其中所述脂肪酸选自由羊油酸、羊脂酸、羊蜡酸(癸酸)和月桂酸(十二烷酸)组成的组。
在一个实施方案中,本发明提供了如本文所述的用于活化Lck的肽,其中最远端的脂肪酸被酰胺化。
在一个实施方案中,本发明提供了如本文所述的用于活化Lck的肽,其中氨基酸序列在Lck活化多肽部分的C-末端被酰胺化。
在特别优选的实施方案中,所述化合物可以包含长度长达20个原子或更多原子的饱和或不饱和的脂族、脂肪酸、聚酰胺或其它主链,其可以具有一条或多条侧链。通常,该主链将具有在约6至20个原子的范围内(即,6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个原子)的长度,并且可以包括一个或多个杂原子(例如,独立地选自N、O、S和P)。当支化时,该主链一般将具有1至5条侧链(例如,1、2、3、4或5条侧链),每条侧链的长度独立地长达18个原子(即,长度为1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17或18个原子)。通常,每条侧链独立地为饱和或不饱和的脂族碳链(例如,C
在至少一些实施方案中,所述化合物是具有3至5个重复单元的聚酰胺,每个重复单元独立地具有3至9个原子的长度(即,具有3、4、5、6、7、8或9个原子的长度)并且不具有侧链或者只具有单一侧链。通常,每个重复单元具有3至6个原子的长度,更通常3至6、3至5,或3至4个原子的长度,且最通常3个原子的长度。每个重复单元的侧链的长度通常独立地为4至18个碳原子的长度(即C
通常,根据本发明的实施方案的待偶联的化合物包含如下所示的式II的化合物:
其中:
n为所述化合物的单体单元的数目并且是1至5的整数;
每个m独立地为0至18的整数;并且
每个R基团独立地为H或C
通常,单体单元的R侧链的长度基本上与该单体单元的m的值成反比。一般来说,每个R的长度将为18-m个碳原子,其中m的值为0至17。例如,如果m为0,则R将为C
通常,在式II的化合物中,n为2至5;每个m独立地为0、1、2或3;并且每个R独立地为脂族碳链。
通常,每个R独立地是长度为4至18个碳原子的碳链。因此,在至少一些实施方案中,根据本发明的Lck活化剂是如下所示的式IIa的聚酰胺部分(PM):
其中:
n为所述化合物的单体单元的数目并且是3至5的整数;
每个m独立地为0、1、2或3;并且
每个R基团独立地是长度为4至18个碳原子的碳链。
通常,在式II或式IIa的化合物中,每个m独立地为0、1或2。更通常地,m为0或1。最通常地,m为0。
正如将会理解的,如本文所述的式II的化合物的单体单元可不同于该化合物的其它单体单元中的一个或多个。
式II或式IIa的化合物/聚酰胺部分可以例如通过使式R-CHNH
在脂肪酸的α或β碳上具有氨基(NH
在本发明的实施方案中,每个脂肪酸部分包含6至16个碳、8至14个碳,或10至12个碳。在一些实施方案中,至少一个脂肪酸部分是饱和的、不饱和的或多不饱和的。在优选的实施方案中,所述脂肪酸中的一个、两个、三个或四个是饱和的。在一些实施方案中,所述脂肪酸选自由以下组成的组:羊油酸(己酸)、羊脂酸(辛酸)、羊蜡酸(癸酸)和月桂酸(十二烷酸)。在优选的实施方案中,所述脂肪酸是十二烷酸(氨基十二烷酸/adod)。
在根据本发明的方法中使用的Lck活化剂的实施方案中,式II化合物的每个R基团的碳链可以独立地为线性的或支化的,并且可以是饱和的,或者不饱和的并具有一个或多个双键。通常,每个R基团均为饱和碳链。
通常,式II化合物的每个R基团独立地是长度为8至18个、8至16个,更优选8至14个并且最优选8至12个碳原子的碳链。最通常地,每个R基团独立地是长度为8至10个碳原子的碳链。
因此,例如,2-氨基-羊蜡酸和月桂酸脂肪酸(长度分别为10和12个碳原子)特别适合用于提供如本文所述的式II的化合物。正如将理解的,在羊蜡酸脂肪酸的情况下,如果羊蜡酸脂肪酸链的碳1和2(α碳)掺入到所得式II化合物的主链中,则所述化合物的单体单元的R基团的长度为8个碳原子。同样,在月桂酸脂肪酸的情况下,所得化合物的单体单元(n=1)的R基团的长度为10个碳原子。
式II化合物的R基团的碳链长度可以独立地在该化合物的一个单体单元与另一个单体单元之间变化。通常,式II化合物的R基团的碳链的长度彼此相同。特别优选使用2-氨基月桂酸脂肪酸酰胺来提供式II化合物。因此,所述化合物的每个单体单元的R基团的长度在这个例子中为10个碳原子。
通常,在式II的化合物中,n为3、4或5,更通常地n为3或4,且最通常地,n为4。
然而,明确涵盖如本文所述的Lck活化剂的式II化合物的所有变型。通常,如本文所述的Lck活化剂的式IIa的化合物以氨基(NH
方案I:式II的化合物
在其它实施方案中,也可以采用以氢原子或除NH
根据本发明使用的式II化合物可以例如具有选自以下的末端基团:例如NH
低级烷基、低级烯基、OR、NHR'和NR'R”基团的一个或多个任选取代基可以选自,例如,OH、卤基(例如F、Cl、Br、I)、C
“低级烷基”意指C
同样,“低级烯基”意指在其最长的链中包含一个或多个双键的C
然而,通常,式II的化合物将以NH
式I的肽(P)的经修饰形式或变体形式之间的氨基酸差异通常是保守性氨基酸变化。保守性氨基酸取代意指将氨基酸残基用具有相似立体化学特性(例如,结构、电荷、酸性或碱性特征)并且基本上不影响构象或特征生物学功能的一个或多个所需方面的另一氨基酸置换。例如,酸性氨基酸诸如天冬氨酸(D)可以被谷氨酸残基(E)置换,极性氨基酸诸如丝氨酸(S)可以被另一种极性氨基酸诸如苏氨酸(T)或天冬酰胺(N)置换,如此类推。
当为了比较目的而对序列进行最佳比对时,可以通过比较序列中每个位置处的氨基酸来确定如本文所述的氨基酸序列之间的序列同一性。序列比对可以使用任何合适的程序或算法,例如通过Needleman和Wunsch算法(Needleman和Wunsch,1970)来执行。可使用标准软件程序,诸如作为Wisconsin Package 10.1版的一部分的GAP(Genetics ComputerGroup,Madison,Wisconsin,United States),使用默认评分矩阵(空位产生罚分为50且空位延伸罚分为3),方便地执行计算机辅助的序列比对。用于比较的氨基酸序列的其它比对方法也是众所周知的,诸如但不限于Smith和Waterman(1981)以及Pearson和Lipman(1988)的算法,此类算法的计算机化实现(例如BESTFIT、FASTA和BLAST),以及通过手动比对和检查序列。
在如本文所述的实施方案中,式II的化合物(C)可以与如本文所述的式I的肽(P)的N-末端或C-末端偶联,如以下式III和式IV所举例说明的。
C-P 式III
P-C 式IV
如本文所述的Lck活化剂的肽(P)和化合物(C)通常根据具体情况,通过相应的肽键或其它合适的(例如,共价或离子)键直接彼此偶联。在其它实施方案中,所述肽可以经由接头基团(LG)与所述化合物偶联。所述接头可以例如具有1至10个原子或更多原子(即1、2、3、4、5、6、7、8、9或10个原子)的长度,其中连接原子或所述接头基团(例如线性链)中的一个或多个原子可以是例如独立地选自N、S和O的非碳原子。然而,可以采用任何合适的连接系统。
根据上文,如本文所述的Lck活化剂的至少一些实施方案是脂肽或者包含脂肽。
还应理解,式III或式IV中的肽(P)可以是式I的肽的反向序列。
在另一些进一步实施方案中,根据本发明的Lck活化剂可以与接头部分(LM)偶联,该接头部分用于将Lck活化剂偶联至靶向部分以将Lck活化剂靶向递送至靶细胞并且/或者偶联至如本文所述的一种或多种其它Lck活化剂。所述接头基团可例如偶联至肽(P)的任一末端,如以下式V至VII中所例示的。
LM-P-C 式V
C-P-LM 式VI
P-C-LM 式VII
在一些实施方案中,接头部分可以将Lck活化剂直接偶联至靶向部分。
在其它实施方案中,接头部分可包含用于将一对Lck活化剂偶联在一起的桥接部分,其中所述Lck活化剂彼此相同或不同。
接头部分(LM)可以任选地包括编码一个或多个酶裂解位点的氨基酸序列或者由编码一个或多个酶裂解位点的氨基酸序列组成,如下所举例说明的,以便在靶细胞表面或靶细胞内细胞内地发生酶裂解以释放一种或多种Lck活化剂。
通常,接头部分包含用于将接头部分偶联至靶向部分的偶联部分。
偶联部分可包含用于与靶向部分连接的任何合适的氨基酸或氨基酸序列,诸如半胱氨酸(C)氨基酸残基(用于与由靶向部分提供的末端半胱氨酸残基形成二硫桥)、赖氨酸残基(K),或选自由例如KAA、CAA组成的组的用于使赖氨酸(K)或半胱氨酸(C)残基与接头部分的酶裂解位点(当存在时)间隔开的间隔区氨基酸序列,其中A是丙氨酸氨基酸残基。间隔区氨基酸序列可以进一步充当用于确定与所选靶向部分的附接的标记。在特别优选的实施方案中,偶联部分将包含一个或多个β氨基酸(例如,在KAA和CAA的情况下,丙氨酸残基可为β氨基酸)。
在一个实施方案中,偶联部分是叠氮化物部分。
在另一个实施方案中,偶联部分(例如叠氮化物部分)与二苯并环辛炔(DBCO)偶联。
接头部分(LM)的所述一个或多个酶裂解位点可以选自由以下组成的组:组织蛋白酶裂解位点,例如GFLGFK(例如,参见Orban等人,Amino Acids,2011,41(2):469-483);基质金属蛋白酶(MMP)裂解位点,其实例包括MMP-9和MMP-2的裂解位点,诸如GPLGIAGQ、PAGLLGC和GPLGLWAQ(例如,参见Kratz F.等人,Bioorg Med Chem Letters,2001,11:2001-2006);前列腺特异性抗原(PSA)裂解位点,诸如KGISSQY和SSKYQL(Kumar SK等人,Bioorg MedChem,2008,16(6):2764-2768;Niemela P等人,Clin Chem,2002,48(8):1257-1264);以及可被细胞内酶诸如谷胱甘肽-s-转移酶裂解的二硫桥(-S-S-),它们全部的用途均明确涵盖于本文。
因此,接头部分(LM)可以例如包含如本文所述的偶联部分和/或酶裂解位点的各种组合或者由如本文所述的偶联部分和/或酶裂解位点的各种组合组成,如可以选自由以下组成的组:GFLGFK、KAAGFLGFK、CAAGFLGFK、GPLGIAGQ、KAAGPLGIAGQ、CAAGPLGGIAGQ、PAGLLGC、KAAPAGLLGC、CAAPAGLLGC、GPLGLWAQ、KAAGPLGLWAQ和CAAGPLGLWAQ等。在至少一些实施方案中,如本文所述的接头部分(LM)可包含多于一个酶裂解位点。
以下方案II中例示了根据如本文所述的实施方案的通过接头部分(LM)偶联在一起的一对Lck活化剂的实例。
方案II:二聚体Lck活化剂的实例
方案II中所示的二聚体Lck活化剂包含通过桥接部分偶联在一起的如本文所述的Lck活化剂Lck1和Lck2。在这种情况下,桥接部分包含酶裂解位点X
在本发明的实施方案中,还可以采用除Gly
在另一些其它实施方案中,如本文所述的Lck活化剂、Lck活化剂的二聚体或其它多聚体可以通过树状大分子或其它合适的生理上可接受的支架/构架与一个或多个其它单独的Lck活化剂或Lck活化剂多聚体偶联。
如本文所述的Lck活化剂进入细胞中可以经由许多机制进行,所述机制包括经由跨细胞外膜的扩散或通过例如受体介导的转运或内化,包括经由富含组织蛋白酶的溶酶体。
如本文所述的用于使一种或多种Lck活化剂靶向的靶向部分可以通过使用与在细胞表面上或在靶细胞的组织环境中表达的受体或其它分子结合的靶向部分诸如配体、结合肽、抗体或其结合片段(诸如Fab和F(ab)
HIV(例如,HIV-1)例如经由包膜蛋白gp120与T淋巴细胞上表达的CD4结合,从而进入T细胞中。与CD4结合后,gp120蛋白产生的构象变化使病毒能够与淋巴细胞的共受体CCR5和/或CXCR4结合,从而使病毒能够与细胞融合。CD4、CCR5和CXCR4是可以根据本发明的实施方案进行靶向以将根据本发明的一种或多种治疗剂递送至T-淋巴细胞的细胞表面受体的实例。可以根据本发明进行靶向的靶细胞上的细胞表面受体或表面表达的分子的其它实例包括CD2、CD3、CD8、CD28和CD45(例如,CD45RA、CD45RB和CD45RO同种型)。
可以根据本发明的实施方案进行靶向以将一种或多种治疗剂递送至靶细胞的进一步分子的实例包括整联蛋白家族成员及其亚基、细胞间粘附分子(ICAM)激素受体、神经递质受体、受体酪氨酸激酶受体、G蛋白连接受体、生长因子受体、跨膜蛋白酶受体、细胞表面蛋白聚糖、CD44、CD55、Fcγ受体、癌胚抗原(CEA)、透明质酸受体、转铁蛋白受体、叶酸盐受体、前列腺特异性膜抗原、血管细胞粘附分子、基质蛋白(诸如纤连蛋白、胶原玻连蛋白和层粘连蛋白)。
化学治疗剂伊巴珠单抗(Ibalizumab)(原名TNX-355)(Bruno CJ和Jacobson JM,JAntimicrobial Chemotherapy,2010,doi:10.1093/jac/dkq261)靶向CD4并且可以用作靶向部分,用于根据本发明将一种或多种Lck活化剂递送至靶细胞,用于治疗根据本发明的癌症或其它疾病或病状的其它药物也一样。同样,也可以利用与CD4(例如,OKT4)或CXCR4结合的抗体或其抗体结合片段。
在一些实施方案中,Lck活化剂可以与治疗性靶向抗体一起单独施用或与靶向抗体缀合作为抗体-药物缀合物(ADC)施用。例如,针对程序性死亡配体-1(PD-1)受体或在肿瘤特异性T细胞上表达的细胞毒性T淋巴细胞相关蛋白4(CTLA4)受体的抗体(其抑制这些受体对T细胞活化和IL-2产生的抑制作用),诸如分别为曲美木单抗(tremelimumab)/伊匹单抗(ipilimumab)(Yervoy)或MSB0010718C,可以与本文所述的Lck活化剂缀合以形成ADC,用于治疗此类抗体靶向的癌症,诸如黑素瘤、肾癌和肺癌(Ott PA,OncLive,2014年2月21日线上发布)。先前也已经使用通过Lck活化介导其作用的双特异性串联scFv配体,描述了CTLA-4受体从T细胞的抑制剂向活化剂的转化(Madrenas J等人,J Immunol,2004,172:5948-5956和Teft WA等人,BMC Immunology,2009;doi:10.1186/1471-2172-10-23,Teft WA等人,BMC Immunology,2009;doi:10.1186/1471-2172-10-23)。因此,根据本发明的实施方案,scFv与如本文所述的Lck活化剂的缀合可以进一步促进T细胞活化。作为进一步实例,本领域技术人员已知的双特异性抗体可用于将例如本文所述的PEG-缀合的Lck活化剂与针对细胞表面受体例如CD28的抗体连接。
在本发明的实施方案中用作靶向部分的抗体或其结合片段(诸如Fab、F(ab)
如上所述,单链可变片段(scFv)及其多聚体形式,例如二价scFv(例如串联scFv和双抗体)、三价scFv(三抗体)和四价scFv(四抗体)也可以在本发明的实施方案中用作靶向部分,其中特别优选使用双抗体。可用于本发明的实施方案中的scFv可包含通过氨基酸接头序列(AAL)以两种可能的取向V
当将scFv用作靶向部分时,如本文所述的各个Lck活化剂可以与它的V
同样,如本文所述的Lck活化剂可以经由通常包含一个或多个如上所述的酶裂解位点的接头部分,以任何合适的方式与抗体、其一个或多个结合片段,或其它靶向部分偶联。
在另一些其它实施方案中,可以利用重组DNA技术将如本文所述的Lck活化剂掺入到靶向部分本身(例如,抗体、抗体结合片段或scFv)中。在此类实施方案中,Lck活化剂可以在Lck活化剂的每个末端处通过包含一个或多个酶裂解位点(例如组织蛋白酶裂解位点)的相应偶联部分与靶向部分偶联,所述偶联部分将Lck活化剂在每个末端处接合至靶向部分。在此类实施方案中,可以将Lck活化剂掺入在靶向部分中任何合适的位置处,该位置不损害靶向部分的结合或靶向功能,并且允许酶裂解位点在使用中裂解。例如,如本文所述的各个Lck活化剂可以上述方式插入到scFv的V
本发明明确涵盖采用多于一个靶向部分来靶向靶组织或靶细胞表面的不同位点,或作为将免疫效应细胞募集到靶细胞的手段的双特异性靶向方案(例如,Weidle UH.等人,Cancer Genomics&Proteomics,2013,10:1-18最近综述的双特异性抗体靶向)。即,如本文所述的单个Lck活化剂可以掺有两个不同的靶向部分,以使不同的靶分子彼此靶向。例如,可以提供用于靶向两个不同的靶分子诸如HER2和CD4的双特异性串联双scFv,例如,在相应的V
明确涵盖包含如本文所述的式I的肽(P),并且有或无本文所述的靶向部分和/或偶联部分的呈嵌合蛋白(即融合蛋白)形式的Lck活化剂,它们在本发明方法中的用途也一样。
例如,公认的是,细胞免疫反应随着衰老而降低。具体而言,已经证实在来自老年患者的T淋巴细胞中淋巴细胞增殖显著降低,并且这与Lck活性的显著降低相关(Fulop TJr等人,Experimental Gerontology,1999,34(2):197-216)。因此,特异性Lck活化剂的防治性施用在预防或降低老年人中使人衰弱的感染的发生率或严重程度方面可能特别有益。而且,失去适当的T细胞免疫反应是癌症化学疗法的副作用,这突出表明需要组合使用Lck活化剂来克服与靶向多种酪氨酸激酶的癌症疗法相关的免疫抑制。除了Lck活化在急性白血病和非霍奇金淋巴瘤中克服对抗癌药物的抗药性以及细胞周期进展抑制中的潜在作用以外,Lck活化在多种病原性感染(病毒性、细菌、真菌、原生动物和寄生虫)以及与Lck缺乏相关的各种疾病的管理中也有关。
免疫系统的T淋巴细胞是由胸腺产生的,并且可以在特定组织(诸如皮肤、淋巴结)和粘膜组织(诸如口腔、肺气道、肠和阴道的粘膜组织)中循环并驻留。上皮内T细胞在体内平衡和防御恶性肿瘤方面起关键作用。诸如皮肤、肠、肺等上皮组织处于持续的环境暴露下,并且形成抵御入侵微生物的第一道防线。小鼠体内缺乏上皮内T细胞(已知其会表达Lck)导致肿瘤排斥的缺陷。具体而言,上皮内此类T细胞的存在是下调包括黑素瘤在内的上皮恶性肿瘤所需的(Girardi M等人,Science,2001,294(5542):605-9;Schon MP等人,JInvest Dermatology,2003,121:951-962)。胸腺内此类组织特异性T细胞的成熟具有Lck依赖性,并且这些细胞有助于防御病原性感染及其病理影响(例如,疟疾的病原性感染及其病理影响)(Inoue S-I等人,PNAS USA,2012,109:12129-12134)。而且,γ-δ(γ/δ)T细胞在针对原生动物寄生虫、细菌和病毒感染的免疫反应中起重要作用。此类T细胞的组织特异性定位是皮肤中免疫监督的必要条件(Jamieson JM等人,Frontiers in Bioscience,2004,9:2640-2651;Schon MP等人,J Invest Dermatology,2003,121:951-962。
在几个T细胞系中,已经证实活化的Lck蛋白会在缺乏抗原刺激的情况下刺激作为T细胞活化标志的白细胞介素2(IL-2)产生(Luo K和Sefton BM,Mol Cell Biol,1992,12(10):4724-4732。
调节性T细胞(Treg)是不同于γ/δT细胞的T细胞子集,在阻抑对癌症的免疫反应中起关键作用。Treg占外周CD4+ T细胞库的5-10%,其通过IL-2Rα和转录因子FOXP3的组成型表达来识别。
已知肿瘤浸润淋巴细胞内FoxP3 Treg的存在与各种类型的人类癌症预后不良相关,并且IL-21由于其能够促进T细胞反应和抵消Treg介导的对免疫系统的阻抑作用而促进抗肿瘤免疫力(Kannappan V等人,Cancer Immunol Immunother,2017,66(5):637-645)。
本发明人已经证明,本发明的Lck活化多肽会增加细胞的IL-21分泌(例如图7)。因此,本文所述的Lck活化多肽具有减少离体或体内的Treg数量的潜力。实际上,本发明人已经证明本文所述的Lck活化多肽会减少体外Treg。
重要的是,本发明人已惊人地证明本文所述的用于活化Lck的肽选择性地活化Lck,而不会活化其它Src家族激酶。例如,图2证明Blk、cSrc、Fgr、Fyn、Hck、Lyn和Yes未被本文所述的用于活化Lck的肽活化。
在一个实施方案中,本发明提供了增加Lck活性的方法,所述方法包括使Lck激酶与包含如本文所述的Lck活化肽的组合物接触。本发明还提供了增加Lck激酶的Y394磷酸化的方法,所述方法包括使Lck激酶与包含如本文所述的Lck活化肽的组合物接触。
在一个实施方案中,当将与包含本文所述的Lck活化肽的组合物接触时的Lck活性水平与未与如本文所述的Lck活化肽接触的Lck活性(例如对照)相比较时,或者对与包含本文所述的Lck活化肽的组合物接触前后的水平进比较时,与如本文所述的Lck活化肽接触的Lck活性增加。类似地,当将与如本文所述的Lck活化肽接触的Lck激酶的Y394磷酸化水平与未与如本文所述的Lck活化肽接触的Lck激酶的Y394磷酸化水平(例如对照)相比较时,或者对与包含本文所述的Lck活化肽的组合物接触前后的水平进行比较时,Lck激酶的Y394磷酸化水平增加。
在一个实施方案中,将所述肽或包含所述肽的药物组合物施用于受试者以增加体内Lck的活性
如本文所用,术语“增加活性”和“活化”一般是指激酶活性,诸如磷酸转移酶活性的增加(例如,增加Lck激酶的Y394磷酸化)。例如,激酶的酶活性的活化是指与不存在活化剂的情况下的相同活性相比,在存在活化剂的情况下激酶的活性的任何增加。术语活化蛋白激酶还包括自体磷酸化的增加,活化后从一个细胞内位置到另一细胞内位置的移动的增加,与将激酶锚定在给定位置的一种或多种蛋白的结合或从将激酶锚定在给定位置的一种或多种蛋白的释放的增加,蛋白激酶的其它活性或功能的增加。这种增加可以通过任何方式引起,所述方式包括(但不限于)增加蛋白激酶与蛋白激酶结合伴侣之间形成复合物的可能性,或增加一旦结合至其靶标时的激酶活性。此类活化可以在体内或体外发生。
激酶的酶活性可以通过本领域技术人员已知的多种方法,例如,以下公开的方法进行监测:Parker,Law等人,(2000),Development of high throughput screeningassays using fluorescence polarization:nuclear receptor-ligand-binding andkinase/phosphatase assays,J.Biomolec.Screening 5(2):77-88;Bader等人(2001),Journal of Biomolecular Screening 6(4):255-64);Liu,F.,X.H.Ma等人(2001).“Regulation of cyclin-dependent kinase 5and casein kinase 1by metabotropicglutamate receptors.”Proceedings of the National Academy of Sciences of theUnited States of America 98(20):11062-8;Evans,D.B.,K.B.Rank等人(2002).“Ascintillation proximity assay for studying inhibitors of human Tau proteinkinase II/Cdk5 using a 96-well format.”Journal of Biochemical&BiophysicalMethods 50(2-3):151-61。
使用此类标准方法,将含有目标激酶的样品在适当条件下暴露于放射性ATP和适当组成的合成肽底物,以提供磷酸化位点。然后测量与该肽新缔合的放射性磷酸盐。化学部分(诸如与底物肽共价连接的生物素)的添加允许链霉亲和素包被的珠粒结合底物肽。可以分离珠粒结合的肽并测量相关的放射性,或者优选地,可以使用适于临近闪烁测定法的珠粒直接测量与底物肽相关的放射性。
肽底物的磷酸化也可以经由磷酸特异性抗体的直接结合或通过测量磷酸特异性抗体从竞争磷酸肽中的置换来检测(参见,例如,Parker,Law等人,2000,Development ofhigh throughput screening assays using fluorescence polarization:nuclearreceptor-ligand binding and kinase/phosphatase assays,J.Biomolec.Screening5(2):77-88)。诸如荧光共振能量转移(FRET)或荧光偏振(FP)的荧光法可用于检测特异性磷酸肽-抗体复合物。这些方法的优势在于,它们采用“均质”检测,该检测不依赖于结合物质的分离,而是依赖于由于溶液中的特异性结合而发生的荧光变化。
产生磷酸特异性抗体的方法是本领域众所周知的。在一个实施例中,在1999年10月15日提交的,Bibb等人的标题为“Methods of Identifying Agents That RegulatePhosphorylation/Dephosphorylation in Dopamine Signalling”的美国专利申请序列号09/419,379,以及2000年10月13日提交的,Bibb等人的标题为“Methods of IdentifyingAgents That Regulate Phosphorylation/Dephosphorylation in DopamineSignalling”的美国专利申请序列号09/687,959(其各自通过引用整体并入本文)中公开的方法用于产生对磷酸化靶标具有特异性的磷酸化状态特异性抗体。
针对磷酸丝氨酸、磷酸苏氨酸或磷酸酪氨酸的磷酸化状态特异性抗体是可商购的。这些抗体可用于确定总体上蛋白质是否被磷酸化以及在哪个残基上磷酸化。此类抗体可从商业来源获得(关于商业来源列表,参见例如Smith,The Scientist 15[4]:24,2001年2月19日,包括Santa Cruz Biotechnology Inc.;Sigma RBI,Stratagene;UpstateBiotechnology和Zymed)。
荧光共振能量转移或FRET广泛用于能够检测大分子的特异性结合的均质测定中。FRET依赖于激发的“供体”荧光分子(荧光团)将其能量转移到附近的“受体”荧光团而不是发光的能力。因此,当两个荧光团通过与底物靶结合而在空间上聚集在一起时,以正常供体波长发射的荧光减少,并且受体荧光团发射的荧光增加。供体荧光的减少或受体荧光的增加可用于测量结合事件。
评估激酶活性的合适方法包括,Bader等人(2001,A cGMP-dependent proteinkinase assay for high throughput screening based on time-resolvedfluorescence resonance energy transfer,Journal of Biomolecular Screening 6(4):255-64)中公开的用于确定例如磷酸二酯酶、激酶或蛋白磷酸酶的活性的方法。Bader等人公开了基于时间分辨的荧光共振能量转移(“FRET”)的用于高通量筛选的cGMP依赖性蛋白激酶测定法,如本领域技术人员将理解的,该cGMP依赖性蛋白激酶测定法可适用于磷酸二酯酶或蛋白磷酸酶的测定。将含有目标激酶的样品暴露于ATP和具有激酶特异性磷酸化位点和氨基末端生物素部分的合成肽底物。使用别藻蓝蛋白标记的链霉亲和素、磷酸肽特异性抗体和铕螯合物标记的二抗检测磷酸化肽。链霉亲和素和磷酸化特异性抗体与磷酸化底物分子的同时结合使二抗上的铕螯合物“供体”足够接近于别藻蓝蛋白荧光团“受体”以使荧光共振能量转移发生,可作为615nm的铕发射减少和665nm波长的别藻蓝蛋白发射增加测量。为了利用激发的铕的长荧光寿命,通常使用铕-别藻蓝蛋白供体-受体对,因此信号是“时间分辨的”。
可以使用其它成对的荧光团,诸如香豆素和异硫氰酸荧光素。可以参与荧光共振能量转移(FRET)的此类分子对称为FRET对。为了使能量转移发生,供体和受体分子通常必须非常接近(高达70至
荧光偏振测量也可以用于测量磷酸二酯酶、蛋白激酶或磷酸酶的活性(参见,例如,Parker,Law等人,2000,Development of high throughput screening assays usingfluorescence polarization:nuclear receptor-ligand-binding and kinase/phosphatase assays,J.Biomolec.Screening 5(2):77-88;Turek等人,2001,Anal.Biochem.299:45-53)。大的特异性抗体与荧光小磷酸肽的结合减缓它的翻滚速度并增加荧光偏振信号。因此,荧光偏振与结合的荧光磷酸肽的量成比例。该测定法可以竞争模式使用,其中将固定浓度的荧光肽和抗体添加到生物样品中,并且将非荧光磷蛋白或磷酸肽的存在记录为信号的减少。它也可以直接结合模式使用,在直接结合模式中磷酸盐的添加(例如通过激酶)或磷酸盐的去除(例如通过磷酸酶)调节抗体结合并因此调节偏振信号。在具体的实施方案中,使用其中采用产物特异性抗磷酸化肽特异性(例如,抗磷酸-丝氨酸)抗体的Turek等人(2001,Anal.Biochem.299:45-53)的方法执行荧光偏振测定。
其它合适的评估激酶活性的方法包括基于细胞的磷酸化测定法。例如,在体内,例如在单个活细胞中使用荧光指示剂,使用诸如Sato等人(2002,Fluorescent indicatorsfor imaging protein phosphorylation in single living cells,NatureBiotechnology 20(3):287-94)公开的方法使基于蛋白质磷酸化的信号转导可视化。此类感受器由两个被柔性接头隔开的荧光蛋白分子组成。接头肽含有磷酸化位点和磷蛋白识别元件。接头的磷酸化引起构象变化,使两种荧光蛋白非常接近,从而允许FRET发生并改变系统的荧光输出。
T细胞在细胞免疫力中起着核心作用,并且年龄相关性疾病的发生率正在递增,其中许多年龄相关性疾病都受到免疫系统失调的影响。有大量证据表明,免疫反应(主要是T细胞反应)在衰老时失调(Fulop T等人,Longevity&Healthspan,2012,1:6)。已经描述了与衰老过程相关的T细胞信号传导途径的几种改变,并且已经提出质膜内的磷脂结构(脂质筏)起到组装TCR级联反应的组分的作用(在Fulop等人,见上文中有综述)。进一步地,已证实在来自老年个体的活化T细胞中,Lck及其活化形式向脂质筏的募集减少(Larbi A等人,JLeukoc Biol,2004,75(2):373-381)。
已经在实验动物模型和人类中观察到T细胞活化途径的年龄相关性改变,最重要的变化发生在CD4+T细胞中,导致细胞因子白细胞介素2(IL-2)的产生减少和克隆扩增(在Fulop等人(见上文)中有综述)。
在IL-2系统中,细胞内信号转导由IL-2受体的β链触发,并且作为Lck催化结构域与IL-2Rβ受体的胞质结构域中的特定位点之间缔合的结果,IL-2Rβ受体被磷酸化的Lck磷酸化(Hatakeyama M等人,Science,1991,252:152308)。Lck是唯一被证实在IL-2刺激T细胞后活化的Src家族激酶(Brockdorff J等人,Eur Cytokine Netw,2000,11(2):225-31),并且已证实活化的Lck蛋白在不存在抗原刺激的情况下会刺激IL-2产生(Luo K和Sefton BM,Mol Cell Biol,1992,12(10):4724-45732)。
T细胞活化和增殖的受损是衰老期间免疫功能丧失的关键变化(NASA-T-cellactivation in aging,Report2016;http://www.nasa.gov/mission pagres/station/research/wexperiments/857.html),并且通过比较太空飞行和地面对照获得的信息有助于了解和确定在其中起作用的特定因素。已知太空飞行和模拟微重力会导致早期T细胞活化中关键基因表达的显著减少,并且许多太空飞行任务已证明白细胞介素2(IL-2)、白细胞介素2受体α(IL-2Rα或CD25)、干扰素γ(IFNγ)和肿瘤坏死因子-α(TNFα)显著减少(在Martinez EM等人,Am J Physiol Regul Integr Comp Physiol,2015,308:R480-R488中有综述)。
关于太空飞行期间免疫力受到抑制的担忧在于,有人质疑与太空飞行相关的免疫系统减弱是否会妨碍人类在地球轨道之外存在的扩展(Gueguinou N等人,J LeukocyteBiology,2009,doi:10.1189/jib.0309167)。如本文所述,在至少一些实施方案中,上述细胞因子的表达以及CD4+和CD8+ T细胞的增殖在正常和耗竭T细胞中都可以用如本文所述的方法中利用的化合物诱导。因此,本发明的方法明确地扩展到在低重力和微重力环境中使用。
本发明人已经证明,本文所述的肽活化Lck,如表3至9和图1所示,并增加Lck在Y394处的磷酸化,如图2所示。
因此,在一个实施方案中,本发明提供了增加Lck活性的方法,所述方法包括使Lck激酶与包含如本文所述的Lck活化肽的组合物接触。
本文描述了Lck的活性,包括Lck活化的下游效应。
如本文所用,术语“接触”是指在体外系统或体内系统中将指定部分(例如如本文所述的Lck活化肽和Lck激酶)聚集在一起。例如,使蛋白激酶与如本文所述的活化剂“接触”包括向具有该激酶的个体或患者(诸如人)施用本发明的化合物,以及例如将如本文所述的活化剂引入到含有含该激酶的细胞或纯化制品的样品中。
在另一个实施方案中,本发明提供了增加Lck磷酸化的方法,所述方法包括使Lck激酶与包含如本文所述的Lck活化肽的组合物接触。
本发明人还证明了本文所述的肽增加人T细胞的IL-2分泌(图14、图15、图37、图38、图40)。重要的是,在抗原刺激之前用本文所述的Lck活化肽预处理细胞能增加人T细胞的IL-2分泌(例如参见图34)。
在一个实施方案中,本发明提供了增加细胞或细胞群体的IL-2分泌的方法,所述方法包括使细胞与包含如本文所述的Lck活化肽的组合物接触。
在一个实施方案中,当将与包含本文所述的Lck活化肽的组合物接触的细胞或细胞群体的IL-2分泌水平与未与本文所述的Lck活化肽接触的细胞或细胞群体的IL-2分泌水平(例如对照)相比较时,或者对与包含本文所述的Lck活化肽的组合物接触前后的水平进行比较时,细胞或细胞群体的IL-2分泌水平增加。
在一个实施方案中,所述细胞是T细胞。
本发明提供了诱导细胞增殖的方法,所述方法包括使细胞与包含如本文所述的Lck活化肽的组合物接触。
如本文所用,术语增殖包括细胞数量的增加,或细胞或细胞群体的细胞分裂次数的增加,并且与术语扩增可互换使用。在一个实施方案中,当将与如本文所述的Lck活化肽接触的细胞或细胞群体的增殖水平与未与如本文所述的Lck活化肽接触的细胞或细胞群体的细胞增殖水平(例如对照)相比较时,或者对与包含本文所述的Lck活化肽的组合物接触前后的水平进行比较时,细胞或细胞群体的细胞增殖水平增加。
在另一个实施方案中,本发明提供了增加细胞群体的增殖的方法,所述方法包括使细胞群体与包含如本文所述的Lck活化肽的组合物接触。
在一个实施方案中,所述细胞是或所述细胞群体包含选自由以下组成的组的细胞:CD4+ T细胞、CD8+T细胞、NK细胞或树突细胞。
在另一个实施方案中,所述细胞是或所述细胞群体包含原初细胞。
在一个优选的实施方案中,所述方法在体内或体外的细胞或细胞群体上执行。在另一个优选的实施方案中,所述方法在离体的细胞或细胞群体上执行。
在另一个实施方案中,本发明提供增加动物中细胞或细胞群体的增殖的方法,所述方法包括向动物施用包含如本文所述的Lck活化肽的组合物。
通常以有效量施用包含如本文所述的Lck活化肽的组合物。如本文所用的术语“有效量”(例如“治疗有效量”或“药物有效量”)是指如本文所述的Lck活化肽的允许Lck激酶活性活化,或增加或降低分子或细胞反应的量。所述“有效量”将因受试者而异,这取决于个体的年龄和总体状况,并且会随着诸如所治疗或所预防的特定病状、治疗的持续时间、先前的治疗以及病状的性质和先前存在的持续时间等因素而变化。
在一些实施方案中,如本文所述的Lck活化肽通常以有效量施用于无疾病或病状症状的受试者以活化Lck,例如施用于任何年龄的健康个体。
具体地,活化剂的有效量界定了可以施用于受试者而没有过度或不可耐受的毒性、刺激、变态反应或其它问题或并发症的Lck活化肽的量,该量与合理的收益/风险比相称,但是正如通过适当技术(诸如贯穿本说明书公开的那些技术)评估的那样,足以提供所需效果。因此,虽然不可能指定确切的有效量,但是本领域技术人员将能够在任何个案中使用常规实验和背景常识确定适当的“有效”量。在这种背景下,治疗结果包括根除或减轻症状。治疗结果不一定是病状的完全改善(即治愈)。
在另一个实施方案中,本发明提供了源自与包含如本文所述的Lck活化肽的组合物接触的细胞或细胞群体的细胞或细胞群体。例如,T细胞、NK细胞或树突细胞或其群体源自由本文所述的方法得到的细胞或细胞群体(例如,在体内或体外使细胞或细胞群体与包含如本文所述的Lck活化肽的组合物接触后)。在另一方面,本发明提供了本文所述的细胞或细胞群体的方法和用途。
本发明人还证明了本文所述的Lck活化肽增加包括CD4+和CD8+ T细胞(图17、图19)在内的T细胞(图3)上的IL-2Ra(CD25)表达。
因此,在一个实施方案中,本发明提供了增加细胞上的IL-2Ra(CD25)表达的方法,所述方法包括使细胞与包含如本文所述的Lck活化肽的组合物接触。在一个实施方案中,所述细胞是T细胞。在优选的实施方案中,T细胞是CD4+ T细胞或CD8+ T细胞。
如以上所讨论的,本文所述的方法可以在体内(例如受试者体内)或体外(例如离体)的细胞或细胞群体上执行。同样如以上所讨论的,本发明提供了由本文所述的方法得到的细胞和细胞群体,以及本文所述的细胞或细胞群体的方法和用途。
本文所述的肽增加CD4+ T细胞的增殖(图17)和CD8+ T细胞的增殖(图35)。因此,本文所述的Lck活化肽可用于在体内和体外诱导细胞和细胞群体的增殖,例如以进行过继细胞疗法。
因此,在一个实施方案中,本发明提供了增加T细胞增殖的方法,所述方法包括使T细胞与包含如本文所述的Lck活化肽的组合物接触。在优选的实施方案中,T细胞是CD4+ T细胞或CD8+ T细胞。
人口结构演变对公共卫生构成了挑战。全球人口,尤其是在发达国家,正老年化并且60岁以上人口的比例到2050年将从1950年的8%增加到预期的21%(在Compte N等人,PLOS One,2013,doi:10.1371/journal.pone.0065325中有综述)。免疫功能下降是衰老的标志,老年人呈现出细菌和病毒感染、癌症和疫苗反应减少的比率和严重程度递增(Compte等人,见上文)。
人免疫系统随年龄逐渐恶化,这种缺陷表现为诱导针对疫苗和感染的免疫记忆的能力降低。对病原体和肿瘤发展的防御取决于多样化TCR库的产生和维持,而年龄较大时,TCR多样性显著降低,从而使得难以抵抗新的病原体并难以对复发性感染产生强烈的回忆反应(在Moro-Garcia MA等人,Front Immunol,2013,doi.org/10.3389/fimmu.2013.00107中有综述)。
在衰老过程中对抗病原体和对疫苗反应的能力下降反映在观察到的CD4+和CD8+T细胞变化,并且已有人提出,通过使CD4+ T细胞群体“复壮(rejuvenation)”可以实现防止衰老中适应性免疫反应的恶化(Moro-Garcia MA等人,Front Immunol,2013,doi.org/10.3389/fimmu.2013.00107)。
CD28表达的丧失是与年龄相关性CD4+ T细胞功能下降的标志。CD28在T细胞活化期间起关键作用,诸如诱导细胞因子(IL-2)产生和促进细胞增殖,因此在活化期间缺少这种共刺激信号会导致T细胞仅部分活化或甚至处于无能状态(Godlove J等人,ExpGerontol,2007,42(5):412-5)。这样,在老年人中CD28阴性T细胞的积聚与对病原体和疫苗的总体免疫反应降低相关(Sauerwein-Teissl M等人,J Immunol,2002,168:5893-5899)并且在一些年龄大于65岁的个体中,CD4+/CD28-T细胞可占总CD4+ T细胞区室的最多50%(Vallejo An等人,J Immunol,2000,165:6301-6307)。
本发明人已经证明本文所述的Lck活化肽增加CD8+和CD4+ T细胞上的CD28表达(图20)。
在一个实施方案中,本发明提供了增加细胞上或细胞群体中的CD28表达的方法,所述方法包括使细胞或细胞群体与包含如本文所述的Lck活化肽的组合物接触。
在优选的实施方案中,T细胞是CD4+ T细胞或CD8+ T细胞。
在一个实施方案中,当将与如本文所述的Lck活化肽接触的细胞或群体上的CD28表达水平与未与如本文所述的Lck活化肽接触的细胞或细胞群体上的CD28表达水平(例如对照)相比较时,或者对与包含本文所述的Lck活化肽的组合物接触前后的水平进行比较时,细胞或细胞群体上的CD28表达水平增加。
在哺乳动物衰老期间,胸腺完整性和功能逐渐下降,并且胸腺退缩被视为免疫衰老中的重要因素(Li L等人,J Immunol.2004,172(5):2909-2916)。小鼠研究已证实IL-12敲除小鼠的胸腺退缩加速,并且IL-12已被证实会在老年野生型小鼠和IL-12敲除小鼠中提供用于增强IL-2诱导的胸腺细胞增殖的强大协同作用(Li等人,见上文)。
在另一个实施方案中,本发明提供了治疗和/或预防受试者的年龄相关性免疫功能障碍的方法,所述方法包括向所述受试者施用包含如本文所述的Lck活化肽的组合物。
在一个实施方案中,以Lck或Lck活性的抑制或下调为特征的疾病或病状选自由以下组成的组:病原性感染、病原性感染引起的败血症(例如,慢性败血症)、免疫缺陷病症、免疫反应降低、T细胞计数降低、T细胞异常、T细胞耗竭和T细胞检查点阻断。
在优选的实施例中,所述疾病或病状是癌症。
如本文所用,术语“年龄相关性免疫功能障碍”包括以上讨论的年龄相关性免疫变化。
在另一个实施方案中,本发明提供了治疗和/或预防与以Lck或Lck活性的抑制或下调为特征的疾病或病状相关的至少一种症状的方法,所述方法包括向受试者施用包含如本文所述的肽的组合物。
如本文所用,术语“治疗”包括治疗性治疗以及预防性治疗(完全预防病症或病症的症状(包括年龄相关性变化)的发作,或延迟病症的症状(包括年龄相关性变化)的发作,或个体中病症的临床前明显阶段)。
术语“预防”包括完全预防病症或病症的症状的发作,或者延迟病症或病症的症状的发作,或个体中病症的临床前明显阶段。例如,这包括对处于罹患疾病(诸如癌症)风险的个体的防治性治疗。“防治(Prophylaxis)”是预防(prevention)的另一个术语。
另外,老年人中IFNγ的产生受损会促成免疫风险表型,并且老年人中在受细菌产物或病毒抗原刺激时产生这种细胞因子的能力降低也会随着衰老而促成疾病易感性(Ouyang Q等人,Eur Cytokine Netw,2002,13(4):392-4)。值得注意的是,老年小鼠表现出的CD8+细胞毒性T淋巴细胞(CTL)对流感病毒的反应减弱,这被认为部分归因于IL-18受体(IL-18R)mRNA表达减少,并且IL-12和IL-18两者均可显著增加老年小鼠中的IFNγ产生,从而逆转与衰老相关的CD8+CTL缺乏(Zhang Y等人,J Interferon&Cytokine Res,2004,doi.org/10.1089/107999001753238097)。
本发明人已经证明本文所述的Lck活化肽增加CD4+ T细胞的IFNg产生(图18)。
因此,本文所述的Lck活化肽可用于增加本文所述的IFNg的生理作用。
在一个实施方案中,本发明提供了增加细胞或细胞群体的细胞因子分泌的方法,所述方法包括使细胞或细胞群体与包含如本文所述的Lck活化肽的组合物接触。
在优选的实施方案中,所述细胞因子为IFNg。
在一个实施方案中,当与包含本文所述的Lck活化肽的组合物接触的细胞或细胞群体的细胞因子(例如IFNg)分泌水平与未与如本文所述的Lck活化肽接触的细胞或细胞群体的细胞因子(例如IFNg)分泌水平(例如对照)比较增加时,或者对与包含本文所述的Lck活化肽的组合物接触前后的水平进行比较时,细胞或细胞群体的细胞因子(例如IFNg)分泌水平增加。
在优选的实施方案中,T细胞是CD4+ T细胞。
自然杀伤(NK)细胞在抵抗感染和癌症的免疫力中也起着重要作用。年龄相关性功能性NK细胞缺乏在人类和小鼠中已有着充分记载,并且已经证实向老年小鼠注射可溶性IL-15/IL-15Rα复合物可完全逆转年龄相关性NK细胞缺乏(Chiu B-C等人,J Immunol,2013,doi:10.4049/jimmunol.1301625)。而且,IL-15在对早期感染的免疫反应中起着至关重要的作用,并已证实会增加CD4+CD28-T细胞的溶细胞特性并增强它们的抗原特异性反应(Alonso-Arias R等人,Aging Cell,2011,10:844-852)。
IL-15促进NK和CD8+ T细胞的发育、功能和存活,并且通过IL-15进行的信号传导经由CD215(IL-15R)受体进行。本发明人已经证明本文所述的Lck活化肽增加NK细胞上的CD215表达(图28)。
本文所述的Lck活化肽可用于增强本文所述的IL-15R和IL-15的生理作用。
因此,在一个实施方案中,本发明提供了增加细胞或细胞群体的IL-15分泌的方法,所述方法包括使细胞或细胞群体与包含如本文所述的Lck活化肽的组合物接触。
在一个实施方案中,当与包含本文所述的Lck活化肽的组合物接触的细胞或细胞群体的IL-15分泌水平与未与本文所述的Lck活化肽接触的细胞或细胞群体的IL-15分泌水平(例如对照)比较增加时,或者对与包含本文所述的Lck活化肽的组合物接触前后的水平进行比较时,细胞或细胞群体的IL-15分泌水平增加。
在一个实施方案中,本发明提供了增加细胞上的IL-15R(CD215)表达的方法,所述方法包括使细胞与包含如本文所述的Lck活化肽的组合物接触。
在一个实施方案中,当来自与包含本文所述的Lck活化肽的组合物接触的细胞或细胞群体的细胞或细胞群体上的IL-15R表达水平与未与如本文所述的Lck活化肽接触的细胞或细胞群体上的IL-15R水平(例如对照)比较增加时,或者对与包含本文所述的Lck活化肽的组合物接触前后的水平进行比较时,细胞或细胞群体上的IL-15R表达水平增加。
在另一个实施方案中,本发明提供了增加NK细胞的IL-15反应性的方法,所述方法包括使NK细胞与包含如本文所述的Lck活化肽的组合物接触。
在一个实施方案中,当与包含本文所述的Lck活化肽的组合物接触的细胞或细胞群体对IL-15的反应性水平与未与如本文所述的Lck活化肽接触的细胞或细胞群体对IL-15的反应性水平(例如对照)比较增加时,或者对与包含本文所述的Lck活化肽的组合物接触前后的水平进行比较时,细胞或细胞群体对IL-15的反应性水平增加。
在优选的实施方案中,所述细胞是CD4+ T细胞或CD8+ T细胞。
在另一个实施方案中,本发明提供了增加NK细胞的IL-15反应性的方法,所述方法包括使NK细胞与包含如本文所述的Lck活化肽的组合物接触。
不希望受到理论的束缚,预期对IL-15的反应性增加会调节NK和CD8+ T细胞的发育、功能和存活。
本发明人还已证明本文所述的Lck活化肽增加小鼠中的NK细胞增殖(图28)。
因此,在一个实施方案中,本发明提供了增加动物中的NK细胞增殖的方法,所述方法包括向动物施用包含如本文所述的Lck活化肽的组合物。
在另一个实施方案中,本发明提供了增加NK细胞群体的增殖的方法,所述方法包括使NK细胞群体与包含如本文所述的Lck活化肽的组合物接触。在一个优选的实施方案中,所述方法在体内或体外的细胞或NK细胞群体上执行。在另一个优选的实施方案中,所述方法在离体的NK细胞或NK细胞群体上执行。在另一个实施方案中,本发明提供了一种诱导NK细胞增殖的方法,所述方法包括使NK细胞与包含如本文所述的Lck活化肽的组合物接触。
本发明人还已证明本文所述的Lck活化肽增加CD8+ T细胞和NK细胞中CD107a(脱粒标志物)的表达(图33),以及NK细胞上NKp44和NKG2D的表达(图21);NKp44和NKG2D是参与细胞裂解的活化受体。
因此,在一个实施方案中,本发明提供了增加CD8+ T细胞或NK细胞中的CD107a表达的方法,所述方法包括使CD8+ T细胞或NK细胞与包含如本文所述的Lck活化肽的组合物接触。
不希望受到理论的束缚,因为CD107a是脱粒标志物,所以预计增加CD8+ T细胞或NK细胞中的CD107a表达的方法会增加细胞毒性反应。因此,在一个实施方案中,本发明提供了增加受试者中的细胞毒性反应的方法,所述方法包括向受试者施用包含如本文所述的Lck活化肽的组合物。
白细胞介素-2(IL-2)是一种促进生长的细胞因子,其主要由辅助T细胞产生并调节细胞和体液免疫力中所牵涉到的各种细胞的生长和功能。IL-2的表达会随年龄而下降,并且已经证实这种下降与年龄相关性免疫功能下降并行(Pahlavani MA和Richardson A,Mech Ageing Dev,1996,89(3):125-54)。而且,向老年小鼠施用IL-21已经被证实能通过触发从头胸腺形成而使它们的外周T细胞库复壮(Al-Chami E等人,Aging Cell,2016,15(2):349-60)。例如,与源自对照老年小鼠的T细胞相比,刺激源自经rIL-21处理的老年小鼠的T细胞展示出增强的Lck激酶活化,从而最终加强了它们的IL-2产生、CD25表达和增殖能力(Al-Chami等人,见上文)。
本发明人已经证明本文所述的Lck活化肽增加包括CD4+和CD8+ T细胞(图17、图19)在内的T细胞(图3)上的IL-2Ra(CD25)表达,并且增加CD4+ T细胞的增殖(图17)和CD8+T细胞的增殖(图35)。
因此,本文所述的Lck活化肽可用于增加本文所述的IL2R的生理作用(例如对IL-2的反应性)。
在一个实施方案中,本发明提供了增加细胞的或细胞群体中的IL-2反应性的方法,所述方法包括使细胞或细胞群体与包含如本文所述的Lck活化肽的组合物接触。
在一个实施方案中,当将与包含本文所述的Lck活化肽的组合物接触的细胞或细胞群体对IL-2的反应性水平与未与如本文所述的Lck活化肽接触的细胞或细胞群体对IL-2的反应性水平(例如对照)相比较时,或者对与包含本文所述的Lck活化肽的组合物接触前后的水平进行比较时,细胞或细胞群体对IL-2的反应性水平增加。
在一个实施方案中,所述细胞是T细胞。在优选的实施方案中,T细胞是CD4+ T细胞或CD8+ T细胞。
在一个实施方案中,所述细胞是或所述细胞群体包含原初细胞。
在一个实施方案中,本发明提供了增加细胞上或细胞群体中的IL-2Ra(CD25)表达的方法,所述方法包括使细胞或细胞群体与包含如本文所述的Lck活化肽的组合物接触。
在一个实施方案中,本发明提供了在检查点抑制剂存在的情况下增加CD25表达的方法,所述方法包括使细胞或细胞群体与包含如本文所述的Lck活化肽的组合物接触。
在另一个实施方案中,本发明提供了诱导细胞增殖的方法,所述方法包括使细胞与包含如本文所述的Lck活化肽的组合物接触。在一个优选的实施方案中,细胞是CD4+ T细胞、CD8+ T细胞或NK细胞。
在另一个实施方案中,本发明提供了增加细胞群体的增殖的方法,所述方法包括使细胞群体与包含如本文所述的Lck活化肽的组合物接触。在优选的实施方案中,所述细胞群体是CD4+ T细胞、CD8+ T细胞或NK细胞的群体。如上所指出的,所述方法可以在体内或体外的细胞或细胞群体上执行。在另一个优选的实施方案中,所述方法在离体的细胞或细胞群体上执行。
在另一个实施方案中,本发明提供了源自与包含如本文所述的Lck活化肽的组合物接触的细胞或细胞群体的细胞群体。例如,T细胞、NK细胞或树突细胞或其群体源自与包含如本文所述的Lck活化肽的组合物接触的细胞或细胞群体。
在一方面,本发明提供了本文所述的细胞或细胞群体的方法和用途。例如,本文所述的细胞或细胞群提可用于过继细胞疗法,包括CAR T细胞疗法。
已经证实细胞因子IL-21对于最佳的疫苗诱导的针对狂犬病毒感染的主要反应的发展至关重要,并且与IL-7组合,在全细胞癌疫苗中具有强大的辅助功效(Dorfmeier CL等人,PLoS Negl Trop Di,2013,doi:10.1371/journal.pntd.0002129;Gu Y-Z等人,Scientific Reports,2016,doi:10.1038/srep32351)。
本发明人已经证明本文所述的Lck活化肽增加CD4+和CD8+ T细胞(图4)、NK细胞(图5、图6)上的IL-21R(CD360)表达,以及增加T细胞的IL-21产生(图7)。
在一个实施方案中,本发明提供了增加细胞或细胞群体的IL-21分泌的方法,所述方法包括使细胞或细胞群体与包含如本文所述的Lck活化肽的组合物接触。
在一个实施方案中,当与包含本文所述的Lck活化肽的组合物接触的细胞或细胞群体的IL-21分泌水平与未与本文所述的Lck活化肽接触的细胞或细胞群体的IL-21分泌水平(例如对照)比较增加时,或者对与包含本文所述的Lck活化肽的组合物接触前后的水平进行比较时,细胞或细胞群体的IL-21分泌水平增加。
在一个实施方案中,本发明提供了在受试者中诱导免疫反应的方法,所述方法包括向所述受试者施用包含如本文所述的Lck活化肽的组合物。
在一个实施方案中,本发明提供了增加细胞或细胞群体上的IL-21R(CD360)表达的方法,所述方法包括使细胞或细胞群体与包含如本文所述的Lck活化肽的组合物接触。
在一个实施方案中,当来自与包含本文所述的Lck活化肽的组合物接触的细胞或细胞群体的细胞或细胞群体上的IL-21R表达水平与未与如本文所述的Lck活化肽接触的细胞或细胞群体上的IL-21R水平(例如对照)比较增加时,或者对与包含本文所述的Lck活化肽的组合物接触前后的水平进行比较时,细胞或细胞群体上的IL-21R表达水平增加
在另一个实施方案中,本发明提供了增加细胞的IL-21反应性的方法,所述方法包括使细胞与包含如本文所述的Lck活化肽的组合物接触。在优选的实施方案中,所述细胞是CD4+ T细胞、CD8+ T细胞或NK细胞。
在一个实施方案中,本发明提供了增加细胞上的IL-21R(CD360)表达的方法,所述方法包括使细胞与包含如本文所述的Lck活化肽的组合物接触。在另一个实施方案中,本发明提供了增加细胞的IL-21反应性的方法,所述方法包括使细胞与包含如本文所述的Lck活化肽的组合物接触。
在一个实施方案中,本发明提供了对有需要的受试者进行疫苗接种的方法,所述方法包括将包含如本文所述的Lck活化肽的组合物与疫苗同时或依序地施用给受试者。本发明还提供了包含与疫苗(例如疫苗抗原)一起配制的如本文所述的Lck活化肽的组合物。
许多新型抗癌药物的显著不良副作用是免疫抑制,其导致爆发性败血症。例如,据报道一种用于转移性肾癌的药物索拉非尼(Sorafenib)在超过10μM的剂量下即使在停药后也会引起不可恢复的T细胞增殖抑制作用(Zhao W等人,Leukemia,2008,22:1226-1233)。例如,已提出增加Lck上调作为在接受酪氨酸激酶抑制剂治疗的慢性髓系白血病患者中再次刺激免疫反应的可行选择(Wang G等人,BioMed Research International,2014,doi.org/10.1155/2014/682010)。而且,例如,BCR-ABL激酶抑制剂伊马替尼(imatinib)(Gleevec,ST1571)在治疗慢性髓系白血病中非常有效。然而,长期用这种药物治疗会诱导免疫抑制,免疫抑制主要是由于与酪氨酸激酶(诸如如Lck和Zap70)的抑制相关的T细胞功能异常引起(Wang G等人,见上文)。另外,糖皮质激素充当阻断TCR活化所需的信号传导事件的有效免疫抑制剂,并且已经证实地塞米松对Lck的抑制会下调肌醇磷酸3受体,从而通过减弱TCR信号的强度来阻抑免疫反应(Harr MW等人,JBC,2009,284:31860-31871)。随着酪氨酸激酶抑制剂的发展和在癌症中的使用的迅速扩展,这些药物的潜在副作用具有重要的临床意义。除伊马替尼外,例如尼洛替尼(nilotinib)和达沙替尼(dasatinib)也被报道会阻抑T细胞功能,这已归因于Lck抑制。
如以上所讨论的,本发明人已经证明,本文所述的肽增加Lck活性(如表3至10和图1所示),并且增加Lck在Y394处的磷酸化(如图2所示),以及增加CD4+ T细胞的增殖(图17)和CD8+ T细胞的增殖(图35)。
因此,癌症疗法可受益于与免疫增强药物(诸如细菌超抗原)的组合治疗。然而,细菌超抗原是一类引起T细胞非特异性活化和大量细胞因子释放,从而导致包括中毒性休克和多器官衰竭在内的严重的威胁生命的症状的抗原。葡萄球菌肠毒素A(SEA)在临床环境中令人担忧,因为它是与抗生素相关的腹泻的常见原因。尽管SEA引起了潜在的发病率,但鉴于Lck受SEA活化(Wang G等人,BioMed Research International,2014,2014:文章编号682010)并且先前缺乏选择性Lck活化剂,有人提出将SEA用于预防慢性髓系白血病中伊马替尼介导的T细胞免疫抑制。
这些报道突出了Lck对于T细胞发育和活化以及因此对于适应性免疫反应的重要性(Stirnweiss A等人,2013,Sci Signal,6(263):ra13.Doi:10.1126/scisignal.2003607)。树突细胞(DC)介导的Lck活化导致“TCR许可”,这一过程极大地提高了TCR对同源肽-MHC II类抗原复合物的反应的敏感性和幅度(Meraner P等人,2007,JImmunol,178(4):2262-2271)。然而,例如伊马替尼通过抑制Lck活性来降低TCR诱导的增殖和活化(Seggewiss R等人,2005,Blood,105:2473-2479)。这暗示着会在干细胞移植后诱导机会性感染以及移植物抗宿主或移植物抗白血病反应(Seggewiss R等人,2005,Blood,105:2473-2479)。
许多人类疾病是由Lck基因座处的异常引起的,并且一个实例是T细胞急性淋巴母细胞性白血病(Converse PJ,2003年9月24日.Lymphocyte-specific protein-tyrosinekinase;Lck.Online Mendelian Inheritance in Man.http://www.ncbi.nlm.nih.gov/entrez/dispomim.cgi?id=153390.in)。另外,大多数与AML有关的DNA变化发生在人的一生中,而不是在出生前遗传的。这些获得性变化中的一些可能具有外部原因,如辐射或致癌的化学药品,但在大多数情况下,它们发生的原因是未知的。
在慢性感染和癌症中,T细胞暴露于持久性抗原和/或炎症信号。这种情形往往与T细胞功能的恶化:一种称为“耗竭”的状态(Wherry EJ和Kurachi M,Nature ReviewsImmunology,2015,15:486-499)相关。耗竭T细胞失去稳健的效应子功能,在信号检查点表达多种抑制性受体(诸如PD-1、LAG3、CD160或2B4),并通过改变的转录程序进行界定。然而,耗竭T细胞的复苏可以重新激发免疫力,从而为持久性感染(诸如HIV-1、丙型肝炎病毒)以及为癌症提供新的治疗靶标(Wherry和Kurachi,见上文)。
本发明人已经证明用本发明的肽处理耗竭CD4+细胞能诱导CD4+ T细胞增殖、CD25表达及TNFa和IFNg产生(图17和图18)。
因此,在一个实施方案中,本发明提供了减少T细胞耗竭的方法,所述方法包括使T细胞与包含如本文所述的Lck活化肽的组合物接触。
术语“耗竭”是指T细胞耗竭,是由于在许多慢性感染和癌症期间发生的持续TCR信号传导引起的T细胞功能障碍的状态。它与无能的区别在于,它不是通过不完全或不足的信号传导产生的,而是由持续的信号传导产生的。它由不良的效应子功能、抑制性受体的持续表达和不同于功能性效应细胞或记忆T细胞的转录状态界定。耗竭妨碍对感染和肿瘤的最佳控制。耗竭可由外在的负调节途径(例如免疫调节细胞因子)以及细胞内在的负调节(共刺激)途径(PD-1、B7-H3、B7-H4等)引起。在一个实施例中,耗竭的降低水平为至少10%,可替代地20%、30%、40%、50%、60%、70%、80%、90%。测量耗竭的方式是本领域普通技术人员已知的。
在一个实施方案中,当将与包含本文所述的Lck活化肽的组合物接触的T细胞或T细胞群体的T细胞功能水平与未与如本文所述的Lck活化肽接触的T细胞或T细胞群体的T细胞功能水平(例如对照)相比较时,或者对与包含本文所述的Lck活化肽的组合物接触前后的水平进行比较时,T细胞或T细胞群体的耗竭水平降低。
在另一个实施方案中,本发明提供了增强T细胞功能的方法,所述方法包括使T细胞与包含如本文所述的Lck活化肽的组合物接触。
如本文所用,“增强T细胞功能”意指诱导、致使或刺激T细胞具有持续或加强的生物学功能,或更新或再活化耗竭或失活的T细胞。增强T细胞功能的实例包括:CD8
如以上所讨论的,本文所述的方法可以在体内(例如受试者体内)或体外(例如离体)的细胞或细胞群体上执行。
在另一个实施方案中,本发明提供了增加T细胞的IFNg分泌的方法,所述方法包括使T细胞与包含如本文所述的Lck活化肽的组合物接触。在优选的实施方案中,T细胞是CD4+T细胞。
最初活化后,CD8+ T细胞产生大量IL-2,但随后进入短暂的不应期,在此期间它们保持一些效应子功能,但丧失了产生IL-2的能力。在这个时段期间,CD8+ T细胞依赖于CD4+T细胞提供的外部IL-2来持续增殖并恢复其全部功能(在Cox MA等人,Trends Immunol,2001,32(4):180-186中有综述)。IL-2通过由CD25(IL-2Rα)、CD122(IL-2Rβ)和γ亚基组成的三聚体受体进行信号传导。CD25在暴露于炎性细胞因子(诸如IL-12和IL-2)后上调,这些炎性细胞因子本身会调节CD25表达的量和持续时间,进而控制反应细胞接收IL-2依赖性信号的能力,从而影响T细胞效应子和记忆库的形成(Cox等人,见上文)。
CD4+ T细胞是IL-2的主要产生者,并与CD8+ T细胞协同作用以促进反应的初始扩展以及可引发保护性次级反应的持久性记忆细胞的形成。重要的是,CD4+ T细胞分泌IL-2不仅上调反应性CD8+ T细胞的CD25表达,而且还提供了IL-2的来源,从而增加了CD25
除了CD25表达在响应于慢性败血症和癌症调节效应细胞和记忆细胞功能中的重要性外,还已发现表达CD25的CD8+ T细胞是在年老时的有效记忆细胞,并且在老年人中这些细胞的积聚似乎是在年老时在缺乏原初T细胞的情况下完整免疫反应的先决条件(Herndler-Brandstetter D等人,J Immunology,2005,175:1566-1574)。这一发现提出了新疫苗接种途径的建议,该新疫苗接种途径旨在支持具有免疫能力的CD8+CD25
本发明人还已证明本文所述的肽增加人CD4+和CD8+ T细胞(图10)以及经处理的小鼠中的CD4+和CD8+ T细胞(图26、图27和图29)上的IL-12RB2表达。本文所述的肽还增加NK细胞(图11)以及经处理的小鼠中的NK细胞(图27)上的IL-12RB1/IL-12RB2表达。
在另一个实施方案中,本发明提供了增加细胞上或细胞群体中的IL-12R表达的方法,所述方法包括使细胞或细胞群体与包含如本文所述的Lck活化肽的组合物接触。
在一个实施方案中,当与包含本文所述的Lck活化肽的组合物接触的细胞或细胞群体上的IL-12R表达水平与未与如本文所述的Lck活化肽接触的细胞或细胞群体上的IL-12R水平(例如对照)比较增加时,或者对与包含本文所述的Lck活化肽的组合物接触前后的水平进行比较时,细胞或细胞群体上的IL-12R表达水平增加。
在另一个实施方案中,本发明提供了增加细胞的IL-12反应性的方法,所述方法包括使细胞或细胞群体与包含如本文所述的Lck活化肽的组合物接触。
在一个实施方案中,当将与包含本文所述的Lck活化肽的组合物接触的细胞或细胞群体对IL-12的反应性水平与未与如本文所述的Lck活化肽接触的细胞或细胞群体对IL-12的反应性水平(例如对照)相比较时,或者对与包含本文所述的Lck活化肽的组合物接触前后的水平进行比较时,细胞或细胞群体对IL-12的反应性水平增加。
在优选的实施方案中,所述细胞是CD4+ T细胞、CD8+ T细胞或NK细胞。
如以上所讨论的,本文所述的方法可以在体内(例如受试者体内)或体外(例如离体)的细胞或细胞群体上执行。
在慢性病毒感染或荷瘤状态期间,由于反应性抗原特异性T细胞的效应子功能和增殖能力的逐步损伤,T细胞的记忆形成和功能发生实质性改变,所述逐步损伤最终影响赋予宿主保护作用的能力(Jin H-T等人,BMB Reports,2011,44(4):217-231)。在肿瘤环境中,CD8+肿瘤浸润淋巴细胞(TIL)显示低水平的CD25(IL-2Rα)表达,因此对IL-2信号传导不应,表明它们无法增殖、产生效应细胞因子并且无法分化为功能性忆记细胞(Mumprecht S等人,Blood,2009,114:1528-1536)。例如,在逆转录病毒诱导的鼠CML模型中,CML特异性CD8+ T细胞表现出效应细胞因子(诸如IFN-γ、TNFα和IL-2)的产生减少(Mumprecht等人,见上文)。
本发明人已经证明用本发明的肽处理耗竭CD4+细胞可诱导CD4+ T细胞增殖、CD25表达及TNFa和IFNg产生(图17和图18),以及来自经处理的小鼠的脾细胞的IFNg产生(图27)。
CD25表达与NK细胞的细胞毒活性呈正相关。本发明人已经证明Lck活化多肽IK14004会增加Lewis肺癌小鼠的脾细胞中NK细胞上的CD25相对表达(图28)。
因此,在一个实施方案中,本发明提供了增强细胞毒性细胞功能的方法,所述方法包括使细胞毒性细胞或细胞毒性细胞群体与如本文所述的Lck活化肽接触。
在一个实施方案中,当与如本文所述的Lck活化肽接触的细胞或细胞群体的细胞毒性细胞功能水平与未与如本文所述的Lck活化肽接触的细胞或细胞群体的细胞毒性细胞功能水平(例如对照)比较增加时,或者对与包含本文所述的Lck活化肽的组合物接触前后的水平进行比较时,细胞或细胞群体的细胞毒性细胞功能水平增强。
在另一个实施方案中,本发明提供了增强T细胞功能的方法,所述方法包括使T细胞或T细胞群体与包含如本文所述的Lck活化肽的组合物接触。
如本文所用,“增强T细胞功能”意指诱导、致使或刺激T细胞具有持续或加强的生物学功能,或更新或再活化耗竭或失活的T细胞。增强T细胞功能的实例包括:CD8
在一个实施方案中,当与如本文所述的Lck活化肽接触的细胞或细胞群体的T细胞功能水平与未与如本文所述的Lck活化肽接触的细胞或细胞群体的T细胞功能水平(例如对照)比较增加时,或者对与包含本文所述的Lck活化肽的组合物接触前后的水平进行比较时,细胞或细胞群体的T细胞功能水平增强。
本文讨论了示例性的细胞毒性细胞功能和T细胞功能。本文所述的肽增加CD4+ T细胞的增殖(图17)和CD8+ T细胞的扩增(图35),以及经处理的小鼠中的NK细胞增殖(图28)。
CD40L介导的CD4+ T细胞对树突细胞的许可对于产生强大的CD8+反应是必需的。本发明人已经证明本文所述的肽增加CD4+ T细胞上的CD40L表达(图12和图13)。
因此,在一个实施方案中,本发明提供了增加T细胞上的CD40L表达的方法,所述方法包括使T细胞与包含如本文所述的Lck活化肽的组合物接触。
在另一个实施方案中,本发明提供了增加CD8+ T细胞反应的方法,所述方法包括使CD4+ T细胞与包含如本文所述的Lck活化肽的组合物接触。
因此,在一个实施方案中,本发明提供了减少T细胞耗竭的方法,所述方法包括使T细胞与包含如本文所述的Lck活化肽的组合物接触。
在另一个实施方案中,本发明提供了增加T细胞的TNFa分泌的方法,所述方法包括使T细胞与包含如本文所述的Lck活化肽的组合物接触。
如以上所讨论的,本文所述的方法可以在体内(例如受试者体内)或体外(例如离体)的细胞或细胞群体上执行。
在清除抗原和/或炎症的急性感染情况下,效应CD8+ T细胞进一步分化为功能性记忆CD8+ T细胞,其可以产生多种细胞因子(IFN-γ、TNFα和IL-2)并在继发感染后产生强大的回忆反应。相比之下,在慢性感染期间,抗原和炎症在效应阶段后持续存在。随着感染的持续和T细胞刺激的持续,T细胞以分层的方式丧失效应子功能并变得耗竭。通常,诸如IL-2产生和细胞因子多功能性等功能以及高增殖能力在早期丧失。接下来是IFN-γ和TNFα产生中的缺陷。T细胞耗竭还伴有上面所指出的抑制性受体的量和多样性的逐渐增加,这些抑制性受体在与它们各自的配体结合后会导致T细胞功能失调。
鉴于多种抑制性受体的共表达是T细胞耗竭的主要特征,已证明同时靶向这些受体会导致T细胞耗竭的协同逆转(Wherry和Kurachi,见上文)。例如,在慢性LCMV感染中,同时阻断小鼠的IL-10和程序性死亡受体1(PD-1)途径导致CD8+ T细胞耗竭的协同逆转并增强病毒控制,如同将IL-2治疗与阻断PD-1途径相结合一样(Wherry和Kurachi,见上文)。另外,在LCMV小鼠模型中,已经证实在LMCV感染后,具有CD25功能的CD8
另一种抑制性受体CTLA-4在慢性HIV感染中在CD4+ T细胞中选择性上调,但在CD8+ T细胞中不上调,这与T细胞响应于病毒抗原产生IL-2的能力下降有关,表明可逆性免疫调节途径与CD4+ T细胞功能异常选择性相关(Kaufmann DE等人,Nature Immunology,2007,8:1246-1254)。T细胞功能的分级丧失与抗原暴露的持续时间、炎症以及抑制性分子(PD-1、CD160、2B4)表达增加相关(Wherry J等人,Nature Immunology,2011)。继而,CD4
T细胞耗竭很可能是慢性HIV感染期间病原体清除失败的重要因素,并且部分受到负面调节途径的调节(在Porichis F和Kaufamm DE,Curr Opin HIV AIDS,2011,6(3):174-180中有综述)。例如,在感染了HIV的受试者中,CD4+ T细胞而不是CD8+ T细胞中的CTLA-4抑制性免疫调节受体以及程序性细胞死亡受体-1(PD-1)上调(Kaufmann DE等人,NatureImmunol,2007,8:1264-1254)。这与CD4
因此,在高抗原水平的情况下阻抑HIV特异性CD4+ T细胞的增殖可能是限制病毒特异性CD4+ T细胞的前体频率的机制(McNeil AC等人,PNAS USA,2001,98:13878—3883)。而且,用PD-L1封闭性抗体阻断PD-1途径会增加HIV特异性CD4
但是,不仅CD4+ T细胞在随后的抗原攻击后变得耗竭且无效,而且CD8
T细胞耗竭的另一种表型标志是CD8+ T细胞上的Tim-3表达,这提示了同时靶向Tim-3和PD-1可能是克服慢性病毒感染中CD8 T细胞功能障碍最有效的方式(Jin HT等人,PNAS USA,2010,107(33):14733-8)。而且,最近的文献报道强调了Lck相对于Tim-3在CD8+T细胞耗竭中的潜在重要性。例如,半乳糖凝集素-9(一种Tim-3的生理配体)与受体磷酸酶CD45结合,磷酸酶CD45,当以高水平存在时,会使Lck上的Y394去磷酸化,从而降低Lck活性(Clayton KL等人,J Immunol,2014,192(2):782-791)。
此外,半乳糖凝集素-9能够增加CD3信号传导筏内Tim-3以及CD45的水平,并且已提出突触处这种磷酸酶的高浓度是借此对Lck进行负调节,导致TCR信号传导减弱的方式(Clayton KL等人,J Immunol,2014,192(2):782-791)。另外,对通过TCR与抗CD3/CD28的扎结而活化的T细胞的细胞裂解物的分析导致Lck募集至Tim-3,并且还提出Tim-3螯合Lck会耗尽细胞内Lck库,从而通过禁止TCR链上ITAM基序的磷酸化而导致TCR不完全活化(Tomkowicz B等人,Plos One,2015,10(10):e0140694(doi:10.1371/journal.pone.0140694)。
在癌症中,现在很清楚的是,肿瘤会选择某些免疫检查点途径作为免疫抗性的主要机制,尤其是针对对肿瘤抗原具有特异性的T细胞,并且用细胞毒性T淋巴细胞相关抗原4(CTLA-4)和程序性细胞死亡蛋白1(PD-1)的抗体阻断剂进行的临床试验已经证明抗肿瘤免疫力随产生持久临床反应的潜力而增强(Pardoll DM,Nature Reviews Cancer,2012,12:252-264)。
即使CTLA-4由活化的CD8+效应T细胞表达,CTLA-4的主要生理作用似乎也会凭借对CD4+ T细胞的两个主要子集的不同作用:下调辅助T细胞活性和增强调节性T(Treg)细胞免疫抑制活性(在Pardoll中有综述,见上文)。然而,在癌症免疫疗法中阻断PD-1途径也可通过减少肿瘤内Treg细胞的数量和/或阻抑活性来增强免疫反应(Pardoll,见上文)。而且,PD-1阻断不仅增强组织和肿瘤微环境中效应T细胞的活性,而且还可能通过对PD-1B细胞的直接作用来增强肿瘤中的自然杀伤细胞活性和抗体的产生(Pardoll,见上文)。在癌症中,表达的主要PD-1配体为PD-L1,并且在几乎所有癌症类型中都发现了PD-L1的高表达(Pardoll,见上文)。因此,将单独或组合靶向一个或多个抑制性检查点的治疗视为拥有系统性控制癌症的巨大潜力(Allison JP,JAMA,2015,314(11):1113-1114;Creelan BC,cancer Control,2014,21(1):80-9)。
本发明人已经证明,本文所述的Lck活化多肽可以在检查点抑制剂PD-L1存在的情况下挽救IL-2分泌(图16)。
因此,在一个实施方案中,本发明提供了治疗或预防受试者的癌症的方法,所述方法包括向受试者施用包含如本文所述的Lck活化肽的组合物。在另一个实施方案中,本发明提供了治疗或预防受试者的癌症的方法,所述方法包括将包含如本文所述的Lck活化肽的组合物与检查点抑制剂依序或同时施用给所述受试者。
在本文中提到了示例性癌症。
在另一个实施方案中,本发明提供了在受试者中激活免疫反应的方法,所述方法包括向所述受试者施用包含如本文所述的Lck活化肽的组合物。
本发明人还已证明本文所述的Lck活化多肽降低Treg细胞的比例,并且与抗PD1抗体协同作用(图9)。
因此,在一个实施方案中,本发明提供了降低细胞群体中的Treg细胞比例的方法,所述方法包括使含Treg的细胞群体与包含如本文所述的Lck活化肽的组合物接触。
在一个实施方案中,本发明提供了降低受试者中的Treg细胞比例的方法,所述方法包括向所述受试者施用包含如本文所述的Lck活化肽的组合物。
在另一个实施方案中,本发明提供了降低受试者中的免疫抑制的方法,所述方法包括向所述受试者施用包含如本文所述的Lck活化肽的组合物。
PD-1靶向疗法对耗竭CD8+ T细胞的挽救是CD28依赖性的。本发明人已经证明本文所述的Lck活化多肽增加CD4+和CD8+ T细胞中的CD28表达。
因此,在一个实施方案中,本发明提供了减少受试者中的T细胞耗竭的方法,所述方法包括向受试者施用包含如本文所述的Lck活化肽的组合物。在另一个实施方案中,将包含如本文所述的Lck活化肽的组合物与检查点抑制剂依序或同时施用。
细胞免疫力下降与许多癌症以及前列腺素E2(PGE2)水平升高相关。已经证实,霍奇金淋巴瘤中的CD4+细胞表现出与在体外被来自健康个体的T细胞中PGE2改变的基因的相似的调节作用,所述调节作用包括使Lck失活以及使ZAP70磷酸化降低。(Chemnitz JM等人,Cancer Research,2006,66:1114)。
在霍奇金淋巴瘤和其它肿瘤中,由于CD4+ T细胞活化受损,细胞免疫力降低,并且有人提出,与霍奇金淋巴瘤相关的PGE2水平升高会通过使Lck失活而抑制CD4+ T细胞功能(Chemnitz JM等人,2006,Cancer Res,66(2),
阿糖胞苷是用于治疗急性骨髓性白血病的最有效的化学治疗剂之一(Frei E等人,Cancer Res,1969,29:1325-1332)。引发细胞分裂需要具有细胞周期蛋白A和B及p34cdc2活性的丝氨酸/苏氨酸激酶p34cdc2激酶复合物。因此,p34cdc2代表监测DNA合成的完成和DNA损伤的存在的有丝分裂检查点(Nurse P,Nature,1990,344:503-507)。然而,虽然DNA复制的状态依赖于p34cdc2的丝氨酸/苏氨酸活性,但是这是由体内Tyr15上p34cdc2的磷酸化来调节的(Atherton-Fessler S等人,Mol Cell Biol,1993,13:1675-1685),并且已经证实p34cdc2的丝氨酸/苏氨酸活性会受到p34cdc2催化亚基中的Tyr15磷酸化抑制(Gould K和Nurse P,Nature,1989,342:39-44)。已经证实Lck激酶使p34cdc2的Tyr15磷酸化(Draetta G等人,Nature,1988,336:738-744),揭示了Lck活化剂在白血病和其它实体癌的治疗中的潜在作用。
先前已经描述了通过用唑来膦酸盐和IL-2的组合离体或在体内刺激外周血淋巴细胞来靶向γ/δT淋巴细胞进行癌症免疫疗法(Gomes AQ等人,Cancer Res,2010,doi:10.1158/0008-5472.CAN-10-3236;Dieli F等人,Cancer Res,2007,67(15):7450-7;Wilhelm M等人,Blood,2003,102(1):200-6),并且如本文所述的Lck活化剂可以用作IL-2的替代用于离体产生γ/δT细胞,并且可以应用于针对患有恶性肿瘤(范围从乳腺癌、前列腺癌到淋巴样恶性肿瘤)的患者的治疗性施用(Dieli F等人,见上文;Wilhem M等人,见上文;Capietto AH等人,J Immunol,2011,187(2):1031-8)。另外,已经证实在包括利妥昔单抗(rituximab)和曲妥珠单抗(trastuzumab)的组合方案中γ/δT细胞对肿瘤细胞的细胞毒性会增强(Tokuyama H等人,Int J Cancer,2008,122(11):2526-343;Capietto AH,见上文),并且本发明扩展到如本文所述的Lck活化剂与如上所述的抗癌药和/或用于治疗根据本发明的癌症或其它疾病或病状的其它药物在组合治疗中的用途。
本发明人已证明本文所述的Lck活化肽;
·当腹膜内或口服施用时,减少肺转移(图22);
·减小Lewis肺癌(LCC)模型中的肿瘤面积(图23);
·在Lewis肺癌模型中,减小异种移植肿瘤的体积和肿瘤细胞的存活能力,并增加肿瘤中CD45+细胞的比例(图24);
·增加从经肽治疗的Lewis肺癌小鼠中取出的脾细胞在TCR刺激后的IFNg和IL-2释放(图25);
·增加TCR刺激从经肽治疗的Lewis肺癌小鼠中取出的脾细胞后,表达IL-12Rβ1和IL-12Rβ2的CD4+ T细胞的比例(图26);
·增加来自于经肽治疗的Lewis肺癌小鼠的脾细胞单细胞悬液(未活化)中的IL-12RB2表达(图27);
·增加来自于经肽治疗的Lewis肺癌小鼠的脾细胞中NK细胞上的CD25(IL-2Rα)、CD215(IL-15R)、CD28和Ki67的表达(图28);以及
·增加在TCR刺激的存在下,来自于经肽治疗的Lewis肺癌小鼠的CD4+ T细胞上的IL-12RB2表达(图29)
因此,在一个实施方案中,本发明提供了治疗受试者的肺癌的方法,所述方法包括向受试者施用包含如本文所述的Lck活化肽的组合物。
因此,在一个实施方案中,本发明提供了预防受试者的肺癌的方法,所述方法包括向受试者施用包含如本文所述的Lck活化肽的组合物。
使IL-2和IL-12同时靶向霍奇金淋巴瘤会增强静息NK细胞的活化和肿瘤细胞的溶解(Hombach A等人,Int J Cancer,2005,doi.org/10.1002/ijc.20829)。本发明人已经证明本文所述的Lck活化肽增加CD8+ T细胞和NK细胞中CD107a(脱粒标志物)的表达(图33),以及NK细胞上NKp44和NKG2D的表达(图21);NKp44和NKG2D是参与细胞裂解的活化受体。
本发明人还已证明本文所述的肽增加人CD4+和CD8+ T细胞(图10)以及经处理的小鼠中的CD4+和CD8+ T细胞(图26、图27和图29)上的IL-12RB2表达。本文所述的肽还增加NK细胞(图11)以及经处理的小鼠中的NK细胞(图27)上的IL-12RB1/IL-12RB2表达。本发明人还证明本文所述的Lck活化肽增加包括CD4+和CD8+ T细胞(图17、图19)在内的T细胞(图3)上的IL-2Ra(CD25)表达。
在急性髓系白血病中,T细胞功能紊乱的多个方面在诊断时都起作用,其中耗竭和衰老为主要过程(Knaus HA等人,JCI Insight,2018,doi:10.1172/jci.insight.120974)。实际上,患有急性和慢性白血病的患者中的T细胞表达耗竭标志物,诸如PD-1或TIM-3,并且反应不良,例如,增殖受损以及IL-2和IFNg的产生减少(Siska PJ等人,Blood,2014,124:4121)。本发明人已经证明用本发明的肽处理耗竭CD4+细胞能诱导CD4+ T细胞增殖、CD25表达及TNFa和IFNg产生(图17和图18)。
本发明人还证明了本文所述的肽增加人T细胞的IL-2分泌(图14、图15、图37、图38、图40)。
多发性骨髓瘤(MM)是一种以恶性浆细胞的克隆增殖为特征的进行性B系赘生物。多发性骨髓瘤中的T细胞在肿瘤部位也显示出耗竭和衰老的特征,MM患者中T细胞亚群的数量和功能异常;例如,CD4:CD8比率倒置,CD4细胞中辅助T细胞1型与2型(Th1:Th2)的比率异常,T细胞活化所需的CD28表达水平在T细胞中下调,并且来自MM患者的循环树突细胞功能异常(在Sharabi A和Haran-Ghera N,Bone Marrow Res,2011,文章编号269519中有综述)。本发明人已经证明本文所述的Lck活化肽增加CD8+和CD4+ T细胞上的CD28表达(图20)。
重要的是,在抗原刺激之前用本文所述的Lck活化肽预处理细胞能增加人T细胞的IL-2分泌(例如参见图34)。
因此,本发明提供了方法和用途,其中例如在疾病症状发作之前,在抗原刺激之前,在暴露于病原体之前等,防治性地施用如本文所述的Lck活化肽。
在另一方面,本发明提供了增强无疾病或病症的个体的免疫功能的方法,所述方法包括向受试者施用有效量的如本文所述的Lck活化肽。
另外,来自骨髓瘤肿瘤部位的CD8+ T细胞在CD3/CD28体外刺激后无法产生IFNg,并且显示出响应于T细胞刺激脱粒的能力的降低(Zelle-Rieser C等人,J Haematology&Oncology,2016,doi.org/10.1186/s13045-016-0345-30)。MM中免疫反应受损因MM患者的外周血中功能活性免疫抑制性Treg的增加而进一步加重(在Dosani T等人,Blood CancerJournal,2015,5:e306中有综述)。
本发明人还已证明本文所述的Lck活化多肽降低免疫抑制性Treg细胞的比例(图8和图9)。
肿瘤浸润淋巴细胞中Foxp3+ Treg细胞的存在与各种类型的人类癌症的不良预后相关。本发明人已证明本文所述的Lck活化多肽减少Foxp3+ Treg细胞(图8和图9)。
因此,本发明提供了降低细胞群体中的Fop3+ Treg细胞的比例的方法,所述方法包括使细胞群体与包含如本文所述的Lck活化肽的组合物接触。
IL-21抑制免疫抑制性Treg。本发明人已经证明本文所述的Lck活化多肽增加T细胞的IL-21产生(图7)。
重要的是,当Lck活化多肽RSKAKNPLYR-(2Adod)
因此,本文所述的Lck活化肽可用于增强降低本文所述的Treg细胞比例的生理作用。
在一个实施方案中,本发明提供了降低细胞群体中的Treg细胞比例的方法,所述方法包括使含Treg的细胞群体与包含如本文所述的Lck活化肽的组合物接触。
在一个实施方案中,所述Treg细胞为Foxp3+ Treg细胞。
在一个实施方案中,当与包含本文所述的Lck活化肽的组合物接触的细胞群体中的Treg比例与未与本文所述的Lck活化肽接触的细胞群体中的Treg比例(例如对照)比较降低时,或者对与包含本文所述的Lck活化肽的组合物接触前后进行比较时,细胞群体中的Treg比例降低。
阿尔茨海默氏病是痴呆症的主要原因,其特征在于神经元的变性和损失以及老年斑和神经原纤维缠结的形成。
最近有报道称,PD-1/PD-L1途径检查点抑制剂通过触发脑部中单核细胞来源的巨噬细胞群体的IFNγ依赖性增加,从而引起脑淀粉样蛋白的清除和认知缺陷的改善,从而改善转基因小鼠模型的AD(Baruch K等人,Nature Med,2016,22:135-37)。如本文所述,在至少一些实施方案中,本发明中利用的化合物可以挽救受到PD-1/PD-L1相互作用抑制的免疫反应。
进一步地,Lck参与神经突增生的调节,并且临床报告描述了AD患者海马中Lck的水平下调(Hata R等人,BBRC,2001,284:310-316)。实际上,人Lck基因已定位于阿尔茨海默氏病相关的遗传连锁区域1p34-36中(Blacker D等人,Hum Mol Genet,2003,12:23-32)。对哺乳动物脑部中的Lck的最新体外和体内功能表征进一步表明,Lck是记忆的获得和维持的关键介体,而记忆的获得和维持是AD中受损最明显的过程(Kim E-J等人,Cell Mol LifeSci,2012,doi:10.1007/s00018-102-1168-1)。
本发明人已经证明,本文所述的Lck活化多肽可以在检查点抑制剂PD-L1存在的情况下挽救IL-2分泌(图16)。
尽管Lck与CD4和CD8两者都缔合,但是当Lck与CD4缔合时,它的活性更高(DelvesPJ和Roitt IM编辑,1998.Encyclopaedia of Immunology,第二版,San Diego:AcademicPress)。HIV的特征在于CD4+细胞耗竭,并且缺乏Nef的HIV毒株不会进展为AIDS(OlszewskiA等人,2004,PNAS.USA,101(39):http://www.pnas.org/cgi/content/full/101/39/14079)。Lck在HIV感染中的重要作用已得到公认。例如,表达非活性Lck的细胞显示出加速的病毒复制,而表达具有正常或升高的酶活性的Lck的细胞显示出与初始内源性Lck酶活性成比例的病毒复制延迟(Yousefi S等人,2003,Clinical&Experimental Immunology,133(1):78-90)。
Nef基因是灵长类慢病毒(人类免疫缺陷病毒1型)HIV-1)、HIV-2和猿猴免疫缺陷病毒(SIV)特有的,并且编码大约25Kd的肉豆蔻酰化膜相关蛋白(Greenway AL等人,1999,JVirol.,73(7):6152-6158)。在细胞水平上,Nef会降低包括CD4、白细胞介素-2受体、I类MHC在内的细胞表面受体的水平,干扰T细胞信号传导,并损害特定细胞因子的产生(在Greenway AL等人,1999(见上文)中有综述)。
Nef与T细胞限制性Lck酪氨酸激酶(淋巴细胞蛋白酪氨酸激酶)直接相互作用,并降低在体外和完整细胞中的Lck激酶活性,从而导致近端和远端Lck介导的信号传导事件受损(Collette Y等人,1996,JBC,271:6333-6341。Lck与Nef的结合不需要其它病毒体或细胞蛋白,因为已证实Lck催化活性的抑制会因纯化的Lck与HIV-1Nef或SIV蛋白之间的结合而出现,说明了Nef介导的发病机理的复杂性。
具体地,Nef与Lck的SH3结构域结合,导致Lck催化活性的抑制(Collette Y等人,1996,JBC,271:6333-6341;Greenway A等人,1996,J Virol,70(10):6701-6708;GreenwayAL等人,1999,J Virol,73(7):6152-6158),并且Lck活化剂的开发可以补充抗逆转录病毒治疗剂的开发。
Lck是T细胞中白细胞介素-2(IL-2)刺激后活化的唯一Src家族激酶(BrockdorffJ等人,2000,Eur Cytokine Netw.,11(2):225-231),尽管早期研究表明在HIV感染患者中的IL-2疗法与单独使用抗逆转录病毒疗法相比,没有增加临床益处,但是观察到CD4+细胞计数持续大量增加(The INSIGHT-ESPRIT Study Group and SILCAAT ScientificCommittee,N Eng J Med,2009,361:1548-1559)。然而,最近的数据表明,在未来的HIV疫苗研究设计中应考虑将IL-2作为佐剂与HIV DNA或蛋白质疫苗一起施用(Baden LR等人,2011,J Infect Dis,204(10):1541-1549),并且事实上IL-2确实会抑制一些受感染的细胞系中的HIV-1复制(Raphael MO等人,2013,JBC,doi:10.1074/jbc.M113.468975)。
这些报道突出了Lck对于T细胞发育和活化以及因此对于适应性免疫反应的重要性(Stirnweiss A等人,2013,Sci Signal,6(263):ra13.Doi:10.1126/scisignal.2003607)。
重要的是,本发明人已经证明本文所述的Lck活化肽(RSKAKNPLYR-(2Adod)
本发明人还已证明本文所述的Lck活化肽(RSKAKNPLYR-(2Adod)
因此,在一个实施方案中,本发明提供了治疗受试者的HIV感染的方法,所述方法包括向受试者施用包含如本文所述的Lck活化肽的组合物。
抵抗由病毒、细菌、原生动物和寄生虫引起的感染的充分的免疫反应可能会因为缺乏特异性激酶活性、促进微生物复制并进入细胞中以及/或者抑制有效的免疫反应而受到损害。
例如,许多细菌性病原体与宿主细胞密切相关。虽然一些仍附着在细胞表面,但其它却被内化。肠粘膜内的γ/δ上皮内T细胞可以通过与邻近上皮细胞的串扰来检测入侵细菌的存在,并且是通过肠道菌群维持体内平衡的免疫防御体系的重要组成部分(Ismail AS等人,PNAS,2011,108:8743-8748)。
细菌入侵后能够在细胞内建立其生命周期的高度保守的进化手段是通过细菌产生的UDP糖水解酶。这些是具有UDP糖水解酶活性和5种主要核苷酸酶活性的双功能酶。例如,大肠杆菌可以产生UDP糖水解酶,其产物显著抑制Lck活性(Berger SA等人,JBC,1996,271:23431-23437)。具体地,在大肠杆菌感染HeLa细胞之后,这种相对非特异性的核苷酸酶导致腺苷积聚,腺苷积聚是造成Lck抑制的直接原因。而且,已经证实,UDP糖水解酶的过表达一旦进入HeLa细胞中便能提高细菌存活率。细胞内ATP的损失并不是Lck抑制的原因,而是ADP、AMP和腺苷的积聚是导致Lck抑制的原因(Berger等人,见上文),并且那些研究人员已经提出,在感染情形下,其它病原体也可能采用这种酶。实际上,白色念珠菌(CandidaAlbicans)培养物含有腺苷,腺苷已被证实是抑制中性粒细胞功能的原因(Smail EH等人,JImmunol,1992,148:3588-3595)。
弗氏志贺菌是细菌性痢疾的致病物,已被证实能在体外入侵活化的CD4+ T细胞,抑制T细胞向趋化性刺激迁移,并且还能损害体内适应性免疫力引发部位(即淋巴结)内的T细胞动力学,从而防止诱导对细菌的有效免疫反应(在Nothelfer K等人,J Exp Med,2014,211(6):1215;Salgado-Pabon W等人,PNAS,2013,110:4458-4463中有综述)。而且,在志贺氏菌病的小鼠模型中,用Unc119治疗会抑制志贺氏菌感染(Vepachedu R等人,PLOS one,2009,doi:10.1371/journal.pone.0005211)。相反,Unc119敲低被证实能增强细菌的入侵和致死性。同样,据报道,在Unc119敲低后,牛结核分枝杆菌(Mycobacterium bovis)BCG感染THP-1细胞的感染性增强,表明Unc119的作用对志贺氏菌无特异性(Vepachedu等人,见上文)。Unc119的抑制作用归因于它与Abl家族激酶的相互作用,而不是尚未进行研究的Src家族激酶的介导。进一步地,发现Unc119敲低使所用细胞系中的志贺氏菌感染加倍。据信,在本发明之前,选择性的Lck活化剂先前尚未被描述。(Bae O-N等人,J.Neuroscience,2012,32(21):7278-7286)。尽管最近报道的数据表明Unc119能活化T细胞中的Lck,但已证实Unc119及其SH3肽基序不仅能活化Lck,而且能活化Src激酶家族内的Hck、Lyn和Fyn激酶成员(Cen O等人,JBC,2003,278:8837-8845;Gorska MM等人,J Exp Med,2004,199(3):369-379)。因此,如本文所述的Lck活化剂可以充当替代性抗生素或充当传统抗生素疗法的补充疗法,并且本发明扩展到所有此类用途。
疟疾是由感染肝细胞和红细胞的疟原虫物种引起的非常普遍的疾病。CD4+ T细胞防御慢性血液期疟疾(blood-stage malaria),而CD8+ T细胞的耗竭则会延迟寄生虫的清除,暗示着这些细胞对慢性疾病具有防御作用(在Wykes MN等人,Cell Reports,2013,5:1204-1213有综述)。而且,正如通过程序性细胞死亡-1受体(PD-1)进行的信号传导被认为会“耗竭”HIV特异性CD4+和CD8+ T细胞一样,PD-1已被证实能介导疟原虫特异性CD8+ T细胞的损失和耗竭并且在较小程度上介导CD4+ T细胞的功能的损失和耗竭(Wykes等人,见上文)。重要的是,最近在PD-1基因敲除小鼠中已经证明CD8+ T细胞增强的IFNγ分泌与对疟疾感染的防御有关,这导致了未来的疟疾疫苗考虑加强CD8+ T细胞反应性的提议(WykesMN等人,Scientific Reports,2016,6:26210)。如本文所述,在至少一些实施方案中,根据本发明的方法利用的化合物可以增强例如耗竭的鼠类CD4+ T细胞、人外周血单核细胞以及例如表达CD8+的Jurkat细胞中的IFNγ分泌,从而进一步表明了在疟疾治疗中的作用,并且如本文针对这所描述的化合物的用途明确地被本发明所涵盖。
嗜T-淋巴细胞病毒,例如疱疹病毒,是本发明实施的Lck活化剂和方法的特定靶标,这是由于例如,松鼠猴疱疹病毒酪氨酸激酶相互作用蛋白(Tip)与Lck发生物理相互作用并抑制稳定表达的细胞系中的Lck活性(Isakov N和Biesinger B,Eur J Biochem,2000,267(12):3413-21)。
进一步地,以埃博拉病毒(Ebolavirus)属和马尔堡病毒(Marburgvirus)属为代表的丝状病毒,在人类和非人灵长类动物中引起致命性出血热。该病毒通过减少B淋巴细胞和T淋巴细胞的数量来攻击免疫系统。B细胞和T细胞(诸如CD4和CD8淋巴细胞)是产生作为免疫调节因子的细胞因子所必需的,并且已经证实,几天内死亡的患者的B细胞和T细胞数量由于凋亡而减少。T细胞需要被活化才能破坏受病毒感染的细胞(Wauquier N等人,PublicLibrary of Science,2010,4(10):837-847),并且已经证实人外周血单核细胞暴露于失活的扎伊尔型埃博拉病毒会导致IL-2的产生减少(Yaddanapudi K等人,The FASEB journal,2006,20:2519-2530)。因此,如本文所述的Lck活化剂的使用可应用于刺激针对这些疾病的T细胞活化和IL-2产生。
而且,如本文所述的Lck活化剂的使用还可在其它感染诸如结核中起作用。例如,大多数个体需要CD4+和CD8+ T细胞来控制结核分枝杆菌(MTB),但无法根除MTB。MTB用于逃避CD4+ T细胞识别的分子机制是通过糖脂ManLAM(其是MTB壁中最丰富的糖脂之一)进行信号传导,糖脂ManLAM通过抑制Lck磷酸化而不是Tyr 505的磷酸化来干扰TCR信号传导(Mahon RN等人,2012,Cell Immunol.275(1-2):98-105;Mahon RN III,PhDDissertation,2010,http://rave.ohiolink.edu/etdc/view?acc num=case1275668686)。
已知IL12RB1对于人类抵抗结核分枝杆菌感染是必不可少的。本发明人已经证明本文所述的Lck活化肽诱导NK细胞中的IL12RB1表达。
因此,在一个实施方案中,本发明提供了治疗受试者的结核分支杆菌的方法,所述方法包括向受试者施用包含如本文所述的Lck活化肽的组合物。
可以根据本发明通过上调Lck活性来抑制或治疗的其它感染包括鼠疫和肝炎病毒(例如,乙型肝炎病毒和丙型肝炎病毒)。乙型肝炎是导致肝损伤和炎症的最普遍的病毒,并且与丙型肝炎病毒一样,与T细胞耗竭相关(Ye B等人,Cell Death&Disease,2015,6,e1694)。鼠疫耶尔森氏菌病的病因的关键毒力因子是酪氨酸磷酸酶YopH。该细菌将YopH注入到宿主细胞中,并且已证实在含有活性YopH的细胞中,Lck在其正调节位点Tyr 394处去磷酸化。通过关闭Lck,YopH在其第一步就阻断了T细胞抗原受体的信号传导,有效地防止了针对这种致死性疾病的保护性免疫反应的发展(Alonso A等人,2003,JBC,279:4922-4928)。在丙型肝炎中,丙型肝炎病毒核心蛋白与T细胞结合并抑制Lck活化,表明该核心蛋白抑制T细胞活化的极早期事件(Yao SQ等人,2004,J Virol,78(12):6409-6419)。
自1973年以来,就对一般感染、术后感染或甚至癌症复发的易感性而言,输血的危害就已为人所知,最近的荟萃分析再次证实了红细胞输注后这种与健康相关的感染的风险(Rhode JM等人,JAMA,2014,311(13):1317-1326;Blumberg N等人,Transfusion,2007,47(4):573-81;Fergusson D等人,Can J Anaesth,2004,51(5):417-24)。虽然提出的输血诱导的免疫调节机制仍尚不清楚,但认为起作用的有文件记载的变化包括CD4/CD8比率降低和IL-2分泌降低(Kirkley SA,Clinical and Diagnostic Laboratory Immunology,1999,6(5):652-657)。因此,与输血联合施用Lck活化剂可以改善这些病状中的一种或多种的风险。
而且,已经证实对同基因脾细胞进行体外IL-2处理以生成淋巴因子活化的杀伤细胞能增强小鼠热损伤模型中IL-2对败血症相关死亡的预防,并且已经证实活化的Lck能在不存在抗原刺激的情况下刺激IL-2产生(Mendez MV等人,J Surg Res,1993,54(6):565-70;Luo K和Sefton BM,Mol Cell Biol,1992,12(10):4724-4732)。此外,已知前列腺素E2(PGE2)在败血症期间的T细胞抑制中起着重要作用,并且在败血症期间T细胞抑制的新生Sprague-Dawley大鼠模型中,已证实前列腺素E2(PGE2)伴有IL-2产量的减少。此类抑制用COX-2抑制剂疗法得到改善,暗示着PGE2参与该过程。鉴于此并且由于T细胞暴露于PGE2导致Lck失活和ZAP70磷酸化降低(Dallal O等人,Biol Neponate,2003,83(3):201-7;Chemnitz JM等人,Cancer Res,2006,66:1114),所以用根据本发明的Lck活化剂的治疗也可应用于通过刺激T细胞活性和刺激IL-2的产生来刺激败血症期间的免疫反应。
因此,如本文所述的Lck活化剂可广泛应用于许多应用中,尤其应用于需要活化Lck或刺激Lck活性的任何应用中。可以通过如本文所述的Lck活化剂和/或根据本发明实施的方法治疗的疾病和病状包括但不限于以Lck的表达不太理想或者Lck的抑制或者Lck或Lck活性的下调为特征的疾病和病状,与上皮内和粘膜内驻留T细胞功能异常和/或对病原性感染(例如,包括慢性感染)的应答需要T细胞活化有关的病症,由病原性感染引起的败血症(例如慢性败血症)和与输血相关的败血症,癌症以及皮肤和上皮恶性肿瘤;防治或治疗一般癌症(例如乳腺癌、结肠癌、结直肠癌和前列腺癌),包括淋巴瘤、霍奇金病和白血病;由抑制T细胞功能的疗法(例如,针对癌症和非癌症病状的疗法)引起的免疫抑制;免疫缺陷病症,包括但不限于严重的联合免疫缺陷综合征(SCID);需要CD4/CD8 T细胞存活的病状以及导致T细胞计数降低的病状或病症(例如,感染诸如肺炎、流感、疱疹感染);由病毒、细菌、真菌和寄生虫引起的病原性感染;T细胞耗竭(例如,与癌症或非癌症病状(诸如,由病原性感染引起的败血症(例如,慢性败血症))和/或与癌症或非癌症病状的治疗相关联),以及T细胞中的检查点阻断(例如,与癌症或慢性败血症相关),以及与年龄相关联的T细胞活化途径中的改变。
已知各种配体-受体相互作用有助于检查点信号传导抑制(例如,参见PardollDM,Nature Reviews Cancer,2012,12:252-264),并且在本发明的至少一些实施方案中,T细胞功能可通过抑制这些相互作用中的一种或多种(例如,PD-1/PD-L1相互作用)来恢复。因此,在至少一些实施方案中,本发明明确地扩展到施用如本文所述的Lck活化剂,以克服耗竭T细胞中的检查点阻断/T细胞信号传导抑制。
病原体和病原性感染的进一步实例包括病毒感染,诸如由以下引起的病毒感染:痘病毒、除疱疹病毒之外的其它嗜T淋巴细胞病毒、粘液病毒、呼肠孤病毒、肠病毒、柯萨奇病毒、埃可病毒、口蹄疫病毒、引起肝炎的病毒(例如甲型肝炎病毒、乙型肝炎病毒和丙型肝炎病毒)、脑炎和脉络丛脑膜炎、猿猴免疫缺陷病毒、SARS、冠状病毒、登革热病毒、流感病毒、黄热病病毒、西尼罗河病毒、腺病毒、水疱性口炎病毒、鼻病毒、人乳头瘤病毒(HPV)、呼吸道合胞病毒、人巨细胞病毒和水痘带状疱疹病毒(VZV);细菌感染,诸如由以下引起的细菌感染:除结核(例如麻风病)以外的其它分枝杆菌感染,由革兰氏阳性和革兰氏阴性细菌(诸如革兰氏阳性球菌和革兰氏阴性球菌,以及革兰氏阴性杆菌和球杆菌)、溶血性链球菌、肠球菌和产生毒素的细菌(诸如破伤风、白喉以及梭菌和肉毒梭菌)感染;原生动物感染,诸如由阿米巴病、疟疾(其致病物为恶性疟原虫(P.falciparum))、利什曼病、锥虫病、弓形虫病和贾第虫病引起的原生动物感染;以及蠕虫感染,诸如由肠道线虫、丝虫病、绦虫(cestode)(绦虫(tapeworm))和棘球绦虫感染引起的蠕虫感染。
除了如本文所述的Lck活化剂在如上所述的疾病或病状的防治或治疗中的用途以外,在本发明的其它实施方案中,根据本发明的本发明Lck活化剂可进一步应用于干细胞疗法(例如心脏干细胞疗法)、胚胎干细胞自我更新,以及胚胎干细胞(例如胚泡胚胎的胚胎干细胞)的多能性的维持,但不限于此,并且所有此类用途均明确地被本发明所涵盖。
针对难治性或晚期癌症的疫苗接种的替代方法是过继T细胞疗法(ACT),即施用离体处理的T细胞(Kaartinen T等人,Cytotherapy,2017,19(6):689-702)。此外,从鼠类研究中也已经清楚,ACT之前的离体扩增期间对T细胞的调节也是影响体内功效的关键参数(Rubinstein MP等人,Cancer Immunol Immunother,2015,64(5):539-549)。T细胞的过继转移可以在患者中介导强效的抗肿瘤和抗病毒免疫力,此类疗法可依赖于包括T细胞受体、嵌合抗原受体(CAR)或其它效应分子在内的遗传信息的转移(在Andrijauskaite K等人,Cancer Gene Ther,2015,22(7):360-367中有综述)。
白细胞介素,当在T细胞离体扩增期间掺入到培养基中时,已经成功地用于增强T细胞的功能性。例如,IL-12调节提高逆转录病毒介导的CD8+ T细胞的转导效率(Andrijauskaite K等人,见上文);已证实添加IL-21会诱导培养物中淋巴细胞的更大扩增并增加CD8+ T中央记忆细胞的产量(Zoon CK等人,Int J Mol Sci,2015,16:8744-8760);并且已经证实,用IL-21培养的CAR+ T细胞的过继转移能改善对小鼠中CD19+B细胞恶性肿瘤的控制(Singh H等人,Cancer Res,2011,71(10:3516-3527)。
在过继免疫疗法中,与用单独的IL-12或IL-18产生的T细胞相比,已证实IL-12和IL-18培养的肿瘤引流淋巴结细胞(TDLN)能更有效地根除肺转移(Li Q等人,Cancer Res,2005,65(3):1063-70)。这表明IL-12和IL-18可用于通过使抗体活化的TDLN细胞向Th1表型协同极化而产生强效的CD4+和CD8+抗肿瘤效应细胞(Li等人,见上文)。
IL-12受体表达与IL-12结合和Th1免疫反应的诱导相关。本发明人已经证明本文所述的Lck活化肽促进CD4+和CD8+ T细胞(图10)和NK细胞(图11)上的IL-12R表达。
因此,在一个实施方案中,本发明提供了在受试者中诱导Th1反应的方法,所述方法包括向所述受试者施用包含如本文所述的Lck活化肽的组合物。
可以在体外/离体扩增T细胞,以使用IL-21进行过继细胞疗法。本发明人已经证明本文所述的Lck活化肽促进CD4+和CD8+ T细胞(图4)上的IL-21R表达。本发明人还已证明本文所述的Lck活化肽促进CD8+T细胞的扩增(图35),并且在IL-2存在或不存在的情况下增加NK细胞中的IL-21R表达(图5和图6)。
具体而言,诱导多能细胞是通过被迫表达对于维持胚胎干细胞的定义属性重要的基因和因子而被基因重编程为胚胎干细胞样状态的成年细胞。只有将成年细胞编程成为干细胞后,才能诱导它们分化为所需的生殖细胞层。虽然Src家族酪氨酸激酶的成员对于人类胚胎干细胞的分化至关重要,但Lck表达水平却随着胚胎干细胞分化而急剧下降(Zhang X等人,Stem Cell Res,2014,13(3Pt A):379-389)。
白血病抑制因子(LIF)是用于小鼠胚胎和诱导多能干细胞的培养和衍生的关键外源性因子之一,并且活化“信号转导和转录活化因子3”(STAT3),其是小鼠胚胎干细胞自我更新的重要调节因子(Dang-Nguyen TQ等人,Molecular Reproduction and Development,2014,81:230)。反过来,已知STAT3通过阻止谱系特异性分化程序的活化而抑制向中胚层和内胚层谱系的分化(Graf U等人,Genes,2011,2(1):280-297)。因此,STAT3对于维持未分化的胚胎干细胞表型至关重要(Raz R等人,PNAS USA,1999,Cell Biology,96:2846-2851)。
重要的是,STAT3的活化是诱导多能性的限制因素,并且它的过表达消除了建立多能性对额外因素的需要(Yang J等人,Cell Stem Cell,2010,7(3):319-328)。因此,STAT3信号传导被认为是主要指导原初多潜能的主要重编程因子之一,因为STAT3促进了自我更新因子的表达(Li Y-Q,Cellular Reprogramming,2010,12(1):3-13)。已证实Lck会直接活化STAT3,而外源性Lck对STAT3的活化受Lck特异性抑制剂PP1减弱(Lund TC等人,CellSignal,1999,11(11):789-796)。因此,根据本发明的Lck活化剂可经由刺激Lck活性而起到上调STAT3活性的作用,因此可应用于促进和维持干细胞自我更新。
进一步地,如本文所述的Lck活化剂特别可应用于T细胞,可应用于加强包括细胞介导的免疫力在内的免疫力和免疫反应、挽救细胞免疫力、上调T细胞受体信号传导、上调一种或多种细胞因子(例如,选自IL-2、IFN-γ和TNFa)的产生、重新激发T细胞、使一种或多种T细胞免疫反应复苏,以及可用作佐剂(例如,在疫苗组合物中或者单独施用给个体以刺激对抗原的免疫反应)。
因此,本文进一步提供了用于对个体进行接种的疫苗组合物,其包含一种或多种本发明实施的Lck活化剂以及药学上可接受的载剂。疫苗可包含通过施用疫苗会产生针对其的免疫反应的任何一种或多种合适的抗原,以及任选地,用于刺激针对所述一种或多种抗原的免疫反应的任何另外的佐剂。
在至少一些实施方案中,可能需要刺激T细胞受体(TCR)才能实现由如本文所述的Lck活化剂治疗引起的T细胞生理结果(例如,IL-2细胞因子产生增加,T细胞信号传导上调等)。即,Lck活化剂可以起增强T细胞受体刺激的生理结果的作用,而不是基础地活化T细胞。因此,在本文所述的方法的至少一些实施方案中,由施用的Lck活化剂处理的T细胞是受到刺激的T细胞。
对根据本发明的一个或多个实施方案的Lck活化剂有反应的T细胞群体可以例如选自由以下组成的组:上皮内T细胞、粘膜内T细胞、γ/δT细胞、树突状表皮T细胞、CD4+ T细胞、CD8+ T细胞、细胞毒性T细胞、调节性T细胞(Treg)、NK细胞、树突细胞,以及前述细胞群体的组合。
本发明人已经证明本文所述的Lck活化肽增加树突细胞的存活能力(图36)。因此,在一个实施方案中,本发明提供了增加树突细胞存活能力的方法,所述方法包括使树突细胞与包含如本文所述的Lck活化肽的组合物接触。
在另一个实施方案中,本发明提供了诱导树突细胞或树突细胞群体的增殖的方法,所述方法包括使细胞或细胞群体与包含本文所述的肽的组合物接触。在另一个实施方案中,本发明提供了增加树突细胞群体的增殖的方法,所述方法包括使细胞群体与包含本文所述的肽的组合物接触。
可以通过技术人员众所周知的合成或重组技术提供如本文所述的Lck活化剂或其一种或多种组分(例如,式I的肽(P)和/或式II的化合物)。进一步地,构成根据本发明的Lck活化剂的肽(P)可掺有不是由遗传密码编码的一种或多种氨基酸,或一种或多种氨基酸类似物。
例如,可以利用一种或多种D-氨基酸、β-氨基酸和/或同型氨基酸而不是L-氨基酸。实际上,肽(P)可以部分或完全由D氨基酸组成或者由例如以下中的一者或多者的组合组成:一种或多种D-氨基酸、一种或多种β-氨基酸、一种或多种同型氨基酸、一种或多种β-同型氨基酸、一种或多种L-氨基酸,以及L-或D-同型氨基酸。β氨基酸的实例包括β-丙氨酸(NH
如本文所述的肽或融合蛋白可在3维构象中受到约束,以用于如本文所述的方法中。例如,它可以与侧链结构一起合成,或者以其它方式掺入到体内具有已知稳定结构的分子中,或者环化以提供增强的刚性,从而提供在体内的稳定性。使肽、融合蛋白等环化的各种方法是已知的。肽可经由四种不同的途径,即头到尾(C-末端到N-末端)、头到侧链、侧链到尾,或侧链到侧链来环化。例如,可以向融合蛋白的肽提供沿肽或融合蛋白彼此间隔开的两个半胱氨酸残基,并且可通过残基的巯基氧化以在它们之间形成二硫桥来将所述融合蛋白的肽环化。环化还可以通过在肽的N-末端氨基酸和C-末端氨基酸之间形成肽键,或例如通过在赖氨酸残基侧链上带正电荷的氨基与谷氨酰胺酸残基侧链上带负电荷的羧基之间形成键来实现。在氨基酸之间形成直接化学键或使用任何合适的接头来实现环化也完全在技术人员的范围内。用于实现根据本发明的环化的特别优选的方法包括形成内酰胺基团,并且用于形成如本文所述的肽和/或Lck活化剂的环化形式的内酰胺化的使用明确地被本发明所涵盖。包括合适的内酰胺化方法在内的实现环化的方法,例如在White CJ和YudinAK.,Contemporary strategies for peptide macrocyclization.Nature Chemistry,2011年6月,第509页中有描述,其全部内容通过交叉引用并入本文。
构成如本文所述的Lck活化剂的肽或融合蛋白还可包括翻译后或合成后修饰,诸如碳水化合物部分的附接或导致氨基酸残基烷基化或乙酰化或其它涉及化学键形成的变化的一种或多种化学反应。
还考虑了构成根据本发明的Lck活化剂的一种或多种肽的肽模拟物的使用,其被明确地涵盖在本文中。肽模拟物可以例如包含用氨基酸类似物对所述肽的一个或多个氨基酸进行的取代,其中一种或多种氨基酸类似物基本上不降低亲本肽的活性,如可以通过常规活性、细胞毒性和/或其它合适的测定法评估的。
如本文所述的Lck活化剂及其组分可以化学合成或使用常规重组技术产生。编码融合蛋白的核酸例如可以通过以下方式提供:采用平末端和寡核苷酸接头来将编码具有一个或多个期望氨基酸序列的肽的单独cDNA片段接合起来,视情况进行消化以提供交错末端,并对粘性末端进行扎结。可替代地,可采用引物对DNA片段进行PCR扩增,这产生具有互补末端的扩增子,随后可将扩增子扎结在一起。
可将如本文所述的肽和融合蛋白在体外表达并从细胞培养物中纯化,以施用于哺乳动物受试者或与式II的化合物偶联以提供Lck活化剂,以用于本发明利用任何合适的技术实施的方法。
固相肽合成(SPPS)、点击化学和葡萄球菌分选酶A介导的肽-肽融合方案或前述的组合也可用于提供如本文所述的Lck活化剂,例如用于将肽组分偶联在一起和/或用于与靶向部分例如scFv等偶联。此类合成方法的各种方案是众所周知的,并且可以采用任何合适的此类方法。
特别优选采用Fmoc或t-Boc或保护基团合成治疗剂的SPPS方法。此类合成方法是众所周知的,并且包括在脱保护步骤之前和之后存在洗涤步骤的重复的偶联和脱保护循环。在本文所述的至少一些实施方案中,可以通过SPSS在固体支持物上合成完整的治疗剂。为了合成例如式II的聚酰胺部分,可以将具有例如Fmoc保护的2-氨基的假脂肪酸构建块(building block)依序偶联在一起,以形成具有3至5个重复单元的部分的聚酰胺骨架,每个重复单元均具有如上所述的R基侧链。同样,然后可以将Lck活化剂的一个或多个肽组分依序偶联到聚酰胺部分(PM),以使活化剂在C-末端至N-末端的方向上延伸,之后使合成的Lck活化剂从固体支持物上释放出来并收集该合成的Lck活化剂。
分选酶A(Srt A)是一种首先在金黄色葡萄球菌(Staphylococcus aureus)中描述的细菌酶,它在裂解序列LPXTG中的苏氨酸和甘氨酸之间裂解,生成酰基酶中间体,然后该中间体可以与N-末端甘氨酸残基反应从而使该酶释放出来并且使甘氨酸和LPXTG标记组分通过肽键融合在一起,参见Levary,D.A等人,“Protein-protein fusion catalysed bysortase A”.PLoS ONE,2011年4月,第6卷(4):1-6,e18342。还请参见,例如,Witte,M.D.,“Production of unnaturally linked chimeric proteins using a combination ofsortase-catalysed transpeptidation and click chemistry”.Nat.Protoc.2013年9月,8(9):1808-1819,以及Bently ML.等人,J.Biol Chem,2008,283:14762-14771,和Mazmanian SK.等人,1999,Science,285:760-763。例如,已经描述了经由分选酶A介导的蛋白质扎结与荧光标签或毒素连接的重组HER1和HER2靶向抗体,参见,例如Madej MP等人,Biotechnology and Bioengineering,2012,109:1461-1470,以及Kornberger P.和SkeriaA.,2014,mAbs 6(2):354-366,前述所有参考文献的内容都通过交叉引用整体并入本文。
点击化学是另一种高产率的方法,其适于在制取如本文所述的Lck活化剂的过程中将组分偶联在一起,所述偶联是例如通过一个组分上的末端叠氮化物基团与另一个组分上的叠氮化物基团之间的金属催化的(例如,Cu(I))叠氮化物-炔烃环加成反应来实现,凭借所述方法将所述组分通过1,2,3三唑键而不是肽键偶联在一起。1,2,3三唑键充当常规肽键的生物电子等排体,并具有抵抗水解的优势,参见例如,Li等人,Click chemistry inpeptide-based drug design,Molecules,2013,18,第9797-9817页;doi:10.3390/molecules18089797。环辛炔(诸如二苯并-双环辛炔(DBCO))同样与叠氮化物具有高反应性,并为如上所述的叠氮化物-炔烃环加成提供了点击化学反应的替代形式,或者可以与叠氮化物-炔烃环加成组合使用以提供由本发明实施的Lck活化剂。基于环辛炔的点击合成反应的优点在于,它们可以在没有铜或其它金属催化剂的情况下进行。
可以通过如下方式使诸如scFv、抗体或抗体片段之类的靶向部分与如上所述的Lck活化剂的接头部分(LM)偶联:首先制备两种组分的半胱氨酸衍生物,将该半胱氨酸衍生物裂解并纯化为HCl盐,然后采用马来酰亚胺偶联,利用溶液相中半胱氨酸的游离巯基使其与相应的点击试剂偶联。随后将该靶向部分用叠氮化物或炔烃(或例如DBCO)试剂衍生化,点击缀合经由偶联至接头部分(LM)的互补试剂进行。
在其它实施方案中,可以用编码如本文所述的融合蛋白(即嵌合蛋白)Lck活化剂(例如,包含如本文所述的肽(P))的核酸转染哺乳动物受试者的靶细胞,以利用一种或多种宿主细胞的转录元件和翻译核糖体复合物在体内表达所述核酸,以实现根据本发明的治疗性治疗(例如,防治或治疗病原性感染)。
为了表达编码如本文所述的Lck活化剂的核酸,通常首先将核酸引入到克隆载体中并在宿主细胞中扩增,然后将核酸切下并将其掺入到用于转染细胞的一种或多种合适表达载体中。该表达载体可以被设计成独立于宿主细胞的基因组DNA表达核酸插入物,或者被设计成定点、同源或异源重组到宿主细胞的基因组DNA中,以便随后在宿主细胞中表达核酸插入物。
典型的克隆载体(例如粘粒)掺有容许载体有效复制的复制起点(ori)、使得能够选择用载体转化的宿主细胞的报告基因或标记基因,以及促进目标核酸序列的插入和后续切除的限制酶裂解位点。优选地,克隆载体具有掺有限制性位点阵列的多接头序列。标记基因可以是抗药基因(例如,针对氨苄青霉素抗药的Amp
合适的表达载体包括能够表达DNA(例如,基因组DNA或cDNA)插入物的质粒。表达载体通常将包括与插入的核酸序列可操作地连接的转录调控序列。“可操作地连接”意指核酸插入物与转录调节控制序列连接,以容许插入的序列转录而在插入物的阅读框中没有移位。此类转录调节控制序列包括用于促进RNA聚合酶结合以引发转录的启动子,用于使核糖体能够与转录的mRNA结合的表达控制元件和用于调节启动子活性的增强子。启动子可以是组织特异性启动子,其仅在特定细胞谱系而不在其它细胞类型中或在此类其它细胞类型中仅以相对较低的水平促进核酸插入物的转录。表达载体的设计将取决于待转染的宿主细胞、转染模式以及所需的核酸插入物转录水平。
适于转染生物(例如细菌)或真核生物(例如酵母、昆虫或哺乳动物细胞)的许多表达载体是本领域已知的。适于转染真核细胞的表达载体包括pSV2neo、pEF.PGK.puro、pTk2、pRc/CNV、pcDNAI/neo、掺有聚腺苷酸化位点和延伸因子1-α启动子的非复制型腺病毒穿梭载体,以及最优选掺有巨细胞病毒(CMV)启动子的基于pAdEasy的表达载体。为了在昆虫细胞中表达,可以利用杆状病毒表达载体,其实例包括基于pVL的载体诸如pVL1392和pVL941,以及基于pAcUW的载体诸如pAcUW1。根据本发明的实施方案的用于在哺乳动物细胞中表达核酸插入物的优选表达载体包括具有CMV或延伸因子1α启动子的质粒,诸如pEF.PGK.puro(Huang,David C.S.等人,Oncogene(1997)14:405-414)。pEF.PGK.puro质粒含有SV40起点、EF-1α启动子、多克隆位点和聚A区域,并且特别优选用于表达编码如本文所述的肽或嵌合蛋白的核酸插入物。
表达载体的各种形式是本领域已知的,并且任何合适的此类表达构建体均可用于预期目的。病毒转移方法还可用于实现将编码如本文所述的Lck活化剂的核酸在体外或体内引入到靶细胞中。可以将表达载体包装到其中以递送至靶细胞的合适病毒包括腺病毒,牛痘病毒,禽、鼠和人起源的逆转录病毒,疱疹病毒(包括单纯疱疹病毒(HSV)和EBV)、乳多空病毒(诸如SV40)和腺相关病毒。可用于本文所述的方法中的特别优选的病毒包括复制缺陷型重组腺病毒或其它病毒。重组病毒可以局部或全身施用以实现将编码肽或融合蛋白的核酸递送到靶细胞中。还可以使用常规的冷或热休克技术或例如本领域已知的磷酸钙共沉淀或电穿孔方案,在体外在细胞内递送编码如本文所述的肽或融合蛋白的核酸。
可以筛选转染的细胞以鉴定表现出核酸插入物的稳定、可再现表达以及编码的肽或融合蛋白的伴随产生的培养物或细胞系。核酸在各种宿主细胞内的稳定整合和表达是本领域众所周知的。可用于表达如本文所述的肽或融合蛋白的宿主细胞包括细菌和益生菌,诸如大肠杆菌、枯草芽孢杆菌(B.subtilis)、乳酸乳球菌(Lactococcus lactis)、链霉菌属(Streptomyces)和假单胞菌属(Pseudomonas)、短杆菌属(Brevibacterium),尤其是扩展短杆菌(B.linens)菌株,酵母诸如酵母属(Sacchromyces)和毕赤酵母属(Pichia),昆虫细胞、禽类细胞和哺乳动物细胞,诸如中国仓鼠卵巢细胞(CHO)、COS、HeLa、HaRas、WI38、SW480和NIH3T3细胞。大肠杆菌用于重组蛋白生产的用途是众所周知的,并且用于此类表达系统的合适的启动子包括T7、trc和lacUV5(Tegel H等人,FEBS Journal,2011,278:729-739)。将宿主细胞在合适的培养基中在促进引入的核酸表达的条件下培养,之后根据情况使用标准纯化技术从宿主细胞和/或上清液中纯化表达的产物。而且,表达的产物可包括宿主细胞(例如细菌细胞,诸如大肠杆菌)内的用于通过ELISA进行定量的组氨酸标签,可从所述宿主细胞制备如下所述的靶向小细胞制品(MacDiarmid J等人,Cancer Cell,2007,11:431-445)。
具体而言,可以在小细胞(例如,De Boer PA等人,A division inhibitor andtopological specific factor coded for by the minicell locus determine properplacement of the division septum in E.coli.Cell,56;641-649,1989)、脂质体、幽灵细菌细胞、空心球体(caveosphere)、合成高分子剂、经超速离心的纳米颗粒和其它无核纳米颗粒中装载如本文所述的Lck活化剂、核酸或表达载体(例如质粒),以将货物靶向递送至靶细胞。此类穿梭剂可被配制用于注射或口服摄取,以便通过胃的酸性环境以使货物经由小肠释放和吸收。
小细胞是纳米大小的细胞,其可以通过控制正常细胞分裂的一个或多个基因的突变产生,并且含有细胞质,并从而含有用于亲本细胞蛋白质表达的细胞质组分,但是是无染色体的,不能自我复制。已经证实通过抑制(或上调)控制细胞分裂的基因来产生小细胞能提供以比静脉内输注通常使用的剂量少得多的剂量将药物递送至肿瘤的解决方案(MacDiarmid,J.A.等人,JC(2007),Cancer Cell;11;431-445)。在本发明的上下文中,小细胞可以是由亲本细胞的异常细胞分裂产生的任何无染色体的细胞,如可能是由于细胞分裂过程的扰动或干扰(例如,二分裂),例如由所涉及的细胞组分的一种或多种遗传突变和/或抑制引起的。可以通过诸如在国际专利申请号WO 03/033519、美国专利号7,183,105和MacDiarmid,J.A.等人,2007中描述的任何常规已知的方法来制备在如本文所述的方法中使用的小细胞,所有这些参考文献的内容均通过交叉引用明确地整体并入本文。例如,DeBoer,P.A.等人,“A division inhibitor and a topological specificity factorcoded for by the minicell locus determine placement of the division septum inE.coli”.Cell 56,1989,第641-649页中进一步描述了控制细胞分裂以产生细菌小细胞的细菌基因的失活。US 7,611,885和US 8,003,091中描述了利用密度梯度离心法(例如,OptiPrep
可以衍生出本文可用的小细胞的细菌细胞的实例包括细菌,诸如大肠杆菌(E.coli)(例如,具有在MinA、MinB、cya、crp、MukA1或MukeE内的突变,或者其过表达minB、minE、flsZ、sdi)、枯草芽孢杆菌某些种(例如,具有在minC、minD、ripX内的突变,或具有smc突变或OriC缺失)、乳杆菌属某些种和假单胞菌属种。细菌可为革兰氏阳性的(例如单核细胞增生李斯特菌(L.monocytogenes))或革兰氏阴性的(例如铜绿假单胞菌(P.aeruginosa))。从外膜中具有孔蛋白的细菌(即,通常为革兰氏阴性细菌,但是一些革兰氏阳性细菌也具有孔蛋白)中分离出来的小细胞是特别优选的,以利于将待递送至靶细胞的如本文所述的核酸、表达载体或Lck活化剂装载到小细胞中。小细胞也可以衍生自古细菌或真核细胞,例如参见US 7,183,105。然而,通常,将利用细菌来源的小细胞,即衍生自细菌亲本细胞的小细胞。
可通过使用任何合适的靶向部分(例如,经由小细胞或脂质体上的双特异性抗体、靶向一个或多个scFv的肽等)获得小细胞对细胞的靶向以实现根据本发明的治疗。靶向部分可以在小细胞的表面上表达,或者例如,小细胞可以用一个或多个选定的靶向部分加标或标记。在特别优选的实施方案中,小细胞对肿瘤细胞的靶向可以使用呈这样的双特异性抗体复合物的形式的靶向部分实现,所述双特异性抗体复合物识别小细胞表面脂多糖的O-抗原组分和对待靶向的哺乳动物细胞具有特异性的细胞表面受体(例如EFGR),该复合物的该两种抗体经由它们的Fc区借助于蛋白A/G连接在一起(参见MacDiarmid,J.A.等人,JC(2007),Cancer Cell;11;431-445,和WO 03/033519。然而,本发明不限于此,并且可以如上所述采用其它靶向部分。
如本文所述的一种或多种Lck活化剂可以在小细胞内或小细胞上被携带至靶细胞或组织。例如,所述一种或多种Lck活化剂可以被装载到小细胞中,在小细胞的膜中表达,或者例如通过电荷缔合而被携带在小细胞的膜上。
通过在含有Lck活化剂或核酸的孵育介质中孵育小细胞,小细胞可以通过被动扩散而装载如本文所述的Lck活化剂或核酸(例如,表达载体)。为了辅助装载,可使小细胞对所述一种或多种Lck活化剂或一种或多种核酸具有渗透性(例如,通过使小细胞穿孔),或者可以例如通过常规的已知技术增加或增强小细胞对所述剂的渗透性。
具体而言,可以通过使用各种已知的可逆和不可逆的方法来促进如本文所述的Lck活化剂和核酸通过细菌小细胞的膜进入。这些方法包括电穿孔(Miller L.等人,Technology in Cancer Research&Treatment,2005,4:1-7)、暴露于洋地黄皂苷(Melo RF.等人,Cell Biochemistry and Function,1998,16:99-105)、NSAIDS(Mizushima T,Inflammation and Regeneration,2008,28:100-105)、Triton-X100(van de Ven AL.等人,J Biomedical Optics,2009,14(2):1-10)、植物皂苷(Bachran C.等人,Mini-Reviewsin Medicinal Chemistry,2008,8:575-584)、乳酸(Alakomi HL等人,Appl EnvironMicrobiol,2000,66(5):2001-5),以及诸如此类的方法。
可替代地,可以用表达如本文所述的Lck活化剂的表达载体转染可从其产生小细胞的细菌或其它细胞,其中该小细胞在产生时由此装载有表达的Lck活化剂。
小细胞的内含物或货物进入靶细胞可以通过使小细胞易位进入靶细胞来进行,这通过由于小细胞与靶细胞(诸如NK细胞、DC、T细胞)上表达的细胞表面受体的相互作用引起的吞噬作用(例如,通过嗜中性粒细胞和巨噬细胞),或通过胞吞作用(网格蛋白介导的或不依赖网格蛋白的胞吞作用),以及随后小细胞降解和小细胞内含物释放到靶细胞的细胞质中(例如,从细胞内区室,例如内体和/或溶酶体释放)来进行。
为了辅助小细胞的装载,可以将如本文所述的Lck活化剂的一个实施方案的肽组分连接至碳水化合物部分,例如葡萄糖(D或L异构体),以便促进通过细菌来源的小细胞上存在的LamB孔蛋白运输。孔蛋白超家族含有许多同型三聚体跨膜蛋白,该三聚体跨膜蛋白在革兰氏阴性细菌的外细胞膜上形成充水孔隙。大多数孔蛋白形成一般的非特异性通道,这些通道受环境变化的调节。麦芽糖孔蛋白(LamB孔蛋白)负责将麦芽糖和麦芽糖糊精引导扩散到大肠杆菌细胞中。具体而言,LamB蛋白还可以促进葡萄糖的扩散(von Meyerburg K和Nikaido H,Biochem Biophys Res.第78卷:第1100-1107页,(1977)),并且从测试的很多种糖中发现葡萄糖在体外跨LamB蛋白扩散的速率最快(Luckey M和Nikaido H,Proc.Natl.Acad.Sci.USA第77卷:第167-171页,(1980)。如本文所述的Lck活化剂、融合蛋白及其肽组分可通过如下方式从细胞培养物中纯化:对细胞膜进行超声处理或者使用洗涤剂破坏细胞膜,离心去除膜和固体片段,并且如果适用的话,通过本领域已知的方法进行亲和或免疫亲和色谱法从溶液或上清液中纯化。可以使用的合适的此类固体基质和支持物包括但不限于琼脂糖、琼脂糖凝胶(sepharose)和其它可商购的支持物(例如,乳胶、聚苯乙烯或右旋糖酐珠粒等)。可以利用常用的酰胺或酯类接头,或通过吸附使用于将本发明的肽或融合蛋白固定在固体支持物上以便后续从中洗脱和浓缩的抗体、其结合片段或其它合适的结合分子与固体基质共价结合。
进一步地,适合在脂质体、聚合物、含固体金属的纳米颗粒等中使用的纳米颗粒,诸如白蛋白、明胶、磷脂也可用于递送如本文所述的Lck活化剂(例如,参见De Jong WH&Borm PJA,Int J Nanomedicine,2008,3(2):133-149)。用针对靶细胞的各种配体或受体的抗体对纳米颗粒进行外部包被的技术也是众所周知的,并且可以用于本发明的实施方案中。
具体而言,根据本发明的Lck活化剂的脂质递送包括通过脂质体、固体脂质纳米颗粒、反向脂质胶束、脂质微管和脂质微柱体(在Swaminatham J&Ehrhardt C,Expert OpinDrug Deliv,2012,9(12):1489-1503中有综述)。含肽货物的脂质体已经例如被提出用于经皮递送,作为喷雾剂,用于鼻内、眼和经颊途径以及用于口服、肠胃外和肺途径(在Swaminatham J和Ehrhardt C,Expert Opin Drug Deliv,2012,9(12):1489-1503中有综述)。脂质体已经作为药物和基因递送媒介物受到广泛研究,并且最近作为肽递送媒介物受到广泛研究(PCT公开号WO2013033838A1,Pharmagap Inc,提交日期2012年8月21日,发明人;Sokoli K和Chabot JM)并且聚乙二醇化脂质体制剂在大多数情况下包含中性脂质和阴离子脂质的混合物。
有许多临床上验证的基于脂质体的药物疗法可用,与非靶向脂质体相比,靶向脂质体在肿瘤组织中实现增强的细胞内药物递送(Kirpotin DB等人,Cancer Res,2006,66:6732)。而且,最近已经报道脂质体介导的基因跨血脑屏障成功递送以治疗胶质瘤(Yue P-J等人,Molecular Cancer,2014,13:191)。基于脂质体的细胞靶向和细胞内化途径的组合可用于根据本发明的方法将Lck活化剂递送至细胞(例如,递送至T细胞以增强免疫系统/免疫反应,如针对病原体或癌细胞等的免疫反应)。
用于改善如本文所述的Lck活化剂向靶细胞(例如免疫细胞)的递送的方法可以包括用靶向配体对脂质体表面进行功能化,所述靶向配体识别由免疫细胞选择性表达的受体诸如CD3或人源化抗CD4抗体((TNX-355,现在称为伊巴珠单抗,TMB-355),由Zhang X-Q等人,Antimicrobial Agents and Chemotherapy,2006,50(6):第2231-2233页描述)。伊巴珠单抗是一种非免疫抑制性单克隆抗体,其结合CD4(HIV的主要受体)并抑制病毒进入过程(Ibalizumab(TMB-355):TaiMed Biologics.2009-09-09)。脂质体外表面上的聚乙二醇化也有助于双特异性抗体或其衍生物的使用,该双特异性抗体或其衍生物同时靶向免疫细胞或癌细胞上的PEG单元和受体。通过用连接至将本文所述的Lck活化多肽裂解掉的MMP9/2裂解序列的Lck活化剂靶向癌细胞,这样可以增强肿瘤浸润淋巴细胞的抗癌活性。本发明人已经证明,MMP9/2不裂解本文所述的Lck活化剂多肽。因此,如本文所述的Lck活化剂可以封装在脂质体内,该脂质体靶向在靶细胞(例如,癌细胞或免疫细胞)上表达的表面抗原,诸如HER1、HER2、PSMA(前列腺特异性膜抗原)或另一种抗原。
如本文所述的Lck活化剂、肽、融合蛋白、工程化抗体和其它结合部分(例如,scFv)可以例如在宿主细胞中表达,具有本领域已知的标签(例如,c-myc和聚His标签)以有助于它们的纯化以及/或者评价它们与细胞系的结合能力。在利用此类标签的情况下,编码的Lck活化剂、肽等可以进一步包括有利于使用内肽酶去除标签的合适的氨基酸序列。同样,编码如本文所述的Lck活化剂、肽、融合蛋白等的核酸可进一步包括信号肽序列,以促进翻译的产物从宿主细胞中分泌,以便如上所述的那样通过亲和色谱法进行纯化。用于制备用于免疫亲和色谱法和亲和色谱法方案的固体基质的方案例如在Current Protocols inMolecular Biology-Ausubel FM.等人,Wiley-Interscience,1988及其后续更新中有描述。
如本文所述的Lck活化剂、其肽组分、融合蛋白和核酸可以分离或纯化的形式提供。如本文所用的术语“纯化的”涵盖如可以通过电泳和/或其它技术评价的,例如达到80%或更高的纯度水平,或至少85%,或至少90%,或至少95%,或至少96%,或至少97%或至少98%或更高(例如99%或更高)的纯度水平的部分纯化。
在另一些进一步的实施方案中,如本文所述的Lck活化剂的一种或多种肽组分的一个或多个游离末端可以例如甲基化、乙酰化或用多个乙二醇单体单元聚乙二醇化,以使其抵抗体内蛋白酶降解的能力降低或者以抑制Lck活化剂经由肾脏从循环中清除。多肽/肽的聚乙二醇化的方法是本领域众所周知的,所有此类方法都明确地被本发明所涵盖。通常,在本发明实施的方法中使用的聚乙二醇化多肽将与2个或更多个聚乙二醇(PEG)单体单元偶联,并且一般与约2至约11个PEG单体(即(PEG)n,其中n等于2至11)偶联。最通常地,n将为2。而且,构成本发明实施的Lck活化剂的肽可以环化以提供增强的刚性,从而提供在体内的稳定性,并且各种此类方法是本领域已知的。
虽然如本文所述的Lck活化剂可以作为用于防治或治疗根据本发明的适用疾病或病状的唯一药物施用于受试者,但是在至少一些实施方案中,该治疗剂可以与一种或多种用于治疗(即,防治性或治疗性治疗)所述疾病或病状的其它药物组合施用。常规用于治疗特定疾病或病状的任何合适的药物都可以与所述组合疗法中的一种或多种如本文所述的治疗剂一起使用,例如检查点阻断剂。
可以在根据本发明的组合疗法中使用的常规抗病毒药可以例如选自逆转录病毒药、蛋白酶抑制剂、整合酶抑制剂、细胞进入抑制剂和神经氨酸酶抑制剂。实例包括核苷逆转录酶抑制剂,诸如齐多夫定(zidovudine,AZT)、阿巴卡韦(Abacavir)、拉米夫定(lamivudine)、恩曲他滨(emtricitabine)和阿昔洛韦(Acyclovir);核苷酸逆转录酶抑制剂,诸如替诺福韦(Tenofovir);非核苷逆转录酶抑制剂,诸如奈韦拉平(nevirapine)和依非韦伦(efavirenz);细胞进入抑制剂,诸如马拉韦罗(maraviroc)和恩夫韦地(Enfuvirtide);整合酶抑制剂,诸如雷特格韦(Raltegravir)、埃替格韦(Elvitegravir)和度鲁特韦(Dolutegravir);蛋白酶抑制剂,诸如地瑞那韦(Darunavir)、阿扎那韦(Atazanavir)、茚地那韦(Indinavir)、洛匹那韦(Lopinavir)、奈非那韦(Nelfinavir)、安普那韦(Amprenavir)和利托那韦(Ritonavir);以及神经氨酸酶抑制剂,诸如扎那米韦(zanamivir)和奥司他韦(oseltamivir)。
在至少一些实施方案中,如本文所述的Lck活化剂可以包括在用于治疗HIV或其它逆转录病毒感染的常规组合疗法中,所述常规组合疗法例如可以选自由以下组成的组:可比韦(combivir)(齐多夫定和拉米夫定)、三协唯(Trizivir)(阿巴卡韦、齐多夫定和拉米夫定)、克力芝(Kaletra)(洛匹那韦和利托那韦)、Epzicom(阿巴卡韦和拉米夫定)、特鲁瓦达(Truvada)(替诺福韦和恩曲他滨)、立普妥(Atripla)(依非韦伦、替诺福韦和恩曲他滨)、Stribild(埃替格韦、可比司他、替诺福韦和恩曲他滨)和三恩美(triumeq)(度鲁特韦、阿巴卡韦和拉米夫定)。
可以在根据本发明的组合疗法中使用的常规抗菌药物可以例如选自由以下组成的组:抗生素,诸如青霉素、头孢菌素、碳青霉烯、氨基糖苷、磺酰胺、喹诺酮和噁唑烷酮。
可以在根据本发明的组合疗法中使用的常规抗原生生物药物可以例如选自由以下组成的组:甲硝唑、奥硝唑、依氟鸟氨酸、呋喃唑酮、美拉胂醇、替硝唑和乙胺嘧啶。
可以在如本文所述的组合疗法中使用的常规抗蠕虫药物包括苯并咪唑类,诸如阿苯达唑、甲苯达唑、三苯达唑、氟苯达唑和芬苯达唑。
如本文所述的Lck活化剂也可用于治疗用常规药物治疗另一种疾病或病状所引起的机会性感染。例如,常用于治疗慢性髓细胞性白血病的药物格列卫(Gleevec)(伊马替尼,ST1571)是酪氨酸激酶的有效抑制剂,并且通过抑制Lck活性而降低TCR诱导的增殖和活化(Seggewiss R等人,2005,Blood,105:2473-2479),这对诱导机会性感染有影响。这也同样适用于改善来自其它酪氨酸激酶抑制剂(诸如伊马替尼、尼洛替尼或达沙替尼)的副作用。例如,尽管免疫增强药物诸如细菌超抗原(例如葡萄球菌肠毒素A(SEA))引起了潜在的发病率,但是鉴于Lck受SEA活化并且缺乏选择性Lck活化剂,有人提出将SEA用于预防慢性髓系细胞性白血病中伊马替尼介导的T细胞免疫抑制(Wang G等人,BioMed ResearchInternational,2014,文章编号682010)。
在一些实施方案中,用于防治或治疗如本文所述的病原性感染或其它疾病或病状的常规药物可通过例如共价键,通过电荷吸引或借助于合适的接头与根据本发明的Lck活化剂复合。用于将药物连接至Lck活化剂的合适的接头包括,例如,优选限定一个或多个酶裂解位点(例如,MMP裂解位点)以在靶细胞或靶组织处或其内部释放药物的长度为1至10个原子的接头,巯基接头以及/或者氨基酸或氨基酸序列。
如本文所述的Lck活化剂对细胞的活性和/或细胞毒性的特征可以通过各种常规已知的测定法,诸如以下的一者或多者来确定:评价细胞形态、台盼蓝拒染、凋亡评估、细胞增殖研究(例如,细胞计数、
可以根据本发明的方法将如本文所述的Lck活化剂施用给哺乳动物,或者可以使细胞与Lck活化剂在体外接触。同样,本发明提供了离体治疗,其中在哺乳动物外部用Lck活化剂处理细胞,然后将细胞返回、施用或植入到哺乳动物体内。
如本文所述的Lck活化剂、载体(例如表达载体)或核酸可以以用于施用于预期受试者的药物组合物提供,所述药物组合物包含药学上可接受的载剂和/或赋形剂。所述Lck活化剂或核酸可以口服、鼻内、经吸入(例如通过气雾剂喷雾)、静脉内、肠胃外、直肠、皮下、通过输注、局部、肌肉内、腹膜内、脊髓内、眼内或经由任何其它被认为恰当的途径施用。
直肠和/或结肠提供了使用与肽偶联的各种吸收增强剂诸如烯胺(苯丙氨酸和苯基甘氨酸)、5-氨基或-甲氧基水杨酸酯、螯合剂、中链脂肪酸、环糊精、pH敏感聚合物包衣药物、偶氮聚合物前药等来增强肽的药物吸收的途径(例如,参见Tiwari G等人,International J Drug Delivery,2010,2:01-11;Kolte BP等人,Asian J Biomedical&Pharmaceutical Sciences,2012,2(14):21-28;Philip AK等人,OMJ,2010,25:70-78;和Lakshmi PJ等人2012,Asian J Res Pharm Sci,2(4):143-149),并且如本文所述的Lck活化剂的此类施用模式和形式也明确涵盖在本文中。
药物组合物可以例如是适于所选施用途径的液体、悬浮液、乳剂、糖浆、霜剂、可摄取的片剂、胶囊、丸剂、栓剂、粉剂、锭剂、酏剂或其它形式。
可用于根据本发明的方法中的药物组合物包括水性药物溶液。可注射的组合物将在存在注射性的程度上是流体,并且通常在预定时期内是稳定的,以提供生产后的储存。而且,药学上可接受的载剂可以包括任何合适的常规已知溶剂、分散介质、水、生理盐水和等渗制品或溶液、表面活性剂,并且可以利用任何合适的药学上可接受的载剂(例如,口服或局部可接受的载剂)。合适的分散介质可以例如含有乙醇、多元醇(例如甘油、丙二醇、液态聚乙二醇等)、植物油及其混合物中的一者或多者。具体而言,Lck活化剂或核酸可以例如与惰性稀释剂、可同化的可食用载剂一起配制并且/或者它可以封装在硬壳或软壳明胶胶囊中。
如本文所述的药物组合物还可掺有一种或多种适于体内和/或局部施用的防腐剂,诸如对羟基苯甲酸酯、氯丁醇、苯酚、山梨酸和硫柳汞。另外,可通过在组合物中使用用于延迟吸收的剂诸如单硬脂酸铝和明胶来实现组合物的延长吸收。含有如本文所述的Lck活化剂或核酸的片剂、锭剂、丸剂、胶囊等也可含有以下的一种或多种:粘合剂,诸如黄蓍胶、阿拉伯胶、玉米淀粉或明胶;崩解剂,诸如玉米淀粉、马铃薯淀粉或海藻酸;润滑剂,诸如硬脂酸镁;甜味剂,诸如蔗糖、乳糖或糖精;和调味剂。
如上所述的成分和介质在药物组合物中的用途是众所周知的。除非任何常规介质或成分与如本文所述的Lck活化剂不相容,否则它们在如本文所述的治疗性和防治性药物组合物中的用途也被包括。
如本文所用的“组合疗法”意指通过相同或不同途径,以与其它一种或多种药物相同或不同的制剂,预先、同时或依序施用根据本发明的Lck活化剂或核酸,由此所述一种或多种活化剂和/或一种或多种核酸在重叠的治疗窗内发挥它们的一种或多种作用。
特别优选将肠胃外组合物配制成剂量单位形式以易于施用和实现剂量均一性。如本文所用的剂量单位形式意指适合作为待治疗受试者的单位剂量的物理离散单位,每个单位含有预定量的至少一种根据本发明的Lck活化剂或核酸,经计算该预定量会联合所用的相关载剂和/或赋形剂产生所需的治疗或防治效果。当剂量单位形式为例如胶囊、片剂或丸剂时,各种成分可以用作包衣(例如虫胶、糖或两者)以以其他方式改变剂量单位的物理形式或者以促进向受试者的施用。
药物组合物一般将含有至少约1重量%的如本文所述的Lck活化剂。该百分比可以变化,并且可以方便地介于所述组合物或制剂的约5%至约80%w/w之间。同样,考虑到提出的施用途径,根据本发明的Lck活化剂或核酸的量应使得合适的有效剂量将被递送给受试者。优选的口服药物组合物将含有约0.1μg至15g的Lck活化剂。
根据本发明的Lck活化剂或核酸的剂量将取决于许多因素,该因素包括将所述Lck活化剂或核酸施用用于防治性还是治疗性用途,预期施用该试剂的疾病、病状或目的,疾病或病状的严重程度,受试者的年龄,以及包括受试者的体重和总体健康状况在内的相关因素,如可由医师或护理人员根据公认的原则确定的。例如,最初可以给予低剂量,随后在评价受试者的反应后在每次施用时增加剂量。类似地,可以以相同的方式来确定施用频率,即通过连续监测受试者在每个剂量之间的反应,并且如有必要,则增加施用频率或可替代地,降低施用频率。
通常,如本文所述的Lck活化剂将根据本发明实施的方法施用,以提供高达约100mg/kg个体体重,更通常在高达约50mg/kg体重的范围内,且最通常在约5mg/kg至40mg/kg体重的范围内的Lck活化剂的剂量。在至少一些实施方案中,将施用Lck活化剂以提供在约5至25mg/kg体重的范围内,通常在约5mg/kg至约20mg/kg的范围内,且更通常在10mg/kg至约20mg/kg的范围内的Lck活化剂的剂量。当口服施用时,每天可施用最多约20g的Lck活化剂(例如每天口服4剂,每剂包含5g的Lck活化剂)。
关于静脉内途径,特别合适的途径是通过注射以使Lck活化剂或核酸全身地分布到血管中,血管供给待治疗的组织或一个或多个特定器官。而且,Lck活化剂可以通过任何合适的输注或灌注技术来递送。所述Lck活化剂或核酸(例如,装载在细菌来源的小细胞中的表达载体)也可以递送到腔体,例如胸膜或腹膜腔中,或直接注射到待治疗的组织中。
可用于本文所述的方法中的合适的克隆和表达载体及其制备和递送的方法在熟练技术人员众所周知的指南和手册中有描述,例如,参见Ausubel等人(1994)CurrentProtocols in Molecular Biology,USA,第1和2卷,John Wiley&Sons,1992;Sambrook等人(1998)Molecular cloning:A Laboratory Manual,第二版,Cold Spring HarbourLaboratory Press 1989,New York,及其再版和更新,其内容通过交叉引用整体并入本文。同样,可用于如本文所述的组合物中的合适的药学上可接受的载剂和制剂可以在熟练技术人员众所周知的手册和教科书,诸如"Remington:The Science and Practice ofPharmacy(Mack Publishing Co.,1995)"及其任何再版和更新中找到。例如,WO200631996、WO 200631689、WO 200629981、WO 200629005、US 20060063731和US20060063924中描述了用于转染细胞以及在体内表达核酸插入物的方法和方案,上面列出的所有前述出版物、指南和手册的内容通过交叉引用整体并入本文。
如本文所述的那样治疗的哺乳动物可以是可根据本发明治疗的任何哺乳动物。例如,哺乳动物可以是牛科、猪科、羊科或马科的成员,实验室试验动物诸如小鼠、兔子、豚鼠、猫或狗,或灵长类动物或人。通常,所述哺乳动物是人。
在另一方面,本发明提供了本文所述的Lck活化多肽在制造用于治疗和/或预防本文所提及的疾病和/或病状(包括年龄相关性变化)的药物中的用途。
在另一方面,本发明提供了本文所述的Lck活化多肽用于治疗和/或预防本文所提及的疾病和/或病状(包括年龄相关性变化)的用途。
下面通过许多非限制性实施例来进一步描述本发明。
实施例1:淋巴细胞特异性蛋白酪氨酸激酶(Lck)在体外受Lck活化多肽活化。
在体外检查本发明的多肽活化Lck的能力。Lck是酪氨酸激酶Src家族的成员。Eurofins Pharma Discovery Services UK Limited(Dundee Technology Park,Dundee,United Kingdom)使用在15μM表观Km以内的ATP浓度,在肽底物(KVEKIGEGTYGVVYK)和试验多肽的存在下,在半对数剂量范围内,进行体外Lck活化激酶研究。实施例X中的所有结果均是相对于对照(100%)的Lck活性百分比。
表3显示多肽RSKAKNPLYR在1μM、10μM或30μM的肽浓度下不会活化Lck。
表3:Lck在体外受Lck活化多肽活化
令人惊讶地,不含RSKAKNPLYR的C-末端精氨酸的多肽RSKAKNPLY被证实在10μM或30μM的肽浓度下能活化Lck,但在1μM下不能。因此,单个精氨酸残基在RSKAKNPLY的羧基末端的存在消除了对Lck的刺激/活化。
在体外检查本发明的多肽活化Src家族激酶的能力。如上所述的那样进行Lck活化研究,并且所有Lck活性值均以相对于对照的百分比表示。简言之,表4和表5例示在10μM浓度的肽RSKAKNPLY的存在下,Src家族激酶中Lck激酶受到的选择性活化。
表4:与其它SFK相比对Lck的选择性活化
表4显示,Lck受多肽RSKAKNPLY选择性地活化;除Lck以外,没有Src家族激酶(SFK)被10μM的肽浓度下的所述肽活化。与表3一致,单个精氨酸残基在RSKAKNPLY的羧基末端的存在消除了对Lck的刺激/活化。
表5显示多肽RVKVKVVVV在1μM和10μM的肽浓度下活化Lck,并且Lck受多肽RVKVKVVVV选择性地活化;除Lck以外,没有Src家族激酶(SFK)被1μM和10μM的肽浓度下的所述肽活化。
表5:与SFK相比RVKVKVVVV对Lck的选择性活化
该数据证明Lck活化肽选择性活化Lck,而不活化Blk、cSrc、Fgr、Fyn、Hck、Lyn或Yes。
检查了阳离子氨基酸位置的修饰和肽SKAKNPLY的取代的影响。简言之,评估了与肽Pep9(RSKAKNPLY)相比具有氨基酸序列变化的肽刺激Lck活性的能力。如实施例1所述的那样进行Lck活化研究,结果示于表6。所有结果均表示为相对于对照(100%)的百分比。
表6证明,如果多肽
表6:肽的Lck活化
实施例2:淋巴细胞特异性蛋白酪氨酸激酶(Lck)受与脂肪酸偶联的Lck活化多肽的选择性活化。
图1示出了与肽RSKAKNPLYR偶联的根据式II的聚酰胺部分(PM)“4C10”(其中m=0且根据上述方案1具有末端氨基基团)(例如“RSKAKNPLYR-4C10”或“RSKAKNPLYR-(2Adod)
如实施例1所述的那样对Lck活化进行评价并且所有Lck活性值均以相对于对照(100%)的百分比表示。为了便于描述,聚酰胺部分用“nCy”表示,其中n是聚酰胺部分的重复单元的数目,Cy是每个重复单元中R基团的碳原子数目,并且每个R基团是饱和的线性碳链。因此,在本实例中,“4C10”是指具有4个重复单元(n=4)的如上面的方案1所示的聚酰胺部分,其中每个重复单元的R基团是饱和的碳侧链,其长度为10个碳原子(例如,四个2-氨基十二烷酸)。
令人惊讶地,如图1所示,与非Lck活化肽序列RSKAKNPLYR的C-末端偶联的聚酰胺酰胺部分的存在诱导了强烈的Lck活化,从30nM的化合物浓度开始(高于对照水平18%)并且在30μM的浓度下达到高于对照水平914%活化。而且,当4C10部分与RSKAKNPYLR肽的N-末端偶联时,虽然也诱导了Lck活化,但程度低于针对C-末端偶联所观察到的程度(在1μM的浓度下435%活化并且在10μM的浓度下410%活化)(数据未示出)。
该数据证明当四个脂肪酸残基(四个2-氨基十二烷酸残基)与不活化Lck的肽(RSKAKNPLYR)偶联时,该四个脂肪酸残基赋予该多肽活化Lck的能力。
还评价了下表5中列出的聚酰胺部分(PM)本身的作用。同样,该聚酰胺部分是如上面的方案1中所示的化合物(其中m=0),并用“nCy”式表示,其中n是该聚酰胺部分的重复单元的数目,Cy是每个重复单元中的R基团的碳原子数目,并且每个R基团是饱和的线性碳链,只是在这种情况下该聚酰胺部分具有末端羟基而不是NH
因此,H-1C10-OH仅包含如本文所述的聚酰胺部分的单个单元,并且对应于一个2-氨基十二烷酸残基(本文也称为“H-(2Adod)
表7:Lck受包含一个、两个、三个或四个2-氨基十二烷酸残基(“2Adod”)的化合物活化
如表7所示,在10μM的化合物浓度下,仅化合物H-2C10-OH表现出较小的低水平Lck活化。
鉴于单独的肽RSKAKNPLYR(参见表3)以及4C10和H-1C10-OH聚酰胺部分在无细胞的Lck激酶活性测定中对Lck无任何影响,以上结果表明通过使非Lck活化肽RSKAKNPLYR与非Lck活化聚酰胺部分4C10-OH偶联获得了意外的协同作用。
表8中示出了与如上所述的聚酰胺部分-1C10-OH(一个2-氨基十二烷酸残基)相比,使聚酰胺部分4C10(即四个2-氨基十二烷酸残基)与肽RSKAKNPLYR的C-末端偶联对Lck活性的影响。
表8:使一个或四个2-氨基十二烷酸残基偶联对Lck活性的影响
在这项研究中并且如表8所示,观察到Lck受到肽RSKAKNPLYR-4C10的大幅刺激,从1μM浓度下高于对照519%增加到30μM浓度下的816%。虽然对于肽RSKAKNPLYR-1C10-OH而言,在1μm下未观察到对Lck活性的刺激,但是在该化合物为10μm和30μm的浓度下获得大幅Lck活化,但是达到的水平低于肽RSKAKNPLYR-4C10获得的水平。这些结果表明,通过使肽RSKAKNPLYR与聚酰胺部分4C10或-1C10-OH的偶联获得了协同作用。
表9中示出了与RSKAKNPLYR偶联的聚酰胺部分4C10(四个2-氨基十二烷酸残基)上的酰胺化对Lck活性的影响。
表9:酰胺化对Lck活化的影响
该数据证明,通过非Lck活化肽RSKAKNPLYR与非Lck活化聚酰胺部分4C10-OH的偶联而获得的意外协同作用可通过酰胺化偶联至肽的最远端的脂肪酸而令人惊讶地得以进一步增强。该数据还证明,当最远端的脂肪酸未酰胺化时,Lck活化水平大约为在最远端的脂肪酸酰胺化时所观察到的活化水平的50%。
检查了聚酰胺部分的线性和非线性(例如垂直)偶联对Lck活化的影响。表9和表10中示出了与RSKAKNPLYR偶联对Lck活性的影响。简言之,当四个脂肪酸残基(四个12氨基十二烷酸残基)与不活化Lck的肽(RSKAKNPLYR)以线性方式偶联时,该四个脂肪酸残基赋予该多肽活化Lck的能力。
表10:脂肪酸残基线性和非线性偶联对Lck活化的影响
*在1、3、5、10处的阴离子残基[在1、10处=D(天冬氨酸);在3、5处=E(谷氨酸)];Adod=十二烷酸(月桂酸);Adec=癸酸(羊蜡酸)。
与表9和表8一致,表10证明当四个脂肪酸残基(四个2-氨基十二烷酸残基)与不活化Lck的肽(RSKAKNPLYR)以非线性垂直方式偶联时,该四个脂肪酸残基赋予该多肽活化Lck的能力。
表10还证明当四个2-氨基癸酸(“Adec”)残基与不活化Lck的肽(RSKAKNPLYR)以垂直方式偶联时,该四个脂肪酸残基赋予该多肽活化Lck的能力。
实施例3:与脂肪酸偶联的Lck活化多肽增加Lck磷酸化并且Lck活化多肽增加Lck在Y394处的磷酸化。
Lck的Tyr394磷酸化导致Lck的构象打开,从而活化Lck激酶。
由Eurofins Pharma Discovery Services UK Limited(Dundee,UnitedKingdom)执行免疫印迹研究。简言之,将Lck(h)在试验肽的存在下,使用标准KinaseProfiler
1.分子量标记
2.标准Lck(仅酶)
3标准Lck-肽底物+ATP(无试验肽)
4.标准Lck+肽底物+ATP(无试验肽)
5.标准Lck+ATP+RSKAKNPLYR 10μM(无肽底物)
6.标准Lck+ATP+RSKAKNPLYR 30μM(无肽底物)
7.标准Lck+ATP+RSKAKNPLY 10μM(无肽底物)
8.标准Lck+ATP+RSKAKNPLY 30μM(无肽底物)
9.标准Lck+ATP+RSKAKNPLYR-4C10 10μM(无肽底物)
10.标准Lck+ATP+RSKAKNPLYR-4C10 30μM(无肽底物)
免疫印迹方案的步骤如下:
SDS-PAGE凝胶: 处于200V下50分钟
蛋白质印迹转移: 处于25V下90分钟
膜: 硝酸纤维素预切印迹膜
0.2μm孔隙尺寸(LC2000(Life Tech))
丽春红染色: 0.1%的在5%乙酸中的丽春红S(w/v)
在施加一抗和二抗之前,将膜用10mL PBST和10%BSA封闭1小时。
将抗pY394 Lck(R&D systems MAB7500,1/2500稀释于封闭缓冲液中)与膜一起在4℃下孵育过夜,然后用4x 20ml TBST洗涤。
将抗小鼠HRP(Cell Signalling Technology,7076,1/5000稀释于封闭缓冲液中)在室温下与膜一起孵育1小时,然后用4x 20mL TBST洗涤。
图2显示在ATP的存在下,Lck在Y394处的弱自体磷酸化不会随Lck暴露于10μM和30μM的肽RSKAKNPLYR中而增加(分别为泳道3和5/6)。相比之下,Lck暴露于10μM和30μM的肽RSKAKNPLY中会诱导Lck的剂量依赖性自体磷酸化(分别为泳道7和8),这表明RSKAKNPLYR的C-末端精氨酸会抑制Lck的自体磷酸化。然而,这种抑制通过4C10聚酰胺部分与肽RSKAKNPLYR的C-末端的偶联(RSKAKNPLYR-4C10)而被克服。而且,在10μM RSKAKNPLYR-4C10的存在下观察到的Lck自体磷酸化超过针对单独的RSKAKNPLY在相同浓度下观察到的自体磷酸化。
这些数据还证明选择性地活化Lck的多肽增强Lck的自体磷酸化,并且Lck活化多肽以剂量依赖性方式增强Lck的自体磷酸化。
实施例4:Lck活化多肽增加人T淋巴细胞(Jurkat)细胞系中的CD25(IL-2Ra)表达。
检查了Lck活化多肽对T细胞系上的IL2Ra(CD25)表达的影响。
简言之,将野生型Jurkat细胞(1x10
图3显示当将受刺激细胞暴露于RSKAKNPLYR-(2Adod)
实施例5:Lck活化多肽增加分离的人CD4+和CD8+ T细胞上的IL-21R表达。
检查了Lck活化多肽对分离的人CD4+和CD8+ T细胞上的IL-21R表达的影响。
简言之,将PBMC与抗CD3(1μg/ml)刺激物和在5个浓度的范围内(0-1.25μM)测试的试验肽一起培养72小时,之后通过流式细胞术评估细胞的CD360(IL-21R)表达。呈现的数据表示响应于肽处理,在CD4+或CD8+ T细胞群体中的平均的相应表达,+/-SEM,n=4。通过双因素方差分析和Dunnett事后检验分析数据。*p<0.05,***P<0.001,****P<0.0001。虚线表示未受刺激的细胞。
图4显示相对于对照,Lck活化融合多肽RSKAKNPLYR-(2Adod)
实施例6:Lck活化多肽增加CD360(IL-21R)阳性CD3
检查了Lck活化多肽增加CD360(IL-21R)阳性CD3
图5显示Lck活化多肽RSKAKNPLYR-(2Adod)
检查了在不存在IL-2的情况下Lck活化多肽增加分离的人CD3
图6显示了在不存在IL-2的情况下,Lck活化多肽RSKAKNPLYR-(2Adod)
实施例7:Lck活化多肽RSKAKNPLYR-(2Adod)
检查了Lck活化多肽RSKAKNPLYR-(2Adod)
简言之,将经过抗CD3抗CD28刺激的T细胞(CD3+分离)与在5个浓度的范围内的RSKAKNPLYR-(2Adod)
图7显示RSKAKNPLYR-(2Adod)
实施例8:Lck活化多肽RSKAKNPLYR-(2Adod)
检查了Lck活化多肽RSKAKNPLYR-(2Adod)
简言之,将经过抗CD3刺激的PBMC与Lck活化多肽RSKAKNPLYR-(2Adod)
图8显示了Lck活化多肽RSKAKNPLYR-(2Adod)
实施例9:Lck活化多肽RSKAKNPLYR-(2Adod)
检查了Lck活化多肽在与抗PD-1抗体(帕博利珠单抗)组合时对人PBMC内调节性T细胞数量的影响。
简言之,将经过抗CD3刺激的PBMC连同Lck活化多肽RSKAKNPLYR-(2Adod)
图9显示了在不存在RSKAKNPLYR-(2Adod)
Lck活化多肽RSKAKNPLYR-(2Adod)
重要的是,当Lck活化多肽RSKAKNPLYR-(2Adod)
实施例10:Lck活化多肽RSKAKNPLYR-(2Adod)
检查了Lck活化多肽RSKAKNPLYR-(2Adod)
简言之,将经过抗CD3刺激的PBMC与Lck活化多肽RSKAKNPLYR-(2Adod)
图10证明Lck活化多肽RSKAKNPLYR-(2Adod)
图11证明Lck活化多肽RSKAKNPLYR-(2Adod)
实施例11:Lck活化多肽RSKAKNPLYR-(2Adod)
检查了Lck活化多肽RSKAKNPLYR-(2Adod)
简言之,将未受刺激的PBMC与5个浓度的范围内的RSKAKNPLYR-(2Adod)
为检查受刺激T细胞,将分离的T细胞(CD3+)用抗CD3抗CD28 Dynabeads
实施例12:Lck活化多肽RSKAKNPLYR-(2Adod)
检查了Lck活化多肽RSKAKNPLYR-(2Adod)
简言之,通过将野生型Jurkat细胞(永生化人T淋巴细胞系)在抗CD28抗体和抗生物素蛋白(avidin)的存在下暴露于生物素化抗CD3抗体中来对它进行刺激。在培养期(48小时)内,将细胞暴露于试验多肽RSKAKNPLYR-(2Adod)
图14显示暴露48小时后,Lck活化多肽RSKAKNPLYR-(2Adod)
正如下面将要讨论的,图42A显示多肽RSKAKNPLYR和RSKAKNPLY增加人T淋巴细胞(Jurkat)细胞系中的IL-2分泌,并且图42B显示rskaknply增加人T淋巴细胞(Jurkat)细胞系中的IL-12分泌,而RSKAKNPLYR未能如此。
实施例13:Lck活化多肽RSKAKNPLYR-(2Adod)
检查了Lck活化多肽改变IL-2分泌的能力。简言之,通过将野生型Jurkat细胞(永生化人T淋巴细胞系)在抗CD28抗体和抗生物素蛋白(avidin)的存在下暴露于生物素化抗CD3抗体中来对它进行刺激。在培养期(72小时)内,将细胞暴露于RSKAKNPLYR-(2Adod)
图15A显示暴露72小时后,Lck活化多肽RSKAKNPLYR-(2Adod)
检查了Lck在Lck活化多肽改变IL-2分泌和IL-2Ra表达的能力中的作用。简言之,通过将缺乏Lck的Jurkat细胞(“J.CaM1.6”)在抗CD28抗体和抗生物素蛋白(avidin)的存在下暴露于生物素化抗CD3抗体来对它进行刺激。在培养期(72小时)内,将细胞暴露于Lck活化多肽RSKAKNPLYR-(2Adod)
图15A显示暴露72小时后,相对于对照在野生型Jurkat细胞中对IL-2分泌的诱导依赖于Lck。图15B显示在暴露72小时后,相对于对照在野生型Jurkat细胞上对IL-2Ra表达的诱导依赖于Lck;在这两种情况下,在不存在组成型Lck表达的情况下,均未观察到反应。
实施例14:Lck活化多肽RSKAKNPLYR-(2Adod)
为防止免疫系统过度活化,程序性死亡1(PD-1)途径充当检查点以控制T细胞活化。当配体PD-L1和PD-L2与PD-1受体结合时,该途径被活化,导致T细胞“耗竭”,这是对T细胞活化和增殖的可逆性抑制。检查了Lck活化多肽RSKAKNPLYR-(2Adod)
简言之,将Jurkat细胞通过用10ng/mL PMA和离子霉素(1μg/mL)刺激来活化,以诱导程序性细胞死亡受体1(PD-1)的细胞表面表达,并且在不存在添加剂的情况下或者与单独的2.5μM的肽RSKAKNPLYR-(2Adod)
重要的是,图16显示RSKAKNPLYR-(2Adod)
实施例15:Lck活化多肽RSKAKNPLYR-(2Adod)
T细胞耗竭的特征在于T细胞功能逐步进行性丧失,并且可以反应细胞的物理缺失告终。白细胞介素2(IL-2)的产生是首先被消除的效应子活动之一,其次是肿瘤坏死因子-α(TNF-α)的产生,而产生干扰素-γ(IFN-γ)的能力对失活更有抵抗力。
检查了Lck活化多肽RSKAKNPLYR-(2Adod)
简言之,培养72小时后对细胞染色进行流式细胞术检查以评估用于指示表达水平的Ki67和CD25频率。Ki67是一种用于确定给定细胞群体(在这种情况下为CD4+细胞)的生长分数的增殖标志物。从能存活群体中,对细胞进行设门以聚焦于CD4+细胞,然后对CD4+细胞进行设门以聚焦于CD25+或Ki67+群体。
使用鼠模型(Tg4 Ly5.1(MBP-Tracker小鼠),B10PlxC57BL/6)进行CD4+ T细胞耗竭测定,从而将CD4+T细胞受体转基因T细胞用用于产生完全反应性效应T细胞的野生型髓鞘碱性蛋白(WT MBP),或用于产生耗竭T细胞的改变的肽配体肽MBP(APL-MBP)进行刺激。将这些静置于IL-2中,然后用APC、一定剂量的APL-MBP肽连同正在研究的任何治疗剂(例如肽)进行二次刺激。
取出小鼠的脾脏并进行处理以产生脾细胞的单细胞悬浮液。使MBP-Tracker脾细胞以3x10
图17证明在用Lck活化融合多肽RSKAKNPLYR-(2Adod)
实施例16:Lck活化多肽诱导TNFa和IFNg分泌。
T细胞耗竭的特征在于T细胞功能逐步进行性丧失,并且可以反应细胞的物理缺失告终。白细胞介素2(IL-2)的产生是首先被消除的效应子活动之一,其次是肿瘤坏死因子-α(TNF-α)的产生,而产生干扰素-γ(IFN-γ)的能力对失活更有抵抗力。
检查了Lck活化多肽RSKAKNPLYR-(2Adod)
培养72小时后,将细胞染色以进行流式细胞术检查,以评估TNFa和IFNg的产生。
图18证明在用Lck活化融合多肽RSKAKNPLYR-(2Adod)
实施例17:Lck活化多肽RSKAKNPLYR-(2Adod)
检查了Lck活化多肽对分离的T细胞(CD4+和CD8+ T细胞)上的IL-2Ra表达的影响。
简言之,将新分离的PBMC在所指示的浓度(μM)的试验肽RSKAKNPLYR-(2Adod)
图19显示Lck活化多肽RSKAKNPLYR-(2Adod)
实施例18:Lck活化多肽RSKAKNPLYR-(2Adod)
检查了Lck活化多肽改变CD28表达的能力。简言之,将经过抗CD3刺激的PBMC与Lck活化多肽RSKAKNPLYR-(2Adod)
图20A显示Lck活化多肽RSKAKNPLYR-(2Adod)
实施例19:Lck活化多肽RSKAKNPLYR-(2Adod)
检查Lck活化多肽RSKAKNPLYR-(2Adod)
简言之,从人PBMC中分离出NK细胞并将其暴露于在5个浓度的范围内的RSKAKNPLYR-(2Adod)
图21证明RSKAKNPLYR-(2Adod)
实施例20:Lck活化多肽RSKAKNPLYR-(2Adod)
检查了Lck活化多肽抑制癌症建立的能力。
经尾静脉为8只8周龄的雌性C57BL/6小鼠接种2x 10(x5)个在PBS中的B16F10细胞,并在第1、4、8和11天对小鼠腹膜内施用RSKAKNPLYR-(2Adod)
图22A证明当腹膜内施用时,RSKAKNPLYR-(2Adod)
图22B证明当口服施用时,RSKAKNPLYR-(2Adod)
实施例21:Lck活化多肽RSKAKNPLYR-(2Adod)
检查了Lck活化多肽减小Lewis肺癌(LLC)(转移模型)小鼠中的肿块的能力。
将来源于ATCC的LLC细胞在DMEM中培养至70%融合,将其分离,然后在PBS中洗涤。第0天,小鼠接受通过尾静脉静脉内注射的0.5x10
图23证明,当腹膜内施用时,RSKAKNPLYR-(2Adod)
实施例22:在Lewis肺癌(LLC)(异种移植)模型中,Lck活化多肽RSKAKNPLYR-(2Adod)
检查了Lck活化多肽调节Lewis肺癌(LLC)小鼠中的异种移植肿瘤的能力。
将Lewis肺癌细胞系培养至约70%融合,然后收集细胞,对其进行计数并将其以5x10
将肿瘤置于含有胶原酶D(2mg/mL,Roche批号28960126)和DNA酶I(100μg/mL,Sigma批号SLBV1446)的2mL RPMI-1640中,并且进行机械消化,然后在37℃下,在振荡培养箱中以80rpm孵育30分钟。使消化的肿瘤样品通过70μm滤网,并用冰冷的RPMI-10洗涤两次。离心样品并进行红细胞裂解,然后洗涤并将其重新悬浮于RPMI-10中。通过台盼蓝拒染计数肿瘤细胞,并对免疫细胞标记CD45(AF700)染色。
图24显示在Lewis肺癌(LLC)异种移植模型中,RSKAKNPLYR-(2Adod)
实施例23:来自于施用了Lck活化多肽的Lewis肺癌小鼠(转移模型)的脾细胞在TCR刺激后具有增加的IFNg产生
检查了用Lck活化多肽处理对经过处理的Lewis肺癌小鼠脾细胞的细胞因子释放的影响。
简言之,在抗CD3和抗CD3和抗CD28抗体的存在下,培养经RSKAKNPLYR-(2Adod)
图25显示经RSKAKNPLYR-(2Adod)
实施例24:施用了Lck活化多肽的Lewis肺癌小鼠(转移模型)的CD4+ T细胞具有增加的IL-12RB2表达水平。
检查了用RSKAKNPLYR-(2Adod)
简言之,在抗CD3和抗CD3和抗CD28抗体的存在下,培养经RSKAKNPLYR-(2Adod)
图26显示经RSKAKNPLYR-(2Adod)
实施例25:施用了Lck活化多肽的Lewis肺癌小鼠(转移模型)的表达IL-12RB2的CD8+ T细胞和NK细胞的比例增加。
检查了用RSKAKNPLYR-(2Adod)
简言之,分离经RSKAKNPLYR-(2Adod)
图27显示经RSKAKNPLYR-(2Adod)
实施例26:施用了Lck活化多肽的Lewis肺癌小鼠(转移模型)具有表达增加的水平的IL-2Ra、IL-15R和CD28的NK细胞以及增加的NK细胞增殖
检查了用Lck活化多肽处理对(未受刺激的)经处理的Lewis肺癌小鼠中的CD25+、CD215+、CD28+NK细胞的比例及NK细胞的增殖的影响。
简言之,分离经RSKAKNPLYR-(2Adod)
图28显示经Lck活化多肽处理的小鼠在不存在刺激的情况下显示出CD25+、CD215+和CD28+NK细胞水平的显著增加,以及增殖NK细胞比例增加。
实施例27:施用了Lck活化多肽的Lewis肺癌小鼠(转移模型)的表达IL-12RB2的CD4+ T细胞的比例增加。
检查了用RSKAKNPLYR-(2Adod)
简言之,分离用腹膜内施用的RSKAKNPLYR-(2Adod)
图29显示经Lck活化多肽处理的小鼠在抗CD3刺激以及抗CD3和抗CD28刺激后,显示出CD4+ T细胞上的IL-12RB2表达水平显著增加。
重要的是,来自经IK14004处理的小鼠的CD4+脾细胞在仅抗CD3活化后表达的IL-12RB2比来自还用抗CD28共同刺激的经媒介物处理的小鼠的脾细胞表达的IL-12RB2多。
实施例28:包含阴离子残基的多肽不活化Lck
检查了包含阴离子残基的肽活化Lck的能力。
图30显示多肽RSKAKNPLYR-(2Adod)
实施例29:在受刺激PBMC测定中Lck活化多肽增加NK细胞上的IL-2Rβ(CD122)表达
检查了Lck活化多肽RSKAKNPLYR-(2Adod)
简言之,将来自健康供体的PBMC用抗CD3(1μg/mL)在RSKAKNPLYR-(2Adod)
图31显示Lck活化多肽RSKAKNPLYR-(2Adod)
实施例30:在受刺激PBMC测定中Lck活化多肽增加T细胞上的IL-2Rβ(CD122)表达
检查了Lck活化多肽RSKAKNPLYR-(2Adod)
简言之,将来自健康供体的PBMC用抗CD3(1μg/mL)在RSKAKNPLYR-(2Adod)
图32显示Lck活化多肽RSKAKNPLYR-(2Adod)
实施例31:RSKAKNPLYR-(2Adod)
检查了Lck活化多肽RSKAKNPLYR-(2Adod)
图33显示RSKAKNPLYR-(2Adod)
实施例32:在抗原刺激之前提供的Lck活化多肽诱导人T淋巴细胞(Jurkat)细胞系中的IL-2分泌,但不诱导Lck缺陷型细胞中的IL-2分泌。
检查了Lck活化多肽诱导人T淋巴细胞(Jurkat)细胞系和Lck缺陷型(JCam1.6)细胞系产生IL-2的能力。
简言之,将500万个细胞接种在T25烧瓶中并且用如上表所指示的不同浓度的RSKAKNPLYR-(2Adod)
图34显示当在抗原刺激之前施用时,Lck活化多肽RSKAKNPLYR-(2Adod)
实施例33:Lck活化多肽引起CD8+细胞群体的扩增
检查了Lck活化多肽RSKAKNPLYR-(2Adod)
简言之,将来自健康供体的PBMC在RSKAKNPLYR-(2Adod)
图35显示Lck活化多肽RSKAKNPLYR-(2Adod)
实施例34:Lck活化多肽增加树突细胞(DC)的存活能力
检查了Lck活化多肽RSKAKNPLYR-(2Adod)
简言之,未成熟的单核细胞来源的DC(iMoDC)源自在Mo-DC分化培养基中培养7天的分离的CD14+单核细胞。将iMoDC在5点浓度曲线范围内的测试肽加上媒介物(0-1.25μM)和抗CD3(1μg/mL)的存在下培养72小时。72小时后,通过流式细胞术评估细胞的存活能力。呈现的数据表示肽处理后能存活细胞的平均百分比。
图36显示Lck活化多肽RSKAKNPLYR-(2Adod)
实施例35:Lck活化多肽RSKAKNPLYR-(2Adod)
检查了Lck活化多肽RSKAKNPLYR-(2Adod)
简言之,将分离的T细胞(CD3+)用抗CD3抗CD28 DynabeadsTM刺激并且与5个浓度的范围内的Lck活化多肽RSKAKNPLYR-(2Adod)
图37显示Lck活化多肽RSKAKNPLYR-(2Adod)
实施例36:Lck活化多肽RSKAKNPLYR-(2Adod)
检查了Lck在Lck活化多肽RSKAKNPLYR-(2Adod)
简言之,通过将野生型Jurkat细胞和缺乏Lck的Jurkat细胞(J.Cam 1.6)在抗CD28抗体和抗生物素蛋白的存在下暴露于生物素化抗CD3抗体中来对它们进行刺激。在培养期(24小时)内,将细胞暴露于Lck活化多肽RSKAKNPLYR-(2Adod)
图38显示Lck活化多肽RSKAKNPLYR-(2Adod)
实施例37:Lck活化多肽RSKAKNPLYR-(2Adod)
检查了Lck在Lck活化多肽RSKAKNPLYR-(2Adod)
简言之,通过将野生型Jurkat细胞和缺乏Lck的Jurkat细胞(J.Cam 1.6)在抗CD28抗体和抗生物素蛋白的存在下暴露于生物素化抗CD3抗体中来对它们进行刺激。在培养期(24小时)内,将细胞暴露于Lck活化多肽RSKAKNPLYR-(2Adod)
图39显示Lck活化多肽RSKAKNPLYR-(2Adod)
实施例38:Lck活化多肽RSKAKNPLYR-(2Adod)
在受刺激与未受刺激的细胞中检查了Lck在Lck活化多肽RSKAKNPLYR-(2Adod)
简言之,通过将Jurkat细胞在抗CD28抗体和抗生物素蛋白的存在下暴露于生物素化抗CD3抗体中而对它进行刺激,或不对该细胞进行刺激。在培养期(24小时)内,将细胞暴露于Lck活化多肽RSKAKNPLYR-(2Adod)
图40显示Lck活化多肽RSKAKNPLYR-(2Adod)
实施例39:外周血CD4+细胞中HIV复制的抑制
检查了Lck活化多肽RSKAKNPLYR-(2Adod)
外周血单核细胞(PBMC)是从澳大利亚红十字会提供的“血沉棕黄层(buffycoat)”中分离出来的。用抗CD3和抗CD28抗体以1μg/ml刺激细胞。将细胞在37℃下孵育2天,并通过CD4+MACS分离CD4+细胞。用HIV-1(AD8菌株,CCR5嗜性)感染一些CD4+细胞。
使用急性感染的原代人CD4+ T细胞(感染后3天)测试了试验肽RSKAKNPLYR-(2Adod)
CD4+细胞模型需要病毒从HIV-1感染的细胞传播到未感染的细胞,以便在培养物上清液中产生可测量的量的病毒。因此,该模型可以检测试验试剂对病毒复制的所有步骤的影响。如图41所示,10μM RSKAKNPLYR-(2Adod)
实施例40:多肽RSKAKNPLYR和RSKAKNPLY增加人T淋巴细胞(Jurkat)细胞系中的IL-2分泌;并且rskaknply增加人T淋巴细胞(Jurkat)细胞系中的IL-12分泌,而RSKAKNPLYR未能如此。
检查了多肽RSKAKNPLYR(“14000”)、RSKAKNPLY(“IK94000)和rskaknply(“IKD94000”)改变IL-2和IL-12分泌的能力。
简言之,通过将野生型Jurkat细胞(永生化人T淋巴细胞系)在抗CD28抗体和抗生物素蛋白(avidin)的存在下暴露于生物素化抗CD3抗体中来对它进行刺激。将细胞按每孔100万个细胞接种(12孔板,2mL体积)并用生物素-抗CD3、抗CD28和抗生物素蛋白(5:5:1.25μg)刺激。用试验肽处理细胞,然后将其在37℃下孵育48小时。然后分析上清液(100ul,n=3)的IL-2和IL-12含量。在培养期(48小时)内,将细胞暴露于试验多肽RSKAKNPLYR-(2Adod)
图42A显示多肽RSKAKNPLYR和RSKAKNPLY增加人T淋巴细胞(Jurkat)细胞系中的IL-2分泌。
图42B显示rskaknply增加人T淋巴细胞(Jurkat)细胞系中的IL-12分泌,而RSKAKNPLYR未能如此。
尽管上面已经描述了本发明的多个实施方案,但是应当理解,在不脱离本发明的范围的情况下,可以对其进行各种修改和改变。因此,上述实施方案仅是说明性的,而不应视为是限制性的。
- 新的合成肽,含有该肽的肺表面活化剂以及治疗呼吸窘迫综合症的药物
- 微生物丛活化剂、将该微生物丛活化剂作为有效成分的抗丝状菌剂、及使用了该微生物丛活化剂的含油脂等的排水的处理方法
