盐酸胺碘酮纳米混悬剂及其制法和应用
文献发布时间:2023-06-19 10:40:10
技术领域
本发明属于医药领域,具体涉及盐酸胺碘酮纳米混悬剂及其制法和应用。
背景技术
盐酸胺碘酮(Amiodarone Hydrochloride,简称AD)又名乙胺碘呋酮、胺碘特隆和安律酮,为苯并呋喃的一个衍生物,其化学名为(2-丁基-3-苯并呋喃基)[4-[2-(二乙氨基)乙氧基]-3,5-二碘苯基]甲酮盐酸盐,为Ⅲ类抗心律失常药物,在临床上广泛应用,主要用于冠状动脉扩张剂治疗心绞痛、抗心律失常和危及生命的室性心律失常的治疗。
盐酸胺碘酮为白色至微黄色结晶性粉末,易溶于甲醇和乙醇,几乎不溶于水,属于生物药剂学分类系统(BCS)中的Ⅱ类。由于其水溶性差,高脂溶性,而在胃肠道吸收缓慢,其表面分布密度大,主要分布于脂肪组织及脂肪含量丰富的器官,其次为心、肾、肺、肝及淋巴结。在血浆中主要与白蛋白和β-脂蛋白结合,其血浆蛋白结合率为95.6%,经肝脏代谢为去乙基胺碘酮(desethy lamiodarone,简称DEA),主要经胆汁和大便排出体外。长时间服用盐酸胺碘酮时,其代谢物去乙基胺碘酮血药浓度是盐酸胺碘酮的0.4~2.0倍,去乙基胺碘酮的抗心律失常作用等于或强于胺碘酮。由于其药代性质的巨大个体差异,其生物利用度为30%~50%,且其剂量浓度关系、血药水平与疗效的关系均存在较大的个体差异。
盐酸胺碘酮已在临床上广泛应用,其药理作用具有多样性。虽然胺碘酮为Ⅲ类抗心律失常药物,但是其药理学显示为多通道阻滞剂,Ⅰ~Ⅳ类抗心律失常药物的电生理特性均有表现,还可以轻度非竞争性地抑制α及β肾上腺素受体,因此其临床上主要用于治疗心房颤动或扑动、心力衰竭后心率失常、治疗心肌梗死合并心律失常和治疗快速室性心率失常。由于致心律失常作用弱,不加重充血性心衰,应用盐酸胺碘酮可有效的减少猝死率和总死亡率。随着其广泛应用,不良反应逐渐增多,不良反应的发生主要与所用的剂量、用法及时间有密切的关系,因此在临床用药时应严格掌握用药方法,密切观察,强调个体化原则,防止不良反应的发生。
目前,临床上盐酸胺碘酮主要以普通片剂、胶囊剂和注射剂为主,随着近年来药物新制剂理论和技术的发展,许多研究者为改善盐酸胺碘酮传统剂型的不足进行了大量的研究,各种新型制剂不断涌现,将盐酸胺碘酮制成脉冲片、冻干粉针剂、固体分散体、分散片和包合物等新型制剂,通过新制剂的研究,改善传统盐酸胺碘酮制剂的一些不足,提高了其生物利用度,能更好的控制病情。
基于盐酸胺碘酮为多通道阻滞剂,具有扩张血管、减慢心率、改善心肌缺血等作用,对各种心律失常都有较好的疗效,为广谱的抗心律失常药,而其属于BCS分类中的Ⅱ类,水难溶性药物,临床应用因此受限。发明人根据纳米混悬剂的特点,将盐酸胺碘酮研制成一种广谱、高效、稳定、安全的纳米口服制剂,增大胺碘酮的溶解度、提高其生物利用度,减少胺碘酮的剂量从而降低其不良反应的发生。
纳米混悬剂(nanosuspension)是近年来针对难溶性药物的制剂难题开发的一种新型剂型技术,通过“由上至下”(the top down)和“由下至上”(the bottom up)两种方式将难溶性药物制成粒径在1000nm以下的高度分散的粒子群,形成稳定的纯药物胶体溶液,可提高难溶性药物的溶解度和溶解速率。与其它纳米制剂最大的区别是,纳米混悬剂为“纯的药物”颗粒,无需载体材料,通过表面活性剂或高分子材料等稳定剂,将药物颗粒分散在水中形成稳定体系。与其它剂型比较,纳米混悬剂具有以下优势:通过减小药物颗粒增加了药物的表面积,明显增加了药物吸收速率和吸收率,提高药物口服生物利用度;可增加药物对生物粘膜的粘附性,减少吸收的个体差异;作为一种中间剂型,还可进一步加工成传统剂型,如片剂、胶囊、喷雾剂、注射剂等;有助于实现难溶性药物的静脉给药,通过表面修饰还可以实现定位释放,靶向给药;制备时,无需使用载药材料,载药量高,还可避免因共溶剂等引起的毒副作用;使用范围广,可用于难溶于水的药物、以及既难溶于水又难溶于油的药物。
目前制备纳米混悬剂主要从两方面入手,一种为将溶液中的药物分子聚集形成纳米范围的晶体,即“由下至上”法;另一种是将大颗粒的药物晶体分散到纳米范围,即“由上至下”法。制备工艺包括微量沉淀法、高压均质法、湿法研磨法等等。
发明人尝试以纳米混悬剂解决盐酸胺碘酮的水溶性差的技术问题,但是在试制过程中,所得混悬剂的粒径通常都在微米级别,最小都在1-2微米左右,难以形成粒径在1000nm以下的高度分散的粒子群,为解决粒径大小的问题,发明人对于纳米混悬剂的制备工艺、辅料等参数做了诸多调整,最终形成了粒径范围为150-800nm的纳米混悬剂,粒径范围甚至可以控制在150-300nm的较小区间内。
发明内容
由于盐酸胺碘酮水溶性差,本发明所解决的技术问题是提供一种粒径范围在150-800nm的纳米混悬剂,具体的,采用湿法研磨法或反溶剂沉淀法制成本发明的盐酸胺碘酮纳米混悬剂,并以该纳米混悬剂作为中间产品,进一步制成口服制剂或注射制剂应用。
本发明盐酸胺碘酮纳米混悬剂的制备方法为:
A、稳定剂溶解于水中,将盐酸胺碘酮分散于该溶液中,制备成普通混悬剂;
B、将普通混悬剂加入采用湿法研磨法或反溶剂沉淀法制成盐酸胺碘酮纳米混悬剂。
步骤A所述的水优选纯化水。
湿法研磨法采用球磨机制备时:
1)先将普通混悬剂加入球磨罐中,加入研磨介质,密封后放入球磨机;
2)设定研磨参数:转速为25-45Hz,研磨2-12小时;优选转速为35Hz,研磨6小时;
3)研磨后过滤去除研磨介质,即得本发明纳米混悬剂。
其中,研磨介质优选氧化锆颗粒,直径为0.2-0.4mm;直径优选0.2mm。
采用反溶剂沉淀制备时:
1)反溶剂沉淀法选用水相为含表面活性剂泊洛沙姆-188和和十二烷基硫酸钠,有机相为乙醇;
2)然后搅拌转速为800rpm,析出温度为0℃,得到纳米混悬剂。
本发明纳米混悬剂主要含有盐酸胺碘酮、稳定剂,其重量配比为:
盐酸胺碘酮 1-10份
稳定剂 1-10份。
其重量配比优选:
盐酸胺碘酮 10份
稳定剂 1-10份。
进一步优选:
盐酸胺碘酮 10份
稳定剂 4-6份。
其中,所述的稳定剂选自泊洛沙姆(Poloxamer)、脂肪酸甘油酯、聚山梨酯(商品名为吐温,Tween)、脂肪酸山梨坦(商品名为司盘,span)、聚氧乙烯型(为聚氧乙烯脂肪酸酯及聚氧乙烯脂肪醇醚)、聚维酮(简称PVP)、十二烷基硫酸钠(SDS)、聚乙二醇(PEG)中的一种或多种;作为表面活性剂或高分子助悬剂应用。本发明所采用的稳定剂均属于“非离子表面活性剂”。
采用上述辅料,结合本发明制备工艺,可以得到粒径范围为150-800nm的纳米混悬剂。
为了进一步控制粒径范围,发明人发现稳定剂采用以混合使用的形式可以得到粒径范围为150-300nm的纳米混悬剂。如
盐酸胺碘酮 1-10份
稳定剂 1-10份。
所采用的稳定剂是:泊洛沙姆(Poloxamer)、脂肪酸甘油酯、聚山梨酯(商品名为吐温,Tween)、脂肪酸山梨坦(商品名为司盘,span)、聚氧乙烯型(为聚氧乙烯脂肪酸酯及聚氧乙烯脂肪醇醚)、聚维酮(简称PVP)、十二烷基硫酸钠(SDS)中的至少两种混合使用。
混合使用时,各稳定剂之间的用量比例,如以重量比计为:(1-10)︰(1-10)︰(1-10)……。若PVP、SDS混合使用,则为PVP 1-10重量份、SDS 1-10重量份;若PVP、SDS、F68混合使用,则为PVP 1-10重量份、SDS 1-10重量份、F68 1-10重量份;若以PVP、SDS、F68、EL混合使用,则为PVP 1-10重量份、SDS 1-10重量份、F68 1-10重量份、EL 1-10重量份;以此类推。
本发明纳米混悬剂的粒径范围为150-800nm,甚至可以有效的集中的控制在150-300nm,产品均一性高,粒径小可显著提高药物的生物利用度,并减少毒副作用;同时,本发明纳米混悬剂属于纯的药物颗粒的稳定胶体分散体系,具有载药量高,所用辅料少,稳定性高等特点。说明:胶体分散体系的直径范围为10
本发明纳米混悬剂可以液体状态存在,也可以制成冻干粉贮存;还可以冻干粉为原料制成口服制剂或注射制剂。如:复溶后制成皮下注射剂或静脉注射剂;或以冻干粉为原料加入药学上可接受的辅料制成常用口服制剂、如胶囊剂、片剂、颗粒剂、丸剂等等常规剂型。
制备冻干粉时,在本发明纳米混悬剂中加入冻干支架剂(亦可称为冻干支撑剂),冷冻干燥即得;冻干支架剂加入比例为3-8%。冻干支架剂选自葡萄糖、甘露醇、果糖、乳糖、蔗糖、半乳糖、海藻糖、壳聚糖中的一种或多种。其中反溶剂沉淀法制备的盐酸胺碘酮纳米混悬剂冻干后简称NS-A,介质研磨法制备的纳米混悬剂溶液冻干后简称NS-B粉末,-20℃保存备用。
盐酸胺碘酮虽具有对各种心律失常都有较好的疗效,为广谱的抗心律失常药,但因其水溶性差,口服生物利用度不高,给药剂量大,影响了其在临床的应用。本发明纳米混悬剂的粒径可以有效的集中的控制在150-800nm,甚至是集中在150-300nm的小范围内,产品均一性高,粒径小。采用本发明纳米混悬剂制备成口服制剂或注射制剂,可以提高盐酸胺碘酮的生物利用度,并减少毒副作用,增强病人适应性和顺应性。还可以将本发明纳米混悬剂进一步加工成其它剂型,以方便临床应用。
附图说明
图1本发明盐酸胺碘酮纳米混悬剂的电镜图;(a)介质研磨纳米混悬剂溶液和(b)反溶剂沉淀法纳米混悬剂溶液透射电镜图,(c)盐酸胺碘酮原料药扫描电镜图。
图2本发明盐酸胺碘酮纳米混悬剂的粒径分布图:NS-A和NS-B纳米混悬剂粉末的稳定性:a、c、e、g为NS-A在0、2、4和8周后纳米混悬剂的粒径及多分散性指数;b、d、f、h为NS-B在0、2、4和8周后纳米混悬剂的粒径及多分散性指数。
图3盐酸胺碘酮纳米晶体体外溶出曲线:AD原药、AD物理混合物、NS-A纳米混悬剂粉末和NS-B纳米混悬剂粉末的体外释放曲线。
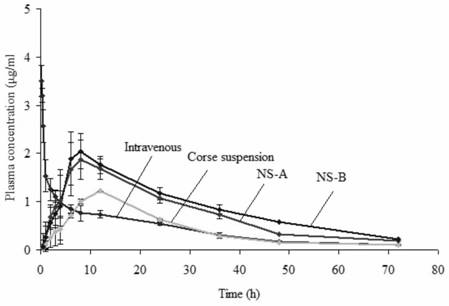
图4盐酸胺碘酮药物代谢曲线:Wistar大鼠经口灌胃组:AD普通混悬剂、AD的NS-A和NS-B纳米混悬剂(50mg/kg);静脉组:AD溶液(20mg/kg)的药时曲线。
具体实施方式
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明,说明但不限制本发明。
盐酸胺碘酮已在临床上广泛应用,其药理作用具有多样性。虽然胺碘酮为Ⅲ类抗心律失常药物,但是其药理学显示为多通道阻滞剂,Ⅰ~Ⅳ类抗心律失常药物的电生理特性均有表现,还可以轻度非竞争性地抑制α及β肾上腺素受体,因此其临床上主要用于治疗心房颤动或扑动、心力衰竭后心率失常、治疗心肌梗死合并心律失常和治疗快速室性心率失常。由于致心律失常作用弱,不加重充血性心衰,应用盐酸胺碘酮可有效的减少猝死率和总死亡率。随着其广泛应用,不良反应逐渐增多,不良反应的发生主要与所用的剂量、用法及时间有密切的关系,因此在临床用药时应严格掌握用药方法,密切观察,强调个体化原则,防止不良反应的发生。
目前,临床上盐酸胺碘酮主要以普通片剂、胶囊剂和注射剂为主,随着近年来药物新制剂理论和技术的发展,许多研究者为改善盐酸胺碘酮传统剂型的不足进行了大量的研究,各种新型制剂不断涌现,将盐酸胺碘酮制成脉冲片、冻干粉针剂、固体分散体、分散片和包合物等新型制剂,通过新制剂的研究,改善传统盐酸胺碘酮制剂的一些不足,提高了其生物利用度,能更好的控制病情。
发明人尝试以纳米混悬剂解决盐酸胺碘酮的水溶性差的技术问题,但是在试制过程中,遇到了诸多技术难点,如:
1、在湿法研磨法初期考察时,发明人先采用粒径为几毫米至几十毫米的玛瑙小球为研磨介质,结果所得纳米混悬剂的粒径皆不理想,为微米级别。经过多番筛选,发明人发现采用直径为0.2-0.6毫米的氧化锆颗粒,所得纳米混悬剂粒径就降为几百纳米了。
2、在稳定剂的筛选过程中,发明人曾考察了甲基纤维素,羧甲基纤维素钠等材料作为稳定剂,但所得粒径都为1-2微米左右,增加研磨时间、强度均无法降至纳米级别,更难以形成粒径在1000nm以下的高度分散的粒子群。最后改用聚维酮,泊洛沙姆,十二烷基硫酸钠,吐温系列等后,混悬剂粒径降到了几百纳米。
3、最终,通过筛选稳定剂用量,最终实现了混悬剂粒径达到150-300nm左右,PDI为0.2左右。采用球磨机制备优选步骤如下:
1)先将稳定剂溶解于水(优选纯化水)中,将盐酸胺碘酮分散于该溶液中,制备成普通混悬剂;
2)先将普通混悬剂加入球磨罐中,加入研磨介质,密封后放入球磨机;
3)设定研磨参数:转速为25-45Hz,研磨2-12小时;优选转速为35Hz,研磨6小时;
4)研磨后过滤去除研磨介质,即得本发明纳米混悬剂。
其中,研磨介质优选氧化锆颗粒,直径为0.2-0.4mm;直径优选0.2mm。
发明人发现也可以采用反溶剂沉淀制备,方法如下:
1)反溶剂沉淀法选用水相为含表面活性剂泊洛沙姆-188和和十二烷基硫酸钠,有机相为乙醇;
2)然后搅拌转速为800rpm,析出温度为0℃,得到纳米混悬剂。
以下为本发明纳米混悬剂的制备工艺筛选过程。
一、湿法研磨法稳定剂(表面活性剂)的筛选
盐酸胺碘酮纳米混悬剂湿法研磨制备过程描述:
取适量盐酸胺碘酮和表面活性剂于球磨罐中,加入适量超纯水。密封球磨罐后,将其固定于球磨机上,设定适当的转速和时间。待球磨过程结束后,过滤,分离球磨介质和化合物溶液,即得到纳米混悬剂溶液。
发明人通过考察不同的因素(表面活性剂的种类和数量、研磨速度和研磨时间)对纳米混悬剂稳定性的影响,以形态、粒径和多分散性指数(PI)作为评价指标,来确定最佳处方。
(1)考察表面活性剂的种类:
本研究考察了十二烷硫酸钠(SDS)、磷脂酰胆碱、吐温-80、聚乙二醇(PEG)、聚乙烯醇(PVA)、聚乙烯吡咯烷酮(PVP K-30)和泊洛沙姆188等它们一种或几种的混合物作为表面活性剂对纳米混悬剂稳定性的影响。
表1表面活性剂的筛选
根据表面活性剂种类的筛选,在制备混悬剂过程中,为了使纳米粒子间的相互吸引力减小和降低粒子相互之间碰撞的概率,通常增加粒子间排斥力,而达到这一步就是使用适量的稳定剂来达到抑制纳米粒子的成长速率。在以水为介质的混悬剂中,混悬剂中使用的稳定剂主要有两种,即离子型稳定剂和非离子稳定剂,离子型稳定剂有十二烷基硫酸钠(SDS)、多库酯钠和磷脂酰胆碱等;常用的非离子稳定剂有普流尼克(Pluronic)、聚乙二醇(PEG)、聚乙烯醇(PVA)、羟丙基纤维素(HPC)、吐温80、聚乙烯吡咯烷酮(PVP)、羟丙基甲基纤维素(HPMC)等。本试验通过预选的几种表面活性剂进行初步选择发现,单个的稳定剂并不能表现出更优的稳定效果,而通过将非离子型与离子型稳定剂联合起来,二者起到协同作用,依靠两者间得静电排斥力和空间阻力,所制得的纳米混悬剂状态比较好,这个可能是通过降低了离子型稳定剂之间的斥力,进而增加稳定剂在粒子表面的密度。由表中结果可以看出十二烷硫酸钠(SDS)+聚乙烯吡咯烷酮(PVP K-30)和泊洛沙姆188+十二烷硫酸钠(SDS)这两组效果比较好,通过进一步优化,最终选择十二烷硫酸钠(SDS)+聚乙烯吡咯烷酮(PVP K-30)为介质研磨纳米混悬剂的表面活性剂组合。
(2)考察表面活性剂的用量
根据确定的表面活性剂组合,进行优化其用量,通过制备不同的处方,确定最优的表面活性剂比例。
表2表面活性剂用量的筛选
根据确定的表面活性剂,固定制备工艺中其它条件不变,我们考察不同的表面活性剂用量对纳米混悬剂中颗粒粒径及其分布的影响。因为合适的稳定剂能够很好地保持纳米粒子的稳定性,但是并不是其用量越多越好。当在分散体系中使用太多的稳定剂时会加快奥斯特瓦尔德熟化效应,这是由于过多表面活性剂粒子的存在为药物粒子相互接触碰撞提供了“桥梁”作用,进而加快了粒子的聚集。
通过表2我们可以知道,两种类型的稳定剂用量只有在一个合适的比例时,混悬剂中颗粒粒径及其分布都比较好,溶液的体系才能达到最好的效果。当我们增加或减少离子型表面活性剂的用量时,有过多或太少的带电分子吸附在分子表面,反而会使粒子间聚集颗粒的粒径及其分布都变大;有研究表明高浓度的非离子型表面活性剂有助于制备稳定的纳米分散体系,但过多的话也会加快分散体系的絮凝。由上表我们看出,当十二烷硫酸钠(SDS)的用量为80mg和聚乙烯吡咯烷酮(PVP K-30)的用量为300mg时,纳米混悬剂体系各评价指标效果比较好。
(3)研磨时间和研磨转速的考察
根据确定的表面活性剂的比例和用量不变,考察研磨速度和研磨时间,通过制备不同的处方,确定最优的研磨时间和研磨转速。
表3研磨时间和研磨转速的筛选
从上表3的结果可以看出,固定稳定剂的种类和用量不变后,考察研磨时间和研磨转速对分散体系粒径和分布的影响。随着研磨速度的增加,所得体系颗粒的粒径显著减小。不过达到35Hz后,粒径变化趋于稳定,考虑到经济,节能等因素,选择35Hz作为本研究中的最佳研磨速度。随着研磨时间的延长,所得体系的粒径和PDI分布系数均有所减小,在6h后,粒径基本变化不大,因此选择6h为本研究中的最佳研磨时间。
最后,综合以上各项参数结果,针对盐酸胺碘酮设计的最优处方。其制备工艺参数为球磨介质为平均粒径为0.4-0.2mm的氧化锆颗粒,转速为35Hz,研磨时间6h。
通过多次单因素筛选可见,处方重量配比如下粒径和PDI均可达到较优值:
盐酸胺碘酮 1-10份
稳定剂 1-10份。
进一步优选重量配比为:
盐酸胺碘酮 8份
稳定剂 1-10份。
更进一步优选重量配比为:
盐酸胺碘酮 8份
稳定剂 4-6份。
即:相对最优处方是药物(盐酸胺碘酮)8份,SDS 1份,PVP 3.75份,转速为35Hz,球磨时间为6小时。该制备条件所得纳米混悬剂的电镜图、粒径分布图图分别见图1-图2。
二、经考察,反溶剂沉淀法与湿法研磨法稳定剂种类与用量不太一致,在湿法研磨发的基础上进行筛选。
盐酸胺碘酮纳米混悬剂反溶剂沉淀法制备过程描述:
称取适量盐酸胺碘酮溶解于无水乙醇中作为有机相,表面活性剂溶解于蒸馏水中作为水相,将水相置于0℃冰水浴中,在800rpm下将含药有机相溶液滴加于水相中,滴加完毕后除去乙醇,即得盐酸胺碘酮纳米混悬剂。
发明人通过在湿法研磨发的基础上对不同的因素(表面活性剂的种类和数量)对纳米混悬剂稳定性的影响作如下筛选:
(1)考察表面活性剂的种类:
本研究考察了十二烷硫酸钠(SDS)、磷脂酰胆碱、吐温-80、聚乙二醇(PEG-6000)、聚乙烯醇(PVA)、聚乙烯吡咯烷酮(PVP K-30)和泊洛沙姆188等它们一种或几种的混合物作为表面活性剂对纳米混悬剂稳定性的影响。
根据在介质研磨法制备盐酸胺碘酮纳米混悬剂中的表面活性剂的筛选(表1),我们选择泊洛沙姆188+十二烷硫酸钠(SDS)作为盐酸胺碘酮的稳定剂,通过后续制备工艺的优化,其淡蓝色乳光,澄清,放置后体系,能保持较长时间。
(2)考察表面活性剂的用量
根据确定的表面活性剂组合,进行优化其用量,通过制备不同的处方,确定最优的表面活性剂比例。
根据确定的表面活性剂,固定制备工艺中其它条件不变,改变其中的某一条件进行考察对纳米混悬剂中颗粒粒径及其分布的影响。因为合适的稳定剂能够很好地保持纳米粒子的稳定性,适宜的制备条件能控制药物颗粒沉淀析出的速度和结晶的大小从而形成均一稳定的纳米混悬剂。
通过表4我们可以知道,两种类型的稳定剂用量只有在一个合适的比例时,混悬剂中颗粒粒径及其分布都比较好,溶液的体系才能达到最好的效果。由上表我们看出,当泊洛沙姆188的用量为50mg和十二烷硫酸钠(SDS)的用量为10mg时,纳米混悬剂体系各评价指标效果比较好。
表4表面活性剂用量的筛选
最后,综合以上各项参数结果,在其制备工艺参数为搅拌速度为800rpm,温度为0℃。处方重量配比如下粒径和PDI均可达到较优值:
盐酸胺碘酮 1-10份
稳定剂 1-10份。
进一步优选重量配比为:
盐酸胺碘酮 10份
稳定剂 1-10份。
更进一步优选重量配比为:
盐酸胺碘酮 10份
稳定剂 4-6份。
相对最优处方是药物(盐酸胺碘酮)10份,SDS 1份,F-68 5份。
试验例1体外溶出试验:
实验方法及过程:
考虑到盐酸胺碘酮的溶解性能,参照2015版《中国药典》II部附录XC浆法进行体外溶出实验。分别精密称取盐酸胺碘酮纳米混悬剂冻干粉(NS-A粉末和NS-B粉末)、盐酸胺碘酮原料药和物理混合物4组样品,每组3份,每份约含有25mg等量的盐酸胺碘酮。将样品分别投入至37±1℃的900mL 0.5%的十二烷基硫酸钠溶液溶液中,调整搅拌速度为100r/min,分别在15min、30min、1h、2h、3h、4h、6h和8h等时间点取样5mL(同时补加相同体积的空白介质),经0.22μm微孔滤膜过滤后,经甲醇定量稀释处理后进样测定盐酸胺碘酮的含量。
结果:
盐酸胺碘酮纳米混悬剂粉末和原药、物理混合物的的溶出结果如图3所示。由图可知,到30min时,药物溶出量将达到80%,1h后基本接近90%的溶出。而盐酸胺碘酮物理混合物和原料药的溶出速度比较缓慢,并且药物溶出量也较低,大约只有药物总量的30%。结果说明盐酸胺碘酮纳米混悬剂能显著提高药物的溶出速度,能使药物在短的时间内快速溶出,有助于药物在体内的吸收。
试验例2体内药代动力学试验
实验方法及过程:
选取健康的雄性Wistar大鼠24只,体重200±20g,随机分为4组,每组6只。实验前禁食12h,试验分为灌胃组(3组)和静脉组(1组),口服灌胃组分别灌胃纳米混悬剂溶液(NS-A和NS-B)和普通混悬剂溶液,给药量为50mg/Kg;静脉组为注射盐酸胺碘酮溶液,给药量为20mg/Kg。分别在给药后0.133、0.25、0.5、0.75、1、2、4、6、8、10、12、24、36、48和72h时间点断尾取血0.3-0.4mL。将取出的血液加入经肝素钠预处理过的离心管中,6000rpm离心10min后,吸取上层血浆测定药物浓度。
根据标准曲线和样品的峰面积计算出每个样品的血药浓度,用DAS ver2.0(DrugAnd Statistics for Windows)软件进行处理,计算药代动力学参数,得血药浓度-时间曲线面积等参数,根据公式计算得到化合物的生物利用度。
根据下述公式计算绝对生物利用度(F):
结果:
从药时曲线图4和药动参数表5可看出,大鼠经灌胃给药三种不同制剂后,盐酸胺碘酮在体内呈现出不同的药动学特征。给予两种纳米混悬剂的灌胃组均在8h出现最高的血药浓度峰值,表明纳米混悬剂可加快吸收。与盐酸胺碘酮普通混悬剂相比,大鼠经给NS-A和NS-B盐酸胺碘酮纳米混悬剂后,其Cmax和AUC0–∞分别是普通混悬剂的1.54、1.68和1.94、2.25倍,其血药浓度显著提高,NS-A和NS-B盐酸胺碘酮纳米混悬剂的绝对生物利用度分别为75.91%和64.72%,是普通混悬剂(33.31%)的2-3倍。另从清除率(CL)可知,盐酸胺碘酮纳米混悬剂在体内的清除率降低,表观分布体积升高,表明盐酸胺碘酮制成纳米混悬剂后,能逃避肝脏代谢进而使代谢过程减慢,有利于提高生物利用度。另外可以很清楚的看到,相对于普通混悬剂,盐酸胺碘酮纳米混悬剂给药后,动物体内血药浓度相对较高,并且药物在血液中持续时间更长。所以,药物在制备成纳米混悬剂后,药物的吸收有了明显增加。证明药物颗粒的粒径减小后,增加了药物的表面积和药物与胃肠道接触的面积,确实能够大大增加药物的吸收率。
表5 Wistar大鼠经口灌胃组:AD普通混悬剂、AD的NS-A和NS-B纳米混悬剂(50mg/kg);静脉组:AD溶液(20mg/kg)的主要的药动学参数
以下为本发明纳米混悬剂的制备实例。
实施例1
先称取0.3gPVP,0.08gSDS溶解到纯化水20mL中,得到溶液;将0.8g盐酸胺碘酮分散到上述溶液中,制备成普通混悬剂;将所得普通混悬剂加入到球磨罐中,并加入20g直径为0.2mm的氧化锆颗粒;将球磨罐密封后,放入球磨机中,设定转速为35Hz,研磨6小时;之后用玻沙漏斗过滤掉氧化锆颗粒,即得盐酸胺碘酮纳米混悬剂。测得其粒径为:204.5nm,PDI为0.217。之后加入5%的甘露醇,将样品分装2mL到西林瓶中,在-80℃中预冻12小时,然后再冷冻干燥机中冻干24小时,得到疏松的冻干粉末,之后加入纯化水复溶,粒径增大在5%之内。
实施例2
先称取0.35g PVP,0.15g SDS溶解到纯化水20mL中,得到溶液;将0.8g盐酸胺碘酮分散到上述溶液中,制备成普通混悬剂;将所得普通混悬剂加入到球磨罐中,并加入20g直径为0.2mm的氧化锆颗粒;将球磨罐密封后,放入球磨机中,设定转速为35Hz,研磨8小时;之后用玻沙漏斗过滤掉氧化锆颗粒,即得盐酸胺碘酮纳米混悬剂;测得其粒径为:321.9nm,PDI为0.298。
实施例3
先称取0.3g PVP,0.08mL SDS溶解到纯化水20mL中,得到溶液;将0.8g盐酸胺碘酮分散到上述溶液中,制备成普通混悬剂;将所得普通混悬剂加入到球磨罐中,并加入20g直径为0.2mm的氧化锆颗粒;将球磨罐密封后,放入球磨机中,设定转速为30Hz,研磨8小时;之后用玻沙漏斗过滤掉氧化锆颗粒,即得盐酸胺碘酮纳米混悬剂。测得其粒径为:215.3nm,PDI为0.221。
实施例4
先称取0.4g PVP,0.15g SDS溶解到纯化水20mL中,得到溶液;将0.8g盐酸胺碘酮分散到上述溶液中,制备成普通混悬剂;将所得普通混悬剂加入到球磨罐中,并加入20g直径为0.2mm的氧化锆颗粒;将球磨罐密封后,放入球磨机中,设定转速为35Hz,研磨8小时;之后用玻沙漏斗过滤掉氧化锆颗粒,即得盐酸胺碘酮纳米混悬剂。测得其粒径为:237.1nm,PDI为0.217。
实施例5
称取100mg盐酸胺碘酮溶解于8mL无水乙醇中作为有机相,表面活性剂0.05g PVP,0.02g SDS溶解于蒸馏水中作为水相,将水相置于0℃冰水浴中,在800rpm下将含药有机相溶液滴加于水相中,滴加完毕后除去乙醇,即得盐酸胺碘酮纳米混悬剂。测得其粒径为:235.8nm,PDI为0.221。
实施例6
称取100mg盐酸胺碘酮溶解于10mL无水乙醇中作为有机相,表面活性剂0.05g F-68,0.01g SDS溶解于蒸馏水中作为水相,将水相置于0℃冰水浴中,在800rpm下将含药有机相溶液滴加于水相中,滴加完毕后除去乙醇,即得盐酸胺碘酮纳米混悬剂。测得其粒径为:196.5nm,PDI为0.181。
实施例7
称取100mg盐酸胺碘酮溶解于10mL无水乙醇中作为有机相,表面活性剂0.05gPVP,0.01g SDS溶解于蒸馏水中作为水相,将水相置于0℃冰水浴中,在800rpm下将含药有机相溶液滴加于水相中,滴加完毕后除去乙醇,即得盐酸胺碘酮纳米混悬剂。测得其粒径为:265.4nm,PDI为0.235。
实施例8
称取100mg盐酸胺碘酮溶解于8mL无水乙醇中作为有机相,表面活性剂0.05g F-68,0.02g SDS溶解于蒸馏水中作为水相,将水相置于0℃冰水浴中,在800rpm下将含药有机相溶液滴加于水相中,滴加完毕后除去乙醇,即得盐酸胺碘酮纳米混悬剂。测得其粒径为:210.2nm,PDI为0.204。
- 盐酸胺碘酮纳米混悬剂及其制法和应用
- 4-(4-(3-三氟甲基)苯甲酰胺基苯氧基)-2-(甲基氨甲酰基)吡啶纳米混悬剂及其制法和应用
