PB在制备预防或治疗PILO诱导的癫痫药物中的应用
文献发布时间:2023-06-19 10:43:23
技术领域
本发明属于药物制剂领域,具体涉及巴利森苷B(PB)在制备预防或治疗匹鲁卡品(PILO)诱导的癫痫药物中的应用。
背景技术
公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
癫痫(epilepsy,EP),一种大脑神经细胞过度异常放电导致的慢性、反复性、进行性的慢性疾病,主要临床表现为突然发作并伴有短暂大脑功能障碍,被列为全球第二大、重点防治的神经系统疾病。
目前,EP的临床治疗主要以服用抗癫痫药物(Antiepileptic drugs,AEDs)为主,但AEDs对30%左右的EP患者发作并不能达到完全有效的控制,长期地服用AEDs还会产生认知功能下降、共济失调等严重影响生活质量的不良反应。中药治疗癫痫历史悠久,具有毒副作用小、作用靶点多的优点,以中药为来源的抗癫痫药物研发具有极大的挖掘潜力,成为近年来抗EP药物研究的热点。例如,石菖蒲中的α-细辛醚能显著改善EP大鼠的学习记忆能力、延长EP自发与反复发作的潜伏期、降低发作频率与等级;钩藤中的钩藤碱可提高血清超氧化物歧化酶活性,下调海马组织Toll-样受体4的表达,对EP持续状态导致的大鼠脑损伤有保护作用;川芎中的川芎嗪可降低IL-2,IL-6和TNF-α的表达对抗戊四氮所致大鼠的EP发作;胡椒中的胡椒碱通过影响抑制性氨基酸和γ-氨基丁酸功能,可显著延长EP小鼠惊厥潜伏期,降低死亡率等,从中医药宝库中寻找高效、低毒的EP防治天然活性成分具有重要的社会和经济效益。
但是发明人研究发现,现有动植物中提取的多种生物活性成分对于EP具有一定的预防及预防作用。但是癫痫产生的原因有遗传、内分泌失调、睡眠原因、化学成分等,在实际预防或治疗过程中,不同原因导致的癫痫需要采用不同的方法预防或治疗。
发明内容
为了更精准高效地预防或治疗癫痫,发明人经长期的技术与实践探索,意外发现巴利森苷B(Parishin B,PB)能够显著延长由匹鲁卡品(Pilocarpine,PILO)诱导的癫痫的潜伏期,缩短癫痫持续状态时间,降低癫痫痫性发作等级,减缓癫痫造成的体重减轻,从而对PILO诱导的癫痫具有良好的预防和治疗作用。
具体地,本发明是通过如下所述的技术方案实现的:
本发明第一方面,提供巴利森苷B在制备预防/或治疗癫痫药物中的应用。
本发明第二方面,提供一种预防/或治疗癫痫的药物,药物包括巴利森苷B。
本发明一个或多个实施例具有以下有益效果:
1)本发明首次发现巴利森苷B能够显著延长由匹鲁卡品诱导的癫痫的潜伏期,缩短癫痫持续状态时间,降低癫痫痫性发作等级,减缓癫痫造成的体重减轻,从而对PILO诱导的癫痫具有良好的预防和治疗作用。
2)综合PPI网络、靶点富集分析等结果,选择FGFR3、FGF-2、PTEN、MAPK12、MTOR 5个蛋白为关键靶点,通过Protein Data Bank(http://www.rcsb.org/pdb/)找到相应蛋白的PDB-ID。利用SYBYL-X 2.0软件Surflex-Dock模块对PB和关键靶蛋白进行分子对接,结果表明,PB与各靶点蛋白均具有一定的相互作用,其中与FGFR3、MAPK12、MTOR具有较好的结合活性。
3)本发明研究表明巴利森苷B具有预防或治疗匹鲁卡品诱导的癫痫的能力,在匹鲁卡品诱导的癫痫方面具有重要的临床应用价值,同时为巴利森苷B活性成分开辟了新的药物用途。
附图说明
构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。以下,结合附图来详细说明本发明的实施方案,其中:
图1为本发明实施例2中PB对EP小鼠体重的影响;
图2为本发明实施例2中PB对EP小鼠存活率的影响;
图3为本发明实施例2中PB对EP小鼠癫痫潜伏期的影响;
图4为本发明实施例2中PB对EP小鼠癫痫持续发作时间的影响;
图5为本发明实施例2中PB抗EP核心靶点的互作网络关联图;
图6为本发明实施例2中PB抗EP核心靶点的GO生物功能注释;
图7为本发明实施例2中PB抗EP作用靶点的KEGG通路富集分析气泡图;
图8为本发明实施例2中PB与关键靶蛋白分子对接模式图。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本公开的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
为了更精准高效地预防或治疗癫痫,发明人经长期的技术与实践探索,意外发现巴利森苷B(Parishin B,PB)能够显著延长由匹鲁卡品(Pilocarpine,PILO)诱导的癫痫的潜伏期,缩短癫痫持续状态时间,降低癫痫痫性发作等级,减缓癫痫造成的体重减轻,从而对PILO诱导的癫痫具有良好的预防和治疗作用。
巴利森苷B(Parishin B,PB)分子式如下:
具体地,本发明是通过如下所述的技术方案实现的:
本发明第一方面,提供巴利森苷B在制备预防/或治疗癫痫药物中的应用。
在本发明的一个或多个实施例中,所述癫痫是由匹鲁卡品诱导引发所致。
在本发明的一个或多个实施例中,巴利森苷B能够显著延长癫痫小鼠的癫痫潜伏期,缩短癫痫持续状态时间,降低癫痫小鼠痫性发作等级,抑制癫痫产生的体重降低。
在本发明的一个或多个实施例中,巴利森苷B通过与靶点FGFR3、MAPK12、MTOR结合来延长癫痫小鼠的癫痫潜伏期,缩短癫痫持续状态时间,降低癫痫小鼠痫性发作等级,抑制癫痫产生的体重降低。
新药物和靶点结合的发现有助于为多靶点给药提供依据,避免作用于同一靶点的药物发生竞争,降低药效。
本发明第二方面,提供一种预防/或治疗癫痫的药物,药物包括巴利森苷B。
所述预防/或治疗癫痫由匹鲁卡品诱导引发所致。
在本发明的一个或多个实施例中,所述药物用药有效浓度为50-200μmg/kg及以上,优选为200mg/kg。
在本发明的一个或多个实施例中,所述预防/或治疗癫痫的药物还包含一种或多种药学上或食品学上可接受的辅料。
在本发明的一个或多个实施例中,固态形式的制剂包括粉剂、片剂、分散颗粒、胶囊、药丸及栓剂;优选的,粉剂及片剂包含约0.1%至约99.9%的活性成分;固体辅料选自碳酸镁、硬脂酸镁、滑石粉、糖或者乳糖;
液态形式的制剂包括溶液、悬浮液及乳液,优选的,液态为非经肠注射用水溶液或水-丙二醇溶液,或添加甜味剂及造影剂的口服溶液。
在本发明的一个或多个实施例中,所述药物制成注射用小水针、注射用冻干粉针、大输液或小输液。
下面结合具体的实施例,对本发明做进一步的详细说明,应该指出,所述具体实施例是对本发明的解释而不是限定。
仪器与试药
KQ-250型超声波清洗器(昆山市超声仪器有限公司);AV412型十分之一电子天平(美国奥豪斯公司);EP214C型万分之一电子天平(瑞士梅特勒-托利多仪器有限公司);巴利森苷B(批号:PRF7070743,质量分数≥98%),购自成都普瑞法科技开发有限公司;盐酸匹鲁卡品(批号:066k1730,质量分数≥98%),购自美国Sigma公司;0.9%生理盐水(批号:20190720),购自山东拓普生物工程有限公司;硫酸阿托品注射液(批号:1902251)、地西泮注射液(批号:1903101)均购自天津金耀药业有限公司。
实验动物
SPF级C57BL/6J雄性小鼠,6周龄,体重20.0g~23.0g,购自济南朋悦实验动物繁育有限公司,生产许可证编号:SCXK(鲁)20140007。饲养环境:山东中医药大学附属医院动物实验中心,屏障环境饲养,使用许可证编号:SYXK(鲁)20180015。实验获得山东中医药大学附属医院实验动物伦理委员会的批准。
实施例1实验部分
1.EP模型的建立
C57BL/6J小鼠适应性饲养1周后,取小鼠腹腔注射硫酸阿托品(1mg/kg),拮抗外周胆碱能反应,15min后腹腔注射PILO(280mg/kg),出现EP症状后60min,以腹腔注射地西泮(10mg/kg)终止反应。按照Racine分级评价,发作等级达到4~5级视为模型制备成功。Racine分级具体指标如下:1级:面部抽搐;2级:点头;3级:单侧前肢阵挛发作;4级:起身,双侧前肢阵挛发作;5级:双侧前肢阵挛发作伴倒地。
2.动物分组与给药
C57BL/6J小鼠随机选取15只作为空白组,将模型制备成功的小鼠随机分为模型组及PB低、中、高剂量给药组,每组15只。空白组:灌胃给予生理盐水+腹腔注射生理盐水;模型组:灌胃给予生理盐水+腹腔注射PILO;PB给药组:灌胃给予PB+腹腔注射PILO。PILO腹腔注射剂量为280mg/kg,1次/2天,共28天。PB低、中、高剂量灌胃剂量分别为50、100、200mg/kg,1次/1天,共28天。模型组、PB给药组灌胃30min后均腹腔注射硫酸阿托品(1mg/kg),以拮抗外周胆碱能反应,15min后再腹腔注射PILO,小鼠在出现癫痫症状后60min,以腹腔注射地西泮(10mg/kg)终止反应。
3.PB对致痫小鼠体重、存活率及痫性行为的影响
第1日、第28日灌胃前对小鼠体重进行称量,记录并计算各组小鼠的平均体重;每日记录各组小鼠的死亡情况,并计算存活率;第2日、第28日腹腔注射PILO后密切观察并记录小鼠EP发作的潜伏期(min)、发作持续时间(s)、发作等级等痫性行为,发作等级按照Racine分级评价,发作等级达到4~5级视为模型制备成功。Racine分级具体指标如下:1级:面部抽搐;2级:点头;3级:单侧前肢阵挛发作;4级:起身,双侧前肢阵挛发作;5级:双侧前肢阵挛发作伴倒地。
4.PB成分作用靶点筛选
利用Swiss Target Prediction(http://www.swisstargetprediction.ch/)数据库,选择人源基因“Homo sapiens”作为研究对象,预测PB成分潜在作用靶点;通过SEA数据库(http://sea.bkslab.org/)检索PB相关作用靶点,将2个数据库检索到的化合物靶点合并,删除重复基因,即得PB成分作用靶点基因。
5.EP疾病靶点筛选
利用OMIM(https://www.omim.org/)、GeneCards(http://www.genecards.org/)和ETCM(http://www.nrc.ac.cn:9090/ETCM/index.php/Home/Index/index.html)数据库,分别以“epilepsy”为关键词,进行EP疾病靶点的检索,将3个数据库的检索结果进行合并,即得EP疾病相关的靶点基因。
6.PB成分靶点-EP疾病靶点互作网络(PPI)的构建及核心靶标的筛选
在STRING(https://string-db.o-rg)平台构建PB成分靶点-EP疾病靶点PPI,物种设为“Homo sapiens”,最低相互作用阈值设为中等置信度“Medium confidence”0.4,其余参数保持默认设置。运用Cytoscape 3.7.1对PPI网络进行拓扑属性分析,筛选PPI网络中的核心靶点。筛选条件:以“节点连接度(degree)”的2倍中位数为卡值,选取PPI的核心节点;在此基础上,以“degree”、“节点紧密度(closeness)”和“节点介度(betweenness)”的中位数为卡值,选取同时满足3个卡值的靶点即为核心靶点。
7.核心靶点的GO生物功能注释和KEGG通路富集分析
运用DAVID数据库(https://david.ncifcrf.gov/summary.jsp)对筛选的核心靶点进行GO生物功能注释和KEGG通路富集分析,其中GO生物功能注释包括生物过程(biological process,BP)、分子功能(molecular function,MF)和细胞成分(celluarcomponent,CC)。物种名称设定“Homo sapiens”,设置P≤0.05。
8.分子对接
综合PPI网络、靶点富集分析等结果,利用SYBYL-X 2.0软件Surflex-Dock模块对PB和关键靶点进行分子对接验证,预测PB分子和目标蛋白可能发生的相互作用,根据对接打分Total score结果,评价PB成分与关键靶点之间的结合活性。
9.统计学方法
采用SPSS 20.0统计学软件进行统计分析。计量资料以x±s表示,多组间比较采用单因素方差分析,方差齐的采用SNK检验,方差不齐的采用Dunnet t检验,P≤0.05表示差异有统计学意义。
实施例2结果讨论
1.PB对EP小鼠体质量、存活率的影响
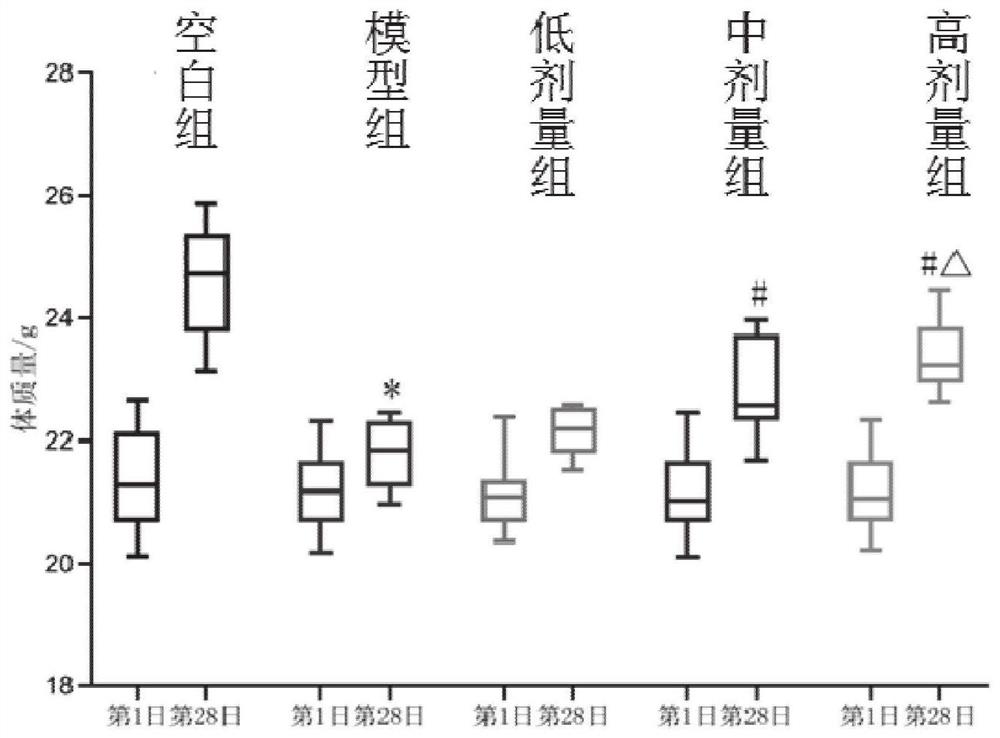
第1日实验各组小鼠体质量无显著性差异(P≥0.05)。第28日,与空白组相比,模型组小鼠体质量显著降低(P≤0.05),提示长期EP发作对小鼠体质量增长具有一定抑制作用;与模型组相比,低剂量组小鼠体质量无显著性变化(P≥0.05),中剂量组、高剂量组能显著增加EP小鼠的体质量(P≤0.05),说明PB给药能抑制EP小鼠体质量降低趋势;与低剂量组相比,中剂量组小鼠体质量变化无显著性差异(P≥0.05),高剂量组小鼠体质量变化有显著性差异(P≤0.05),提示PB给药改善EP小鼠体质量降低趋势具有一定的剂量依赖性,具体结果见图1。
模型组28日存活率为60.0%,较空白组存活率显著降低(P≤0.05),说明长期EP发作可降低小鼠的存活率;低剂量组、中剂量组28日存活率分别为66.7%、73.3%,较模型组存活率均无显著性差异(P≥0.05),高剂量组28日存活率为93.3%,与模型组相比,存活率显著提高(P≤0.05),说明PB给药适宜剂量可提高EP小鼠的存活率,具体结果见图2。
注:与空白组比,*P≤0.05;与模型组比,#P≤0.05,与低剂量组比,△P≤0.05
2.PB对EP小鼠痫性行为学变化的影响
第2日实验各组小鼠EP发作潜伏期、持续发作时间均无显著性差异(P≥0.05),发作等级为4~5级。第28日,与模型组相比,低剂量组EP小鼠发作潜伏期、持续发作时间均无显著性差异(P≥0.05),发作等级为4~5级;与模型组、低剂量组相比,中剂量组、高剂量组均能显著延长EP小鼠癫痫发作潜伏期(P≤0.05)、缩短持续发作时间(P≤0.05),发作等级为3~4级;与中剂量组相比,高剂量组EP小鼠癫痫发作潜伏期、持续发作时间具有显著性差异(P≤0.05),结果提示PB给药适宜剂量可显著改善EP小鼠痫性行为,具体结果见图3和图4。
3.PB成分作用靶点
经SEA数据库和Swiss Target Prediction数据库检索,去除重复值后共得到PB潜在作用靶点共63个,结果见表1。
表1 PB成分潜在作用靶点
Table 1 Potential targets of PB
4.EP疾病靶点
经OMIM、GeneCards和ETCM数据库检索,去除重复值后共得到EP疾病潜在作用靶点共719个。
5.PB成分靶点-EP疾病靶点PPI构建及核心靶标
将PB成分靶点和EP疾病靶点在STRING数据库进行初筛,共得到靶点304个,然后将其得导入Cytoscape-v 3.7.1软件,进行拓扑分析筛选,最终得到核心靶点共52个,具体见表2,PPI见图5。
表2 PB抗EP核心靶点及其拓扑参数
Table 2 Key targets of PB in antiepileptic and their topologicalparameters
6.核心靶点的GO生物功能注释和KEGG通路富集分析
将“PB成分靶点-EP疾病靶点PPI构建及核心靶标”项获取的52个靶点信息导入到DAVID数据库进行GO富集分析。结果显示与BP相关的条目有27个,包括血管生成、细胞增殖、神经元突触可塑性、细胞分裂、细胞缺氧反应、中枢神经系统髓鞘化、蛋白质磷酸化、胞内钠离子稳态等方面;与MF相关的条目有3个,包括生长因子活性、蛋白结合、ATP结合;与CC相关的条目有13个,包括高尔基体、神经元突触、原生质膜、外泌体、树突、轴突、微管等,见图6。
KEGG通路注释分析共富集出59条生物通路,按照P≤0.05的阈值,筛选得到与EP相关的通路15条,通路相关靶蛋白基因结果见表3,通路富集气泡图见图7。结果分析表明PB抗EP机制可能与VEGF信号通路、MAPK信号通路、PI3K-Akt信号通路、FoxO信号通路、Rap1信号通路、Ras信号通路等有关。此外研究还发现PB对神经胶质瘤、肾细胞癌、子宫内膜癌等有一定的作用。
表3 PB抗癫痫KEGG富集相关通路的靶蛋白基因
Table 3 Genes enriched by PB inantiepileptic-associated KEGG pathway
7.分子对接验证
综合PPI网络、靶点富集分析等结果,选择FGFR3、FGF-2、PTEN、MAPK12、MTOR 5个蛋白为关键靶点,通过Protein Data Bank(http://www.rcsb.org/pdb/)找到相应蛋白的PDB-ID。利用SYBYL-X 2.0软件Surflex-Dock模块对PB和关键靶蛋白进行分子对接,结果见表4、图8。文献表明,Total score≥4.25;说明分子与靶点有一定的相互作用;Total score≥7.0,说明分子与靶点具有较好的结合活性,从对接结果可以看出,PB与各靶点蛋白均具有一定的相互作用,其中与FGFR3、MAPK12、MTOR具有较好的结合活性。
表4PB成分与关键靶蛋白的分子对接得分值
Table 4 Docking scores of PB with its key targets
实施例3
基于前期酒炙天麻相关研究基础,本发明首先探讨PB成分对PILO诱发的EP小鼠痫性行为的初步干预作用。《神农本草经》记载天麻“味辛,温。……,久服益气力,长阴肥健,轻身增年。”本研究表明PB给药能抑制EP小鼠体质量降低趋势,且具有一定的剂量依赖性,同时可提高EP小鼠的存活率、延长EP发作潜伏期、缩短持续状态时间及降低发作等级,PB对EP小鼠痫性行为发生具有一定的改善作用,本研究将为PB抗癫痫创新药物的开发奠定研究基础。
EP发作或EP持续状态会对大脑认知功能产生损害,改善EP发作致认知功能障、学习记忆减退等脑功能损伤是目前抗癫痫药物研究的热点之一,如山竹果壳中的α-倒捻子素成分对戊四氮点燃的EP小鼠有治疗作用,并可改善EP小鼠学习记忆能力;灵芝中的灵芝三萜成分具有改善戊四氮点燃的EP大鼠的学习记忆损伤的效果,同时能改善EP引起的神经细胞损伤。研究表明天麻对血管性痴呆大鼠,慢性不可预见性温和应激大鼠,记忆获得、巩固和再现障碍小鼠,Aβ1-42致痴呆大鼠等模型的学习记忆障碍具有改善作用,本研究后期将进一步考察PB成分对PILO诱发的EP小鼠学习记忆能力是否有改善作用。
本研究应用网络药理学技术方法探讨PB成分抗EP的潜在作用机制,PPI网络分析筛选共得到52个核心靶点,包括VEGFA、FGF2、HRAS、PTEN、MTOR、SLC2A1、IL2、ESR1、CAV1、GRM5、SCN2A等。其中VEGFA是最主要的血管内皮生长因子,VEGF可调节EP脑内突触神经传递、脑血管异常,改善血管源性水肿,促进EP持续状态后的海马神经再生和逆转认知缺陷,系统参与EP发病机制;FGF-2具有神经递质或神经调质的功能,是形成学习与记忆的主要机制,可增强EP大鼠增强内源性神经保护机能;PTEN的表达可延长EP大鼠的潜伏期,降低EP发作频率,抑制脑神经元凋亡,降低神经炎症反应,靶向PTEN可对EP发生发挥关键作用;MTOR调节神经元发育和突触可塑性,参与氧化应激与自噬的调控,在癫痫的形成、发生中起重要作用,上述分析表明PB治疗EP具有多靶点、多环节、多途径的作用特点,目前还未见PB抗EP作用机制研究的相关报道,另分子对接研究结果显示,FGF-2、PTEN、MTOR等靶蛋白与PB均具有一定的结合活性,其或可成为PB抗EP研究的潜在作用靶点。
GO富集分析显示,PB抗EP主要涉及血管生成、细胞增殖、神经元突触可塑性、细胞缺氧反应、中枢神经系统髓鞘化、蛋白质磷酸化等生物过程,生长因子活性、蛋白结合等分子功能及外泌体、微管等细胞成分。研究报道,激活神经突触可塑性可抑制EP形态活性;中枢神经系统髓鞘发育不良可引起EP发作,EP反复发作引起的中枢神经系统白质脱髓鞘样改变又可促进EP的进一步发作;通过抑制CRMP-2蛋白表达并促进其磷酸化可抑制神经轴突的生长,进而可发挥抗EP作用;Tau蛋白过度磷酸化导致其失去促微管组装的生物学功能,降低Tau蛋白磷酸化程度可改善在EP发作造成的认知功能下降。结合对FGF-2、MTOR等靶点作用分析,后期PB抗EP机制研究可从调控细胞氧化应激、自噬、微管组装影响神经生长因子活性、神经元突触可塑性等角度深入开展。
KEGG通路富集分析显示,PB抗EP主要涉及VEGF、MAPK、PI3K-Akt、FoxO、Rap1、Ras等信号通路。研究报道,未成熟脑惊厥持续状态后的潜伏期是影响EP形成的关键时期,在潜伏期抑制VEGF通路表达可以改善海马病理损伤,阻碍EP的形成;MAPK信号通路在EP发病中起到关键作用,p38MAPK抑制剂可以有效缩短EP大鼠的痫性发作时间并改善大鼠的认知功能;腺苷A2A受体阻断剂SCH58261可通过抑制MAPK通路对EP持续状态造成的海马神经元损伤起一定保护作用;miR129通过抑制MAPK信号通路,抑制c-Fos表达,影响海马神经元增殖和凋亡,从而抑制EP的发生发展;H
本研究通过初步药效学评价、网络药理学分析、分子对接及文献信息挖掘的组合研究模式,探讨PB成分的抗EP活性及潜在的作用靶点及作用机制,研究结果提示PB可能通过多靶点、多通路发挥抗EP药理作用,下一步将对所预测分析得到的潜在关键靶点和通路进行试验验证,为PB抗癫痫创新药物的深入开发提供研究基础。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- PB在制备预防或治疗PILO诱导的癫痫药物中的应用
- PB在制备预防或治疗PILO诱导的癫痫药物中的应用
