一对用于检测芋螺毒素的抗体及其应用
文献发布时间:2023-06-19 11:42:32
技术领域
本发明属于生物药物分析领域,特别是涉及一对用于检测芋螺毒素的抗体及其应用。
背景技术
疼痛是一种与组织损伤或潜在组织损伤相关的不愉快的主观感觉和情感体验,也是一种预防机体遭受进一步损伤的预防机制。诱发慢性疼痛的因素有很多,目前临床上治疗慢性疼痛的药物都会伴有一定的不良反应,同对于疼痛的治疗效果也是很难让人满意。α9a10型烟碱乙酰胆碱受体(α9a10 nAChRs)被认为一个新型的重要的治疗疼痛的靶点。
芋螺毒素αO-GeXIVA是利用cDNA克隆技术从我国南海海域的将军芋螺中鉴定的一种新型芋螺毒素,由28个氨基酸组成,包含4个半胱氨酸,可通过半胱氨酸之间形成二硫键产生3种异构体。其中,GeXIVA[1,2]是迄今为止活性最强的特异性阻断α9α10nAChRs的芋螺毒素,其半阻断剂量为4.6nM。在慢性压迫性神经痛(CCI)模型和选择性神经损伤(SNI)模型中,通过肌肉注射GeXIVA[1,2],模型动物的机械痛感得到显著缓解,镇痛效果达6h,具有极为强大的镇痛活性。而相比之下,目前上市的一些同类镇痛药物,需要通过脊髓注射中枢给药才能发挥药效。因此GeXIVA[1,2]十分具有药用潜力,有望运用于临床成为第二代新型镇痛药。
相比于GeXIVA[1,2]已广泛开展的药效学(PD)研究,其在药代动力学(PK)方面的研究目前仍未很好的进行。药物在进入体内后经过吸收、分布、代谢最后排泄出体外,获取PK特征有助于阐明药物在体内发挥药效作用的机制,同时也是药物研究必不可少的部分。PK数据可以与PD相结合构建PK-PD模型,借助数学方法把浓度、时间、药物效应三者之间的关系,能够更为全面的了解药物的效应随剂量及时间的变化规律。构建PK-PD模型一方面有助于阐明药物作用机制,评价药物相互作用,为临床前研究提供了有效的研究方法;另一方面可模拟临床试验,优化给药方案,指导个体治疗,为新药的临床应用提供了重要的理论基础。基于PK-PD模型,使用不同种属动物的PK-PD数据构建生理药代动力学(PBPK)模型,可将临床前动物数据外推至人、指导临床人首次用药(FIH)、预测药物-药物相互作用(DDI)、指导特殊人群用药等。这些基于PK数据的模型的建立以及运用对新药的开发均具有深远的意义。PK研究的基础,是一套高灵敏度高特异性的生物分析检测方法。目前GeXIVA[1,2]仍欠缺一高灵敏度高特异性的在多种生物基质中分析定量方法,这也是现阶阶段制约GeXIVA[1,2]PK研究展开的的主要因素之一。对于GeXIVA[1,2],目前未有可行的能够借鉴的生物分析方法,亦无商品化的抗体。
发明内容
为了解决上述问题,本发明提供了一对用于检测芋螺毒素的抗体及其应用。本发明提供的用于检测芋螺毒素的抗体,具有灵敏度高特异性好,能够充分满足检测需求的优势。本发明不仅为芋螺毒素提供了灵敏的生物检测方法,也为芋螺毒素后续的可能的临床试验数据分析提供了可靠的技术支持。
为了实现上述目的,本发明提供了如下技术方案:
本发明提供了一对用于检测芋螺毒素的抗体,所述抗体包括捕获抗体4B2和检测抗体2#;所述捕获抗体4B2的重链的核苷酸序列如SEQ ID NO:1所示,捕获抗体4B2的轻链的核苷酸序列如SEQ ID NO:2所示。
优选的,所述检测抗体2#包括生物素标记的检测抗体2#。
本发明还提供了上述抗体在检测芋螺毒素中的应用。
优选的,所述芋螺毒素包括GeXIVA[1,2]。
本发明提供了一种用于检测芋螺毒素的试剂盒,所述试剂盒包括上述的抗体和反应液。
优选的,所述反应液包括包被液、封闭液、样品稀释液和显色液;所述封闭液包括含酪蛋白的磷酸盐缓冲液;所述包被液包括碳酸钠-碳酸氢钠缓冲液;所述样品稀释液优选包括含牛血清白蛋白的磷酸盐缓冲液;所述显色液包括TMB。
本发明还提供了一种芋螺毒素的检测方法,所述检测方法包括以下步骤:对上述捕获抗体4B2依次进行包被和封闭,加入待测样品并混合后,加入生物素标记的上述检测抗体2#,加入亲和素-辣根过氧化物酶,进行显色处理,显色处理结束后与标准曲线进行对比。
优选的,所述捕获抗体4B2的浓度为10μg/mL;所述生物素标记的检测抗体2#的浓度为2μg/mL。
优选的,所述待测样品包括血浆。
优选的,所述待测样品的前处理方法包括:将血浆与蛋白酶抑制剂混合后,进行离心处理得到血浆样品,将血浆样品与含有蛋白酶抑制剂的样品稀释液混合。
本发明提供了一对用于检测芋螺毒素的抗体,所述抗体包括捕获抗体4B2和检测抗体2#。所述抗体具有灵敏度高和特异性好的优势。由实施例数据可知,本发明提供的抗体具有极高的选择性和特异性,试验结果显示血浆中内源性物质不干扰GeXIVA[1,2]的测定;试验中大鼠及比格犬血浆中GeXIVA[1,2]的最低定量限为1.25ng/mL表明具有极高的灵敏度。
附图说明
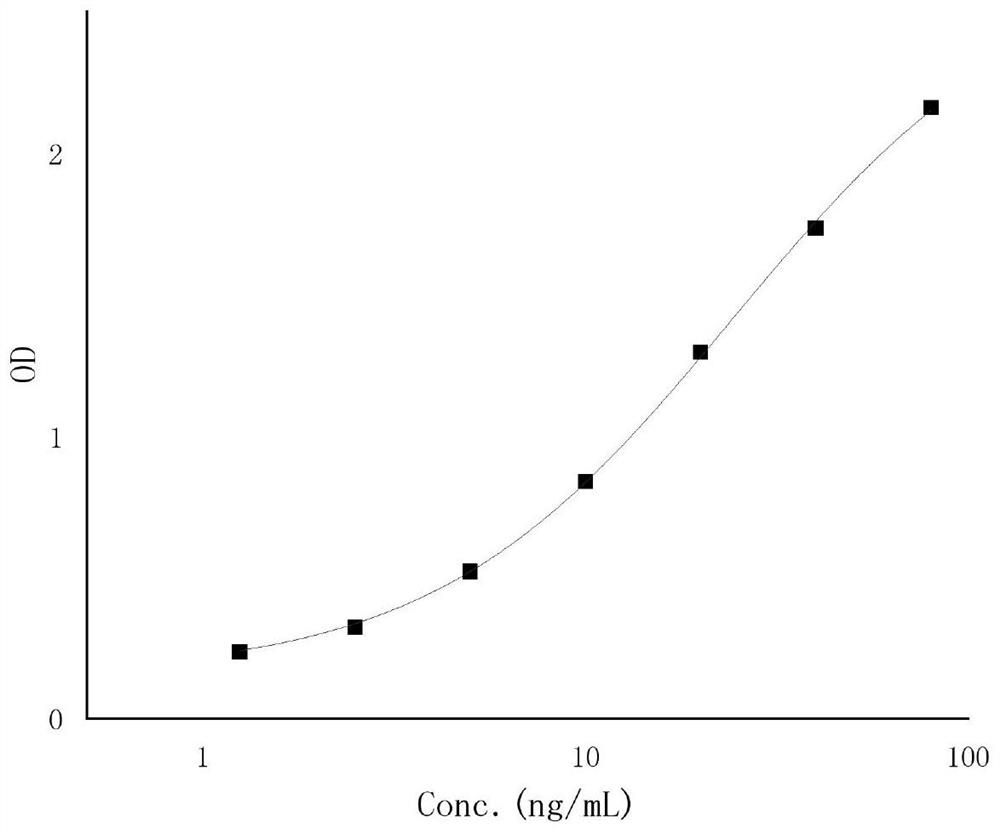
图1为比格犬血浆GeXIVA[1,2]样品标准曲线图;
图2为大鼠血浆GeXIVA[1,2]样品标准曲线图。
具体实施方式
本发明提供了一对用于检测芋螺毒素的抗体,所述抗体包括捕获抗体4B2和检测抗体2#;所述捕获抗体4B2的重链的核苷酸序列如SEQ ID NO:1所示,捕获抗体4B2的轻链的核苷酸序列如SEQ ID NO:2所示。所述SEQ ID NO:1为:
ATGGGATGGAGCTGTATCATCCTCTTCTTGGTATCAACAGCTACAGGTGTCCACTCCCAGGTCCAACTGCAGCAGCCTGGGGCTGAGCTTGTGAAGCCTGGGGCTTCAGTGAAGCTGTCCTGCAAGGCTTCTGGCTACACCTTCACCAGCTACTGGATTCACTGGGTGAAGCAGAGGCCTGGACAAGGCCTTGAGTGGATCGGAGAGATTGATCCTTCTGATTTTTATACTAACTACAATCAAAAGTTCAAGGGCAAGGCCACATTGACTGTAGACAAATCCTCCAGCACAGCCTACATACACCTCAGCAGCCTGACATCTGAGGACTCTGCGGTCTATTACTGTGCCCTCTTTGGTAACCACGGGGCTTACTGGGGCCAAGGGACTCTGATCACTGTCTCTGCA;所述SEQ ID NO:2为:
ATGAAGTCACAGACCCAGGTCTTCGTATTTCTACTGCTCTGTGTGTCTGGTGCTCATGGGAGTATTGTGATGACCCAGACTCCCAAATTCCTGCTTGTATCAGCAGGAGACAGGGTTACCATAACCTGCAAGGCCAGTCAGAGTGTGAGTAATGATGTAGCTTGGTACCAACAGAAGCCAGGGCAGTCTCCTAAACTGCTGATATACTATGTATCCAATCGCTACACTGGAGTCCCTGATCGCTTCACTGGCAGTGGATATGGGACGGATTTCACTTTCACCATCAGCACTGTGCAGGCTGAAGACCTGGCAGTTTATTTCTGTCAGCAGGATTATAGTACTCCGTGGACGTTCGGTGGAGGCACCAAGCTGGAAATCAAA;
所述捕获抗体4B2的重链的氨基酸序列如SEQ ID NO:3:
MGWSCIILFLVSTATGVHSQVQLQQPGAELVKPGASVKLSCKASGYTFTSYWIHWVKQRPGQGLEWIGEIDPSDFYTNYNQKFKGKATLTVDKSSSTAYIHLSSLTSEDSAVYYCALFGNHGAYWGQGTLITVSA所示;
所述捕获抗体4B2的轻链的氨基酸序列如SEQ ID NO:4:
MKSQTQVFVFLLLCVSGAHGSIVMTQTPKFLLVSAGDRVTITCKASQSVSNDVAWYQQKPGQSPKLLIYYVSNRYTGVPDRFTGSGYGTDFTFTISTVQAEDLAVYFCQQDYSTPWTFGGGTKLEIK所示。
在本发明中,所述检测抗体2#优选包括生物素标记的检测抗体2#;所述生物素优选包括Sulfo-NHS-LC-Biotin。
本发明还提供了上述抗体在检测芋螺毒素中的应用;所述芋螺毒素优选包括GeXIVA[1,2]。本发明提供的抗体在检测芋螺毒素时,具有灵敏度高、特异性好和不易受其他物质干扰的优势。
在本发明中,上述抗体的制备方法优选包括以下步骤:
(1)将芋螺毒素GeXIVA[1,2]与血蓝蛋白(Keyhole Limpet Hemocyanin,KLH)偶联后分别与佐剂CFA和AD11.15混合,免疫Balb/C小鼠制备单克隆抗体;将GeXIVA[1,2]与KLH偶联后分别与佐剂CFA和AD11.10混合,免疫新西兰白兔制备多克隆抗体;
(2)免疫结束后,使用间接法评价尾血价效,挑选尾血价效最高的小鼠和兔,取小鼠的脾脏细胞与骨髓杂交瘤细胞SP2/0融合并用间接法筛选出最强阳性克隆,将最强阳性克隆注射入预先注射了IFA佐剂的小鼠的腹腔中,得到小鼠腹水;
(3)使用Protein G填料柱纯化小鼠腹水得到捕获抗体4B2,使用ProteinA填料柱纯化兔血清,得到检测抗体2#。
本发明提供了一种用于检测芋螺毒素的试剂盒,所述试剂盒包括上述的抗体和反应液。本发明提供的试剂盒能够根据标准曲线对血液中的GeXIVA[1,2]进行定量检测,标准曲线的线性范围为1.25~80ng/mL;所述试剂盒的最低检量为1.25g/mL。
在本发明中,所述反应液优选包括包被液、封闭液、样品稀释液和显色液;所述封闭液优选包括含酪蛋白的磷酸盐缓冲液(PBS);所述包被液优选包括碳酸钠-碳酸氢钠缓冲溶液(pH=9.5~9.7);所述样品稀释液优选包括含牛血清白蛋白的磷酸盐缓冲液;所述显色液优选包括TMB。所述牛血清白蛋白和酪蛋白购自美国Sigma-Aldrich公司,纯度≥99%;所述TMB单组份显色液购自北京索莱宝公司;所述PBS购自Gibco。
本发明还提供了一种芋螺毒素的检测方法,所述检测方法包括以下步骤:对上述的捕获抗体4B2依次进行包被和封闭,加入待测样品并混合后,加入生物素标记的上述检测抗体2#,加入亲和素-辣根过氧化物酶,进行显色处理,显色处理结束后与标准曲线进行对比。
本发明对进行待测样品的制备;所述待测样品优选为血浆,在本发明的实施例中,所述血液优选为大鼠的血浆或比格犬的血浆;所述待测样品的制备方法优选为:取含有GeXIVA[1,2]的血浆,将血浆与蛋白酶抑制剂混合后,进行离心处理得到血浆样品,将血浆样品与含有蛋白酶抑制剂的样品稀释液混合得到待测样品;
本发明在制备待测样品的同时,优选还制备了标准曲线(标准曲线是以GeXIVA浓度作为横坐标,酶标仪所测得的OD值为纵坐标进行绘制标准曲线),所述标准曲线的制备方法优选包括:取大鼠或比格犬的血浆,每100μL血浆中加入4μL 25×蛋白酶抑制剂,使用含蛋白酶抑制剂的血浆配制含80ng/mL、40ng/mL、20ng/mL、10ng/mL、5ng/mL、2.5ng/mL进而1.25ng/mL GeXIVA[1,2]的血浆样品及空白血浆样品,将25μL血浆样品与225μL含有蛋白酶抑制剂的样品稀释液混合,进行稀释样品,质控(QC)样品的制备方法同前文,质控样品的终浓度分别为3ng/mL、30ng/mL和60ng/mL。
取含有GeXIVA[1,2]的血浆,使用牛血清白蛋白(BSA)的PBST缓冲液作为稀释液(每100mL PBST中加入3g BSA),将稀释液与血液以10:1的体积比进行第一次稀释后得到稀释后的血样;对稀释后的血样依次进行添加蛋白酶抑制剂、第二次稀释、离心处理和第三次稀释;
本发明对捕获抗体4B2依次进行包被和封闭处理;所述包被处理优选为:使用包被液将捕获抗体4B2稀释至10μg/mL,置于酶标板中,每孔100μL,4℃包被过夜(16h)后使用PBST洗板三次,每孔300μL,纸上拍干得到经过包被的捕获抗体4B2备用;
所述封闭处理优选为:使用质量百分含量为0.5%的含有酪蛋白(Casein)PBS封闭液在37℃的环境中封闭1.5h,封闭结束后使用PBST洗板三次,每孔300μL,纸上拍干备用;
本发明将经过封闭的包被抗体与待测样品混合;所述混合的条件具体为:向含有经过包被的封闭抗体的酶标板中添加待测样品,添加待测样品后进行孵育;所述孵育的操作为,每孔添加待测样品100μL,在25℃、200rpm的环境中反应1h,反应结束后使用PBST洗板3次,洗板时每孔中PBST的添加量为300μL,孵育结束后在纸上拍干即为混合结束;
本发明将待测样品与经过包被的封闭抗体混合结束后,添加生物素标记的检测抗体2#;所述生物素标记的检测抗体2#经过样品稀释液稀释,经过稀释的生物素标记的检测抗体2#的浓度为2μg/mL,添加生物素标记的检测抗体2#后进行孵育操作,所述孵育的操作如上文所示,孵育结束后在纸上拍干备用;本发明提供的抗体所用浓度灵敏度更高;
本发明待添加生物素标记的检测抗体2#结束后,添加亲和素-辣根过氧化物酶(HRP)的稀释液进行孵育,所述孵育操作如上文所示,孵育结束后在纸上拍干备用;
本发明待添加亲和素-HRP后,添加显色液进行显色检测,将显色检测的结果与标准曲线进行比对,得到检测结果。
为了进一步说明本发明,下面结合附图和实施例对本发明提供的一对用于检测芋螺毒素的抗体及其应用进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
实施例1
(1)特异识别多肽药GeXIVA[1,2]小鼠单克隆抗体制备:将GeXIVA[1,2]干粉溶解2mg/ml。采用SMCC方法将GeXIVA[1,2]与载体蛋白KLH进行偶联,并分别与佐剂CFA和AD11.15混合,制备免疫原,利用免疫原免疫小鼠14天后抽取小鼠尾血,使用间接ELISA方法进行血清中抗体效价的评价。
(2)根据尾血评价的结果选择信号最高的小鼠取脾细胞与骨髓瘤细胞SP2/0进行细胞融合。融合后的第15天挑取564个单克隆细胞在96孔板中进行培养,再经过7天后,通过间接ELISA方法对96孔板中的细胞培养上清进行评价,筛选能够分泌识别多肽药的单克隆抗体的单克隆细胞株。
(3)挑选了29个阳性克隆进行复筛,培养三天后,对所述阳性克隆进行复筛,确认3株强阳性克隆(1H2,4B2,6E4)。对强阳性克隆1H2,4B2和6E4分别进行小鼠腹水制备:分别将约10
(4)取1mL偶联有G蛋白的柱料加入空柱子中,使用PBS溶液清洗后,取2mL腹水用8mL的PBS稀释后上柱;预先加入100μL中和液(1M Tris,1.5MNaCI,1mM EDTA,pH=8.3),使用pH2.7的甘氨酸洗脱液进行洗脱,每mL洗脱液收集一管,共收集5管;再加入300μL中和液后使用pH1.9的甘氨酸洗脱液进行洗脱,每1mL洗脱液收集一管,共收集3管;然后分别对每一管洗脱液进行OD
(5)使用GeXIVA[1,2]偶联KLH制备免疫原免疫白兔48天,期间抽取第25天时尾血1mL留存。对比检测第48天及25天血清抗体效价,第48天高于25天,因此使用免疫第48天的血液。结束免疫后收集血清,进行ProteinA纯化,得到检测抗体2#。
(6)将上述制备得到的抗体进行生物素标记,方法为:取2mg抗体使用PBS溶液4℃透析过夜,然后加入Sulfo-NHS-LC-Biotin,反应1h后,使用脱盐柱进行纯化,然后根据OD
(7)抗体配对:分别将3株鼠单抗(1H2,4B2,6E4)和1株兔多抗(2#)进行包被酶标板,分别同2株经过生物素标记的鼠单抗(4B2和6E4)和1株经过生物素标记的兔多抗(2#)进行配对测试。
分别包被抗体,碳酸盐缓冲液作为包被缓冲液,包被浓度为5μg/mL,4℃过夜包被;
PBST(0.1‰)清洗之后,使用3%BSA-PBS进行封闭1h;
PBST(0.1‰)清洗之后,GeXIVA[1,2]多肽药稀释在比格犬混合血中,再使用3%BSA+0.1%T-20进行10倍稀释,25℃反应1h;
PBST(0.1‰)清洗之后,再加入1μg/mL的生物素标记抗体,生物素抗体使用稀释液3%BSA+0.1%T-20,25℃反应1h;
PBST(0.1‰)清洗之后,加入1:10000用3%BSA+0.1%T-20稀释的HRP标记的亲和素,37℃反应1h;
PBST(0.1‰)清洗之后,100μLTMB显色液显色,20min之后使用酶标仪读取OD
经过封闭液筛选确定,捕获抗体4B2,生物素标记的检测抗体2#,0.5%Casein封闭为最优配比。
(8)棋盘法优化抗体比例及稀释比例:棋盘法优化20μg/mL、10μg/mL、5μg/mL、2μg/mL4B2捕获抗体及2μg/mL、1μg/mL、0.5μg/mL、0.1μg/mL生物素标记的检测抗体2#,以及1:5、1:10、1:40稀释比例,最终确定最优配比为10μg/mL4B2单抗包被、2μg/mL生物素标记的检测抗体2#生物素多抗检测、样品稀释比例1:10。
应用例1
1试验材料
1.1药品及试剂
GeXIVA[1,2],上海吉尔生化有限公司合成,序列如SEQ ID NO:1所示:TCRSSGRYCRSPYDRRRRYCRRITDACV,SEQ ID NO:1;纯度:97.67,批号:483937-2-Y,-20℃保存。
GeXIVA[1,2]I23A:上海吉尔生化有限公司合成,序列如SEQ ID NO:2所示:TCRSSGRYCRSPYDRRRRYCRRATDACV,SEQ ID NO:2;-20℃保存。
BSA、Casein:美国Sigma-Aldrich公司,纯度≥99%。
PBST、包被液、中止液、TMB单组份显色液、ELISA中止液购自北京索莱宝。
PBS:购自Gibco。
酶标板:购自Costar。
蛋白酶抑制剂:Roche cOmplete。
比格犬及不含GeXIVA[1,2]成分的比格犬空白血浆由北京新星科技有限公司。
SD大鼠及SD大鼠购自维通利华。
1.2仪器
酶标仪:MolecularDevice M190
洗板机:Thermo Wallwash
恒温摇床:米欧ST60-4
1.3溶液配制
封闭液:将0.5g Casein粉末完全溶解于100mL 1×PBS中充分混匀后备用。
样品、生物素抗体、亲和素-HRP所用稀释液:将3g BSA完全溶解于100ml PBST中。
2试验方法及步骤
2.1包被抗体
使用包被液将捕获抗体4B2稀释至10μg/mL,加入至酶标板中,每孔100μL,4℃包被过夜(16h)后使用PBST洗板三次,每孔300μL,纸上拍干备用。
2.2封闭
使用0.5%Casein-PBS封闭液37℃封闭1.5h。使用PBST洗板三次,每孔300μL,纸上拍干备用。
2.3用于制备标准曲线的血浆样品及质控样品的制备
取大鼠或比格犬的血浆,每100μL血浆中加入4μL 25×蛋白酶抑制剂,使用含蛋白酶抑制剂的血清配制含80ng/mL、40ng/mL、20ng/mL、10ng/mL、5ng/mL、2.5ng/mL和1.25ng/mL GeXIVA[1,2]的血浆样品,购买的空白血浆样品,将25μL血浆样品与225μL含有蛋白酶抑制剂的样品稀释液(工作浓度)混合,进行稀释样品;质控样品的制备方法同前文,终浓度分别为3ng/mL、30ng/mL和60ng/mL。
制备获得的比格犬血浆GeXIVA[1,2]样品标准曲线图如图1所示,制备获得的大鼠血浆GeXIVA[1,2]样品标准曲线图如图2所示。
2.4实际血浆样本处理
取含有GeXIVA[1,2]的血浆,将血浆立刻与25×蛋白酶抑制剂(每1mL全血样品加入40μL)混合,并置于冰上进行保存,直至进行离心处理,经4℃,3500rpm,离心10min后取上清获得血浆样品。将25μL血浆样品与225μL含有蛋白酶抑制剂的样品稀释液(同上)混合得到待测样品,取100μL用于ELISA分析。
2.5样品加样
取上述准备好的用于制备标准曲线的血浆样品、质控样品和动物实际样品加入封闭好的酶标板中,每孔100μL,25℃,200rpm反应1h。反应结束后使用PBST洗板三次,每孔300μL,纸上拍干。
2.6生物素标记的检测抗体2#孵育
使用样品稀释液配制浓度为2μg/mL的生物素标记的检测抗体2#,在孵育完样品的酶标板中每孔加入100μL生物素标记的检测抗体2#,25℃,200rpm反应1h。反应结束后使用PBST洗板三次,每孔300μL,纸上拍干。
2.7亲和素-HRP抗体孵育
使用样品稀释液配制1:10000亲和素-HRP,在孵育完生物素标记的检测抗体2#的酶标板中每孔加入100μL上述亲和素-HRP,25℃,200rpm反应1h。反应结束后使用PBST洗板三次,每孔300μL,纸上拍干。
2.8TMB显色反应
在孵育完亲和素-HRP的酶标板中每孔加入100μLTMB单组份显色液。25℃反应10min后立即加入ELISA中止液50μL。
2.9数据采集及处理
加入中止液后立即于酶标仪450/630nm吸收波长读取数据。使用Excel导出数据后使用Origin软件进行Logistic四参数拟合作图及分析。
3试验结果
3.1线性范围及定量下限
取已制备的标准曲线样本,终浓度分别为1.25ng/mL、2.5ng/mL、5ng/mL、10ng/mL、20ng/mL、40ng/mL、80ng/mL。
按“血浆样品处理”项下操作建立工作曲线,使用Origin软件非线性曲线拟合进行Logistics四参数分析。验证过程中,对6个独立的分析批进行测定,结果以列表形式报告,以确定标准曲线回归模型整体的稳健性。拟合时,一条标曲允许排除由于明确或不明原因产生失误的浓度点。排除后应至少有75%的校正标样回算浓度在标示值的±20%(定量下限与定量上限在±25%)范围内。定量下限与定量上限之间的浓度范围为标准曲线的定量范围。
表1比格犬血浆中GeXIVA[1,2]标准曲线回算浓度统计表
表2大鼠血浆中GeXIVA[1,2]标准曲线回算浓度统计表
由表1和表2可知,大鼠及比格犬血浆中GeXIVA[1,2]的最低定量限为1.25ng/mL,线性范围为1.25~80ng/mL。
3.2准确度和精密度
按“标准曲线及质控样本制备”项下方法分别配制比格犬及大鼠血浆中的低、中、高三个浓度的质控样品(HQC、MQC、LOC)、定量上限(ULOQ)及定量下限(LLOQ),每个浓度进行5样本分析,连续测定6天,根据当日工作曲线,分别计算质控样品的测得浓度,与配制浓度对照,求得测定方法的准确度与精密度,结果分别见表3和表4。
对于批内和批间准确度,各浓度质控样品的平均浓度应在标示值的±20%(定量下限和定量上限为±25%)范围内。批内和批间精密度均不应超过20%(定量下限和定量上限为25%)。此外,方法总误差(即%相对偏差绝对值与%变异系数之和)不应超过30%(定量下限和定量上限为40%)。
表3比格犬血浆样品中GeXIVA[1,2]ELISA测定方法的准确度和精密度
表4大鼠血浆样品中GeXIVA[1,2]ELISA测定方法的准确度和精密度
由表3和表4可知,批内/批间偏差<20%,上下限为25%,批间/批内CV<20%,上下限<25%,批间的偏差两个加起来小于30,可知,批间批内精密度准确度及方法总误差均符合标准。
3.3选择性
选择性考察10个比格犬及大鼠个体血浆,每个个体考察三个水平的样品,Blank,ULOQ和LLOQ。按“血浆样本处理”项下方法操作。通过向至少10个不同来源的基质加入定量下限和定量上限水平的分析物来考察选择性,同时测量未加入分析物的基质。选择性考察要求至少80%以上的样品准确度在±20%范围内(如果在定量下限水平,则在±25%范围内),且未加入分析物的基质的测量值应低于定量下限。结果如表5和表6所示。
表5比格犬血浆选择性验证样品结果统计表
表6大鼠血浆选择性验证样品结果统计表
由表5和表6可知,回算浓度均值值准确度(AR)与标示值在25%之内。因此,本发明提供的抗体的选择性线性范围符合检测要求。
3.4样品短期稳定性
按“标准曲线及质控样本制备”项下方法分别配制比格犬血浆中的低、高两个浓度的质控样品,每个样品三个复孔,考察了常温下1h、30min;4℃1h、30min稳定性。每一浓度质控样品应有67%以上的样品浓度在标示值的±20%范围内。对样品短期稳定性的检测结果如表7和表8所示。
表7比格犬血浆中GeXIVA[1,2]短期稳定性结果
表8大鼠血浆中GeXIVA[1,2]短期稳定性结果
由表7和表8可知,根据上文给出的评判标准,每个条件每个浓度的样品三个中有两个(66%以上)回算浓度在±20%之内。由此可知,短期稳定性的参数符合检测要求。
3.5特异性
特异性是指在样品中存在相关干扰物质的情况下,分析方法能够准确、专一地测定分析物的能力。I23A为GeXIVA[1,2]第23位氨基酸突变体。该试验考察了干扰物质I23A对检测的影响。按“标准曲线及质控样本制备”项下方法分别配制比格犬血浆中的低、高两个浓度的质控样品。向空白基质及低、高质控样品中加入十倍ULOQ量的干扰物I23A(800ng/mL)每个样品三个复孔。检测结果如表9和表10所示。要求至少80%以上的质控样品准确度(AR)在±20%范围内(如果在定量下限水平,则在±25%范围内),且未加入分析物的基质的测量值应低于定量下限。
表9比格犬血浆中特异性验证样品结果统计表
表10大鼠血浆中特异性验证样品结果统计表
由表9和表10可知,CV和AR在检测范围内,由此可知,本发明提供的抗体在检测GeXIVA[1,2]时具有较高的特异性。
3.5比格犬和大鼠血浆实际样品检测
比格犬肌肉注射中剂量(0.07mg/kg)GeXIVA[1,2]后使用上述方法检测血浆中GeXIVA浓度。检测结果如表11所示。
大鼠肌肉注射中剂量(0.5mg/kg)GeXIVA[1,2]后使用上述方法检测血浆中GeXIVA浓度。检测结果如表12所示。
表11比格犬肌肉注射0.07mg/kg GeXIVA[1,2]后不同时间平均血药浓度
表12大鼠肌肉注射0.5mg/kg GeXIVA[1,2]后不同时间平均血药浓度
由表11和表12,结合上述检测可知,本发明提供了一对用于检测GeXIVA[1,2]的抗体,建立并确证了大鼠及比格犬血浆中GeXIVA[1,2]的ELISA生物分析方法,方法确证结果显示血浆中内源性物质不干扰GeXIVA[1,2]的测定。大鼠及比格犬血浆中GeXIVA[1,2]的最低定量限为1.25ng/mL,线性范围为1.25~80ng/mL,批间批内精密度准确度及方法总误差均符合标准。
本发明验建立的ELISA方法能灵敏有效地检测比格犬及大鼠血浆GeXIVA[1,2]含量,其特异性、选择性线性范围及定量下限、准确度、精密度、稳定性等参数均符合检测要求。
虽然本发明已以较佳的实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可以做各种改动和修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
序列表
<110> 中国人民解放军军事科学院军事医学研究院
<120> 一对用于检测芋螺毒素的抗体及其应用
<160> 4
<170> SIPOSequenceListing 1.0
<210> 1
<211> 405
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 1
atgggatgga gctgtatcat cctcttcttg gtatcaacag ctacaggtgt ccactcccag 60
gtccaactgc agcagcctgg ggctgagctt gtgaagcctg gggcttcagt gaagctgtcc 120
tgcaaggctt ctggctacac cttcaccagc tactggattc actgggtgaa gcagaggcct 180
ggacaaggcc ttgagtggat cggagagatt gatccttctg atttttatac taactacaat 240
caaaagttca agggcaaggc cacattgact gtagacaaat cctccagcac agcctacata 300
cacctcagca gcctgacatc tgaggactct gcggtctatt actgtgccct ctttggtaac 360
cacggggctt actggggcca agggactctg atcactgtct ctgca 405
<210> 2
<211> 381
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
atgaagtcac agacccaggt cttcgtattt ctactgctct gtgtgtctgg tgctcatggg 60
agtattgtga tgacccagac tcccaaattc ctgcttgtat cagcaggaga cagggttacc 120
ataacctgca aggccagtca gagtgtgagt aatgatgtag cttggtacca acagaagcca 180
gggcagtctc ctaaactgct gatatactat gtatccaatc gctacactgg agtccctgat 240
cgcttcactg gcagtggata tgggacggat ttcactttca ccatcagcac tgtgcaggct 300
gaagacctgg cagtttattt ctgtcagcag gattatagta ctccgtggac gttcggtgga 360
ggcaccaagc tggaaatcaa a 381
<210> 3
<211> 135
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 3
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ser Thr Ala Thr Gly
1 5 10 15
Val His Ser Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Lys
20 25 30
Pro Gly Ala Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe
35 40 45
Thr Ser Tyr Trp Ile His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu
50 55 60
Glu Trp Ile Gly Glu Ile Asp Pro Ser Asp Phe Tyr Thr Asn Tyr Asn
65 70 75 80
Gln Lys Phe Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser
85 90 95
Thr Ala Tyr Ile His Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val
100 105 110
Tyr Tyr Cys Ala Leu Phe Gly Asn His Gly Ala Tyr Trp Gly Gln Gly
115 120 125
Thr Leu Ile Thr Val Ser Ala
130 135
<210> 4
<211> 127
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 4
Met Lys Ser Gln Thr Gln Val Phe Val Phe Leu Leu Leu Cys Val Ser
1 5 10 15
Gly Ala His Gly Ser Ile Val Met Thr Gln Thr Pro Lys Phe Leu Leu
20 25 30
Val Ser Ala Gly Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Ser
35 40 45
Val Ser Asn Asp Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro
50 55 60
Lys Leu Leu Ile Tyr Tyr Val Ser Asn Arg Tyr Thr Gly Val Pro Asp
65 70 75 80
Arg Phe Thr Gly Ser Gly Tyr Gly Thr Asp Phe Thr Phe Thr Ile Ser
85 90 95
Thr Val Gln Ala Glu Asp Leu Ala Val Tyr Phe Cys Gln Gln Asp Tyr
100 105 110
Ser Thr Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
115 120 125
- 一对用于检测芋螺毒素的抗体及其应用
- 一对检测HCV-cAg的单克隆抗体和分泌该抗体对的杂交瘤细胞株及其应用
