一种细胞来源的外泌体在制备治疗阿尔茨海默病生物制剂中的应用
文献发布时间:2023-06-19 11:49:09
技术领域
本发明涉及生物医药领域,具体涉及一种细胞来源的外泌体在制备治疗阿尔茨海默病生物制剂中的应用。
背景技术
阿尔茨海默病(Alzheimers disease,AD)是常见于老年人中的一种神经退行性疾病,临床上以记忆障碍、失语、失用、失认、视空间技能损害、执行功能障碍以及人格和行为改变等全面性痴呆表现为特征,多发于65岁以上的老年人,据统计65岁以上的人群有10%的人患病,85岁以上的人群有50%的人患病。随着人口老龄化的加剧,预计到2050年全世界将有1.3亿的AD患者,将给国家和社会带来巨大的负担,而且确诊AD的患者,其平均存活期仅为7年左右,目前临床上治疗AD药物主要是胆碱酯酶抑制剂和谷氨酸受体拮抗剂,这些药物可以对AD起到一定的缓解作用,但是无法从根源治愈。因此,探索一种AD的有效治疗方法迫在眉睫。
近些年,针对AD治疗研宂的重点主要集中在抑制β淀粉样蛋白(Aβ)的异常合成和聚集。为此科学家开发了一系列的药物,然而到目前为止,此类药物的临床试验均以失败告终,这说明对于AD治疗,单纯的考虑Aβ是远远不够的。目前的研究认为,小胶质细胞功能的紊乱与Aβ之间存在的恶性循环是导致AD发生和恶化的重要因素之一。
小胶质细胞是脑内常驻的免疫细胞,具有高度动态的过程,不断地对脑内局部环境进行勘察并吞噬和清除程序性死亡的细胞和碎片。在AD的病理环境下,小胶质细胞被激活,并吞噬和降解细胞外A,但大量聚集的Aβ降低了小胶质细胞的生物活性,并产生大量的炎症因子,这些炎症又可以进一步促进Aβ的产生和聚集。因此,小胶质细胞和Aβ之间的恶性循环加剧了AD病情的恶化,所以调节小胶质细胞的功能和减少Aβ对小胶质细胞的作用被认为是一个有前景的AD治疗药物的研究策略。
干细胞是一类具有自我更新、自我复制能力的多潜能细胞,在一定条件下,干细胞可以迁移到相应的病灶或损伤的细胞处,替代或修复死亡或受损伤的细胞,直接起到修复损伤的作用,因此,干细胞在组织修复及免疫调控等领域发挥了重要作用。但近些年越来越多的研究证明,干细胞分泌的外泌体在治疗领域起到越来越重要的作用,干细胞分泌的外泌体可以携带干细胞特有的生物活性物质传递给受损伤的组织或细胞,也可以起到与干细胞相同的治疗作用,而且外泌体具有免疫原性低,毒性小,可通过血脑屏障(BBB)等优势。所以,干细胞来源的外泌体有可能成为一种替代干细胞治疗的新型生物疗法。
综上所述,本发明开发了一种iPSCs诱导NSCs来源的外泌体的制备方法,可应用于治疗阿尔茨海默病的新型药物的研发及生产,开拓了阿尔茨海默病治疗应用的新领域。
发明内容
为此,本发明提供一种干细胞来源的外泌体在制备治疗阿尔茨海默病生物制剂中的应用。
为了实现上述目的,本发明提供如下技术方案:
根据本发明的一方面提供的一种细胞来源的外泌体在制备治疗阿尔茨海默病生物制剂中的应用。
进一步的,所述生物制剂的剂型包括口服制剂、注射用剂或鼻腔滴剂。
进一步的,所述的外泌体能用于药物装载、表面修饰或赋形。
根据本发明的另一方面提供的一种用于制备治疗阿尔茨海默病生物制剂的细胞来源的外泌体,所述外泌体的提取方法包括超速离心法、密度梯度离心法、超滤法、聚合物沉淀法、切向流过滤法、免疫捕获法、亲和色谱法、微流控法或分子排阻法。
进一步的,所述的细胞外泌体,具有穿越血脑屏障的功能,同时能够增强小胶质细胞的生物活性,降低小胶质细胞的氧化应激ROS水平,并减少其炎症因子TNF-a和IL-1β的释放。
进一步的,所述细胞来源有植物、微生物、动物及人,包括体液、组织液、体细胞、干细胞及经干细胞诱导分化的细胞。
进一步的,所述的外泌体具有治疗阿尔茨海默病的潜力,能在制备治疗阿尔茨海默病生物制剂中应用。
本发明具有如下优点:
本发明的细胞功能实验表明,诱导性多能干细胞(iPSCs)诱导NSCs来源的外泌体能够穿透血脑屏障(BBB),同时能够增强小胶质细胞的生物活性,降低小胶质细胞的氧化应激(ROS)水平,并减少其炎症因子的释放。因此,该外泌体具有治疗阿尔茨海默症(AD)的潜力。本发明可助力外泌体相关的AD生物制剂的产业化应用,具有极大的商业价值。
附图说明
为了更清楚地说明本发明的实施方式或现有技术中的技术方案,下面将对实施方式或现有技术描述中所需要使用的附图作简单地介绍。显而易见地,下面描述中的附图仅仅是示例性的,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图引伸获得其它的实施附图。
本说明书所绘示的结构、比例、大小等,均仅用以配合说明书所揭示的内容,以供熟悉此技术的人士了解与阅读,并非用以限定本发明可实施的限定条件,故不具技术上的实质意义,任何结构的修饰、比例关系的改变或大小的调整,在不影响本发明所能产生的功效及所能达成的目的下,均应仍落在本发明所揭示的技术内容得能涵盖的范围内。
图1为本发明提供的切向流过滤膜F-1和F-2纯化外泌体原理示意图。其中,(1)为切向流过滤膜F-1原理示意图,(2)为切向流过滤膜F-2原理示意图。
图2为本发明提供的双重切向流过滤体系的结构图,其中,1为第一储存罐,2为第一蠕动泵,3为第一过滤装置,4为第二储存罐,5为第二过滤装置,6为第二蠕动泵。
图3为本发明提供的干细胞外泌体提取制备及其在阿尔茨海默症中的应用流程示意图。
图4为本发明提供的诱导性多能干细胞(iPSCs)的显微镜观察图。
图5为本发明提供的神经干细胞显微镜观察图。
图6为本发明提供的神经干细胞荧光显微镜观察图。
图7为本发明提供的Transwell实验示意图,(1)小鼠小胶质细胞,(2)小鼠脑微血管内皮细胞,(3)PKH26荧光染料标记的外泌体。
图8为本发明提供体外模拟血脑屏障(BBB)穿透实验结果图。
图9为本发明提供的外泌体对Aβ诱导的小胶质细胞增殖活性检测结果图。
图10为本发明提供的外泌体对小胶质细胞内氧化应激(ROS)水平检测结果图。
图11为本发明提供的小胶质细胞分泌的TNF-a含量测定结果图。
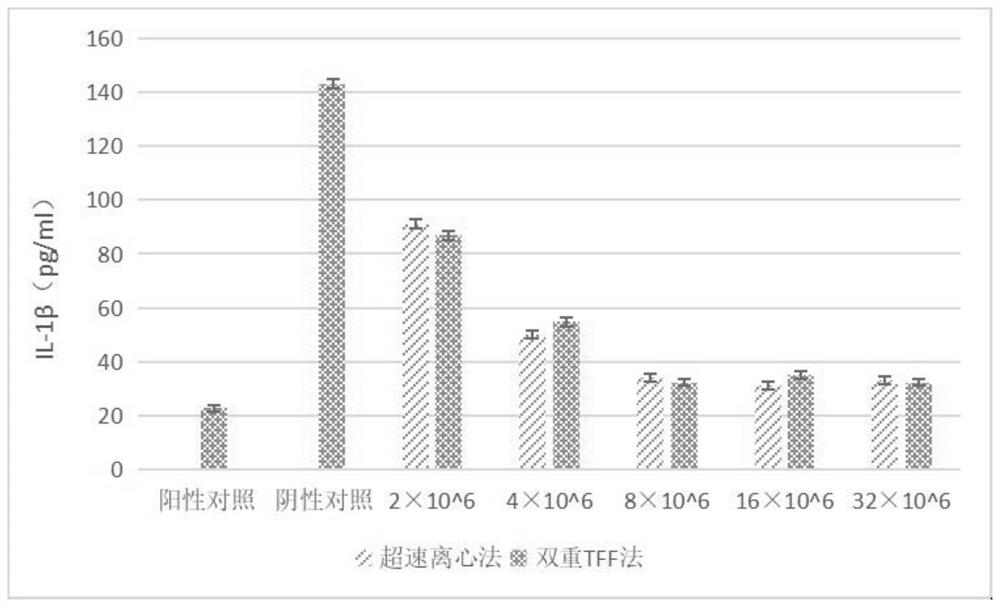
图12为本发明提供的小胶质细胞分泌的IL-1β含量测定结果图。
具体实施方式
以下由特定的具体实施例说明本发明的实施方式,熟悉此技术的人士可由本说明书所揭露的内容轻易地了解本发明的其他优点及功效,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
一.干细胞的制备及培养
1.诱导性多能干细胞(iPSCs)细胞的制备培养及分化
将iPSCs接种至6孔板培养细胞,待密度达到70%-80%,更换神经干细胞的诱导分化培养基,此时记为第0天,每周更换2-3次培养液,在培养至第10-14天时,收集细胞。再将细胞接种至预处理的6孔板中,用神经干细胞培养基培养,收获细胞并进行免疫荧光鉴定。图4、图5、图6所示。
2.神经干细胞的培养及上清液收集
已鉴定的神经干细胞接种于包被的6孔板中培养,待细胞贴壁铺满85%-95%时,收集细胞培养上清液。
3.细胞培养上清的预处理
将细胞培养上清液加入离心管中,5000-12000g离心5-50min,再用0.22-0.45μm滤膜过滤除菌,放置4℃备用。
二.外泌体的提取纯化、鉴定及定量
如图2所示,(1)向第一储存罐1和第二储存罐4中加入无菌水,分别打开蠕动泵(第一蠕动泵2和第二蠕动泵6),冲洗系统;
(2)向第一储存罐1中加入4L预处理的样本溶液,打开第一蠕动泵2使系统循环,预处理的样本溶液经设有切向流过滤膜F-1(原理如图1-1所示)的第一过滤装置3浓缩过滤,使含有外泌体的溶液进入第二储存罐4中;待第一储存罐1中的液体体积为最小运行体积时,加入2L无菌的PBS缓冲液继续浓缩过滤至最小运行体积;
(3)待第二储存罐4中的液体体积超过400mL时,打开第二蠕动泵6使系统循环,含有外泌体的溶液经设有切向流过滤膜F-2(原理如图1-2所示)的第二过滤装置5,浓缩过滤,去除了小分子物质;
(4)待第二储存罐4中的液体体积为最小运行体积时,向第二储存罐4中加入2000mL的PBS缓冲液,继续浓缩过滤至第二储存罐4中溶液为200mL,收集该溶液,即得到双重切向流过滤体系提取纯化的外泌体。
2.超速离心法提取外泌体
将20ml预处理后样本加至超速离心管中,4℃条件下100000g离心2h,用1mL的无菌PBS缓冲液进行重悬,即得到超速离心分离纯化的外泌体。
3.外泌体的鉴定及定量
收集后的外泌体,通过电镜、纳米粒径示踪分析仪、Western Blot等方法从形态,颗粒粒径分布及浓度,特异性的蛋白marker(CD9、CD63、ALIX)对外泌体进行鉴定。
三.细胞功能实验评价
1.体外模拟血脑屏障(BBB)穿透实验
BBB是血液与脑组织间一种特殊屏障,由毛细血管的内皮、基膜和星型胶质细胞等构成,其中内皮细胞是构成BBB的主要结构,BBB可以有选择地限制某些物质由血液进入脑组织,是阻碍治疗阿默茨海默症药物进入脑内的主要障碍。
本实验利用Transwell系统模拟脑内的BBB,该装置如图7所示。首先在Transwell系统上层小室培养小鼠脑微血管内皮细胞,下层小室培养小鼠小胶质细胞,并用Aβ42寡聚体处理,以此细胞模拟AD的病理环境。将外泌体进行PKH26荧光染料标记,并加入到上层小室,培养12h,以游离的荧光染料作为阴性对照。最后用流式细胞仪检测小鼠小胶质细胞的平均荧光强度。
实验结果如图8所示,由于BBB模型的阻碍,游离的荧光染料未能进入下层小室,相比之下,荧光标记的外泌体穿过了BBB并进入了小胶质细胞,其中双重TFF法提取的外泌体,其检测的平均荧光强度高于超速离心法和超滤法,可能是超速离心法强大的离心力影响了外泌体的表面结构,最终影响其外泌体对BBB的穿透能力。
2.外泌体对Aβ诱导的小胶质细胞增殖活性的影响
Aβ寡聚体(Aβ42)对小鼠小胶质细胞的持续刺激会导致其产生毒性,进而导致细胞的凋亡,所以本实验验证了外泌体对Aβ诱导的小胶质细胞增殖活性的影响。
取小鼠小胶质细胞消化重悬后制成密度为5×10
实验结果如图9所示,与对照组相比,外泌体确实能够提高Aβ诱导的小胶质细胞的增殖活性,而且随着外泌体的浓度的增加,对应的小胶质细胞的增殖活性也逐渐增强,最适外泌体浓度为8×106particals/mL。其中,双重TFF法和超速离心法提取的外泌体对小胶质细胞增殖活性的影响无明显差别,说明这两种方法并没有影响小胶质细胞对外泌体的摄入。
3.外泌体对小胶质细胞内氧化应激(ROS)水平的影响
在阿尔茨海默症的炎症坏境的影响下,小胶质细胞内ROS水平会有明显的增加,采用Aβ42寡聚体处理小鼠小胶质细胞,加入10μL不同浓度的外泌体进行孵(1×10
实验结果如图10所示,用Aβ42寡聚体处理小鼠小胶质细胞,其胞内ROS水平显著增强。经过外泌体后,胞内ROS水平有所降低,而且随着外泌体的浓度的增加而降低,最适外泌体浓度为8×10
4.外泌体对Aβ诱导的小胶质细胞分泌炎症因子的影响
Aβ诱导的小胶质细胞发生氧化应激的同时,还可以使小胶质细胞分泌大量的炎症因子,如IL-1β和TNF-a。本实验采用ELISA法检测不同条件下的小胶质细胞对炎症因子分泌的影响。
将小鼠小胶质细胞以1×10
实验结果如图11-12所示,Aβ42寡聚体诱导的小胶质细胞内的TNF-a和IL-1β含量分别为1.91ng/mL和0.14ng/mL,加入不同浓度的干细胞外泌体后,TNF-a和IL-1β含量随着外泌体浓度的升高而降低,甚至接近了未经Aβ42寡聚体处理的水平,最适外泌体浓度为8×10
本发明的细胞功能实验表明,诱导性多能干细胞(iPSCs)诱导NSCs来源的外泌体能够穿透血脑屏障(BBB),同时能够增强小胶质细胞的生物活性,降低小胶质细胞的氧化应激(ROS)水平,并减少其炎症因子的释放。因此,该外泌体具有治疗阿尔茨海默症(AD)的潜力。本发明可助力外泌体相关的AD生物制剂的产业化应用,具有极大的商业价值,具体流程如图3所示。
虽然,上文中已经用一般性说明及具体实施例对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 一种细胞来源的外泌体在制备治疗阿尔茨海默病生物制剂中的应用
- 一种脐带间充质干细胞来源的外泌体及其在制备治疗肝癌药物中的应用
