用于IHC检测的脱蜡、水化和抗原修复一体缓冲液及其应用
文献发布时间:2023-06-19 19:27:02
技术领域
本发明属于免疫检测技术领域,具体地,涉及一种用于IHC的脱蜡、水化和抗原修复一体缓冲液及其应用。
背景技术
免疫治疗已在多种肿瘤的治疗中显示出有效性和安全性,并被广泛应用,已成为恶性肿瘤治疗一个新的里程碑。然而,并不是所有患者都能从免疫治疗中获益,因此需要借助特定的生物标记物来筛选适宜人群,其中PD-L1表达是目前应用最广的免疫治疗生物标志物。一系列临床研究结果证明肿瘤细胞和/或肿瘤相关免疫细胞的PD-L1表达水平与免疫治疗疗效及患者预后密切相关。
目前,PD-L1的检测主要通过免疫组织化学(IHC)的方法进行,其基本原理为石蜡切片经过常规的脱蜡水化后用抗原修复液进行抗原修复,以充分暴露组织在福尔马林固定过程中被遮蔽的抗原表位,然后通过特异性PD-L1抗体与组织中的抗原结合形成抗原-抗体复合物,再通过酶标二抗与第一抗体反应形成抗原-一抗-二抗复合物。后通过二抗中标记的酶对底物进行催化在细胞原位产生不可溶的沉淀从而起到示踪抗原的目的。其检测基本步骤包括烤片、脱蜡、水化、抗原修复、封闭、染色、显色、复染、脱水、透明和封片处理。PD-L1石蜡切片的抗原修复好坏将直接影响PD-L1的阳性率和判读结果。其中脱蜡、水化和抗原修复在整个PD-L1的免疫组织化学检测过程中起到了极其重要的作用。
然而,烤片、脱蜡、水化和抗原修复等前序切片处理过程大概就要花费近1.5个小时的时间,使得整个PD-L1的免疫组织化学检测的时间很长,从而影响了PD-L1的检测效率。另外,常规的石蜡切片脱蜡需要使用有机溶剂二甲苯,对环境和操作者有一定的危害性。
发明内容
为了解决上述技术问题中的至少一个,本发明采用的技术方案如下:
本发明第一方面提供一种用于免疫组织化学检测的脱蜡、水化和抗原修复一体缓冲液,所述脱蜡、水化和抗原修复一体缓冲液包含Tris Base、EDTA、壬基酚聚氧乙烯醚、防腐剂、蛋白酶K和聚乙二醇2000。
在本发明的一些实施方案中,所述防腐剂为ProClin
在本发明的一些实施方案中,所述脱蜡、水化和抗原修复一体缓冲液的pH值为9.0。
在本发明的一些实施方案中,所述脱蜡、水化和抗原修复一体缓冲液包含摩尔浓度为5~20mM的Tris Base、摩尔浓度为0.5~1.5mM的EDTA、质量分数为0.25%~2%的壬基酚聚氧乙烯醚、体积分数为0.3%~0.4%的防腐剂、质量体积比为80~120μg/mL的蛋白酶K,以及体积分数为3%~6%的聚乙二醇2000。
在本发明的一些具体实施方案中,所述脱蜡、水化和抗原修复一体缓冲液包含摩尔浓度为10mM的Tris Base、摩尔浓度为1mM的EDTA、质量分数为0.25%~2%的壬基酚聚氧乙烯醚、体积分数为0.35%的ProClin
本发明第二方面提供本发明第一方面所述的脱蜡、水化和抗原修复一体缓冲液的制备方法,包括以下步骤:
称取或量取Tris Base、EDTA、壬基酚聚氧乙烯醚、防腐剂、蛋白酶K、聚乙二醇2000于洁净的容器内,加入总体积70%~90%的纯化水充分搅拌混匀,再定容至总体积。
进一步地,在定容至总体积之前,进一步包括调节pH值至9.0的步骤。
本发明第三方面提供一种免疫组织化学检测试剂盒,包括本发明第一方面任一所述的脱蜡、水化和抗原修复一体缓冲液。
进一步地,所述试剂盒还包括封闭液、二抗显色系统和/或苏木素。这里的苏木素可以是未经配制的苏木素粉末,也可以是配制好的苏木素染液。
在本发明的一些实施方案中,所述免疫组织化学检测试剂盒用于检测生物样本是否具有PD-L1表达,所述试剂盒还包括PD-L1抗体。当然,本发明的试剂盒是一种通用试剂盒,可以搭配不同的一抗、二抗适用于不同的抗原检测。
本发明第四方面提供一种免疫组织化学检测方法,包括以下步骤:
S1,获得石蜡保存的生物样本并切片;
S2,将获得的切片加入至98~100℃的权利要求1所述的脱蜡、水化和抗原修复一体缓冲液中,孵育8~10min,即可完成切片的脱蜡、水化和抗原修复;
S3,将切片进行封闭、一抗孵育、二抗孵育、显色、苏木素复染。
在本发明的一些实施方案中,在步骤S3之前,进一步包括将所述的脱蜡、水化和抗原修复一体缓冲液冷却至室温的步骤。
在本发明的一些实施方案中,所述免疫组织化学检测方法是非诊断和治疗目的的方法。
在本发明的一些具体实施方案中,所述免疫组织化学检测方法用于辅助诊断。
本发明的有益效果
相对于现有技术,本发明取得了以下有益效果:
利用本发明的脱蜡、水化和抗原修复一体缓冲液进行石蜡切片处理,能够显著缩短免疫组织化学检测的时间,使得抗原染色更加高效。
利用本发明的方法进行免疫组织化学检测,过程中不使用二甲苯和酒精等有机溶剂,更加环保。
利用本发明的缓冲液或试剂盒,结合本发明的方法进行检测,染色强度更明显,更易于观察,有利用临床辅助诊断。
附图说明
图1示出了利用本发明实施例1配制的不同缓冲液进行处理后染色的结果。A:缓冲液#1处理后的切片染色结果;B:缓冲液#2处理后的切片染色结果;C:缓冲液#3处理后的切片染色结果。
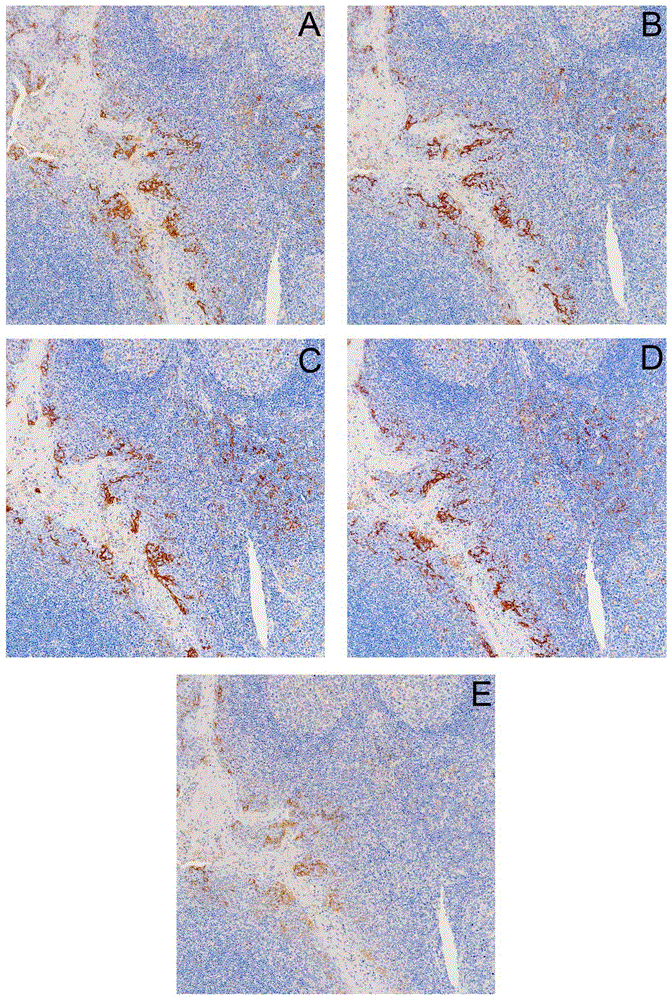
图2示出了利用本发明实施例2配制的不同缓冲液进行处理后染色的结果。A:缓冲液#4处理后的切片染色结果;B:缓冲液#5处理后的切片染色结果;C:缓冲液#6处理后的切片染色结果;D:缓冲液#7处理后的切片染色结果;E:普通Tris-EDTA抗原修复液处理后的切片染色结果。
具体实施方式
除非另有说明、从上下文暗示或属于现有技术的惯例,否则本申请中所有的份数和百分比都基于重量,且所用的测试和表征方法都是与本申请的提交日期同步的。在适用的情况下,本申请中涉及的任何专利、专利申请或公开的内容全部结合于此作为参考,且其等价的同族专利也引入作为参考,特别这些文献所披露的关于本领域中的相关术语的定义。如果现有技术中披露的具体术语的定义与本申请中提供的任何定义不一致,则以本申请中提供的术语定义为准。
本申请中的数字范围是近似值,因此除非另有说明,否则其可包括范围以外的数值。数值范围包括以1个单位增加的从下限值到上限值的所有数值,条件是在任意较低值与任意较高值之间存在至少2个单位的间隔。对于包含小于1的数值或者包含大于1的分数(例如1.1,1.5等)的范围,则适当地将1个单位看作0.0001,0.001,0.01或者0.1。对于包含小于10(例如1到5)的个位数的范围,通常将1个单位看作0.1。这些仅仅是想要表达的内容的具体示例,并且所列举的最低值与最高值之间的数值的所有可能的组合都被认为清楚记载在本申请中。
术语“包含”,“包括”,“具有”以及它们的派生词不排除任何其它的组分、步骤或过程的存在,且与这些其它的组分、步骤或过程是否在本申请中披露无关。为消除任何疑问,除非明确说明,否则本申请中所有使用术语“包含”,“包括”,或“具有”的组合物可以包含任何附加的添加剂、辅料或化合物。相反,出来对操作性能所必要的那些,术语“基本上由……组成”将任何其他组分、步骤或过程排除在任何该术语下文叙述的范围之外。术语“由……组成”不包括未具体描述或列出的任何组分、步骤或过程。除非明确说明,否则术语“或”指列出的单独成员或其任何组合。
为了使本发明所解决的技术问题、技术方案及有益效果更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。
实施例
以下例子在此用于示范本发明的优选实施方案。本领域内的技术人员会明白,下述例子中披露的技术代表发明人发现的可以用于实施本发明的技术,因此可以视为实施本发明的优选方案。但是本领域内的技术人员根据本说明书应该明白,这里所公开的特定实施例可以做很多修改,仍然能得到相同的或者类似的结果,而非背离本发明的精神或范围。
除非另有定义,所有在此使用的技术和科学的术语,和本发明所属领域内的技术人员所通常理解的意思相同,在此公开引用及他们引用的材料都将以引用的方式被并入。
那些本领域内的技术人员将意识到或者通过常规试验就能了解许多这里所描述的发明的特定实施方案的许多等同技术。这些等同将被包含在权利要求书中。
下述实施例的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的仪器设备,如无特殊说明,均为实验室常规仪器设备;下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。
实施例1不同表面活性剂对免疫组织化学检测的影响
1.含不同表面活性剂的缓冲液的配制
本实施例中发明人分别用不同的组分制备用于免疫组织化学检测的缓冲液,意外地发现,当选用特定的表面活性剂——壬基酚聚氧乙烯醚时,能够实现脱蜡、水化和抗原修复一体化处理。为了验证壬基酚聚氧乙烯醚的预料不到的技术效果,发明人分别利用壬基酚聚氧乙烯醚、Tween-20和TrionX-100作为表面活性剂(1%v/v),按表1的比例配制缓冲液。
表1含不同表面活性剂缓冲液配方
缓冲液#1-#3配制方法如下:准确称取或量取Tris Base、EDTA、壬基酚聚氧乙烯醚或Tween-20或TrionX-100、ProClin TM950、蛋白酶K、聚乙二醇2000于洁净的玻璃容器内,加入800mL纯化水充分搅拌混匀,用稀盐酸调节pH至9.0,再用纯化水定容至1000mL。
2.免疫组织化学检测
分别用上述配好的缓冲液#1~#3进行PD-L1的免疫组织化学检测,所需的其他试剂见表2所示:
表2脱蜡、水化和抗原修复一体化处理后免疫组织化学检测用试剂
其中,PBST清洗液配制(1L):量取纯化水800mL,倒入配制容器中;分别称取氯化钠8.0g,氯化钾0.2g,十二水磷酸氢二钠2.87g和磷酸氢二钾0.2g,完全溶解后调整pH值至7.2-7.4,加入Tween-20 1mL后定容至1L。
取FFPE(Formalin-fixed paraffin-embedding)组织样本,切片后分别利用上述缓冲液#1~#3进行脱蜡、水化和抗原修复一体化操作后,添加封闭液,淬灭内源性过氧化物酶的活性;使用PD-L1兔单克隆抗体孵育切片,室温孵育30分钟;添加二抗显色系统,按照说明书操作孵育染色;添加苏木素染液,室温孵育7分钟后终止显色,最后用PBST清洗液返蓝10秒。
利用缓冲液#1-#3进行免疫组织化学检测的染色结果如图1及表3所示,可见,含1%壬基酚聚氧乙烯醚的缓冲液#1染色强度最强(“+++”);而含1% Tween-20的缓冲液#2和含1% TrionX-100的缓冲液#3进行免疫组织化学检测,染色强度弱(“+”),效果十分不理想。可见利用壬基酚聚氧乙烯醚作为表面活性剂进行脱蜡、水化和抗原修复一体化处理,能够取得预料不到的技术效果。
表3含不同表面活性剂进行免疫组织化学检测结果
实施例2含有不同比例壬基酚聚氧乙烯醚的脱蜡、水化和抗原修复一体缓冲液的配制
1.含有不同比例壬基酚聚氧乙烯醚的缓冲液的配制
本实施例提供4种缓冲液#4-#7,均包括Tris-Base、EDTA、壬基酚聚氧乙烯醚、ProClin
表4含不同比例壬基酚聚氧乙烯醚的缓冲液#4-#7配方
缓冲液#4-#7配制方法如下:准确称取或量取Tris Base、EDTA、壬基酚聚氧乙烯醚、ProClin TM950、蛋白酶K、聚乙二醇2000于洁净的玻璃容器内,加入800mL纯化水充分搅拌混匀,用稀盐酸调节pH至9.0,再用纯化水定容至1000mL。
由上表可知,缓冲液#6与实施例1中缓冲液#1配方相同,为了展示不同批次的染色效果,在此利用不同的编号进行区分。
2.普通Tris-EDTA抗原修复液的配制
作为对比,本实施例还提供普通的Tris-EDTA抗原修复液的配制,配方如表5所示。
表5普通Tris-EDTA抗原修复液配方
普通Tris-EDTA抗原修复液配制步骤如下:
准确称取或量取Tris Base、EDTA和ProClin
3.免疫组织化学检测
分别用上述配好的缓冲液#4-#7以及普通Tris-EDTA抗原修复液进行PD-L1的免疫组织化学检测。其中,利用普通Tris-EDTA抗原修复液进行检测,除表2所示试剂外,还包括表6所示的试剂:
表6普通Tris-EDTA抗原修复液进行免疫组织化学检测另外所需试剂
操作步骤及时间如表7所示:
表7免疫组织化学检测步骤及时间
从表7可知,利用脱蜡、水化、抗原修复一体缓冲液#4~#7进行PD-L1检测的总实验时间为102分钟(不含清洗过程);而利用普通Tris-EDTA抗原修复液通过常规方法进行PD-L1检测的总实验时间为182分钟(不含清洗过程),总用时缩短了1个小时。
免疫组织化学染色结果如图2及表8所示,可见利用脱蜡、水化、抗原修复一体缓冲液#4-#7进行免疫组织化学检测,染色强度均比较强(“+++”);而利用通Tris-EDTA抗原修复液进行免疫组织化学检测,染色强度相对较弱(“++”)。
表8各缓冲液进行免疫组织化学检测结果
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 一种基于ISET原理的循环肿瘤细胞IHC抗原修复方法
- 一种糖类抗原CA125表面Tn抗原检测用校准品缓冲液及其制备方法、检测试剂盒
