MNDA在诊断尿路感染中的用途和诊断试剂盒
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及分子诊断技术领域,具体而言,涉及MNDA在诊断尿路感染中的用途和诊断试剂盒。
背景技术
尿路感染是由微生物入侵引起的炎症免疫级联反应,是一种需要及时诊断和适当治疗的复发性感染。大肠埃希菌是尿路感染发生和复发的主要病原体。尿路感染可导致尿频、尿急、尿痛、发烧、肾区不适等临床症状,如未得到及时诊治易导致病情迁延发展为慢性尿路感染,导致肾脏瘢痕、肾脏功能损伤、严重者导致肾衰竭并危及生命,严重影响患者的生活质量。因此,对疾病的及时诊断是确保有效治疗并且改善预后的关键。当前尿路感染临床诊断的金标准为中段尿培养,但其检测周期较长(2-3天)且绝大部分标本为阴性(>70%),费时费力并且缺乏敏感性和特异性。
发明内容
本发明的目的在于提供MNDA在诊断尿路感染中的用途和诊断试剂盒。本发明首次提供了尿路感染的生物标志物,利用MNDA诊断尿路感染具有较高的敏感性和特异性。
本发明是这样实现的:
一方面,本发明提供生物标志物的检测试剂在制备尿路感染诊断试剂盒中的应用,所述生物标志物为MNDA基因的表达产物。
人骨髓细胞核分化抗原(Human myeloid nuclear differentiation antigen,MNDA)仅在骨髓细胞的特定谱系中表达,最显着的是在炎症部位的巨噬细胞中以高水平表达。MNDA具有多种生物学功能,如调节巨噬细胞分化与活化,调节中性粒细胞凋亡,调节单核细胞活化等。然而,目前MNDA研究大多致力于白血病或淋巴瘤等方向。MNDA作为分子标志物用于尿路感染的报道至今还没有。
本发明实施例的研究数据首次显示,MNDA与尿路感染密切相关,可以作为诊断尿路感染的一个新型生物学标志物,经过体内动物实验发现大肠埃希菌引起的尿路感染中,膀胱MNDA的蛋白及mRNA表达显著升高,且三个额外GEO数据集证明MNDA在尿路感染时表达升高。进一步的,MNDA高表达与疾病的严重程度呈正相关。此外,MNDA的ROC曲线下面积在动物模型及GEO数据集中分别为1和0.769。说明MNDA基因的表达产物可以作为尿路感染的生物标志物,通过对MNDA的检测,可快速诊断尿路感染,有利于医师在早期阶段掌握病情,临床医师及时采取治疗措施,将有效缩短诊疗过程,避免并发症的发生。本发明首次公开了尿路感染的生物标志物,利用MNDA诊断尿路感染具有较好的敏感性和特异性。
可选地,在本发明的一些实施方案中,上述MNDA基因为人MNDA基因。
可选地,在本发明的一些实施方案中,所述表达产物为mRNA或蛋白。
基于本发明实施例的研究,MNDA基因的转录产物mRNA,或其翻译产物MNDA蛋白,均可以作为检测标志物,用于尿路感染诊断。
可选地,在本发明的一些实施方案中,所述mRNA的核酸序列为SEQ ID NO.1:
aguguaagaaggccaucuacaaucaagauugagaguggcucuaacaagugccauuuuuccuuguuagcuuucauuucucagcccuuuacaagauuaaaauagucugcaguuuaaucucuccaaagcuuuacggacagugauucuguccuaaacaagacagugacuccaggauuucugaagacuauuguggaagaagcauccauuaaggccaagcuauaacaucagaaauggugaaugaauacaagaaaauucuuuugcugaaaggauuugagcucauggaugauuaucauuuuacaucaauuaaguccuuacuggccuaugauuuaggacuaacuacaaaaaugcaagaggaauacaacagaauuaagauuacagauuugauggaaaaaaaguuccaaggcguugccugucuagacaaacuaauagaacuugccaaagauaugccaucacuuaaaaaccuuguuaacaaucuucgaaaagagaagucaaaaguugcuaagaaaauuaaaacacaagaaaaagcuccagugaaaaaaauaaaccaggaagaagugggucuugcggcaccugcacccaccgcaagaaacaaacugacaucggaagcaagagggaggauuccuguagcucagaaaagaaaaacuccaaacaaagaaaagacugaagccaaaaggaauaaggugucccaagagcagaguaagcccccaggucccucaggagccagcacaucugcagcuguggaucaucccccacuaccccagaccucaucaucaacuccauccaacacuucguuuacuccgaaucaggaaacccaggcccaacggcagguggaugcaagaagaaauguuccccaaaacgacccagugacaguggugguacugaaagcaacagcgccauuuaaauacgaguccccagaaaaugggaaaagcacaauguuucaugcuacaguggccaguaagacucaauauuuccaugugaaagucuucgacaucaacuugaaagagaaauuuguaaggaagaaggucauuaccauaucugauuacucugaauguaaaggaguaauggaaauaaaggaagcaucaucugugucugacuuuaaucaaaauuuugaggucccaaacagaauuaucgaaauagcaaauaaaacucccaagaucagucaacuuuacaagcaagcaucuggaacaaugguguauggguuguuuauguuacaaaagaaaagcguacacaagaagaacacaauuuaugaaauacaggauaauacaggauccauggauguaguggggaguggaaaauggcacaauaucaagugugagaaaggagauaaacuucgacucuucugccuucaacugagaacaguugaccgcaagcugaaacugguguguggaagucacagcuucaucaaggucaucaaggccaagaaaaacaaggaaggaccaaugaauguuaauugaaauaugaaagcugaaaugcaacaaacaacuuccgcuuaaaacaauuaaguuguuaauaacugugauuuuguaaauuucaguaauucauuuaaaugauguuucaguagauauauucuagcauauuaagagcuuuuauaacugaguuauagauuaguuugcuuucuggaauaaaauuuucuucuuauacucuuccuuuuuuuuagauauuacauuuugcuuuuaugacauucacgaggcaaaaaauaaaauaucuuuuuuugaagga。
该序列为人MNDA基因的mRNA序列,以该mRNA为检测标志物,通过检测其表达水平,可以实现尿路感染的诊断或辅助诊断。
可选地,在本发明的一些实施方案中,当所述生物标志物为MNDA基因转录的mRNA时,所述检测试剂包括如下试剂中的一种或几种:RNA提取试剂、RNA逆转录试剂、以及qRT-PCR试剂。
在RNA水平检测目标基因的表达水平是本领域熟知的技术,基于本发明公开的内容,本领域技术人员容易获得并制备检测MNDA基因mRNA表达水平的试剂,例如RNA提取试剂、RNA逆转录试剂、以及qRT-PCR试剂等。
可选地,在本发明的一些实施方案中,所述qRT-PCR试剂包括但不限于引物对SEQID NO.2-3、SEQ ID NO.4-5、或SEQ ID NO:6-7。
SEQ ID NO.2:
5’-GGAAGAAGCATCCATTAAGG-3’;
SEQ ID NO.3:
5’-GTTTGTCTAGACAGGCAAC-3’。
SEQ ID NO.4:
5’-GTTTACTCCGAATCAGGAAACCC-3’
SEQ ID NO.5:
5’-TAAATGGCGCTGTTGCTTTCA-3’
SEQ ID NO.6:
5’-AGCGTACACAAGAAGAACACAA-3’
SEQ ID NO.7:
5’–GTTTCAGCTTGCGGTCAACTG-3’
根据MNDA基因的序列,本领域技术人容易设计出多种检测MNDA基因mRNA表达水平的引物对,无论何种引物对均属于本发明的保护范围。
可选地,在本发明的一些实施方案中,所述蛋白的氨基酸序列为SEQ ID NO.8:
MVNEYKKILLLKGFELMDDYHFTSIKSLLAYDLGLTTKMQEEYNRIKITDLMEKKFQGVACLDKLIELAKDMPSLKNLVNNLRKEKSKVAKKIKTQEKAPVKKINQEEVGLAAPAPTARNKLTSEARGRIPVAQKRKTPNKEKTEAKRNKVSQEQSKPPGPSGASTSAAVDHPPLPQTSSSTPSNTSFTPNQETQAQRQVDARRNVPQNDPVTVVVLKATAPFKYESPENGKSTMFHATVASKTQYFHVKVFDINLKEKFVRKKVITISDYSECKGVMEIKEASSVSDFNQNFEVPNRIIEIANKTPKISQLYKQASGTMVYGLFMLQKKSVHKKNTIYEIQDNTGSMDVVGSGKWHNIKCEKGDKLRLFCLQLRTVDRKLKLVCGSHSFIKVIKAKKNKEGPMNVN。
该序列为人MNDA蛋白氨基酸序列。
可选地,在本发明的一些实施方案中,当所述生物标志物为MNDA基因表达的MNDA蛋白时,所述检测试剂包括如下试剂中的一种或几种:蛋白提取试剂、以及western blot试剂。
蛋白含量检测技术是本领域熟知的技术,基于本发明公开的内容,本领域技术人员容易获得并制备检测MNDA蛋白浓度的试剂,例如蛋白提取试剂、ELISA试剂、以及westernblot试剂等。
可选地,在本发明的一些实施方案中,所述ELISA试剂和western blot试剂包括特异性结合MNDA蛋白的抗体。
对于本领域技术人员,在知晓目标检测蛋白的氨基酸序列基础上,容易获得或制备检测该蛋白的ELISA试剂和western blot试剂,例如抗MNDA蛋白的抗体,这对本领域技术人员来说是容易实现的。
另一方面,本发明提供一种尿路感染的诊断试剂盒,其包括生物标志物的检测试剂,所述生物标志物为MNDA基因的表达产物。
可选地,在本发明的一些实施方案中,所述诊断试剂盒的检测样品来自血清或血浆或膀胱组织。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1为构建大鼠尿路感染模型的结果分析图。
图2为对照组与造模组大鼠膀胱组织中差异蛋白的筛选。
图3为尿路感染疾病特征基因的筛选。
图4为膀胱组织中MNDA的转录表达水平图。
图5为MNDA表达水平与膀胱组织损伤和细菌负荷相关性分析。
图6为膀胱组织中MNDA的蛋白表达水平图。
图7为实施例5的结果分析图。
图8为实施例6的结果分析图。
图9为MNDA在尿路感染患者与健康人血清中蛋白表达水平图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例1
筛选急性尿路感染关键疾病特征基因MNDA
1.构建尿路感染动物模型
本实施例首先从广东省医学实验动物中心购买20只6-8周龄雌性SD大鼠(体重160-180克),随机分为2组,通过经尿道逆行注射大肠埃希菌构建尿路感染模型,以无菌PBS作为对照。通过HE染色观察大鼠膀胱组织学形态变化及评估尿液及膀胱内细菌负荷验证尿路感染模型构建成功。利用GraphPad Prism 8.0软件作图,结果如图1所示。
图1结果显示:大鼠经尿道逆行注射大肠埃希菌后膀胱组织可见明显炎症免疫细胞浸润(图1A),且与对照组相比,造模组的HE组织损伤评分显著升高(图1B)。尿液及膀胱内细菌负荷结果表明:造模后,大鼠尿液及膀胱组织内细菌量较对照组显著增加(图1C),值得注意的是HE评分与尿液及膀胱内细菌负荷显著相关。这些结果充分说明本实施例成功构建了尿路感染动物模型。
2.TMT蛋白质组学检测
(1)蛋白提取及酶解(对照组和造模组各取3个样品);
将SDT缓冲液加入到样品中,并转移到2ml离心管中。裂解物通过MP Fastprep-24自动均质机(24×2,6.0M/S,60s,两次)均质化。将匀浆物超声处理,然后煮沸15分钟。在14000g下离心40分钟后,用0.22μm过滤器过滤上清液。用BCA蛋白质测定试剂盒(P0012,Beyotime)定量滤液。将样品储存在-80℃。利用TEAB buffer对样品进行酶解。
(2)TMT稳定同位素标记技术标记;
根据制造商的说明,使用TMT试剂(Thermo Fisher Scientific)标记每个样品的100μg肽混合物。
(3)高效液相色谱分离及液相串联质普分析;
LC-MS/MS分析在Q Exactive Plus质谱仪(Thermo Fisher Scientific)上进行,该质谱仪与Easy nLC(Thermo Fisher Scientific)耦合90/120分钟。质谱仪在正离子模式下操作。使用数据依赖性top10方法获取MS数据,从调查扫描(350-1800m/z)动态选择最丰富的前体离子进行HCD片段化。自动增益控制(AGC)目标设置为3e6,最大注入时间为45ms。在m/z 200时以70,000的分辨率获得调查扫描,在m/z 200下将HCD光谱的分辨率设置为17,500,隔离宽度为2m/z。归一化碰撞能量为30eV。
(4)表达鉴定与定量结果:通过质谱分析得到377488张二级谱图(Totalspectrums)。质谱二级图谱经蛋白理论数据搜库后,得到可利用有效图谱数(Matchedspectrums)为52794,谱图利用率为14%。通过谱图解析共鉴定到30231条肽段(Peptides),其中特异性肽段(Unique Peptides)为28130。一共鉴定到5446个蛋白,其中5140个蛋白在造模组与对照组中可定量。
(5)筛选差异表达蛋白:定量分析中,首先通过标记试剂在质谱的信号强度,计算得到每个样品各自的相对定量值,计算造模组相对于对照组的变化倍数(Fold change,FC),根据FC>1.3及p值<0.05筛选差异蛋白,结果如图2所示。
图2结果显示:PCA主成分分析表明对照组和造模组的蛋白定量均具有较好的重复性(图2A)。火山图中红色点表示显著差异表达上调蛋白,蓝色点表示显著差异表达下调蛋白,总共筛选出421个差异蛋白质(图2B)。热图展示了421个差异蛋白在不同样本中的差异表达。
3.机器学习结合Lasso回归筛选尿路感染特征基因:支持向量机(support vectormachines,SVM)是一种二分类模型,它的基本模型是定义在特征空间上的间隔最大的线性分类器,可用于临床科研中疾病特征基因的筛选。
图3结果显示:利用“randomForest”R包筛选出10个尿路感染疾病特征基因(图3A),Lasso回归筛选出11个尿路感染特征基因(图3B),两者取交集即为尿路感染疾病特征基因:人骨髓细胞核分化抗原基因(MNDA基因,图3C)。
实施例2
尿路感染大鼠膀胱组织MNDA转录水平检测
1.膀胱组织RNA提取
(1)将经液氮固定的膀胱组织充分研磨,加入1ml Trizol试剂后用电动均浆器充分匀浆3-5min,之后转移至1.5ml EP管。
(2)加入200μL氯仿,使用振荡器将其低速震荡15秒后使用桌上离心机瞬离,静置5分钟。提前4℃预冷离心机,使用离心机离心10分钟,13000rpm。离心后加入氯仿离心后(氯仿:Trizol=1:5),可见裂解液分为两层(水相和有机相),用无酶枪头吸取400μL水相中的RNA转移至另一1.5ml EP管。
(3)加入与RNA等体积预冷的异丙醇(400μL),上下颠倒摇晃混匀后静置10分钟。静置后使用离心机4℃离心10分钟,12000rpm。
(4)离心后弃上清,吸水纸沾干,加入1ml预冷的75%乙醇,轻轻震荡以去除RNA表面的异丙醇。之后使用离心机4℃离心5分钟,12000rpm。
(5)离心后弃上清,吸水纸沾干,倒置干燥5-10分钟,根据RNA量加入适量DEPC水,一般为20-50μL。
(6)测量RNA浓度:用DEPC水擦拭BioTek微量检测板后用干纸巾擦拭干净,第一排的两孔加入2μL DEPC水当做内参,按实验分组的顺序分别取2μL样品加于微量检测板上,再利用Synergy2多功能酶标仪测量260nm和280nm处样品的吸光值,计算260nm/280nm比值,若比值>1.8则提示结果可信,RNA纯度高。最后用无酶水将样品浓度配平为500或1000ng/μL。
2.RNA的逆转录
(1)根据以下成分于冰上配制反应混合液,为了保证反应混合液配制的准确性,进行下列各项反应时,应先按照反应数+2的量配置反应混合液,然后再分装到每个反应管中,最后根据RNA浓度加入不同RNA体积(每个样品取1μg)。
(2)RNA浓度为500ng/μL时
(3)RNA浓度为1000ng/μL时
(4)室温静置:室温静置5-30分钟。
(5)反转录反应(TB Green qPCR法):根据以下成分于冰上配制反应混合液,为了保证反应混合液配制的准确性,进行下列各项反应时,应先按照反应数+2的量配置反应混合液,然后再分装10μL到每个反应管中。轻柔混匀后立即进行反转录反应。
反应体系如下:
反应程序如下:
/>
3.qRT PCR:
(1)PCR反应液:按照下列组份配置PCR反应液
(2)进行RT PCR反应:反应液配置好后添加至PCR96孔板,并做3个重复,贴上专用PCR封口膜封口,然后离心使液体流至孔底部,放置于Bio-Rad PCR反应仪中。反应体系如下:
Stage1:预变性
Reps:1
95℃30秒
Stage2:PCR反应
Reps:40
95℃5秒
60℃31或34秒
结果见图4。
图4结果显示:经尿道逆行注射大肠埃希菌后,造模组MNDA的转录水平较对照组显著升高(图4),说明MNDA mRNA在大肠埃希菌相关尿路感染中发挥一定的作用。
实施例3
MNDA表达水平与膀胱组织病理性评分,尿液细菌负荷,膀胱内细菌负荷的相关性。绝大多数尿路感染起源于肠道并上升到膀胱,膀胱是尿路感染重要的目标靶器官。因此,本实施例通过评估膀胱病理损伤,膀胱内尿液细菌负荷,膀胱细胞内细菌负荷来评价疾病的严重程度。
膀胱病理损伤评分:对于每个HE组织切片,采用五个随机视野进行评分:1(膀胱上皮正常),2(局灶性和多灶性炎症),3(水肿和弥漫性炎症),4(标记有坏死的炎症细胞和中性粒细胞和膀胱上皮),5(炎症细胞浸润进入肌肉),或6(表面上皮细胞丢失,基于5分)。
图5结果显示:大鼠大肠埃希菌感染后,膀胱组织MNDA的含量与膀胱组织病理损伤,膀胱内尿液细菌负荷及膀胱细胞内细菌负荷成正比,且具有统计学差异(图5A和5B)。说明MNDA的高表达会导致宿主病情加重。
实施例4
尿路感染大鼠膀胱组织MNDA翻译水平检测
1.膀胱组织蛋白提取
(1)取体积约3*3*3mm的膀胱组织至1.5ml EP管,根据膀胱组织体积大小加入200-500μl RIPA裂解液后用组织研磨器充分研磨。
(2)使用超声波细胞破碎仪按照运行20s间隙5s的设定程序对每个样品裂解液超声3次,超声裂解功率为25W,注意超声过程超声破碎仪不可直接接触EP管底面以防止蛋白溅出。
(3)提前4℃预冷离心机,将裂解液放入离心机离心20分钟,吸取上清液加入新的1.5ml EP管内并记录体积,注意勿吸取下层细胞碎片。
(4)BCA法检测蛋白样品浓度并蛋白定量。
(5)将定量好的蛋白样品使用振荡器震荡均匀,再放入恒温金属浴于105℃水浴15分钟使样品蛋白充分变性。待温度降至50℃以下时取出样品,短暂离心后放入-80℃冰箱保存。
2.SDS-PAGE电泳
(1)根据蛋白浓度取20-40μl样品上样,电泳仪恒压90V运行30分钟后将电压调制120V,最后根据目标蛋白的分子量决定运行时间。
(2)100V恒定电压转膜100分钟。
(3)转膜结束后,PBS中清洗5-10分钟,之后用5%的脱脂牛奶封闭,室温下摇床孵育封闭2小时以上。
(4)封闭结束后TBST清洗3次,每次10分钟。之后根据目标蛋白分子量结合marker指示带切取需要部分条带,并用铅笔标记好。
(5)孵育一抗,4℃摇床摇晃过夜孵育。
(6)孵育完成后用TBST清洗(如前所述),孵育二抗,室温避光孵育1-2小时。
(7)孵育完成后用TBST清洗(如前所述),将清洗好的NC膜置于LI-COR
(8)利用ImageJ对蛋白进行半定量分析,并利用PS(Adobe photoshop 2020)、AI(Adobe Illustrator 2020)等软件进行可视化。
3.结果如图6所示。
图6结果显示:经尿道逆行注射大肠埃希菌后,造模组MNDA的蛋白水平较对照组显著升高,说明MNDA蛋白在大肠埃希菌相关尿路感染中发挥一定的作用。
实施例5
收集尿路感染GEO数据集验证MNDA表达
首先从GEO数据库筛选出尿路感染相关数据集,合并并消除批次效应。通过合并后的数据集评估MNDA的相对表达量,结果如图7所示。
图7结果显示:本实施例首先筛选出三个GEO数据集:GSE11783,GSE124917和GSE28242。PCA主成分分析表明三个数据集存在明显批次效应(图7A),利用“sva”R包可明显消除三组数据集的批次效应(图7B)。接下来利用“dplyr”R包合并数据集,并评估了MNDA的相对表达量,结果表明MNDA在尿路感染造模组显著升高(图7C)。
实施例6
ROC曲线分析评估MNDA对尿路感染的诊断效能
利用ROC曲线评估了MNDA在尿路感染大鼠动物模型及GEO数据集中的诊断效能,利用“pROC”R包进行统计分析并作图,结果如下图所示。
图8结果显示:ROC曲线分析表明MNDA在大鼠尿路感染动物模型中曲线下面积为1.000,95%置信区间为:1.000-1.000,灵敏度和特异性均为100%(图8A);MNDA在尿路感染GEO数据集中曲线下面积为0.769,95%置信区间为:0.571-0.935(图8B),其灵敏度为76.2%,特异性为85.7%,结果表明MNDA作为新型尿路感染诊断指标具有较高的准确性。
实施例7
MNDA在尿路感染诊断中的应用
1.尿路感染患者及健康人血清样品收集
首先收集6例尿路感染伴发烧患者血清样品和6例健康人血清样品,采血后轻轻倒转采血管混合4~5次,直立置于室温待血液完全凝固,1000g离心10分钟,分离上层血清。
2.ELISA检查血清MNDA表达变化情况
(1)标准品的稀释:利用MNDA-ELISA试剂盒将原倍标准品进行稀释。
(2)加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、待测样品孔。在酶标包被板上标准品准确加样50μl,待测样品孔中先加样品稀释液40μl,然后再加待测样品10μl(样品最终稀释度为5倍)。加样将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。
(3)温育:用封板膜封板后置37℃温育30分钟。
(4)配液:将30倍浓缩洗涤液用蒸馏水30倍稀释后备用。
(5)洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30秒后弃去,如此重复5次,拍干。
(6)加酶:每孔加入酶标试剂50μl,空白孔除外。
(7)温育:操作同3。
(8)洗涤:操作同5。
(9)显色:每孔先加入显色剂A50μl,再加入显色剂B50μl,轻轻震荡混匀,37℃避光显色10分钟.
(10)终止:每孔加终止液50μl,终止反应(此时蓝色立转黄色)。
(11)测定:以空白孔调零,450nm波长依序测量各孔的吸光度(OD值)。测定应在加终止液后15分钟以内进行。
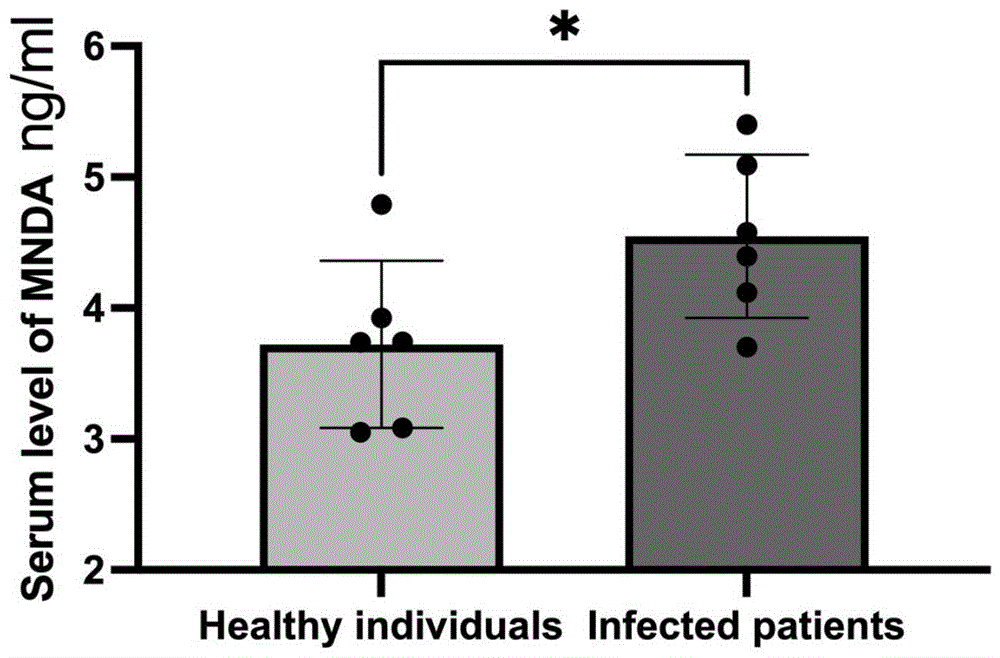
3.结果如图9所示。
图9结果显示:与健康正常人相比,尿路感染伴发烧患者待血清MNDA蛋白水平显著升高,说明MNDA蛋白在尿路感染进展中发挥一定的作用。
综上所述,本发明实施例通过机器学习算法筛选出MNDA可作为尿路感染特征基因,ROC曲线分析表明MNDA可作为尿路感染的一个新型生物标志物。体内实验发现大肠埃希菌相关尿路感染可引起MNDA的转录及翻译表达上调,而且MNDA的高表达与疾病的严重性呈正相关。进一步GEO数据库验证了MNDA在尿路感染中的高表达。因此,本发明实施例提供MNDA作为尿路感染的一个诊断指标及病情评估指标。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 一组蛋白作为肿瘤标志物在制备恶性肿瘤诊断试剂和试剂盒中的用途
- D-丝氨酸作为标志物在制备抑郁症诊断试剂盒中的应用及抑郁症诊断试剂盒
- 蛋白标志物在诊断肠易激综合征的产品中的用途和用于诊断肠易激综合征的试剂盒
- SETD4在制备胰腺癌诊断和/或预后试剂盒中的用途及SETD4阻断剂在制备治疗胰腺癌药物中的用途
