一种均一透明质酸寡聚糖的膜纯化方法
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及一种均一度高的透明质酸寡聚糖的膜纯化方法,属于生物工程技术领域。
背景技术
透明质酸(hyaluronic acid,简称HA),又称玻尿酸,是一种由D‒葡萄糖醛酸和N‒乙酰氨基葡萄糖为重复双糖单位,通过β(1‒3) 和β(1‒4) 糖苷键交替连接而成的大分子黏性多糖,由Meyer等人于1934年首次从牛玻璃球眼中提取获得。
研究表明,HA的生物活性依赖于其分子量的大小,不同分子量范围的HA表现出不同的生理学功能。高分子量HA由于具有较好的粘弹性,可应用于眼科手术黏弹剂和关节腔内注射治疗。而HA寡聚糖由于分子量较小(小于10000 Da),更容易透过表皮层进入真皮层,具有抗炎、免疫调节、促进细胞增殖,促进内源HA和胶原蛋白合成等功效。因此,HA寡聚糖在食品、化妆品以及医药领域具有广阔的应用前景。
目前,HA寡聚糖的生产工艺主要是通过链球菌发酵合成高分子量HA,再经过体外酶解获得HA寡聚糖,后续经有机溶剂提纯HA寡聚糖,由于该工艺繁琐,导致HA寡聚糖的生产成本居高不下,另外大量使用有机溶剂(乙醇),存在较大的安全生产隐患。此外,该工艺获得的HA寡聚糖的均一性较低、分散系数往往比较高。
专利CN111518736A公开了一种一步发酵法直接获得HA寡聚糖的重组谷氨酸棒杆菌,即在重组谷氨酸棒杆菌发酵过程中加入透明质酸酶,显著缩短了HA寡聚糖的生产周期,另外在发酵过程中加入透明质酸酶,降低了发酵液的黏度,显著提高了HA寡聚糖的产率。但是该专利中采用醇沉的方式得到HA寡聚糖,依然存在很大的安全隐患。
发明内容
针对现有技术存在的不足,本发明提供了一种均一透明质酸寡聚糖的膜纯化方法,该方法通过膜纯化的方式从发酵液中纯化得到透明质酸寡聚糖,所得产品均一性高、收率和纯度也较高,且无需使用有机溶剂,安全性高。
本发明具体技术方案如下:
一种均一透明质酸寡聚糖的膜纯化方法,该方法包括对透明质酸寡聚糖的发酵液进行超滤和脱色的步骤,其中透明质酸寡聚糖的发酵液先进行超滤,再进行活性炭脱色处理。这样的处理顺序有更高的收率和纯度。
进一步的,该方法对透明质酸寡聚糖的发酵液依次进行微滤、热变性去除蛋白、超滤、活性炭脱色、精滤、喷雾干燥的处理,得到透明质酸寡聚糖。该透明质酸寡聚糖均一性高,分散系数低。
进一步的,本发明提供的是发酵法得到的透明质酸寡聚糖发酵液的纯化处理方法,是从发酵液中提取、纯化得到透明质酸寡聚糖产品的方法。所述透明质酸寡聚糖的发酵液中,透明质酸寡聚糖的分子量≤200kDa,优选为6 kDa‒8 kDa,所述透明质酸寡聚糖的发酵液可以是现有技术中报道的任意菌株发酵得到的。在本发明某一具体实施方式中,所述透明质酸寡聚糖的发酵液是谷氨酸棒杆菌进行发酵得到的含透明质酸寡聚糖的发酵液。所用的谷氨酸棒杆菌可以是现有技术中报道的任意能够用于生产透明质酸寡聚糖的谷氨酸棒杆菌,发酵获得发酵液的方法也可以是现有技术中报道的任意可行的方法,发酵液中透明质酸寡聚糖的含量可以是任意的含量。本发明方法对于各种透明质酸寡聚糖发酵液具有普适性。
在本发明某一具体实施方式中,所用的透明质酸寡聚糖发酵液是采用CN111518736A中记载的重组谷氨酸棒杆菌发酵得到的发酵液,其发酵方法为:挑取重组谷氨酸棒杆菌单克隆,接入种子培养基培养,转接到发酵培养基中;发酵培养基成份为:20 g/L玉米浆干粉、20 g/L硫酸铵、3 g/L磷酸二氢钾、0.5 g/L无水硫酸镁;发酵培养条件:发酵温度为28 ℃,pH维持在7.0,发酵时间72 h,在发酵20 h时,加入水蛭透明质酸酶。
在本发明某一具体实施方式中,发酵液中透明质酸寡聚糖发酵液的含量为 35-70g/L。
进一步的,本发明对发酵液先进行微滤处理,微滤的目的是为了实现固液分离,即将含有透明质酸寡聚糖的发酵液直接进行微滤固液分离,获得含有透明质酸寡聚糖的微滤上清液。微滤所用的膜材料的材料可以是各种类型,例如陶瓷膜等,膜的孔径为0.2‒1 um,例如可以是0.2um、0.4 um、0.5 um、0.8 um、1 um,优选为0.4-0.8um。
进一步的,微滤时的操作温度控制在30℃‒37℃,例如温度可以为30℃、31℃、32℃、33℃、34℃、35℃、36℃、37℃,微滤的具体操作步骤为:将发酵液进行微滤,待滤出液接近初始发酵液体积一半时,加入水至原始发酵液体积,继续微滤;重复该操作(待滤出液接近初始发酵液体积一半时,加入水至原始发酵液体积),直至滤出1.5‒3倍于原始发酵液体积的微滤上清液后,微滤结束。微滤过程中通过加水能够显著提高透明质酸寡聚糖的收率,且纯度也较高。
进一步的,将微滤后的上清液进行热变性去除蛋白,即将微滤上清液加热使蛋白变性沉淀,然后冷却至室温后通过过滤的方式去除变性的蛋白质。蛋白质变性的温度一般为80℃‒100℃,例如可以为80℃、85℃、90℃、95℃、100℃,恒温维持0.5‒5分钟,例如可以为0.5分钟、1分钟、1.5分钟、2分钟、2.5分钟、3分钟、3.5分钟、4分钟、4.5分钟、5分钟。蛋白质全部变性后,将上清液冷却至室温,通过过滤去除大部分变性的蛋白质。过滤采用常规的去除蛋白质的操作,例如在上清液中加入上清液0.5-2wt%的珍珠岩和0.5-2wt%的硅藻土作为助滤剂,搅拌混匀,过0.1-0.2 um的滤纸板,滤纸板的孔径可以为0.1um、0.2um,除去大部分的变性蛋白质,获得过滤上清液。
进一步的,去除蛋白质后的上清液进行超滤,超滤即将含有透明质酸寡聚糖的过滤上清液进行超滤,除去小分子杂质。超滤所用的膜材料可以是各种材质,例如有机膜等,膜的孔径为2 kDa-10 kDa,例如2 kDa、3 kDa、5 kDa、8 kDa、10 kDa,优选为2 kDa-5 kDa。
进一步的,超滤时的操作温度控制在20 ℃-25 ℃,超滤过程中多次加水,直至超滤截留液电导率 ≤ 3 ms/cm且超滤实时透过液电导率 ≤ 300 us/cm时,超滤结束。
进一步的,超滤过程中的多次加水 ,指的是两次或两次以上。
进一步的,超滤所得的超滤截留液进行活性炭脱色,活性炭脱色的操作为:将超滤截留液调节pH至5.0-5.5,然后加入活性炭进行脱色,脱色后过滤去除活性炭,然后调整pH至7.0-7.5。所用的活性炭为食品级活性炭或药用级活性炭,优选为药用级活性炭,活性炭的用量、脱色条件可以参照现有常规方式。例如活性炭用量可以为超滤截留液质量的0.5-2wt%,例如0.5%、1%、1.5%、2%,脱色的温度为55-65℃,脱色时间为1-2 h。过滤活性炭时,优选加入超滤截留液0.5%-2%的珍珠岩和0.5 %-2%的硅藻土作为助滤剂,搅拌混匀,然后过0.1-0.2 um的滤纸板去除活性炭。其中,珍珠岩的浓度可以为0.5%、1%、1.5%、2%,硅藻土的浓度可以为0.5%、1%、1.5%、2%。
进一步的,活性炭脱色后的上清液进行精滤,以去除残留的菌体和活性炭,精滤时,将上清液过尼龙膜,优选的尼龙膜的孔径小于等于0.22um。
进一步的,精滤后的精滤液进行真空喷雾干燥,获得无菌白色透明质酸寡聚糖粉末。喷雾干燥采用常规的操作模式,例如设备进样口温度170 ℃,出样口温度70 ℃‒75 ℃。最终得到的产品的纯度 ≥ 96%,蛋白质含量 ≤ 0.03%,重均分子量为6 kDa‒8 kDa,分散系数
本发明将含有透明质酸寡聚糖的发酵液通过微滤固液分离、热变性去除蛋白、超滤除小分子杂质、活性炭脱色、精滤除菌和残留炭、真空喷雾干燥的操作获得了高纯度、高收率的透明质酸寡聚糖粉末,产品纯度 ≥ 96%,蛋白质含量 ≤ 0.03%,重均分子量为6kDa‒8 kDa,分散系数
附图说明
图1为本发明工艺流程图。
图2为重组谷氨酸棒杆菌发酵HA寡聚糖的产量‒时间曲线图。
图3为实施例8中不同透明质酸寡聚糖产品的纯度对比图。
具体实施方式
下面结合实施例进一步说明本申请,应当理解,实施例仅用于进一步说明和阐释本申请,并非用于限制本申请。
除非另外定义,本说明书中有关技术的和科学的术语与本领域内的技术人员所通常理解的意思相同。在相冲突的情况下,以本说明书包括其中定义为准,另外,材料、方法和例子仅供说明,而不具限制性。
下述实施例中,HA寡聚糖含量(透明质酸寡聚糖含量)、蛋白质含量、HA寡聚糖分子量(透明质酸寡聚糖分子量)测定方法如下所示:
1、HA含量测定(硫酸咔唑法)
(1)试剂
0.025 mol/L硼砂硫酸溶液:称取4.77 g硼砂,溶于浓硫酸(优级纯)500 ml中,摇匀即得。
咔唑试液:称取咔唑0.125 g加无水乙醇100 ml,振摇使其溶解,即得。本液应置棕色玻璃瓶中,密塞,置暗处保存。
(2)对照品
葡萄糖醛酸
(3)对照品溶液制备
精密称取经105 ℃以五氧化二磷为干燥剂,真空干燥至恒重的葡萄糖醛酸对照品约0.1 g(Ws),置100 ml容量瓶中,加水溶解稀释至刻度,摇匀,作为贮备液。精密量取贮备液5 ml,置100 ml容量瓶中,加水制成每1 ml中含50 ug的溶液,摇匀,按下式计算葡糖醛酸对照溶液的浓度。
(4)样品制备
发酵液离心取上清200 ul,加入800 ul 5 %的NaCl溶液,离心取上清液200 ul加入800 ul工业乙醇,离心去上清,自然风干,加1 ml纯化水复溶,然后稀释适当倍数使葡糖醛酸浓度在标曲范围内。
(5)标准曲线的制备
精密量取对照品溶液0、0.2、0.4、0.6、0.8和1 ml,分别置具塞试管中,各加水至1ml,混匀,加入5 ml0.025 mol/L硼砂硫酸溶液,混匀,置沸水浴中加热10分钟,置冰水中放冷。精密加入咔唑试液200 ul,摇匀,置沸水浴中加热15分钟,置冰水中放冷。照紫外可见分光光度计操作规程,在530 nm波长处测定吸光度,以葡萄糖醛酸的浓度(ug/ml)与吸光度,从仪器上显示回归方程及相关系数(r>0.990)。
(6)样品测定
精密量取样品试液1 ml,平行制备两支试管,按照标准样品测定方法操作。
蛋白质含量测定(考马斯亮蓝法)
(1)试剂
考马斯亮蓝试液:取考马斯亮蓝(G250)0.1 g,加乙醇50 ml溶解后,再加85 %磷酸100 ml加水稀释至800 ml,用定量滤纸滤过,即得。
(2)牛血清白蛋白标准溶液的制备
精密称取牛血清蛋白对照品约50 mg(M)置100 ml量瓶中,加水溶解定容至刻度,摇匀,作为贮备液。临用前精密量取5 ml于50 ml容量瓶中,加水制成每1 ml约含50 ug的溶液,摇匀,按下式计算牛血清蛋白标准溶液的浓度。
(3)标准曲线的制备
精密量取对照品溶液0、0.1、0.2、0.4、0.8、1 ml,分别置具塞试管中,各加纯化水至1 ml(0空白管试液量加倍),加4 ml考马斯亮蓝试液,立即混匀,5分钟后,照分光光度法在595 nm波长处测吸光度,以牛血清蛋白的浓度与对应的吸光度计算回归方程(r>0.980)。
(4)样品制备
精密称取样品约0.1 g置于离心管中,精密量取5 ml纯化水加入其中,室温下摇床震荡混匀(1-2 h)加速溶解,24 h之内测定,三个平行。
(5)样品测定
制备的样品溶液去1 ml,按照标曲样品测定方法进行操作。
(6)样品测定
制备的样品溶液用0.1 mol/L氢氧化钠溶液稀释适当倍数后,按照标曲样品测定方法进行操作。
寡聚糖分子量测定(MW)
电子天平精密称取0.01 g和0.1 mg,利用多角度激光光散射仪测定,色谱柱TSK-GEL GMPWXL(7.8 mm × 300 mm),流动相为0.2 mol/L氯化钠溶液,流速0.6 ml/min,柱文35 ℃,检测器温度35 ℃,进样量500 ul,折光指数增量dn/dc=0.160。
4、HA寡聚糖白度
(1)仪器
数显白度仪
(2)样品制备
将粉末或细小颗粒状样品盛放在粉末器中,用表面干净光洁的玻璃板将样品表面压平,使试样表面均匀平整。
(3)样品测定
将盛样品的粉末放在数显白度仪的试样座上,待数值稳定后读取测量值。
实施例1 HA寡聚糖发酵
工程菌使用CN111518736A中报道的谷氨酸棒状杆菌,将其在适宜的培养基中,适宜的培养条件下,进行发酵生产透明质酸寡聚糖,发酵温度为28 ℃,pH维持在7.0,发酵时间72 h。发酵培养基成份包括:20 g/L玉米浆干粉、20 g/L硫酸铵、3 g/L磷酸二氢钾、0.5g/L无水硫酸镁。一级种子在只含有大豆蛋白胨培养基中220 rpm 30 ℃培养20‒24h,待OD为9‒12,按照初始OD在0.2‒0.3转入二级种子培养基进行培养。二级种子培养基为发酵培养基,220 rpm 30 ℃培养9‒11h,待OD为18‒22,按照10%接种量转入发酵罐。在发酵过程中,用氨水维持pH=7.0,补加葡萄糖使糖浓度维持在10‒50 g/L,通气量30‒50 L/min,转速逐步提升到650 rpm。在发酵20 h时取样并加入水蛭透明质酸酶,使酶活力达到6000 U/ml,24、36、47、60、72 h取样检测HA浓度和OD。从图1可以看出,前60小时HA寡聚糖的大量积累,之后积累缓慢,到发酵72 h,HA寡聚糖的产量达到了52.67 g/L。
实施例2微滤膜孔径筛选
将实施例1中含有高浓度透明质酸寡聚糖的发酵液直接进行微滤,微滤过滤所用的膜材料是孔径分别为0.2 um、0.4 um、0.5 um、0.8 um和1 um的陶瓷膜,操作温度控制在30 ℃‒37 ℃。待滤出液接近初始发酵液体积一半时,加入与初始发酵液体积一半的纯化水继续微滤,多次重复加入纯化水,直到滤出1.5倍于初始发酵液体积的微滤液,微滤结束,分别检测不同膜孔径下HA寡聚糖的收率,收率计算方法为:滤出液HA的质量比上发酵液HA的质量,结果如表1所示。从表1可以看出,微滤膜孔径越大,HA寡聚糖的收率越高,但是1 um微滤膜在微滤过程中有大量的菌体被滤出,因此优选0.4 um‒0.8 um的陶瓷膜。
实施例3微滤条件筛选
实施例2中0.5 um微滤膜HA寡聚糖的收率为61.3%,为进一步提高收率,改变滤出的微滤液的体积,如下:
将实施例1的含有透明质酸寡聚糖的发酵液直接用0.5 um微滤膜进行微滤,操作温度控制在30 ℃‒37 ℃,待滤出液接近初始发酵液体积一半时,加入与初始发酵液体积一半的纯化水继续微滤,多次重复加入纯化水,直到滤出3倍于初始发酵液体积的微滤液,微滤结束,检测HA寡聚糖收率。
进一步的,对微滤后的上清液依次进行热变性去除蛋白、超滤、活性炭脱色、精滤、喷雾干燥的处理,步骤如下:
热变性去除蛋白:将微滤上清液加热至95±5℃,恒温维持2分钟,冷却至室温;在冷却的微滤上清液中加入1%的珍珠岩和1%硅藻土作为助滤剂,搅拌混匀,过0.1‒0.2 um的滤纸板,除去大部分的变性蛋白质,获得过滤上清液;
超滤:将过滤上清液进行超滤,超滤过滤所用的膜材料是孔径为3 kDa的有机膜,操作温度控制在20 ℃‒25 ℃,超滤过程中多次加自来水,直至超滤截留液电导率 ≤ 3ms/cm,超滤实时透过液电导率 ≤ 300 us/cm,超滤结束;
活性炭脱色:将超滤截留液用盐酸调节pH=5.0‒5.5,加入0.5‒2%药用级活性炭60℃搅拌1‒2 h,冷却至室温后,加入1%的珍珠岩和1%硅藻土作为助滤剂,搅拌混匀,过0.1‒0.2 um的滤纸板,过滤上清液液用氢氧化钠溶液调pH=7.0‒7.5;
精滤:将pH调整后的过滤上清液经0.22 um的尼龙膜进行精过滤除菌和残留炭;
喷雾干燥:将含有透明质酸寡聚糖的精滤液进行喷雾干燥,设备操作条件:进样口温度170 ℃,出样口温度70 ℃‒75 ℃,最终获得透明质酸寡聚糖粉末。
为了验证微滤操作对透明质酸寡聚糖收率和纯度的影响,同时进行以下对照实验,步骤如下:
将实施例1的含有透明质酸寡聚糖的发酵液稀释一倍后于9000 rpm离心15 min,保持温度为20 ℃,离心进行固液分离,取上清液检测HA寡聚糖收率;
将上述离心上清液依次进行热变性去除蛋白、超滤、活性炭脱色、精滤、喷雾干燥的处理,得到透明质酸寡聚糖粉末,操作方式与上述一致。
从表2可以看出,微滤过程能够显著提高HA寡聚糖的收率,尽管离心固液分离也可以获得高收率,但是产品的纯度较低。
实施例4热变性去除蛋白条件筛选
为了提高HA纯度和降低蛋白质含量,对微滤上清液热变性去除蛋白质条件进行优化,实验组按照实施例3中的方法进行蛋白质去除,对照组按照下述步骤去除蛋白质:将微滤上清液先用浓NaOH溶液调pH到10‒10.5,后续热变性除蛋白、超滤、活性炭脱色、精滤、喷雾干燥操作步骤与实施例3一致。
从表3可以看出,微滤上清液直接加热可以提高透明质酸寡聚糖纯度和降低蛋白质含量。
实施例5超滤膜孔径筛选
取实施例3中过滤去除变性蛋白质的上清液,将其进行超滤,超滤所用的膜材料是孔径分别为2 kDa、3 kDa、5 kDa、8 kDa和10 kDa的有机膜,操作温度控制在20 ℃‒25 ℃。超滤过程中多次加水,加水总体积为初始上清液的5倍体积。超滤结束时,超滤截留液电导率均在2.7‒3 ms/cm,超滤实时滤过液电导率均在260‒300 us/cm。超滤所得截留液按照实施例3的方法依次进行活性炭脱色、精滤、喷雾干燥的处理,最终获得了透明质酸寡聚糖粉末。
从表4可以看出,超滤膜孔径越小,透明质酸寡聚糖的收率越高,但透明质酸寡聚糖纯度及分子量均有所降低,因此优选2 kDa‒5 kDa的有机膜。
实施例6活性炭脱色条件筛选
为了探究食品级和药用级活性炭对透明质酸寡聚糖纯度、蛋白质含量及白度的影响,进行以下操作:
将实施例5所得的超滤截留液用盐酸调节pH=5.0‒5.5,加入2%的药用级活性炭或1%的食品级活性炭,60 ℃搅拌1‒2 h,冷却至室温后,加入1%的珍珠岩和1%硅藻土作为助滤剂,搅拌混匀,过0.1‒0.2 um的滤纸板,过滤上清液用氢氧化钠溶液调pH=7.0‒7.5。将pH调整后的过滤上清液经0.22 um的尼龙膜进行精滤除菌和残留炭;将含有透明质酸寡聚糖的精滤液进行喷雾干燥,设备操作条件:进样口温度170 ℃,出样口温度70 ℃‒75 ℃,最终获得了透明质酸寡聚糖粉末。
从表5可以看出,2%的食品级活性炭可以提高透明质酸寡聚糖纯度及粉末的白度,但与1%药用级活性炭的效果相差不大,并且成本费用相等,因为考虑到后续活性炭的处理以及对环境的污染,优选药用级活性炭。
实施例7 各处理步骤的不同组合对结果的影响
按照以下顺序对透明质酸寡聚糖的发酵液进行处理:
微滤:将实施例1的含有透明质酸寡聚糖的发酵液直接用0.5 um微滤膜进行微滤,操作温度控制在35 ℃左右,待滤出液接近初始发酵液体积一半时,加入与初始发酵液体积一半的纯化水继续微滤,多次重复加入纯化水,直到滤出3倍于初始发酵液体积的微滤液,微滤结束;
热变性去除蛋白:将微滤上清液加热至95±5 ℃,恒温维持2分钟,冷却至室温;在冷却的微滤上清液中加入0.5%‒2%的珍珠岩和0.5%‒2%硅藻土作为助滤剂,搅拌混匀,过0.1‒0.2 um的滤纸板,除去大部分的变性蛋白质,获得过滤上清液;
超滤:将过滤上清液进行超滤,超滤过滤所用的膜材料是孔径为3 kDa的有机膜,操作温度控制在20 ℃‒25 ℃,超滤过程中多次加自来水,直至超滤截留液电导率 ≤ 3ms/cm,超滤实时透过液电导率 ≤ 300 us/cm,超滤结束;
活性炭脱色:将超滤截留液用盐酸调节pH=5.0‒5.5,加入0.5‒2%药用级活性炭60℃搅拌1‒2 h,冷却至室温后,加入0.5%‒2%的珍珠岩和0.5%‒2%硅藻土作为助滤剂,搅拌混匀,过0.1‒0.2 um的滤纸板,过滤上清液液用氢氧化钠溶液调pH=7.0‒7.5;
精滤:将pH调整后的过滤上清液经0.22 um的尼龙膜进行精过滤除菌和残留炭;
喷雾干燥:将含有透明质酸寡聚糖的精滤液进行喷雾干燥,设备操作条件:进样口温度170 ℃,出样口温度70 ℃‒75 ℃,最终获得透明质酸寡聚糖粉末。
为了验证步骤的先后顺序对结果的影响,同时进行以下对照实验:
对照1:按照微滤-热变性去除蛋白-活性炭脱色-超滤-精滤-喷雾干燥的步骤,各步骤操作方式与上述一致。
对照2:按照微滤-超滤-热变性去除蛋白-活性炭脱色-精滤-喷雾干燥的步骤,各步骤操作方式与上述一致。
对照3:按照微滤-热变性去除蛋白-超滤-精滤-喷雾干燥的步骤,各步骤操作方式与上述一致。
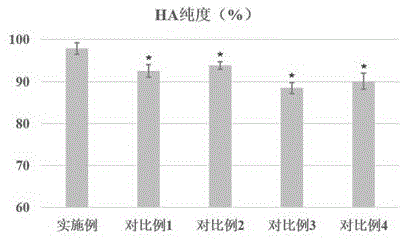
对照4:按照微滤-热变性去除蛋白-活性炭脱色-精滤-喷雾干燥的步骤,各步骤操作方式与上述一致。
从表6可以看出,本发明各步骤的组合顺序在产品的纯度、收率、白度、分散系数方面均有突出的优势,图3是各产品纯度的对比图,其中,对比例1(
- 一种膜层厚度均一性调整方法及其调整装置
- 一种黄原胶/壳聚糖纳米纤维膜的制备方法
- 一种包埋月桂精油和纳米银的脂质体/壳聚糖抗菌、抗氧化涂膜液及制备方法与应用
- 一种沸石珍珠岩粉凝胶壳聚糖树脂吸附剂及其制备方法和透明质酸的纯化和生产方法
- 含干细胞因子的明胶-透明质酸-壳聚糖电纺膜制备方法
