一种加快植物生长的miR172e、试剂盒及其应用与方法
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于植物基因工程领域,具体涉及一种加快植物生长的miR172e、试剂盒及其应用与方法。
背景技术
百合(Lilium)是百合科多年生草本球根植物,作为一种特色药食兼用的保健品和常用中药在我国广泛种植。百合花姿高雅纯洁,是世界著名六大切花之一,具有极高的观赏价值与药用价值。百合种质资源丰富,种类繁多,广泛分于亚洲、北美洲、欧洲等地区,根据不同的分类标准,百合的分类方法也多种多样,其中根据亲本来源不同可将百合分为:亚洲、东方、麝香、喇叭和新铁炮百合,分别表示为A(Asiatic)、O(Oriental)、L(Longiflorum)、T(Trumpet)和F(Formolongi),以及杂交类百合:LA杂种百合、OT杂种百合、OA杂种百合和LO杂种百合,共9类。
随着百合鲜切花市场需求量的不断增加,传统繁殖方式为我国新品种的选育以及产量品质均设置了障碍。百合幼年期过长,在自然条件下,扦插或组培繁育的百合小仔球叶片长势不明显,种球膨大缓慢,培养成商品种球需要3年及以上时间,增加了百合繁育的时间及成本。目前对于百合的研究大多集中在花色和花香方面,对于缩短其育种年限,调控期营养期相变的研究还相对较少。
因此,本领域亟需开发可以调控百合生长、缩短育种周期的全新的技术手段。
发明内容
基于本领域现有技术上的空白,本发明提供一种加快植物生长的miR172e、试剂盒及其应用与方法。
本发明的技术方案如下:
一种加快植物生长的miR172e,其特征在于,与所述miR172e的前体互补的DNA序列如SEQ ID NO.2所示。
一种加快植物生长的试剂盒,其特征在于,包括:过表达如SEQ ID NO.2所示的DNA序列的引物。
所述如SEQ ID NO.2所示的DNA序列的引物如SEQ ID NO.9和SEQ ID NO.10所示;
优选地,如SEQ ID NO.2所示的DNA序列与miR172e的前体互补。
所述的一种加快植物生长的试剂盒还包括:转基因实验的常用试剂。
所述转基因实验的常用试剂选自:PCR试剂、真核转基因表达载体、感受态细胞、瞬时转化试剂;
优选地,PCR试剂选自:PCR缓冲液、dNTP、DNA聚合酶、水;
优选地,真核转基因表达载体选自pNC-Cam3304-MCS35S;
优选地,感受态细胞选自农杆菌感受态细胞;
优选地,所述农杆菌选自农杆菌GV3101;
优选地,瞬时转化试剂选自:MES、MgCl
优选地,所述加快植物生长指:缩短植物营养生长时间;
优选地,所述植物为拟南芥。
miR172e在加快植物生长方面的应用,其特征在于,与所述miR172e的前体互补的DNA序列如SEQ ID NO.2所示。
在植物体内过表达miR172e;
优选地,所述调控指:在植物体内过表达miR172e加快植物生长;
优选地,在植物体内过表达miR172e抑制植物体内AP2基因的表达进而加快植物生长;
优选地,所述加快植物生长指:缩短植物营养生长时间;
优选地,所述植物为拟南芥。
一种加快植物生长的方法,其特征在于,在植物体内过表达miR172e来加快植物生长;与所述miR172e的前体互补的DNA序列如SEQ ID NO.2所示。
在植物体内过表达miR172e抑制AP2基因的表达,进而加快植物生长。
所述过表达miR172e指:将序列如SEQ ID NO.2所示的miR172e连接表达载体pNC-Cam3304-MCS35S获得的重组过表达质粒pCAMBIA3304-pre-miR172e转化感受态细胞后再转染植物;
优选地,所述miR172e连接表达载体的引物序列如SEQ ID NO.9和SEQ ID NO.10所示;
优选地,所述感受态细胞指农杆菌GV3101;
优选地,所述加快植物生长指:缩短植物营养生长时间;
优选地,所述植物指拟南芥。
本发明首次提出一种可加快植物生长的miR172e,其具有SEQ ID No.2所示的核苷酸序列,并建立了该miR172e与植物生长速度方面的关联,并揭示了序列如SEQ ID No.2所示的miR172e对AP2基因的抑制表达或沉默表达作用。本发明通过相关试验正是过表达具有如SEQ ID No.2所示序列的miR172e可加快植物生长,而通过过表达miR172e的方式抑制表达AP2基因可有效加快植物生长(使植株的远轴叶背毛和抽薹均提前出现)。
本发明提供的miR172e以及基于该基因的试剂盒、应用、调控方法对调控植物生长具有重要应用价值。
附图说明
图1为本发明实验例1中AP2和miR172e加酶切位点后PCR扩增结果电泳图。
图2为本发明实验例1中pCAMBIA3304-AP2和pCAMBIA3304-pre-miR172e重组质粒双酶切验证。
图3为本发明实验例2中烟草叶片进行GUS组织染色后的GUS信号图。
图4为本发明实验例2中以转入pCAMBIA3304-AP2和pCAMBIA3304-pre-miR172e的农杆菌为模板的PCR电泳图和RLM-5’RACE测序结果。
图5为本发明实验例3中AP2和miR172e加酶切位点后PCR扩增结果电泳图。
图6为本发明实验例3中以T1代转基因拟南芥DNA扩增目的片段AP2和miR172e的电泳图。
图7为本发明实验例4中AP2或miR172e侵染野生型和突变型拟南芥后的过表达植株与野生型和突变型的表达量对比图。左上图和左下图的纵坐标为miR172e的相对表达量;右上图和右下图的纵坐标为AP2的相对表达量。
图8为本发明实验例4中AP2或miR172e侵染野生型和突变型拟南芥后的过表达植株与野生型和突变型的表型观察。
具体实施方式
下面结合具体实施例和实验例对本发明的详细内容做进一步具体描述,但并不以此限制本发明的保护范围。
生物材料的来源
本发明实验例1使用的百合杂交品种‘Robina’是公知公用的百合品种,可商购获得。
本发明实验例1使用的本氏烟草也是广泛使用的商业烟草品种,可商购获得。
本发明实验例1使用的大肠杆菌感受态细胞可商购获得。
本发明实验例4使用的mir172e突变型拟南芥和AP2突变型拟南芥的种子均购于AraShare官网;AP2突变型拟南芥的AP2基因存在T-DNA插入突变,mir172e突变型拟南芥的mir172e存在基因沉默突变。
第1组实施例、本发明的miR172e
本组实施例提供一种加快植物生长的miR172e。
本组所有的实施例都具备如下共同特征:与所述miR172e前体互补的DNA序列如SEQ ID NO.2所示。
本领域技术人员根据本发明的内容和教导,可以将如SEQ ID NO.2所示的DNA序列或miR172e用于任何一种植物生长的调控。任何扩增、人工合成、使用、销售、许诺销售、生产、制备如SEQ ID NO.2所示的DNA序列或miR172e的行为,或,任何将SEQ ID NO.2所示的DNA序列或miR172e用于制备调控植物生长用途的制品的行为,或,任何将SEQ ID NO.2所示的DNA序列或miR172e用于任何一种植物的生长调控的行为,或,任何将SEQ ID NO.2所示的DNA序列或miR172e用于调控AP2基因表达的行为均落入本发明的保护范围。
在具体的实施例中,所述加快植物生长指:缩短植物营养生长时间;所述植物选自:拟南芥。
本领域技术人员可以根据本发明的内容和教导,将如SEQ ID NO.2所示的DNA序列或miR172e用于除拟南芥以外的其他植物,例如,包括但不限于:百合的生长调控,具体为:在百合体内过表达SEQ ID NO.2所示的DNA序列或miR172e缩短百合的营养生长的时间使其提前进入生殖生长、提前开花。
第2组实施例、本发明的试剂盒
本组实施例提供一种加快植物生长的试剂盒。本组所有的实施例都具备如下共同特征:所述试剂盒包括:过表达如SEQ ID NO.2所示的DNA序列的引物。
在一些实施例中,所述过表达如SEQ ID NO.2所示的DNA序列的引物如SEQ IDNO.9和SEQ ID NO.10所示。
优选地,如SEQ ID NO.2所示的DNA序列与miR172e前体互补。
在进一步的实施例中,所述的一种加快植物生长的试剂盒还包括:转基因实验的常用试剂。
在另一些实施例中,所述转基因实验的常用试剂选自:PCR试剂、真核转基因表达载体、感受态细胞、瞬时转化试剂;
优选地,PCR试剂选自:PCR缓冲液、dNTP、DNA聚合酶、水;
优选地,真核转基因表达载体选自pNC-Cam3304-MCS35S;
优选地,感受态细胞选自农杆菌感受态细胞;
优选地,所述农杆菌选自农杆菌GV3101;
优选地,瞬时转化试剂选自:MES、MgCl
优选地,所述加快植物生长指:缩短植物营养生长时间;
优选地,所述植物选自:拟南芥。
第3组实施例、本发明miR172e的应用
本组实施例提供miR172e在加快植物生长方面的应用。本组所有的实施例都具备如下共同特征:如SEQ ID NO.2所示的DNA序列与miR172e的前体互补。
在一些实施例中,在植物体内过表达miR172e;
优选地,所述调控指:在植物体内过表达miR172e加快植物生长;
优选地,在植物体内过表达miR172e抑制植物体内AP2基因的表达进而加快植物生长;
优选地,所述加快植物生长指:缩短植物营养生长时间;
优选地,所述植物选自:拟南芥。
第4组实施例、本发明的加快植物生长的方法
本组实施例提供一种加快植物生长的方法。本组所有的实施例都具备如下共同特征:在植物体内过表达miR172e来加快植物生长;如SEQ ID NO.2所示的DNA序列与miR172e的前体互补。
在一些实施例中,在植物体内过表达miR172e抑制AP2基因的表达,进而加快植物生长。
在另一些实施例中,所述过表达miR172e指:将序列如SEQ ID NO.2所示的miR172e连接表达载体pNC-Cam3304-MCS35S获得的重组过表达质粒pCAMBIA3304-pre-miR172e转化感受态细胞后再转染植物;
优选地,所述miR172e连接表达载体的引物序列如SEQ ID NO.9和SEQ ID NO.10所示;
优选地,所述感受态细胞指农杆菌GV3101;
优选地,所述加快植物生长指:缩短植物营养生长时间;
优选地,所述植物选自:拟南芥。
下面结合实验例对本发明的技术效果做进一步阐释。下述实验例中使用的材料和试剂列示如下:
1、植物材料
(1)本试验选用OT(Oriental×Trumpet)百合杂交品种‘Robina’为材料。剥取完整健康,无病虫害的‘Robina’百合仔球外鳞片,排列扦插于草炭为基质的纸箱中,在恒温培养箱中培养。处理组(BC15T):25℃常规培养12周,15℃变温处理4周,4℃低温下培养10周。对照组(BC25T):25℃常规培养16周,4℃低温下培养10周。培养后选取长势饱满的小仔球,用去离子水冲洗干净后剥取小仔球的芽心,用锡箔纸包好-80℃冰箱保存。
(2)将本氏烟草种子种植于草炭蛭石混合的穴盘中,控制湿度,置于光照黑暗交替培养箱中培养,生长5-6周即可用于试验。
2、主要试剂
(1)1.0%琼脂糖凝胶。用分析天平称取1g琼脂糖粉末溶于100mL TAE缓冲液,玻璃棒充分搅拌,加热沸腾至溶解完全。将溶液温度降至60℃左右插入温度计观察,拿出温度计并小心加入10μL的核酸染料,充分混匀后倒入胶板中直至冷却,凝固后取出胶块放至4℃保存。
(2)LB培养基。液体:用分析天平称取0.5g酵母提取物、1g胰蛋白胨粉末和1gNaCl粉末,量筒量取100mL去离子水,将固体粉末溶于去离子水中,玻璃棒充分搅拌使其溶解,盖好封口膜,高压蒸汽灭菌锅121℃,101KPa,灭菌30min。盖好封口膜4℃保存。固体:在加入固体粉末的基础上再加入1.5g琼脂粉末,灭菌锅灭菌后,在超净工作台中冷却至60℃左右,加入抗生素Amp/Kan(1000:1),混匀后立即倒入灭好菌的培养皿中,冷却凝固后盖上盖子、用封口膜封口,放至4℃保存。
(3)YEB培养基。固体:在加100mL去离子水中加入1.65g YEB粉末,1.2g琼脂粉末,高压蒸汽灭菌锅121℃,101KPa,灭菌30min,取出后于自然冷却至60℃,加入100μL Kan(50mg/mL)和100μL Rif(30mg/mL),混匀后立即倒入灭好菌的培养皿中,冷却凝固后盖上盖子、用封口膜封口,放至4℃保存。液体:培养基中不加琼脂,灭菌冷却放至4℃保存。
(4)GUS染液配制。使用GUSBlue KIT试剂盒配制GUS染液:将1mL溶解液A和B溶液混合,使用移液枪吹打20次混匀,直至混合液澄清。再将AB混合液以1:50的体积加入缓冲液C当中,现用现配,GUS染色液配制完成。保存于-80℃备用。
实验例1、百合pre-miR172e及其靶基因AP2的克隆和超表达载体的构建
1、AP2的克隆
(1)百合芽心RNA的提取
使用爱博森多糖多酚RNA快速提取试剂盒进行百合芽心的RNA提取。材料来自北京农学院902实验室扦插的百合仔球,仔细拨开仔球鳞片,取出百合芽心用锡纸包裹后迅速放入液氮中,保存于-80℃备用。具体操作步骤试剂盒参照说明书。
(2)cDNA第一链的合成
选用TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix反转录试剂盒(北京全式金生物),见表1,合成cDNA第一链。
表1
将混合液轻轻混匀,瞬时离心,在PCR仪中42℃孵育30min,将得到的cDNA稀释2倍,保存于-20℃备用。
(3)引物设计
使用Primer3.0在线软件设计了AP2的引物(北京六合华大基因公司),引物序列如下(见表2):
表2
(4)PCR扩增反应
表3
AP2-PCR扩增的反应条件:94℃5min;94℃40s,56.5℃30s,72℃1.5min,设置35个循环;72℃延伸10min,4℃保温,-20℃备用。
(5)切胶回收
选用
(6)pTOPO-T Vector载体的连接与转化
①在PCR管中按照表中体系(表4)配置连接液。
表4
/>
②用移液枪轻轻混匀连接液,室温连接5min。
③将100μL大肠杆菌感受态细胞置于冰上融化为冰水混合物状态。
④无菌条件下将连接液加入到100μL感受态细胞中轻轻敲打管底混匀,室温静置5min。
⑤无菌条件下在混合液中加入600μL LB液体培养基,在37℃恒温振荡培养箱中180rpm震荡培养30min。
⑥取200μL菌液涂布于含Amp抗生素的LB固体培养基上,37℃倒置培养12h-14h。
(7)转化子鉴定
用10μL枪头挑取合理大小的阳性单菌落,接于含有10μL dd H2O的2mL离心管中,吹打混匀,取1μL进行菌落PCR鉴定,体系如表5所示。
表5
AP2-PCR扩增的反应条件:94℃5min;94℃40s,56.5℃30s,72℃1.5min,设置35个循环;72℃延伸10min,4℃保温,-20℃备用。
将剩余的9μL菌液加入含有1.5mL LB液体培养基的离心管中,再加入1.5μL Amp,置于摇床中37℃180rpm震荡培养6h。将菌落PCR产物跑胶后成像,选取成像结果正确的菌液,吸取150μL进行测序(北京六合华大生物公司)。对测序结果正确的菌液进行保菌,在冻融管中加入200μL甘油(60%)和600μL菌液,混合均匀保存于-80℃备用。
2、百合miR172e前体基因的克隆
(1)百合叶片DNA的提取
使用爱博森DNA提取试剂盒进行百合叶片的DNA提取。材料取自北京农学院东大地种植的百合‘Robina’开花前的幼嫩叶片,取材后迅速将叶片用锡纸包裹放入液氮中,保存于-80℃备用。具体操作步骤试剂盒参照说明书。
(2)引物设计
使用Primer3.0在线软件设计了AP2的引物(北京六合华大基因公司),引物序列如表6:
表6
/>
(3)PCR扩增反应
表7
miR172e-PCR扩增的反应条件:94℃5min;94℃40s,56.5℃30s,72℃30s,设置35个循环;72℃延伸10min,4℃保温,-20℃备用。
(4)切胶回收
参考上述1中的(5)。
(5)pTOPO-T Vector载体的连接与转化
参考上述1中的(6)。
(6)转化子鉴定
参考上述1中的(7)。
3、超表达载体的构建
(1)提取质粒
选择测序结果正确的留存1mL菌液,加入至含有6mL(含Amp)LB液体培养基的10mL离心管中,37℃180rpm过夜培养后用于提取质粒,质粒提取试剂盒购自全式金生物技术有限公司,具体操作按照试剂盒中说明书进行,提取的质粒保存于-20℃备用。
(2)载体酶切
表8
轻轻混匀避免吹打后瞬时离心,PCR仪中50℃孵育1h。
(3)引物设计
在目的基因引物序列5’端添加20bp的同源臂序列,之后进行无缝克隆,引物序列如表9:
表9
(4)PCR扩增反应
以华大公司返回的含T载体的质粒作为PCR模板,具体扩增条件和体系AP2参考上述1中的(4),
pre-miR172e参考上述2中的(3)。
(5)切胶回收
参考上述1中的(5)。
(6)pNC-Cam3304-MCS35S载体的连接
表10
移液枪吹打混匀15-20次,瞬时离心,在PCR仪中50℃连接30min。
(7)转化大肠杆菌
①将100μL大肠杆菌感受态细胞置于冰上融化为冰水混合物状态。
②无菌条件下将连接液加入到100μL感受态细胞中轻轻敲打管底混匀,室温静置5min。
③在混合液中加入600μL LB液体培养基,在37℃恒温振荡培养箱中180rpm震荡培养30min。
④取200μL菌液涂布于含Kan抗生素的LB固体培养基上,37℃倒置培养12h-14h。
(8)转化子鉴定
参考上述1中的步骤(7)。将试验中所需的Amp替换为Kan。
4、AP2和pre-miR172e片段克隆结果和超表达载体构建结果
通过1%琼脂糖凝胶电泳检测,发现AP2的PCR扩增产物在1000bp和2000bp之间靠近1000bp的地方有一条清晰条带(图1),pre-miR172e的PCR扩增产物在300bp附近有一条清晰条带(图1),分别切胶回收后连接转化到TA克隆载体上进行测序,使用DNAMAN软件进行序列比对,发现结果分别与实验例1中百合转录组数据库预测的1245bp的AP2基因片段和300bp的pre-miR172e片段序列一致,表明AP2基因和pre-miR172e克隆成功。分别利用无缝克隆引物对测序结果正确的重组质粒进行PCR验证(图2),目的条带位置正确,说明pCAMBIA3304-AP2和pCAMBIA3304-pre-miR172e超表达载体构建成功。
实验例2、百合pre-miR172e及其靶基因AP2的鉴定
1、GUS组织化学染色
(1)提取质粒
选择上述3中步骤(8)测序结果正确的留存1mL菌液,加入至含有6mL(含Kan)LB液体培养基的10mL离心管中,37℃180rpm过夜培养后用于提取质粒,质粒提取试剂盒购自全式金生物技术有限公司,具体操作按照试剂盒中说明书进行,提取的质粒保存于-20℃备用。
(2)转化农杆菌
①取-80℃保存的GV3101农杆菌感受态细胞于冰上融化至冰水混合状态。
②向刚好化冻的感受态细胞悬液中加入1μg需要转化的质粒DNA,轻轻混匀,冰上静置5min。
③将离心管置于液氮中速冻5min。
④快速将离心管迅速置于37℃水浴中5min。
⑤将离心管放回冰浴中5min。
⑥无菌条件下加入600μl无抗生素的YEB液体培养基,于28℃摇床180rp震荡培养1.5小时。
⑦吸取200μl菌液加到含Amp和Kan抗生素的YEB固体培养基平板上,用无菌的细菌涂布器将细胞均匀涂开。等平板中的液体完全吸收后,倒置平板,28℃培养2天。
(3)转化子鉴定
①参考上述1中的步骤(7)进行转化子鉴定,向剩余9μL菌液中加入1.5mL含有三抗的液体YEB培养基,28℃180rpm振荡培养1-2天。
②PCR结果用1%琼脂糖凝胶电泳检测条带位置是否正确。
③吸取200μL 60%的无菌甘油溶液于1.5mL灭菌冻融管中,加入600μL菌液,混匀后于-80℃冰箱保存备用。
④利用冻融法分别将pCAMBIA3304-AP2和pCAMBIA3304-pre-miR172e转入农杆菌GV3101,进行菌液PCR,扩增目的片段,电泳检测结果显示条带单一明亮,位置准确(图3),说明两个重组质粒均成功转入农杆菌,可以进行后续试验。
(4)烟草瞬时转化
①母液配置
表11
将配置好的母液高压灭菌后保存于-20℃备用。
②将10μL的乙酰丁香酮溶液加入到配置好的母液中,放在冰上保存备用。
③将隔夜培养好的农杆菌5000rpm离心10min,收集菌体,用配置好的溶液稀释菌体,使菌液浓度OD600:0.8-1.0,避光孵育3h。
④挑选长势良好,5-6周的烟草叶片,用无菌无针头的注射器缓慢侵染烟草叶片背面。
⑤将侵染后的烟草先避光培养24h,再正常培养48-72h。
(5)GUS组织染色
根据GUS染色试剂盒(北京华越洋生物公司)配置工作液。收集烟草叶片,在GUS染液中浸泡15min并进行真空渗透,直到染液完全渗透到叶片组织中。真空渗透后,在新配制的染液中37℃恒温黑暗渗透18小时,然后用70%的乙醇对其进行脱色。每隔12小时更换一次乙醇溶液,直到叶子完全脱色,最后可用肉眼观察到叶片颜色的变化。
2、miR172e和靶基因AP2剪切位点的鉴定
(1)百合芽心RNA的提取
参考上述1中的(1)。
(2)引物设计
根据miR172e靶基因AP2的序列,利用Primer5.0设计基因的特异性引物(见表12)
表12
(3)5’RACE接头连接
表13
将混合液轻轻混匀,在PCR仪中37℃孵育1h。
(3)cDNA第一链的合成
表14
/>
将混合液轻轻混匀,在PCR仪中42℃孵育1h。
(4)Outer 5'RLM-RACE PCR反应
表15
将Outer 5'RLM-RACE PCR反应产物稀释十倍用于Inner 5'RLM-RACE PCR。
(5)Inner 5'RLM-RACE PCR反应
表16
(7)切胶回收
参考上述1中的(5)。
(8)pTOPO-T Vector载体的连接与转化
参考上述1中的(6)。
(9)转化子的鉴定
参考上述1中的(7)。
3、百合pre-miR172e及其靶基因AP2的鉴定结果
GUS组织化学染色结果表明,当AP2 GUS和空载体3304GUS分别注射的烟草叶片颜色较蓝,GUS信号显著增加,而miR172e GUS和AP2 GUS共同注射的位置蓝色不明显(图3),GUS信号显著减少,表明miR172e可以剪切烟叶中的AP2转录本,两者具有互作功能。RLM-5’RACE测序结果显示,miR172e对AP2 mRNA的靶基因酶切位点位于miR172e互补序列3’端第9-10个核苷酸处(图4)。
实验例3、转基因拟南芥的构建
1、拟南芥的种植培养
(1)取出4℃保存的干燥拟南芥种子适量,均匀撒在湿润滤纸的培养基上,盖上盖子4℃避光春化三天。
(2)将草炭和蛭石加去离子水以3∶1混合均匀后,放入高压灭菌锅灭菌,灭菌结束后放凉备用。
(3)将灭好的培养基质分别放入花盆中,每盆播种四粒纯化后的拟南芥种子,在托盘中浇足水,盖上透明罩放入培养箱中光照黑暗交替培养。
(4)拟南芥长出四片真叶时揭盖,定期浇水观察植株生长情况,用于后续实验。
2、转化农杆菌
(1)取-80℃保存的GV3101农杆菌感受态细胞于冰上融化至冰水混合状态。
(2)向刚好化冻的感受态细胞悬液中加入1μg需要转化的质粒DNA,轻轻混匀,冰上静置5min。
(3)将离心管置于液氮中速冻5min。
(4)快速将离心管迅速置于37℃水浴中5min。
(5)将离心管放回冰浴中5min。
(6)无菌条件下加入600μl无抗生素的YEB液体培养基,于28℃摇床180rp震荡培养1.5小时。
(7)吸取200μl菌液加到含Amp和Kan抗生素的YEB固体培养基平板上,用无菌的细菌涂布器将细胞均匀涂开。等平板中的液体完全吸收后,倒置平板,28℃培养2天。
3、转化子的鉴定
参考上述1中的(7)。然后扩增目的片段,电泳检测结果显示条带单一明亮,位置准确(图5),说明两个重组质粒均成功转入农杆菌,可以进行后续试验。
4、侵染模式植物拟南芥
(1)侵染前一天,将测序结果正确的农杆菌进行扩繁培养,置于28℃180rpm恒温摇床中过夜培养。将拟南芥浇透水备用
(2)将扩繁后的菌液转移至若干50ml离心管中,5000rmp离心10min,弃上清收集菌体。
(3)配置5%的蔗糖溶液灭菌冷却至室温,每管菌体中加入20ml的蔗糖溶液,涡旋混匀,5000rmp离心10min,重复三次。然后再加入20ml蔗糖溶液重悬菌体,全部倒入一个烧杯中,用蔗糖溶液改变其OD
(4)侵染前将拟南芥的全部果荚剪去,将花序全部浸没在侵染液中1min左右,待所有花序都浸透侵染液后,避光培养24h,侵染结束。
(5)避光培养24h后,将拟南芥移至光照培养箱进行光照黑暗交替培养,后续两周每周再进行一次侵染,三次侵染结束后,定期浇水观察其生长情况,直到拟南芥成熟后收种子。
5、转基因拟南芥阳性苗的筛选
(1)取适量收集的拟南芥种子于2ml离心管中,在超净工作台中进行洗种子。首先加入1ml无菌水晃动洗涤5min,静置后小心将水吸出,再加入1ml 75%的乙醇,晃动洗涤5min,静置后小心将其吸出,再加入1ml 8%的次氯酸钠,晃动洗涤10min,静置后小心将其吸出,最后加入无菌水1mL晃动洗涤2min,重复5次。
(2)将洗好的种子均匀散播在含有除草剂的1/2MS培养基中,尽量使每个种子都分开培养,盖上盖子封口膜封口,放在4℃避光春化3天。
(3)将春化后的培养基移至光照黑暗交替培养基,培养12天左右,拟南芥长出四片小真叶后,用镊子小心夹取一株移栽至含基质的花盆中,在托盘中浇足水,盖上透明罩保湿,待一周后植株生长后揭盖,后期注意浇水养护观察,直到植株成熟收种子。
6、转基因拟南芥阳T1代阳性苗的鉴定
(1)拟南芥叶片的DNA提取
参考实验例1的2中的步骤(2)。
(2)PCR的扩增
以提取的拟南芥DNA为模板,进行PCR扩增,反应体系同实验例1的1中的步骤(4)与实验例1的2中的步骤(3)。电泳检测PCR产物条带的正确性,从而鉴定转基因成功。
7、转基因拟南芥的构建结果
同时提取T1代转基因拟南芥与野生型拟南芥DNA,分别以AP2和pre-miR172e上游下游引物进行PCR扩增,电泳结果中对照组以野生型拟南芥DNA为模板未扩增出条带,而以T1代转基因拟南芥DNA为模板扩增的目的条带,条带单一且明亮、位置正确(图6)说明pCAMBIA3304-AP2和pCAMBIA3304-pre-miR172e均被成功转至模式植物拟南芥中。
实验例4、转基因拟南芥表达模式验证和表型分析
1、RNA提取
参照实验例1的1的步骤(1)。
2、荧光定量cDNA第一链的合成
(1)AP2荧光定量cDNA第一链合成方法如下:
利用购自北京全式金生物科技有限公司的反转录试剂盒进行荧光定量cDNA的合成:
表17
将其轻轻混匀,在PCR仪中42℃孵育15min,85℃加热5s,并将其稀释2倍,保存于-20℃备用。
(2)miR172e荧光定量cDNA第一链的合成
表18
将其轻轻混匀,在PCR仪中37℃孵育1h,85℃加热5s,并将其稀释2倍,保存于-20℃备用。
3、引物设计
(1)miR172e的上游引物序列为自身的成熟序列,下游引物序列为全式金反转录试剂盒中的Universal miRNA qPCR primer,内参为拟南芥U4序列,由北京华大公司合成引物,引物序列如下(见表19):
表19
(2)AP2的荧光引物通过Primer5.0软件设计,由北京华大公司合成引物,引物序列如下(见表20):
表20
3、荧光定量PCR扩增
(1)将八连拍置于冰上,避光加入下列反应液轻轻混匀,每个样品3个生物学重复3个技术重复
表21
/>
qRT-PCR反应程序:95℃2min;95℃15s,60℃15s,72℃20s,39个循环。
4、T2代拟南芥的表型观察
观察T2代拟南芥的抽薹和远轴叶背毛出现的时间,记录植株抽薹时莲座叶的数量和真叶的生长顺序,并观察叶片生长过程中远轴叶背毛是否产生,将野生型、过表达型;突变型、过表达型进行共同拍照,记录拟南芥的表型并进行比较。
5、转基因拟南芥表达模式验证结果及表型观察
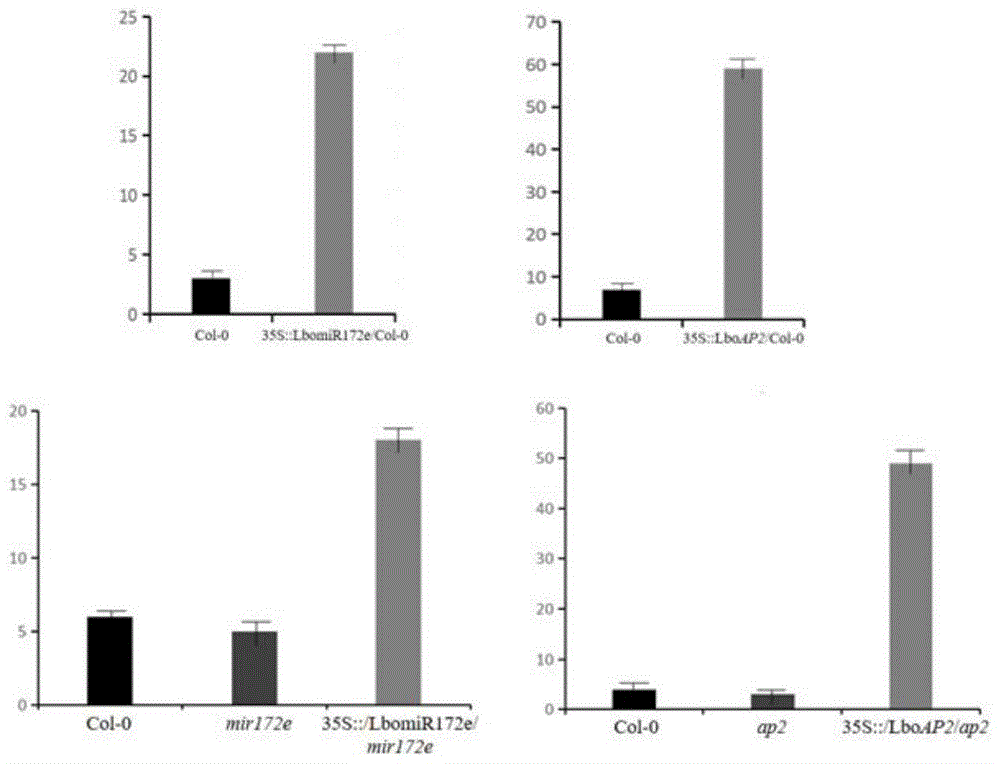
提取T2代转基因拟南芥与野生型拟南芥RNA,反转录后进行转基因植株表达模式验证,发现miR172e和AP2侵染野生型和突变型拟南芥后的过表达植株(35S::LbomiR172e/Col-0;35S::/LbomiR172e/mir172e;35S::LboAP2/Col-0;35S::/LboAP2/AP2)与野生型(Col-0)和突变型(mir172e;AP2)相比表达量增高(图7),证明转基因成功;通过对拟南芥的表型观察可发现miR172e转基因植株的远轴叶背毛比野生型和突变型提前出现(图中箭头标注位置即为叶背毛开始出现的叶片位置),并提前抽薹(图8),而AP2却相反,说明过表达miR172e加快了拟南芥的生长,能够使其提前发生相变,而AP2作为它的负调控因子则延迟了拟南芥的生长。
- 一种提取水培植物基因组DNA的试剂盒及提取方法
- 一种食源性植物过敏原成分的检测试剂盒和方法
- 一种肿瘤特异性生长因子检测试剂盒及其使用方法
- 一种植物亚细胞定位试剂盒及其应用
- 一种含铜纳米棒复合物快速检测试剂盒的制备方法及应用
- 一种调控植物生长的AP2基因、试剂盒及其应用与方法
- 通过改变激酶和磷酸酶的表达水平加快植物生长并提高产量的方法
