一种高效联产D-阿洛酮糖和葡萄糖酸的方法
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于合成生物技术领域,具体涉及一种高效联产D-阿洛酮糖和葡萄糖酸的方法。
背景技术
D-阿洛酮糖是D-果糖的C-3差向异构体,在小麦中以游离糖的形式存在。D-阿洛酮糖除具有低能量、改善肠道菌群、抗龋齿等生理功能外,还在抑制血糖升高与体脂积累、清除自由基、神经保护等诸多方面发挥着重要生理作用。D-阿洛酮糖甜度可达到蔗糖的70%,能量只有蔗糖的0.3%,是一种新型甜味剂,尤其适用于糖尿病及肥胖症人群,它可被小肠吸收,通过尿液排出体外。
D-阿洛酮糖3-差向异构酶(DPEase)可以催化D-果糖合成D-阿洛酮糖。不同来源的DPEase在大肠杆菌中异源表达时,D-果糖至D-阿洛酮糖的平衡转化率可以达到20-30%。然而,该转化率并不高,导致大量的底物D-果糖大量积累。近年来,有研究者将底物D-果糖替换为易得、低价的D-葡萄糖,由葡萄糖异构酶与D-阿洛酮糖-3-差向异构酶共表达合成D-阿洛酮糖。然而酶与酶之间存在空间距离,而上一个酶的产物是下一个酶的底物,导致物质转化率更低。双酶体系表达中,D-葡萄糖合成D-阿洛酮糖的平衡转化率在12%-16%之间,底物和中间底物积累严重。
基于酶转化法利用D-果糖生产蒜糖醇与蒜糖醇生产D-阿洛酮糖都的需要向反应体系中添加昂贵的辅酶NAD(H)。在宿主内构建多酶表达系统,结合融合蛋白策略,以及发酵条件优化、全细胞催化条件等措施可以以提高蒜糖醇的生产效率,但是以廉价单糖为底物利用胞内级联反应催化生产蒜糖醇的过程存在明显的低效性,且催化终点处有中间产物积累。催化体系效率偏低除受限于多酶体系中各酶性质的较大差异外,蒜糖醇合成过程中辅因子的持续性需求及NAD
发明内容
针对现有技术存在的不足,本发明提供了一种高效联产D-阿洛酮糖和葡萄糖酸的方法,利用该方法可以提高D-阿洛酮糖的产率以及同时合成葡萄糖酸。
为解决上述技术问题,本发明采用如下技术方案:
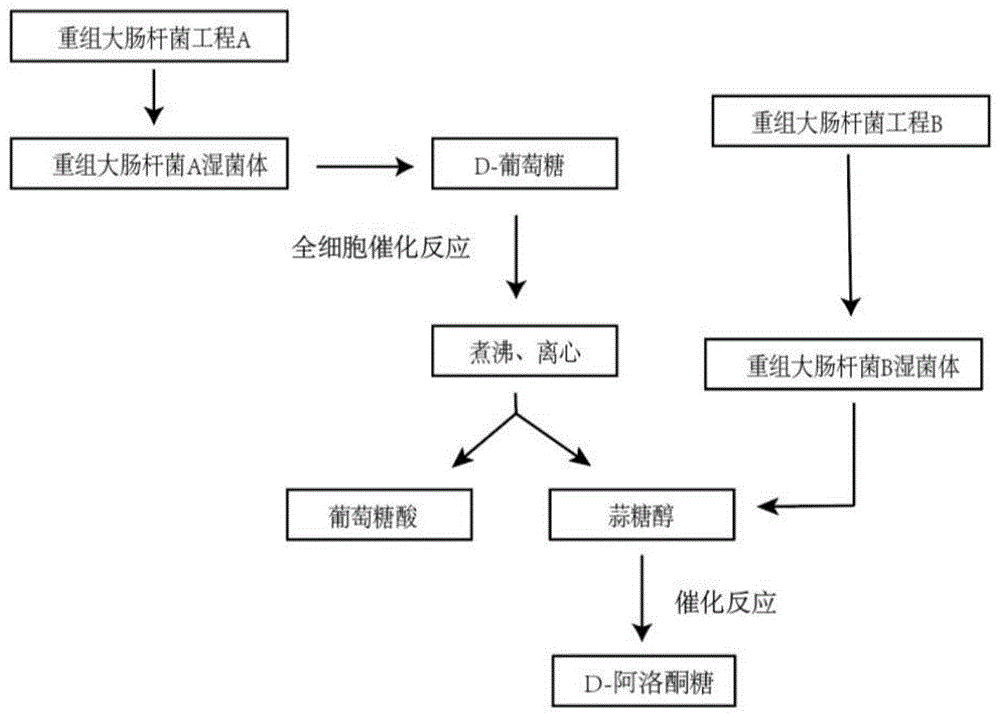
本发明所述的一种高效联产D-阿洛酮糖和葡萄糖酸的方法,以D-葡萄糖为原料,加入重组大肠杆菌A湿菌体,进行全细胞催化反应后,反应完成后灭菌,灭菌离心获得葡萄糖酸;上清液加入重组大肠杆菌B进行催化反应,制得D-阿洛酮糖;所述重组大肠杆菌A湿菌体同时表达Bacillus sp.的葡萄糖异构酶gi基因、Clostridium bolteae ATCCBAA-613的D-阿洛酮糖-3-差向异构酶dpe基因、Providencia alcalifaciens的rdh基因、枯草WB800的葡萄糖脱氢酶GDH基因以及过表达大肠杆菌中的NAPRTase和NAD+Syn的编码基因pncB和nadE;所述重组大肠杆菌B同时表达Rubrivivax sp.的糖醇脱氢酶SDH基因、Streptococcuspyogenes的NADH氧化酶NOX基因。
所述重组大肠杆菌A按以下方法构建:将来源于Bacillus sp.的葡萄糖异构酶基因gi以及来源于Clostridium bolteae ATCCBAA-613的D-阿洛酮糖-3-差向异构酶基因dpe连接在pRSFDuet-1上,得到重组质粒pRSFDuet-gi-dpe;将来源于Providenciaalcalifaciens的rdh基因片段以及来源于枯草WB800的GDH基因片段其连接在pETDuet-1表达载体得到质粒pETDuet-gdh-rdh;再将重组质粒pRSFDuet-gi-dpe和重组质粒pETDuet-gdh-rdh转化至大肠杆菌E.coli BL21(DE3)中,得到重组大肠杆菌Ec/pRgd-pEgr;在重组大肠杆菌Ec/pRgd-pEgr的基础上,过表达大肠杆菌中的NAPRTase和NAD
所述重组大肠杆菌A湿菌体按以下操作进行制备:将重组大肠杆菌A接种到LB培养基中培养,采用诱导剂IPTG在20℃条件下诱导24h,收集得到湿菌体。
所述的将重组大肠杆菌A接种到LB培养基中培养的接种量为:5ml菌液/50mlLB培养基。
所述的LB培养基按以下组分制备:5g/L酵母提取物、10g/L蛋白胨、10g/L氯化钠,并且pH为7.0。
所述重组大肠杆菌B按以下方法构建:将来源于Rubrivivax sp.的糖醇脱氢酶基因sdh以及来源于Streptococcus pyogenes的NADH氧化酶基因nox连接在pRSFDuet-1上,得到重组质粒pRSFDuet-sdh-nox。
所述全细胞催化反应条件为,底物浓度为20~50g/L,反应温度为30-50℃,反应时间12-18h,pH是7-8.5,Co
重组大肠杆菌B催化反应条件为pH=7,添加0.2mM NAD+。
本发明的有益效果如下:
本发明在重组大肠杆菌构建时创新性的以葡萄糖脱氢酶(GDH)与核糖醇脱氢酶(RDH)偶联构建辅酶循环系统以提高细胞生产过程中所需的NADH的再生效率,同时,结合引入nadE和pncB构建NAD+补偿途径,将烟酸转化为NAD+,胞内NAD(H)含量提高了120.3%。通过催化过程优化,蒜糖醇产量达到16.72g/L,蒜糖醇转化为D-阿洛酮糖产率15.07g/L。
本发明以D-葡萄糖为底物进行转化,D-葡萄糖作为自然界中一种成本低廉、易获得的单糖,相对于常规合成D-阿洛酮糖所用的果糖,能有效降低制备成本。
附图说明
图1为本发明的工艺流程图;
图2为本发明的反应流程图;
图3为对实施例1条件下D-阿洛酮糖液相图;
图4为对实施例1条件下葡萄糖酸液相图。
图中:GI:葡萄糖异构酶;DPE:D-阿洛酮糖-3-差向异构酶;RDH:核糖醇脱氢酶;GDH:葡萄糖脱氢酶;SDH:糖醇脱氢酶;NOX:NADH氧化酶。
具体实施方式
下面结合实施例对本发明做进一步说明。若未特别指明,实施例中所用技术手段为本领域技术人员所熟知的常规手段。
本发明实施例中所用到的原料和试剂均为常规化学试剂,均能通过商业渠道购买得到。
实施例1
本实施例是高效联产葡萄糖酸和D-阿洛酮糖的方法的一个实施实例,具体步骤如下:
(1)重组大肠杆菌的构建:
重组质粒pRSFDuet-gi-dpe的构建:以来源于Bacillus.sp的葡萄糖异构酶基因gi基因片段和来源于ClostridiumbolteaeATCCBAA-613的D-阿洛酮糖-3-差向异构酶基因dpe基因片段为模板,以gi-F:
ccacagccaggatccgaattcaatgagcctgaccaccg(BamHI)为上游引物,gi-R:taagcattatgcggccgcaagcttttaaccacgcgc(HindIII)为下游引物进行PCR扩增,扩增得到目的片段gi;以dpe-F:
atatacatatggcagatctaatgcgttacttcaaagaagaagtt(BamHI)为上游引物,dpe-R:gtttctttaccagactcgagttagataccgaaaacgtgcctaca(HindIII)为下游引物进行PCR扩增,扩增得到目的片段dpe。通过用限制性内切酶BamHI和HindIII对质粒pRSFDuet-1在37℃进行双酶切,再用无缝克隆试剂盒分别将目的基因gi和dpe与表达载体pRSFDuet-1的多克隆位点MCS1和MCS2进行重组连接,得到重组质粒pRSFDuet-gi-dpe。
重组质粒pETDuet-gdh-rdh的构建:以来源于Providencia alcalifaciens的rdh基因片段为模板,以rdh-F:
atatacatatggcagatctgatggctatctctctggaaaacaaa(BamHI)为上游引物,以rdh-R:gtttctttaccagactcgagttacagatcaacgctgttcgg(HindIII)为下游引物进行PCR扩增,扩增得到目的片段rdh;用限制性内切酶BamHI和HindIII对质粒pRSFDuet-1在37℃进行双酶切,再用无缝克隆试剂盒对基因片段和质粒pRSFDuet-1进行重组连接,得到重组质粒pRSFDuet-rdh。以来源于枯草WB800的GDH基因片段为模板,以gdh-F:
ctgatatcggatccgaattcatgtatccggatttaaaaggaaaagt(EcoRⅠ)为上游引物,以gdhR:tggtggtggtggtgctcgagttaaccgcggcctgc(XhoⅠ)为下游引物进行PCR扩增扩增得到目的片段gdh。用限制性内切酶EcoRⅠ和XhoⅠ对质pRSFDuet-rdh在37℃进行双酶切,再用无缝克隆试剂盒对基因片段和质粒pRSFDuet-rdh进行重组连接,得到重组质粒pETDuet-gdh-rdh。
重组质粒pRSFDuet-gi-dpe和重组质粒pETDuet-gdh-rdh的转化:将重组质粒pRSFDuet-gi-dpe和重组质粒pETDuet-gdh-rdh共同转化至E.coliBL21(DE3)中得到重组大肠杆菌Ec/pRgd-pEgr。
在上步重组大肠杆菌Ec/pRgd-pEgr中过表达大肠杆菌中的NAPRTase和NAD
(2)湿菌体的制备:
将重组大肠杆菌A在LB培养基中37℃培养,至OD
(3)全细胞催化反应:
以D-葡萄糖为底物,D-葡萄糖浓度为25g/L,加入1mMol/L的金属离子Co
(4)将重组大肠杆菌A催化反应后的产物煮沸后离心,取上清液为下一步反应的底物。
(5)重组大肠杆菌B的构建:
重组质粒pRSFDuet-sdh-nox的构建:以来源于Rubrivivax sp.的sdh基因片段和来源于Streptococcus pyogenes的nox基因片段为模板,以sdh-F:ccacagccaggatccgaattcaatgagcctgaccaccg(BamHI)为上游引物,sdh-R:taagcattatgcggccgcaagcttttaaccacgcgc(HindIII)为下游引物进行PCR扩增,扩增得到目的片段sdh;以nox-F:ggatccatgagtaaaatcgttgtagtcggtg(BamHI)为上游引物,nox-R:ctcgagttatttttcagccgtaagggcagc(HindIII)为下游引物进行PCR扩增,扩增得到目的片段nox。通过用限制性内切酶BamHI和HindIII对质粒pRSFDuet-1在37℃进行双酶切,再用无缝克隆试剂盒分别将目的基因sdh和nox与表达载体pRSFDuet-1的多克隆位点MCS1和MCS2进行重组连接,得到重组质粒pRSFDuet-sdh-nox。
将重组大肠杆菌B在LB培养基中37℃培养,至OD
利用(4)步骤的上清液进行反应,以tris-HCl(pH 7.0)缓冲液为反应液,控制反应温度为45℃,经过12h催化反应,其中反应体系为1mL。
通过高效液相色谱(HPLC)检测底物D-葡萄糖的消耗和D-阿洛酮糖的产生,并计算转化率。
HPLC检测条件如下:色谱分析柱Carbomix-Pb-NP10:8%(7.8×300mm),流动相为超纯水,流速为0.5mL/min,柱温78℃,示差(RI)检测器,其中D-葡萄糖标准品保留时间为14.28min,D-果糖标准品保留时间为20.12min,D-阿洛酮糖标准品保留时间为34.13min(图3)。
通过高效液相色谱(HPLC)检测葡萄糖酸产生,并计算转化率。
HPLC检测条件如下:色谱柱:Zorbax SAX¢4.6mm×25mm;流动相:0.1M的磷酸二氢钾溶液;流速:1.0mL/min;检测器:紫外和势差折光检测器;柱温:室温(<30℃);进样量:100μL。(图4)
实施例2
全细胞催化反应时整个反应体系的温度为20℃,其余操作均与实施例1操作相同。
实施例3
全细胞催化反应时整个反应体系的温度为35℃,其余操作均与实施例1操作相同。
实施例4
全细胞催化反应时整个反应体系的pH为7.5,其余操作均与实施例1操作相同。
实施例5
全细胞催化反应时整个反应体系的温度为30℃,其余操作均与实施例1操作相同。
实施例6
全细胞催化反应时整个反应体系的pH为8.0,其余操作均与实施例1操作相同。
实施例7
全细胞催化反应时整个反应体系中D-葡萄糖浓度为50g/L,其余操作均与实施例1相同。
对比例1:
将实施例1中构建的重组质粒pRSFDuet-gi-dpe转入大肠杆菌,将重组大肠杆菌在LB培养基中37℃培养,至OD600为0.6-1.0时,加入终浓度为1mM IPTG(Isopropyl-β-D-thiogalactopyranoside),异丙基-β-D-硫代半乳糖苷。20℃诱导24h,收集得到湿菌体;以D-葡萄糖为底物(D-葡萄糖浓度为25g/L),加入金属离子(1mMol/L的Co2+)、以及重组大肠杆菌经过诱导后的湿菌体(湿菌体浓度为25g/L),以tris-HCl(pH 8.5)缓冲液为反应液,控制反应温度为45℃,经过12-18h催化反应,其中反应体系为1mL。
检测条件与实施例1相同。
各实施例以及对比实施例的实验结果如表1所示。
本发明涉及的各个基因序列如表2所示。
通过表1数据可以发现,本发明以D-葡萄糖为底物,经重组大肠杆菌构建、辅酶系统重构、湿菌体制备以及全细胞催化反应制取葡萄糖糖酸和D-阿洛酮糖。该工艺技术史无前例。相比较7个实施例,得出第一步合成蒜糖醇最佳催化条件为温度为45℃以及pH为8.5,蒜糖醇合成D-阿洛酮糖的最佳催化条件40℃以及pH为7.0。
以上所述仅为本发明的较佳实例而已,并不限制本发明,凡在本发明的精神和原则之内所作的修改、等同替换和改进等,均应包含在本发明的保护范围之内。
表1
表2
/>
/>
/>
- 一种从葡萄糖酸废液中回收制备葡萄糖酸衍生物的方法
- 一种提高菌株产2-酮基-D-葡萄糖酸速率的发酵工艺
- 一种利用工程大肠杆菌以玉米芯水解液为底物高产D-木糖酸的方法
- 一种合成D-二苯甲酰酒石酸及联产苯甲酸甲酯的方法
- 一种酶催化乳糖联产D-半乳糖和葡萄糖酸或葡萄糖酸盐的方法
- 一种联产5-酮基-D-葡萄糖酸及4-氯-3-羟基丁酸乙酯的方法
