一种靶向CLDN18.2的抗体药物偶联物及其应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及生物医药领域,特别地涉及一种靶向CLDN18.2的抗体药物偶联物及其应用。
背景技术
抗体药物偶联物(antibody-drug conjugate,ADC)是通过一个化学链将具有生物活性的小分子药物连接到单抗上,单抗作为载体将小分子药物靶向运输到目标细胞中,可以作为肿瘤靶向性的药物。靶向药物是将异常的肿瘤细胞或基因作为靶点,从而阻止肿瘤细胞的生长并杀死它,所以靶向治疗不会误伤到正常的细胞,而且全部药效都用在肿瘤细胞上,药效比常规化疗药强,副作用却比常规化疗小很多。
CLDN18.2在原发性胰腺导管腺癌、非小细胞肺癌(NSCLC)患者中表达,而相应正常组织中不表达;在晚期印戎细胞癌(SRCC)、巴雷特食管受损鳞状上皮中表达增加。除此之外,CLDN18.2的表达不仅限于原发病灶,其在转移灶中也有高表达,可能参与恶性肿瘤细胞的增殖和趋化。
因此,包含靶向CLDN18.2抗原的ADC药物可能将被广泛用于抗肿瘤的临床使用中。
发明内容
针对现有技术中存在的技术问题,本发明提出了一种抗体药物偶联物,其包含与药物偶联的特异性结合CLDN18.2的抗体、其抗原结合片段或其变体,所述抗体、其抗原结合片段或其变体包括重链可变区和轻链可变区,其中:所述重链可变区包含如SEQ ID NO.1所示的HCDR1、如SEQ ID NO.2所示的HCDR2、以及如SEQ ID NO.3所示的HCDR3;以及所述轻链可变区包含如SEQ ID NO.4所示的LCDR1、如SEQ ID NO.5所示的LCDR2、以及如SEQ ID NO.6所示的LCDR3。
在一些实施例中,所述抗体、其抗原结合片段或其变体进一步包括:
SEQ ID NO.7所示的重链可变区;以及SEQ ID NO.8所示的轻链可变区。
在一些实施例中,所述的抗体或其抗原结合部分选自以下组:全抗体、双特异性抗体、单克隆抗体、嵌合抗体、人源化抗体和全人源抗体。
在一些实施例中,所述抗体、其抗原结合片段或其变体其进一步包括重链恒定区和轻链恒定区,其中:所述抗体重链恒定区选自IgG系列抗体;轻链恒定区选自κ或λ链。
在一些实施例中,所述IgG系列抗体选自IgG1、IgG2和IgG4中的一者或多者。
在一些实施例中,其中所述抗原结合片段选自以下组:Fab片段、Fab’片段、F(ab)
在一些实施例中,其中所述CLDN18.2选自以下组:人CLDN18.2、小鼠CLDN18.2和猴子CLDN18.2。
在一些实施例中,如上任一项所述的抗体药物偶联物,所述抗体药物偶联物的分子式为:Ab-[L-D]n,其中Ab表示抗CLDN18.2抗体、其抗原结合片段或其变体,L表示连接子,D表示药物,n表示相对于每一分子Ab的药物平均连接数。
在一些实施例中,其中所述药物D为细胞毒性剂或者细胞增殖抑制剂。
在一些实施例中,所述药物选自卡其霉素类、倍癌霉素类、安曲霉素类衍生物PBD、喜树碱类衍生物、海兔毒素及澳瑞他汀类、美登素及其衍生物中的一种或者多种。
在一些实施例中,进一步地,所述药物选自MMAF、MMAE、MMAD、PBD、杜卡霉素、细胞松驰素B、短杆菌肽D、溴化乙锭、吐根碱、丝裂霉素、依托泊苷(etoposide)、替尼泊苷(tenoposide)、长春新碱、长春碱、秋水仙碱、阿霉素、道诺霉素(daunorubicin)、二羟基炭疽菌素(dihydroxy anthracin)、美登木素生物碱(maytansinoids,诸如DM-1和DM-4)、二酮、米托蒽醌(mitoxantrone)、光神霉素、放线菌素D、1-去氢睾酮、糖皮质激素、普鲁卡因(procaine)、丁卡因(tetracaine)、利多卡因(lidocaine)、普萘洛尔(propranolol)、嘌呤霉素、表柔比星(epirubicin)和环磷酰胺及其类似物中的一个或者多个。
在一些实施例中,所述连接子L为半胱氨酸偶联连接子、赖氨酸偶联连接子、缬氨酸-瓜氨酸(Val-Cit,vc)连接子、SPDB连接子、SMCC连接子、SMAC(sortasemediatedantibody conjugation technology)连接子。
一种抗体药物偶联物的制备方法,包括:制备特异性结合CLDN18.2的抗体、其抗原结合片段或其变体,其包括重链可变区和轻链可变区,其中:所述重链可变区包含如SEQ IDNO.1所示的HCDR1、如SEQ ID NO.2所示的HCDR2、以及如SEQ ID NO.3所示的HCDR3;以及所述轻链可变区包含如SEQ ID NO.4所示的LCDR1、如SEQ ID NO.5所示的LCDR2、以及如SEQID NO.6所示的LCDR3;采用缬氨酸-瓜氨酸(Val-Cit,vc)连接子将所述抗体、其抗原结合片段或其变体于MMAC偶联;获得抗CLDN18.2的抗体药物偶联物。
一种组合物,如上任一项的抗体药物偶联物、或者如上所述的方法制备的抗体药物偶联物,以及任选的药学上可接受的赋形剂。
如上任一项的抗体药物偶联物、或者如上所述的方法制备的抗体药物偶联物在制备预防和/或治疗癌症或肿瘤的药物中的用途。
在一些实施例中,所述药物为细胞治疗的药物。
在一些实施例中,所述癌症或肿瘤为CLDN18.2表达阳性的癌症或肿瘤。
在一些实施例中,其中所述癌症或肿瘤选自膀胱癌、卵巢癌、肺癌、腺癌、胃癌、乳腺癌、肝癌、胰腺癌、皮肤癌、恶性黑色素瘤、头颈癌、肉瘤、胆管癌、肾癌、结肠癌、小肠癌、睾丸胚胎性癌、胎盘绒毛膜癌、宫颈癌、睾丸癌、子宫癌、食道癌和胆囊癌细胞。
如上任一项的抗体药物偶联物在制备确定样品中CLDN18.2的存在和/或量的试剂中的用途。
一种药物组合物,其包含:如上任一项的抗体药物偶联物或者如上所述的方法制备的抗体药物偶联物。
本发明提供一种抗体,与claudin18.2(例如人claudin18.2、鼠claudin18.2、猴claudin18.2)结合的全人源的单克隆抗体,其与现有技术抗体分子相比,具有更高的ADCC活性、CDC活性和/或claudin18.2结合稳定性。
附图说明
下面,将结合附图对本发明的优选实施方式进行进一步详细的说明,其中:
图1是根据本发明一个实施例的人源CLDN18.2和CLDN18.1特异性检测;其中横坐标为Anti-hIgG-Fc-AF647荧光强度,检测抗体和CLDN18.1及CLDN18.2的结合强度;纵坐标SSC-H为细胞的偏向色散,检测细胞的复杂程度;P1026为筛选到的CLDN18.2特异性结合抗体;NC(Negative control)为阴性对照,具体抗体为Human IgG1,kappa Isotype control,品牌:CrownBio货号:C0001-4,批号AB190016,为不与CLDN18.1和CLDN18.2结合的阴性对照抗体;IMAB362为阳性对照,特异性结合人CLDN18.2,根据IMAB362抗体的专利CN101312989A的Clone:175D10(Heavy Chain:SEQ ID NO:103;Light Chain:SEQ ID NO:110),分别合成轻重链序列,通过ExpiCHO
图2是根据本发明一个实施例的抗体种属交叉结果检测,其中横坐标为Anti-hIgG-Fc-AF647荧光强度,检测抗体和CLDN18.2的结合强度;纵坐标SSC-H为细胞的偏向色散,检测细胞的复杂程度;P1026为筛选到的CLDN18.2特异性结合抗体;NC(Negativecontrol)为阴性对照,具体抗体为Human IgG1,kappa Isotype control,品牌:CrownBio货号:C0001-4,批号AB190016,为不与CLDN18.2结合的阴性对照抗体;IMAB362为阳性对照,特异性结合人CLDN18.2,根据IMAB362抗体的专利CN101312989A的Clone:175D10(HeavyChain:SEQ ID NO:103;Light Chain:SEQ ID NO:110),分别合成轻重链序列,通过ExpiCHO
图3是根据本发明一个实施例的抗体结合能力检测;其中横坐标为抗体浓度,纵坐标为平均荧光强度;
图4是根据本发明一个实施例的CLDN18.2抗体对过表达人claudin18.2的MC38细胞的ADCC活性;
图5是根据本发明一个实施例的CLDN18.2抗体对过表达人claudin18.2的MC38细胞的CDC活性;
图6是根据本发明一个实施例的CLDN18.2抗体的內吞活性;
图7A是根据本发明一个实施例的CLDN18.2抗体药物偶联物在GSU胃癌模型中的抗肿瘤药效;以及
图7B是根据本发明一个实施例的CLDN18.2抗体药物偶联物在胃癌PDX模型中的抗肿瘤药效。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
在以下的详细描述中,可以参看作为本申请一部分用来说明本申请的特定实施例的各个说明书附图。在附图中,相似的附图标记在不同图式中描述大体上类似的组件。本申请的各个特定实施例在以下进行了足够详细的描述,使得具备本领域相关知识和技术的普通技术人员能够实施本申请的技术方案。应当理解,还可以利用其它实施例或者对本申请的实施例进行结构、逻辑或者电性的改变。
抗体疗法在全球已被批准用于治疗多种癌症,且显著改善患者预后,提高患者总生存期。多种抗体分子可以特异性结合到肿瘤表面抗原,抗体通过Fc片段引发抗体依赖的细胞介导的细胞毒性作用(ADCC)和补体依赖的细胞毒性作用(CDC),最终引起肿瘤细胞死亡。
如本文中所用,术语“抗体”通常指由两对相同的多肽链组成的免疫球蛋白分子,每对多肽链具有一条“轻”(L)链和一条“重”(H)链。抗体的轻链可被分为к和λ轻链。重链可被分类为μ、δ、γ、α或ε,并且抗体的同型被分别定义为IgM、IgD、IgG、IgA和IgE。在轻链和重链内,可变区和恒定区由约12个或更多个氨基酸的“J”区连接,并且重链还包括约3个或更多个氨基酸的“D”区。每条重链由重链可变区(V
本抗体不受任何抗体产生方法的限制。例如,其包括重组抗体、单克隆抗体和多克隆抗体。抗体可以是不同种型的抗体,例如,IgG(例如,IgG 1、IgG2、IgG3或IgG4亚型)、IgAl、IgA2、IgD、IgE或IgM抗体。
如本文中所用,术语“抗原结合片段”通常指全长抗体的一个或多个片段,其保持与所述抗体所结合的相同抗原(例如CLDN18.2)结合的能力,并与完整抗体竞争抗原特异性结合。抗原结合片段可通过重组DNA技术或通过酶促或化学切割完整抗体来产生。在一些情况下,抗原结合位点包括Fab、Fab’、F(ab’)
在一些实施方案中,抗体或抗原结合片段包含的氨基酸序列具有一个或多个修饰基团。例如,本发明公开的抗体或抗原结合片段可以包含有韧性的接头序列,或者可以被修饰以添加功能性基团(例如PEG、药物、毒素或标签)。
本发明公开的抗体、抗原结合片段包括被修饰的衍生物,即通过任何类型的分子与抗体或抗原结合片段的共价连接进行修饰,其中共价连接不会阻止抗体或抗原结合片段与表位结合。包括但不限制以下实例,抗体或抗原结合片段可以被糖基化、乙酰化、聚乙二醇化、磷酸化、酰胺化、通过已知的保护/封闭基团衍生化、蛋白水解切割、连接至细胞配体或其他蛋白质等。众多化学修饰中的任一种修饰可以通过现有技术进行,包括但不限于特异性化学裂解、乙酰化、甲酰化、衣霉素的代谢合成等。
在一些实施方案中,抗体或抗原结合片段可以与治疗剂、药物前体、肽、蛋白质、酶、病毒、脂类、生物反应调节剂、药剂或PEG缀合。
抗体或抗原结合片段可通过将其偶联至化学发光化合物来被可检测地标记。然后通过检测在化学反应过程中出现的发光从而确定化学发光标记的抗体或抗原结合片段的存在。化学发光标记化合物的实例包括鲁米诺、异鲁米诺、芳香吖啶酯、咪唑、吖啶盐和草酸酯。
如本文中所用,术语“全抗体”是指具有抗体全长序列的抗体。在一些实施例中,全抗体可以为嵌合抗体、人源化抗体或者全人源抗体。在另一些实施例中,全抗体可以为单克隆抗体或者多克隆抗体。在一个实施例中,全抗体为结合Claudin18.2抗原的免疫原性片段。进一步地,全抗体为CLDN18.2抗体,其包含CLDN18.2抗体的全长序列。
如本文中所用,术语“单克隆抗体”通常指由相同的免疫细胞产生的抗体,所述免疫细胞都是独特的亲代细胞的克隆。单克隆抗体可具有单价亲和力,因为它们与同一表位(抗原被抗体识别的部分)结合。其已经成为生物化学、分子生物学和医学的重要工具。近年来已开发了多种单克隆抗体技术,诸如噬菌体展示、单B细胞培养、来自各种B细胞群体的单细胞扩增和单浆细胞询问技术(single plasma cell interrogation technologies)。本申请提供了一种分离的单克隆抗体,例如,与claudin18.2(人claudin18.2、鼠claudin18.2、猴claudin18.2)结合的全人源的单克隆抗体,其与现有的抗CLDN18.2抗体分子相比,具有更高的ADCC活性、CDC活性和/或claudin18.2结合稳定性。
如本文中所用,“嵌合抗体”的不同部分来源于不同的动物物种,如具有来源于鼠抗体的可变区和人免疫球蛋白恒定区的那些抗体。通过将鼠抗体重链和轻链的可变区与人重链和轻链的恒定区连接来实现抗体的嵌合化(如,通过Kraus等在
Methods in Molecular Biology series,Recombinant antibodies for cancertherapy ISB N-O89603-918-8中所述)。
如本文中所用,“CAR-T”是指:CAR-T疗法就是嵌合抗原受体T细胞免疫疗法,是一种治疗肿瘤的新型精准靶向疗法,在临床肿瘤治疗上取得很好的效果,是一种能够精准、快速、高效,且有可能治愈癌症的新型肿瘤免疫治疗方法。
如本文中所用,“CAR-NK”或者“CAR-NK细胞”是指CAR-NK细胞疗法,CAR-NK细胞,由识别肿瘤特异抗原的细胞外信号结构域、跨膜区和细胞内结构域组成,它们可以建立新的激活途径,以增强靶细胞的溶解。CAR-NK细胞通过CAR特异性识别抗原表达肿瘤,同时通过NK细胞受体自身来消除肿瘤。其中,CAR为嵌合抗原受体,NK细胞为自然杀伤细胞,是不同于T、B淋巴细胞的大颗粒淋巴细胞的免疫细胞。NK细胞的活性取决于是刺激和抑制信号的平衡,而不是抗原特异性。
如本文中所用,“人源化”是指:抗体主要通过氨基酸残基与靶抗原相互作用,所述氨基酸残基位于六个重链和轻链互补决定区(CDR)中。为此,各个抗体之间的CDR内部的氨基酸序列比CDR外部的序列更加多样。因为CDR序列负责大部分抗体-抗原相互作用,通过构建表达载体来表达模拟特异性天然存在的抗体的性质的重组抗体是可能的,所述表达载体包括接枝到来自具有不同性质的不同抗体的框架序列的特异性天然存在的抗体的CDR序列(参见,如,Riechmann,L.等(1998)Nature 332:323-327;Jones,P.等(1986)Nature321:522-525和Queen,C.等(1989)Proc.Natl.Acad.Sci.U.S.A.86:10029-10033)。这样的框架序列可从包括种系抗体基因序列的公共DNA数据库获得。这些种系序列将不同于成熟的抗体基因序列,因为它们不包括完全组装的可变基因,其在B细胞成熟期间通过V(D)J连接形成。
“全人源”或者“完全人”是将人体抗体基因通过转基因或转染色体技术,将人类编码抗体的基因全部转移至基因工程改造的抗体基因缺失动物中,使动物表达人类抗体,达到抗体全人源化的目的。通常指具有完全人氨基酸序列衍生的抗体区域治疗剂的抗体,其中已通过使用遗传修饰的小鼠或通过结合筛选的抗体工程方法在体内选择了抗原特异性。与被人源化抗体相比,全人源抗体在人体内诱导免疫反应的风险较低,且特异性免疫效果更强,具有更高的ADCC活性、CDC活性和/或claudin18.2结合稳定性。
如本文中所用,术语“双特异性抗体”通常指能够同时与两种不同类型的抗原结合的人工蛋白质。制造方法的主要类型有四重杂交瘤(quadromas)、化学缀合和基因重组。IgG样形式,除两个Fab位点结合不同的抗原外,保留了两个Fab臂和一个Fc区的常规单克隆抗体(mAb)结构。每个重链和轻链对来自独特的mAb。由两条重链制成的Fc区形成第三个结合位点。非IgG样形式包括化学连接的Fab,仅由Fab区组成,以及各种类型的二价和三价单链可变片段(scFvs)。还有模拟两种抗体可变结构域的融合蛋白。双特异性抗体具有较高的细胞毒性潜能,并与在较低有效剂量下表达相对弱的抗原结合。另外,靶向一种以上的分子可用于规避平行途径的调节并避免对治疗的抗性。
双特异性抗体包括交联的或“异源偶联物”抗体。例如,异源偶联物中的抗体之一可与亲和素偶联,而另一抗体与生物素偶联。也可使用任何方便的交联方法产生异源偶联抗体。合适的交联剂和交联技术在本领域中是众所周知的并且在美国专利第4,676,980号中公开,此专利以全文引用的方式并入本文。
如本文中所用,术语“Fab片段”通常指免疫球蛋白分子的一部分(诸如抗原结合片段)。Fab片段可以包含一条轻链和重链的一部分,具有单个抗原结合位点。Fab片段可以通过木瓜蛋白酶消化免疫球蛋白分子而获得。例如,Fab片段可由每个重链和轻链的一个恒定结构域和一个可变结构域组成。可变结构域可在免疫球蛋白分子的氨基末端含有包含一组互补决定区的互补位(抗原结合位点)。木瓜蛋白酶可用于将免疫球蛋白分子裂解成两个Fab片段和一个Fc片段。胃蛋白酶在铰链区下方裂解,从而形成一个F(ab’)
本文所用的术语“Fv片段”通常指由IgG和IgM类抗体的酶促裂解制成的最小片段。Fv片段具有由VH和VL区制成的抗原结合位点,但它们缺少CH1和CL区。通过非共价相互作用,VH和VL链在Fv片段中结合在一起。
如本文中所用,术语“ScFv”通常指单链抗体片段。ScFv可指重组单链多肽分子,其中抗体的轻链和重链可变区通过肽接头连接。单链抗体(ScFv)通常不包括抗体的Fc区的涉及效应子功能的部分,因此是裸抗体,尽管已知有将此类区域添加到已知ScFv分子中(如果需要的话)的方法。参见Helfrich等人,A rapid and versatile method for harnessingScFv antibody fragments with various bi ological functions.J Immunol Methods237:131-145(2000)和de Haard等人,Creating and engineering human antibodies forimmunotherapy.Advanced Drug Deli very Reviews 31:5-31(1998)。
如本文中所用,术语“IgG”通常指一种亚型的抗体。每个IgG具有两个抗原结合位点。代表了约75%的人血清抗体,IgG是在循环中发现的最常见的抗体类型。被识别的免疫球蛋白基因包括κ、λ、α、γ(IgG1、IgG2、IgG3、IgG4)。
本文相对于特定氨基酸序列(如在序列表中显示的那些)给出的教导应理解为还涉及特定序列的变体,从而产生功能上等效于所述特定序列的序列,如显示出等同于或相似于特定氨基酸序列的那些性质的氨基酸序列。一个重要的性质为保留抗体结合至其靶标或保持抗体的效应物功能。优选地,当相对于特定序列为变体的序列替代抗体中的特定序列时,所述序列保留所述抗体结合至CLDN18.2,并且优选保留如本文所述的所述抗体的功能,如CDC介导的裂解或ADCC介导的裂解。
本领域技术人员将理解的是,特别是CDR、高变区和可变区的序列可被修饰而不会丧失结合CLDN18.2的能力。例如,CDR区与本文指定的抗体区为相同的或高度同源的。预期“高度同源的”为可以在CDR中进行1至5,优选1至4,如1至3或1或2个取代。另外,所述高变区和可变区可被修饰使得它们显示与本文明确公开的抗体区域基本同源。如本文所用,CDR可以为重链可变区的CDR区,也可以是轻链区的CDR区。进一步地,CDR区可以是指重链和/或轻链的CDR1、CDR2和/或CDR3。进一步地,HCDR是指重链可变区的互补决定区,具体包括HCDR1、HCDR2以及HCDR3;LCDR是指轻链可变区的互补决定区,具体包括LCDR1、LCDR2以及LCDR3。
如本文中所用,术语“变体”通常指与母体分子至少有一个氨基酸不同的蛋白质。变体可以指分子本身,包含该分子的组合物。当这种分子是多肽或蛋白质时,其也可以指分子的氨基酸序列。在一些情况下,变体与其母体分子(例如,蛋白质)相异在于一个或多个氨基酸,诸如1-50、1-40、1-30、1-20、1-15、1-14、1-13、1-12、1-11、1-10、1-9、1-8、1-7、1-6、1-5、1-4、1-3或1-2个氨基酸的添加、缺失或替换。在一些情况下,变体可以与其母体分子的氨基酸序列具有至少约80%(例如,至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或更高)的序列同源性。
在一些实施例中,本文所述的抗体或抗原结合片段可与药物偶联。包含抗体或其抗原结合片段的抗体药物偶联物可共价或非共价结合药物。在某些实施方案中,药物为细胞毒性剂或细胞增殖抑制剂。
在一些实施例中,抗体药物偶联物的分子式为:Ab-[L-D]n,其中Ab表示抗CLDN18.2抗体、其抗原结合片段或其变体,L表示连接子,D表示药物,n表示相对于每一分子Ab的药物平均连接数。在一些实施例中,连接子L为半胱氨酸偶联连接子、赖氨酸偶联连接子、缬氨酸-瓜氨酸(Val-Cit,vc)连接子、SPDB连接子、SMCC连接子、SMAC(sortasemediatedantibody conjugation technology)连接子。
在一些实施例中,药物选自卡其霉素类、倍癌霉素类、安曲霉素类衍生物PBD、喜树碱类衍生物、海兔毒素及澳瑞他汀类、美登素及其衍生物中的一种或者多种。进一步地,所述药物选自MMAF、MMAE、MMAD、PBD、杜卡霉素、细胞松驰素B、短杆菌肽D、溴化乙锭、吐根碱、丝裂霉素、依托泊苷(etoposide)、替尼泊苷(tenoposide)、长春新碱、长春碱、秋水仙碱、阿霉素、道诺霉素(daunorubicin)、二羟基炭疽菌素(dihydroxy anthracin)、美登木素生物碱(maytansinoids,诸如DM-1和DM-4)、二酮、米托蒽醌(mitoxantrone)、光神霉素、放线菌素D、1-去氢睾酮、糖皮质激素、普鲁卡因(procaine)、丁卡因(tetracaine)、利多卡因(lidocaine)、普萘洛尔(propranolol)、嘌呤霉素、表柔比星(epirubicin)和环磷酰胺及其类似物中的一个或者多个。
“序列相似性”表明为相同的或代表保守性氨基酸取代的氨基酸的百分比。两个氨基酸序列之间的“序列同一性”表明序列之间相同氨基酸的百分比。
如本文中所用,术语“结合特异性”通常指一种物质特异性结合另一种物质,并且不容易随机结合任何其它物质的能力。例如,一种蛋白质可由于其特定的结构而与另一种蛋白质特异性结合。例如,靶向部分可以表现出对相应肿瘤抗原的结合特异性。
如本文中所用,术语“claudin18.2”与“CLDN18.2”可以互换,Claudin18.2蛋白含有4个跨膜结构域,2个胞外环,可用于单克隆抗体结合,且claudin18.2抗体已经被用于治疗癌症的研究中。例如,claudiximab(IMAB362),一种由Astellas开发的人鼠嵌合抗体,在治疗胃及胃食管结合部癌的临床试验中展现出积极的数据。Claudin 18.2在大比例的原发胃癌及其转移癌中大量存在,并在其恶变中发挥重要作用。例如,在胰腺、食道、卵巢和肺肿瘤中发现有Claudin 18.2的频繁异位激活((Niimi et al.,(2001)Mol Cell Biol 21(21):7380-7390;Tanaka et al.(2011)J Histochem Cytochem 59(10):942-952;Mickeet al.,(2014)Int J Cancer 135(9):2206-2214;Shimobaba et al.(2016)BiochimBiophys Acta 1863(6Pt A):1170-1178;Singh et al.,(2017)J Hematol Oncol 10(1):105;Tokumitsu et al.,(2017)Cytopathology 28(2):116-121)。多种癌症或肿瘤如膀胱癌、卵巢癌、肺癌、腺癌、胃癌、乳腺癌、肝癌、胰腺癌、皮肤癌、恶性黑色素瘤、头颈癌、肉瘤、胆管癌、肾癌、结肠癌、小肠癌、睾丸胚胎性癌、胎盘绒毛膜癌、宫颈癌、睾丸癌、子宫癌、食道癌和胆囊癌细胞中,可检测到CLDN18.2表达阳性。
如本文中所用,术语“claudin18.2抗体”、“CLDN18.2抗体”、“抗claudin18.2抗体”与“抗CLDN18.2抗体”可以互换。在一些实施方式中,本发明的抗体或其抗原结合片段能够与CLDN18.2(claudin18.2)特异性结合。在一些实施方式中,所述抗体或其抗原结合片段是鼠源抗体、嵌合抗体、人源化抗体或者全人源抗体。在一些实施方式中,本发明的抗体或其抗原结合片段具有以下特性:a)与CLDN18.2特异性结合;b)高亲和力;c)强的ADCC活性;d)强的CDC活性。在一些实施例中,抗CLDN18.2抗体可以损害CLDN18.2表达阳性的肿瘤或者癌细胞的生长。由于Claudin 18.2在大比例的原发胃癌及其转移癌中大量存在,并在其恶变中发挥重要作用。抗CLDN18.2抗体可以损害,例如,胰腺、食道、卵巢和肺中的肿瘤。进一步地,在一些实施例中,抗CLDN18.2抗体还可以针对其他癌症或肿瘤具有治疗作用,这些癌症或肿瘤包括但不限于膀胱癌、卵巢癌、肺癌、腺癌、胃癌、乳腺癌、肝癌、胰腺癌、皮肤癌、恶性黑色素瘤、头颈癌、肉瘤、胆管癌、肾癌、结肠癌、小肠癌、睾丸胚胎性癌、胎盘绒毛膜癌、宫颈癌、睾丸癌、子宫癌、食道癌和胆囊癌细胞。
在一些实施方案中,能够结合CLDN18.2的抗体优选包含抗CLDN18.2的单克隆抗体(优选抗本文所述CLDN18.2的单克隆抗体)的重链可变区(V
在一个实施方案中,能够结合CLDN18.2的抗体中的抗CLDN18.2的单克隆抗体的重链可变区(V
在一个实施方案中,能够结合CLDN18.2的抗体中的抗CLDN18.2的单克隆抗体的轻链可变区(V
在一个实施方案中,包含如本文所述的一个或多个CDR,一组CDR或CDR组的组合的抗体包含所述CDR连同其介入其间的框架区。
在一个实施方案中,包含如本文所述的一个或多个CDR,一组CDR或CDR组的组合的抗体包含在人抗体框架中的所述CDR。
在一个实施方案中,能够结合CLDN18.2的抗体中的抗CLDN18.2的单克隆抗体的重链可变区(V
QVQLVESGGGLVQPGGSLRLSCAASGFTFSNYEMNWVRQAPGKGLEWVAY
ITGSGRTIYYADSVKGRFTISRDNAKKSLYLQMNSLRSEDTAVYYCAIYDYGDFDFWGQGTLVTVSS;SEQ ID NO.8为
DIQMTQSPSSVSASVGDRVTITCRASQGISSWLAWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQANSFPLTFGGGTKVEIK。
本文中提及的包含相对于其重链的特定链、或特定区域或序列的抗体优选涉及其中所述抗体的所有重链包含所述特定链、区域或序列的情形。这相应地适用于抗体的轻链。
如本文所用,术语“核酸”或者“核苷酸”旨在包括DNA和RNA。核酸可以为单链的或双链的,但优选为双链的DNA。
根据本发明,术语“表达”以其最通用意义使用并且包括RNA或RNA和蛋白质/肽的产生。其也包括核酸的部分表达。此外,可以瞬时或稳定地进行表达。
术语“转基因动物”是指具有包含一个或多个转基因,优选重链转基因和/或轻链转基因,或转染色体(整合或未整合至动物的天然基因组DNA)的基因组,并且优选能够表达所述转基因的动物。例如,转基因小鼠可具有人轻链转基因和人重链转基因或人重链转染色体,使得当用CLDN18.2抗原和/或表达CLDN18.2的细胞免疫时,小鼠产生人抗-CLDN18.2抗体。可将人重链转基因整合至小鼠的染色体DNA,如转基因小鼠,如HuMAb小鼠,如HCo7或HCol2小鼠的情形,或可将人重链转基因保持在染色体外,如在WO 02/43478中所述的转染色体(如,KM)小鼠的情形。通过经历V-D-J重组和同种型转换,这样的转基因和转染色体小鼠能够产生CLDN18.2的人单克隆抗体的多个同种型(如,IgG,IgA和/或IgE)。
如本文中所用,术语“基本上不”通常是指很少或几乎不结合特定物质。例如,非常少或几乎没有(例如,少于10%、少于9%、少于8%、少于7%、少于6%、少于5%、少于4%、少于3%、少于2%、少于1%、少于0.5%、少于0.1%或少于0.01%)根据本申请的抗体、其抗原结合片段或其变体与CLDN18.1结合。
如本文使用的“减少”、“降低”或“抑制”意指水平(如表达水平或细胞增殖水平)的整体下降或能够引起水平(如表达水平或细胞增殖水平)整体下降,优选5%或更高,10%或更高,20%或更高,更优选50%或更高,并且最优选75%或更高。
诸如“增加”或“增强”的术语优选涉及增加或增强约至少10%,优选至少20%,优选至少30%,更优选至少40%,更优选至少50%,甚至更优选至少80%并且最优选至少100%,至少200%,至少500%,至少1000%,至少10000%或甚至更多。
虽然以下提供了关于本发明抗体的治疗功效的潜在机制的考虑因素,但不应将其视为以任何方式限制本发明。
本文所述的抗体优选与免疫系统的组分相互作用,优选通过ADCC或CDC。也可将本文所述的抗体用于靶向有效载荷(如,放射性同位素、药物或毒素),以直接杀伤肿瘤细胞或可与传统的生物或化学治疗剂协同使用,从而通过互补的作用机制攻击肿瘤,所述作用机制可以包括由于化学治疗剂对T淋巴细胞的细胞毒性副作用而可能已经受损的抗肿瘤免疫响应。然而,本文所述的抗体也可以仅通过结合于细胞表面上的CLDN18.2发挥作用,由此如阻断细胞增殖。
本文所说的“ADCC”、“抗体依赖的细胞介导的细胞毒性”是指Antibody-DependentCell-mediated Cytotoxicity,描述了效应细胞的细胞杀伤能力,其优选需要由抗体标记的靶细胞。当抗体的Fab段结合于肿瘤细胞上的抗原表位且抗体Fc结构域接合免疫效应细胞(如NK细胞、巨噬细胞、中性粒细胞等)表面上的Fc受体(FcR)时,优选出现ADCC,即ADCC介导免疫效应细胞直接杀伤靶细胞。
已鉴定几种家族的Fc受体,特定的细胞群体特征性地表达限定的Fc受体。可将ADCC视为直接诱导可变程度上即刻肿瘤破坏的机制,所述即刻肿瘤破坏导致抗原呈递并诱导肿瘤定向的T-细胞响应。优选地,ADCC的体内诱导将导致肿瘤定向T-细胞响应和宿主来源的抗体响应。
本文所说的“CDC”、“补体依赖的细胞毒性”是指Complement DependentCytotoxicity,为可由抗体定向的另一细胞杀伤方法,是补体参与的细胞毒作用,即通过特异性抗体与细胞膜表面相应抗原结合,形成复合物而激活补体经典途径,所形成的攻膜复合物对靶细胞发挥裂解效应。
IgM为补体激活的最有效的同种型。IgG1和IgG3也都在经由经典的补体-激活途径定向CDC上非常有效。优选地,在该级联中,抗原-抗体复合物的形成导致揭露参与诸如IgG分子的抗体分子的CH2结构域紧密邻近的多个C1q结合位点(C1q为补体C1的三个亚组分之一)。优选地,这些揭露的C1q结合位点将先前低亲和力的C1q-IgG相互作用转化成其中一种高亲合力,这触发了涉及一系列其它补体蛋白质事件的级联,并导致效应-细胞趋化因子/活化剂C3a和C5a的蛋白水解释放。优选地,补体级联在形成膜攻击复合物时终止,这在细胞膜中产生利于水和溶质自由进出细胞的孔。
在本申请中,抗体可通过多种技术产生,所述技术包括常规的单克隆抗体方法学,如,Kohler和Milstein(Nature 256:495,1975)的标准体细胞杂交技术。虽然体细胞杂交程序为优选的,但原则上,可采用用于产生单克隆抗体的其它技术,如病毒或B-淋巴细胞的致癌转化或使用抗体基因库的噬菌体展示技术。
用于制备分泌单克隆抗体的杂交瘤的优选动物系统为鼠系统,更优选为小鼠系统。分离用于融合的免疫细胞的免疫方案和技术为领域已知的。
用于制备分泌单克隆抗体的杂交瘤的其它优选动物系统为大鼠和兔系统(如,在Spieker-Polet等,Proc.Natl.Acad.Sci.U.S.A.92:9348(1995)中所述,也参见Rossi等,Am.J.Clin.Pathol.124:295(2005))。
在另一优选的实施方案中,使用携带人免疫系统而非小鼠系统的部分的转基因或转染色体小鼠,可生成人单克隆抗体。这些转基因和转染色体小鼠包括分别被称为HuMAb小鼠和KM小鼠的小鼠,并且在本文被共同称为“转基因小鼠”。在这样的转基因小鼠中产生人抗体可如WO2004035607中对于CD20详细描述进行。
然而,生成单克隆抗体的另一策略涉及从产生限定特异性抗体的淋巴细胞中直接分离编码抗体的基因,如参见Babcock等(1996;A novel strategy for generatingmonoclonal antibodies from single,isolated lymphocytes producing antibodiesof defined specificities)。对于重组抗体工程的详细内容也可参见Welschof和Kraus(Recombinant antibodes for cancer therapy ISBN-0-89603-9l8-8)以及Benny K.C.LoAntibody Engineering ISBN 1-58829-092-1。
为生成抗体,如上所述,可用来源于抗原序列(即针对待被定向的抗体的序列)的载体-偶联的肽,重组表达的抗原或其片段和/或表达抗原的细胞的浓缩制剂来免疫小鼠。可选地,可用编码抗原或其片段的DNA来免疫小鼠。在使用纯化或浓缩的抗原制剂免疫不会产生抗体的情况下,还可用表达抗原的细胞(如细胞系)来免疫小鼠,以促进免疫响应。
为生成产生单克隆抗体的杂交瘤,可从免疫的小鼠分离脾细胞和淋巴结细胞并融合至适当的永生化细胞系,如小鼠骨髓瘤细胞系。然后,可对所得的杂交瘤进行产生抗原-特异性抗体的筛选。然后,可通过ELISA对单个孔进行分泌抗体的杂交瘤的筛选。通过免疫荧光和FACS分析,使用表达抗原的细胞,可鉴定对抗原具有特异性的抗体。可将分泌抗体的杂交瘤重新接种,再次筛选,如果仍对单克隆抗体呈阳性,则可通过有限稀释进行亚克隆。然后,可将稳定的亚克隆在体外进行培养以在组织培养基中生成用于表征的抗体。
使用,例如,如本领域熟知的重组DNA技术和基因转染方法的组合也可在宿主细胞转染瘤中产生抗体(Morrison,S.(1985)Science 229:1202)。
例如,在一个实施方案中,可将目标基因(如,抗体基因)连接到表达载体,如在WO87/04462,WO 89/01036和EP 338 841中公开的GS基因表达系统使用的如真核表达质粒,或本领域熟知的其它表达系统。可将具有克隆的抗体基因的纯化质粒引入真核宿主细胞,如CHO细胞、NS/0细胞、HEK293T细胞或HEK293细胞或者其它真核细胞,如植物来源的细胞、真菌细胞或酵母细胞。用于引入这些基因的方法可为领域中所述的方法,如电穿孔、脂质体(lipofectine/lipofectamine)或其它方法。在将这些抗体基因引入宿主细胞之后,可鉴定和选择表达抗体的细胞。这些细胞代表转染瘤,然后可扩增所述转染瘤的表达水平并扩大规模以产生抗体。可从这些培养物上清液和/或细胞中分离并纯化重组抗体。
可选地,克隆的抗体基因可在其它表达系统中表达,所述表达系统包括原核细胞,如微生物体,如大肠杆菌。此外,抗体可在转基因非人动物中(如绵羊和兔的乳汁或母鸡的蛋)或在转基因植物产生;参见如Verma,R.,等
(1998)J.Immunol.Meth.216:165-181;Pollock,等
(1999)J.Immunol.Meth.231:147-157;以及Fischer,R.,等
(1999)Biol.Chem.380:825-839。
如本文中所用,术语“一种或多种分离的核酸分子”通常是指从其天然环境中分离的或人工合成的任何长度的核苷酸(无论是脱氧核糖核苷酸还是核糖核苷酸或其类似物)的聚合形式。
如本文中所用,术语“融合蛋白”通常可以指包含与异源多肽(即,与前一多肽或其结构域无关的多肽)的氨基酸序列直接或间接(例如,通过接头)融合的多肽的氨基酸序列,或者由其组成的多肽。
如本文中所用,术语“一种或多种载体”通常指可将编码蛋白质的多核苷酸插入其中并表达的核酸媒介物。载体中携带的遗传物质元件可以通过用载体转化、转导或转染宿主细胞而在宿主细胞中表达。载体的实施方案包括:质粒;噬菌粒;粘粒;人工染色体,诸如酵母人工染色体(YACs)、细菌人工染色体(BACs)或P1衍生的人工染色体(PACs);噬菌体诸如λ噬菌体或M13噬菌体和动物病毒。用作载体的动物病毒包括逆转录病毒(包括慢病毒)、腺病毒、腺相关病毒、疱疹病毒(诸如单纯疱疹病毒)、溶瘤病毒、黄疸病毒、杆状病毒、乳头状瘤病毒、乳多空病毒(诸如SV40病毒)。载体可包含多种控制表达的元件,包括启动子序列、转录起始序列、增强子序列、选择元件和报告基因。另外,载体还可包含复制起点。载体还可能包括有助于其进入细胞的组分,诸如病毒颗粒、脂质体或蛋白壳,但不仅仅是这些物质。在一些实施例中,本发明的抗体或其抗原结合部分还可以由溶瘤病毒编码或由溶瘤病毒承载。
可使用标准的结合测定(如,ELISA、Western印迹、免疫荧光和流式细胞术分析)来确定抗体结合抗原的能力。
为纯化抗体,可将选择的杂交瘤在用于单克隆抗体纯化的旋转瓶中生长。可选地,抗体可在基于透析的生物反应器中产生。可过滤上清液,且如果需要,在用蛋白质G-琼脂糖或蛋白质A-琼脂糖亲和层析之前,浓缩上清液。洗脱的IgG可通过凝胶电泳和高效液相色谱检测以确保纯度。可将缓冲液更换成PBS,使用1.43的消光系数可由OD
为确定选择的单克隆抗体是否结合于独特的表位,可使用定向诱变或多位点定向诱变。
为确定抗体的同种型,可进行具有不同商品化试剂盒的同种型ELISA(如,Zymed,Roche Diagnostics)。可将微量滴定板的孔用抗-小鼠Ig包被。在封闭之后,将板与单克隆抗体或纯化的同种型对照在环境温度下反应2小时。然后,可将孔与小鼠IgG1、IgG2a、IgG2b或IgG3、IgA或小鼠IgM-特异性过氧化物酶-偶联的探针反应。在洗涤之后,可将板用ABTS底物(1mg/ml)显色,并在OD
为证明免疫小鼠的血清中存在抗体或单克隆抗体结合于表达抗原的活细胞,可使用流式细胞术。可将天然表达抗原或在转染之后表达抗原的细胞系和缺少抗原表达的阴性对照(在标准生长条件下生长)与不同浓度的单克隆抗体在杂交瘤上清液或在含1%FBS的PBS中混合,并且可在4℃温育30min。在洗涤之后,APC-或Alexa Flour647-(AF647)标记的抗IgG抗体可在相同条件下结合至抗原-结合的单克隆抗体作为一抗染色。使用光和侧向散射性质的FACS仪器来对单个活细胞进行门控,通过流式细胞术可分析样品。为在单次测量中区分抗原-特异性单克隆抗体与非特异性结合剂,可采用共转染的方法。可如上所述,对用编码抗原和荧光标记物的质粒瞬时转染的细胞进行染色。可在与抗体-染色的细胞不同的荧光通道中检测转染细胞。因为大部分转染细胞表达两个转基因,所以抗原-特异性单克隆抗体优先结合于表达荧光标记物的细胞,而非特异性抗体以相当的比率结合未转染细胞。除流式细胞术测定以外,还可以使用荧光显微镜的替代测定,或者可以使用荧光显微镜的替代测定来代替流式细胞术测定。正如上文所述,可对细胞进行染色并通过荧光显微镜对其进行检测。
为证明免疫小鼠的血清中存在抗体或单克隆抗体结合于表达抗原的活细胞,可使用免疫荧光显微镜分析。
可制备来自表达抗原的细胞的细胞提取物和适当的阴性对照,并对其进行十二烷基硫酸钠(SDS)聚丙烯酰胺凝胶电泳。在电泳之后,将分开的抗原转移至硝酸纤维素膜,封闭并用待测试的单克隆抗体来探测。使用抗-小鼠IgG过氧化物酶可检测IgG结合并用ECL底物显影。
抗体与抗原的反应性可进一步通过免疫组织化学以技术人员熟知的方式测试,所述方式为如,使用多聚甲醛或丙酮固定的来自非癌组织或癌组织样品的冰冻切片或用多聚甲醛固定的来自非癌组织或癌组织样品的石蜡包埋组织切片,所述非癌组织或癌组织样品为在常规的手术程序期间从患者获得的,或从携带用自发表达抗原或转染之后表达抗原的细胞系接种的异种移植肿瘤的小鼠获得的。
可测试抗体介导吞噬作用的能力以及杀伤表达CLDN18.2的细胞。体外单克隆抗体活性的测试将在测试体内模型之前提供最初的筛选。
ADCC测试:可将来自健康供体的多形核细胞(PMN)、NK细胞、单核细胞、单核细胞或其它效应细胞通过Ficoll Hypaque密度离心纯化,随后将污染的红细胞裂解。可将洗涤的效应细胞悬浮在补充有10%热灭活的胎牛血清或者补充有5%热灭活的人血清的RPMI中,并与51Cr标记的表达CLDN18.2的靶细胞以效应细胞与靶细胞的不同比率相混合。可选地,可以用荧光增强配体(BATDA)来标记靶细胞。可通过荧光计测量具有从死细胞释放的增强配体的铕的高荧光螯合物。另一替代技术可以利用具有荧光素酶的靶细胞转染。然后,加入的荧光黄仅可被活细胞氧化。接着可以不同浓度加入纯化的抗-CLDN18.2 IgG。可将无关的人IgG用作阴性对照。测定可在37℃进行4至20小时,这取决于使用的效应细胞类型。通过测量51Cr释放或培养物上清液中EuTDA螯合物的存在,可测定样品的细胞溶解。可选地,由荧光黄的氧化引起的发光可为活细胞的量度。还可以以不同组合测试抗-CLDN18.2单克隆抗体,以确定多个单克隆抗体是否增强细胞溶解。
CDC测试:使用多种已知的技术可测试单克隆抗-CLDN18.2抗体介导CDC的能力。例如,血清补体可以以技术人员已知的方式从血液获得。为确定mAb的CDC活性,可使用不同的方法。例如,可测量51Cr释放或可使用碘化丙啶(PI)排除测定评估增加的膜渗透性。简而言之,可洗涤靶细胞,并可将5x 105/ml与不同浓度的mAb在室温或在37℃温育10-30min。然后,可将血清或血浆加入到20%(v/v)的最终浓度并将细胞在37℃温育20-30min。可将来自每一个样品的所有细胞加入到FACS管中的PI溶液中。然后,使用FACSArray,可通过流式细胞术分析立即分析混合物。
在替代测定中,可在贴壁细胞上确定CDC的诱导。在该测定的一个实施方案中,在测定之前24h,在用组织-培养平底微量滴定板中以3x 104个细胞/孔的密度接种细胞。第二天,去除生长培养基并将细胞以一式三份与抗体温育。将对照细胞用生长培养基或含0.2%皂苷的生长培养基温育,分别用于确定背景裂解和最大裂解。在室温温育20min之后,去除上清液并将含20%(v/v)人血浆或血清的DMEM(预温热至37℃)加入到细胞中,并在37℃再温育20min。将来自每一个样品的所有细胞都加入到碘化丙啶溶液(10μg/ml)中。然后,将上清液更换为含有2.5μg/ml溴化乙锭的PBS,并使用Tecan Safire,在600nm处测量在520nm处激发后的荧光发射。如下计算特异性裂解的百分比:特异性裂解%=(荧光样品-荧光背景)/(荧光最大裂解-荧光背景)x 100。
单克隆抗体诱导的凋亡和细胞增殖抑制:为测试引发凋亡的能力,可将单克隆抗-CLDN18.2抗体,例如,与CLDN18.2阳性肿瘤细胞(如SNU-16、DAN-G、KATO-III或CLDN18.2转染的肿瘤细胞)在37℃温育约20小时。可收获细胞,在膜联蛋白-V结合缓冲液(BDbiosciences)中洗涤,并与膜联蛋白-V偶联的FITC或APC(BD biosciences)在暗处温育15min。可将来自每一个样品的所有细胞都加入到在FACS管中的PI溶液(10μg/ml于PBS中),并通过流式细胞术立即评估(如上)。可选地,可用商业上可获得的试剂盒来检测由单克隆抗体对细胞增殖的总体抑制。DELFIA细胞增殖试剂盒(Perkin-Elmer,Cat.No.AD0200)为在微板中增殖细胞的DNA合成期间基于5-溴-2’-脱氧尿苷(BrdU)掺入测量的非同位素免疫测定。使用铕标记的单克隆抗体检测掺入的BrdU。为允许抗体检测,使用Fix溶液将细胞固定并使DNA变性。将未结合的抗体洗掉并加入DELFIA诱导剂以将铕离子从标记的抗体解离至溶液中,在溶液中它们与DELFIA诱导剂的组分形成高荧光螯合物。所测量的荧光-在检测中利用时间分辨荧光测定术-与每个孔的细胞中的DNA合成成比例。
使用CHO稳转细胞(Cell Pool)通过流式方法检测与18.1的交叉反应,抗体CLDN-BC-P1026-hH1为CLDN18.2特异性抗体,不与CLDN18.1反应。
P1026抗体相关信息如下:
细胞株CLDN-BC-P1026-hH1;
来源:抗原免疫全人源小鼠获得。
如本文中所用,术语“细胞”通常指向其中引入载体的细胞,包括许多细胞类型,诸如原核细胞诸如大肠杆菌(Escherichia coli)和枯草芽孢杆菌(Bacillus subtilis)、真菌细胞诸如酵母细胞或曲霉属(Aspergillus)细胞、昆虫细胞诸如S2果蝇细胞或Sf9,或动物细胞诸如成纤维细胞、CHO细胞、COS细胞、NSO细胞、HeLa细胞、BHK细胞、HEK293细胞、MC38细胞或人细胞。
如本文中所用,术语“使得能够表达的条件”通常指使得能够表达本申请的抗体、其抗原结合片段或其变体的条件。在一些实施方案中,使得能够表达的条件包括但不限于孵育时间、温度和培养基,并且可以取决于细胞类型,以及可由本领域普通技术人员容易地确定。在一些实施方案中,在产生本申请的抗体、其抗原结合片段或其变体的过程中,将细胞在培养中生长,并且在可用于生长培养物的任何装置(包括发酵罐)中生长。可将细胞生长成单层或附着至表面。或者,可将细胞悬浮生长。可将细胞在无血清培养基中生长。
如本文中所用,术语“癌症”通常指一组涉及异常细胞生长的疾病,其具有侵入或扩散到身体其它部位的潜力。癌症从根本上说是一种组织生长调节的疾病。为了使正常细胞转化为癌细胞,必须改变调节细胞生长和分化的基因。受影响的基因分为两大类。癌基因是促进细胞生长和繁殖的基因。肿瘤抑制基因是抑制细胞分裂和存活的基因。恶性转化可通过新型癌基因的形成、正常癌基因的不适当过表达或肿瘤抑制基因的表达不足或失活而发生。通常,要将正常细胞转化为癌细胞,需要多个基因的改变。癌症按细胞类型分类,包括癌、肉瘤、淋巴瘤和白血病、生殖细胞肿瘤和母细胞瘤。
如本文中所用,术语“T细胞”通常指在细胞介导的免疫中起核心作用的一种类型的淋巴细胞(白细胞的一种亚型)。通过细胞表面存在的T细胞受体,可以将T细胞与其它淋巴细胞(诸如B细胞和天然杀伤细胞)区分开来。它们被称为T细胞,因为它们在胸腺中从胸腺细胞成熟。大多数人T细胞在细胞受体上重新排列它们的α和β链,并被称为alpha beta T细胞(αβT细胞),是适应性免疫系统的一部分。特化γδT细胞(人体内的一小部分T细胞,在反刍动物中更常见)具有不变的T细胞受体,其多样性有限,能够有效地向其它T细胞呈递抗原,并被认为是先天免疫系统的一部分。
如本文中所用,术语“MC38”细胞是指小鼠结肠癌细胞。MC38小鼠结直肠癌细胞过表达人claudin18.2,模拟高表达claudin18.2的结直肠癌。采用小鼠结直肠癌细胞,是为了尽可能在免疫健全小鼠的背景下模拟人体内情况。
如本文中所用,术语“药学上可接受的赋形剂”通常指与药物施用相容的任何和所有的溶剂、分散介质、包衣、等渗剂和吸收延迟剂等。在一些实施例中,CLDN18.2的赋形剂使其表达稳定或表达增加。在一些实施例中,CLDN18.2表达稳定剂或者表达增加剂为奥沙利铂和/或5-FU。在一些实施例中,优选地,施用CLDN18.2时其表达在癌细胞的细胞表面。进一步地,癌细胞为与claudin18.2相关的癌细胞,例如为实体瘤细胞,例如胃癌细胞,胰腺癌细胞,食管癌细胞,肠癌细胞,肝癌细胞,肺癌细胞等。本申请的CLDN18.2抗体或其抗原结合部分具有体内抗肿瘤效果。
如本文中所用,术语“约”通常是指基于本领域普通技术可以合理推断的给定值的近似值,包括由于该给定值的实验和/或测量条件而产生的等价值和近似值。例如,其可以指比该术语所修饰的值高或低不超过10%的值。例如,术语“约5μg/kg”是指4.5μg/kg至5.5μg/kg的范围。作为另一个实例,“约1小时”意指48分钟到72分钟的范围。
如本文中所用,术语“有效量”通常是指足以提供足够高的浓度以赋予其接受者有益效果的剂量。任何特定受试者的特定治疗有效剂量水平将取决于多种因素,包括所治疗的病症、病症的严重程度、特定组分的活性、施用途径、清除率、治疗持续时间、受试者的年龄、体重、性别、饮食和一般健康状况以及其它相关因素。
如本文中所用,术语“结合特异性”通常指特异性结合(例如,与之免疫反应)给定靶标(同时不结合或基本上不结合非靶标)的能力。本申请的抗体(或其抗原结合片段或变体)可以是单特异性的,并且包含一个或多个特异性结合靶标的结合位点,或者可以是多特异性的(例如双特异性或三特异性),并且包含两个或更多个特异性结合相同或不同靶的结合位点。
如本文中所用,术语“修饰”通常指对多肽的肽骨架(例如氨基酸序列)的任何操作或任何翻译后修饰(例如糖基化)。例如,修饰与相应野生型多肽的序列相比较。修饰可以是一个或多个氨基酸(例如,1、2、3、4、5、6、7、8、9、10个或更多个)的替换、添加和/或缺失。
如本文中所用,术语“氨基酸替换”通常指多肽特定位置处的一个氨基酸被另一个氨基酸替换。
如本文中所用,术语“分离的多核苷酸”通常是指从其天然环境中分离的或人工合成的任何长度的核苷酸(无论是脱氧核糖核苷酸还是核糖核苷酸,或其类似物)的聚合形式。
一方面,本申请提供了可与CLDN18.2结合的抗体、其抗原结合片段或其变体。抗体、其抗原结合片段或其变体可与CLDN18.2特异性结合,并且基本上不与CLDN18.1结合。
在本申请中,优选抗体、其抗原结合片段或其变体保持单体的形式(例如,而二聚体、三聚体或其它多聚体)。
根据本申请的抗体可以选自:单克隆抗体、嵌合抗体、人源化抗体、完全人抗体和双特异性抗体。
根据本申请的抗原结合片段可以选自:Fab片段、Fab’片段、F(ab)
在一些情况下,变体可以是与根据本申请的抗体或其抗原结合片段相异在于一个或多个氨基酸(诸如1-50个、1-40个、1-30个、1-20个、1-15个、1-14个、1-13个、1-12个、1-11个、1-10个、1-9个、1-8个、1-7个、1-6个、1-5个、1-4个、1-3个或1-2个氨基酸)的添加、缺失或替换的多肽。
在一些情况下,变体可以是与根据本申请的抗体或其抗原结合片段具有至少80%(例如,至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或更高)序列同一性的多肽。
在一些情况下,参考抗体包含轻链LCDR1-3和重链HCDR1-3,重链HCDR1可包含如SEQ ID NO:1中所示的氨基酸序列,重链HCDR2可包含如
SEQ ID NO:2中所示的氨基酸序列,重链HCDR3可包含如SEQ ID NO:3中所示的氨基酸序列,轻链LCDR1可包含如SEQ ID NO:4中所示的氨基酸序列,轻链LCDR2可包含如SEQID NO:5中所示的氨基酸序列,轻链LCDR3可包含如SEQ ID NO:6中所示的氨基酸序列。
在一些实施例中,抗CLDN18.2抗体的制备方法为本领域的常规方法。在某些实施方案中,制备的抗体不会在待治疗的动物(例如人类)中引起有害的免疫应答。在一些实施方案中,本发明公开的抗体、抗原结合片段、或衍生物使用本领域公认的技术修饰以降低其免疫原性。例如,抗体可以被人源化、灵长类化、去免疫化或者可以制备嵌合抗体。在一些实施例方案中,本申请的抗体为全人源抗体。
scFv的制备可参见生产单链单元的技术(美国专利4,694,778;Bird,Science242:423-442(1988)、Huston et al.,Proc.Natl.Acad.Sci.USA 55:5879-5883(1988)和Wardet al.,Nature334:544-554(1989)和Nie et al.,Antibody Therapeutics
3(1):18-62(2020))。通过氨基酸桥接Fv区的重链和轻链片段形成单链单元,产生单链融合肽。也可以使用在大肠杆菌中组装功能性Fv片段的技术(Skerra et al.,Science242:1038-1041(1988))。
可用于生产单链Fv(scFv)和抗体的技术的实例包括如美国专利4,946,778和5,258,498,以及Huston et al.,Methods in Enzymology 203:46-88(1991)、Shu et al.,Proc.Natl.Sci.USA90:1995-1999(1993)和Skerra et al.,Science
240:1038-1040(1988)中所述。对于包括在人体内使用抗体和体外检测实验的某些用途,可以使用嵌合抗体、人源化抗体或全人源抗体。嵌合抗体是抗体的不同部分源自不同动物物种的一类分子,例如具有鼠源单克隆抗体的可变区和人源免疫球蛋白恒定区的抗体。生产嵌合抗体的方法是本领域已知的,参见Morrison,Science 229:1202(1985);Oi etal.,BioTechniques 4:214(1986);Gillies et al.,J.Immunol.Methods 125:191-202(1989);Neuberger et al.,Nature
372:604-608(1984);Takeda et al.,Nature314:452-454(1985);和美国专利5,807,715、4,816,567和4,816,397,其全部内容通过引用并入本文。
在一些实施方案中,采用杂交瘤技术来制备以产生本发明的抗体。使用例如杂交瘤方法来制备单克隆抗体,诸如Kohler和Milstein,Nature,256:495(1975)所述。在杂交瘤方法中,通常用免疫剂免疫小鼠、仓鼠或其它合适的宿主动物,以引起淋巴细胞产生或能产生特异性结合免疫剂的抗体。
免疫剂将通常包括蛋白抗原、其片段、或其融合蛋白。通常,如果期望人源细胞,则使用外周血淋巴细胞;如果期望非人哺乳动物源,则使用脾淋巴细胞或淋巴结细胞。在一些实施方案中,采用脾淋巴细胞;然后用适合的融合剂,例如聚乙二醇,将淋巴细胞与永生化细胞系融合,以形成杂交瘤细胞(Goding,MonoclonalAntibodies:Principles andPractice,Academic Press,(1986)第59-103页)。永生化细胞系通常是转化的哺乳动物细胞,特别是啮齿动物、牛和人来源的骨髓瘤细胞。通常,采用大鼠或小鼠骨髓瘤细胞系。在一些实施方案中,采用脾淋巴细胞和小鼠的骨髓瘤细胞进行融合。杂交瘤细胞可在适当的培养基中培养,一些实施方式中培养基含有一种或多种抑制未融合的永生化细胞生长或存活的物质。例如,如果亲本细胞缺乏次黄嘌呤-鸟嘌呤磷酸核糖基转移酶(HGPRT或HPRT),则杂交瘤的培养基通常包括次黄嘌呤、氨基喋呤和胸腺嘧啶(“HAT培养基”),所述物质防止HGPRT-缺陷的细胞生长。在一些实施方案中,杂交瘤细胞所产生的单克隆抗体的结合特异性通过免疫沉淀或通过体外结合测定,如放射性免疫测定(RIA)或酶联免疫吸附测定(ELISA)来测定。此类技术和测定是本领域已知的。单克隆抗体的结合亲和力可例如通过Munson和Pollard,Anal.Biochem.,107:220(1980)的Scatchard分析来测定。此外,在单克隆抗体的治疗应用中,鉴定对靶抗原具有高度特异性和高结合亲和力的抗体是重要的。
在鉴定出期望的杂交瘤细胞之后,可用有限稀释步骤将所述克隆进行亚克隆并用标准方法使其生长(参见Goding,Monoclonal Antibodies:Principles and Practice,Academic Press,(1986)第59-103页)。适用于该目的的培养基包括例如Dulbecco改良的Eagle培养基和RPMI-1640培养基等。
在一些实施方案中,可通过常规技术手段分离或纯化由亚克隆分泌的单克隆抗体,如蛋白A-琼脂糖凝胶、羟基磷灰石层析、凝胶电泳、透析或亲和层析。
单克隆抗体还可通过重组DNA方法制备,例如美国专利No.4,816,567中所述。编码本文所述单克隆抗体的DNA可使用常规方法来分离和测序(例如,通过使用能够与抗体的重链和轻链的基因特异性结合的寡核苷酸探针)。编码本文所述抗体的DNA还可以按常规方法根据抗体序列设计合成。将分离或合成的DNA插入表达载体中,然后将其转染到宿主细胞例如不另外产生免疫球蛋白的中国仓鼠卵巢(CHO)细胞、人胚胎肾(HEK)293细胞、猿COS细胞、PER.NS0细胞、SP2/0、YB2/0或骨髓瘤细胞中,从而在重组宿主细胞中获得合成的单克隆抗体。
在一些实施方案中,采用杂交瘤技术来制备以产生本发明的抗体或其抗原结合片段,使用含有CLDN18.2的蛋白制剂免疫小鼠,免疫后去小鼠的脾淋巴细胞与骨髓瘤细胞进行融合,通过CLDN18.2蛋白对杂交瘤进行筛选,并对阳性的杂交瘤进行有限稀释,进一步亚克隆,再次鉴定杂交瘤株与CLDN18.2蛋白的结合能力,以制备产生抗CLDN18.2抗体。在一些实施方案中,小鼠为6-8周龄的雌性Balb/c小鼠。
本发明公开的抗体或抗原结合片段的结合特异性可以通过体外实验,例如免疫共沉淀、放射免疫实验(RIA)或酶联免疫吸附实验(ELISA)来检测。
对于包括在人体内使用抗体和体外检测实验的某些用途,一些实施方式中可以使用嵌合抗体、人源化抗体或全人源抗体。嵌合抗体是抗体的不同部分源自不同动物物种的一类分子,例如具有鼠源单克隆抗体的可变区和人源免疫球蛋白恒定区的抗体。生产嵌合抗体的方法是本领域已知的,参见Morrison,Science 229:1202(1985);Oi et al.,BioTechniques4:214(1986)、Gillies et al.,J.Immunol.Methods 125:191-202(1989)和美国专利5,807,715、4,816,567和4,816397,其全部内容通过引用并入本文。
还可以转基因小鼠来生产全人源抗体,所述小鼠不能表达功能性内源性免疫球蛋白但能表达人类免疫球蛋白基因。例如,人重链和轻链免疫球蛋白基因复合物可以随机引入或通过同源重组引入到小鼠胚胎干细胞。或者,除了人重链和轻链基因之外,还可以将人的可变区、恒定区和多样性区域引入小鼠胚胎干细胞中。小鼠重链和轻链的免疫球蛋白基因可以通过同源重组引入人免疫球蛋白基因座而丧失功能。特别地,JH区域的纯合缺失可以防止内源抗体的产生。将修饰过的胚胎干细胞扩增并显微注射进囊胚中以产生嵌合小鼠。然后培育嵌合小鼠以产生表达人源抗体的纯合后代。用选择出的抗原例如全部或部分期望的多肽靶点以常规方式免疫转基因小鼠。可以使用常规杂交瘤技术从免疫的转基因小鼠获得靶向抗原的单克隆抗体。转基因小鼠携带的人免疫球蛋白转基因在B细胞分化过程中重排,随后发生类别转换和体细胞突变。因此,使用这种技术可以产生可用于治疗的IgG、IgA、IgM和IgE抗体。在本申请中,抗CLDN18.2抗体可以是全人源抗体。
在另一些实施方案中,使用常规方法(例如使用能够特异性结合编码鼠抗体重链和轻链的基因的寡核苷酸探针),可以容易地分离编码所需单克隆抗体的DNA并对其进行测序。一旦分离出来,DNA可以被置于表达载体中,然后被转染到原核或真核宿主细胞如大肠杆菌细胞、猿猴COS细胞、中国仓鼠卵巢(CHO)细胞或不另外产生免疫球蛋白的骨髓瘤细胞中。分离的DNA(如本文所述可以是合成的)也可用于制备抗体的恒定区和可变区的序列,如美国专利5,658,570中所述,其全部内容通过引用并入本文。该方法从所选细胞中提取RNA并转化成cDNA,然后使用Ig特异性引物通过PCR技术进行扩增。适于此目的的合适的探针在美国专利5,658,570中也有所提及。
此外,使用常规重组DNA技术,可将本发明的抗体或抗原结合片段的一个或多个CDR插入框架区,例如插入到人类框架区以构建人源化非全人源抗体。框架区可以是天然存在的或共有的框架区,优选人类框架区(参见Chothia et al.,J.Mol.Biol.278:457-479(1998),其列出一系列人类框架区)。一些多核苷酸可以编码框架区和CDR组合产生的与目标抗原的至少一个表位特异性结合的抗体。在框架区内进行一个或多个氨基酸取代,可以选择能够改善抗体与其抗原结合的氨基酸取代。另外,可用此法进行参与链间二硫键形成的一个或多个可变区中半胱氨酸残基的取代或缺失,从而产生缺少一个或多个链间二硫键的抗体分子。本领域技术范围内的对多核苷酸进行的其他改变也涵盖于本发明中。
此外,在Newman,Biotechnology 10:1455-1460(1992)中公开了另一种生产重组抗体的高效方法,特别地,该技术能产生含有猴可变区和人恒定区序列的灵长类抗体,该参考文献的全部内容通过引用并入本文。此外,该技术也在共同转让的美国专利5,658,570、5,693,780和5,756,096中有所提及,每个专利的全部内容通过引用并入本文。
抗体可以通过使用常规重组DNA技术制备。使用本领域技术人员公知的技术可以选择、构建和培养生产抗体的载体及细胞系等。这些技术在各种实验室手册和主要出版物中均有描述,例如Recombinant DNA Technology for Production of ProteinTherapeutics in Cultured Mammalian Cells,D.L.Hacker,F.M.Wurm,in ReferenceModule in Life Sciences,2017,其全部内容包括补充内容通过引用并入全文。
在一些实施方案中,可以按常规方法根据本文所述抗体氨基酸序列设计合成编码抗体的DNA,将其置入表达载体中,然后转染宿主细胞,在培养基中培养被转染的宿主细胞产生单克隆抗体。在一些实施方案中,表达抗体载体包括至少一个启动子元件,抗体编码序列,转录终止信号和polyA尾。其他元件包括增强子,Kozak序列及插入序列两侧RNA剪接的供体和受体位点。可以通过SV40的前期和后期启动子,来自逆转录病毒的长末端重复序列如RSV、HTLV1、HIVI及巨细胞病毒的早期启动子来获得高效的转录,也可应用其它一些细胞的启动子如肌动蛋白启动子。合适的表达载体可包括pIRES1neo,pRetro-Off,pRetro-On,PLXSN,或者Plncx,pcDNA3.1(+/-),pcDNA/Zeo(+/-),pcDNA3.1/Hygro(+/-),PSVL,PMSG,pRSVcat,pSV2dhfr,pBC12MI和pCS2等。常使用的哺乳动物宿主细胞包括293细胞、Cos1细胞、Cos7细胞、CV1细胞、鼠L细胞和CHO细胞等。
在一些实施方案中,插入基因片段需含有筛选标记,常见的筛选标记包括二氢叶酸还原酶、谷氨酰胺合成酶、新霉素抗性、潮霉素抗性等筛选基因,以便于转染成功的细胞的筛选分离。将构建好的质粒转染到无上述基因的宿主细胞,经过选择性培养基培养,转染成功的细胞大量生长,产生想要获得的目的蛋白。
此外,可以使用本领域技术人员已知的标准技术在编码本发明所述抗体的核苷酸序列中引入突变,包括但不限于导致氨基酸取代的定点突变和PCR介导的突变。变体(包括衍生物)编码相对于原重链可变区和轻链可变区来说少于50个氨基酸的取代、少于40个氨基酸的替换、少于30个氨基酸的取代、少于25个氨基酸的取代、少于20个氨基酸的取代、少于15个氨基酸的取代、少于10个氨基酸的取代、少于5个氨基酸的取代、少于4个氨基酸的取代、少于3个氨基酸的取代或少于2个氨基酸的取代。或者可以沿着全部或部分编码序列时随机引入突变,例如通过饱和突变,以及可以筛选所得突变体的生物活性以鉴定保留活性的突变体。
本发明还提供了抗CLDN18.2抗体或抗原结合片段为主要成分的药物或者组合物的用途及施用方法。在一些实施方案中,提供了用于治疗或改善各种类型的癌症或肿瘤等相关疾病的方法,所述方法包括向有需要的患者施用有效剂量的抗CLDN18.2抗体或抗原结合片段。在一些实施方案中,提供了抗CLDN18.2抗体或抗原结合片段在用于治疗或改善癌症或肿瘤等相关疾病中的应用。在一些实施方案中,提供了所述抗CLDN18.2抗体或抗原结合片段在制备用于治疗或改善癌症或肿瘤等相关疾病的药物中的应用。
对于任何特定患者的具体剂量和治疗方案将取决于各种因素,包括所使用的特定抗体、抗原结合片段或衍生物、患者的年龄和体重、一般健康状况、性别和饮食,以及给药时间、排泄频率、药物组合,以及所治疗的特定疾病的严重程度。由包括在本领域普通技术人员范围内的医疗护理人员对这些因素进行判断。所述剂量还将取决于待治疗的个体患者、给药途径、制剂类型、所用化合物的特性、疾病的严重程度以及所需的效果。所用剂量可以通过本领域熟知的药理学和药代动力学原理确定。例如,在一些实施方案中,本发明抗体施用于患者的剂量为每次0.01mg/kg至100mg/kg患者体重;在一些实施方案中,每1星期、2星期、3星期、或每月给药一次。
抗体及其抗原结合片段的施用方法包括但不限于真皮内、肌肉、腹腔、静脉、皮下、鼻腔、硬脊膜外注射和口服。抗体、抗原结合片段或组合物可以通过任何方便的途径施用,例如通过输注或推注,通过上皮或皮肤粘膜(例如口腔粘膜、直肠和肠粘膜等)吸收,并且可以与其他生物活性剂共同施用。因此,含有本发明的抗体、抗原结合片段的药物组合物可以口服给药、直肠给药、肠胃外给药、脑池内给药、阴道内给药、腹腔内给药、外敷(如通过粉末,软膏,滴剂或透皮贴剂)、口腔给药或通过口服或鼻腔喷雾给药。
本发明使用的术语“肠胃外”是指包括静脉内、肌肉内、腹腔内、胸骨内、皮下和关节内注射和输注的施用方式。
施用方式可以是全身施用或局部施用。
本发明抗体、抗原结合片段或药物组合物可以局部施用于需要治疗的区域;可以通过但不限于以下方式:手术期间局部输注,例如与手术后伤口敷料联合的局部应用,通过注射,通过导管,借助栓剂或借助植入物来实现,所述植入物是多孔的、无孔的或凝胶状的材料,包括膜(例如硅橡胶膜)或纤维。一些实施方式中,当施用本发明的蛋白质(包括抗体)时,必须注意使用不吸收蛋白质的材料。
在一些实施方案中,本发明组合物包含编码抗体的核酸或多聚核苷酸,可以通过将其构建为合适的核酸表达载体的一部分来体内施用所述核酸以促进其编码的蛋白质的表达,然后通过下述方式施用上述部分载体使其变为胞内部分,例如通过使用逆转录病毒载体(参见美国专利4,980,286),或通过直接注射,或通过使用微粒轰击(例如基因枪;Biolistic,Dupont),或用脂质或细胞表面受体或转染试剂包被,或者通过与已知进入细胞核的同源异型盒类肽连接施用(参见例如Joliot et al.,1991,Proc.Natl.Acad.Sci.USA88:1864-1868)等等。可选地,核酸可以通过同源重组在引入细胞内并整合至宿主细胞DNA中用于表达。
通常在进行体外测试用于治疗疾病的方法,包括施用本发明所述抗体、抗原结合片段或衍生物,然后在可接受的动物模型中体内测试期望的治疗性或预防性活性,最后施用于人体。合适的动物模型(包括转基因动物)是本领域普通技术人员所公知的。例如,用于证明本发明所述抗体或抗原结合片段的治疗用途的体外测定包括抗体或抗原结合片段对细胞系或患者组织样品的影响。抗体或抗原结合片段对细胞系和/或组织样品的作用可以利用本领域技术人员已知的技术进行检测,例如本发明其他部分公开的技术。根据本发明的内容,可用于确定是否施用特异性抗体或抗原结合片段的体外测定实验包括体外细胞培养实验,其中患者组织样品在培养物中培养,并暴露于或以其他方式施用化合物,并观察这种化合物对组织样品的影响。
各种已知输送系统可用于施用本发明抗体或编码本发明抗体的多核苷酸,例如包封于脂质体、微粒、微胶囊、能够表达所述化合物的重组细胞、受体介导的内吞作用(参见例如Wu andWu,1987,J.Biol.Chem.262:4429-4432)、作为逆转录病毒或其它载体的一部分的核酸的构建等。
在一些实施例中,在一些实施方案中,本申请的抗体或抗原结合片段与其他治疗方法联合使用。本发明抗CLDN18.2抗体或抗原结合片段可以结合其它治疗或预防方案,包括施用一种或多种本发明抗体或抗原结合片段以及一种或多种其它治疗剂或方法一起使用或组合使用。在一些实施方案中,其他治疗方案包括但不限于放射疗法、化学疗法、激素疗法等。对于组合治疗,抗体可以与其它治疗剂可同时或分开施用。当分开施用时,可以在施用另一种其它治疗剂之前或之后施用本发明抗体。
在一些实施方案中,本发明抗体与化疗剂组合施用。在一些实施方案中,可与本发明抗体一起施用的化疗剂包括但不限于卡铂(伯尔定)、顺铂(顺铂,顺铂-AQ)、环磷酰胺(癌得星,环磷酰胺)、多西他赛(泰素帝)、阿霉素(亚德里亚霉素)、埃罗替尼(特罗凯)、依托泊苷(凡毕士)、氟尿嘧啶(5-FU)、吉西他滨(健择)、甲磺酸伊马替尼(格列卫)、伊立替康(伊立替康)、甲氨蝶呤(重氮片,氨甲喋呤钠,甲氨蝶呤)、紫杉醇(Taxol,Abraxane)、索拉菲尼(多吉美)、舒尼替尼(索坦)、拓扑替康(Hycamtin)、长春新碱(Oncovin,Vincasar PFS)和长春花碱(Velban)。
在一些实施方案中,本发明抗体与细胞因子、趋化因子或共刺激分子组合施用。在一些实施方案中,可与本发明抗体一起施用的细胞因子、趋化因子或共刺激分子包括但不限于CCR7、CCL19、CCL21、CCL2、CCL3、CCL5、CCL16、CXCR4、CXCR7、CXCL12,白细胞介素(例如IL-1-IL17)、干扰素(例如IFNα1、IFNα8、IFNα10、IFNα13、IFNα14、IFNα16、IFNα17、IFNα21、IFNβ1、IFNW、IFNE1和IFNK)、血细胞生成因子、TGFs(例如TGF-α、TGF-β、和TGF家族的其他成员),4-1BB、4-1BB-L、CD137、CD137L、CTLA-4GITR,GITRL、Fas、Fas-L、TNFR1、TRAIL-R1、TRAIL-R2、p75NGF-R、DR6、RANK、EDAR1、XEDAR、Fn114、Troy/Trade、TAJ、TNFRII、HVEM、CD27、CD30,CD40、4-1BB、OX40、GITR、GITRL、TACI、BAFF-R、BCMA、RELT、CD95(Fas/APO-1)、糖皮质激素诱导的TNFR相关蛋白、TNF受体相关凋亡介导蛋白(TRAMP)和死亡受体-6(DR6)等。
在一些实施方案中,本申请的抗体与免疫治疗剂联合施用。在一些实施方案中,可与本发明抗体一起施用的免疫治疗剂包括但不限于阿巴伏单抗(CA-125),阿昔单抗(CD41),阿德木单抗(EpCAM),阿夫土单抗(CD20),培化阿珠单抗(VEGFR2),喷替酸阿妥莫单抗(CEA),Amatuxi单抗(MORAb-009),马安那莫单抗(TAG-72),阿伯珠单抗(HLA-DR),阿西莫单抗(CEA),巴维昔单抗(磷脂酰丝氨酸),贝妥莫单抗(CD22),贝利木单抗(BAFF),贝伐单抗(VEGF-A),比伐单抗(CD44 v6),兰妥莫单抗(CD19),Brentuximab vedotin(CD30TNFRSF8),美坎珠单抗(黏蛋白CanAg),Cantuzumabravtansine(MUC1),卡罗单抗喷他肽(前列腺癌细胞),Carlu单抗(CNTO888),卡妥索单抗(EpCAM,CD3),西妥昔单抗(EGFR),泊西他珠单抗(EpCAM),西妥木单抗(IGF-1受体),克立昔单抗(紧密连接蛋白),Clivatuzumabtetraxetan(MUC1),可那木单抗(TRAIL-R2),达西珠单抗(CD40),Dalotuzumab(胰岛素样生长因子I受体),地诺单抗(RANKL),地莫单抗(B淋巴瘤细胞),达西珠单抗(DR5),依美昔单抗(GD3神经节苷脂),依夫洛昔单抗(EpCAM),Elotuzu单抗(SLAMF7),Enavatuzu单抗(PDL192),Ensituxi单抗(NPC-1C),依帕珠单抗(CD22),厄马索单抗(HER2/neu,CD3),伊瑞西珠单抗(整合素αvβ3),Farletuzu单抗(叶酸受体1),FBTA05(CD20),Ficlatuzu单抗(SCH900105),芬妥木单抗(IGF-1受体),Flanvotu单抗(糖蛋白75),夫苏木单抗(TGF-β),加利昔单抗(CD80),Ganitu单抗(IGF-I),吉妥单抗(CD33),Gevokizu单抗(IL-1β),Girentuxi单抗(碳酸酐酶9(CA-IX)),替伊莫单抗(CD20),Icrucumab(VEGFR-1),伊戈伏单抗(CA-125),Indatuximabravtansine(SDC1),Intetumu单抗(CD51),伊珠单抗奥佐米星(CD22),伊匹木单抗(CD152),伊妥木单抗(CD30),拉贝珠单抗(CEA),来沙木单抗(TRAIL-R2),利韦单抗(乙型肝炎表面抗原),林妥珠单抗(CD33),Lorvotuzumab mertansine(CD56),鲁卡木单抗(CD40),鲁昔单抗(CD23),马帕木单抗(TRAIL-R1),马妥珠单抗(EGFR),美泊利单抗(IL-5),米拉珠单抗(CD74),米妥莫单抗(GD3神经节苷脂),Mogamulizu单抗(CCR4),Moxetumo单抗pasudotox(CD22),他那可单抗(C242抗原),他那莫单抗(5T4),Narnatu单抗(RON),Necitumu单抗(EGFR),尼妥珠单抗(EGFR),Nivolu单抗(IgG4),奥法木单抗(CD20),Olaratu单抗(PDGF-Rα),Onartuzu单抗(人离散因子受体激酶),莫奥珠单抗(EpCAM),奥戈伏单抗(CA-125),Oxelu单抗(OX-40),帕尼单抗(EGFR),Patritu单抗(HER3),Pemtumo单抗(MUC1),帕妥珠单抗(HER2/neu),平妥莫单抗(腺癌抗原),普托木单抗(波形蛋白),Racotumo单抗(N-羟乙酰神经氨酸),Radretu单抗(纤连蛋白外结构域-B),雷韦单抗(狂犬病病毒糖蛋白),雷莫芦单抗(VEGFR2),利妥木单抗(HGF),利妥昔单抗(CD20),罗妥木单抗(IGF-1受体),Samalizu单抗(CD200),西罗珠单抗(FAP),Siltuxi单抗(IL-6),Tabalu单抗(BAFF),他珠单抗(α-甲胎蛋白),帕他莫单抗(CD19),替妥莫单抗(固生蛋白C),Teprotumu单抗(CD221),替西木单抗(CTLA-4),替加珠单抗(TRAIL-R2),TNX-650(IL-13),托西莫单抗(CD20),曲妥珠单抗(HER2/neu),TRBS07(GD2),曲美木单抗(CTLA-4),西莫白介素单抗(EpCAM),Ublituxi单抗(MS4A1),Urelu单抗(4-1BB),伏洛昔单抗(整合素α5β1)。
在一些实施例中,本申请涉及一种抗体药物偶联物,其包含与药物偶联的特异性结合CLDN18.2的抗体、其抗原结合片段或其变体,所述抗体、其抗原结合片段或其变体包括重链可变区和轻链可变区,其中:所述重链可变区包含如SEQ ID NO.1所示的HCDR1、如SEQID NO.2所示的HCDR2、以及如SEQ ID NO.3所示的HCDR3;以及所述轻链可变区包含如SEQID NO.4所示的LCDR1、如SEQ ID NO.5所示的LCDR2、以及如SEQ ID NO.6所示的LCDR3。
其中所述抗体、其抗原结合片段或其变体进一步包括:SEQ ID NO.7所示的重链可变区;以及SEQ ID NO.8所示的轻链可变区。所述抗体或其抗原结合部分选自以下组:全抗体、双特异性抗体、单克隆抗体、嵌合抗体、人源化抗体和全人源抗体。其中所述抗体、其抗原结合片段或其变体其进一步包括重链恒定区和轻链恒定区,其中:所述抗体重链恒定区选自IgG系列抗体;轻链恒定区选自κ或λ链。
在一些实施例中,抗体药物偶联物的分子式为:Ab-[L-D]n,其中Ab表示抗CLDN18.2抗体、其抗原结合片段或其变体,L表示连接子,D表示药物,n表示相对于每一分子Ab的药物平均连接数。其中所述药物D为细胞毒性剂或者细胞增殖抑制剂。所述药物选自卡其霉素类、倍癌霉素类、安曲霉素类衍生物PBD、喜树碱类衍生物、海兔毒素及澳瑞他汀类、美登素及其衍生物中的一种或者多种。
在一些实施例中,进一步地,所述药物选自MMAF、MMAE、MMAD、PBD、杜卡霉素、细胞松驰素B、短杆菌肽D、溴化乙锭、吐根碱、丝裂霉素、依托泊苷(etoposide)、替尼泊苷(tenoposide)、长春新碱、长春碱、秋水仙碱、阿霉素、道诺霉素(daunorubicin)、二羟基炭疽菌素(dihydroxy anthracin)、美登木素生物碱(maytansinoids,诸如DM-1和DM-4)、二酮、米托蒽醌(mitoxantrone)、光神霉素、放线菌素D、1-去氢睾酮、糖皮质激素、普鲁卡因(procaine)、丁卡因(tetracaine)、利多卡因(lidocaine)、普萘洛尔(propranolol)、嘌呤霉素、表柔比星(epirubicin)和环磷酰胺及其类似物中的一个或者多个。
在一些实施例中,所述连接子L为半胱氨酸偶联连接子、赖氨酸偶联连接子、缬氨酸-瓜氨酸(Val-Cit,vc)连接子、SPDB连接子、SMCC连接子、SMAC(sortasemediatedantibody conjugation technology)连接子。
根据本申请公开的序列表及本领域常规技术手段即可获得本申请的免疫抗原、抗CLDN18.2抗体,此处不再赘述。以下将通过具体实施例对本申请的抗体或抗原结合片段进行描述。
实施例1抗CLDN18.2抗体的制备
本申请的抗CLDN18.2抗体通过CHO细胞偏好性进行密码子优化,分别合成轻重链序列,将重链连接至PEE12.4表达载体上,轻链连接至PEE6.4表达载体上,测序正确后提取质粒,利用Expi CHO-S
表1抗CLDN18.2抗体P1026的氨基酸序列
在本申请中不再赘述生产抗体的方法。
实施例2抗CLDN18.2抗体的检测
利用流式细胞法,检测抗CLDN18.2抗体对表达CLDN18.2细胞的结合能力,并进一步检测其不结合CLDN18.1的特异性。进一步地,对抗CLDN18.2抗体进行种属交叉检测。
实验步骤概况如下:
1.亲和力检测
分别将阳性对照抗体、待测抗体稀释至20μg/mL,取适量CLDN18.2和CLDN18.1过表达细胞,分装至96孔板,将适量抗体加入每个孔使其终浓度为10μg/mL,4℃孵育30min后,PBS洗涤2次,加入适量1:5000比例稀释的anti-human IgG Fc AF647荧光二抗,4℃孵育30min后,PBS洗涤2次,加入适量PBS,流式细胞仪检测结合信号。同时实验设置CHO-S以及NC空白对照。采用FlowJo分析各抗体分别结合CLDN18.2和CLDN18.1的活性,优选特异性结合CLDN18.2抗体进入下一步EC50检测及种属交叉检测和亲和力检测。
图1是根据本发明一个实施例的人源CLDN18.2和CLDN18.1特异性检测;其中横坐标为Anti-hIgG-Fc-AF647荧光强度,检测抗体和CLDN18.1及CLDN18.2的结合强度;纵坐标SSC-H为细胞的偏向色散,检测细胞的复杂程度。如图1所,全人源抗体P1026(CLDN18.2的特异性结合抗体)只结合CLDN18.2且不结合CLDN18.1。
2.活性检测
分别将阳性对照抗体、待测抗体稀释至20μg/mL,取适量人源、鼠源和猴源CLDN18.2过表达细胞CLDN18.2细胞和人源CLDN18.1过表达细胞,分装至96孔板,将适量抗体加入每个孔使其终浓度为10μg/mL,4℃孵育30min后,PBS洗涤2次,加入适量1:5000比例稀释的anti-human IgG Fc AF647荧光二抗,4℃孵育30min后,PBS洗涤2次,加入适量PBS,流式细胞仪检测结合信号。同时实验设置CHO-S以及NC空白对照。采用FlowJo分析各抗体分别结合人源、鼠源和猴源CLDN18.2和CLDN18.1的活性。
图2是根据本发明一个实施例的抗体种属交叉结果检测,其中横坐标为Anti-hIgG-Fc-AF647荧光强度,检测抗体和CLDN18.2的结合强度;纵坐标SSC-H为细胞的偏向色散,检测细胞的复杂程度。如图2所示,全人源抗体P1026(CLDN18.2的特异性结合抗体)只结合CLDN18.2且不结合CLDN18.1;全人源抗体P1026可结合人、小鼠及食蟹猴的CLDN18.2,其结合效果与已知的CLDN18.2抑制剂Zolbetuximab(IMAB362)相当。
3.结合力检测
分别将阳性对照抗体、待测抗体稀释梯度稀释;取适量CLDN18.2过表达细胞,分装至96孔板,将适量抗体加入每个孔,4℃孵育30min后,PBS洗涤2次,加入适量1:5000比例稀释的anti-human IgG Fc AF647荧光二抗,4℃孵育30min后,PBS洗涤2次,加入适量PBS,流式细胞仪检测结合信号。同时实验设置CHO-S以及NC空白对照。采用FlowJo分析各抗体结合CLDN18.2的MFI,将MFI导入至GraphPad Prism分析,获得各抗体结合CLDN18.2的EC
图3是根据本发明一个实施例的抗体结合能力检测;其中横坐标为抗体浓度,纵坐标为平均荧光强度;表2是根据本申请一个实施例的抗体结合力和亲和力检测数据。如图3及表2所示,相比于已知的CLDN18.2抑制剂IMAB362,本申请的全人源抗CLDN18.2抗体P1026具有更强的结合力和亲和力。
表2全人源抗CLDN18.2抗体结合力和亲和力检测数据
实施例3抗CLDN18.2抗体的ADCC活性(antibody dependent cell-mediatedcytotoxicity)
本实验选择ADCC Reporter Bioassay评价CLDN18.2抗体的ADCC活性。这是一种生物发光报告基因检测系统,以人工构建的效应细胞替代NK细胞,配合高灵敏度的检测试剂,可定量基于ADCC作用机制的治疗性抗体药在其活化途径中的生物活性,是一种作用机制检测法。
取对数生长期靶细胞MC38-hCLDN18.2及效应细胞FcR-TANK进行细胞计数,分别调整细胞密度为4×10
孵育结束前45min,向靶细胞最大释放孔中加入1×裂解液,混匀后,继续培养45min。孵育结束后,取出培养板,吸取50μL上清液于新的酶标板中,每孔加入50μL的LDH检测液,轻拍孔板,混匀后,室温避光孵育10-30min。每孔再加入50μL终止液,轻拍孔板混匀。酶标仪分别读取OD
其中,
实验值(Experimental):实验孔增量值–培养基对照孔增量值
靶细胞自发值(Target Spontaneous):靶细胞自发放孔增量值–培养基对照孔增量值
效应细胞自发值(Effector Spontaneous):效应细胞自发释放孔增量值–培养基对照孔增量值
靶细胞最大值(Target Maximum):靶细胞最大释放孔增量值–等体积对照孔增量值
使用Graphpadprism作曲线图,并进行数据非线性拟合,拟合方式[Agonist]vs.response--Variable slope(four parameters),得到受试品的EC
图4是根据本申请一个实施例的CLDN18.2抗体对过表达人claudin18.2的MC38细胞的ADCC活性。表3显示了CLDN18.2抗体对过表达人claudin18.2的MC38细胞的ADCC活性。其中,IMAB362-IgG1作为抗体阳性对照。如图4和表3所示,抗体P1026具有很强的ADCC作用,且抗体P1026比阳性抗体CLN-zolbetuximab-IgG1的ADCC效应强。
表3 CLDN18.2抗体对过表达人claudin18.2的MC38细胞的ADCC活性
实施例4抗CLDN18.2抗体的CDC活性(complement dependent cytoxicity)
取对数生长期的靶细胞5×10
孵育结束后,取出培养板,酶标仪检测560/590nm各孔荧光值。按照下列公式计算细胞毒性(Cytotoxicity)%:
其中,
Flu s:为实验孔的荧光值(即为加细胞、加不同浓度受试品孔);
Flu c:为实验对照孔荧光值的平均值(即为加细胞、加培养基孔,不加受试品);
Flu b:为空白孔的荧光值的平均值(即为只加培养基孔,不加细胞和受试品)。
使用Graphpadprism作曲线图,并进行数据非线性拟合,拟合方式[Agonist]vs.response--Variable slope(four parameters),得到受试品的EC
IMAB362-IgG1作为阳性抗体对照。
图5是根据本申请一个实施例的CLDN18.2抗体对过表达人claudin18.2的MC38细胞的CDC活性。表4显示了CLDN18.2抗体对过表达人claudin18.2的MC38细胞的CDC活性。如图5和表4所示,抗体P1026在补体存在的情况下存在显著的CDC效应。
表4CLDN18.2抗体对过表达人claudin18.2的MC38细胞的CDC活性
实施例5抗CLDN18.2抗体的內吞活性
将CHO-S-hCLDN18.2细胞分别与终浓度为10nM的待测CDLN18.2抗体、10nM的阴性对照hIgG1以及对照IMAB362抗体(以上抗体均pHAb染料标记)混合,37℃分别孵育0hr、1hr、4hr、8hr,流式细胞仪采集不同时间处理后的细胞内吞数据。采用FlowJo X10.0.7分析并导出不同时间处理下CLDN18.2抗体和hIgG1与CHO-S-hCLDN18.2细胞表面表达的CLDN18.2结合后内吞进细胞中发出荧光的比例。使用GraphPad Prism 7.00对数据进行处理分析,绘制内吞曲线。
图6为根据本申请一个实施例的抗CLDN18.2抗体P1026的內吞活性曲线。如图6所示,相比于IMAB362,P1026可更快速的显示出內吞活性,1小时内的內吞活性即接近40,远高于IMAB362及阴性对照(NC)。
实施例6抗CLDN18.2抗体药物偶联物的体内抗肿瘤效果
在本实施例中,瞬转表达制备P1026样品,并采用VC-MMAE连接子和毒素进行偶联,并开展体内药效评价。
抗体药物偶联物制备方法
(1)将连接子-细胞毒药物(VC-MMAE)溶于二甲基亚砜,得到连接子-细胞毒药物储备液;
(2)将还原剂溶于缓冲液中,配置还原剂储备液,
(3)将P1026裸抗样品与所述步骤(2)中的还原剂缓冲液进行还原反应1-2h,得到抗体还原后的溶液;
(4)将所述步骤(1)中的连接子-细胞毒药物储备液滴加到抗体还原后的溶液中,进行加成反应1-2h,得到抗体偶联药物。
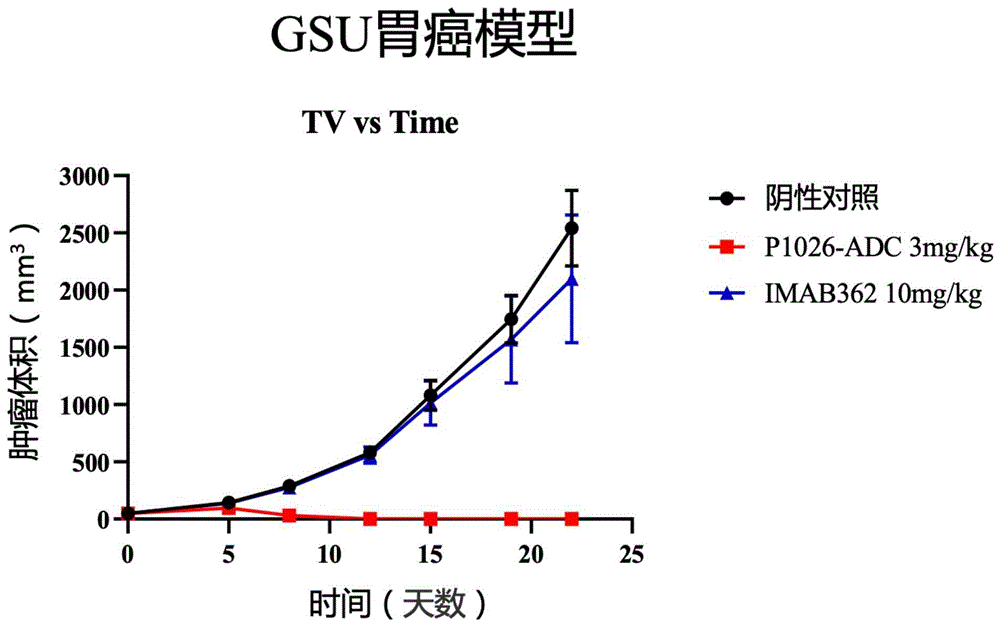
1.GSU胃癌模型
GSU人胃癌肿瘤细胞来源于ATCC,用含有灭活的10%胎牛血清,100U/ml的青霉素以及2mM谷氨酰胺的RPMI-1640培养基在37℃、5% CO
将GSU肿瘤细胞用PBS调整至浓度为5×10
分组后每周使用游标卡尺对肿瘤体积进行2次测量,安乐死前测量肿瘤体积,测量肿瘤的长径和短径,其体积计算公式为:肿瘤体积=0.5×长径×短径2。末次给药后,对实验动物体重及肿瘤生长状态继续观察7天,观察期间,每周测量两次肿瘤体积及动物体重,并记录测量值。完成观察后,结束实验。
图7A为根据本申请一个实施例的抗体药物偶联物P1026-ADC的GSU胃癌模型抗肿瘤效果。表5-1为根据本申请一个实施例的抗体药物偶联物P1026-ADC的GSU胃癌模型抗肿瘤效果。如图7A及表5-1所示,3mg/kg的本申请抗体药物偶联物即可使得肿瘤体积减小至消失,效果远好于现有的抗胃癌肿瘤药物IMAB362。
表5-1P1026-ADC在GSU胃癌模型中的抗肿瘤效果
GAS076为人源胃癌的病人组织异种移植模型(PDX),其肿瘤组织在小鼠体内进行传代,当皮下肿瘤体积长到500-1000mm
当平均肿瘤体积达到120-130mm
分组后每周使用游标卡尺对肿瘤体积进行2次测量,安乐死前测量肿瘤体积,测量肿瘤的长径和短径,其体积计算公式为:肿瘤体积=0.5×长径×短径2。末次给药后,对实验动物体重及肿瘤生长状态继续观察7天,观察期间,每周测量两次肿瘤体积及动物体重,并记录测量值。完成观察后,结束实验。
图7B为根据本申请一个实施例的抗体药物偶联物P1026-ADC的胃癌PDX模型抗肿瘤效果。表5-2为根据本申请一个实施例的抗体药物偶联物P1026-ADC的胃癌PDX模型抗肿瘤效果。如图7B及表5-2所示,P1026-ADC抗肿瘤效果远好于现有的抗胃癌肿瘤药物IMAB362。甚至当P1026-ADC使用10mg/kg时,可使得肿瘤体积减小至消失。
表5-2ADC在胃癌PDX模型中的抗肿瘤效果
上述实施例仅供说明本发明之用,而并非是对本发明的限制,有关技术领域的普通技术人员,在不脱离本发明范围的情况下,还可以做出各种变化和变型,因此,所有等同的技术方案也应属于本发明公开的范畴。
- 一种靶向于EGFR的抗体-药物偶联物及其制备方法与应用
- 一种靶向B7-H3的抗体药物偶联物、其制备方法及应用
