用于治疗癌症的组合物和方法
文献发布时间:2023-06-19 19:30:30
相关申请的交叉引用
本申请要求于2020年4月14日提交的美国临时申请第63/009,569号的优先权和权益。本申请的内容通过引用整体并入本文。
技术领域
本公开涉及分子生物学,并且更具体涉及嵌合抗原受体、含有一个或多个CAR的转座子,以及制备和使用所述嵌合抗原受体、含有一个或多个CAR的转座子的方法。
序列表的并入
创建于2021年4月13日的大小为54.6KB的命名为“POTH-057_001WO_SequenceListing.txt”的文本文件的内容以全文引用的方式特此并入。
背景技术
本领域长期以来但尚未满足的需求是,不使用传统抗体序列或其片段来指导免疫细胞的特异性的方法。本公开提供了一种优良的嵌合抗原受体。
发明内容
本公开提供一种治疗癌症的方法,所述方法包括向受试者施用:第一组合物,所述第一组合物包括表达嵌合抗原受体(CAR)的T细胞群,其中所述CAR包括与B细胞成熟抗原(BCMA)特异性结合的抗原识别结构域;以及第二组合物,所述第二组合物包括抗CD20剂。在一些实施例中,所述方法进一步包括第三组合物,所述第三组合物包括至少一种淋巴细胞清除剂。在一些实施例中,所述抗CD20剂是利妥昔单抗(rituximab)、奥法木单抗(ofatumumab)、奥瑞珠单抗(ocrelizumab)、碘i131托西莫单抗(iodinei131tositumomab)、奥滨尤妥珠单抗(obinutuzumab)或替伊莫单抗(ibritumomab)。在一优选的实施例中,所述抗CD20剂是利妥昔单抗。在一些实施例中,所述抗原识别结构域包括Centyrin、scFv、单结构域抗体、VH或VHH。在一些实施例中,所述抗原识别结构域包括Centyrin。在一些实施例中,所述抗原识别结构域包括VH。
本公开还提供了一种治疗癌症的方法,所述方法包括向受试者施用:包括表达嵌合抗原受体(CAR)的T细胞群的第一组合物,其中所述CAR包括抗原识别结构域和包括抗CD20剂的第二组合物。在一些实施例中,所述第一组合物包括包含表达多于一个CAR的T细胞群的第一组合物。在一些实施例中,所述多于一个CAR中的每个CAR与不同的抗原结合。在一些实施例中,所述方法进一步包括第三组合物,所述第三组合物包括至少一种淋巴细胞清除剂。在一些实施例中,所述抗CD20剂是利妥昔单抗(rituximab)、奥法木单抗(ofatumumab)、奥瑞珠单抗(ocrelizumab)、碘i131托西莫单抗(iodinei131tositumomab)、奥滨尤妥珠单抗(obinutuzumab)或替伊莫单抗(ibritumomab)。在一优选的实施例中,所述抗CD20剂是利妥昔单抗。在一些实施例中,所述抗原识别结构域包括Centyrin、scFv、单结构域抗体、VH或VHH。在一些实施例中,所述Centyrin特异性地结合B细胞成熟抗原(BCMA)。在一些实施例中,所述VH特异性地结合BCMA。在一些实施例中,所述Centyrin特异性地结合前列腺特异性膜抗原(PSMA)。在一些实施例中,所述scFv结合粘蛋白1(MUC-1)。在一些实施例中,所述scFv结合MUC1-C。
在一些实施例中,所述方法提供了与施用所述第一组合物但未施用所述第二组合物的患者相比,所述患者对所述第一组合物的抗药物抗体(ADA)应答降低至少50%。
在一些实施例中,所述方法提供了与施用所述第一组合物但未施用所述第二组合物的患者相比,所述患者体内所述第一组合物的持久性增加至少75%。在一些实施例中,所述方法提供了与施用所述第一组合物但未施用所述第二组合物的患者相比,所述患者体内所述第一组合物的持久性增加至少90%。在一些实施例中,持久性的度量是血浆浓度曲线的曲线下面积(AUC)。
在一些实施例中,所述第一组合物以多次输注形式施用,其中所述多次输注包括分成第一次输注和第二次输注的总剂量,并且其中i)所述第一次输注占所述总剂量的约三分之一;并且ii)所述第二次输注占所述总剂量的约三分之二,并在所述第一次输注后至少10天施用。
在一些实施例中,所述第一组合物以多次输注形式施用,其中所述多次输注包括分成第一次输注和第二次输注的总剂量,并且其中i)所述第一次输注占所述总剂量的约三分之二;并且ii)所述第二次输注占所述总剂量的约三分之一,并在所述第一次输注后至少10天施用。
在一些实施例中,所述第一组合物以多次输注形式施用,其中所述多次输注包括分成第一次输注、第二次输注和第三次输注的总剂量,并且其中i)所述第一次输注占所述总剂量的约三分之一;ii)所述第二次输注占所述总剂量的约三分之一,并在所述第一次输注后至少10天施用;并且iii)所述第三次输注占所述总剂量的约三分之一,并在所述第二次输注后至少10天施用。
在一些实施例中,所述第一次输注与所述第二次输注之间的时间或所述第二次输注与所述第三次输注之间的时间为至少1周、2周、3周、4周、5周或6周。
在一些实施例中,所述第一组合物、所述第二组合物和所述第三组合物依次施用。在一些实施例中,所述第一组合物、所述第二组合物和/或所述第三组合物同时施用。在一些实施例中,所述第三组合物在所述第一组合物之前施用。
在一些实施例中,所述第三组合物以多于一个剂量施用。在一些实施例中,所述第三组合物每天施用一次,并且其中所述第三组合物的第一剂量在所述第一组合物的所述第一次输注之前至少5天施用。在一些实施例中,所述第三组合物在所述第一组合物的所述第一次输注之前3天、4天和5天施用。
在一些实施例中,所述第二组合物在所述第一组合物之前施用。在一些实施例中,所述第二组合物以多于一个剂量施用。在一些实施例中,所述第二组合物的第一剂量在所述第一组合物的所述第一次输注之前12天施用,其中所述第二组合物的第二剂量在所述第一组合物的所述第一次输注之前5天施用,并且其中在所述第一组合物的所述第一次输注后每周一次施用后续剂量持续至少8周。
在一些实施例中,所述受试者先前未用抗癌剂进行治疗。在一些实施例中,所述受试者i)在施用所述第二组合物的第一剂量之前2周内;或ii)在施用所述第二组合物的第一剂量之前抗癌剂的5个半衰期内未接受抗癌剂。
在一些实施例中,所述受试者在施用所述第一组合物的所述第一次输注后未接受抗癌剂。在一些实施例中,所述受试者先前未用免疫抑制剂进行治疗。在一些实施例中,所述受试者i)在施用所述第二组合物的第一剂量之前2周内;或ii)在施用所述第二组合物的第一剂量之前免疫抑制剂的5个半衰期内未接受免疫抑制剂。在一些实施例中,所述受试者在施用所述第一组合物的所述第一次输注后未接受免疫抑制剂。
在一些实施例中,所述受试者先前未用抗炎剂进行治疗。在一些实施例中,所述受试者i)在施用所述第二组合物的第一剂量之前2周内;ii)在施用所述第二组合物的第一剂量之前l周内;ii)或在施用所述第二组合物的第一剂量之前免疫抑制剂的5个半衰期内未接受抗炎剂。在一些实施例中,所述受试者在施用所述第一组合物的所述第一次输注后未接受抗炎剂。在一些实施例中,所述抗炎剂是皮质类固醇。在一些实施例中,所述皮质类固醇是泼尼松(prednisone)并且其中所述泼尼松以至少5毫克/天的剂量全身性施用。
在一些实施例中,所述受试者先前未用粒细胞-集落刺激因子(G-CSF)或粒细胞-巨噬细胞集落刺激因子(GM-CSF)进行治疗。在一些实施例中,所述受试者i)在施用所述第二组合物的第一剂量之前2周内;或ii)在施用所述第二组合物的第一剂量之前G-CSF或GM-CSF的5个半衰期内未接受G-CSF或GM-CSF。在一些实施例中,所述受试者在施用所述第一组合物的最后一次输注后和/或在施用所述第一组合物的最后一次输注后2个月内未接受G-CSF或GM-CSF。
在一些实施例中,所述受试者先前未用草药进行治疗。在一些实施例中,所述受试者在施用所述第二组合物的第一剂量之前2周内未接受草药。在一些实施例中,所述受试者在施用所述第一组合物的最后一次输注后和/或在施用所述第一组合物的最后一次输注后2个月内未接受草药。
在一些实施例中,同时施用所述第三组合物的第一淋巴细胞清除剂和所述第三组合物的第二淋巴细胞清除剂。在一些实施例中,依次施用所述第三组合物的第一淋巴细胞清除剂和所述第三组合物的第二淋巴细胞清除剂。在一些实施例中,所述第一淋巴细胞清除剂和所述第二淋巴细胞清除剂在同一天施用,其中所述第一淋巴细胞清除剂在30分钟的时间段内静脉内施用,并且其中所述第二淋巴细胞清除剂在30分钟的时间段内静脉内施用。
在一些实施例中,所述第一淋巴细胞清除剂和所述第二淋巴细胞清除剂是环磷酰胺或氟达拉滨(fludarabine)。在一些实施例中,所述第三组合物的剂量包括i)100mg/m
在一些实施例中,所述第一组合物以至少0.1x10
在一些实施例中,所述第一次输注、所述第二次输注和/或所述第三次输注通过约0.5毫升/分钟至约30毫升/分钟的流速静脉内输注施用。在一些实施例中,所述流速为约1毫升/分钟至约20毫升/分钟。在一些实施例中,所述第一次输注、所述第二次输注和/或所述第三次输注的总持续时间为约5分钟至约30分钟。
在一些实施例中,所述第二组合物的剂量包括100mg/m
在一些实施例中,所述第二组合物通过静脉内输注施用,并且其中所述静脉内输注的流速为约25毫克/小时至约500毫克/小时。在一些实施例中,所述第二组合物的所述第一剂量通过静脉内输注以50毫克/小时的流速施用,并且其中所述流速每30分钟增加到最大400毫克/小时。在一些实施例中,所述第二组合物的所述第二剂量和所述后续剂量通过静脉内输注以约100毫克/小时的流速施用,并且其中所述流速每30分钟增加到最大约400毫克/小时。
在一些实施例中,在所述第二组合物的每个剂量之前30分钟施用对乙酰氨基酚(acetaminophen)、抗组胺药(antihistamine)和甲基强的松龙(methylprednisolone)。
在一些实施例中,所述癌症是血液学癌症。在一些实施例中,所述癌症是多发性骨髓瘤。在一些实施例中,所述多发性骨髓瘤是复发性多发性骨髓瘤或难治性多发性骨髓瘤。
在一些实施例中,所述癌症是实体肿瘤。在一些实施例中,所述癌症是前列腺癌。在一些实施例中,所述癌症是阉割抗性前列腺癌(CRPC)。在一些实施例中,所述实体肿瘤是乳腺癌、结肠直肠癌、肺癌、卵巢癌、胰腺癌或肾癌。在一些实施例中,所述乳腺癌是三阴性乳腺癌。
本公开提供了一种单位剂量输注袋,其包括250mL的包括以下的组合物:表达CAR的T细胞群,其中所述CAR包括包含与BCMA特异性结合的Centyrin的抗原识别结构域,其中所述组合物的浓度为约3x10
本公开提供了一种单位剂量输注袋,其包括250mL的包括以下的组合物:表达CAR的T细胞群,其中所述CAR包括包含与BCMA特异性结合的VH的抗原识别结构域,其中所述组合物的浓度为约3x10
本公开提供了一种单位剂量输注袋,其包括250mL的包括以下的组合物:表达CAR的T细胞群,其中所述CAR包括包含与PSMA特异性结合的Centyrin的抗原识别结构域,其中所述组合物的浓度为约3x10
本公开提供了一种单位剂量输注袋,其包括250mL的包括以下的组合物:表达CAR的T细胞群,其中所述CAR包括包含与MUC1-C特异性结合的scFv的抗原识别结构域,其中所述组合物的浓度为约3x10
附图说明
图1是描绘本公开的包含包括CARTyrin(包括CD8a信号肽、Centyrin、CD8a铰链序列和跨膜序列以及CD3z共刺激结构域)的转座子的7676个碱基对的piggyBac CARTyrin构建体的示意图。
图2是本公开的P-BCMA-101构建体的氨基酸序列的示意图。
图3A-3B是本公开的P-BCMA-101构建体的核酸序列的示意图。
图4是描绘本公开的CARTyrin的构建的示意图以及对比Centyrin和抗体的特征的表格。
图5A是描绘用5μg的CARTyrin mRNA电穿孔后CARTyrin表达的一系列细胞分选图。
图5B,左图是描绘用对照K562细胞系和表达BCMA的H929细胞系挑战后的CARTyrin功能的一系列细胞分选图,右图是示出左图的图的量化的图(用表达BCMA的系U266添加来自挑战的数据)。
图5C是描绘CARTyrin活性随着在T细胞电穿孔期间使用的mRNA量而变化的图。
图6是描绘在小鼠中使用A08 CARTyrin的体内肿瘤挑战研究时间轴的示意图。
图7是示出经A08 CARTyrin处理的小鼠完全(100%)存活率的一对图。通过M蛋白的存在来评估肿瘤负荷。在受保护的动物中无可检测到的M蛋白。
图8是描绘本公开的示例性诱导型截短的胱天蛋白酶9多肽的示意图。
图9是一系列流式细胞术图,所述流式细胞术图描绘了在经修饰以单独表达治疗剂(CARTyrin)或在核转染后的第12天与本公开的诱导型胱天蛋白酶多肽(由通过piggyBac(PB)转座酶引入到细胞中的iC9构建体(也称为“安全开关”)编码)组合的细胞中,随着增加剂量的诱导剂(AP1903)而变化的从活细胞区域(门控右下象限)移动到凋亡细胞聚集区域(左上象限)的细胞丰度。
图10是一系列流式细胞术图,所述流式细胞术图描绘了在经修饰以单独表达治疗剂(CARTyrin)或在核转染后的第19天与本公开的诱导型胱天蛋白酶多肽(由通过piggyBac(PB)转座酶引入到细胞中的iC9构建体(也称为“安全开关”)编码)组合的细胞中,随着增加剂量的诱导剂(AP1903)而变化的从活细胞区域(门控右下象限)移动到凋亡细胞聚集区域(左上象限)的细胞丰度。
图11是描绘在图9(左图)或图10(右图)中所示的汇总结果的量化的一对图。具体地,这些图示出了iC9安全开关在第12天(图9和左图)或第19天(图10和右图)对每种经修饰的细胞类型的随着iC9开关的诱导剂(AP1903)浓度而变化的细胞活力百分比的影响。
图12A-D是示出BCMA CARTyrin的稳定表达和功能的图。图12A是描绘在piggyBac(PB)转座后P-BCMA-101上的CARTyrin表面表达的流式细胞术图。模拟物表示没有主要的BCMA/Fc/生物素。图12B是示出重新刺激的P-BCMA-101 T细胞上CARTyrin表达的增加的流式细胞术图。图12C是示出P-BCMA-101细胞对BCMA+(H929)细胞系的体外杀伤的图。图12D是示出P-BCMA-101细胞对表达BCMA的细胞系的增殖的流式细胞术图。
图13A-D是示出在GLP安全性研究中用P-BCMA-101处理的携带MM.1S-Luc肿瘤的NSG小鼠的体内肿瘤生长和存活率的线形图。用M.1SBCMA+MM细胞IV移植雌性NSG小鼠,并在17-19天后IV给药P-BCMA-101和任一媒剂(n=10)(黑色);4x10
图14是P-BCMA-101单次施用的总体研究设计的示意图。
图15是P-BCMA-101临床制造及工艺方案的示意图。
图16是队列A和队列C中P-BCMA-101周期施用的总体研究设计的示意图。在1期-周期施用期间,多剂量的P-BCMA-101将在2周的2个周期中静脉内施用。
图17是队列B中P-BCMA-101周期施用的总体研究设计的示意图。在1期-周期施用期间,多剂量的P-BCMA-101将在2周的3个周期内静脉内施用。
图18是P-BCMA-101 1期组合施用的总体研究设计的示意图。在1期-组合施用中,P-BCMA-101将与所批准的疗法、来那度胺(lenalidomide)和利妥昔单抗(rituximab)组合施用。
图19A是示出在单独用P-BCMA-101治疗的多发性骨髓瘤患者中P-BCMA-101随时间变化的拷贝/ug DNA数的图。
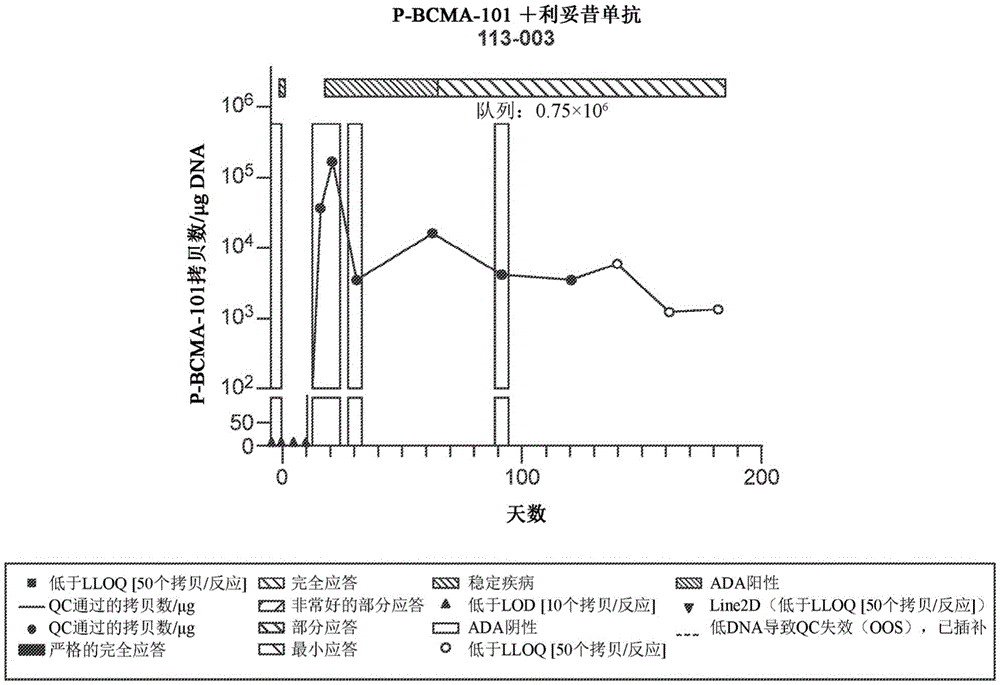
图19B是示出在用P-BCMA-101和利妥昔单抗的组合治疗的多发性骨髓瘤患者中P-BCMA-101随时间变化的拷贝/ug DNA数的图。
具体实施方式
本公开提供了一种治疗癌症的方法,所述方法包括向受试者施用:包括表达嵌合抗原受体(CAR)的T细胞群的第一组合物,其中所述CAR包括抗原识别结构域和包括抗CD20剂的第二组合物。
在一些实施例中,CAR的抗原识别结构域包括Centyrin、scFv、单结构域抗体、VH或VHH。
在一些实施例中,抗原识别结构域与B细胞成熟抗原(BCMA)或肿瘤坏死因子受体超家族成员17(TNFRSF17)特异性地结合。在一些实施例中,抗原识别结构域包括特异性结合BCMA的Centyrin。特异性结合BCMA的Centyrin的非限制性实例在PCT公开第WO2018/014038号公开。在一些实施例中,特异性结合BCMA的Centyrin包括SEQ ID NO:41的氨基酸序列。
在一些实施例中,抗原识别结构域包括特异性结合BCMA的VH。特异性结合BCMA的VH的非限制性实例在PCT公开第WO2019/126574号中公开。
在一些实施例中,抗原识别结构域与前列腺特异性膜抗原(PSMA)特异性地结合。在一些实施例中,抗原识别结构域包括特异性结合PSMA的Centyrin。特异性结合PSMA的Centyrin的非限制性实例在PCT公开第WO2019/173636号公开。
在一些实施例中,抗原识别结构域与粘蛋白1(MUC-1)特异性地结合。人MUC1是异二聚体糖蛋白,翻译为单个多肽并在内质网中切割成N末端和C末端亚基(MUC1-N和MUC1-C)。在一些实施例中,抗原识别结构域包括与MUC1-C特异性结合的scFv。特异性结合MUC1-C的Centyrin的非限制性实例在PCT申请第PCT/US2020/066121号和PCT公开第WO2018/014039号中公开。
本公开的琴都灵蛋白特异性结合至抗原。包括一个或多个特异性结合抗原的琴都灵蛋白的本公开的嵌合抗原受体可用于朝向特异性抗原引导细胞(例如细胞毒性免疫细胞)的特异性。
本公开的Centyrin可以包括共有序列,所述共有序列包括LPAPKNLVVSEVTEDSLRLSWTAPDAAFDSFLIQYQESEKVGEAINLTVPGSERSYDLTGLKPGTEYTVSIYGVKGGHRSNPLSAEFTT(SEQ IDNO:1)。
本公开的嵌合抗原受体可以包括人CD2、CD3δ、CD3ε、CD3γ、CD3ζ、CD4、CD8α、CD19、CD28、4-1BB或GM-CSFR的信号肽。本公开的铰链/间隔子结构域可以包括人CD8α、IgG4和/或CD4的铰链/间隔子/茎。本公开的胞内结构域或内切结构域可以包括人CD3ζ的胞内信号传导结构域,并且可以进一步包括人4-1BB、CD28、CD40、ICOS、MyD88、OX-40胞内区段或其任何组合。示例性跨膜结构域包含但不限于人CD2、CD3δ、CD3ε、CD3γ、CD3ζ、CD4、CD8α、CD19、CD28、4-1BB或GM-CSFR跨膜结构域。
如本文所使用的,术语“P-BCMA-101”是指与BCMA结合的Centyrin、与BCMA结合的CARTyrin、与BCMA特异性结合的CAR,或表达与BCMA特异性结合的CARTyrin或CAR的T细胞或T细胞群。在一些情况下,“P-BCMA-101”是指编码与BCMA结合的CAR或CARTyrin的构建体(例如,包含周围的元素,如DHFR和iC9)。
在一些实施例中,P-BCMA-101 CARTyrin包括包含SEQ ID NO:3的氨基酸序列的人CD8α信号肽,包括特异性结合BCMA的Centyrin的抗原识别区,所述BCMA包括SEQ ID NO:41的氨基酸序列;包括SEQ ID NO:10的氨基酸序列的人CD8α铰链区;包括SEQ ID NO:4的氨基酸序列的人CD8α跨膜区;包括SEQ ID NO:8的氨基酸序列的人4-1BB共刺激结构域;以及包括SEQ ID NO:6的氨基酸序列的CD3ζ共刺激结构域。在一些实施例中,P-BCMA-101CARTyrin包括SEQ ID NO:42的氨基酸序列。在一些实施例中,P-BCMA-101 CARTyrin由包括SEQ ID NO:44的核酸序列的多核苷酸编码。
本公开提供了经基因修饰的细胞,如T细胞、NK细胞、造血祖细胞、来源于外周血(PB)的T细胞(包含来自G-CSF动员的外周血的T细胞)、来源于脐带血(UCB)的T细胞通过向这些细胞中引入本公开的CAR和/或CARTyrin,使其对一种或多种抗原具有特异性。本公开的细胞可以通过电转移编码本公开的CAP或CARTyrin的转座子和包括编码本公开的转座酶的序列(优选地,编码本公开的转座酶的序列是mRNA序列)的质粒来修饰。编码CARTyrin的转座子的实例在PCT/US2019/021224中有所描述,所述文献通过全文引用的方式并入本文。编码CAR的转座子的实例在PCT/US2018/066936和PCT/US2017/042457中有所描述,每个文献以其整体并入本文。
本公开的转座子游离体地维持或整合到重组细胞/经修饰的细胞的基因组中。转座子可以是利用转座子和转座酶来增强非病毒基因转移的两个组分piggyBac系统的一部分。在此方法的某些实施例中,转座子是通过两个顺式调节绝缘子元件侧接的具有编码嵌合抗原受体的序列的质粒DNA转座子。在某些实施例中,转座子是piggyBac转座子。在某些实施例,并且具体地在其中转座子是piggyBac转座子的那些实施例中,转座酶是piggyBac
在本公开的方法的某些实施例中,转座子是通过两个顺式调节绝缘子元件侧接的具有编码抗原受体的序列的质粒DNA转座子。在某些实施例中,转座子是piggyBac转座子。在某些实施例,并且具体地在其中转座子是piggyBac转座子的那些实施例中,转座酶是piggyBac
在本公开的方法的某些实施例中,转座酶是piggyBac
在本公开的方法的某些实施例中,转座酶是piggyBac
在某些实施例中,转座酶是piggyBac
在本公开的方法的某些实施例中,转座酶是Super piggyBac
在本公开的方法的某些实施例,在包含其中转座酶包括在位置30、165、282和/或538处的上述突变的那些实施例中,piggyBac
在本公开的方法的某些实施例中,在包含其中转座酶包括位置30、165、282和/或538处的上述突变的那些实施例中,piggyBac
本公开的蛋白质支架可以源自纤连蛋白III型(FN3)重复蛋白、编码或互补核酸、载体、宿主细胞、组合物、组合、调配物、装置以及制备和使用其的方法。在一优选的实施例中,蛋白质支架包含来自人腱生蛋白-C(下文称为“腱生蛋白”)的多个FN3结构域的共有序列。在一另外的优选的实施例中,本发明的蛋白质支架是15个FN3结构域的共有序列。本公开的蛋白质支架可以设计成结合各种分子,例如,细胞靶蛋白。在一优选的实施例中,本公开的蛋白质支架可以设计成结合野生型和/或变体形式的抗原的表位。
本公开的蛋白质支架可以包含另外的分子或部分,例如抗体的Fc区、白蛋白结合结构域或影响半衰期的其它部分。在另外的实施例中,本公开的蛋白质支架可以与可以编码所述蛋白质支架的核酸分子结合。
本公开提供了至少一种用于在宿主细胞中表达基于多个FN3结构域的共有序列的至少一种蛋白质支架的方法,所述方法包括在其中至少一种蛋白质支架以可检测和/或可回收的量的方式表达的条件下培养如本文所描述的宿主细胞。
本公开提供了至少一种组合物,所述组合物包括(a)基于多个FN3结构域的共有序列和/或如本文所描述的编码核酸的蛋白质支架;(b)合适的和/或药学上可接受的载体或稀释剂。
本公开提供了一种基于纤连蛋白III型(FN3)重复蛋白,优选地,多个FN3结构域的共有序列,并且更优选地,来自人腱生蛋白的多个FN3结构域的共有序列产生蛋白质支架的文库的方法。所述文库是通过改变(通过突变)支架部分(例如环区)中特定位置的分子中的氨基酸或氨基酸的数量来制备连续代的支架而形成的。可以通过改变单环的氨基酸组成或同时改变多环或支架分子的另外的位置来生成文库。经改变的环可以相应地延长或缩短。可以生成此类文库以包含每个位置处的所有可能的氨基酸,或设计的氨基酸的子集。文库成员可以用于通过展示,如体外或CIS展示(DNA、RNA、核糖体展示等)、酵母、细菌和噬菌体展示进行筛选。
本公开的蛋白质支架提供增强的生物物理特性,如还原条件下的稳定性和高浓度下的溶解度;其可以在原核系统,如大肠杆菌(E.coli)、真核系统,如酵母和体外转录/翻译系统,如兔网织红细胞裂解物系统中表达和折叠。
本公开提供了一种通过用靶标平移本发明的支架文库并检测粘合剂来产生与特定靶标结合的支架分子的方法。在其它有关方面,本公开包括可以用于产生或亲和具有期望活性的成熟蛋白质支架的筛选方法,例如,能够以一定的亲和性结合靶蛋白。亲和力成熟可以通过使用如噬菌体展示或体外展示的系统的迭代轮次的诱变和选择来完成。在此过程期间的诱变可能是对特定支架残基的定点诱变、由于易错PCR、DNA改组和/或这些技术的组合所引起的随机诱变的结果。
本公开提供了一种基于纤连蛋白III型(FN3)重复蛋白的共有序列的分离的、重组的和/或合成的蛋白质支架,所述蛋白质支架包含但不限于源自哺乳动物的支架,以及包括至少一种基于共有FN3序列的编码蛋白质支架的多核苷酸的组合物和编码核酸分子。本公开进一步包含但不限于制备和使用此类核酸和蛋白质支架的方法,包含诊断和治疗组合物、方法和装置。
本公开的蛋白质支架提供优于传统疗法的优势,如局部施用、口服施用或跨血脑屏障的能力、在大肠杆菌中表达的能力允许随资源变化的蛋白质的表达增加,而哺乳动物细胞表达能力被设计成被设计成与多个靶标或同一靶标的多个表位结合的双特异性分子或串联分子,与药物、聚合物和探针缀合的能力,调配成高浓度的能力,以及此类分子有效穿透病变组织和肿瘤的能力。
此外,蛋白质支架具有与其模拟抗体的可变区的折叠有关的抗体的许多特性。此定向使FN3环能够与抗体互补决定区(CDR)类似地暴露。其应该能够与细胞靶标结合,并且可以改变环,例如亲和力成熟,以改善某些结合或相关特性。
本公开的蛋白质支架的六个环中的三个环拓扑地对应于抗体的互补决定区(CDR1-3),即抗原结合区,而其余三个环以类似于抗体CDR的方式暴露表面。这些环跨SEQ IDNO:13的残基13-16、22-28、38-43、51-54、60-64和75-81处或附近。优选地,在残基22-28、51-54和75-81处或附近的环区改变结合特异性和亲和力。这些环区中的一个或多个环区与其它环区和/或保持其序列的其它链作为骨架部分随机化以填充文库,并且有效粘合剂可以选自对特定蛋白质靶标具有高亲和力的文库。一个或多个环区可以与靶蛋白相互作用,其类似于抗体CDR与蛋白质的相互作用。
本公开的支架可以包括抗体模拟物。
术语“抗体模拟物”旨在描述特异性结合靶序列并且具有不同于天然存在的抗体的结构的有机化合物。抗体模拟物可以包括蛋白质、核酸或小分子。本公开的抗体模拟物特异性结合的靶序列可为抗原。抗体模拟物可提供优于抗体的特性,包含但不限于优越的溶解度、组织渗透性、对热和酶的稳定性(例如,对酶降解的抗性)以及较低的生产成本。示例性抗体模拟物包含但不限于亲和抗体、人泛素(afflilin)、亲和体、亲和素(affitin)、α抗体、抗运载蛋白、和高亲和性多聚体(也称为亲合力多聚体)、DARPin(设计的锚蛋白重复蛋白)、Fynomer、Kunitz结构域肽和单功能抗体(monobody)。
本公开的亲和抗体分子包括蛋白质支架,所述蛋白质支架包含一个或多个无任何二硫桥键的α螺旋或由其组成。优选地,本公开的亲和抗体分子包括三个α螺旋或由其组成。例如,本公开的亲和抗体分子可以包括免疫球蛋白结合结构域。本公开的亲和抗体分子可以包括蛋白A的Z结构域。
本公开的人泛素分子包括通过修饰例如γ-B晶状体球蛋白或泛素的暴露的氨基酸而产生的蛋白质支架。人泛素分子在功能上模仿抗体对抗原的亲和力,但在结构上不模仿抗体。在用于制造人泛素的任何蛋白质支架中,溶剂或适当折叠的蛋白质分子中可能的结合搭配物可及的那些氨基酸都被视为暴露的氨基酸。这些暴露的氨基酸中的任何一个或多个可经修饰以特异性结合靶序列或抗原。
本公开的亲和体分子包括蛋白质支架,所述蛋白质支架包括经工程化以展示肽环的高度稳定的蛋白质,所述肽环为特定靶序列提供高亲和力结合位点。本公开的示例性亲和体分子包括基于胱抑素蛋白或其三级结构的蛋白质支架。本公开的示例性亲和体分子可共享共同的三级结构,其包括位于反平行β-片层的顶部上的α-螺旋。
本公开的亲和素分子包括人工蛋白质支架,其结构可例如衍生自DNA结合蛋白(例如DNA结合蛋白Sac7d)。本公开的亲和素选择性地结合靶序列,其可为抗原的全部或部分。通过使DNA结合蛋白的结合表面上的一个或多个氨基酸序列随机化并使所得的蛋白质经受核糖体展示和选择来制造本公开的示例性亲和素。本公开的亲和素的靶序列可例如在基因组中或在肽、蛋白质、病毒或细菌的表面上发现。在本公开的某些实施例中,亲和素分子可以用作酶的特异性抑制剂。本公开的亲和素分子可以包含耐热蛋白或其衍生物。
本公开的α抗体分子也可称为细胞穿透性α抗体(CPAB)。本公开的α抗体分子包括与多种靶序列(包含抗原)结合的小蛋白(通常小于10kDa)。α抗体分子能够到达并结合细胞内靶序列。在结构上,本公开的α抗体分子包括形成单链α螺旋的人工序列(类似于天然存在的卷曲螺旋结构)。本公开的α抗体分子可以包括蛋白质支架,所述蛋白质支架包含经修饰以特异性结合靶蛋白的一个或多个氨基酸。无论分子的结合特异性如何,本公开的α抗体分子都保持恰当的折叠和热稳定性。
本公开的抗运载蛋白分子可以包括与蛋白质或小分子中的靶序列或位点结合的人工蛋白质。本公开的抗运载蛋白分子可以包括衍生自人类脂质运载蛋白的人工蛋白质。本公开的抗运载蛋白分子可例如代替单克隆抗体或其片段来使用。抗运载蛋白分子可展示优于单克隆抗体或其片段的组织渗透和热稳定性。本公开的示例性抗运载蛋白分子可以包括约180个氨基酸,质量为约20kDa。在结构上,本公开的抗运载蛋白分子包括筒状结构,所述筒状结构包含通过环和连接的α螺旋成对连接的反平行β-股。在优选实施例中,本公开的抗运载蛋白分子包括筒状结构,所述筒状结构包含通过环和连接的α螺旋成对连接的八个反平行β-股。
本公开的高亲和性多聚体分子包括与靶序列(也可以是抗原)特异性结合的人工蛋白质。本公开的高亲合性多聚体可识别相同靶标内或不同靶标内的多个结合位点。当本公开的高亲和性多聚体识别超过一个靶标时,高亲和性多聚体模拟双特异性抗体的功能。人工蛋白质高亲和性多聚体可以包括两个或更多个肽序列,每个约30-35个氨基酸。这些肽可通过一个或多个接头肽连接。高亲和性多聚体的一个或多个肽的氨基酸序列可源自膜受体的A结构域。高亲合性多聚体具有刚性结构,其可任选地包括二硫键和/或钙。与抗体相比,本公开的高亲合性多聚体可展示更高的热稳定性。
本公开的DARPin(设计的锚蛋白重复蛋白)包括对靶序列具有高特异性和高亲和力的基因工程化、重组或嵌合蛋白。在某些实施例中,本公开的DARPin衍生自锚蛋白,并且任选地包括锚蛋白的至少三个重复基序(也称为重复结构单元)。锚蛋白介导高亲和力蛋白质-蛋白质相互作用。本公开的DARPin包括大的靶相互作用表面。
本公开的Fynomer包括小结合蛋白(约7kDa),其衍生自人类Fyn SH3结构域且经工程化以在与抗体相同的亲和力和相同的特异性下结合至靶序列和分子。
本公开的Kunitz结构域肽含有包括Kunitz结构域的蛋白质支架。Kunitz结构域包括抑制蛋白酶活性的活性位点。在结构上,本公开的Kunitz结构域包括富含二硫键的α+β折叠。此结构以牛胰胰蛋白酶抑制剂为例。Kunitz结构域肽识别特定的蛋白质结构,并充当竞争性蛋白酶抑制剂。本公开的Kunitz结构域可以包括艾卡拉肽(Ecallantide)(源自人类脂蛋白相关凝结抑制剂(LACI))。
本公开的单功能抗体是大小与单链抗体相当的小蛋白质(包括约94个氨基酸并且具有约10kDa的质量)。这些基因工程化的蛋白特异性结合靶序列,包含抗原。本公开的单功能抗体可特异性靶向一种或多种不同的蛋白质或靶序列。在优选实施例中,本公开的单功能抗体包括模拟人类纤连蛋白的结构,并且更优选地,模拟纤连蛋白的第十个细胞外III型结构域的结构的蛋白质支架。纤连蛋白的第十个细胞外III型结构域以及其单功能抗体模拟物含有七个形成筒的β折叠,和在每侧上对应于抗体的三个互补决定区(CDR)的三个暴露环。与抗体的可变结构域的结构相比,单功能抗体缺乏金属离子的任何结合位点以及中心二硫键。可通过修饰环BC和FG来优化多特异性单功能抗体。本公开的单功能抗体可以包括纤连蛋白。
此类方法可以包括向需要此类调节、治疗、缓解、预防或减轻症状、影响或机制的细胞、组织、器官、动物或患者施用有效量的组合物或包括至少一种支架蛋白的药物组合物。有效量可以包括每单次施用(例如,团注)、多次施用或连续施用约0.001至500mg/kg的量,或达到每单次施用、多次施用或连续施用0.01-5000μg/ml的血清浓度的血清浓度,或其中的任何有效范围或值,如使用本文所描述的或相关领域已知的已知方法所完成和确定的。
支架蛋白的产生和生成
如本领域所熟知的,本公开的至少一种支架蛋白可以任选地由细胞系、混合的细胞系、无限增殖化细胞或无限增殖化细胞的克隆群体产生。参见例如Ausubel等人编,《现代分子生物学实验技术(Current Protocols in Molecular Biology)》,John Wiley&Sons,Inc.,NY,N.Y.(1987-2001);Sambrook等人,《分子克隆:实验指南(Molecular Cloning:ALaboratory Manual)》,第2版,Cold Spring Harbor,N.Y.(1989);Harlow和Lane,《抗体实验指南(Antibodies,a Laboratory Manual)》,Cold Spring Harbor,N.Y.(1989);Colligan等人编,《当代免疫学实验指南(Current Protocols in Immunology)》,纽约的约翰·威利父子出版公司(John Wiley&Sons,NY,N.Y.)(1994-2001);Colligan等人,《当代蛋白质科学实验指南(Current Protocols in Protein Science)》,纽约州纽约市的约翰·威利父子出版公司,(1997-2001)。
如本领域已知的,来自支架蛋白的氨基酸可经改变、添加和/或缺失以降低免疫原性或降低、增强或修饰结合、亲和力、缔合速率、解离速率、亲合力、特异性、半衰期、稳定性、溶解度或任何其它合适的特征。
任选地,可在保留对抗原的高亲和力和其它有利生物学特性的情况下对支架蛋白进行工程化。为了实现此目标,可以任选地使用亲本和工程化序列的三维模型,通过对亲本序列和各种概念工程化产物的分析过程来制备支架蛋白。三维模型是普遍可用的,并且是所属领域的技术人员熟悉的。可获得计算机程序,其说明并显示所选候选序列的可能的三维构象结构,且可测量可能的免疫原性(例如,加利福尼亚州蒙罗维亚(Monrovia,Calif.)的Xencor,Inc.的Immunofilter程序)。对这些展示的检查允许对残基在候选序列的功能方面的可能作用进行分析,即对影响候选支架蛋白结合其抗原的能力的残基进行分析。以这种方式,可以从亲本和参考序列中选择残基并将其组合,从而获得所需的特征,例如对靶抗原的亲和力。作为上述程序的替代或补充,可使用其它合适的工程化方法。
支架蛋白的筛选
使用核苷酸(DNA或RNA展示)或肽展示文库,例如体外展示可以方便地实现筛选蛋白质支架与类似蛋白质或片段的特异性结合。此方法涉及针对具有所需功能或结构的单个成员筛选大量肽。展示的核苷酸或肽序列的长度可为3至5000个或更多个核苷酸或氨基酸,常为5-100个氨基酸长,且通常为约8-25个氨基酸长。除了用于生成肽库的直接化学合成方法外,还描述了几种重组DNA方法。一种类型涉及在噬菌体或细胞的表面上展示肽序列。每个噬菌体或细胞均含有编码特定展示肽序列的核苷酸序列。此类方法在PCT专利公开第91/17271号、第91/18980号、第91/19818号和第93/08278号中有所描述。
用于生成肽文库的其它系统具有体外化学合成和重组方法两个方面。参见PCT专利公开第92/05258号、第92/14843号和第96/19256号。还参见美国专利第5,658,754号和第5,643,768号。肽展示文库、载体和筛选试剂盒可从英杰公司(Invitrogen)(加利福尼亚州卡尔斯巴德(Carlsbad,Calif.))和剑桥抗体技术公司(Cambridge AntibodyTechnologies)(英国剑桥郡(Cambridgeshire,UK))等供应商商购获得。参见例如,分配给Enzon公司(Enzon)的美国专利第4,704,692号、第4,939,666号、第4,946,778号、第5,260,203号、第5,455,030号、第5,518,889号、第5,534,621号、第5,656,730号、第5,763,733号、第5,767,260号、第5856456号;分配给Dyax公司(Dyax)的美国专利第5,223,409号、第5,403,484号、第5,571,698号、第5,837,500号;分配给安斐曼科斯公司(Affymax)的美国专利第5,427,908号、第5,580,717号,分配给剑桥抗体技术公司的美国专利第5,885,793号;分配给基因泰克公司(Genentech)的美国专利第5,750,373号;分配给Xoma、Colligan,前述;Ausubel,前述;或Sambrook,前述的美国专利第5,618,920号、第5,595,898号、第5,576,195号、第5,698,435号、第5,693,493号、第5,698,417号。
本公开的蛋白质支架可以以宽范围的亲和力(KD)结合人或其它哺乳动物蛋白。在一优选的实施例中,如本领域技术人员所实践的,本发明的至少一种蛋白质支架可以任选地以如通过表面等离子体共振或Kinexa方法所确定的高亲和力,例如以等于或小于约10-7M的KD,如但不限于0.1-9.9(或其中的任何范围或值)X 10-8、10-9、10-10、10-11、10-12、10-13、10-14、10-15或其中的任何范围或值与靶蛋白结合。
蛋白质支架对抗原的亲和力或亲合力可以使用任何合适的方法以实验方式确定。(参见例如Berzofsky等人,“抗体-抗原相互作用(Antibody-Antigen Interactions)”《基础免疫学(Fundamental Immunology)》,Paul,W.E.编,Raven Press:New York,N.Y.(1984);Kuby,Janis《免疫学(Immunology)》,W.H.Freeman and Company:New York,N.Y.(1992);和本文所述的方法)。如果在不同条件(例如,盐浓度、pH)下测量,则所测量的特定蛋白质支架-抗原相互作用的亲和力可能变化。因此,亲和力和其它抗原结合参数(例如KD、Kon、Koff)的测量优选地用蛋白质支架和抗原的标准化溶液,以及标准化缓冲液(如本文所描述的缓冲液)来进行。
可以用本公开的蛋白质支架进行竞争性分析,以确定哪些蛋白质、抗体和其它拮抗剂与本发明的蛋白质支架竞争结合至靶蛋白和/或共享表位区。所属领域的技术人员容易知道的这些分析评估拮抗剂或配体之间对于蛋白质上有限数目的结合位点的竞争。在竞争之前或之后,蛋白质和/或抗体被固定或不溶解,并且与靶蛋白结合的样品从未结合的样品中分离出来,例如,通过倾析(其中蛋白质/抗体预溶解)或通过离心(其中蛋白质/抗体在竞争性反应后沉淀)。同样地,竞争性结合可以通过功能是否通过蛋白质支架与靶蛋白的结合或缺乏所述结合而改变来确定,例如蛋白质支架分子是否抑制或增强了例如标记的酶活性。如所属领域中众所周知的,可使用ELISA和其它功能分析。
核酸分子
本公开的编码蛋白质支架的核酸分子可以是RNA的形式,如mRNA、hnRNA、tRNA或任何其它形式,或者是DNA的形式,包含但不限于通过克隆获得的cDNA和基因组DNA或合成生产,或其任何组合。DNA可以是三链、双链或单链,或其任何组合。DNA或RNA的至少一条链的任何部分可以是编码链,也称为有义链,或者其可以是非编码链,也称为反义链。
本公开的分离的核酸分子可以包含包括开放阅读框(ORF)的核酸分子,任选地,具有一个或多个内含子,例如但不限于,至少一种蛋白质支架的至少一个特定部分;包括与靶蛋白结合的蛋白质支架或环区的编码序列的核酸分子;以及核酸分子,其包括与上述那些基本不同的核苷酸序列,但由于遗传密码的简并性,仍编码如本文所描述和/或本领域已知的蛋白质支架。当然,遗传密码在本领域是众所周知的。因此,对于本领域技术人员而言,产生编码本发明的特异性蛋白质支架的此类简并核酸变体将是常规的。参见例如Ausubel等人,前述,并且此类核酸变体包含在本发明中。
如本文所指示的,包括编码蛋白质支架的核酸的本公开的核酸分子可以包含但不限于其本身编码蛋白质支架片段的氨基酸序列的那些;整个蛋白质支架或其一部分的编码序列;蛋白质支架、片段或部分的编码序列,以及另外的序列,如具有或不具有上述另外的编码序列的至少一个信号前导物或融合肽的编码序列,如至少一个内含子,以及具有另外的非编码序列,包含但不限于非编码5′和3′序列,如在转录、mRNA加工(包含剪接和聚腺苷酸化信号)中起作用的转录的非翻译序列(例如,核糖体结合和mRNA的稳定性);编码另外的氨基酸的另外的编码序列,如提供另外的官能性的氨基酸。因此,可以将编码蛋白质支架的序列与标志物序列融合,如编码有助于纯化包括蛋白质支架片段或部分的融合蛋白质支架的肽的序列。
与如本文所描述的多核苷酸选择性杂交的多核苷酸
本公开提供了在选择性杂交条件下与本文所公开的多核苷酸杂交的分离的核酸。因此,此实施例的多核甘酸可以用于分离、检测和/或定量包括此类多核甘酸的核酸。例如,本发明的多核苷酸可以用于鉴定、分离或扩增保藏文库中的部分或全长克隆。在一些实施例中,多核苷酸是与来自人或哺乳动物核酸文库的cDNA分离或以其它方式互补的基因组或cDNA序列。
优选地,cDNA文库包括至少80%的全长序列,优选地至少85%或90%的全长序列,并且更优选地至少95%的全长序列。可以对cDNA文库归一化以增加稀有序列的代表性。低或中等严格杂交条件通常但不排他地与相对于互补序列具有降低的序列同一性的序列一起使用。对于更高同一性的序列,可以任选地使用中等和高严格条件。低严格条件允许选择性杂交具有约70%序列同一性的序列,并且可以用于鉴定直系同源或旁系同源序列。
任选地,本发明的多核甘酸将编码由本文所描述的多核甘酸编码的蛋白质支架的至少一部分。本发明的多核苷酸涵盖可以用于与编码本发明的蛋白质支架的多核苷酸选择性杂交的核酸序列。参见例如,Ausubel,前述;Colligan,前述,每一个均通过引用整体并入本文。
核酸的构建
可使用本领域众所周知的(a)重组方法、(b)合成技术、(c)纯化技术和/或(d)其组合来制备本公开的分离的核酸。
核酸可以方便地包括除本发明的多核苷酸之外的序列。例如,可将包括一或多个核酸内切酶限制位点的多克隆位点插入到核酸中以帮助分离多核苷酸。另外,可插入可翻译序列以帮助分离本公开的翻译的多核苷酸。例如,六聚组氨酸标志物序列提供了纯化本公开的蛋白质的便利手段。除了编码序列外,本公开的核酸任选地是用于克隆和/或表达本公开的多核苷酸的载体、衔接子或接头。
可以将另外的序列添加到此类克隆和/或表达序列中,以优化其在克隆和/或表达中的功能,以便帮助多核苷酸的分离或改善多核苷酸向细胞中的引入。克隆载体、表达载体、衔接子和接头的使用是本领域熟知的。(参见例如Ausubel,前述;或Sambrook,前述)。
构建核酸的重组方法
可使用所属领域的技术人员已知的任何数目的克隆方法从生物学来源获得本公开的分离的核酸组合物,例如RNA、cDNA、基因组DNA或其任何组合。在一些实施例中,在严格条件下与本发明的多核苷酸选择性杂交的寡核苷酸探针用于鉴定cDNA或基因组DNA文库中的期望序列。RNA的分离以及cDNA和基因组库的构建是所属领域的技术人员众所周知的。(参见例如Ausubel,前述;或Sambrook,前述)。
核酸筛选和/分离方法
可基于本公开的多核苷酸的序列,使用探针来筛选cDNA或基因组库。探针可用于与基因组DNA或cDNA序列杂交,以分离相同或不同生物体中的同源基因。所属领域的技术人员应了解,可在分析中采用各种程度的杂交严格性;例如,杂交或洗涤介质可以是严格的。随着杂交条件变得更加严格,探针与靶标之间必须存在更大程度的互补性,以使双螺旋形成发生。严格度可通过温度、离子强度、pH和部分变性溶剂(如甲酰胺)的存在中的一种或多种来控制。例如,可通过例如在0%至50%范围内操纵甲酰胺的浓度来改变反应物溶液的极性而方便地改变杂交的严格性。可检测结合所需的互补性程度(序列同一性)将根据杂交培养基和/或洗涤培养基的严格性而变化。互补性程度将最佳为100%或70-100%,或其中的任何范围或值。但是,应理解,可通过降低杂交和/或洗涤介质的严格性来补偿探针和引物中的微小序列变异。
RNA或DNA的扩增方法在所属领域中是众所周知的,并且基于本文呈现的教导和指导,可根据本公开使用而无需过度的实验。
DNA或RNA扩增的已知方法包含但不限于聚合酶链反应(PCR)和相关扩增方法(参见例如颁予Mullis等人的美国专利第4,683,195号、第4,683,202号、第4,800,159号、第4,965,188号;颁予Tabor等人的第4,795,699号和第4,921,794号;颁予英尼斯的第5,142,033号;颁予Wilson等人的第5,122,464号;颁予英尼斯的第5,091,310号;颁予Gyllensten等人的第5,066,584号;颁予Gelfand等人的第4,889,818号;颁予Silver等人的第4,994,370号;颁予Biswas的第4,766,067to Biswas号;颁予Ringold的第4,656,134号)和RNA介导的扩增,其使用针对靶序列的反义RNA作为双股DNA合成的模板(颁予Malek等人的美国专利第5,130,238号,商品名为NASBA),所述参照案的全部内容以引用的方式并入本文中。(参见例如Ausubel,前述;或Sambrook,前述)。
例如,聚合酶链反应(PCR)技术可用于直接从基因组DNA或cDNA库扩增本公开的多核苷酸和相关基因的序列。PCR和其它体外扩增方法也可能有用,例如,克隆编码待表达蛋白质的核酸序列,使核酸用作探针,以检测样品中所需mRNA的存在、核酸测序或用于其它目的。足以指导技术人员通过体外扩增方法的技术的实例见于Berger,前述;Sambrook,前述;和Ausubel;前述;以及Mullis等人,美国专利第4,683,202号(1987);和Innis等人,《PCR协议:方法和应用指南(PCR Protocols A Guide to Methods and Applications),编者Academic Press Inc.,San Diego,Calif.(1990)。用于基因组PCR扩增的可商购获得的试剂盒是所属领域中已知的。参见例如Advantage-GC基因组PCR试剂盒(Clontech)。另外,例如T4基因32蛋白(Boehringer Mannheim)可用于提高长PCR产物的产量。
构建核酸的合成方法
本公开的分离的核酸也可通过已知方法通过直接化学合成来制备(参见例如Ausubel等人,前述)。化学合成通常产生单股寡核苷酸,其可通过与互补序列杂交或通过使用单股作为模板的DNA聚合酶聚合而转化为双股DNA。所属领域的技术人员应认识到,尽管DNA的化学合成可限于约100个或更多个碱基的序列,但通过连接较短序列可获得较长序列。
重组表达盒
本公开进一步提供了包括本公开核酸的重组表达盒。本公开的核酸序列,例如编码本公开的蛋白质支架的cDNA或基因组序列可以用于构建可以引入到至少一个期望宿主细胞中的重组表达盒。重组表达盒通常将包括可操作地连接于转录起始调节序列的本公开的多核苷酸,所述调节序列将引导多核苷酸在预期宿主细胞中的转录。异源和非异源(即内源)启动子均可用于引导本公开的核酸的表达。
在一些实施例中,可以将充当启动子、增强子或其它元件的分离的核酸引入本公开的多核苷酸的非异源形式的适当位置(上游、下游或内含子中),以上调或下调本公开的多核苷酸的表达。例如,可以通过突变、缺失和/或取代在体内或体外改变内源启动子。
载体和宿主细胞
本公开还涉及包含本公开的分离的核酸分子的载体、用重组载体基因工程化的宿主细胞以及通过本领域技术人员众所周知的重组技术产生至少一个蛋白质支架。参见例如,Sambrook等人,前述;Ausubel等人,前述,每一个均通过引用整体并入本文。
例如,可使用PB-EFla载体。载体包括以下核甘酸序列:
/>
多核苷酸可任选地连接至含有用于在宿主中繁殖的可选标志物的载体。通常,将质粒载体引入沉淀物(例如磷酸钙沉淀物)中,或与带电脂质的复合物中。如果载体是病毒,则可使用适当的包装细胞系将其体外包装,且接着转导到宿主细胞中。
DNA插入物应与适当启动子可操作地连接。表达构建体将进一步含有用于转录起始、终止的位点,并且在转录区域中含有用于翻译的核糖体结合位点。由构建体表达的成熟转录物的编码部分将优选地包含在起始处开始的翻译和适当地位于待翻译的mRNA末端的终止密码子(例如,UAA、UGA或UAG),其中UAA和UAG优选用于哺乳动物或真核细胞表达。
表达载体将优选但任选地包含至少一种可选标志物。此类标志物包含例如但不限于安比西林、博莱霉素(Shbla基因)、嘌呤霉素(pac基因)、潮霉素B(hygB基因)、G418/遗传霉素(neo基因)、霉酚酸、或谷氨酰胺合成酶(GS,美国专利第5,122,464号;第5,770,359号;第5,827,739号)、杀稻瘟菌素(bsd基因)、用于真核细胞培养的抗性基因以及用于在大肠杆菌和其它细菌或原核生物中培养的安比西林、博莱霉素(Sh bla基因)、嘌呤霉素(pac基因)、潮霉素B(hygB基因)、G418/遗传霉素(neo基因)、康霉素、大观霉素、链霉素、卡本西林、博莱霉素、红霉素、多粘菌素B或四环素抗性基因(以上专利特此以全文引用的方式并入)。用于上述宿主细胞的适当培养基和条件是所属领域中已知的。合适的载体对于技术人员将是显而易见的。可通过磷酸钙转染、DEAE-葡聚糖介导的转染、阳离子脂质介导的转染、电穿孔、转导、感染或其它已知方法将载体构建体引入至宿主细胞中。此类方法描述于所属领域中,如Sambrook,前述,第1-4和16-18章;Ausubel,前述,第1、9、13、15、16章。
表达载体将优选但任选地包含至少一种可选细胞表面标志物,用于分离由本公开的组合物和方法修饰的细胞。本公开的可选细胞表面标志物包括表面蛋白、糖蛋白或蛋白质组,其将细胞或细胞亚群与另一个定义的细胞亚群区分开。优选地,可选细胞表面标志物将通过本公开的组合物或方法修饰的那些细胞与未通过本公开的组合物或方法修饰的那些细胞区分开。此类细胞表面标志物包含例如但不限于“名称簇”或“分类决定子”蛋白(通常缩写为“CD”),如CD19、CD271、CD34、CD22、CD20、CD33、CD52或其任何组合的截短或全长形式。细胞表面标志物进一步包含自杀基因标志物RQR8((Philip B等人,《血液(Blood.)》2014年8月21日;124(8):1277-87)。
表达载体将优选但任选地包含至少一种可选耐药性标志物,所述可选耐药性标志物用于分离由本公开的组合物和方法修饰的细胞。本公开的可选耐药性标志物可以包括野生型或突变型Neo、DHFR、TYMS、FRANCF、RAD51C、GCS、MDR1、ALDH1、NKX2.2或其任何组合。
本公开的至少一种蛋白质支架可以以修饰的形式表达,如融合蛋白,并且不仅可以包含分泌信号,而且还可包含另外的异源功能区。例如,可以将另外的氨基酸的区,特别是带电氨基酸添加到蛋白质支架的N端,以改善在纯化期间或在随后的处理和储存期间在宿主细胞中的稳定性和持久性。同样地,可以将肽部分添加到本公开的蛋白质支架中以促进纯化。可以在最终制备蛋白质支架或其至少一个片段之前去除此类区。此类方法描述于许多标准实验室手册中,如Sambrook,前述,第17.29-17.42和18.1-18.74章;Ausubel,前述,第16、17和18章。
所属领域的技术人员对于可用于表达编码本公开的蛋白质的核酸的众多表达系统是知识丰富的。可替代地,可以通过在含有编码本公开的蛋白质支架的内源性DNA的宿主细胞中开启(通过操纵)而在宿主细胞中表达本公开的核酸。此类方法为所属领域中众所周知的,例如美国专利第5,580,734号、第5,641,670号、第5,733,746号和第5,733,761号中所述,其以全文引用的方式并入本文中。
可用于产生蛋白质支架、其特定部分或变体的细胞培养物的示例是本领域中已知的细菌、酵母和哺乳动物细胞。哺乳动物细胞系统通常将呈细胞单层的形式,尽管也可使用哺乳动物细胞悬浮液或生物反应器。已在所属领域中开发了许多能够表达完整糖基化蛋白的合适的宿主细胞系,并且包含COS-1(例如ATCC CRL 1650)、COS-7(例如ATCC CRL-1651)、HEK293、BHK21(例如ATCC CRL-10)、CHO(例如ATCC CRL 1610)和BSC-1(例如ATCC CRL-26)细胞株、Cos-7细胞、CHO细胞、hep G2细胞、P3X63Ag8.653、SP2/0-Ag14、293细胞、HeLa细胞等,其容易地购自例如美国菌种保藏中心,Manassas,Va.(www.atcc.org)。优选的宿主细胞包含淋巴来源的细胞,如骨髓瘤和淋巴瘤细胞。尤其优选的宿主细胞为P3X63Ag8.653细胞(ATCC登录号CRL-1580)和SP2/0-Ag14细胞(ATCC登录号CRL-1851)。在特别优选的实施例中,重组细胞为P3X63Ab8.653或SP2/0-Ag14细胞。
这些细胞的表达载体可包含以下表达控制序列中的一个或多个,例如但不限于复制起点;启动子(例如,晚期或早期SV40启动子、CMV启动子(美国专利第5,168,062号;第5,385,839号)、HSV tk启动子、pgk(磷酸甘油酸激酶)启动子、EF-1α启动子(美国专利第5,266,491号)、至少一个人类启动子;增强子和/或加工信息位点,如核糖体结合位点、RNA剪接位点、聚腺苷酸化位点(例如,SV40大T Ag poly A添加位点)和转录终止子序列。参见例如Ausubel等人,前述;Sambrook等人,前述。可用于产生本发明的核酸或蛋白质的其它细胞是例如可从美国菌种保藏中心细胞系和杂交瘤目录(www.atcc.org)或其它已知或商业来源已知的和/或可获得的。
当采用真核宿主细胞时,通常将聚腺苷酸化或转录终止子序列并入载体中。终止子序列的一个实例是来自牛生长激素基因的聚腺苷酸化序列。还可包含用于精确剪接转录物的序列。剪接序列的实例为来自SV40的VP1内含子(Sprague等人,《病毒学杂志(J.Virol.)》45:773-781(1983))。另外,如所属领域中已知的,可将控制宿主细胞中的复制的基因序列并入载体中。
蛋白质支架的纯化
可以通过众所周知的方法从重组细胞培养物中回收和纯化蛋白质支架,所述方法包含但不限于蛋白质A纯化、硫酸铵或乙醇沉淀、酸提取、阴离子或阳离子交换色谱法、磷酸纤维素色谱法、疏水相互作用色谱法、亲和色谱法、羟基磷灰石色谱法和凝集素色谱法。高效液相色谱法(“HPLC”)也可以用于纯化。参见例如,Colligan,《当代免疫学实验指南》或《当代蛋白质科学实验指南》,纽约州纽约市的约翰·威利父子出版公司(John Wiley&Sons,NY,N.Y.),(1997-2001),例如第1、4、6、8、9、10章,每个文献均通过引用整体并入本文。
本公开的蛋白质支架包含天然纯化的产物、化学合成程序的产物以及通过重组技术从原核或真核宿主(包含例如大肠杆菌、酵母、高等植物、昆虫和哺乳动物细胞)中产生的产物。取决于重组生产程序中使用的宿主,本公开的蛋白质支架可以是糖基化的或可以是非糖基化的。此类方法在许多标准实验室手册中均有描述,如Sambrook,前述,第17.37-17.42节;Ausubel,前述,第10、12、13、16、18和20章,Colligan,《蛋白质科学(ProteinScience)》,前述,第12-14章,所有文献均通过引用整体并入本文。
氨基酸代码
构成本公开的蛋白质支架的氨基酸通常被缩写。氨基酸名称可通过用所属领域中众所周知的其单字母代码、其三字母代码、名称或三个核苷酸密码子指定氨基酸来指示(参见Alberts,B.等人,《细胞分子生物学(Molecular Biology of The Cell)》,第三版,纽约州的加兰出版公司(Garland Publishing,Inc.,New York),1994)。如本文所指定的,本公开的蛋白质支架可以包含来自天然突变或人为操作的一个或多个氨基酸取代、缺失或添加。可以通过本领域中已知的方法,如定点诱变或丙氨酸扫描诱变来鉴定本公开的蛋白质支架中对于功能必不可少的氨基酸(例如Ausubel,前述,第8、15章;Cunningham和Wells,《科学(Science)》244:1081-1085(1989))。后一程序将单一丙氨酸突变引入分子中的每个残基。接着测试所得突变分子的生物活性,例如但不限于至少一种中和活性。还可以通过结构分析,如结晶、核磁共振或光亲和性标记来鉴定对于蛋白质支架结合至关重要的位点(Smith等人,《分子生物学杂志(J.Mol.Biol.)》224:899-904(1992)和de Vos等人,《科学》255:306-312(1992))。
如技术人员将理解的,本发明包含至少一种本公开的生物活性蛋白质支架。生物活性蛋白质支架的比活性为天然(非合成)、内源性或相关和已知蛋白质支架的比活性的至少20%、30%或40%,并且优选地,至少50%、60%或70%,并且最优选地,至少80%、90%、或95%-99%或更大。分析和定量酶活性和底物特异性的量度的方法是所属领域的技术人员众所周知的。
另一方面,本公开涉及如本文所描述的蛋白质支架和片段,其通过有机部分的共价连接进行修饰。此类修饰可以产生具有改进的药物动力学特性(例如,增加的体内血清半衰期)的蛋白质支架片段。有机部分可为直链或分支链的亲水性聚合基团、脂肪酸基团或脂肪酸酯基团。在特定实施例中,亲水性聚合基团的分子量可为约800到约120,000道尔顿,且可为聚烷二醇(例如聚乙二醇(PEG)、聚丙二醇(PPG))、碳水化合物聚合物、氨基酸聚合物或聚乙烯吡咯烷酮,且脂肪酸或脂肪酸酯基团可包括约八个至约四十个碳原子。
本公开的经修饰的蛋白质支架和片段可以包括直接或间接地与抗体共价结合的一个或多个有机部分。与本公开的蛋白质支架或片段结合的每个有机部分可以独立地为亲水性聚合基团、脂肪酸基团或脂肪酸酯基团。如本文所使用的,术语“脂肪酸”涵盖单羧酸和二羧酸。如本文所使用的,术语“亲水性聚合基团”是指相比于在辛烷中,更可溶于水中的有机聚合物。例如,聚赖氨酸在水中比在辛烷中更可溶。因此,本公开涵盖通过聚赖氨酸的共价连接修饰的蛋白质支架。适合于修饰本公开的蛋白质支架的亲水性聚合物可以是直链或支链的,并且包含例如聚链烷二醇(例如PEG、单甲氧基-聚乙二醇(mPEG)、PPG等)、碳水化合物(例如葡聚糖、纤维素、寡糖、多糖等)、亲水性氨基酸的聚合物(例如聚赖氨酸、聚精氨酸、聚天冬氨酸等)、聚链烷氧化物(例如聚氧乙烯、聚环氧丙烷等)和聚乙烯吡咯烷酮。优选地,修饰本公开的蛋白质支架的亲水性聚合物作为单独分子实体的分子量为约800至约150,000道尔顿。例如,可使用PEG5000和PEG20,000,其中下标是以道尔顿为单位的聚合物的平均分子量。亲水性聚合物基团可被一个至大约六个烷基、脂肪酸或脂肪酸酯基团取代。可以通过采用合适的方法来制备被脂肪酸或脂肪酸酯基团取代的亲水性聚合物。例如,包括胺基的聚合物可与脂肪酸或脂肪酸酯的羧酸根偶合,并且脂肪酸或脂肪酸酯上活化的羧酸根(例如,用N,N-羰基二咪唑活化)可与聚合物上的羟基偶合。
适用于修饰本公开的蛋白质支架的脂肪酸和脂肪酸酯可以是饱和的或者可以含有一个或多个不饱和单元。适合于修饰本公开的蛋白质支架的脂肪酸包含,例如,正十二烷酸酯(C12,月桂酸酯)、正十四烷酸酯(C14,肉豆蔻酸酯)、正十八烷酸酯(C18,硬脂酸酯)、正二十烷酸酯(C20、花生酸酯)、正二十二烷酸酯(C22,山嵛酸酯)、正三十烷酸酯(C30)、正四十烷酸酯(C40)、顺式-Δ9-十八烷酸酯(C18,油酸酯)、所有顺式-Δ5,8,11,14-二十碳四烯酸酯(C20,花生四烯酸)、辛二酸、十四烷二酸、十八烷二酸、二十二烷二酸等。合适的脂肪酸酯包含包括直链或支链低级烷基的二羧酸的单酯。低级烷基可以包括一个至约十二个,优选地一个至约六个碳原子。
可以使用合适的方法,如通过与一种或多种改性剂反应制备经修饰的蛋白质支架和片段。如本文所使用的术语“改性剂”是指包括活化基团的合适的有机基团(例如,亲水聚合物、脂肪酸、脂肪酸酯)。“活化基团”是可以在适当条件下与第二化学基团反应,由此在改性剂与第二化学基团之间形成共价键的化学部分或官能团。例如,胺反应性活化基团包含亲电子基团,如甲苯磺酸酯、甲磺酸酯、卤基(氯、溴、氟、碘)、N-羟基琥珀酰亚胺酯(NHS)等。可以与硫醇反应的活化基团包含例如马来酰亚胺、碘乙酰基、丙烯酰基、吡啶基二硫化物、5-硫醇-2-硝基苯甲酸硫醇(TNB-硫醇)等。醛官能团可以与含胺分子或含酰肼分子偶联,并且叠氮基可与三价磷基反应以形成氨基磷酸酯或磷酸酰亚胺键。将活化基团引入到分子中的合适的方法是本领域已知的(参见例如Hermanson,G.T.,《生物缀合物技术(Bioconiugate Techniques)》,加利福尼亚州圣地亚哥的学术出版社(Academic Press:San Diego,Calif.)(1996))。活化基团可以直接与有机基团(例如亲水性聚合物、脂肪酸、脂肪酸酯)结合,或者通过接头部分,例如二价C1-C12基团结合,其中一个或多个碳原子可以被杂原子,例如氧、氮或硫取代。合适的接头部分包含例如四甘醇、-(CH2)3-、-NH-(CH2)6-NH-、-(CH2)2-NH-和-CH2-O-CH2-CH2-O-CH2-CH2-O-CH-NH-。例如,可以通过使单-Boc-烷基二胺(例如,单-Boc-乙二胺、单-Boc-己二胺)与脂肪酸在1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(EDC)存在的情况下反应,以在游离胺与脂肪酸羧酸酯之间形成酰胺键来产生包括接头部分的改性剂。如所描述的,Boc保护基可以通过用三氟乙酸(TFA)处理以暴露可以与另一种羧酸酯偶联的伯胺,或者可以与马来酸酐反应,并且所得产物环化以产生激活的脂肪酸的马来酰亚胺衍生物而从产物中去除。(参见,例如,Thompson等人,WO 92/16221,其全部教导通过引用并入本文。)
本公开的经修饰的蛋白质支架可以通过使蛋白质支架或片段与改性剂反应来产生。例如,有机部分可以通过使用胺反应性改性剂,例如PEG的NHS酯以非位点特异性方式与蛋白质支架结合。包括与本公开的蛋白质支架的特异性位点结合的有机部分的经修饰的蛋白质支架和片段可以使用合适的方法制备,如反向蛋白水解(Fisch等人.,《生物缀合物化学(Bioconjugate Chem.)》,3:147-153(1992);Werlen等人,《生物缀合物化学》,5:411-417(1994);Kumaran等人,《蛋白质科学》6(10):2233-2241(1997);Itoh等人,《生物有机化学(Bioorg.Chem.)》,24(1):59-68(1996);Capellas等人,《生物技术与生物工程(Biotechnol.Bioeng.)》,56(4):456-463(1997)),以及Hermanson,G.T.,《生物缀合物技术》,加利福尼亚州圣地亚哥的学术出版社(1996)中所描述的方法。
包括另外的治疗活性成分的蛋白质支架组合物
本公开的蛋白质支架化合物、组合物或组合可以进一步包括任何合适的助剂中的至少一种,所述助剂如但不限于稀释剂、粘合剂、稳定剂、缓冲液、盐、亲脂性溶剂、防腐剂、佐剂等。优选药学上可接受的助剂。制备此类无菌溶液的非限制性实例和方法是本领域众所周知的,如但不限于Gennaro编,《雷明顿药物科学(Remington′s PharmaceuticalSciences),第18版,马克出版公司(Mack PublishingCo.)(宾夕法尼亚州伊斯顿(Easton,Pa.))1990。可以常规地选择适用于本领域所熟知的或如本文所描述的蛋白质支架、片段或变体组合物的施用方式、溶解度和/或稳定性的药学上可接受的载体。
可用于本发明组合物的药用赋形剂和添加剂包含但不限于蛋白质、肽、氨基酸、脂质和碳水化合物(例如糖,包含单糖、二糖、三糖、四糖和寡糖;衍生糖,如糖醇、醛糖酸、酯化糖等;以及多糖或糖聚合物),其可以单独或组合存在,单独或组合占重量或体积的1-99.99%。示例性蛋白质赋形剂包含血清白蛋白,如人血清白蛋白(HSA)、重组人白蛋白(rHA)、明胶、酪蛋白等。也可以在缓冲能力中起作用的代表性氨基酸/蛋白质组分包含丙氨酸、甘氨酸、精氨酸、甜菜碱、组氨酸、谷氨酸、天冬氨酸、半胱氨酸、赖氨酸、亮氨酸、异亮氨酸、缬氨酸、甲硫氨酸、苯丙氨酸、阿斯巴甜等。一种优选的氨基酸是甘氨酸。
适用于本发明的碳水化合物赋形剂包含例如单糖,如果糖、麦芽糖、半乳糖、葡萄糖、D-甘露糖、山梨糖等;二糖,如乳糖、蔗糖、海藻糖、纤维二糖等;多糖,如棉子糖、松三糖、麦芽糖糊精、葡聚糖、淀粉等;以及糖醇,如甘露醇、木糖醇、麦芽糖醇、乳糖醇、木糖醇山梨糖醇(山梨醇)、肌醇等。用于本发明的优选的碳水化合物赋形剂是甘露醇、海藻糖和棉子糖。
蛋白质支架组合物还可以包含缓冲液或pH调节剂;通常,缓冲液是由有机酸或碱制备的盐。代表性的缓冲液包含有机酸盐,如柠檬酸、抗坏血酸、葡糖酸、碳酸、酒石酸、琥珀酸、乙酸或邻苯二甲酸的盐;Tris、氨丁三醇盐酸盐或磷酸盐缓冲液。用于本发明组合物的优选的缓冲液是有机酸盐,如柠檬酸盐。
另外地,本发明的蛋白质支架组合物可以包含聚合赋形剂/添加剂,如聚乙烯吡咯烷酮、ficolls(聚合糖)、葡聚糖(例如,环糊精,如2-羟丙基-β-环糊精)、聚乙二醇、调味剂、抗微生物剂、甜味剂、抗氧化剂、抗静电剂、表面活性剂(例如,聚山梨醇酯,如“吐温20”和“吐温80”)、脂质(例如,磷脂、脂肪酸)、类固醇(例如,胆固醇)和螯合剂(例如,EDTA)。
适用于根据本发明的蛋白质支架、部分或变体组合物的这些和另外已知的药用赋形剂和/或添加剂是本领域众所周知的,例如,列于“《雷明顿:药学科学与实践(Remington:The Science&Practice of Pharmacy)》”,第19版,Williams和Williams,(1995)中,以及“《医师手册(Physician′s Desk Reference)》”,第52版,新泽西州蒙特威尔的医药经济公司(Medical Economics,Montvale,N.J.)(1998)中,所述文献的公开内容通过引用整体并入本文。优选的载体或赋形剂材料是碳水化合物(例如糖类和糖醇)和缓冲液(例如柠檬酸盐)或聚合物剂。示例性的载体分子是可用于关节内递送的粘多糖、透明质酸。
从白细胞去除术产物分离T细胞
可以使用封闭系统和标准方法(例如,COBE光谱单采血液成分术系统)在临床站点从受试者收集白细胞去除术产物或血液。优选地,根据标准医院或机构白细胞去除术程序将产品收集在标准白细胞去除术收集袋中。例如,在本公开的方法的优选实施例中,除了在白细胞去除术期间通常使用的抗凝剂或血液添加剂(肝素等)之外,不包含其它抗凝剂或血液添加剂。
或者,可直接从全血分离白细胞(WBC)/外周血单核细胞(PBMC)(使用BiosafeSepax2(封闭/自动化))或T细胞(使用
白细胞去除术程序和/或直接细胞分离程序可以用于本公开的任何受试者。
白细胞去除术产物、血液、WBC/PBMC组合物和/或T细胞组合物应包装在隔热容器中,并应根据批准与临床方案一起使用的标准医院机构采血程序保持在受控的室温(+19℃到+25℃)下。白细胞去除术产物、血液、WBC/PBMC组合物和/或T细胞组合物不应冷藏。
在运输过程中,白细胞去除术产物、血液、WBC/PBMC组合物和/或T细胞组合物的细胞浓度不得超过0.2x10
如果白细胞去除术产物、血液、WBC/PBMC组合物和/或T细胞组合物必须储存(例如过夜),则应将其保存在受控的室温(与上述相同)下。在储存过程中,白细胞去除术产物、血液、WBC/PBMC组合物和/或T细胞组合物的浓度不得超过0.2x10
优选地,白细胞去除术产物、血液、WBC/PBMC组合物和/或T细胞组合物的细胞应储存在自体血浆中。在某些实施例中,如果白细胞去除术产物、血液、WBC/PBMC组合物和/或T细胞组合物的细胞浓度高于0.2x10
优选地,当开始标记和分离程序时,白细胞去除术产物、血液、WBC/PBMC组合物和/或T细胞组合物应不超过24小时。可使用封闭和/或自动化系统(例如,CliniMACS Prodigy)来处理和/或制备白细胞去除术产物、血液、WBC/PBMC组合物和/或T细胞组合物以进行细胞标记。
自动化系统可通过纤维分离和/或洗涤细胞产品(例如白细胞去除术产物、血液、WBC/PBMC组合物和/或T细胞组合物)进行额外的血沉棕黄层分离。
封闭和/或自动化系统可用于制备和标记用于T细胞分离的细胞(来自例如白细胞去除术产物、血液、WBC/PBMC组合物和/或T细胞组合物)。
尽管WBC/PBMC可直接被核转染(这更容易并且节省额外的步骤),但本公开的方法可包含在核转染之前首先分离T细胞。直接对PBMC进行核转染的较容易的策略需要通过CAR信号传导介导的CAR+细胞的选择性扩增,这本身被证明是通过使T细胞功能性耗尽而直接降低了产物的体内效率的较差的扩增方法。产物可以包含T细胞、NK细胞、NKT细胞、单核细胞或其任何组合的CAR+细胞的异质组合物,这增加了患者之间产物的变异性,并且使给药和CRS管理更加困难。由于T细胞被认为是肿瘤抑制和杀伤的主要效应物,所以用于制造自体产物的T细胞分离相对于其它更具异质性的组合物可能会产生重大效益。
T细胞可通过在单向标记程序中富集标记的细胞或耗尽标记的细胞直接分离,或在两步标记程序中间接分离。根据本公开的某些富集策略,可将T细胞收集在细胞收集袋中,且将未标记的细胞(非靶细胞)收集在阴性级分袋中。与本公开的富集策略相比,非标记细胞(靶细胞)被收集在细胞收集袋中,且标记细胞(非靶细胞)被分别收集在阴性级分袋或非靶细胞中。选择试剂可以包含但不限于抗体涂布的珠粒。可在修饰和/或扩增步骤之前去除抗体涂布的珠粒,或在修饰和/或扩增步骤之前将其保留在细胞上。细胞标志物的以下非限制性实例中的一个或多个可用于分离T细胞:CD3、CD4、CD8、CD25、抗生素、CDlc、CD3/CD19、CD3/CD56、CD14、CD19、CD34、CD45RA、CD56、CD62L、CD133、CD137、CD271、CD304、IFN-γ、TCRα/β、和/或其任何组合。分离T细胞的方法可以包含一种或多种特异性结合和/或可检测地标记细胞标志物的以下非限制性实例中的一个或多个,其可用于分离T细胞:CD3、CD4、CD8、CD25、抗生素、CD1c、CD3/CD19、CD3/CD56、CD14、CD19、CD34、CD45RA、CD56、CD62L、CD133、CD137、CD271、CD304、IFN-γ、TCRα/β、和/或其任何组合。这些试剂可能是或不是“良好制造规范”(“GMP”)级。试剂可以包含但不限于Thermo DynaBeads和Miltenyi CliniMACS产品。分离本公开的T细胞的方法可以包含标记和/或分离步骤的多次迭代。在分离本公开的T细胞的方法中的任何时间点,可通过肯定或否定地选择非所要细胞和/或非所要细胞类型而从本公开的T细胞产品组合物中耗尽非所要细胞和/或非所要细胞类型。本公开的T细胞产品组合物可含有可表达CD4、CD8和/或另一种T细胞标志物的其它细胞类型。
本公开的用于T细胞核转染的方法可通过例如用于WBC/PBMC的群体或组合物中的T细胞核转染方法来消除T细胞分离的步骤,所述过程在核转染后包含分离步骤或通过TCR信号传导进行的选择性扩增步骤。
在T细胞富集和/或分选之前或之后,可通过阳性或阴性选择来耗尽某些细胞群体。可从细胞产品组合物耗尽的细胞组合物的实例可以包含骨髓细胞、CD25+调节T细胞(TRegs)、树突状细胞、巨噬细胞、红血球、肥大细胞、γ-δT细胞、自然杀伤(NK)细胞、自然杀伤(NK)样细胞(例如细胞因子诱导的杀伤(CIK)细胞)、诱导的自然杀伤(iNK)T细胞、NK T细胞、B细胞、或其任何组合。
本公开的T细胞产品组合物可以包含CD4+和CD8+ T细胞。在分离或选择程序期间,可将CD4+和CD8+ T细胞分离到单独的收集袋中。CD4+ T细胞和CD8+ T细胞可分别进行进一步处理,或在重构(合并为相同组合物)后以特定比例进行处理。
可重构CD4+ T细胞和CD8+ T细胞的特定比例可取决于所用扩增技术的类型和功效、细胞培养基和/或用于T细胞产品组合物扩增的生长条件。可能的CD4+∶CD8+比率的实例包含但不限于50%∶50%、60%∶40%、40%∶60%、75%∶25%和25%∶75%。
CD8+ T细胞展现杀伤肿瘤细胞的强效能力,而CD4+ T细胞提供支持CD8+ T细胞增殖能力和功能所需的许多细胞因子。因为从正常供体分离的T细胞主要是CD4+,所以在体外关于CD4+∶CD8+比率对T细胞产品组合物进行了人工调整,以提高否则将存在于体内的CD4+T细胞与CD8+ T细胞的比率。优化的比率也可用于自体T细胞产品组合物的离体扩增。考虑到T细胞产品组合物的人工调整的CD4+∶CD8+比率,重要的是应当注意,本公开的产物组合物可显著不同,并且比任何天然存在的T细胞群提供显著更大的优势。
用于T细胞分离的优选的方法可以包含用于产生未接触的全T细胞的阴性选择策略,这意味着所得的T细胞组合物包含尚未被操纵并且含有天然存在的T细胞的多样性/比率的T细胞。
可用于阳性或阴性选择的试剂包含但不限于磁性细胞分离珠粒。在执行本公开的T细胞分离方法中的下一步骤之前,可从或可不从选择的CD4+ T细胞群体、CD8+ T细胞群体或CD4+和CD8+ T细胞的混合群体中去除或去除或耗尽磁性细胞分离珠粒。
可制备T细胞组合物和T细胞产品组合物用于冷冻保存、在标准T细胞培养基中保存和/或基因修饰。
T细胞组合物、T细胞产品组合物、未刺激的T细胞组合物、静息T细胞组合物或其任何部分可使用标准冷冻保存方法冷冻保存,所述方法被优化以在高回收率、活力、表型和/或功能能力下储存和回收人类细胞。可使用可商购获得的冷冻保存培养基和/或方案。本公开的冷冻保存方法可包含不含DMSO的冷冻保存剂(例如,不含CryoSOfree
T细胞组合物、T细胞产品组合物、未刺激的T细胞组合物、静息T细胞组合物或其任何部分可储存于培养基中。可针对细胞储存、细胞基因修饰、细胞表型和/或细胞扩增来优化本公开的T细胞培养基。本公开的T细胞培养基可包含一种或多种抗生素。由于在通过核转染进行基因修饰后,细胞培养基内包含抗生素可降低转染效率和/或细胞产量,因此可改变特定抗生素(或其组合)和其各自的浓度,以获得最佳转染效率和/或通过核转染进行基因修饰后的细胞产量。
本公开的T细胞培养基可包含血清,并且此外,可改变血清组成和浓度以获得最佳细胞结果。对于T细胞培养,人类AB血清优于FBS/FCS,因为尽管考虑将其用于本公开的T细胞培养基中,但FBS/FCS可引入异种蛋白。血清可从打算施用培养物中的T细胞组合物的受试者的血液中分离,因此,本公开的T细胞培养基可以包括自体血清。无血清培养基或血清替代品也可用于本公开的T细胞培养基中。在本公开的T细胞培养基和方法的某些实施例中,无血清培养基或血清替代品可提供优于用异种血清补充培养基的优点,包含但不限于具有更大活力、更高核转染效率、展现更大核转染后活力、显示更合乎需要的细胞表型、和/或添加扩增技术后更大/更快的扩增的更健康细胞。
T细胞培养基可以包含可商购获得的细胞生长培养基。示例性可商购的细胞生长培养基包含但不限于PBS、HBSS、OptiMEM、DMEM、RPMI 1640、AIM-V、X-VIVO 15、CellGro DC培养基、CTS OpTimizer T细胞扩增SFM、TexMACS培养基、PRIME-XV T细胞扩增培养基、ImmunoCult-XF T细胞扩增培养基或其任何组合。
可制备T细胞组合物、T细胞产品组合物、未刺激的T细胞组合物、静息T细胞组合物或其任何部分以用于基因修饰。制备T细胞组合物、T细胞产品组合物、未刺激的T细胞组合物、静息T细胞组合物或其任何部分以用于基因修饰可包含在所需核转染缓冲液中的细胞洗涤和/或再悬浮。可将冷冻保存的T细胞组合物解冻,并准备通过核转染进行遗传修饰。可根据标准或已知方案解冻冷冻保存的细胞。冷冻保存的细胞的解冻和制备可经优化以产生具有更大活力、更高核转染效率、展现更大核转染后活力、显示更合乎需要的细胞表型、和/或添加扩增技术后更大/更快的扩增的细胞。例如,Grifols Albutein(25%人类白蛋白)可用于解冻和/或制备过程。
自体T细胞产品组合物的基因修饰
T细胞组合物、T细胞产品组合物、未刺激的T细胞组合物、静息T细胞组合物或其任何部分可以使用例如核转染策略,如电穿孔来进行基因修饰。待核染的细胞的总数、核转染反应的总体积和样品制备的精确时序可经优化以产生具有更大活力、更高核转染效率、展现更大核转染后活力、显示更合乎需要的细胞表型、和/或添加扩增技术后更大/更快的扩增的细胞。
可使用例如龙沙Amaxa、MaxCyte PulseAgile、Harvard Apparatus BTX、和/或Invitrogen Neon来完成核转染和/或电穿孔。包含但不限于塑料聚合物电极的非金属电极系统可优选用于核转染。
在通过核转染进行基因修饰之前,T细胞组合物、T细胞产品组合物、未刺激的T细胞组合物、静息T细胞组合物或其任何部分可以重新悬浮于核转染缓冲液中。本公开的核转染缓冲液包含可商购获得的核转染缓冲液。本公开的核转染缓冲液可经优化以产生具有更大活力、更高核转染效率、展现更大核转染后活力、显示更合乎需要的细胞表型、和/或添加扩增技术后更大/更快的扩增的细胞。本公开的核转染缓冲液可以包含但不限于PBS、HBSS、OptiMEM、BTXpress、Amaxa Nucleofector、人类T细胞核转染缓冲液和其任何组合。本公开的核转染缓冲液可以包括一个或多个补充因子,以产生具有更大活力、更高核转染效率、展现更大核转染后活力、显示更合乎需要的细胞表型、和/或添加扩增技术后更大/更快的扩增的细胞。示例性补充因子包含但不限于重组人类细胞因子、趋化因子、白介素和其任何组合。示例性细胞因子、趋化因子和白介素包含但不限于IL2、IL7、IL12、IL15、IL21、IL1、IL3、IL4、IL5、IL6、IL8、CXCL8、IL9、IL10、IL11、IL13、IL14、IL16、IL17、IL18、IL19、IL20、IL22、IL23、IL25、IL26、IL27、IL28、IL29、IL30、IL31、IL32、IL33、IL35、IL36、GM-CSF、IFN-γ、IL-1α/IL-1F1、IL-1β/IL-1F2、IL-12p70、IL-12/IL-35p35、IL-13、IL-17/IL-17A、IL-17A/F异二聚体、IL-17F、IL-18/IL-1F4、IL-23、IL-24、IL-32、IL-32β、IL-32γ、IL-33、LAP(TGF-β1)、淋巴毒素-α/TNF-β、TGF-β、TNF-α、TRANCE/TNFSF11/RANK L和其任何组合。示例性补充因子包含但不限于盐、矿物质、代谢物或其任何组合。示例性盐、矿物质和代谢物包含但不限于HEPES、烟酰胺、肝素、丙酮酸钠、L-谷氨酰胺、MEM非必需氨基酸溶液、抗坏血酸、核苷、FBS/FCS、人类血清、血清替代品、抗生素、pH调节剂、厄尔氏盐(Earle′s Salt)、2-巯基乙醇、人类转铁蛋白、重组人类胰岛素、人类血清白蛋白、Nucleofector PLUS补充物、KCL、MgCl2、Na2HPO4、NAH2PO4、乳糖酸钠、甘露糖醇、琥珀酸钠、氯化钠、CINa、葡萄糖、Ca(NO3)2、Tris/HCl、K2HPO4、KH2PO4、聚乙烯亚胺、聚乙二醇、泊洛沙姆188、泊洛沙姆181、泊洛沙姆407、聚乙烯吡咯烷酮、Pop313、Crown-5和其任何组合。示例性补充因子包含但不限于培养基,如PBS、HBSS、OptiMEM、DMEM、RPMI 1640、AIM-V、X-VIVO 15、CellGro DC培养基、CTSOpTimizer T细胞扩增SFM、TexMACS培养基、PRIME-XV T细胞扩增培养基、ImmunoCult-XF T细胞扩增培养基和其任何组合。示例性补充因子包含但不限于细胞DNA感应、代谢、分化、信号转导、细胞凋亡路径和其组合的抑制剂。示例性抑制剂包含但不限于TLR9、MyD88、IRAK、TRAF6、TRAF3、IRF-7、NF-KB、1型干扰素、促炎性细胞因子、cGAS、STING、Sec5、TBK1、IRF-3、RNApol III、RIG-1、IPS-1、FADD、RIP1、TRAF3、AIM2、ASC、Caspase1、Pro-IL1B、PI3K、Akt、Wnt3A的抑制剂、糖原合酶激酶-3β(GSK-3β)的抑制剂(例如TWS119)、巴弗洛霉素(Bafilomycin)、氯奎、奎纳克林、AC-YVAD-CMK、Z-VAD-FMK、Z-IETD-FMK和其任何组合。示例性补充因子包含但不限于以增强细胞递送、增强核递送或转运、增强核酸向细胞核的便利转运、增强表染色体核酸的降解和/或降低DNA介导的毒性的方式修饰或稳定一种或多种核酸的试剂。修饰或稳定一个或多个核酸的示例性试剂包含但不限于pH调节剂、DNA结合蛋白、脂质、磷脂、CaPO4、具有或不具有NLS序列的净中性电荷DNA结合肽、TREX1酶和其任何组合。
可在将细胞添加至核转染缓冲液(任选地,含于核转染反应小瓶或比色管内)之前、与其同时或在其之后将转座试剂(包含转座子和转座酶)添加至本公开的核转染反应中。本公开的转座子可以包括质粒DNA、线性化质粒DNA、PCR产物、DOGGYBONE
本公开的转座子可以包括编码一个或多个全长或截短的基因的一个或多个序列。通过本公开的转座子引入的全长和/或截短的基因可以编码以下中的一个或多个:信号肽、Centyrin、单链可变片段(scFv)、铰链、跨膜结构域、共刺激结构域、嵌合抗原受体(CAR)、嵌合T细胞受体(CAR-T)、CARTyrin(包括Centyrin的CAR-T)、受体、配体、细胞因子、耐药性基因、肿瘤抗原、同种异体或自体抗原、酶、蛋白质、肽、多肽、荧光蛋白、突变蛋白或其任何组合。
本公开的转座子可在水、TAE、TBE、PBS、HBSS、培养基、本公开的补充因子或其任何组合中制备。
本公开的转座子可经设计以优化临床安全性和/或改进可制造性。作为非限制性实例,本公开的转座子可经设计以通过消除不必要序列或区域和/或包含非抗生素所选标志物来优化临床安全性和/或改进可制造性。本公开的转座子可为或可不为GMP级。
本公开的转座酶可由质粒DNA、mRNA、蛋白质、蛋白质-核酸组合或其任何组合的一个或多个序列编码。
本公开的转座酶可在水、TAE、TBE、PBS、HBSS、培养基、本公开的补充因子或其任何组合中制备。本公开的转座酶或编码或递送其的序列/构建体可为或可不为GMP级。
本公开的转座子和转座酶可通过任何方式递送到细胞。
尽管本公开的组合物和方法包含通过质粒DNA(pDNA)将本公开的转座子和/或转座酶递送至细胞,但使用质粒进行递送可允许将转座子和/或转座酶整合至细胞的染色体DNA中,可能导致持续转座酶表达。因此,本公开的转座子和/或转座酶可以mRNA或蛋白质的形式递送至细胞,以消除任何染色体整合的可能性。
在将转座子和/或转座酶引入至核转染反应中之前,本公开的转座子和转座酶可单独或彼此组合地预培育。可优化转座子和转座酶中的每一个的绝对量以及相对量,例如转座子与转座酶的比例。
在任选地于小瓶或比色管中制备核转染反应物后,可将反应物装载至核转染设备中,并根据制造商的方案进行激活以递送电脉冲。用于将本公开的转座子和/或转座酶(或编码本公开的转座子和/或转座酶的序列)递送至细胞的电脉冲条件可经优化以产生具有增强的活力、更高核转染效率、更大核转染后活力、所需细胞表型、和/或添加扩增技术后更大/更快的扩增的细胞。当使用Amaxa核转染仪技术时,考虑用于Amaxa 2B或4D核转染仪的各种核转染程序中的每一种。
在本公开的核转染反应之后,可将细胞轻轻地添加至细胞培养基中。例如,当T细胞经历核转染反应时,可将T细胞添加至T细胞培养基。本公开的核转染后细胞培养基可以包括任何一种或多种市售培养基。本公开的核转染后细胞培养基(包含本公开的核转染后T细胞培养基)可经优化以产生具有更大活力、更高核转染效率、展现更大核转染后活力、显示更合乎需要的细胞表型、和/或添加扩增技术后更大/更快的扩增的细胞。本公开的核转染后细胞培养基(包含本公开的核转染后T细胞培养基)可包括PBS、HBSS、OptiMEM、DMEM、RPMI 1640、AIM-V、X-VIVO 15、CellGro DC培养基、CTS OpTimizer T细胞扩增SFM、TexMACS培养基、PRIME-XV T细胞扩增培养基、ImmunoCult-XF T细胞扩增培养基和其任何组合。本公开的核转染后细胞培养基(包含本公开的核转染后T细胞培养基)可包括一种或多种本公开的补充因子,以增强活力、核转染效率、核转染后活力、细胞表型、和/或添加扩增技术后更大/更快的扩增。示例性补充因子包含但不限于重组人类细胞因子、趋化因子、白介素和其任何组合。示例性细胞因子、趋化因子和白介素包含但不限于IL2、IL7、IL12、IL15、IL21、IL1、IL3、IL4、IL5、IL6、IL8、CXCL8、IL9、IL10、IL11、IL13、IL14、IL16、IL17、IL18、IL19、IL20、IL22、IL23、IL25、IL26、IL27、IL28、IL29、IL30、IL31、IL32、IL33、IL35、IL36、GM-CSF、IFN-γ、IL-1α/IL-1F1、IL-1β/IL-1F2、IL-12p70、IL-12/IL-35p35、IL-13、IL-17/IL-17A、IL-17A/F异二聚体、IL-17F、IL-18/IL-1F4、IL-23、IL-24、IL-32、IL-32β、IL-32γ、IL-33、LAP(TGF-β1)、淋巴毒素-α/TNF-β、TGF-β、TNF-α、TRANCE/TNFSF11/RANKL和其任何组合。示例性补充因子包含但不限于盐、矿物质、代谢物或其任何组合。示例性盐、矿物质和代谢物包含但不限于HEPES、烟酰胺、肝素、丙酮酸钠、L-谷氨酰胺、MEM非必需氨基酸溶液、抗坏血酸、核苷、FBS/FCS、人类血清、血清替代品、抗生素、pH调节剂、厄尔氏盐(Earle′s Salt)、2-巯基乙醇、人类转铁蛋白、重组人类胰岛素、人类血清白蛋白、Nucleofector PLUS补充物、KCL、MgCl2、Na2HPO4、NAH2PO4、乳糖酸钠、甘露糖醇、琥珀酸钠、氯化钠、CINa、葡萄糖、Ca(NO3)2、Tris/HCl、K2HPO4、KH2PO4、聚乙烯亚胺、聚乙二醇、泊洛沙姆188、泊洛沙姆181、泊洛沙姆407、聚乙烯吡咯烷酮、Pop313、Crown-5和其任何组合。示例性补充因子包含但不限于培养基,如PBS、HBSS、OptiMEM、DMEM、RPMI 1640、AIM-V、X-VIVO 15、CellGro DC培养基、CTS OpTimizer T细胞扩增SFM、TexMACS培养基、PRIME-XV T细胞扩增培养基、ImmunoCult-XF T细胞扩增培养基和其任何组合。示例性补充因子包含但不限于细胞DNA感应、代谢、分化、信号转导、细胞凋亡路径和其组合的抑制剂。示例性抑制剂包含但不限于TLR9、MyD88、IRAK、TRAF6、TRAF3、IRF-7、NF-KB、1型干扰素、促炎性细胞因子、cGAS、STING、Sec5、TBK1、IRF-3、RNA polIII、RIG-1、IPS-1、FADD、RIP1、TRAF3、AIM2、ASC、Caspase1、Pro-IL1B、PI3K、Akt、Wnt3A的抑制剂、糖原合酶激酶-3β(GSK-3β)的抑制剂(例如TWS119)、巴弗洛霉素(Bafilomycin)、氯奎、奎纳克林、AC-YVAD-CMK、Z-VAD-FMK、Z-IETD-FMK和其任何组合。示例性补充因子包含但不限于以增强细胞递送、增强核递送或转运、增强核酸向细胞核的便利转运、增强表染色体核酸的降解和/或降低DNA介导的毒性的方式修饰或稳定一种或多种核酸的试剂。修饰或稳定一个或多个核酸的示例性试剂包含但不限于pH调节剂、DNA结合蛋白、脂质、磷脂、CaPO4、具有或不具有NLS序列的净中性电荷DNA结合肽、TREX1酶和其任何组合。
本公开的核转染后细胞培养基(包含本公开的核转染后T细胞培养基)可在室温下使用或预热至例如32℃至37℃之间,包括终点。本公开的核转染后细胞培养基(包含本公开的核转染后T细胞培养基)可预热至维持或增强本公开的转座子或其部分的细胞活力和/或表达的任何温度。
本公开的核转染后细胞培养基(包含本公开的核转染后T细胞培养基)可包含于组织培养瓶或培养皿、G-Rex瓶、生物反应器或细胞培养袋、或任何其它标准容器中。本公开的核转染后细胞培养物(包含本公开的核转染后T细胞培养物)可以保持静止,或者可替代地,其可以被扰动(例如,摇动、旋动或振荡)。
核转染后细胞培养物可以包括经基因修饰的细胞。核转染后T细胞培养物可以包括经基因修饰的T细胞。本公开的经基因修饰的细胞可以在规定的时间段内静息或通过例如添加T细胞扩增剂技术而刺激扩增。在某些实施例中,本公开的经基因修饰的细胞可以在规定的时段内静息,或者立即通过例如添加T细胞扩增剂技术而刺激扩增。可以使本公开的经基因修饰的细胞静息以使其具有足够的适应时间、发生转座的时间和/或进行阳性或阴性选择的时间,从而产生具有增强的活力、更高的核转染效率、更大的核转染后活力、期望的细胞表型、和/或添加扩增技术后更大/更快扩增的细胞。可以使本公开的经基因修饰的细胞静息例如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或更多个小时。在某些实施例中,可例如使本公开的经基因修饰的细胞静息过夜。在某些方面中,过夜为约12小时。可以使本公开的经基因修饰的细胞静息例如1、2、3、4、5、6、7、8、9、10、11、12、13、14或更多天。
可以在核转染反应之后并且在添加扩增剂技术之前选择本公开的经基因修饰的细胞。为了最佳选择经基因修饰的细胞,可以使细胞在核转染后细胞培养基中静息至少2-14天,以促进经修饰的细胞的鉴定(例如,将经修饰的细胞与未经修饰的细胞区分开)。
早在核转染后24小时,在成功对本公开的转座子进行核转染后,在经修饰的T细胞中可检测到本公开的CAR/CARTyrin和选择标志物的表达。由于转座子的表染色体表达,单独的所选标志物的表达可能无法将经修饰的T细胞(已成功整合转座子的那些细胞)与未经修饰的T细胞(未成功整合转座子的那些细胞)区分开。当转座子的表染色体表达阻碍了选择标志物对经修饰的细胞的检测时,可使核转染的细胞(经修饰的和未经修饰的细胞)静息一段时间(例如2-14天)以使细胞停止表达或失去所有表染色体转座子表达。在此延长的静息期后,仅经修饰的T细胞对于选择标志物的表达应保持阳性。对于每个核转染反应和选择过程,可优化此延长的静息期的长度。当转座子的表染色体表达阻碍了选择标志物对经修饰的细胞的检测时,可在没有此延长的静息期的情况下进行选择,但是,可在稍后的时间点(例如扩增阶段期间或之后)包含另外的选择步骤。
本公开的经基因修饰的细胞的选择可以通过任何方式进行。在本公开的方法的某些实施例中,可以通过分离表达特异性选择标志物的细胞来进行本公开的经基因修饰的细胞的选择。本公开的选择标志物可以由转座子中的一个或多个序列编码。由于成功的转座,本公开的选择标志物可以由经修饰的细胞表达(即,不由转座子中的一个或多个序列编码)。在某些实施例中,本公开的经基因修饰的细胞含有赋予对核转染后细胞培养基的有害化合物的抗性的选择标志物。有害化合物可以包括例如抗生素或药物,其缺乏由选择标志物赋予的对经修饰的细胞的抗性,将导致细胞死亡。示例性选择标志物包含但不限于以下基因中的一种或多种的野生型(WT)或突变形式:neo、DHFR、TYMS、ALDH、MDR1、MGMT、FANCF、RAD51C、GCS和NKX2.2。示例性选择标志物包含但不限于可分别通过Ab涂布的磁珠技术或柱选择靶向的表面表达的选择标志物或表面表达的标记。可将可裂解标记(如用于蛋白质纯化的那些)添加至本公开的选择标志物,以进行有效柱选择、洗涤和洗脱。在某些实施例中,本公开的选择标志物不由经修饰的细胞(包含经修饰的T细胞)天然地表达,并且因此可以适用于经修饰的细胞的物理分离(通过例如细胞分选技术)。本公开的示例性选择标志物不由经修饰的细胞(包含经修饰的T细胞)天然地表达,包含但不限于全长、突变或截短形式的CD271、CD19CD52、CD34、RQR8、CD22、CD20、CD33和其任何组合。
可以在核转染反应后选择性扩增本公开的经基因修饰的细胞。在某些实施例中,经修饰的T细胞包括可以通过CAR/CARTyrin刺激选择性扩增的CAR/CARTyrin。可以通过与覆盖靶标的试剂(例如表达靶标的肿瘤系或正常细胞系或被靶标覆盖的扩增剂珠粒)接触来刺激包括CAR/CARTyrin的经修饰的T细胞。可替代地,可以通过与照射的肿瘤细胞、照射的同种异体正常细胞、照射的自体PBMC接触来刺激包括CAR/CARTyrin的经修饰的T细胞。为了使用于刺激的表达靶标的细胞对本公开的细胞产品组合物的污染最小化,例如,当可以将细胞产品组合物直接施用于受试者时,可以使用涂覆有CAR/CARTyrin靶蛋白的扩增剂珠粒进行刺激。可以通过CAR/CARTyrin刺激对包括CAR/CARTyrin的经修饰的T细胞的选择性扩增进行优化,以避免在功能上耗尽经修饰的T细胞。
本公开的所选经基因修饰的细胞可以在规定的时段内冷冻保存、静息或通过添加细胞扩增剂技术而刺激扩增。本公开的所选经基因修饰的细胞可以在规定的时段内冷冻保存、静息,或者立即通过添加细胞扩增剂技术而刺激扩增。当所选经基因修饰的细胞为T细胞时,可以通过添加T细胞扩增剂技术对T细胞进行刺激扩增。可以使本公开的所选经基因修饰的细胞静息例如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或更多个小时。在某些实施例中,可以使本公开的所选经基因修饰的细胞静息例如过夜。在某些方面中,过夜为约12小时。可以使本公开的所选经基因修饰的细胞静息例如1、2、3、4、5、6、7、8、9、10、11、12、13、14或更多天。可以使本公开的所选经基因修饰的细胞静息任何时段,从而产生具有增强的活力、更高的核转染效率、更大的核转染后活力、期望的细胞表型、和/或添加扩增技术后更大/更快的扩增的细胞。
可以使用任何标准冷冻保存方法来冷冻保存所选经基因修饰的细胞(包含本公开的所选经基因修饰的T细胞),所述方法可以针对以高回收率、活力、表型和/或功能能力储存和/或回收人类细胞而进行优化。本公开的冷冻保存方法可以包含可商购获得的冷冻保存培养基和/或方案。
所选经基因修饰的细胞(包含本公开的所选经基因修饰的T细胞)的转座效率可以通过任何方式评估。例如,在应用扩增剂技术之前,可以通过荧光激活细胞分选(FACS)来测量所选经基因修饰的细胞(包含本公开的所选经基因修饰的T细胞)对转座子的表达。确定所选经基因修饰的细胞(包含本公开的所选经基因修饰的T细胞)的转座效率可以包含确定表达转座子(例如CAR)的所选细胞的百分比。可替代地或者另外地,可以通过任何方法评估T细胞的纯度、转座子表达(例如CAR表达)的平均荧光强度(MFI)、CAR(在转座子中递送)介导表达CAR配体的靶细胞的脱粒和/或杀死的能力、和/或所选经基因修饰的细胞(包含本公开的所选经基因修饰的T细胞)的表型。
在满足某些发放标准后,可以发放本公开的细胞产品组合物以向受试者施用。示例性发放标准可以包含但不限于在细胞表面上表达可检测水平的CAR的修饰、选择和/或扩增的T细胞的特定百分比。
自体T细胞产品组合物的基因修饰
本公开的经基因修饰的细胞(包含经基因修饰的T细胞)可以使用扩增剂技术扩增。本公开的扩增剂技术可以包括可商购获得的扩增剂技术。本公开的示例性扩增剂技术包含通过TCR刺激本公开的经基因修饰的T细胞。尽管考虑了用于刺激本公开的经基因修饰的T细胞的所有手段,但优选的方法为通过TCR刺激本公开的经基因修饰的T细胞,从而产生具有优异水平的杀伤能力的产物。
为了通过TCR刺激本公开的经基因修饰的T细胞,可以以3∶1的珠粒∶T细胞比率使用赛默飞扩增剂DynaBead。如果扩增剂珠粒不可生物降解,则可从扩增剂组合物中去除珠粒。例如,可在约5天后从扩增剂组合物中去除珠粒。为了通过TCR刺激本公开的经基因修饰的T细胞,可以使用Miltenyi T细胞激活/扩增试剂。为了通过TCR刺激本公开的经基因修饰的T细胞,可以使用干细胞技术公司(StemCell Technologies)的ImmunoCult人CD3/CD28或CD3/CD28/CD2 T细胞激活剂试剂。此技术可为优选的,因为可溶性四聚抗体复合物将在一段时间后降解且将不需要从方法去除。
人工抗原呈递细胞(APC)可以经工程化以共表达靶抗原并且可以用于通过本公开的TCR和/或CAR刺激本公开的细胞或T细胞。人工APC可以包括或者可以衍生自肿瘤细胞系(包含例如永生化骨髓性白血病细胞系K562),且可经工程化以共表达多个共刺激分子或技术(如CD28、4-1BBL、CD64、mbIL-21、mbIL-15、CAR靶分子等)。当本公开的人工APC与共刺激分子组合时,可优化条件以防止非所要表型和功能能力(即,终末分化的效应T细胞)的产生或出现。
照射的PBMC(自体或同种异体)可以表达一些靶抗原,如CD19,并且可以用于通过本公开的TCR和/或CAR刺激本公开的细胞或T细胞。可替代地或者另外地,照射的肿瘤细胞可以表达一些靶抗原并且可以用于通过本公开的TCR和/或CAR刺激本公开的细胞或T细胞。
板结合和/或可溶性抗CD3、抗CD2和/或抗CD28刺激可以用于通过本公开的TCR和/或CAR刺激本公开的细胞或T细胞。
抗原涂覆的珠粒可以展示靶蛋白并且可用于通过本公开的TCR和/或CAR刺激本公开的细胞或T细胞。可替代地或者另外地,涂覆有CAR/CARTyrin靶蛋白的扩增剂珠粒可以用于通过本公开的TCR和/或CAR刺激本公开的细胞或T细胞。
提出了通过TCR或CAR/CARTyrin并且经由经基因修饰的T细胞上表面表达的CD2、CD3、CD28、4-1BB和/或其它标志物刺激本公开的细胞或T细胞的扩增方法。
可在核转染后立即将扩增技术应用于本公开的细胞,直至核转染后约24小时。尽管在扩增程序期间可使用各种细胞培养基,但本公开的理想的T细胞扩增培养基可产生具有例如更高的活力、细胞表型、总扩增或更高的体内持久性、植入和/或CAR介导的杀死能力的细胞。可以优化本公开的细胞培养基以改善/增强本公开的经基因修饰的细胞的扩增、表型和功能。扩增的T细胞的优选表型可包含T干细胞记忆、T中枢和T效应记忆细胞的混合物。扩增剂Dynabead可能主要产生中枢记忆T细胞,其可在临床上产生优良性能。
本公开的示例性T细胞扩增培养基可部分或完全包含PBS、HBSS、OptiMEM、DMEM、RPMI 1640、A1M-V、X-VIVO 15、CellGro DC培养基、CTS OpTimizer T细胞扩增SFM、TexMACS培养基、PRIME-XV T细胞扩增培养基、ImmunoCult-XF T细胞扩增培养基或其任何组合。本公开的T细胞扩增培养基可以另外的包含一种或多种补充因子。可包含于本公开的T细胞扩增培养基中的补充因子增强活力、细胞表型、总扩增或增加体内持久性、移植和/或CAR介导的杀死能力。可包含于本公开的T细胞扩增培养基中的补充因子包含但不限于重组人类细胞因子、趋化因子和/或白介素,如IL2、IL7、IL12、IL15、IL21、IL1、IL3、IL4、IL5、IL6、IL8、CXCL8、IL9、IL10、IL11、IL13、IL14、IL16、IL17、IL18、IL19、IL20、IL22、IL23、IL25、IL26、IL27、IL28、IL29、IL30、IL31、IL32、IL33、IL35、IL36、GM-CSF、IFN-γ、IL-1α/IL-1F1、IL-1β/IL-1F2、IL-12p70、IL-12/IL-35p35、IL-13、IL-17/IL-17A、IL-17A/F杂二聚体、IL-17F、IL-18/1L-1F4、IL-23、IL-24、IL-32、1L-32β、IL-32γ、IL-33、LAP(TGF-β1)、淋巴毒素-α/TNF-β、TGF-β、TNF-α、TRANCE/TNFSF11/RANKL或其任何组合。可包含于本公开的T细胞扩增培养基中的补充因子包含但不限于盐、矿物质和/或代谢物,如HEPES、烟酰胺、肝素、丙酮酸钠、L-谷氨酰胺、MEM非必需氨基酸溶液、抗坏血酸、核苷、FBS/FCS、人类血清、血清替代品、抗生素、pH调节剂、厄尔氏盐、2-巯基乙醇、人类转铁蛋白、重组人类胰岛素、人类血清白蛋白、Nucleofector PLUS补充物、KCL、MgCl2、Na2HPO4、NAH2PO4、乳糖酸钠、甘露糖醇、琥珀酸钠、氯化钠、CINa、葡萄糖、Ca(NO3)2、Tris/HCl、K2HPO4、KH2PO4、聚乙烯亚胺、聚乙二醇、泊洛沙姆188、泊洛沙姆181、泊洛沙姆407、聚乙烯吡咯烷酮、Pop313、Crown-5或其任何组合。可包含于本公开的T细胞扩增培养基中的补充因子包含但不限于细胞DNA感应、代谢、分化、信号转导和/或细胞凋亡路径的抑制剂,如TLR9、MyD88、IRAK、TRAF6、TRAF3、IRF-7、NF-KB、1型干扰素、促炎性细胞因子、cGAS、STING、Sec5、TBK1、IRF-3、RNA pol III、RIG-1、IPS-1、FADD、RIP1、TRAF3、AIM2、ASC、Caspase1、Pro-IL1B、PI3K、Akt、Wnt3A的抑制剂、糖原合酶激酶-3β(GSK-3β)的抑制剂(例如TWS119)、巴弗洛霉素(Bafilomycin)、氯奎、奎纳克林、AC-YVAD-CMK、Z-VAD-FMK、Z-IETD-FMK或其任何组合。
可包含于本公开的T细胞扩增培养基中的补充因子包含但不限于以增强细胞递送、增强核递送或转运、增强核酸向细胞核的便利转运、增强表染色体核酸的降解和/或降低DNA介导的毒性的方式修饰或稳定核酸的试剂,如pH调节剂、DNA结合蛋白、脂质、磷脂、CaPO4、具有或不具有NLS序列的净中性电荷DNA结合肽、TREX1酶、或其任何组合。
可在扩增过程中通过使用所选药物或化合物来选择本公开的经基因修饰的细胞。例如,在某些实施例中,当本公开的转座子可以编码赋予经基因修饰的细胞对添加到培养基中的药物的抗性的选择标志物时,选择可以在扩增过程期间发生并且可能需要大约1-14天的培养以进行选择。可用作由本公开的转座子编码的选择标志物的耐药性基因的实例包含但不限于基因neo、DHFR、TYMS、ALDH、MDR1、MGMT、FANCF、RAD51C、GCS、NKX2.2或其任何组合的野生型(WT)或突变形式。可添加至选择标志物可赋予其抗性的培养基中的对应药物或化合物的实例包含但不限于G418、嘌呤霉素、安比西林(Ampicillin)、康霉素、甲氨蝶呤、马法兰(Mephalan)、替莫唑胺、长春新碱、依托泊苷、多柔比星(Doxorubicin)、苯达莫司汀(Bendamustine)、氟达拉滨(Fludarabine)、Aredia(帕米膦酸二钠)、Becenum(卡莫司汀(Carmustine))、BiCNU(卡莫司汀)、硼替佐米、卡非佐米、Carmubris(卡莫司汀)、卡莫司汀、克拉芬(环磷酰胺)、环磷酰胺、环磷氮介(环磷酰胺)、达雷木单抗(Daratumumab)、Darzalex(达雷木单抗)、多希(Doxil)(多柔比星盐酸盐脂质体)、盐酸盐多柔比星脂质体、Dox-SL(盐酸盐多柔比星脂质体)、埃罗妥珠单抗(Elotuzumab)、Empliciti(埃罗妥珠单抗)、Evacet(多柔比星盐酸盐脂质体)、Farydak(帕比司他(Panobinostat))、柠檬酸伊沙佐米(IxazomibCitrate)、Kyprolis(卡非佐米)、来那度胺、LipoDox(多柔比星盐酸盐脂质体)、Mozobil(普乐沙福(Plerixafor))、尼欧萨(Neosar)(环磷酰胺)、Ninlaro(柠檬酸伊沙佐米)、帕米膦酸二钠、帕比司他、普乐沙福、泊马度胺、Pomalyst(泊马度胺)、雷利米得(Revlimid)(来那度胺)、Synovir(沙利度胺)、沙利度胺、撒利多迈(Thalomid)(沙利度胺)、万珂(Velcade)(硼替佐米)、唑来膦酸、唑米他(唑来膦酸)、或其任何组合。
本公开的T细胞扩增过程可在WAVE生物反应器、G-Rex烧瓶、或任何其它合适的容器和/或反应器中的细胞培养袋中发生。
本公开的细胞或T细胞培养物可保持稳定、摇动、旋动或振荡。
本公开的细胞或T细胞扩增过程可以优化某些条件,包含但不限于培养持续时间、细胞浓度、T细胞培养基添加/去除的时间表、细胞大小、总细胞数目、细胞表型、细胞群的纯度、经基因修饰的细胞在不断增长的细胞群中所占的百分比、补充剂的用途和组成、扩增剂技术的添加/去除、或其任何组合。
本公开的细胞或T细胞扩增过程可持续至在调配所得的扩增细胞群之前的预定终点为止。例如,本公开的细胞或T细胞扩增过程可持续预定量的时间:至少2、4、6、8、10、12、14、16、18、20、22、24小时;至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30天;至少1、2、3、4、5、6、7、8、9、10、11、12周;至少1、2、3、4、5、6个月,或至少1年。本公开的细胞或T细胞扩增过程可持续至所得培养物达到预定的总细胞密度为止:1、10、100、1000、104、105、106、107、108、109、1010个细胞/体积(μl、ml、L)或其间的任何密度。本公开的细胞或T细胞扩增过程可持续至所得培养物的经基因修饰的细胞,从而展示了本公开的转座子的预定表达水平:阈值表达水平(指示所得经基因修饰的细胞临床上有效的最小、最大或平均表达水平)的1%、10%、20%、30%、40%、50%、60%、70%、80%、90%、或100%或其间的任何百分比。本公开的细胞或T细胞扩增过程可持续至所得培养物的经基因修饰的细胞的比例与未经修饰的细胞的比例达到预定阈值:至少1∶10、1∶9、1∶8、1∶7、1∶6、1∶5、1∶4、1∶3、1∶2、1∶1、2∶1、2∶1、4∶1、5∶1、6∶1、7∶1、8∶1、9∶1、10∶1或其间的任何比率。
经基因修饰的自体T细胞发放的分析
可以在本公开的扩增过程期间或之后评估经基因修饰的细胞的百分比。可以通过荧光激活细胞分选(FACS)来测量本公开的经基因修饰的细胞对转座子的细胞表达。例如,FACS可以用于确定表达本公开的CAR的细胞或T细胞的百分比。可替代地或者另外地,可以评估经基因修饰的细胞或T细胞的纯度、由本公开的经基因修饰的细胞或T细胞表达的CAR的平均荧光强度(MFI)、CAR介导表达CAR配体的靶细胞的脱粒和/或杀死的能力和/或CAR+T细胞的表型。
打算向受试者施用的本公开的组合物可能需要满足一个或多个“发放标准”,所述标准表明组合物对于调配为医药产品和/或向受试者施用是安全且有效的。发放标准可以包含要求本公开的组合物(例如本公开的T细胞产品)包括特定百分比的在其细胞表面上表达可检测水平的本公开的CAR的T细胞。
扩展过程应持续至满足特定标准为止(例如,获得某一总细胞数、获得特定的记忆细胞群体、获得特定大小的群体)。
某些标准用信号表示扩增过程应结束的点。例如,一旦细胞达到300fL的大小,便应对其进行调配、再活化或冷冻保存(否则,达到高于此阈值的大小的细胞可能会开始死亡)。一旦细胞群体达到小于300fL的平均细胞大小便立即进行冷冻保存可在解冻和培养后产生更好的细胞回收,因为细胞在冷冻保存之前细胞尚未达到完全静止的状态(完全静止的大小约为180fL)。在扩增之前,本公开的T细胞可具有约180fL的细胞大小,但在扩增后3天时,其细胞大小可增加超过四倍至约900fL。在接下来的6-12天中,T细胞群体将缓慢减小细胞大小,直至在180fL完全静止。
制备用于调配物的细胞群的方法可以包含但不限于浓缩细胞群体的细胞、洗涤细胞和/或经由针对特定表面表达标志物的耐药性或磁珠分选对细胞进行进一步选择的步骤。制备用于调配的细胞群体的方法可以进一步包含分选步骤以确保最终产物的安全性和纯度。例如,如果来自患者的肿瘤细胞已经用于刺激本公开的经基因修饰的T细胞或者已经基因修饰以便刺激制备用于调配物的本公开的经基因修饰的T细胞,而重要的是最终产物中不包含来自患者的肿瘤细胞。
细胞产品输注和/或冷冻保存以供输注
本公开的药物调配物可分配至用于输注、冷冻保存和/或储存的袋中。
可使用标准方案和任选地不溶性冷冻保存介质来冷冻保存本公开的药物调配物。例如,可使用不含DMSO的冷冻保存剂(例如,不含CryoSOfree
本公开的药物调配物可储存于室温下。有效治疗可能需要多次施用本公开的药物调配物,因此,药物调配物可以预等分的“剂量”包装,所述剂量可储存在一起但分离以施用个别剂量。
本公开的药物调配物可被存档用于随后的再扩增和/或选择,以对于同种异体疗法情况下的相同患者产生额外剂量,所述相同患者可能需要在例如病况缓解和复发后的未来日期给药。
调配物
如上所述,本公开提供了稳定的调配物,其优选地包括具有盐水或所选盐的磷酸盐缓冲液,以及含有防腐剂的保存溶液和调配物,以及适合于药物或兽医用途的多用途保存调配物,其在药学上可接受的调配物中包括至少一种蛋白质支架。保存调配物含有至少一种已知防腐剂或任选地选自由以下组成的组:至少一种苯酚、间甲酚、对甲酚、邻甲酚、氯甲酚、苯甲醇、亚硝酸苯汞、苯氧基乙醇、甲醛、氯丁醇、氯化镁(例如六水合物)、对羟基苯甲酸烷酯(甲酯、乙酯、丙酯、丁酯等)、苯扎氯铵、苄索氯铵、脱氢乙酸钠和硫柳汞、聚合物、或其在水性稀释剂中的混合物。可使用如所属领域中已知的任何合适的浓度或混合物,例如约0.0015%,或其中的任何范围、值或分数。非限制性实例包含无防腐剂、约0.1-2%间甲酚(例如0.2、0.3、0.4、0.5、0.9、1.0%)、约0.1-3%苯甲醇(例如0.5、0.9、1.1、1.5、1.9、2.0、2.5%)、约0.001-0.5%硫柳汞(例如0.005、0.01)、约0.001-2.0%苯酚(例如0.05、0.25、0.28、0.5、0.9、1.0%)、0.0005-1.0%对羟基苯甲酸烷酯(例如、0.00075、0.0009、0.001、0.002、0.005、0.0075、0.009、0.01、0.02、0.05、0.075、0.09、0.1、0.2、0.3、0.5、0.75、0.9、1.0%)等。
如上所述,本发明提供了一种包括包装材料和至少一个小瓶的制品,所述小瓶包括至少一种蛋白质支架与规定缓冲液和/或防腐剂的溶液,任选地在水性稀释剂中,其中所述包装材料包括指示此类溶液可以保存1、2、3、4、5、6、9、12、18、20、24、30、36、40、48、54、60、66、72小时或更长时段的标签。本发明进一步包括制品,所述制品包括包装材料、包括冻干的至少一种蛋白质支架的第一小瓶和包括规定缓冲液或防腐剂的水性稀释剂的第二小瓶,其中所述包装材料包括指示患者在水性稀释剂中重构至少一种蛋白质支架以形成可以保持二十四小时或更长时间的溶液的标签。
根据本发明使用的至少一种蛋白质支架可以通过重组方式产生,包含从哺乳动物细胞或转基因制剂中产生,或者可以从如本文所描述的或本领域已知的其它生物来源纯化。
本发明的产物中至少一种蛋白质支架的范围包含重构时产生的量,如果在湿/干系统中,浓度为约1.0μg/ml至约1000mg/ml,尽管更低和更高的浓度是可操作的并且取决于预期的递送媒剂,例如,溶液调配物将不同于透皮贴剂、肺部、转化粘液质或渗透或微泵方法。
优选地,水性稀释剂任选地进一步包括药学上可接受的防腐剂。优选的防腐剂包含选自由以下组成的组的防腐剂:苯酚、间甲酚、对甲酚、邻甲酚、氯甲酚、苯甲醇、对羟基苯甲酸烷基酯(甲基、乙基、丙基、丁基等)、苯扎氯铵、苄索氯铵、脱氢醋酸钠和硫柳汞,或其混合物。调配物中使用的防腐剂的浓度是足以产生抗微生物作用的浓度。此类浓度取决于所选择的防腐剂并且容易由技术人员确定。
其它赋形剂,例如等渗剂、缓冲剂、抗氧化剂和防腐增强剂,可以任选地并且优选地添加到稀释剂中。等渗剂,如甘油通常以已知浓度使用。优选添加生理耐受的缓冲液以提供改进的pH对照。调配物可以覆盖宽范围的pH,如约pH 4至约pH 10,和优选的约pH 5至约pH 9的范围,以及最优选的约6.0至约8.0的范围。优选地,本发明的调配物具有介于约6.8至约7.8之间的pH。优选的缓冲液包含磷酸盐缓冲液,最优选地是磷酸钠,具体地是磷酸盐缓冲盐水(PBS)。
其它添加剂,如药学上可接受的增溶剂,如吐温20(聚氧乙烯(20)脱水山梨糖醇月桂酸酯)、吐温40(聚氧乙烯(20)脱水山梨糖醇单棕榈酸酯)、吐温80(聚氧乙烯(20)脱水山梨醇单油酸酯)、普朗尼克(Pluronic)F68(聚氧乙烯聚氧丙烯嵌段共聚物),以及PEG(聚乙二醇)或非离子表面活性剂,如聚山梨醇酯20或80或泊洛沙姆(poloxamer)184或188、
本发明的调配物可以通过包括混合至少一种蛋白质支架和选自由以下组成的租的防腐剂的方法来制备:苯酚、间甲酚、对甲酚、邻甲酚、氯甲酚、苯甲醇、对羟基苯甲酸烷基酯(甲基、乙基、丙基、丁基等)、苯扎氯铵、苄索氯铵、脱氢醋酸钠和硫柳汞或其在水性稀释剂中的混合物。使用常规溶解和混合程序在水性稀释剂中混合至少一种蛋白质支架和防腐剂。为了制备合适的调配物,例如,将缓冲溶液中测量量的至少一种蛋白质支架与缓冲溶液中的期望的防腐剂组合,其量足以提供期望浓度的蛋白质和防腐剂。本领域的普通技术人员将认识到此过程的变化。例如,添加组分的顺序、是否使用另外的添加剂、制备调配物的温度和pH是可以针对所使用的浓度和施用方式进行优化的所有因素。
可以将所要求的调配物作为澄清溶液或作为包括一小瓶冻干的至少一种蛋白质支架的双小瓶提供给患者,所述至少一种蛋白支架在水性稀释剂中用含有水、防腐剂和/或赋形剂,优选地磷酸盐缓冲液和/或盐水以及选定的盐的第二小瓶重构。需要重构的单个溶液小瓶或双小瓶可以多次重复使用,并且可以满足单个或多个周期的患者治疗,并且因此可以提供比目前可用的治疗方案更方便的治疗方案。
本发明所要求的制品适用于在立即到二十四小时或更长范围内的时段内施用。因此,本发明所要求的制品向患者提供显著优点。本发明的调配物可以任选地在约2℃至约40℃的温度下安全储存,并且在很长一段时间内保留蛋白质的生物活性,因此允许包装标签指示溶液可以在6、12、18、24、36、48、72或96小时或更长时段内保存和/或使用。如果使用保存的稀释剂,则此类标签可以包含长达1-12个月、半年、一年半和/或两年的使用。
本发明的至少一种蛋白质支架的溶液可以通过包括将至少一种蛋白质支架混合在水性稀释剂中的方法来制备。使用常规溶解和混合程序进行混合。为了制备合适的稀释剂,例如,将测量量的至少一种蛋白质支架在水或缓冲液中以足以提供期望浓度的蛋白质和任选地防腐剂或缓冲液的量组合。本领域的普通技术人员将认识到此过程的变化。例如,添加组分的顺序、是否使用另外的添加剂、制备调配物的温度和pH是可以针对所使用的浓度和施用方式进行优化的所有因素。
可以将所要求的产物作为澄清溶液或作为包括一小瓶冻干的至少一种蛋白质支架的双小瓶提供给患者,所述至少一种蛋白支架用含有水性稀释剂的第二小瓶重构。需要重构的单个溶液小瓶或双小瓶可以多次重复使用,并且可以满足单个或多个周期的患者治疗,并且因此提供比目前可用的治疗方案更方便的治疗方案。
所要求的产物可以通过向药房、诊所或其它此类机构和设施提供澄清溶液或包括一小瓶冻干的至少一种蛋白质支架的双小瓶间接地提供给患者,所述蛋白支架用含有水性稀释剂的第二小瓶重构。在此情况下,澄清溶液的体积可以达到一升甚至更大,从而提供了一个大的储存器,可以一次或多次从所述储存器中取出至少一种蛋白质支架溶液的较小部分以转移到较小的小瓶中,并由药房或诊所提供给其客户和/或患者。
包括单瓶系统的公认的装置包含用于递送溶液的笔式注射器装置,如BD Pens、BD
本发明所要求的产品包含包装材料。除了监管机构所需的信息之外,包装材料还提供可使用产品的条件。本发明的包装材料向患者提供说明数以在水性稀释剂中重构至少一种蛋白质支架以形成溶液,并在2-24小时或更长时间内将溶液用于两个小瓶的湿/干产物。对于单瓶溶液产物,标签指示此类溶液可以使用2-24小时或更长时间。本发明要求的产物可用于人类药物产品用途。
本发明的调配物可以通过包括混合至少一种蛋白质支架和所选缓冲液,优选地,含有盐水或选定的盐的磷酸盐缓冲液的方法来制备。使用常规溶解和混合程序在水性稀释剂中混合至少一种蛋白质支架和缓冲液。为了制备合适的调配物,例如,将测量量的在水或缓冲液中的至少一种蛋白质支架与在水中的期望缓冲剂组合,其量足以提供期望浓度的蛋白质和缓冲液。本领域的普通技术人员将认识到此过程的变化。例如,添加组分的顺序、是否使用另外的添加剂、制备调配物的温度和pH是可以针对所使用的浓度和施用方式进行优化的所有因素。
可以将所要求的稳定的或保存的调配物作为澄清溶液或作为包括一小瓶冻干的蛋白质支架的双小瓶提供给患者,所述蛋白质支架在水性稀释剂中用含有防腐剂或缓冲剂和赋形剂的第二小瓶重构。需要重构的单个溶液小瓶或双小瓶可以多次重复使用,并且可以满足单个或多个周期的患者治疗,并且因此提供比目前可用的治疗方案更方便的治疗方案。
稳定蛋白质支架的其它调配物或方法可以产生不同于包括蛋白质支架的冻干粉的澄清溶液。在非澄清溶液中包括颗粒悬浮液的调配物,所述颗粒是含有可变尺寸结构的蛋白质支架的组合物,并且被不同地称为微球、微粒、纳米颗粒、纳米球或脂质体。此类含有活性剂的相对均质的、基本上呈球形的颗粒调配物可以通过使含有活性剂和聚合物的水相与非水相接触,随后通过蒸发非水相以导致颗粒从水相聚结而形成,如教导于美国专利第4,589,330号中。多孔微粒可以使用含有活性剂和分散在连续溶剂中的聚合物的第一相并通过冷冻干燥或稀释-萃取-沉淀从悬浮液中去除所述溶剂来制备,如教导于美国专利第4,818,542号中。用于此类制剂的优选的聚合物是选自由以下组成的组的天然或合成共聚物或聚合物:明胶琼脂、淀粉、阿拉伯半乳聚糖、白蛋白、胶原蛋白、聚乙醇酸、聚乳酸、乙交酯-L(-)丙交酯聚(ε-己内酯、聚(ε-己内酯-CO-乳酸)、聚(ε-己内酯-CO-乙醇酸)、聚(β-羟基丁酸)、聚氧乙烯、聚乙烯、聚(2-氰基丙烯酸烷基酯)、聚(甲基丙烯酸羟乙酯)、聚酰胺、聚(氨基酸)、聚(2-羟乙基DL-天冬酰胺)、聚(酯脲)、聚(L-苯丙氨酸/乙二醇/1,6-二异氰酸基己烷)和聚(甲基丙烯酸甲酯)。特别优选的聚合物是聚酯,如聚乙醇酸、聚乳酸、乙交酯-L(-)丙交酯聚(ε-己内酯)、聚(ε-己内酯-CO-乳酸)和聚(ε-己内酯-CO-乙醇酸)。可用于溶解聚合物和/或活性物质的溶剂包含:水、六氟异丙醇、二氯甲烷、四氢呋喃、己烷、苯或六氟丙酮倍半水合物。用第二相分散含有活性物质的相的过程可以包含迫使所述第一相通过喷嘴中的孔口以影响液滴形成。
干粉调配物可以由除冻干以外的方法产生,如通过喷雾干燥或通过蒸发或通过结晶组合物的沉淀的溶剂萃取,随后通过一个或多个步骤以去除水性溶剂或非水性溶剂。喷雾干燥的蛋白质支架调配物的制备教导于美国专利第6,019,968号中。基于蛋白质支架的干粉组合物可以通过在提供可吸入干粉的条件下在溶剂中喷雾干燥蛋白质支架以及任选的赋形剂的溶液或浆液来制备。溶剂可以包含易干燥的极性化合物,如水和乙醇。蛋白质支架稳定性可以通过在缺乏氧气的情况下,如在氮气层下或通过使用作为干燥气体的氮气进行喷雾干燥程序来增强。另一种相对干燥的调配物是分散在悬浮介质中的多个穿孔微结构的分散体,所述悬浮介质通常包括如在WO 9916419中所教导的氢氟烷烃推进剂。可以使用定量雾化吸入器将稳定的分散体施用于患者的肺。可用于喷雾干燥的药物的工业制造的设备由瑞士步琪有限公司(Buchi Ltd.)或尼罗公司(Niro Corp)制造。
根据本发明,在本文所描述的稳定或保存的调配物或溶液中的至少一种蛋白质支架可以通过包含如本领域所熟知的SC或IM注射;经皮、肺部、转化粘液质、植入物、渗透泵、药筒、微泵或技术人员所熟知的其它方式在内的多种递送方法施用于患者。
治疗应用
本发明还提供了一种使用至少一种本发明的蛋白质支架来用于调节或治疗如本属领域已知的或如本文所描述的细胞、组织、器官、动物或患者的疾病的方法,例如向细胞、组织、器官、动物或患者施用治疗有效量的蛋白质支架或使所述细胞、组织、器官、动物或患者与所述治疗有效量的蛋白质支架接触。本发明还提供了一种用于调节或治疗细胞、组织、器官、动物或患者的疾病,包含但不限于恶性疾病的方法。
本发明还提供了一种用于调节或治疗细胞、组织、器官、动物或患者的至少一种癌症或恶性疾病,包含但不限于以下中的至少一种的方法:白血病、急性白血病、急性成淋巴细胞性白血病(ALL)、急性淋巴细胞性白血病、B细胞、T细胞或FAB ALL、急性髓系白血病(AML)、急性骨髓性白血病、慢性粒细胞性白血病(CML)、慢性淋巴细胞性白血病(CLL)、毛细胞白血病、骨髓增生异常综合征(MDS)、淋巴瘤、霍奇金氏病(Hodgkin′s disease)、恶性淋巴瘤、非霍奇金氏淋巴瘤、伯基特氏淋巴瘤(Burkitt′s lymphoma)、多发性骨髓瘤、复发多发性骨髓瘤、难治性多发性骨髓瘤、卡波氏肉瘤(Kaposi′s sarcoma)、结直肠癌、胰腺癌、鼻咽癌、恶性组织细胞增多病、肿瘤伴生综合症/恶性高钙血症、实体瘤、膀胱癌、乳腺癌、三阴性乳腺癌、结肠直肠癌、子宫内膜癌、头癌、颈癌、遗传性非息肉病性癌、霍奇金氏淋巴瘤、肝癌、肺癌、非小细胞肺癌、卵巢癌、胰腺癌、前列腺癌、阉割抗性前列腺癌、肾细胞癌、睾丸癌、腺癌、肉瘤、恶性黑色素瘤、血管瘤、转移性疾病、癌症相关骨骼再吸收、癌症相关骨痛等。在一些实施例中,所述癌症是多发性骨髓瘤。在一些实施例中,所述癌症是复发多发性骨髓瘤。在一些实施例中,所述癌症是难治性多发性骨髓瘤。在一些实施例中,所述癌症是实体肿瘤。在一些实施例中,所述癌症是前列腺癌。在一些实施例中,所述癌症是阉割抗性前列腺癌(CRPC)。在一些实施例中,所述实体肿瘤是乳腺癌、结肠直肠癌、肺癌、卵巢癌、胰腺癌或肾癌。在一些实施例中,所述乳腺癌是三阴性乳腺癌。
本公开提供了一种治疗癌症的方法,所述方法包括向受试者施用:包括表达嵌合抗原受体(CAR)的T细胞群的第一组合物,其中所述CAR包括抗原识别结构域和包括抗CD20剂的第二组合物。在一些实施例中,所述抗CD20剂是利妥昔单抗(rituximab)、奥法木单抗(ofatumumab)、奥瑞珠单抗(ocrelizumab)、碘i131托西莫单抗(iodinei131tositumomab)、奥滨尤妥珠单抗(obinutuzumab)或替伊莫单抗(ibritumomab)。在一些实施例中,所述抗CD20剂是利妥昔单抗
在一些实施例中,与单独施用CAR-T的受试者相比,向受试者施用CAR-T和抗CD20剂导致受试者的CAR-T的体内存活率和持久性增加。在一些实施例中,血液样品中的CAR-T拷贝数/mL或CAR-T拷贝数/ug DNA是在一段时间内确定的,作为持久性的代表。在一些实施例中,血浆浓度曲线的曲线下面积(AUC)(即由顶部的血浆浓度曲线和底部的x轴线(时间)定义的面积)用作持久性的量度。在一些实施例中,100天后(时间)的血浆浓度曲线的AUC用作持久性的量度。受试者体CAR-T持久性的增加提供了改善对治疗的应答的卓越效果。受试者中AUC的增加提供了改善对治疗的应答的卓越效果。“增加的”或“增强的”量通常是“统计学上显著的”量,并且可以包含大于单独施用CAR的受试者的应答的至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、20%、30%、40%、50%、60%、70%、75%、80%、85%、90%、95%、100%、150%、200%、250%、300%、350%、400%、450%、500%、600%、700%、800%、900%、1000%、1500%、2000%或3000%的增加(包含介于例如11%、12%、13%、14%、15%之间的增量所有百分比)。“增加的”或“增强的”量可以包含大于单独施用CAR-T的受试者的应答的1%-10%、10%-20%、20%-30%、30%-40%、40%-50%、50%-60%、60%-70%、70%-80%、80%-90%、90%-100%、100%-150%或150%-200%的增加。在一些实施例中,与单独施用CAR-T的受试者相比,施用CAR-T和抗CD20剂的受试者的CAR-T的持久性至少高75%。在一些实施例中,与单独施用CAR-T的受试者相比,施用CAR-T和抗CD20剂的受试者的CAR-T的持久性高至少90%。
在一些实施例中,与单独施用CAR的受试者相比,向受试者施用CAR和抗CD20剂导致受试者的CAR的体内持久性和扩增增加。在一些实施例中,与单独施用CAR的受试者相比,向受试者施用CAR和抗CD20剂导致受试者的体内持久性增加但不影响CAR的扩增。
如本文所使用的,术语“抗药物抗体”或“ADA”是指在受试者中产生的针对存在于受试者中的治疗性蛋白质的抗体。经典的抗药物抗体(ADA)应答在本领域被理解为是由向受试者全身施用重组治疗性蛋白引起的。此外,如本文关于CAR-T治疗所使用的,ADA应答旨在涵盖在本文所描述的研究中所观察到的抗体应答,其中产生了与CAR-T结合的抗体(即,针对P-BCMA-101 CAR-T产生的抗体)。
在一些实施例中,与单独施用CAR-T的受试者相比,向受试者施用CAR-T和抗CD20剂导致受试者的对CAR-T的抗药物抗体(ADA)应答降低。在一些实施例中,使用中尺度发现公司(meso scale discovery)(MSD)测定法随时间推移在外周血中测量ADA应答。受试者中ADA应答的降低提供了改善对治疗的应答的卓越效果。“减少的”或“降低的”量通常是“统计学上显著的”量,并且可以包含小于单独施用CAR-T的受试者的应答的1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、20%、30%、40%、50%、60%、70%、80%、90%、100%的减少(包含介于例如11%、12%、13%、14%、15%之间的增量所有百分比)。“减少的”或“降低的”量可以包含小于单独施用CAR-T的受试者的应答的1%-10%、10%-20%、20%-30%、30%-40%、40%-50%、50%-60%、60%-70%、70%-80%、80%-90%或90%-100%的减少。在一些实施例中,与单独施用CAR-T的受试者相比,施用CAR-T和抗CD20剂的受试者对CAR-T的抗药物抗体应答降低至少50%。
本发明的任何方法可以包括向需要此类调节、治疗或疗法的细胞、组织、器官、动物或患者施用有效量的包括至少一种蛋白质支架的组合物或药物组合物。此类方法可以任选地进一步包括用于治疗此类疾病或病症的共施用或组合疗法,其中所述至少一种蛋白质支架、特定部分或其变体的施用进一步包括在选自至少一种烷化剂、有丝分裂抑制剂和放射性药物中的至少一种之前、与其同时、和/或在其之后进行施用。合适的剂量为本领域中众所周知的。参见例如Wells等人编,《药物治疗手册(Pharmacotherapy Handbook)》,第2版,Appleton and Lange,Stamford,Conn.(2000);《PDR药典(PDR Pharmacopoeia)》,《塔拉斯孔口袋药典(Tarascon Pocket Pharmacopoeia)》2000,Deluxe版,美国加利福尼亚州洛玛连达市的塔拉斯康出版公司(Tarascon Publishing,Loma Linda,Calif.)(2000);《哺乳2001药物手册(Nursing 2001 Handbook of Drugs)》,第21版,宾夕法尼亚州春屋的春屋公司(Springhouse Corp.,Springhouse,Pa.),2001;《健康专业人员的药物指南(HealthProfessional′s Drug Guide)》2001,编者Shannon,Wilson,Stang,新泽西州上鞍河的Prentice-Hall公司(Prentice-Hall,Inc,Upper Saddle River,N.J),所述参考文献各自以全文引用的方式并入本文中。
优选的剂量可以任选地包含约0.1-99和/或100-500mg/kg/施用,或其任何范围、值或级分,或实现每单次或多次施用的约0.1-5000μg/ml血清浓度的血清浓度,或其任何范围、值或级分。本发明的蛋白质支架的优选剂量范围为患者体重的约1mg/kg,至多约3、约6或约12mg/kg。
可替代地,施用剂量可以取决于已知因素,如特定药剂的药效学特征,及其施用方式和途径;接受者的年龄、健康状况和体重;症状的性质和程度、同时治疗的种类、治疗的频率以及期望的效果而变化。通常活性成分的剂量可以为每千克体重约0.1至100毫克。每次施用通常为每千克0.1至50毫克,并且优选地为0.1至10毫克/千克或者以缓释形式有效获得期望结果。
作为非限制性实例,人类或动物的治疗可以作为本发明的至少一种蛋白质支架的一次性或周期性剂量提供,所述一次性或周期性剂量为可在第1-40天的中的至少一天,或可替代地或者另外地,第1-52周中的至少一周,或可替代地或者另外地,第1-20年中的至少一年,以每天约0.1至100mg/kg或其任何范围、值或级分使用单次输注或重复剂量提供。
适用于内部施用的剂型(组合物)通常每单位或容器含有约0.001毫克至约500毫克的活性成分。在这些药物组合物中,基于组合物的总重量,活性成分将通常以约0.5-99.999重量%的量存在。
在一些实施例中,第一组合物包括以受试者体重的至少0.1x10
对于肠胃外施用,蛋白质支架可以被调配成与药学上可接受的肠胃外媒剂缔合或单独提供的溶液、悬浮液、乳液、颗粒、粉末或冻干粉末。此类媒剂的实例是水、盐水、林格氏溶液、葡萄糖溶液和约1-10%的人血清白蛋白。也可以使用脂质体和非水媒剂,例如不挥发性油。媒剂或冻干粉末可以含有保持等渗性(例如氯化钠、甘露醇)和化学稳定性(例如缓冲液和防腐剂)的添加剂。调配物通过已知或合适的技术灭菌。
合适的药物载体在《雷明顿药物科学》,A.Osol(本领域的标准参考文本)的最新版本中有所描述。
可替代施用
根据本发明,许多已知和开发的模式可以用于施用药学上有效量的根据本发明的至少一种蛋白质支架。虽然在以下描述中使用了肺部施用,但根据本发明可以使用其它施用方式并获得合适的结果。本发明的蛋白质支架可以在载体中作为溶液、乳液、胶体或悬浮液或者作为干粉使用适合于通过本文所描述的或本领域已知的吸入或其它方式施用的多种装置和方法中的任何一种来递送。
肠胃外调配物和施用
用于肠胃外施用的调配物可以含有作为常见赋形剂的无菌水或盐水、聚亚烷基二醇,如聚乙二醇、植物源油、氢化萘等。根据已知的方法,可以通过使用适当的乳化剂或增湿剂和悬浮剂来制备用于注射的水性或油性混悬液。用于注射的药剂可以是无毒、不可口服施用的稀释剂,如水溶液、无菌注射溶液或溶剂中的悬浮液。作为可用的媒剂或溶剂、水、林格氏溶液、等渗盐水等是允许的;可以使用普通溶剂或悬浮溶剂、无菌不挥发性油。为此目的,可以使用任何种类的不挥发性油和脂肪酸,包含天然或合成或半合成的脂肪油或脂肪酸;天然或合成或半合成的甘油单酯或甘油二酯或甘油三酯。肠胃外施用在本领域中是已知的并且包含但不限于常规的注射方式、如在美国专利第5,851,198号中所描述的气压无针注射装置,以及如在美国专利第5,839,446号中所描述的激光穿孔器装置,所述美国专利通过引用整体并入本文。
可替代递送
本发明进一步涉及通过以下方式的至少一种蛋白质支架的施用:肠胃外、皮下、肌肉内、静脉内、关节内、支气管内、腹内、囊内、软骨内、腔内、体腔内、小脑内、脑室内、大肠内、宫颈内、胃内、肝内、心肌内、骨内、骨盆内、心包内、腹膜内、胸膜内、前列腺内、肺内、直肠内、肾内、视网膜内、脊柱内、滑膜内、胸内、子宫内、膀胱内、病灶内、团注、阴道、直肠、口腔、舌下、鼻内或经皮方式。可以制备至少一种蛋白质支架组合物以用于肠胃外(皮下、肌肉内或静脉内)或任何其它施用,特别是以液体溶液或悬浮液的形式;用于阴道或直肠施用,特别是以半固体形式,如但不限于乳膏和栓剂;用于口腔或舌下施用,如但不限于以片剂或胶囊的形式;或鼻内,如但不限于粉末、滴鼻剂或气雾剂或某些药剂的形式;或经皮,如不限于凝胶、软膏、洗剂、混悬液或具有化学增强剂如二甲亚砜,以改变皮肤结构或增加透皮贴剂中的药物浓度的贴剂递送系统(Junginger等人,“《药物渗透增强(Drug PermeationEnhancement)》;”Hsieh,D.S.编,第59-90页(纽约州的马塞尔·德克尔公司(MarcelDekker,Inc.New York)1994,所述文献通过引用整体并入本文),或与能够将含有蛋白质和肽的调配物应用到皮肤的氧化剂一起(WO 98/53847),或应用电场来创建瞬时传输通路,如电穿孔,或增加带电药物通过皮肤的流动性,如离子电渗,或应用超声波,如超音播导(美国专利第4,309,989和4,767,402号)(上述出版物和专利通过引用整体并入本文)。
肺部/鼻施用
对于肺部施用,优选地,至少一种蛋白质支架组合物以有效到达肺或鼻窦的下气道的粒径递送。根据本发明,可以通过本领域已知的用于通过吸入施用治疗剂的多种吸入装置或鼻装置中的任何一种来递送至少一种蛋白质支架。这些能够在患者的窦腔或肺泡中沉积雾化调配物的装置包含定量雾化吸入器、雾化器、干粉发生器、喷雾器等。适用于指导蛋白质支架的肺部或鼻施用的其它装置也是本领域已知的。所有此类装置均可以使用适合于在气雾剂中分配蛋白质支架的施用的调配物。此类气雾剂可以包含溶液(水性和非水性两者)或固体颗粒。
像沙丁胺醇(Ventolin)定量雾化吸入器等定量雾化吸入器通常使用推进剂气体并且需要在吸气期间致动(参见例如WO 94/16970、WO 98/35888)。干粉吸入器,如Turbuhaler
优选地,包括至少一种蛋白质支架的组合物通过干粉吸入器或喷雾器递送。用于施用本发明的至少一种蛋白质支架的吸入装置有若干个期望特征。例如,通过吸入装置递送是有利可靠的、可再现的和准确的。吸入装置可以任选地递送小的干颗粒,例如小于约10μm,优选地约1-5μm,以获得良好的可呼吸性。
以喷雾形式施用蛋白质支架组合物
可以通过在压力下迫使至少一种蛋白质支架的悬浮液或溶液通过喷嘴来产生包含蛋白质支架组合物的喷雾。可以选择喷嘴尺寸和配置、所施加的压力和液体进料速率以实现期望输出和颗粒尺寸。例如,可以通过与毛细管或喷嘴进料相关的电场来产生电喷雾。有利地,由喷雾器递送的至少一种蛋白质支架组合物的颗粒具有小于约10μm,优选地,在约1μm至约5μm的范围内,并且最优选地,约2μm至约3μm的粒径。
适用于喷雾器的至少一种蛋白质支架组合物的调配物通常包含在水溶液中的蛋白质支架组合物,所述水溶液的浓度为每ml溶液或mg/gm的约0.1mg至约100mg,或其中的任何范围、值或级分的至少一种蛋白质支架组合物。所述调配物可以包含试剂,如赋形剂、缓冲剂、等渗剂、防腐剂、表面活性剂,并且优选地,锌。所述调配物还可以包含用于稳定蛋白质支架组合物的赋形剂或试剂,如缓冲剂、还原剂、本体蛋白质或碳水化合物。可用于调配蛋白质支架组合物的本体蛋白质包含白蛋白、鱼精蛋白等。可用于调配蛋白质支架组合物的典型的碳水化合物包含蔗糖、甘露醇、乳糖、海藻糖、葡萄糖等。蛋白质支架组合物调配物还可以包含表面活性剂,所述表面活性剂可以减少或防止由溶液雾化形成气雾剂而引起的蛋白质支架组合物的表面诱导的聚集。可以使用各种常规的表面活性剂,如聚氧乙烯脂肪酸酯和醇,以及聚氧乙烯山梨糖醇脂肪酸酯。量将通常介于调配物的0.001与14重量%之间的范围内。用于本发明目的的特别优选的表面活性剂是聚氧乙烯脱水山梨糖醇单油酸酯、聚山梨酯80、聚山梨酯20等。本领域已知的用于蛋白质调配的另外的试剂,如蛋白质支架或特定部分或变体也可以包含在调配物中。
通过雾化器施用蛋白质支架组合物
本发明的蛋白质支架组合物可以通过雾化器,如喷射雾化器或超声雾化器施用。通常,在喷射雾化器中,压缩空气源用于产生通过孔口的高速空气射流。当气体膨胀超出喷嘴时,会产生一个低压区域,所述低压区域通过连接到储液器的毛细管吸取蛋白质支架组合物的溶液。来自毛细管的液体流在其离开管时被剪切成不稳定的细丝和液滴,从而产生气雾剂。可以采用一系列配置、流速和挡板类型来实现给定喷射雾化器的所期望的性能特征。在超声雾化器中,高频电能用于产生振动机械能,通常使用压电换能器。此能量直接或通过耦合流体传送至蛋白质支架组合物的调配物,从而产生包含蛋白质支架组合物的气雾剂。有利地,由雾化器递送的蛋白质支架组合物的颗粒具有小于约10μm,优选地,在约1μm至约5μm的范围内,并且最优选地,约2μm至约3μm的粒径。
适用于喷射雾化器或超声雾化器的至少一种蛋白质支架的调配物通常包含浓度为每ml溶液约0.1mg至约100mg的至少一种蛋白质支架。所述调配物可以包含试剂,如赋形剂、缓冲剂、等渗剂、防腐剂、表面活性剂,并且优选地,锌。所述调配物还可以包含用于稳定至少一种蛋白质支架组合物的赋形剂或试剂,如缓冲剂、还原剂、本体蛋白质或碳水化合物。可用于调配至少一种蛋白质支架组合物的本体蛋白质包含白蛋白、鱼精蛋白等。可用于调配至少一种蛋白质支架的典型的碳水化合物包含蔗糖、甘露醇、乳糖、海藻糖、葡萄糖等。至少一种蛋白质支架调配物还可以包含表面活性剂,所述表面活性剂可以减少或防止由溶液雾化形成气雾剂而引起的至少一种蛋白质支架的表面诱导的聚集。可以使用各种常规的表面活性剂,例如聚氧乙烯脂肪酸酯和醇,以及聚氧乙烯山梨醇脂肪酸酯。量将通常介于调配物的约0.001与4重量%之间的范围内。用于本发明目的的特别优选的表面活性剂是聚氧乙烯脱水山梨糖醇单油酸酯、聚山梨酯80、聚山梨酯20等。本领域已知的用于蛋白质调配的另外的试剂,如蛋白质支架也可以包含在调配物中。
通过定量雾化吸入器施用蛋白质支架组合物
在定量雾化吸入器(MDI)中,推进剂、至少一种蛋白质支架和任何赋形剂或其它添加剂作为包含液化压缩气体的混合物被包含在罐中。计量阀的致动将混合物释放为气雾剂,优选地含有尺寸范围小于约10μm、优选地约1μm至约5μm、并且最优选地约2μm至约3μm的颗粒。可以通过使用通过本领域技术人员已知的各种方法,包含喷射研磨、喷雾干燥、临界点冷凝等产生的蛋白质支架组合物的调配物获得所期望的气雾剂粒径。优选的定量雾化吸入器包含由3M或葛兰素公司制造并使用氢氟烃推进剂的定量雾化吸入器。与定量雾化吸入器装置一起使用的至少一种蛋白质支架的调配物通常包含细碎粉末,所述细碎粉末含有作为在非水介质中的悬浮液的至少一种蛋白质支架,例如,借助表面活性剂悬浮在推进剂中。推进剂可以是为此目的而使用的任何常规材料,如氯氟烃、氟氯烃化合物、氢氟烃或烃,包含三氯氟甲烷、二氯二氟甲烷、二氯四氟乙醇和1,1,1,2-四氟乙烷,HFA-134a(氟代烷烃-134a)、HFA-227(氟代烷烃-227)等。优选地,推进剂是氢氟烃。可以选择表面活性剂以稳定作为推进剂中的悬浮液的至少一种蛋白质支架,以保护活性剂免受化学降解等。合适的表面活性剂包含脱水山梨糖醇三油酸酯、大豆卵磷脂、油酸等。在一些情况下,溶液气雾剂优选的使用溶剂,如乙醇。本领域已知的用于蛋白质调配的另外的试剂也可以包含在调配物中。本领域普通技术人员将认识到,目前发明的方法可以通过通过本文未描述的装置肺部施用至少一种蛋白质支架组合物来实现。
口服调配物和施用
用于口服施用的调配物依赖于佐剂(例如,间苯二酚和非离子表面活性剂,如聚氧乙烯油基醚和正十六烷基聚乙烯醚)的共同施用,以人为地增加肠壁的渗透性,以及酶促抑制剂(例如,胰蛋白酶抑制剂、二异丙基氟磷酸(DFF)和抑肽酶)的共同施用,以抑制酶促降解。用于递送亲水剂的调配物包含蛋白质和蛋白质支架以及意用于口服、口腔、粘膜、鼻、肺部、阴道跨膜或直肠施用的至少两种表面活性剂的组合教导于美国专利第6,309,663号中。用于口施用的固体型剂型的活性成分化合物可以与至少一种添加剂混合,所述添加剂包含蔗糖、乳糖、纤维素、甘露醇、海藻糖、棉子糖、麦芽糖醇、葡聚糖、淀粉、琼脂、精氨酸盐、甲壳素、壳聚糖、果胶、黄蓍胶、阿拉伯胶、明胶、胶原蛋白、酪蛋白、白蛋白、合成或半合成聚合物和甘油酯。这些剂型还可以含有其它类型的添加剂,例如非活性稀释剂、润滑剂(如硬脂酸镁、对羟基苯甲酸酯)、防腐剂(如山梨酸、抗坏血酸、α-生育酚)、抗氧化剂(如半胱氨酸)、崩解剂、粘合剂、增稠剂、缓冲剂、甜味剂、调味剂、芳香剂等。
片剂和丸剂可以进一步被加工成包有肠溶衣的制剂。用于口服施用的液体制剂包含允许药用的乳剂、糖浆、酏剂、混悬剂和溶液制剂。这些制剂可以含有通常用于所述领域的非活性稀释剂,例如水。脂质体也已被描述为用于胰岛素和肝素的药物递送系统(美国专利第4,239,754号)。最近,混合氨基酸(类蛋白)的人工聚合物的微球已被用于递送药物(美国专利第4,925,673号)。此外,载体化合物描述于美国专利第5,879,681号和美国专利第5,871,753号并且用于口服递送生物活性剂是本领域已知的。
粘膜调配物和施用
用于口服施用包封在一种或多种生物相容性聚合物或共聚物赋形剂中的生物活性剂的调配物,优选地,可生物降解的聚合物或共聚物提供微囊剂,由于所得微囊剂的适当尺寸,导致药剂到达淋巴集结(也被称为动物的“派尔集合淋巴结”或“GALT”)并被其吸收,而不会由于药剂已经通过胃肠道而丧失有效性。在支气管(BALT)和大肠中可以发现类似的淋巴集结。上述组织通常被称为粘膜相关淋巴网状组织(MALT)。为了通过粘膜表面吸收,施用至少一种蛋白质支架的组合物和方法包含包括多个亚微颗粒、粘膜粘附性大分子、生物活性肽和水性连续相的乳液,其通过实现乳液颗粒的黏附来促进通过粘膜表面的吸收(美国专利第5,514,670号)。适用于本发明的乳液应用的粘液表面可以包含角膜、结膜、口腔、舌下、鼻、阴道、肺部、胃、肠和直肠施用途径。用于阴道或直肠施用的调配物,例如栓剂可以含有例如聚亚烷基二醇、凡士林、可可脂等作为赋形剂。用于鼻内施用的调配物可以是固体并且含有例如乳糖作为赋形剂,或者可以是滴鼻剂的水性或油性溶液。对于口腔施用,赋形剂包含糖、硬脂酸钙、硬脂酸镁、预胶化淀粉等(美国专利第5,849,695号)。
经皮调配物和施用
对于经皮施用,将至少一种蛋白质支架包封在递送装置,如脂质体或聚合物纳米颗粒、微粒、微囊剂或微球中(除非另有说明,否则统称为微粒)。许多合适的装置是已知的,包含由合成聚合物制成的微粒,所述合成聚合物如聚羟酸,如聚乳酸、聚乙醇酸及其共聚物、聚原酸酯、聚酸酐和聚磷腈,以及天然聚合物,如胶原蛋白、聚氨基酸、白蛋白和其它蛋白质、海藻酸和其它多糖及其组合(美国专利第5,814,599号)。
延长施用和调配物
可能期望将本发明的化合物在延长的时间段内,例如,从单次施用开始持续一周至一年的时间段递送至受试者。可以利用各种缓释、储存或植入剂型。例如,剂型可以含有在体液中具有低溶解度的化合物的药学上可接受的无毒盐,例如,(a)具有多元酸的酸加成盐,所述多元酸如磷酸、硫酸、柠檬酸、酒石酸、单宁酸、扑酸(pamoic acid)、海藻酸、聚谷氨酸、萘单磺酸或二磺酸、聚半乳糖醛酸等;(b)具有多价金属阳离子的酸,所述多价金属阳离子如锌、钙、铋、钡、镁、铝、铜、钴、镍、镉等,或者具有由例如N,N′-二苄基-乙二胺或乙二胺形成的有机阳离子形成的盐;或(c)(a)和(b)的组合,例如单宁酸锌盐。另外地,本发明的化合物,或者优选地相对不溶性盐,如刚刚所描述的相对不溶性盐可以与适用于注射的例如芝麻油在凝胶,例如,单硬脂酸铝凝胶中调配。特别优选的盐是锌盐、单宁酸锌盐、双羟萘酸盐等。另一种类型的用于注射的缓释储存调配物将含有分散用于包封在缓慢降解、无毒、非抗原性聚合物中的化合物或盐,如美国专利第3,773,919号中所描述的聚乳酸/聚乙醇酸聚合物。化合物,或者优选地相对不溶性盐,如上文所描述的相对不溶性盐,也可以被调配成胆固醇基质硅橡胶小丸,特别是用于动物。另外的缓释、储存或植入调配物,例如气体或液体脂质体在文献中是已知的(美国专利第5,770,222号以及“《缓释以及控释药物递送系统(Sustained and Controlled Release Drug Delivery Systems)》”,J.R.Robinson编,纽约州的马塞尔·德克尔公司,1978)。
作为过继性细胞疗法输注经修饰的细胞
本公开提供了经修饰的细胞,其表达已被选择和/或扩增以向有需要的受试者施用的一种或多种本公开的CAR和/或CARTyrin。本公开的经修饰的细胞可被调配成用于在任何温度(包含室温和体温)下储存。本公开的经修饰的细胞可被调配成用于冷冻保存和后续解冻。可在药学上可接受的载剂中调配本公开的经修饰的细胞以从无菌包装直接向受试者施用。可以在具有细胞活力和/或CAR/CARTyrin表达水平的指标的药学上可接受的载剂中调配本公开的经修饰的细胞,以确保最低水平的细胞功能和CAR/CARTyrin表达。本公开的经修饰的细胞可与一种或多种试剂一起以指定密度在药学上可接受的载剂中调配,以抑制进一步的扩增和/或防止细胞死亡。
诱导型促凋亡多肽
本公开的诱导型促凋亡多肽优于现有的诱导型多肽,因为本公开的诱导型促凋亡多肽的免疫原性低得多。虽然本公开的诱导型促凋亡多肽为重组多肽,并且因此为非天然存在的,但重组以产生本公开的诱导型促凋亡多肽的序列不包括宿主人类免疫系统可以识别为“非自身”的非人类序列,并且因此在受试者中诱导接受以下者的免疫应答:本公开的诱导型促凋亡多肽,包含诱导型促凋亡多肽的细胞或包含诱导型促凋亡多肽或包含诱导型促凋亡多肽的细胞的组合物。
本公开提供了包括配体结合区、接头和促凋亡肽的诱导型促凋亡多肽,其中诱导型促凋亡多肽不包括非人类序列。在某些实施例中,非人类序列包括限制位点。在某些实施例中,促凋亡肽为胱天蛋白酶多肽。在某些实施例中,胱天蛋白酶多肽为胱天蛋白酶9多肽。在某些实施例中,胱天蛋白酶9多肽为截短的胱天蛋白酶9多肽。本公开的诱导型促凋亡多肽可为非天然存在的。
本公开的胱天蛋白酶多肽包含但不限于胱天蛋白酶1、胱天蛋白酶2、胱天蛋白酶3、胱天蛋白酶4、胱天蛋白酶5、胱天蛋白酶6、胱天蛋白酶7、胱天蛋白酶8、胱天蛋白酶9、胱天蛋白酶10、胱天蛋白酶11、胱天蛋白酶12、和胱天蛋白酶14。本公开的胱天蛋白酶多肽包含但不限于与凋亡相关的那些胱天蛋白酶多肽,包含胱天蛋白酶2、胱天蛋白酶3、胱天蛋白酶6、胱天蛋白酶7、胱天蛋白酶8、胱天蛋白酶9、和胱天蛋白酶10。本公开的胱天蛋白酶多肽包含但不限于引发凋亡的那些胱天蛋白酶多肽,包含胱天蛋白酶2、胱天蛋白酶8、胱天蛋白酶9、和胱天蛋白酶10。本公开的胱天蛋白酶多肽包含但不限于执行凋亡的那些胱天蛋白酶多肽,包含胱天蛋白酶3、胱天蛋白酶6、和胱天蛋白酶7。
本公开的胱天蛋白酶多肽可由相比于野生型氨基酸或核酸序列具有一个或多个修饰的氨基酸或核酸序列编码。编码本公开的胱天蛋白酶多肽的核酸序列可经密码子优化。相比于野生型氨基酸或核酸序列,对本公开的胱天蛋白酶多肽的氨基酸和/或核酸序列的一个或多个修饰可增加本公开的胱天蛋白酶多肽的相互作用、交联、交叉活化或活化。或者或另外,相比于野生型氨基酸或核酸序列,对本公开的胱天蛋白酶多肽的氨基酸和/或核酸序列的一个或多个修饰可降低本公开的胱天蛋白酶多肽的免疫原性。
相比于野生型胱天蛋白酶多肽,本公开的胱天蛋白酶多肽可为截短的。例如,可截短胱天蛋白酶多肽以消除编码胱天蛋白酶活化和募集结构域(CARD)的序列,以消除或最小化活化局部发炎应答外加在包括本公开的诱导型胱天蛋白酶多肽的细胞中引发凋亡的可能性。编码本公开的胱天蛋白酶多肽的核酸序列可经剪接以形成相比于野生型胱天蛋白酶多肽的本公开的胱天蛋白酶多肽的变异氨基酸序列。本公开的胱天蛋白酶多肽可由重组和/或嵌合序列编码。本公开的重组和/或嵌合胱天蛋白酶多肽可包含来自一种或多种不同胱天蛋白酶多肽的序列。可替代地或者另外地,本公开的重组和/或嵌合胱天蛋白酶多肽可包含来自一个或多个物种的序列(例如人类序列和非人类序列)。本公开的胱天蛋白酶多肽可为非天然存在的。
本公开的诱导型促凋亡多肽的配体结合区可包含有助于或促进本公开的第一诱导型促凋亡多肽与本公开的第二诱导型促凋亡多肽的二聚化的任何多肽序列,所述二聚化活化或诱导促凋亡多肽的交联和细胞凋亡的引发。
配体结合(“二聚化”)区可以包括将允许使用天然或非天然配体(即,和诱导剂),例如非天然的合成配体进行诱导的任何多肽或其功能结构域。取决于诱导型促凋亡多肽的性质和配体(即,诱导剂)的选择,配体结合区可在细胞膜内部或外部。已知多种配体结合多肽和其功能结构域,包含受体。本公开的配体结合区可包含来自受体的一个或多个序列。备受关注的是已知或可易于产生配体(例如小有机配体)的配体结合区。这些配体结合区或受体可以包含但不限于FKBP和亲环蛋白受体、类固醇受体、四环素受体等,以及“非天然的”受体,其可获自抗体,特别是重链或轻链亚基、其突变序列、通过随机程序获得的随机氨基酸序列、组合合成等。在某些实施例中,配体结合区选自由以下组成的组:FKBP配体结合区、亲环蛋白受体配体结合区、类固醇受体配体结合区、亲环蛋白受体配体结合区、和四环素受体配体结合区。
包括一个或多个受体结构域的配体结合区可以为至少约50个氨基酸,并且少于约350个氨基酸,通常少于200个氨基酸,作为天然结构域或其截短的活性部分。结合区可例如为小的(<25kDa,以允许在病毒载体中有效转染),单体的,非免疫原性的,具有合成可接近的、细胞可渗透的、无毒的配体,其可被配置用于二聚化。
取决于诱导型促凋亡多肽的设计和适当配体(即,诱导剂)的可用性,包括一个或多个受体结构域的配体结合区可在细胞内或细胞外。对于疏水性配体,结合区可在膜的任一侧上,但对于亲水性配体,特别是蛋白质配体,结合区通常将在细胞膜外部,除非存在用于内化配体的转运系统,呈配体可用于结合的形式。对于细胞内受体,诱导型促凋亡多肽或包括诱导型促凋亡多肽的转座子或载体可编码在受体结构域序列的5′或3′的信号肽和跨膜结构域,或可具有在受体结构域序列的5′的脂质附着信号序列。当受体结构域在信号肽与跨膜结构域之间时,受体结构域将在细胞外。
抗体和抗体亚单位,例如重链或轻链,具体地说片段,更具体地说可变区的全部或部分,或用以产生高亲和力结合的重链和轻链的融合物可用作本公开的配体结合区。所涵盖的抗体包含作为异位表达的人类产物的抗体,如不会触发免疫应答且通常不在外围(即,CNS/脑区外部)表达的细胞外结构域。此类实例包含但不限于低亲和力神经生长因子受体(LNGFR)和胚胎表面蛋白(即,癌胚抗原)。另外,可针对生理学上可接受的半抗原分子制备抗体,且针对结合亲和力筛选个别抗体亚单位。可通过缺失恒定区、可变区的一部分、诱变可变区等来分离和修饰编码亚单位的cDNA,以获得对配体具有适当亲和力的结合蛋白结构域。以这种方式,几乎任何生理上可接受的半抗原化合物都可以用作配体或提供所述配体的表位。代替抗体单元,可以采用天然受体,其中结合区或结合结构域是已知的,并且存在适用或已知的用于结合的配体。
为了使受体多聚,诱导型促凋亡多肽的配体结合区/受体结构域的配体可以是多聚体,因为配体可具有至少两个结合位点,其中每个结合位点都能够结合至配体受体区(即,具有第一结合位点和第二结合位点的配体,所述第一结合位点能够结合第一诱导型促凋亡多肽的配体结合区,且所述第二结合位点能够结合第二诱导型促凋亡多肽的配体结合区,其中第一和第二诱导型促凋亡多肽的配体结合区是相同或不同的)。因此,如本文所用,术语“多聚配体结合区”是指与多聚配体结合的本公开的诱导型促凋亡多肽的配体结合区。本公开的多聚配体包含二聚配体。本公开的二聚配体可具有两个能够结合至配体受体结构域的结合位点。在某些实施例中,本公开的多聚配体是小的合成有机分子的二聚体或更高阶寡聚物,通常不大于约四聚体,个别分子通常为至少约150Da且小于约5kDa,通常小于约3kDa。可采用多对合成配体和受体。例如,在涉及天然受体的实施例中,二聚FK506可以与FKBP12受体一起使用,二聚化环孢菌素A可与亲环蛋白受体一起使用,二聚化雌激素与雌激素受体一起使用,二聚化糖皮质激素与糖皮质激素受体一起使用,二聚化四环素与四环素受体一起使用,二聚化维生素D与维生素D受体一起使用等。可替代地,可以使用更高阶的配体,例如三聚体。对于涉及非天然的受体的实施例,例如抗体亚基,经修饰的抗体济,包含串联的重链和轻链可变区的单链抗体、由柔性接头分离的单链抗体,或经修饰的受体以及其突变序列等,可以使用多种化合物中的任一种。包括本公开的多聚配体的单元的显著特征是每个结合位点能够以高亲和力结合受体,并且优选地,其能够被化学二聚。同样,方法可用于平衡配体的疏水性/亲水性,以使其能够在功能含量下溶解于血清中,但对于大多数应用而言却跨质膜扩散。
本公开的诱导型促凋亡多肽的活化可通过例如由诱导剂介导的化学诱导的二聚化(CID)来完成,以产生条件控制的蛋白质或多肽。由于不稳定二聚剂的降解或单体竞争性抑制剂的施用,本公开的促凋亡多肽不仅可诱导,而且这些多肽的诱导也是可逆的。
在某些实施例中,配体结合区包括FK506结合蛋白12(FKBP12)多肽。在某些实施例中,配体结合区包括在位置36处具有缬氨酸(V)取代苯丙氨酸(F)(F36V)的FKBP12多肽。在其中配体结合区包括在位置36处具有缬氨酸(V)取代苯丙氨酸(F)(F36V)的FKBP12多肽的某些实施例中,诱导剂可包含AP1903,一种合成药物(CAS索引名称:2-哌啶甲酸,1-[(2S)-1-氧代-2-(3,4,5-三甲氧基苯基)丁基]-,1,2-乙烷二基双[亚氨基(2-氧代-2,1-乙烷二基)氧基-3,1-亚苯基[(1R)-3-(3,4-二甲氧基苯基)亚丙基]]酯,[2S-[1(R*),2R*[S*[S*[1(R*),2R*]]]]]-(9C1)CAS登记号:195514-63-7;分子式:C78H98N4O20;分子量:1411.65))。在其中配体结合区包括在位置36处具有缬氨酸(V)取代苯丙氨酸(F)(F36V)的FKBP12多肽的某些实施例中,诱导剂可包括AP20187(CAS登记号:195514-80-8和分子式:C82H107N5O20)。在某些实施例中,诱导剂为AP20187类似物,例如AP1510。如本文所使用的,诱导剂AP20187、AP1903和AP1510可互换使用。
AP1903 API由Alphora Research Inc.制造且AP1903注射用药品由FormatechInc制造。其在非离子增溶剂Solutol HS 15的25%溶液(250mg/mL,BASF)中调配为AP1903的5mg/mL溶液。在室温下,此调配物为透明、略微黄色的溶液。冷冻后,此调配物经历可逆的相变,产生乳白色溶液。重新升温到室温后,此相变被逆转。3mL玻璃小瓶中的填充量为2.33mL(每个小瓶总共注射约10mg AP1903)。在确定需要施用AP1903后,可例如使用非DEHP、非环氧乙烷灭菌输液器,在2小时内通过IV输注向患者施用单次固定剂量的AP1903注射剂(0.4mg/kg)。AP1903的剂量是针对所有患者单独计算的,且除非体重波动≥10%,否则不会重新计算。输注前,将计算出的剂量稀释在100mL的0.9%生理盐水中。在AP1903的先前I期研究中,用单次剂量的AP1903注射液以在2小时内IV输注的0.01、0.05、0.1、0.5和1.0mg/kg的剂量水平对24名健康志愿者进行治疗。AP1903血浆含量与剂量成正比,其中在0.01-1.0mg/kg剂量范围内的平均Cmax值在约10-1275ng/mL范围内。在初始输注时段后,血液浓度展现出快速分布期,其中在给药后2小时和10小时,血浆水平分别降至最大浓度0.5mg/kg的18%,7%和1%。注射用AP1903在所有剂量水平下均显示安全性和良好耐受性,并展现有利的药物动力学概况。Iuliucci J D等人,《临床药理学杂志(J ClinPharmacol.)》41:870-9,2001。
所用的注射用AP1903的固定剂量例如可为在2小时内静脉内输注的0.4mg/kg。细胞的体外有效信号传导所需的AP1903的量为10-100nM(1600Da MW)。这等于16-160μg/L或~0.016-1.6μg/kg(1.6-160μg/kg)。在上述AP1903的I期研究中,至多耐受1mg/kg的剂量。因此,对于此I期研究,0.4mg/kg可为与治疗细胞组合的AP1903的安全和有效剂量。
与野生型氨基酸或核酸序列相比,本公开的编码配体结合的氨基酸和/或核酸序列可含有一个或多个修饰的序列。例如,本公开的编码配体结合区的氨基酸和/或核酸序列可为密码子优化的序列。与野生型多肽相比,一种或多种修饰可增加配体(例如,诱导剂)对本公开的配体结合区的结合亲和力。或者或另外,与野生型多肽相比,一种或多种修饰可降低本公开的配体结合区的免疫原性。本公开的配体结合区和/或本公开的诱导剂可为非天然存在的。
本公开的诱导型促凋亡多肽包括配体结合区、接头和促凋亡肽,其中所述诱导型促凋亡多肽不包括非人类序列。在某些实施例中,非人类序列包括限制位点。接头可以包括任何有机或无机材料,所述有机或无机材料在配体结合区二聚化后允许促凋亡多肽的相互作用、交联、交叉激活或激活,使得促凋亡多肽的相互作用或激活引发细胞中的细胞凋亡。在某些实施例中,接头是多肽。在某些实施例中,接头是包括富含G/S的氨基酸序列的多肽(“GS”接头)。在某些实施例中,接头是包括氨基酸序列GGGGS(SEQ ID NO:25)的多肽。在优选的实施例中,接头是多肽并且编码所述多肽的核酸未含有限制性内切核酸酶的限制性位点。本公开的接头可以是非天然存在的。
可在能够引发和/或调节本公开的诱导型凋亡多肽在细胞中的表达的任何启动子的转录调控下,在所述细胞中表达本公开的诱导型促凋亡多肽。如本文所使用的,术语“启动子”是指充当RNA聚合酶转录基因的初始结合位点的启动子。例如,本公开的诱导型促凋亡多肽可在能够引发和/或调节本公开的诱导型促凋亡多肽在哺乳动物细胞中的表达的任何启动子(包含但不限于天然、内源、外源和异源启动子)的转录调节下,在哺乳动物细胞中表达。优选的哺乳动物细胞包含人类细胞。因此,本公开的诱导型促凋亡多肽可在能够引发和/或调节本公开的诱导型促凋亡多肽在人类细胞中的表达的任何启动子(包含但不限于人类启动子或病毒启动子)的转录调节下,在人类细胞中表达。在人类细胞中表达的示例性启动子包含但不限于人类细胞巨大病毒(CMV)立即早期基因启动子、SV40早期启动子、劳氏肉瘤病毒(Rous sarcoma virus)长末端重复序列、β-肌动蛋白启动子、大鼠胰岛素启动子和甘油醛-3-磷酸脱氢酶启动子,其中的每一个可用于获得本公开的诱导型促凋亡多肽的高水平表达。还考虑使用所属领域中熟知其它病毒或哺乳动物细胞或细菌噬菌体启动子来实现本公开的诱导型促凋亡多肽的表达,条件是表达水平足以引发细胞凋亡。通过采用具有熟知特性的启动子,可优化转染或转化后所关注蛋白质的表达水平和模式。
选择响应于特定生理或合成信号而被调节的启动子可允许本公开的诱导型促凋亡多肽的诱导型表达。蜕皮激素系统(Invitrogen,Carlsbad,Calif.)是这样的一种系统。设计此系统以允许调节所关注基因在哺乳动物细胞中的表达。其由严格调节的表达机制组成,所述机制几乎不允许基础水平表达转基因,但诱导率超过200倍。所述系统基于果蝇的异二聚蜕皮激素受体,且当蜕皮激素或类似物(如muristerone A)与受体结合时,受体激活启动子以开启下游转基因的表达,从而实现高水平的mRNA转录物。在此系统中,杂二聚体受体的两个单体从一个载体组成性表达,而驱动所关注基因的表达的蜕皮激素响应性启动子在另一质粒上。因此,将这种类型的系统工程化为所关注载体可能是有用的。可能有用的另一诱导型系统是最初由Gossen和Bujard(Gossen和Bujard,《美国国家科学院院刊(Proc.Natl.Acad.Sci.USA)》,89:5547-5551,1992;Gossen等人,《科学》,268:1766-1769,1995)开发的Tet-Off
在一些情况下,期望调节基因疗法载体中转基因的表达。例如,取决于所需表达水平,利用具有不同活性强度的不同病毒启动子。在哺乳动物细胞中,CMV立即早期启动子通常用于提供强大的转录激活。CMV启动子综述于Donnelly,J.J.等人,1997.《免疫学年鉴(Annu.Rev.Immunol.)》15:617-48中。当需要降低转基因的表达水平时,也使用了效力较低的CMV启动子的修饰形式。当需要在造血细胞中表达转基因时,通常使用逆转录病毒启动子,例如来自MLV或MMTV的LTR。取决于所需作用使用的其它病毒启动子包含SV40、RSV LTR、HIV-1和HIV-2 LTR,腺病毒启动子(例如来自E1A、E2A或MLP区域),AAV LTR,HSV-TK和禽肉瘤病毒。
在其它实例中,可选择在特定分化细胞中受发育调节并具有活性的启动子。因此,例如,启动子在多能干细胞中可能没有活性,但例如在多能干细胞分化为更成熟的细胞的情况下,所述启动子可接着被激活。
类似地,组织特异性启动子用于在特定组织或细胞中进行转录,从而减少对非靶向组织的潜在毒性或非所需作用。与例如CMV启动子的更强启动子相比,这些启动子可能导致表达降低,但也可能导致更局限的表达和免疫原性(Bojak,A.等人,2002.《疫苗(Vaccine.)》20:1975-79;Cazeaux,N.等人,2002.《疫苗》20:3322-31)。例如,在适当的情况下,可使用组织特异性启动子,例如PSA相关启动子或前列腺特异性腺激肽释放酶,或肌肉肌酸激酶基因。
组织特异性或分化特异性启动子的实例包含但不限于以下者:B29(B细胞);CD14(单核细胞);CD43(白细胞和血小板);CD45(造血细胞);CD68(巨噬细胞);结蛋白(肌肉);弹性蛋白酶-1(胰腺腺泡细胞);内皮因子(内皮细胞);纤连蛋白(分化细胞、愈合组织);和Flt-1(内皮细胞);GFAP(星形胶质细胞)。
在某些适应症中,需要在施用基因治疗载体后的特定时间激活转录。这是通过例如可调节激素或细胞因子的那些启动子完成的。细胞因子和炎性蛋白响应性启动子包含K和T激肽原(Kageyama等人,(1987)《生物化学杂志(J.Biol.Chem.)》,262,2345-2351)、c-fos、TNF-α、C-反应蛋白(Arcone等人,(1988)《核酸研究(Nucl.Acids Res.)》,16(8),3195-3207)、结合球蛋白(Oliviero等人,(1987)《欧洲分子生物学杂志(EMBO J.)》,6,1905-1912)、血清淀粉样蛋白A2、C/EBPα、IL-1、IL-6(Poli和Cortese,(1989)《美国国家科学院院刊(Proc.Nat′l Acad.Sci.USA)》,86,8202-8206)、补体C3(Wilson等人,(1990)《分子细胞生物学(Mol.Cell.Biol.)》,6181-6191)、IL-8、α-1酸糖蛋白(Prowse和Baumann,(1988)《分子细胞生物学》,8,42-51)、α-1抗胰蛋白酶、脂蛋白脂肪酶(Zechner等人,《分子细胞生物学》,2394-2401,1988)、血管紧张素原(Ron等人,(1991)《分子细胞生物学》,2887-2895)、纤维蛋白原、c-jun(可由佛波醇酯、TNF-α、UV辐射、视黄酸和过氧化氢诱导)、胶原蛋白酶(由佛波醇酯和视黄酸诱导)、金属硫蛋白(重金属和糖皮质激素可诱导)、基质溶素(可由佛波醇酯、白介素-1和EGF诱导)、α-2巨球蛋白和α-1抗胰凝乳蛋白酶。其它启动子包含例如SV40、MMTV、人类免疫缺乏病毒、(MV)、莫洛尼病毒(Moloney virus)、ALV、埃-巴二氏病毒、劳氏肉瘤病毒、人类肌动蛋白、肌球蛋白、血红蛋白和肌酸。
据设想,取决于所需的作用,单独或与另一启动子组合的任何上述启动子都可为有用的。选择启动子和其它调节元件,以使其在所需细胞或组织中起作用。另外,此启动子列表不应被解释为穷尽性或限制性的;与本文公开的启动子和方法结合使用的其它启动子。
实例
实例1-P-BCMA-101(A/K/A抗BCMA CARTYRIN(A08))的表征
在将编码CARTyrin的序列的mRNA电穿孔到T细胞中后评估本公开的CARTyrin的表达。表达CARTyrin的T细胞的功能是通过对瘤株的脱粒来测量的。表征进一步测定与功能的相关性。
图4描绘了A08抗BCMA CARTyrin的结构。
图5-8展示了P-BCMA-101(编码A08抗BCMA CARTyrin)的体外和体内表征。
A08 CARTyrin的体外评估证明了慢病毒转导人原代T细胞后的高水平的表面表达以及针对BCMA+肿瘤细胞的强细胞毒性功能(例如,增殖)(参见图5A-C)。在体外此强大的性能之后,评估了A08 CARTyrin在体内发挥作用的能力。
图6描绘了使用A08 CARTyrin在小鼠中进行体内研究的治疗方案。此研究的结果表明,100%的用P-BCMA-101(编码A08 CARTyrin)处理的小鼠均存活到了第21天(参见图7)。经处理的动物在第21天的这种完全存活伴随着零肿瘤负荷的示出(如通过M蛋白丰度评估,这在第21天在这些动物中均未检测到)(参见图7)。图8提供了进一步展示对照动物以及用P-BCMA-101处理的那些动物中的肿瘤负荷的一系列照片。与对照相比,表达A08CARTyrin的动物表现出降低的肿瘤负荷。
实例2-PIGGYBAC集成的IC9安全开关进入到人全T细胞的表达和功能
使用具有四个piggyBac转座子之一的Amaxa 4D核转染对人全T细胞进行核转染。将接受“模拟”条件的经修饰的T细胞用空piggyBac转座子进行核转染。经修饰的T细胞接受单独含有治疗剂的piggyBac转座子(编码CARTyrin的序列)或含有整合的iC9序列和治疗剂的piggyBac转座子(编码CARTyrin的序列)。
图8提供了含有配体结合区、接头和截短的胱天蛋白酶9多肽的iC9安全开关的示意图。具体地,iC9多肽含有包括包含在位置36(F36V)处缬氨酸(V)取代苯丙氨酸(F)的FK506结合蛋白12(FKBP12)多肽的配体结合区。iC9多肽的FKBP12多肽由包括
为了测试iC9安全开关,将四种经修饰的T细胞中的每一种与0、0.1nM、1nM、10nM、100nM或1000nMAP1903(AP1903的诱导剂)一起温育24小时。使用7-氨基放线菌素D(7-AAD),即一种荧光嵌入剂,作为细胞发生凋亡的标志物,通过流式细胞术评估活力。
在第12天评估了细胞活力(参见图9)。数据表明,随着含有iC9构建体的细胞中诱导剂浓度的增加,细胞群从右下象限移动到左上象限;然而,在缺乏iC9构建体的细胞(仅接受CARTyrin的细胞)中未观察到此效应,在这些细胞中,无论诱导剂的浓度如何,细胞都均匀分布在这两个区域中。此外,在第19天评估了细胞活力(参见图10)。数据显示了如在图9中示出的相同的趋势(核转染后第12天);然而,在稍后的时间点(核转染后第19天),群体向左上象限的转移更为明显。
对聚合的结果进行了量化,并且如在图11中所提供的,示出了iC9安全开关随在第12天(图9和左图)或第19天(图10和右图)对每种经修饰的细胞类型的随着iC9开关的诱导剂(AP1903)浓度而变化的细胞活力百分比的显著影响。iC9安全开关的存在会在第12天诱导大多数细胞凋亡,并且在第19天效果更为显著。
此研究的结果表明,iC9安全开关在与诱导剂(例如AP1903)接触时能够非常有效地消除活性细胞,因为AP1903即使在研究的最低浓度(0.1nM)下也能诱导细胞凋亡。此外,iC9安全开关可以在功能上表示为三顺反子向量的一部分。
实例3:开放标签、多中心、1期研究,以评估P-BCMA-101对患有复发性/难治性多发
研究产品的名称:P-BCMA-101和利米多赛(Rimiducid)
自体CAR-T细胞经工程化以含有与TCRζ和4-1BB信号传导结构域(CARTyrin)偶联的抗B细胞成熟抗原(BCMA)Centyrin。
研究产品简要的描述:P-BCMA-101包含使用被称为piggyBac(PB)DNA修饰系统的基于电穿孔的非病毒(DNA转座子)基因递送系统进行基因修饰的T细胞,所述修饰系统通过“剪切粘贴”机制有效地将DNA从质粒移动到染色体。与慢病毒或y-逆转录病毒转导相比,PB具有包含更安全的插入谱、更高水平的转基因表达、稳定且持续时间更长的转基因表达以及高度富集、有利的T干细胞记忆(Tscm)表型的优势。
P-BCMA-101细胞是从受试者获得的自体T细胞并经修饰以含有3个主要的组分:抗BCMA Centyrin嵌合抗原受体(CARTyrin)基因、二氢叶酸还原酶(DHFR)抗性基因和基于诱导型胱天蛋白酶9(iC9)的安全开关基因。
CARTyrin表达盒编码与CD8a信号/前导肽、CD8a铰链/间隔子、CD8a跨膜结构域、细胞内4-1BB信号传导结构域和T细胞受体(TCR)ζ链信号传导结构域融合的细胞外BCMA结合的Centyrin蛋白(参见图4)。与由基于抗体的单链可变区(scFv)组成的结合结构域相比,CARTyrin结合结构域是完整的人蛋白,其更小、更稳定并且可能免疫原性更低,但具有使得能够具体识别和杀死表达BCMA的MM细胞的类似抗原结合特性。CARTyrin还旨在避免T细胞衰竭。
DHFR选择基因在制造期间用于对转座的P-BCMA-101 T细胞进行离体选择,以产生更均匀的产物。
“安全开关”是在大多数CAR-T细胞中未发现的额外安全性特征,其旨在通过静脉内施用合成小分子二聚体药物活化剂利米多赛(来快速消融P-BCMA-101细胞(如有需要)(参见第15.3节)。
测试产物、剂量、施用途径:1期:单次施用-剂量水平的P-BCMA-101作为单剂量静脉内施用。将以研究设计中描述的3+3递增设计按队列进行剂量水平测试。
1期:周期施用-多剂量的P-BCMA-101在2个周期(队列A和队列C)或3个周期(队列B)中静脉内施用,每个周期2周。施用的总剂量将遵循3+3设计,从≤最大耐受剂量(MTD)开始,如在单剂量递增期间确定的。在队列A和B的第一周期中,将施用总剂量的1/3。在队列A中,将在第2周期中施用至多总剂量的2/3。在队列B中,将在第2周期和第3周期中的每一个中施用至多总剂量的1/3。在队列C中,将在第1周期中施用至多总剂量的2/3,并且将在第2周期中施用至多总剂量的1/3。
1期:组合施用-P-BCMA-101将与所批准的疗法:来那度胺组合施用(队列R:从P-BCMA-101输注前1周开始,每日口服10-25mg,每28天中持续21天;并且队列RP:在单采血液成分术前一周,然后从P-BCMA-101输注前1周开始每28天中持续21天,每日口服10-25mg和利妥昔单抗(队列RIT:在P-BCMA-101输注前12天和5天,然后每8周施用375mg/m
2期:静脉内施用总剂量为6-15×10
如果有临床指征,可以静脉内施用利米多赛0.4mg/kg。
符合第15.4节标准的受试者可能有资格接受P-BCMA-101的另一次输注。
参考疗法:无
主要目的:此研究的主要目的是:
1期-基于剂量限制毒性(DLT)测定P-BCMA-101的安全性和最大耐受剂量(MTD)
2期-评估P-BCMA-101的安全性和功效
主要终点:
1期-每个剂量水平下的具有DLT的受试者的数量以定义MTD
2期-基于不良事件(AE)、检查和标准实验室研究的安全性和耐受性
由独立审查委员会(IRC)评估的国际骨髓瘤工作组标准(Kumar,2016)的总体应答率(ORR)和应答持续时间(DOR)
次要目的:此研究的次要目的是评估:
1期-P-BCMA-101的安全性和可行性;P-BCMA-101的抗骨髓瘤作用;细胞剂量的影响,以指导用于2/3期研究中的进一步评估的剂量选择
2期-细胞因子释放综合征(CRS)的发生率和严重程度;额外的功效终点
次要终点:将评估以下次要终点:
1期-产生方案禁止剂量的P-BCMA-101的能力;基于AE、检查和标准实验室研究的安全性和耐受性;使用李氏准则(Lee,2014)分级的CRS;基于国际骨髓瘤工作组(IMWG)统一应答标准(Rajkumar,2011;Kumar 2016;Cavo,2017)的功效;总体应答率(ORR);应答时间(TTR);应答持续时间(DOR);无进展生存期(PFS);以及总体生存期(OS)。
2期-使用李氏准则(Lee,2014)分级的CRS;IL-6拮抗剂、皮质类固醇和利米多赛的使用率;OS、PFS、TTR、微小残留疾病(MRD)阴性率
探索性目的:此研究的探索性目的是:
1期-评估MM浆细胞BCMA表达、循环可溶性BCMA与临床应答之间的关系
1期和2期-表征P-BCMA-101细胞的扩增和功能持久性;评估推定的CRS标志物与功效或安全性之间的关系;以及评估利米多赛对P-BCMA-101相关不良事件的影响,如果需要的话
探索性终点:在研究过程期间将评估以下探索性终点:
1期-骨髓中的BCMA和/或其它生物标志物;血液中的可溶性BCMA和/或其它生物标志物水平
1期和2期-P-BCMA-101细胞(例如,血液和骨髓中的P-BCMA-101细胞的载体拷贝数/mL);P-BCMA-101细胞亚群组成和克隆性;CRS标志物:C反应蛋白(CRP)、铁蛋白、IL-6、IL-2、TNF-α和干扰素γ(IFN-γ)
受试者群体和数量:确诊为复发性/难治性MM的成人。1期计划多达大约120名受试者。大约100名可评估受试者将在2期中接受治疗。
研究设计
本研究将分多个部分进行:1期,开放标签,单次递增剂量(SAD)极端;1期,多剂量,周期施用期;1期,与来那度胺或利妥昔单抗组合施用期;以及2期,在患有复发性/难治性MM的成年受试者中进行的开放标签,功效和安全性期。
仅在管理肿瘤学受试者和干细胞/骨髓移植方面经验丰富并具有管理嵌合抗原受体(CAR)-T细胞施用预期的急性紧急事件类型的资源的场所才会被选择参与此研究。安全委员会将定期开会审查整个研究期间的数据。
符合方案进入标准的受试者将有资格参加研究。受试者纳入后,将对其进行白细胞去除术以获得外周血单核细胞(PBMC),所述PBMC将被送往制造场所,以产生P-BCMA-101CARTyrin-T细胞。然后将细胞返回至研究部位,并在标准的基于化学疗法的预处理方案之后,将如下所述施用于受试者。
1期-此研究的1期包含在至多大约120名成年受试者中进行的开放标签、多中心、单次递增剂量(SAD)、多队列研究、多剂量周期施用队列研究以及组合施用研究。此研究的1期将遵循剂量递增队列的3+3设计,其中最初计划向每个队列的3名受试者给药P-BCMA-101T细胞(表1)。安全委员会可能会建议在队列中纳入另外的受试者,以进一步评估在该剂量水平下所观察到的结果。对于前2个队列中的每个队列,前3名受试者的给药将错开。如果报告了3级相关毒性、CRS或DLT,则安全委员会将审查数据并决定是否继续进行下一个主题。安全委员会将在每个队列结束时审查数据,以确定进入下一个队列的进展情况。根据安全委员会的判断,从第3队列开始,每个队列中的第一名和第二名受试者的给药将错开。
DLT被定义为至少可能与P-BCMA-101相关的任何美国国家癌症研究所不良事件通用术语标准(NCICTCAE)级别≥3的事件,包含P-BCMA-101细胞的不可控扩增,并且不归因于在最后一次P-BCMA-101细胞输注后的前28天内发病的基础疾病或淋巴细胞清除化疗方案,但以下情况除外:
3级或4级中性粒细胞减少症,伴有或不伴有中性粒细胞减少发热,其在最后一次P-BCMA-101细胞输注后28天内消退
3级发热
3级或4级血小板减少症,伴有或不伴有血小板减少症导致的出血,其在最后一次P-BCMA-101细胞输注后28天内消退
3级或4级贫血和淋巴细胞减少症
3级或4级低丙球蛋白血症
脱发
3级或4级恶心、呕吐或腹泻,其在24小时内对药物治疗有应答
细胞输注后2小时内发生的即刻超敏反应(发热、皮疹、支气管痉挛)(与细胞输注有关),其在使用基于标准抗组胺药物的治疗的情况下在细胞施用后6小时内可逆至2级或更低
3级脑病,其在28天内恢复到低于2级
根据李氏准则(Lee,2014)的3级CRS,其在14天内消退
3级非血液学实验室异常,其在14天内恢复至≤2级
4级非血液学实验室异常,其在7天内恢复至≤2级
表1:剂量递增指南
1.MTD-6名经治疗的受试者中不超过1名受试者出现DLT的最高剂量
3+3剂量递增将按如下方式进行,安全委员会将在每个队列结束时审查数据以确定结果。从队列1开始,将在队列中对至少3名受试者进行给药。如果在前3名受试者中在最后一次给药后到第28天没有观察到DLT,则递增可能会继续到下一个队列。如果在前3名受试者中的1名受试者中观察到DLT,则将有至少3名另外的受试者在此剂量水平下接受治疗。如果没有观察到进一步的DLT,则可能会继续增量。如果在3名或6名受试者中的2名或更多名受试者中观察到DLT,则MTD将被视为处于下一个较低剂量水平,并且可以在较低剂量水平下进行进一步纳入,或者安全委员会可自行决定测试中等剂量水平。如果队列1中有2名或更多名受试者经历DLT,则安全委员会在审查可用数据后,可以选择使用相同的3+3扩展规则对队列-1中的3名受试者进行给药。如果队列-1中有2名或更多名受试者经历DLT,则安全委员会基于对用于评估风险和益处的安仝性和功效数据的考虑,可以选择使用相同的3+3扩展规则以较低剂量对3名受试者进行给药或中止研究。
提议剂量(P-BCMA-101细胞/kg/剂量)包含:
队列-1:0.25×10
队列1: 0.75×10
队列2: 2×10
队列3: 6×10
队列4: 10×10
队列5: 15×10
基于来白所述队列的安全性和功效数据在安仝委员会的指导下对队列中的另外的受试者进行给药,以进一步评估P-BCMA-101的作用,前提是剂量不超过MTD。如果队列5在未完成总体MTD的情况下完成,则安全委员会可以选择以5-10×10
1期-周期施用:在研究的1期周期剂量施用部分,多剂量的P-BCMA-101将在2个周期(队列A和队列C)或3个周期(队列B)中静脉内施用,每个周期2周。施用的总剂量将遵循3+3设计,从≤MTD开始,如在单次剂量递增期间确定的。在队列A和B的第一周期中,将施用总剂量的1/3。在队列A中,将在第2周期中施用至多总剂量的2/3。在队列B中,将在第2周期和第3周期中的每一个中施用至多总剂量的1/3。在队列C中,将在第1周期中施用至多总剂量的2/3,并且将在第2周期中施用至多总剂量的1/3。将使用针对单次施用所描述的相同的3+3剂量递增和/或递减规则。这些程序在第15.5节中有详细说明。
1期-组合施用:P-BCMA-101将与批准的疗法:来那度胺(队列R和队列RP)和利妥昔单抗(队列RIT)组合施用。施用的P-BCMA-101的剂量将遵循3+3设计,以:5MTD开始,如在剂量递增期间测定的。将使用针对单次施用所描述的相同的3+3剂量递增和/或递减规则。这些程序在第15.6节中有详细说明。
2期-此研究的2期是在大约100名患有复发性和/或难治性MM的成年受试者中进行的开放标签、多中心研究。受试者将接受6-15×106个细胞/kg的总剂量(根据在1期确定的时间表)。
研究访视-1期和2期中经治疗的受试者将经受安全性、耐受性和应答(骨髓瘤分期)的系列测量。这些措施将在筛选、纳入或基线访视以及调理化疗期间获得。1期和2期两者中的P-BCMA-101施用时间段和随访将在第10天、第2周、第3周、第4周、第6周、第8周、第3个月、第4个月、第5个月、第6个月、第7个月、第8个月、第9个月进行,并且然后每3个月进行,持续长达P-BCMA-101施用后24个月。在完成或退出此方案后,应同意接受P-BCMA-101的受试者加入单独的方案,此方案允许在最后一次给药之后继续随访共15年以评估长期安全性。
筛选访视-同意的受试者将进行筛选访视以确定资格。符合所有入选标准并且没有任何排除标准的受试者将返回参加纳入和白细胞去除术访视。
纳入访视-符合条件的受试者将返回纳入访视,以提供必须在白细胞去除术之前收集的样品和测量结果。纳入评估将在白细胞去除术前14天(±3天)进行,或获得医学监查员的批准。
白细胞去除术访视-纳入的符合条件的受试者将返回并进行白细胞去除术以获得用于P-BCMA-101制造的PBMC。此访视应在筛选访视的约28天内进行。一旦产品被制造出来,受试者将在白细胞去除术访视后约4周返回进行组合疗法(如果适用)、调理化疗和P-BCMA-101细胞施用时间段。如果不能从白细胞去除术样品中制造满足发放标准的P-BCMA-101细胞,则可以尝试进行第二次白细胞去除术和制造。如果第二次尝试也失败了,则受试者将从研究中退出并被视为未经受研究治疗。
可以根据研究者的判断对在白细胞去除术访视后和调理化疗和P-BCMA-101细胞施用时间段之前经历快速疾病进展的受试者施用挽救疗法。除非必要,否则不应使用挽救疗法,并且将根据受试者的临床病史(优选先前使用过的药剂,并且需要医学监查员批准)由研究者自行决定。如果受试者接受挽救疗法,则调理化疗和P-BCMA-101细胞施用时间段应安排在最后一次挽救疗法治疗的日期后至少2周或5个半衰期时,并且受试者应符合第4节和第6节中所描述的关于进入标准(包含可测量MM的进入标准)和伴随药物的标准。受试者对挽救疗法的应答将由研究者和医学监查员进行评估,以确定受试者是否仍然有资格接受研究产品。
在整个研究期间,出于姑息治疗的目的,受试者将被允许接受放射疗法或血浆置换术和交换。
基线访视(第-12天至第-6天)-一旦产品制造完成,在开始调理化疗前一周期间,受试者将返回进行基线评估并确认继续符合条件。应在第-5天之前的72小时内重复以下评估:小型精神状态检查(MMSE)、体格检查、生命体征、包含电解质和镁在内的化学小组、包含B和T细胞计数在内的血液学、凝血、循环骨髓瘤/浆细胞的评估和妊娠测试(如果适用的话)。必须在开始预处理化疗和组合疗法的7天内进行基线骨髓瘤应答评估。骨髓和肿瘤的基线新鲜样品不用于确认资格,并且7天的窗口旨在为受试者和研究者提供灵活性;如果在筛选期间进行并提供了新的骨髓活检/抽出物,则不需要在基线访视期间重复。
调理化疗和P-BCMA-101细胞施用时间段-在使用P-BCMA-101细胞输注给药之前,受试者将接受300mg/m
在淋巴细胞清除化疗方案后的2个休息日之后,受试者将在大约5分钟至20分钟(第0天)内静脉内施用P-BCMA-101(受试者应预先服用对乙酰氨基酚(acetaminophen)和苯海拉明(diphenhydramine))。使用CAR-T疗法进行的先前研究已观察到在施用研究产品的3-7天内出现峰值毒性。将在输注期间和之后以及之后大约7天密切监测研究受试者。此观察时间段将包含对AE,包含P-BCMA-101细胞相关毒性的出现,如所有受试者的CRS的系列评估。将使用李氏准则(Lee,2014)对CRS进行分级。有关AE分级和管理的指南可在此方案的第8节中和研究参考手册中找到。在第15.3节和研究参考手册中可以找到使用利米多赛对显著P-BCMA-101相关毒性的指南。
如果研究者基于个体患者的风险认为合适,则受试者可以住进医院接受P-BCMA-101施用。不要求住院,但受试者应在最后一个剂量的P-BCMA-101之后大约14天内留在距医院50英里的范围内,并且在出现CRS或神经毒性症状(如发热)的情况下进行住院评估。如果通过住院评估,则受试者在其被研究者评估为稳定之前不会出院。在淋巴细胞清除化疗期间或在满足上述标准后(如研究者认为适当),受试者在P-BCMA-101施用之前可以维持作为住院患者。
随访:第10天、第2周、第3周、第4周、第6周、第8周、第3个月、第4个月、第5个月、第6个月、第7个月、第8个月、第9个月、第12个月、第15个月、第18个月、第21个月和第24个月。受试者将在最后一个剂量的P-BCMA-101之后返回接受定期随访,并且经历对安全性、耐受性和抗骨髓瘤应答的系列评估,如事件时间表中所述。
重复施用:如果在受试者的疾病进展时制造中剩余足够的P-BCMA-101细胞,则经安全委员会批准,可以以至多已成功完成剂量限制毒性评估的最高剂量水平施用额外的细胞。为了接受额外的P-BCMA-101 T细胞输注,受试者将被分配新的受试者识别号,受试者必须满足针对初始给药所描述的所有资格标准,并且除了白细胞去除术外,还将经受相同的筛选、纳入、调理化疗和后续程序。第15.4节中概述了再处理程序。
安全性监测:将建立一个由研究者和发起人的临床代表组成的安全委员会,并定期审查所有受试者和每个队列的数据,以确定剂量递增和纳入。
入选标准:
1.必须签署书面知情同意书;
2.男性或女性,≥18岁;
3.必须在初始诊断时明确诊断为患有IMWG标准所定义的活动性MM(Rajkumar,2014);
4.必须具有由以下标准中的至少1项标准定义的可衡量的MM:
1期:
血清M蛋白大于或等于0.5g/dL(5g/L);
尿M蛋白大干或等于200毫克/24小时;
血清游离轻链(FLC)测定:涉及的FLC水平大于或等于10mg/dL(100mg/L),前提是血清FLC比率异常;
骨髓浆细胞>总骨髓细胞的30%,或其它可测量的骨疾病(例如,可通过PET或CT测量的浆细胞瘤)(经医学监查员批准)
2期:
血清M蛋白大于或等于1.0g/dL(10g/L);
尿M蛋白大于或等于200毫克/24小时;
血清FLC测定:涉及的FLC水平大于或等于10mg/dL(100mg/L),前提是血清FLC比率异常
5.必须具有通过以下所定义的复发性/难治性MM:
1期:
接受过至少3条既往疗法线,其中必须含有蛋白酶体抑制剂和免疫调节剂(IMiD);或者
如果对蛋白酶体抑制剂和IMiD为“双重难治”,定义为在使用这些药剂治疗时或治疗后60天内出现进展,则为接受过至少2条既往疗法线。
2期:
接受过至少3条既往疗法线,其中必须含有蛋白酶体抑制剂、IMiD和CD38靶向疗法,其中至少2条既往线以三联组合的形式进行,并且每条线经历≥2个周期,除非PD是最好的应答;并且
对最近的治疗线具有难治性;以及
经历过ASCT或者不是ASCT的候选人。
注意:诱导疗法、自体干细胞移植(ASCT)和维持疗法,如果按顺序给予而不干预进展,则应视为单线。
6.必须愿意从筛查开始并在整个研究过程中进行节育(有生育能力的男性和女性两者)。
队列R、RP或RIT中的女性必须承诺在开始治疗前4周、疗法期间、剂量中断期间和来那度胺中止后持续4周以及
队列R或RP中的男性在服用来那度胺期间并且在停用来那度胺后至多4周在与具有生殖潜力的女性发生任何性接触时必须始终使用乳胶或合成避孕套,即使他们已经成功进行了输精管切除术。服用来那度胺的男性患者不得捐献精子。
7.必须在筛查时血清妊娠测试为阴性,并且在开始淋巴细胞清除化疗方案前3天内尿测试为阴性(有生育能力的女性)。
队列R和RP中的女性受试者必须在开始来那度胺之前两次妊娠测试为阴性。第一次测试应在受试者开始来那度胺疗法前10-14天内进行,第二次测试应在受试者开始来那度胺疗法前24小时内进行,并且然后在第一个月期间每周进行一次测试,之后在月经周期规律的女性中每月进行一次测试或在月经不规律的女性中每2周进行一次测试。
8.如果进行,则必须从自体干细胞移植后至少90天开始。
9.必须具有足够的重要器官功能,定义如下(或医学监查员批准):
使用Cockcroft-Gault公式计算的血清肌酐<2.0mg/dL并且估计的肌酐清除率>30毫升/分钟,并且不是透析依赖性的。
绝对中性粒细胞计数>1000/μL,并且血小板计数>50,000/μL(如果骨髓浆细胞>细胞结构的50%,则为>30,000/μL)。
基于剂量队列估计获得靶细胞剂量的足够绝对CD3计数(2期:绝对淋巴细胞计数>300/μL)。
血红蛋白>8g/dL(可允许输血和/或生长因子支持)。
血清谷草酰乙酸转氨酶(SGOT)<3×正常上限并且总胆红素<2.0mg/dL(除非有吉尔伯特综合征的分子记录病史)。
左心室射血分数(LVEF)>45%。LVEF评估必须在纳入后4周内进行。
10.根据NCI CTCAE 4.03版标准或受试者的先前基线,必须已从先前疗法引起的毒性(周围神经病变除外)中恢复至级别<2。
11.必须具有0到1的东部肿瘤协作组(ECOG)体力状态。
排除标准:1.怀孕或哺乳;2.患有静脉通路不足和/或患有白细胞去除术的禁忌症;3.患有活动性溶血性贫血、浆细胞白血病、华氏巨球蛋白血症、POEMS综合征(多发性神经病、器官肿大、内分泌病、单克隆蛋白和皮肤变化)、弥散性血管内凝血、白细胞淤滞或淀粉样变性;4.除MM外,还患有活动性第二恶性肿瘤(患病至少5年),不包含低风险赘生物,如非转移性基底细胞或鳞状细胞皮肤癌;5.患有活动性自身免疫性疾病,如牛皮癣、多发性硬化症、狼疮、类风湿性关节炎等(医学监查员将确定疾病是否为活动性和自身免疫性);6.具有严重中枢神经系统(CNS)疾病史,如中风、癫痫等(医学监查员将确定是否为严重);7.具有活动性全身感染(例如,引起发热或需要抗菌治疗);8.具有乙型或丙型肝炎病毒、人免疫缺陷病毒(HIV)或人T淋巴细胞病毒(HTLV)感染或任何免疫缺陷综合征;9.患有纽约心脏协会(NYHA)III级或Iv级心力衰竭、不稳定型心绞痛或者有心肌梗塞或严重心律失常(例如,房颤、持续的[>30秒]室性快速型心律失常等)病史;10.患有在研究者或医学监查员看来会妨碍安全参与和/或遵守方案(包含指示很可能不符合或无法进行足够的白细胞去除术、调理化疗和/或CAR-T细胞施用的医疗条件或实验室发现)的任何精神或医学病症(例如,心血管、内分泌、肾脏、胃肠道、泌尿生殖系统、免疫缺陷或未另行指定的肺部病症);11.曾接受过基因治疗或基因修饰细胞免疫疗法(或已获得医学监查员批准)。受试者可能已经接受了与抗骨髓瘤治疗相关的非基因修饰的自体T细胞或干细胞;12.在开始调理化疗的时间的2周或5个半衰期(以较长者或已获得医学监查员批准)内接受过抗癌药物;13.在开始白细胞去除术的2周内接受了免疫抑制药物,和/或预计在研究期间需要所述免疫抑制药物(医学监查员将确定药物是否被认为是免疫抑制性)。一般而言,所有非必需药物(包含补充剂、草药等)应从白细胞去除术前2周到P-BCMA-101施用后2个月中止,因为有可能产生未察觉的免疫抑制作用;14.在所需的白细胞去除术后的2周内或施用P-BCMA-101的1周或5个半衰期(以较短者为准)内,已接受≥5mg/天的泼尼松或等效剂量的另一种皮质类固醇的全身皮质类固醇疗法,或预计在研究期间需要所述疗法。(允许使用局部和吸入类固醇。在研究特定指导之外接受P-BCMA-101细胞后禁用全身性皮质类固醇);15.骨髓瘤有CNS转移或有症状的CNS受累(包含软脑膜癌病、颅神经病或肿块病变和脊髓压迫);16.对此研究中使用的任何药剂有严重的即刻超敏反应病史;17.有接受过异体干细胞移植或任何其它异体或异种移植的病史,或在90天内经受过自体移植;18.无法每日服用乙酰水杨酸(ASA)(325mg)作为预防性抗凝剂。对ASA不耐受的患者可以使用华法林(warfarin)或低分子量肝素(仅队列R和RP);19.在过去6个月内有血栓栓塞性疾病的病史,无论是否使用抗凝剂(仅队列R和RP)。
研究持续时间:受试者将在本研究的最后一次给药后进行长达2年的随访,之后同意的受试者将进入长期安全性随访方案,在最后一次给药后进行总共15年的随访。
事件时间表:参见表2,单次施用事件时间表——通过调理化疗进行筛查,以及表3,事件时间表——P-BCMA-101施用和随访。表8和表9描述了用P-BCMA-101再治疗受试者的事件时间表(参见第15.4节)。对于利米多赛治疗,参见表7中的事件时间表。表10、表11、表12和表13(参见第15.5节)中描述了周期施用队列中受试者的事件时间表。表14和表15中描述了组合施用队列中受试者的事件时间表(参见第15.6节)。
暂停给药或停止研究的标准:如果发生研究定义的DLT或任何与治疗相关的死亡,新受试者的给药将暂停,直至安全委员会开会审查事件并确定未来计划,其中可能包含停止研究、降低后续剂量水平、制定另外的安全性程序或研究修正,按计划继续研究或其它适合事件的措施。如上所述,如果2名或更多受试者在1期期间在队列中具有DLT,并且在2期的相应剂量水平或低于所述相应剂量水平时≥10%发生率≥4级或≥30%发生率≥3级CRS或神经毒性>10名患者时,所述剂量水平将超过MTD,并且任何进一步的给药将以较低的剂量水平进行。
统计方法:人口统计和基线特性、安全性和功效数据将使用适当的描述性统计数据进行总结。数据分析将按剂量队列提供,并在适当的情况下为所有受试者组合提供。将计算连续变量的描述性统计数据,包含平均值、中位数、标准偏差和范围,并且将使用计数和百分比对分类数据进行汇总。对于应答率终点,将计算点估计值和双侧精确二项式95%置信区间。将使用卡普兰-梅尔方法(Kaplan-Meier method)对事件发生时间变量进行汇总。
将使用按队列的受试者的计数和百分比并针对组合的所有受试者对治疗中发生的AE(TEAE)进行汇总。也将按严重程度和关系对TEAE进行汇总。将使用按剂量队列的受试者的计数和百分比对伴随药物进行汇总。
将使用观察值的描述性统计数据和按队列从基线值的变化对生命体征、心电图(ECG)测量和实验室结果进行总结。实验室结果也将按队列相对于正常范围(以下、之内或以上)进行汇总。
此研究的1期部分是标准的3+3剂量队列设计,其旨在确定某一剂量,低于所述剂量将出现33%的DLT发生率。因此,可以纳入至多120名受试者,以包含剂量递增、周期施用和组合施用期间有18个队列每队列6名受试者的可能性,以及可能被纳入以替代在DLT评估期完成之前中止的受试者或进一步评估队列发现的受试者。
对于此研究的2期部分将测试应答率终点以排除使用最近批准的护理标准药剂达雷木单抗在p<0.05的情况下获得的≤30%的应答率。将使用卡普兰-梅尔方法对事件发生时间变量进行汇总。对于100名受试者样品,本试验的2期部分将有90%的能力检测到15个百分点的改善,超过30%的应答率。此能力计算基于对具有1侧0.05显著性水平的二项式比例的精确检验。一旦35名受试者被纳入、接受P-BCMA-101并随访4个月或者在4个月随访前进展,将进行无效分析。此分析集合被称为无效分析集合(FAS)。无效分析将使用无效指数(FI),其等于1减去基于FAS中观察到的BOR比例的条件把握度(CP)。如果FI高于0.80(即,如果CP降至低于0.20),则研究可能会停止。
接受额外输注P-BCMA-101的受试者也将作为单独的亚组进行分析,以获取之后的所有结果。
1.表2:事件时间表-通过调理化疗进行筛查(单次施用)
1.包含所需的筛选之前6个月的MM测量结果(包含血清蛋白电泳[SPEP]、尿蛋白电泳[UPEP]、血清免疫固定[SIFE]、尿液免疫固定[UIFE]、血清游离轻链[FLC]、微小残留疾病[MRD]以及根据临床上所指示的,PET/CT和/或骨髓/肿瘤活检/抽吸物[骨髓活检],如果可用的话)。
2.仅在筛选访视时获得身高。
3.在筛选时获得12导联ECG和超声心动图。
4.将在以下时间评估骨髓瘤应答(可以从在上个月内的任何结果中获得):筛查时;开始调理化疗后7天内的基线(注意:必须在最后一次骨髓瘤疗法完成(包含挽救疗法)与淋巴细胞清除化疗开始之间进行2次或更多次评估);第0天(在P-BCMA-101施用之前-因此,24小时尿液采集将在第-1天开始,以便在P-BCMA-101施用之前完成),并且如临床上所指示的,根据国际骨髓瘤工作组标准和标准评估,包含SPEP、UPEP、SIFE、UIFE和血清FLC。骨髓活检、抽吸物和MRD(由中心实验室分析)必须在开始调理化疗的7天内完成,然后根据临床上所指示的进行,或者具有医学监查员豁免。将提交骨髓抽吸物的样品和骨髓活检的样品(如研究参考手册中所描述)以评估MRD、浆细胞频率、P-BCMA-101细胞、BCMA和其它生物标志物。还应提交任何髓外活检的一部分以评估P-BCMA-101细胞、BCMA和其它生物标志物。如果在筛查期间进行并提供了新的骨髓活检/抽吸物,则无需在基线访视期间重复。根据临床上所指示的进行PET/CT。
5.有生育能力的女性将在筛选时进行血清妊娠测试,并在开始调理化疗前72小时(3天)内进行尿液妊娠测试。
6.血液化学将包含钠、钾、氯化物、镁、碳酸氢盐、血尿素氮、肌酐、钙、白蛋白、葡萄糖、LDH、总蛋白、ALT、AST、胆红素(总胆红素和直接胆红素)、碱性磷酸酶、PTT和PT或INR。
血液学研究包含:
·全血细胞计数(CBC)
·血小板
·所有时间点的B(CD19)和T细胞计数(CD3)以及CD4和CD8,第-3天、第-4天除外
·需要在P-BCMA-101施用前的时间点评估循环骨髓瘤/浆细胞(例如,通过流式细胞术或具有人工差异的CBC)。如果在纳入和基线样品中鉴定出循环骨髓瘤/浆细胞,请联系发起人并参考排除标准#3和#10。
7.将在纳入时评估P-BCMA-101细胞;例如,P-BCMA-101细胞血液的载体拷贝数/mL、表面标志物表型、克隆性等。在每个时间点对样品进行的细胞表征和表型评估将根据每个测定的时间相关性而有所不同。
8.将使用李氏准则(Lee,2014)对CRS进行分级。
9.在开始调理化疗的7天内在基线处获得PET/CT。
10.将在筛选访视时记录过敏症以及受试者在筛选前30天期间服用的所有处方药和非处方药、维生素、草药和营养补充剂。每次访视时都应记录所有药物、补充剂和过敏症(包含任何当前症状的严重程度)。如果可能的话,应根据研究者的判断,在筛选前中止不必要的药物/补充剂。
11.受试者在开始调理化疗时应继续满足进入标准或具有医学监查员批准。应在第-5天的72小时内重复以下评估,以重新评估进入标准:MMSE(应包含受试者笔迹样品);体格检查;生命体征;怀孕和化学小组、包含B和T细胞计数在内的血液学、凝血。
12.纳入评估将在白细胞去除术前14天(±3天)进行,或具有医学监查员批准。
13.白细胞去除术应在筛选后约28天内进行或具有医学监查员批准。可以在第51节和研究参考手册中找到用于进行白细胞去除术的指导(具体地产品和过程的表征,包含中点和终点计数与具有手工差异的CBC、血小板、B和T细胞(CD4和CD8)、骨髓瘤细胞、流式细胞术、机器性能)在单采血液成分术期间在研究场所单采血液成分术中心进行,并在单采血液成分术产物从单采血液成分术中心运送到其它位置进行分析、表征和制造P-BCMA-101细胞之前报告)。
14.标记为“……的样品”或“……的血液样品”的实验室研究被送到中央实验室,而那些没有如此标记的实验室研究通常在研究场所进行。在P-BCMA-101-001A3(修正3)批准之前纳入的受试者将在研究场所继续评估骨髓瘤应笞、HIV、乙型肝炎和丙型肝炎以及HTLV筛查、血清IgG以及细胞因子释放综合征标志物(CRS)。
2.表3:事件时间表-P-BCMA-101施用和随访(单次施用)
1.在第0天、第1天、第4天、第7天、第4周、第3个月以及之后每3个月进行12导联ECG。
2.将在第0天(在P-BCMA-101施用之前-因此,24小时尿液采集将在第-1天开始,以便在P-BCMA-101施用之前完成)、第2周、第3周、第4周、第6周、第8周和第3个月、第4个月、第5个月、第6个月、第7个月、第8个月、第9个月、第12个月、第15个月、第18个月、第21个月和第24个月并且如临床上所指示的(例如,评估表明应笞确认后≤1周)根据国际骨髓瘤工作组标准和标准评估,包含血清蛋白电泳(SPEP)、尿蛋白电泳(UPEP)、血清免疫固定(SIFE)、尿液免疫固定(UIFE)、血清游离轻链(FLC)评估骨髓瘤应答。骨髓活检、抽吸物和微小残留疾病(MRD)(由中心实验室分析)必须在第4周、第3个月、第6个月和第12个月完成,然后根据临床上所指示的进行,或者具有医学监查员豁免。将提交髓抽吸物的样品和骨髓活检的样品(如研究参考手册中所描述)以评估MRD、浆细胞频率、P-BCMA-101细胞、BCMA和其它生物标志物。还应提交任何髓外活检的一部分以评估P-BCMA-101细胞、BCMA和其它生物标志物。根据临床上所指示的进行PET/CT。
3.有生育能力的女性将在筛查后的所有指定访视时进行尿液妊娠测试。
4.血液化学将包含钠、钾、氯化物、镁、碳酸氢盐、血尿素氮、肌酐、钙、白蛋白、葡萄糖、LDH、总蛋白、ALT、AST、胆红素(总胆红素和直接胆红素)、碱性磷酸酶、PTT和PT或INR。肿瘤溶解(尿酸和磷酸盐)的评估将在基线处和第1天、第4天、第7天进行,然后根据临床上所指示的进行。血液学研究包含:
·全血细胞计数
·血小板
·B(CD19)和T细胞计数(CD3)以及CD4和CD8
5.将评估P-BCMA-101细胞;例如,P-BCMA-101细胞血液的载体拷贝数/mL、表面标志物表型、克隆性等。在基线处、第0天(P-BCMA-101施用后1小时)、第4天、第7天、第10天、第2周、第3周、第4周、第6周、第8周、第3个月、第4个月、第5个月、第6个月、第7个月、第8个月、第9个月以及之后每3个月进行评估。在每个时间点对样品进行的细胞表征和表型评估将根据每个测定的时间相关性而有所不同。
6.将使用李氏准则(Lee,2014)对CRS进行分级。
7.在第0天,应在P-BCMA-101施用之前和之后大约1小时(+/-15分钟)获得MMSE(应包含受试者笔迹样品)、12导联ECG、体格检查、化学小组、血液学和凝血。将在P-BCMA-101施用之前和之后采集生命体征(温度、呼吸频率、脉搏、O2饱和度和血压),然后每15分钟(+/-5分钟)一次,持续至少一小时,并且直到这些体征令人满意且稳定。
8.如果受试者在P-BCMA-101施用之后中止此研究,则应在开始替代性药物、放射或外科手术干预之前进行计划的下一次访视的事件,并记录为此研究的研究结束访视。如果受试者正在纳入方案P-BCMA-101-002,则受试者应在受试者中止P-BCMA-101-001方案之后同意并纳入方案P-BCMA-101-002,并且根据方案P-BCMA-101-002所规定与此方案中的P-BCMA-101的施用相关的时间表来进行并记录此方案的第一次访视的事件。
9.如果需要的话,第10天评估可以在第10天后至多2天进行,但不能与第2周评估在同一天进行。
10.每次访视时都应记录所有药物、补充剂和过敏症(包含任何当前症状的严重程度)。
11.标记为“……的样品”或“……的血液样品”的实验室研究被送到中央实验室,而那些没有如此标记的实验室研究通
常在研究场所进行。在P-BCMA-101-001 A3(修正3)批准之前纳入的受试者将在研究场所继续评估骨髓瘤应笞、HIV、乙型肝炎和丙型肝炎以及HTLV筛查、血清IgG以及细胞因子释放综合征标志物(CRS)。
12.将在开始调理化疗的7天内在基线处获得PET/CT,然后按照临床上所指示的进行(例如,如果在需要成像的基线处发现软组织浆细胞瘤,则每8周进行一次,作为应答评估的一部分或确认应答)。
实例4-多发性骨髓瘤的P-BCMA-101 T细胞疗法
1.介绍
多发性骨髓瘤(MM)通常是无法治愈的致命疾病,其典型地经历多次复发和再现的过程。目前可用的疗法不足,并且对有效和持久的MM疗法的需求仍未得到满足。嵌合抗原受体T细胞(CAR-T)免疫疗法正在成为重要的潜在癌症(包含MM)治疗方法。B细胞成熟抗原(BCMA)是有吸引力的靶标,因为BCMA在MM细胞中表达,但在非恶性细胞中,BCMA表达主要限于浆细胞和B细胞亚群。最近公开了使用两种类似的BCMA靶向的CAR-T细胞产品(NCI/NIH,宾夕法尼亚大学(University of Pennsylvania)和蓝鸟生物公司(Bluebird Bio)研究)的MM患者的临床数据,其表明了所述方法的安全性和功效(Ali,2016;Cohen,2016;Berdeja,2016)。体外和体内研究表明,P-BCMA-101 T细胞以高亲和力和特异性与BCMA+肿瘤细胞系结合,产生稳健的脱粒和细胞毒性。未满足的医疗需求与可用的临床前和临床数据以及此构建体的潜在安全性和功效优势相结合,为在患有复发性或再现性MM的患者中评估P-BCMA-101提供了基本原理。研究者手册中也详细描述了以下信息。
1.1多发性骨髓瘤
多发性骨髓瘤(MM)是可治疗但通常无法治愈的浆细胞恶性肿瘤,其通常经历侵袭性和致命性临床过程。据估计,2015年美国发生约26,850例新发MM病例,其中有大约11,240例死亡。此诊断在生命的第6个和第7个十年时最常见(Howlader,2015)。
MM的标志性特征是骨髓中的浆细胞的单克隆扩增,伴随着单克隆抗体(mAb)的过量产生,这些单克隆抗体在血清蛋白电泳中产生“M峰”(Raab,2009)。此疾病的临床特征是由恶性克隆的骨髓浸润、高水平的循环单克隆抗体(mAb)和/或游离轻链、免疫力下降和终末器官损伤所致。MM的典型体征和症状包含贫血、血小板减少引起的出血、白细胞减少症和低抗体产生引起的频繁感染、骨损伤和骨折引起的骨痛以及高水平的M蛋白累积和高钙血症引起的肾功能损害。
对MM的病理生理学的理解和新型治疗剂的引入的最新进展有助于此疾病的管理,并且在过去20年中观察到生存率显著提高。中位生存期从20世纪80年代的约2年增加到今天的至多5-6年或更长(Engelhardt,2010)。治疗方案往往由两至三种药剂构成;大多数所有患者在其疾病的治疗过程的早期和晚期都接受蛋白酶体抑制剂(硼替佐米或卡非佐米)和免疫调节剂(IMiD)(来那度胺、泊马度胺、沙利度胺)。此外,符合条件的患者可能会经受自体造血干细胞移植和/或不太常见的同种异体造血干细胞移植。2015年,美国批准了若干种新疗法,包含2种mAb(达雷木单抗和埃罗妥珠单抗)、泛组蛋白去乙酰化酶(HDAC)抑制剂(帕比司他(panabinostat))和口服蛋白酶体抑制剂(伊沙佐米)。这些最近批准的长期影响仍有待确定,但其似乎不会在复发性和/或难治性环境中产生治愈,并且大多数患者最终会复发并死亡(Kumar,2008)。复发的肿瘤倾向于随着每次复发而更积极地复发。
对治疗的应答不太持久,并且随后的疾病进展产生与缩短的生存时间相关的难治性疾病(Kumar,2012)。
1.2多发性骨髓瘤的P-BCMA-101 T细胞疗法的基本原理
1.2.1.P-BCMA-101 T细胞疗法
P-BCMA-101是基于Centyrin的自体CAR-T细胞疗法,被称为CARTyrin T细胞。其是旨在靶向表达细胞表面抗原BCMA的MM细胞并将细胞毒性作用引导到靶细胞的生物产物(Tai,2015)。P-BCMA-101的作用机制与其它CAR-T方法相同(例如,Ali,2016;Berdeja,2016)。每位患者的外周血单核细胞(PBMC)将通过白细胞去除术采集,然后用于通过转座酶核糖核酸(RNA)的电穿孔以及编码携带CARTyrin的PB转座子的DNA质粒(即,piggyBac
P-BCMA-101细胞旨在表达3个主要组分:抗BCMA Centyrin嵌合抗原受体(CARTyrin)基因、二氢叶酸还原酶(DHFR)抗性基因和基于诱导型胱天蛋白酶9(iC9)的安全开关基因(Hermanson,2016)。
CARTyrin表达盒编码与CD8a信号/前导肽、CD8a铰链/间隔子、CD8a跨膜结构域、细胞内4-1BB信号结构域和T细胞受体(TCR)ζ链信号传导结构域融合的细胞外BCMA结合的Centyrin蛋白。与由基于抗体的单链可变区(scFv)组成的结合结构域相比,CARTyrin结合结构域是完整的人蛋白,其更小、更稳定并且可能免疫原性更低,但具有使得能够识别和杀死表达BCMA的MM细胞的类似抗原结合特性。此构建体还旨在避免T细胞衰竭。
DHFR抗性基因在T细胞的制造期间用于离体选择表达CARTyrin的T细胞,以产生更同质的产物,意图是提高药效和安全性。
安全开关是大多数CAR-T细胞中没有的额外安全性特征,其旨在通过静脉内施用合成二聚体药物利米多赛来快速消融P-BCMA-101细胞(参见第15.3节)。
截至2019年7月14日,36名受试者接受了P-BCMA-101细胞治疗(1期34名,2期2名),其中3名接受了第二次P-BCMA-101施用。所有1期剂量递增队列(1-5:0.75-15×10
1.2.2.BCMA作为CAR-T细胞的治疗靶标
骨髓瘤具有若干个特性,这使其适于用过继性T细胞疗法进行治疗。第一,骨髓瘤主要是骨髓的疾病,并且靶向CD19的过继性T细胞疗法在如急性淋巴细胞白血病(ALL)等以骨髓为主的疾病中特别成功(Brentjens,2013)。第二,自体干细胞移植是骨髓瘤的标准治疗,并且淋巴细胞清除可能会增强过继性T细胞疗法的功效(Brentjens,2011;Pegram,2012)。第三,与针对骨髓瘤的所有其它治疗不同,同种异体SCT具有潜在的治愈性,但是,其应用受到移植相关毒性、死亡率、患者资格和合适供体的可用性的限制。CAR-T细胞疗法有可能成为实现这种抗肿瘤功效的更安全的方式(Milone,2015)。
CD19作为靶标的效用受限于其在MM的恶性浆细胞上不常表达的事实;因此,已经探索了其它抗原,特别关注由肿瘤细胞而非正常组织表达的抗原。一个有吸引力的靶标是BCMA。选择此靶标的基本原理是在MM细胞中检测到BCMA,但在非恶性细胞中,BCMA表达主要受限于浆细胞和B细胞亚群,并且因此可能不太可能产生中靶脱瘤效果。
当在P-BCMA-101 T细胞表面上表达的BCMA特异性CAR与MM肿瘤细胞表面上表达的BCMA抗原结合时,就会发生MM肿瘤细胞识别。信号传导和激活由CAR内编码的胞质内信号传导结构域4-1BB和CD3~介导。激活可以导致CAR-T细胞介导的颗粒酶和穿孔素释放靶向的MM肿瘤的直接细胞毒性。肿瘤杀伤也可以通过CD4+ T细胞释放细胞因子激活免疫系统的其它组分来介导。可以通过立即切除肿瘤或通过在初始肿瘤应答后保留的长期记忆CAR-T细胞来提供对肿瘤复发的长期根除和预防。因此,拥有具有T干细胞记忆表型(Tscm)和T中枢记忆表型(Tcm)的CAR-T细胞可能具有特别的优势。此外,在CAR-T介导的肿瘤细胞裂解期间释放非BMCA肿瘤相关抗原可能导致适应性免疫系统的非工程化肿瘤特异性细胞的启动和/或重新激活,这种现象被称为‘表位-传播’,这也可以有助于长期根除和预防肿瘤复发。
在Carpenter等人(Carpenter,2013)进行的非临床研究中,抗BCMA-CAR T细胞表现出特定的抗BCMA功能,包含细胞因子产生、增殖、细胞毒性和体内肿瘤根除。重要的是,抗BCMA-CAR T细胞识别并杀死原代MM细胞。作者得出结论,BCMA是表达CAR的T细胞的合适靶标,并且抗BCMA-CAR T细胞的过继转移是治疗MM的有前途的新策略(Carpenter,2013)。
美国国家癌症研究所(NCI)进行的研究所公开的数据证实了在复发性/难治性MM患者中表达抗BCMA CAR的T细胞的概念的首次临床证明。患者(N=16)以4个剂量水平纳入,包含:0.3×10
来那度胺(来那度胺,2019)是免疫调节酰亚胺药物(IMiD)类的成员,其以显著的抗骨髓瘤活性以及对免疫系统的多效性作用而闻名,并且在美国被批准用于治疗骨髓瘤、骨髓增生异常综合征和淋巴瘤(Moreau,2019;Fink,2015)。除了其直接的抗骨髓瘤特性外,据推测,来那度胺可以增强CAR-T细胞(如P-BCMA-101)的功效。来那度胺治疗增加了原初和干细胞记忆T细胞的频率,并且这两个T亚群不仅是P-BCMA-101制造过程的优选起始材料,而且它们还与CAR-T细胞产品的改善的临床结果相关(Fostier,2018;Barnett,2016a;Cohen,2019)。没有提议将来那度胺直接包含在制造过程中,因为这种方法可能会增加产生的CAR-T细胞的数量和效应子功能(Wang,2018)。因此,假设在单采血液成分术之前包含来那度胺治疗以改进输入材料中的T细胞的质量,随后改进所制造的CAR-T细胞产品的质量。正提议将来那度胺与CAR-T细胞联合施用,因为其已被证明可以在体外和小鼠模型两者中增强CAR-T细胞效应子功能和整体抗骨髓瘤活性(Otáhal,2016;Wang,2018;Works,2019)。此外,目前正在至少一项其它临床试验(NCT03070327)中探索来那度胺和抗BCMA CAR-T细胞产品的类似组合。
利妥昔单抗(利妥昔单抗,2019)是抗CD20抗体治疗剂,其消耗CD20+细胞,从而消耗B细胞,具有出色的安全性和功效,并且在美国被批准用于治疗多种淋巴瘤、白血病和自身免疫性疾病(Salles,2017)。出于若干个原因,预计P-BCMA-101与利妥昔单抗之间会产生治疗协同作用。CD20表达在多发性骨髓瘤的子集中得到充分证明,所述子集可能包含多发性骨髓瘤干细胞(Flores-Montero,2016;Matsui,2018;Kapoor,2008)。尽管关于多发性骨髓瘤干细胞是否一致表达CD20存在一些争议,但一致认为骨髓瘤分化与正常B细胞发育平行,其中BCMA-CD20+细胞最终成熟为BCMA+CD20-细胞(Johnsen,2016;
1.2.3.P-BCMA-101设计和基本原理
如上文所描述的,P-BCMA-101细胞旨在表达3个主要组分:抗BCMA Centyrin嵌合抗原受体(CARTyrin)基因、二氢叶酸还原酶(DHFR)抗性基因和基于诱导型胱天蛋白酶9(iC9)的安全开关基因(Hermanson,2016)。通过BCMA特异性CARTyrin进行的在MM肿瘤细胞表面表达的BCMA抗原的结合触发P-BCMA-101细胞内由CARTyrin编码的胞质内信号传导结构域介导的信号传导和激活。除了通过CARTyrin编码的独特抗BCMA部分之外,P-BCMA-101方法与大多数其它CAR-T细胞之间的主要区别在于制造过程。
用于CAR分子表达的自体T细胞的基因修饰通常通过慢病毒或γ-逆转录病毒转导完成,而P-BCMA-101是使用被称为piggyBac(PB)DNA修饰系统的基于电穿孔的非病毒(DNA转座子)基因传递系统制造的(Nakazawa,2013),所述系统通过“剪切和粘贴”机制有效地将DNA从质粒转移到染色体,并且已被广泛用作人类基因转移方法,包含CAR-T产生(Woodard,2015;Fraser,1996;Singh,2013;Huls,2013)。与基于病毒的递送相比,PB提供优势,包含更安全的插入谱(Cunningham,2015)、更大的转基因容量(使得能够递送遗传组分以提高安全性和功效)、更高水平和更稳定的转基因表达(Cunningham,2015)、持续时间更长的转基因表达(Mossine,2013)以及高度有利的TSCM表型的优势。在P-BCMA-101的情况下,使用SuperpiggyBac转座酶(SPB),这是工程化的高活性酶,其可催化PB转座子到靶基因组中的TTAA位点中的整合,并且具有更明确和更安全的整合谱。虽然慢病毒和γ-逆转录病毒的遗传货物容量限制在约10-20Kb,但已证明piggyBac DNA修饰系统的货物限制>300Kb,从而允许转移多个有益基因。此外,与慢病毒相比,PB介导的引入允许转基因的高水平持久表达(Cunningham,2015)。最后,使用这种方法制造CAR-T细胞增加具有干细胞记忆表型(Tscm)的细胞的百分比,这可以增加安全性和功效。在小鼠MM模型(包含MM.1S p53敲除(KO)模型,其旨在概括患有侵袭性骨髓瘤以及具有不良预后指标(如del17p和其它TP53异常)的患者)中,已经证明了前所未有的应答持久性和对复发性肿瘤的重新控制的功效。据推测,通过逐渐扩增和分化,Tscm细胞可能会降低急性不良反应的概率。据观察,平均>60%的P-BCMA-101 T细胞表现出以CD45RA、CD62L和CD197(CCR7)阳性表达为特征的Tscm表型。此外,P-BCMA-101对于抑制性受体CD279(PD-1)、Tim-3和Lag-3的表达在很大程度上(平均<10%)呈阴性(Barnett,2016a)。因此,除了在安全性方面的优势之外,使用PB(即,P-BCMA-101)制造CAR-T细胞可以提供功效优势。
1.24.P-BCMA-101的非临床研究总结
1.2.4.1.候选产品筛选和选择
P-BCMA-101中的抗BCMA结合CARTyrin选自一组不同的CARTyrin。选择基于其在体外和体内临床前研究中的比较表现(Barnett,2016b)。使用不同的CARTyrin构建不同CARTyrin的组,这些CARTyrin先前被鉴定为特异性识别BCMA蛋白,以可变的亲和力结合并且展示单体性质。在体外研究中评估了这些不同CARTyrin候选物对BCMA+肿瘤系的功能活性,这些体外研究测量了其脱粒能力,这是细胞毒性杀伤能力的替代性标志物,以及其直接裂解靶肿瘤细胞的能力。进行这些研究是为了鉴定此方案中使用的前导BCMA CARTyrin分子。
1.2.4.1.1.体外筛选
在选择候选CARTyrin并支持体内评估后,使用PB转座产生P-BCMA-101细胞,并且进行了表型和功能表征。在P-BCMA-101 T细胞的表面上检测到CARTyrin(图12A)并且在再刺激后显著增加(图12B)。为了在体外测试这些T细胞的杀伤功能,将P-BMCA-101细胞与表达BCMA的细胞共培养,并且然后测量靶细胞杀伤(图12C)。P-BCMA-101细胞对BCMA+骨髓瘤细胞系H929表现出很强的细胞毒性功能。接下来,4天后评估与BCMA+细胞系共培养后P-BCMA-101细胞增殖的能力。CD4+和CD8+ T细胞两者都表现出稳健的增殖能力;CD4+ T细胞的增殖指数为3.0±0.09,并且CD8+ T细胞的增殖指数为3.4±0.03(图12C)。这些数据表明,PB转座的P-BCMA-101细胞在细胞表面上表达可检测水平的CARTyrin、特异性地杀死BCMA+靶细胞并且在暴露于BCMA+细胞靶标时增殖(Hermanson,2016)。
1.2.4.1.2.MM异种移植物模型中的体内筛选
使用表达荧光素酶的MM.1S p53 WT在MM异种移植物中进行体内测定,并且将敲除(TP53KO)MM细胞系静脉内(IV)注射到NSG小鼠中,以测定体内抗肿瘤功效方面的最佳CARTyrin+ T细胞候选产品(MD安德森癌症中心(MD Anderson Cancer Center))。
在MM.1S p53 WT实验中,评估了两个剂量的P-BCMA-101细胞:0.5×10
在MM.1S TP53KO模型(MD安德森癌症中心)中观察到类似的结果,此模型被设计为p53无效,以概括患有侵袭性骨髓瘤并且具有不良预后指标(如del17p和其它TP53突变)的患者。未处理组中的所有小鼠在50天内死亡,而在P-BCMA-101处理组中100%的小鼠存活到90天实验结束。这是独特的发现,因为已经在此模型中测试了许多现有多发性骨髓瘤疗法,并且都未能控制这种侵袭性肿瘤系(个人通信R.Orlowski)。
1.2.4.2.P-BCMA-101临味前毒理学
1.2.4.2.1 P-BCMA-101 Centyrin与人蛋白组的体外结合
体外人蛋白筛选技术用于鉴定P-BCMA-101中的Centyrin以Centyrin-Fc融合蛋白的形式的潜在二级靶标结合,以促进测定。筛选Centyrin-Fc融合蛋白与4300+种人蛋白的结合。这些人蛋白中的绝大多数表示细胞表面膜蛋白,每一种都在人HEK293细胞中单独表达。此研究证明了Centyrin与其预期靶标BCMA结合的高度特异性。
1.2.4.2.2.P-BCMA-101对正常人类组织的反应性
检测了P-BCMA-101细胞对一组正常人类组织细胞系的潜在反应性,以评估P-BCMA-101 CAR-T细胞是否可能对正常、健康的人类组织表现出任何直接毒性。将P-BCMA-101 T细胞与正常人类细胞类型或BCMA+MM1.S阳性对照细胞共培养,并且使用基于发光或流式细胞术的读数评估对正常人类细胞类型的潜在T细胞反应性。测试了九个细胞系,并且除了对BCMA+MM1.S阳性对照细胞的反应性之外,没有观察到反应性。
1.2.4.2.3.携带MM1.S骨髓瘤肿瘤的NSG小鼠中的P-BCMA-101 CAR-T细胞单剂量GLP安全性和功效研究
在于斯坦福国际研究所(SRI International)进行的携带MM肿瘤的雌性NSG小鼠的符合GLP的药理学-毒理学混合研究的背景下,评估了P-BCMA-101的安全性和功效(图13A-D)。此研究的目的是评估P-BCMA-101细胞在单次静脉内(IV)给药后并且在P-BCMA-101施用后监测至多3个月的携带人MM.1S-Luc骨髓瘤细胞的小鼠中的抗肿瘤功效和安全性。对雌性NSG小鼠IV移植MM.1S BCMA+MM细胞,并且在17-19天后以低剂量(4×10
1.3.潜在风险和益处
1.3.1.益处评佶
基于P-BCMA-101和其它CAR-T细胞(包含抗BCMA CAR-T细胞)的数据,可以合理地预期P-BCMA-101可以发挥抗肿瘤作用。第1.2节中的数据强力支持这一点。如上文所描述的,与先前的抗BCMA CAR-T产物相比,P-BCMA-101具有许多旨在改善功效的特征,如高Tscm表型比例和Centyrin结合结构域。
1.3.2.风险评佶
参与这项研究会将受试者暴露于基因工程化自体T细胞。基于类似产物的临床经验,风险是可接受的。P-BCMA-101的潜在安全问题实际上与其它CAR-T细胞产品相同。在CAR-T细胞研究中看到的主要不良反应是CRS和与通过其预期作用机制激活CAR-T细胞相关的相关症状(据报告,细胞因子的显著增加与功效相关)。第6.3节提供了用于管理这些毒性的描述和指南。虽然尚未报告BCMA靶向的CAR-T细胞,但CAR-T细胞的其它理论问题包含:1)“中靶/中瘤”毒性,通过骨髓瘤肿瘤细胞的快速破坏表现为肿瘤溶解综合征(TLS);2)与破坏健康组织中的BCMA+非肿瘤细胞相关的“中靶/脱瘤”毒性(低丙球蛋白血症除外);3)由于BCMA结合结构域与BCMA阴性靶标的潜在交叉反应而导致的“脱靶”毒性;以及4)继发于抗CAR-T抗体发展的免疫相关反应。这些问题中的许多问题在第1.2节的数据中得到解决。基于这些细胞的终末分化、基因添加材料和过程的插入谱和特征以及迄今为止广泛的临床经验和对接受其它CAR-T细胞产品的患者的长期随访(Jena,2010),潜在的致瘤性是被认为可以忽略不计的另一个假设风险(Tey,2014;Hackett,2013)。至少一项先前的CAR-T研究使用了类似的DNA转座子方法,并且在1期临床试验中发现在至多1.2×10
这项1期研究中的提议起始剂量(0.75×10
如上文所描述的,P-BCMA-101被设计为具有许多提高安全性的特征,如高Tscm比例、小型免疫原性不良Centyrin结合结构域以及DHFR选择基因。
此研究采用了若干另外的措施来解决潜在风险,包含以下:逐步增加T细胞剂量;分阶段纳入受试者;在具有自体T细胞疗法相关毒性管理经验的专业学术中心进行治疗;毒性管理指南;以及评估整个研究的安全性的安全审查委员会。截至2019年7月14日,1期中最常见的TEAE(>30%)是中性粒细胞减少症、WBC减少、血小板减少症、贫血、恶心、便秘和发热性中性粒细胞减少症。仅4名受试者患有CRS(1名受试者在2×10
1.3.3.总体益处:风险结论
可能为患有复发性/难治性MM(一种致命的恶性肿瘤)的受试者提供的潜在益处似乎证明了P-BCMA-101 T细胞疗法的已知风险和预期的潜在风险是合理的。
2.研究目的和终点
主要目的:此研究的主要目的是:
1期-基于剂量限制毒性(DLT)测定P-BCMA-101的安全性和最大耐受剂量(MTD)
2期-评估P-BCMA-101的安全性和功效
主要终点:
1期-每个剂量水平下的具有DLT的受试者的数量以定义MTD
2期-基于不良事件(AE)、检查和标准实验室研究的安全性和耐受性;通过如由独立审查委员会(IRC)评估的国际骨髓瘤工作组标准(Kumar,2016)确定的总体应答率(ORR)和应答持续时间(DOR)
次要目的:此研究的次要目的是评估:
1期-P-BCMA-101的安全性和可行性;P-BCMA-101的抗骨髓瘤作用;细胞剂量的影响,以指导用于2/3期研究中的进一步评估的剂量选择
2期-细胞因子释放综合征(CRS)的发生率和严重程度;额外的功效终点
次要终点:将评估以下次要终点:
1期-产生方案禁止剂量的P-BCMA-101的能力;基于AE、检查和标准实验室研究的安全性和耐受性;使用李氏准则(Lee,2014)分级的CRS;基于国际骨髓瘤工作组(IMWG)统一应答标准(Rajkumar,2011;Kumar2016;Cavo,2017)的功效;总体应答率(ORR);应答时间(TTR);应答持续时间(DOR);无进展生存期(PFS);以及总体生存期(OS)。
2期-使用李氏准则(Lee,2014)分级的CRS;IL-6拮抗剂、皮质类固醇和利米多赛的使用率;OS、PFS、TTR、微小残留疾病(MRD)阴性率
探索性目的:此研究的探索性目的是:
1期-评估MM浆细胞BCMA表达、循环可溶性BCMA与临床应答之间的关系
1期和2期-表征P-BCMA-101细胞的扩增和功能持久性;评估推定的CRS标志物与功效或安全性之间的关系;评估利米多赛对P-BCMA-101相关不良事件的影响,如果需要的话。
探索性终点:在研究过程期间将评估以下探索性终点:
1期-骨髓中的BCMA和/或其它生物标志物;血液中的可溶性BCMA和/或其它生物标志物水平
1期和2期-P-BCMA-101细胞(例如,血液和骨髓中的P-BCMA-101细胞的载体拷贝数/mL);P-BCMA-101细胞亚群组成和克隆性;CRS标志物:C反应蛋白(CRP)、铁蛋白、IL-6、IL-2、TNF-α和干扰素γ(IFN-γ)
3.研究计划
3.1.整体研究设计
本研究将分多个部分进行:1期,开放标签,SAD期;1期,多剂量周期施用期;1期,组合施用期;以及2期,在患有复发性/难治性MM的成年受试者中进行的开放标签功效和安全性期。单剂量施用的研究设计的示意图在图14中示出。1期周期施用队列的示意图在第15.5节中的图16和图17中示出。组合施用的研究设计的示意图在第15.6节中的图18中示出。
仅在管理肿瘤学受试者和干细胞/骨髓移植方面经验丰富并具有管理CAR-T细胞施用预期的急性紧急事件类型的资源的场所才会被选择参与此研究。安全委员会将定期开会审查整个研究期间的数据。
符合方案进入标准的受试者将有资格参加此研究,并且将遵循表2中针对单次施用队列概述的程序。第15.5节详细介绍了周期施用队列的程序。第15.6节详细介绍了1期组合施用的程序。受试者纳入后,将对其进行白细胞去除术以获得PBMC,这些PBMC将被送往制造场所,以生产P-BCMA-101CARTyrin-T细胞。为P-BCMA-101制造留出大约4周的时间,受试者旨在在白细胞去除术访视后大约4周返回进行调理化疗和P-BCMA-101施用(研究者认为必要时可以延长此时间段)。
在用P-BCMA-101细胞输注给药之前,受试者将接受300mg/m
在淋巴细胞清除化疗方案后的2个休息日之后,将在第0天在大约5分钟至20分钟内通过IV施用向受试者给药P-BCMA-101细胞。使用其它CAR-T疗法进行的先前研究已观察到在施用研究产品的3-7天内出现峰值毒性。将在输注期间和之后以及之后大约7天密切监测研究受试者。此观察时间段将包含对不良事件(AE),包含P-BCMA-101细胞相关毒性的出现,包含所有受试者的CRS的系列评估。将使用李氏准则(Lee,2014)对CRS进行分级。
基于研究者对个体患者的风险的评估,受试者可以住进医院接受P-BCMA-101施用。不要求住院,但受试者应在最后一个剂量的P-BCMA-101之后大约14天内留在距医院50英里的范围内,并且在出现CRS或神经毒性症状(如发热)的情况下进行住院评估。如果通过住院评估,则受试者在其被研究者评估为稳定之前不会出院。受试者在淋巴细胞清除化疗期间或在满足上述标准后(如研究者认为适当)可以维持作为住院患者。
受试者将返回接受定期随访,并且经历对安全性、耐受性和抗骨髓瘤应答的系列评估,如事件时间表(表3)中所述。1期和2期两者中的治疗后随访将在第10天、第2周、第3周、第4周、第6周、第8周、第3个月、第4个月、第5个月、第6个月、第7个月、第8个月、第9个月进行,并且然后每3个月进行,持续长达P-BCMA-101施用后24个月。第15.5节详细介绍了周期施用队列的随访程序。第15.6节详细介绍了组合施用队列的随访程序。
将鼓励所有接受P-BCMA-101并完成或退出研究的同意受试者进入长期随访(LTFU)方案(P-BCMA-101-002)。在此研究与LTFU研究之间,从最后的P-BCMA-101输注开始,受试者将被随访15年。此LTFU用于根据FDA(FDA,2006)针对基因疗法临床试验的要求来观察延迟的AE。在LTFU期期间,将继续随访受试者的总体存活率。
3.2研究给药
3.2.1. 1期的剂量递增指南
此研究的1期是在大约120名成年受试者中进行的开放标签、多中心、SAD多队列研究、多剂量周期施用队列研究以及组合施用研究。最初,至多6个剂量水平的P-BCMA-101将作为单剂量静脉内施用。
提议剂量(P-BCMA-101细胞/kg/剂量)包含:
队列-1:0.25×10
队列1: 0.75×10
队列2: 2×10
队列3: 6×10
队列4: 10×10
队列5: 15×10
此研究的1期将遵循剂量递增队列的3+3设计,其中最初计划向每个队列的3名受试者给药P-BCMA-101 T细胞。根据在这些受试者中观察到的结果,可以向队列中的其它受试者给药。
对于前2个队列中的每个队列,前3名受试者的给药将错开而不是同时进行,其中受试者之间至少间隔14天以评估安全性,因为CAR-T研究中的毒性峰值发生施用的3-7天,其中绝大多数在2周内发生,并且经2-3周消退(Frey,2016)。
根据安全委员会的判断,从第3队列开始,每个队列中的第一名和第二名受试者的给药将错开。表1概述了剂量递增指南。
P-BCMA-101细胞的施用将在3+3设计的递增剂量队列中进行。从队列1开始,将在队列中对至少3名受试者进行给药。如果在前3名受试者中到第28天没有观察到P-BCMA-101细胞相关DLT,则递增可能会继续到下一个队列。如果在前3名受试者中的1名受试者中观察到P-BCMA-101细胞相关DLT,则将有至少3名额外受试者在此剂量水平下接受治疗。如果在2名或更多名受试者中观察到DLT,则MTD将被视为处于或低于下一个较低剂量水平,并且可以在较低剂量水平下进行进一步纳入,或者安全委员会可自行决定测试中等剂量水平,否则可能会继续递增(即,MTD是经评估没有出现MTD的队列的最高剂量)。如果队列1中有2名或更多名受试者经历DLT,则安全委员会在审查所有可用数据后,可以选择使用相同的3+3扩展规则对队列-1中的3名受试者进行给药。如果队列-1中有2名或更多名受试者经历DLT,则安全委员会基于对用于评估风险和益处的安全性和功效数据的考虑,可以选择使用相同的3+3扩展规则以较低剂量对3名受试者进行给药或中止研究。
安全委员会可以基于此队列的安全性和功效数据将其它受试者添加到队列中,以进一步评估P-BCMA-101的安全性和抗骨髓瘤作用,前提是剂量不超过MTD。如果队列5在未完成总体MTD的情况下完成,则安全委员会可以选择以5-10×10
3.2.2.周期施用中的给药
在1期-周期施用中,多剂量的P-BCMA-101将在2个周期(队列A和队列C)或3个周期(队列B)中静脉内施用,每个周期2周。施用的总剂量将遵循3+3设计,从<MTD开始,如在单次施用递增期间确定的。在第一周期中,将施用总剂量的1/3。在队列A中,将在第2周期中施用至多总剂量的2/3。在队列B中,将在第2周期和第3周期中的每一个中施用至多总剂量的1/3。在队列C中,将在第1周期中施用至多总剂量的2/3,并且将在第2周期中施用至多总剂量的1/3。第15.5节提供了程序的细节。每次输注前,血清肌酐应≤2.0mg/dL,血清谷氨酸草酰乙酸转氨酶(SGOT)≤3×正常上限,并且总胆红素≤2.0mg/dL,或者有医学监查员批准以进行P-BCMA-101输注。
3.2.3.组合施用中的给药
在1期-组合施用中,P-BCMA-101将与批准的疗法组合施用:
来那度胺
队列R:从P-BCMA-101输注前1周开始,每日口服来那度胺10mg,每28天中持续21天;以及
队列RP:从单采血液成分术前1周开始持续7天,以及从P-BCMA-101输注前1周开始每28天中持续21天,每日口服来那度胺10mg。
除非疾病进展,否则队列R和队列RP将继续使用来那度胺给药。请参阅来那度胺包装插页获取处方信息(来那度胺,2019)(应特别注意,来那度胺是假定的致畸剂,避免怀孕和监测是必需的)。以下是特定于此方案的额外建议。如果在P-BCMA-101施用后28天没有报告DLT并且血小板≥50,000/μL并且中性粒细胞>1000/μL,则剂量可以增加至每日口服25mg,每28天中持续21天。如果在以此剂量治疗的前6名患者中报告了<2个DLT,则根据安全委员会的决定,所有患者的起始剂量可以增加至每日口服25mg,每28天中持续21天。在治疗期间,如果中性粒细胞减少至<1000/μL,则保持来那度胺直至中性粒细胞≥1000/μL,然后以5mg的较低剂量重新开始。在治疗期间,如果血小板减少至<30,000/μL,则保持来那度胺直至血小板≥30,000/μL,然后以5mg的较低剂量重新开始。如果肌酐清除率为30-60毫升/分钟,则最大来那度胺剂量应为每日10mg。如果肌酐清除率<30毫升/分钟,则维持来那度胺。在DLT的情况下,应中止来那度胺。此研究允许的最低剂量为每日5mg。研究者和安全委员会可以基于其它安全性发现决定适时中止来那度胺。患者应按照指示同时接受抗凝药物(例如,每日口服阿司匹林325mg)。不要与来那度胺一起使用糖皮质激素。
利妥昔单抗
队列RIT:除非疾病进展,否则在P-BCMA-101输注前12天和5天,然后每8周通过静脉内输注375mg/m
施用的P-BCMA-101的剂量将按照3+3设计递增或递减,从≤剂量递增期间测定的MTD开始。第15.6节提供了程序的细节。
3.2.4. 2期中的给药
此研究的2期是在大约100名患有复发性/难治性MM的成年受试者中进行的开放标签、多中心研究。2期的受试者将接受6-15×10
3.2.5.重复给药
如果在受试者的疾病进展时制造中剩余足够的P-BCMA-101细胞,则经安全委员会批准,可以以至多已成功完成剂量限制毒性评估的最高剂量水平施用额外的细胞。为了接受额外的P-BCMA-101 T细胞输注,受试者将被分配新的受试者识别号,受试者必须满足针对初始给药所描述的所有资格标准,并且除了白细胞去除术外,还将经受相同的筛选、纳入、调理化疗和后续程序。第15.4节提供了关于再处理程序的详细信息。
3.3.剂量限制毒性评估
DLT被定义为至少可能与P-BCMA-101细胞疗法相关的任何美国国家癌症研究所不良事件通用术语标准(NCICTCAE)级别≥3的事件,包含P-BCMA-101细胞的不可控扩增,并且不归因于在最后一次P-BCMA-101细胞输注后的前28天内发病的基础疾病或淋巴细胞清除化疗方案,但以下情况除外:
3级或4级中性粒细胞减少症,伴有或不伴有中性粒细胞减少发热,其在最后一次P-BCMA-101细胞输注后28天内消退;
3级发热;
3级或4级血小板减少症,伴有或不伴有血小板减少症导致的出血,其在最后一次P-BCMA-101细胞输注后28天内消退;
3级或4级贫血和淋巴细胞减少症;
3级或4级低丙球蛋白血症;
脱发;
3级或4级恶心、呕吐或腹泻,其在24小时内对药物治疗有应答;
细胞输注后2小时内发生的即刻超敏反应(发热、皮疹、支气管痉挛)(与细胞输注有关),其在使用基于标准抗组胺药物的治疗的情况下在细胞施用后6小时内可逆至2级或更低;
3级脑病,其在28天内恢复到低于2级;
根据李氏准则(Lee,2014)的3级CRS,其在14天内消退;
3级非血液学实验室异常,其在14天内恢复至≤2级;
4级非血液学实验室异常,其在7天内恢复至≤2级。
3.4.受试者数量和研究持续时间
在1期,计划在至多20个场所纳入至多120名受试者。在2期,计划在至多20个场所纳入大约100名受试者。纳入的受试者将经受安全性、耐受性和应答(骨髓瘤分期)的系列测量。这些测量将在筛选与P-BCMA-101施用后至多24个月之间根据表2和表3中针对单次施用所描述的事件时间表以及第15.5节针对周期施用队列和第15.6节针对组合施用队列所描述的事件时间表获得。根据表8和表9中所描述的事件时间表,经历疾病进展的受试者可以接受额外的P-BCMA-101输注。
在完成或退出此方案后,将鼓励已同意接受P-BCMA-101的受试者加入单独的方案(P-BCMA-101-002),此方案允许在最后一次给药之后继续随访共15年以评估长期安全性。
4.研究人群的选择、退出、完成和终止标准
4.1.入选标准
受试者必须符合以下入选标准才有资格参与此研究:
1.必须签署书面知情同意书。
2.男性或女性,≥18岁。
3.必须在初始诊断时明确诊断为患有IMWG标准所定义的活动性MM(Rajkumar,2014)。
4.必须具有由以下标准中的至少1项标准定义的可衡量的MM:
1期:
血清M蛋白大于或等于0.5g/dL(5g/L);
尿M蛋白大于或等于200毫克/24小时;
血清游离轻链(FLC)测定:涉及的FLC水平大于或等于10mg/dL(100mg/L),前提是血清FLC比率异常;
骨髓浆细胞>总骨髓细胞的30%,或其它可测量的骨疾病(例如,可通过PET或CT测量的浆细胞瘤)(经医学监查员批准)
2期:
血清M蛋白大于或等于1.0g/dL(10g/L);
尿M蛋白大于或等于200毫克/24小时;
血清FLC测定:涉及的FLC水平大于或等于10mg/dL(100mg/L),前提是血清FLC比率异常;
5.必须具有通过以下所定义的复发性/难治性MM:
1期:
接受过至少3条既往疗法线,其中必须含有蛋白酶体抑制剂和免疫调节剂(IMiD);或者
如果对蛋白酶体抑制剂和IMiD为“双重难治”,定义为在使用这些药剂治疗时或治疗后60天内出现进展,则为接受过至少2条既往疗法线。
2期:
接受过至少3条既往疗法线,其中必须含有蛋白酶体抑制剂、IMiD和CD38靶向疗法,其中至少2条线以三联组合的形式进行,并且每条线经历>2个周期,除非PD是最好的应答;
对最近的治疗线具有难治性;以及
经历过ASCT或者不是ASCT的候选人。
注意:诱导疗法、自体干细胞移植和维持疗法,如果按顺序给予而不干预进展,则应视为单线。
6.必须愿意从筛查开始到研究期间进行节育(有生育能力的男性和女性两者)。
队列R、RP或RIT中的女性必须承诺在开始治疗前4周、疗法期间、剂量中断期间和来那度胺中止后持续4周以及利妥昔单抗最后给药后12个月持续禁止性交或使用两种可靠的节育方法。
队列R或RP中的男性在服用来那度胺期间并且在停用来那度胺后至多4周在与具有生殖潜力的女性发生任何性接触时必须始终使用乳胶或合成避孕套,即使他们已经成功进行了输精管切除术。服用来那度胺的男性患者不得捐献精子。
7.必须在筛查时血清妊娠测试为阴性,并且在开始淋巴细胞清除化疗方案前3天内尿妊娠测试为阴性(有生育能力的女性)。
队列R和RP中的女性受试者必须在开始来那度胺之前两次妊娠测试为阴性。第一次测试应在受试者开始来那度胺疗法前10-14天内进行,第二次测试应在受试者开始来那度胺疗法前24小时内进行,并且然后在第一个月期间每周进行一次测试,之后在月经周期规律的女性中每月进行一次测试或在月经不规律的女性中每2周进行一次测试。
8.如果进行,则必须从自体干细胞移植后至少90天开始。
9.必须具有足够的重要器官功能,定义如下(或医学监查员批准):
使用Cockcroft-Gault公式计算的血清肌酐≤2.0mg/dL并且估计的肌酐清除率≥30毫升/分钟,并且不是透析依赖性的。
绝对中性粒细胞计数≥1000/μL,并且血小板计数≥50,000/μL(如果骨髓浆细胞≥细胞结构的50%,则为≥30,000/μL)。
基于剂量队列估计获得靶细胞剂量的足够绝对CD3计数。(2期:绝对淋巴细胞计数≥300/μL)
血红蛋白>8g/dL(可允许输血和/或生长因子支持)。
血清谷草酰乙酸转氨酶(SGOT)≤3×正常上限并且总胆红素≤2.0mg/dL(除非有吉尔伯特综合征的分子记录病史)。
左心室射血分数(LVEF)≥45%。LVEF评估必须在纳入后4周内进行。
10.根据NCI CTCAE 4.03版标准或受试者的先前基线,必须已从先前疗法引起的毒性(周围神经病变除外)中恢复至级别≤2。
11.受试者的东部肿瘤协作组(ECOG)体力状态必须为0-1。
4.2排除标准
1.怀孕或哺乳
2.静脉通路不足和/或患有白细胞去除术的禁忌症。
3.患有活动性溶血性贫血、浆细胞白血病、华氏巨球蛋白血症、POEMS综合征(多发性神经病、器官肿大、内分泌病、单克隆蛋白和皮肤变化)、弥散性血管内凝血、白细胞淤滞或淀粉样变性。
4.除MM外,还具有活动性第二恶性肿瘤(患病至少5年),不包含低风险赘生物,如非转移性基底细胞或鳞状细胞皮肤癌。
5.患有活动性自身免疫性疾病,如牛皮癣、多发性硬化症、狼疮、类风湿性关节炎等(医学监查员将确定疾病是否为活动性和自身免疫性)。
6.具有严重中枢神经系统(CNS)疾病史,如中风、癫痫等(医学监查员将确定是否为严重)。
7.具有活动性全身感染(例如,引起发热或需要抗菌治疗)。
8.具有乙型或丙型肝炎病毒、人免疫缺陷病毒(HIV)或人T淋巴细胞病毒(HTLV)感染或任何免疫缺陷综合征。
9.患有纽约心脏协会(NYHA)III级或IV级心力衰竭、不稳定型心绞痛或者有心肌梗塞或严重心律失常(例如,房颤、持续的[>30秒]室性快速型心律失常等)病史。
10.患有在研究者或医学监查员看来会妨碍安全参与和/或遵守方案(包含指示很可能不符合或无法进行足够的白细胞去除术、调理化疗和/或CAR-T细胞施用的医疗条件或实验室发现)的任何精神或医学病症(例如,心血管、内分泌、肾脏、胃肠道、泌尿生殖系统、免疫缺陷或未另行指定的肺部病症)。
11.曾接受过基因疗法或基因修饰细胞免疫疗法(或
已获得医学监查员的批准)。受试者可能已经接受了与抗骨髓瘤治疗相关的非基因修饰的自体T细胞或干细胞。
12.在开始调理化疗的时间的2周或5个半衰期(以较长者或有医学监查员批准的为准)内接受过抗癌药物。
13.在开始白细胞去除术的2周内接受了免疫抑制药物,和/或预计在研究期间需要免疫抑制药物(医学监查员将确定药物是否被认为是免疫抑制性)。一般而言,所有非必需药物(包含补充剂、草药等)应从白细胞去除术前2周到P-BCMA-101施用后2个月中止,因为有可能产生未察觉的免疫抑制作用。
14.在所需的白细胞去除术后的2周内或施用P-BCMA-101的1周或5个半衰期(以较短者为准)内,已接受≥5mg/天的泼尼松或等效剂量的另一种皮质类固醇的全身皮质类固醇疗法,或预计在研究期间需要所述疗法。(允许使用局部和吸入类固醇。在研究特定指导之外接受P-BCMA-101细胞后禁用全身性皮质类固醇)。
15.骨髓瘤有CNS转移或有症状的CNS受累(包含软脑膜癌病、颅神经病或肿块病变和脊髓压迫)。
16.对此研究中使用的任何药剂有严重的即刻超敏反应病史。
17.有接受过异体干细胞移植或任何其它异体或异种移植的病史,或在90天内经受过自体移植。
18.无法每日服用乙酰水杨酸(ASA)(325mg)作为预防性抗凝剂。对ASA不耐受的患者可以使用华法林或低分子量肝素(仅队列R和RP)。
19.在过去6个月内有血栓栓塞性疾病的病史,无论是否使用抗凝剂(仅队列R和RP)。
4.3受试者退出
被纳入但未完成研究方案的受试者将被视为提前中止研究。提前中止的原因(例如,自愿退出、毒性、死亡)必须记录在病例报告表上。最终研究评估将在终止时间完成。如果受试者中止此研究,则应在开始替代性药物、放射或外科手术干预之前进行计划的下一次访视的事件(包含所有安全性和功效评估),并记录为此研究的研究结束访视。鼓励在接受P-BCMA-101后退出方案的受试者加入伴随的长期随访方案P-BCMA-101-002。提前中止的潜在原因包含:
1.受试者丢失随访。
2.研究者的判断是受试者病得太重,以至于无法继续。
3.受试者不遵守研究疗法和/或门诊预约。
4.怀孕
5.自愿退出;受试者可以随时不带偏见地将他/她自己从研究中移除。受试者可以在其希望撤回同意的任何时间退出研究。
6.恶性肿瘤显著进展,需要替代性药物、放射或外科手术干预。如果疾病标志物在达到进行性疾病后根据P-BCMA-101细胞活性降低而不是确认先前的增加,则所述标志物应出于进行性疾病的考虑随后从所述水平增加,以使受试者中止方案,除非指示另一种全身性骨髓瘤疗法。
7.在T细胞基因修饰和扩增程序中遇到了技术困难,其阻碍了产生符合所有质量控制标准的临床细胞剂量。
8.主要研究者、发起人、研究资助者、机构审查委员会(IRB)/独立伦理委员会(IEC)或食品与药物管理局(FDA)终止研究。
4.4.研究终止
发起人可以随时以任何理由暂停或终止研究。如果研究暂停或终止,则发起人将确保酌情通知适用的场所、监管机构和IRB/IEC。
如果研究者在其场所停止/终止研究,则必须通知发起人。发起人将确保酌情通知监管机构和IRB/IEC。
发起人将确保根据当地法规向相关监管机构/IEC作出适当的研究结束声明。
5.研究治疗
5.1.白细胞去除术
完成所有筛选程序并符合所有资格标准的受试者将接受白细胞去除术,以采集外周血单核细胞(PBMC)用于制造P-BCMA-101。此访视应在筛选访视的约28天内进行。被纳入研究中的受试者将在纳入医院经受使用Spectra Optia系统(泰尔茂比司特公司(TerumoBCT))或等效白细胞去除术机器的标准白细胞去除术程序。在此程序之后,经白细胞去除术处理的细胞将在经过验证的温度受控条件下立即运送到制造和分析场所。目的是执行10-15升(由场所政策限定的最少和最多)的单采血液成分术并采集1.5-3×10
P-BCMA-101的制造在图15中以图表示。采集到的单采血液成分术产物将通过快递运送到制造商处用于立即制造。P-BCMA-101的制造,包含T细胞分离、使用piggyBac DNA质粒(编码抗BCMA CARTyrin的P-BCMA-101质粒)的电穿孔以及Super piggyBac转座酶mRNA(SPB mRNA)、CARTyrin+ T细胞选择和细胞扩增,将在大约4周内完成。最终产品将被冷冻保存在袋子中。最终调配物将含有至多10%(v/v)的二甲基亚砜(DMSO)。
在产品发放用于输注后,冷冻的P-BCMA-101产品将通过快递运送到纳入研究中心的药房或适当的细胞疗法设施。P-BCMA-101将在≤-130℃下储存直到施用时间。
如果不能从白细胞去除术样品中制造满足发放标准的P-BCMA-101细胞,则可以尝试进行第二次白细胞去除术和制造。如果第二次尝试也失败了,则受试者将从研究中退出并被视为未经受研究治疗。如果在受试者的疾病进展时制造中剩余足够的P-BCMA-101细胞,则经安全委员会批准,可以以至多已成功完成剂量限制毒性评估的最高剂量水平施用额外的细胞。
一旦产品制造完成,受试者将在白细胞去除术访视后大约4周(此时间段可以根据研究者和医学监查员的判断延长)返回诊所进行调理化疗和P-BCMA-101施用时间段。
可以根据研究者的判断对在白细胞去除术访视后和入院进行调理化疗和P-BCMA-101施用时间段之前经历快速疾病进展的受试者施用挽救疗法。除非必要,否则不应使用挽救疗法,并且将根据受试者的临床病史(优选先前使用过的药剂,并且需要医学监查员批准)由研究者自行决定。如果受试者接受挽救疗法,则调理化疗和P-BCMA-101施用时间段应安排在最后一次挽救疗法治疗的日期后至少2周或5个半衰期时,并且受试者应符合第4节和第6节中所描述的关于进入标准和伴随药物的标准。受试者对挽救疗法的应答将由研究者和医学监查员进行评估,以确定受试者是否仍然有资格接受研究产品。
在整个研究期间,出于姑息治疗的目的,受试者将被允许接受放射疗法或血浆置换术和交换。
5.2.调理化疗
在使用P-BCMA-101细胞输注给药之前,受试者将接受300mg/m
5.3.P-BCMA-101施用
5.3.1.描述
P-BCMA-101包含通过被称为piggyBac(PB)DNA修饰系统的基于电穿孔的非病毒(DNA转座子)基因传递系统进行基因修饰的激活的T细胞。PB DNA修饰系统通过“剪切和粘贴”机制有效地将DNA从质粒转移到染色体。P-BCMA-101被设计成包含三个主要组分:抗BCMA Centyrin CAR(CARTyrin)基因、DHFR选择基因(Rushworth,2016)和基于iCasp9的安全开关基因(Straathof,2005)。这些组分连同5′启动子和3′poly-A信号侧接两个非翻译的顺式调节绝缘子元件,所述元件可以通过阻止不正确的基因激活或沉默来稳定转基因(Mossine,2013)。
CARTyrin表达盒编码与CD8a信号/前导肽、CD8a铰链/间隔子、CD8a跨膜结构域、细胞内4-1BB信号结构域和TCRζ链信号传导结构域融合的细胞外BCMA结合的Centyrin蛋白。与由基于抗体的单链可变区(scFv)组成的结合结构域相比,CARTyrin结合结构域是完整的人蛋白,其更小、更稳定并且可能免疫原性更低,但具有使得能够识别和杀死表达BCMA的MM细胞的类似抗原结合特性。
DHFR选择基因在T细胞的制造期间用于离体选择表达CARTyrin的T细胞,以增强最终产物的效力和功效。
iC9安全开关基因是大多数CAR-T细胞中没有的额外特征,其旨在通过静脉内施用合成二聚体药物利米多赛来快速消融P-BCMA-101细胞。
5.3.2.产品标签
每个产品袋都将标有产品名称(P-BCMA-101)、产品制造日期、产品批号、储存条件、部件号以及至少两个非个人受试者标识符(如受试者的姓名首字母缩写、出生日期和/或研究受试者识别号)。此外,产品袋上将标有以下注意事项:“仅用于自体用途”、“未针对感染性物质进行评估”和“注意:新药-受联邦法律限制,仅限于研究用途”。
5.3.3.储存
在收到研究产品和任何相关研究治疗供应品后,必须进行盘点,并填写药物接收日志并由收货人签名。重要的是,指定的研究人员对货物进行清点、计数并验证货物是否含有货物库存中注明的所有项目。给定货物中的任何损坏或无法使用的研究产品研究药物都将记录在研究文件中。研究者必须就提供给研究者的场所的任何损坏或无法使用的研究治疗通知研究发起人或指定人员。P-BCMA-101细胞可以出于各种原因需要退回给发起人或指定人员,包含但不限于:1)贴错标签的产品;2)受试者的病状禁止输注/注射;以及3)受试者拒绝输注/注射。总体而言,任何未使用的产品都将退回给发起人或指定人员。
含有P-BCMA-101细胞的袋子将在血库条件下储存在场所的受监控的≤-130℃冰箱中,直到受试者准备好接受输注。
5.3.4.准备
推荐的T细胞输注前预先用药包含650mg对乙酰氨基酚和25-50mg盐酸苯海拉明。这些药物可以根据需要每6小时给药一次。非甾体抗炎剂可以用于对乙酰氨基酚无法控制的发热,但应在仔细考虑可能影响受试者的耐受性的因素(如出血风险和肾功能)的情况下使用。对败血症的评估应考虑到严重程度或持续时间出乎意料的发热,或其它提示性症状学。除非如支持性护理指南(第6.3节)中所描述的有必要,否则不应施用全身性皮质类固醇,因为可能会对基于T细胞的研究产品的功效产生不利影响。
受试者在给药前(即,开始调理化疗前)应继续满足肝脏和肾脏实验室纳入要求。另外地,应继续没有活动性感染的证据,或明显的心脏(例如,需要升压的低血压或无法控制的心律失常)或肺部损害(例如,需要补充氧气或胸部X光片显示显著的进行性浸润)。
5.3.5.给药和施用
在1期,P-BCMA-101的剂量水平将作为单剂量或多剂量静脉内施用。将以剂量递增指南(第3.2节)中描述的3+3递增设计按队列进行剂量水平测试。在2期,受试者将接受6×10
冷冻保存的P-BCMA-101被运送到纳入研究中心并在<-130℃下储存,直到输注。如果为受试者接收到的冷冻袋上的标签指示内容物超过此队列的P-BCMA-101细胞的指定剂量(+/-5%),则应仅施用与指定剂量对应的产品体积。如果为受试者接收到的冷冻袋上的标签指示内容物少于此队列的P-BCMA-101细胞的指定剂量(+/-5%),并且已为受试者提供了多个冷冻袋,则应从多个冷冻袋(这可能包含来自不同白细胞去除术/制造的冷冻袋)施用与指定剂量对应的产品体积。如果为受试者接收到的冷冻袋上的标签指示内容物少于此队列的P-BCMA-101细胞的规定剂量(+/-5%),并且没有针对与指定剂量对应的产品体积向受试者提供足够数量的冷冻袋,则可以施用产品,但是针对此受试者的剂量将被记录为接受的剂量,而不是队列水平剂量,并且来自此受试者的所有数据都如此。紧接在输注之前,将P-BCMA-101解冻并输注,如下文详述的。输注前无需对P-BCMA-101进行进一步处理。细胞应记录在研究药房或适用的细胞疗法设施中。
在淋巴细胞清除化疗方案后的2个休息日之后,将通过IV施用向受试者给药P-BCMA-101。基于研究者的评估,受试者可以住进医院接受P-BCMA-101施用。不要求住院,但受试者应在最后一个剂量的P-BCMA-101之后大约14天内留在距医院50英里的范围内,并且在出现CRS或神经毒性症状(如发热)的情况下进行住院评估。紧接在输注之前,将P-BCMA-101细胞在≤-130℃下(在气相液氮中)转移到受试者床边。细胞将在输注前在床边用维持在36℃至38℃的水浴解冻(必须得到发起人的预先批准才能在不同的位置解冻并在2℃-8℃下运送到床边)。将轻轻按摩袋子,直到细胞刚好解冻。容器中不应有结块。如果袋子看起来损坏或泄漏,或以其它方式受损,则不应输注,并应退回给发起人或发起人的指定人员。输注袋标签将具有至少2个唯一标识符,包含受试者的研究识别号和姓名首字母缩写或出生日期。在输注之前,2个人将在受试者在场的情况下独立地验证所有这些信息,从而确认信息与参与者正确匹配。急救医疗设备(即,急救手推车)将在输注期间可用,以防受试者对输注有过敏应答、严重的低血压危象或任何其它反应。重症监护病房应在研究施用场所的合理距离内。
P-BCMA-101细胞通常以250mL输注袋的形式提供,浓度范围为大约3×10
将在输注之前和之后测量生命体征(体温、呼吸频率、脉搏和血压),然后每15分钟进行一次,持续至少一小时,并且直到这些体征令人满意且稳定。
应按照机构生物安全指南处理空袋和剩余细胞。在未使用或损坏的产品/包装的情况下,应联系发起人以确定处置。
使用其它CAR-T疗法进行的先前研究已观察到在施用研究产品的3-7天内出现峰值毒性。将在输注期间和之后以及之后大约7天密切监测研究受试者。此观察时间段将包含对AE,包含P-BCMA-101相关毒性的出现,如所有受试者的CRS的系列评估。
如果通过住院评估,则受试者在其被研究者评估为稳定之前不会出院。受试者在淋巴细胞清除化疗期间或在满足上述标准后(如研究者认为适当)可以维持作为住院患者。受试者将返回接受定期随访,并且经历对安全性、耐受性和抗骨髓瘤应答的系列评估,如事件时间表中所述。
6.伴随药物和治疗
6.1.禁止的伴随药物和治疗
在P-BCMA-101施用后或在开始白细胞去除术或调理化疗的2周或5个半衰期(以较长者或有医学监查员批准的为准)内可能未接受研究或已接受抗癌/抗骨髓瘤药物。除非必要,否则不应使用挽救治疗,但如果研究者认为必要并经医学监查员批准,可以在白细胞去除术与调理化疗之间施用。相关药剂需要满足排除标准中所描述的间隔。
在开始白细胞去除术时,可能未在2周或5个半衰期(以较长者为准)内接受免疫抑制药物,和/或预计在纳入研究时需要免疫抑制药物,或者在P-BCMA-101施用后接受免疫抑制药物(医学监查员将确定何时以及是否允许使用潜在的免疫抑制药物)。
在所需的白细胞去除术后的2周内或施用P-BCMA-101的1周或5个半衰期(以较短者为准)内,可能没有接受≥5mg/天的泼尼松或等效剂量的另一种皮质类固醇的全身皮质类固醇疗法,或预计在研究期间需要所述疗法(允许局部和吸入类固醇)。在关于AE管理的研究特定指南之外接受P-BCMA-10l后,通常禁用全身皮质类固醇,与组合疗法一起直接使用,或经医学监查员批准。
在开始白细胞去除术的2周内、在计划施用P-BCMA-101之前的5个半衰期内或在没有医学监查员批准的情况下施用P-BCMA-101后2个月内,可能没有接受G-CSF或GM-CSF。
一般而言,所有非必需药物(包含补充剂、草药等)应从白细胞去除术前2周到P-BCMA-101施用后2个月中止,因为有可能产生未察觉的免疫抑制作用。
6.2.允许的伴随药物和治疗
在整个研究期间,出于姑息治疗的目的,受试者将被允许接受放射疗法或血浆置换术和交换。研究者认为对受试者的健康而言必要的其它诊断或治疗可以由研究者自行决定是否进行,以符合医疗护理标准并遵守方案。
将在筛选访视时记录受试者在筛选前30天期间服用的所有处方药和非处方药、维生素、草药和营养补充剂。在每次访视时,伴随药物将记录在病历和相应的电子病例报告表(eCRF)中。这些药物的任何添加、删除或更改都将进行记录。
6.3.支持性护理指导
推荐的P-BCMA-101输注前预先用药包含650mg对乙酰氨基酚和25mg至50mg盐酸苯海拉明。这些药物可以根据需要每6小时给药一次。非甾体抗炎剂可以用于对乙酰氨基酚无法控制的发热,但应在仔细考虑可能影响受试者的耐受性的因素(如出血风险和肾功能)的情况下使用。对败血症的检查应考虑到严重程度或持续时间出乎意料的发热,或其它提示性症状学。由于已知的对T细胞存活率的不利影响以及基于T细胞的研究产品的功效,除非有如下文所描述的严重或危及生命的AE需要,否则不应施用全身性皮质类固醇。
研究者必须在AE管理中使用适当的医学判断,包含预期事件,如调理化疗的预期事件,以及包含CRS在内的CAR-T细胞疗法的预期事件。CRS可能是与CAR-T细胞施用相关的最常见AE,其特征在于细胞因子被活性T细胞释放到循环中,并对多个器官系统产生下游影响。在输注治疗性单克隆抗体(mAb)、全身性白细胞介素-2(IL-2)和双特异性CD19-CD3T细胞结合抗体博纳吐单抗(blinatumomab)后,也出现了CRS。据报告,CRS的发生率和严重程度与急性淋巴细胞白血病患者的疾病负担相关。临床和实验室测量范围从轻度CRS(例如,全身症状、高热)到严重CRS和/或可能危及生命(例如高热、乏力、疲劳、肌痛、恶心、厌食、心动过速/低血压、缺氧、毛细血管渗漏、血细胞减少、心功能不全、肾功能不全、肝功能衰竭、弥散性血管内凝血。神经系统变化和/或脑水肿与严重或致命结果的可能性有关)。CAR-T细胞疗法中CRS管理的目标是预防危及生命的病状,同时保留抗肿瘤作用的益处,因此疗法通常是根据CRS的症状和/或标志物定制的。例如,皮质类固醇和其它侵袭性免疫抑制剂是针对CRS的有效治疗,但也经常对CAR-T细胞产生毒性。建议的CRS管理通常是根据Lee等人(Lee,2014)和Brudno等人(Brudno,2016)。请参阅研究参考手册(毒性参考手册)获取详细毒性管理建议。总结:建议对1级CRS进行对症治疗。当受试者出现对液体或1种低剂量血管加压药的应答性低血压或对低流量氧气(40%FiO2)的应答性轻度呼吸道症状或2级器官毒性时,CRS被定义为2级。由于低血压是严重程度分级的主要驱动因素,因此必须在开始疗法之前确定明确的基线血压。对具有2级CRS的受试者使用免疫抑制剂(托珠单抗(tocilizumab)+/-皮质类固醇)进行干预的决定受判断受试者能够耐受与此综合征相关的改变的血流动力学和器官压力的程度的影响。在老年受试者和患有严重合并症的受试者中,根据临床判断,对具有2级CRS的受试者进行免疫抑制干预可能是合适的。液体疗法和1种低剂量血管加压药不足以逆转低血压的受试者被归类为严重或3级CRS。类似地,需要多于低流量氧气或示出3级器官毒性证据(包含但不限于凝血功能障碍、肾脏或心脏功能障碍)的受试者应被视为3级。具有3级CRS的受试者需要非常密切地监测,可能在重症监护室中接受1∶1护理。重要的是,在具有2级或更高级别CRS的受试者中,应仔细留意心脏功能,因为可能会发生心脏代偿失调,并且在没有仔细监测的情况下可能不会很明显。对于担心心功能不全的受试者,可能需要进行频繁的超声心动图监测。具有3级CRS的受试者应接受免疫抑制剂治疗,如托珠单抗和皮质类固醇(例如,每6小时IV10mg地塞米松(dexamethasone)),因为存在进展风险和不可逆器官功能障碍的可能性,并且目的是防止进展至4级。4级CRS发生在受试者经历即刻危及生命的毒性(包含需要机械通气)或4级器官毒性时。建议所有具有4级CRS的受试者接受免疫抑制剂和/或细胞毒剂(如托珠单抗(通常每日8mg/kg,持续1天至2天)、皮质类固醇(例如,甲基强的松龙,每日1g,持续3天)、利米多赛(通常0.4mg/kg))和/或侵袭性免疫抑制剂/细胞毒剂(如环磷酰胺(例如,1.5g/g/m
有指示时,托珠单抗通常以8mg/kg的剂量经1小时静脉内施用,如果在24小时至48小时内没有出现临床改善,则可以选择重复给药。在对托珠单抗有应答的具有CRS的受试者中,发热和低血压通常会在几小时内消退,并且此后升压和其它支持性护理措施可能会很快被舍弃。然而,在一些情况下,症状可能不会完全消退,并且可能需要持续若干天的积极支持。
如果受试者出现无法控制的P-BCMA-101 T细胞扩增或其它可能与P-BCMA-101相关的临床上显著的3-4级毒性,则建议研究者审查临床情况和潜在的混杂因素,并考虑使用免疫抑制剂和/或细胞毒剂(如皮质类固醇(例如,甲基强的松龙,每日1g,持续3天)、利米多赛(通常为0.4mg/kg))和/或侵袭性免疫抑制剂/细胞毒剂(如环磷酰胺(例如,1.5g/m
7.评佶和程序时间表
7.1.程序时间表
本研究的程序时间表对于单次施用的受试者是相同的,并且表2中提供了从筛选到调理化疗的程序,并且表3中提供了从P-BCMA-101施用到随访的程序。第15.5节提供了周期施用队列的程序时间表。第15.6节提供了组合施用的程序时间表。在获得同意、筛选和资格确认后,所有受试者将经历如第5.3节所描述的白细胞去除术、调理化疗和P-BCMA-101施用。受试者将返回接受定期随访,并且经历对安全性、耐受性和抗骨髓瘤应答的系列评估,如每个相应事件时间表中所述。治疗后随访将在第10天、第2周、第3周、第4周、第6周、第8周、第3个月、第4个月、第5个月、第6个月、第7个月、第8个月、第9个月、第12个月、第15个月、第18个月、第21个月和第24个月进行。
7.2.临床评估
在整个研究过程中进行的临床评估和程序在事件时间表中进行了概述。这些表格中未描述的评估定时窗口可以在研究参考手册中找到。
7.2.1.病史
将在筛选时记录一般病史和人口统计数据以及将被视为研究中的AE的任何基线症状或医学病状。还将获得MM疾病史,包含在筛选前6个月内获得的MM评估结果,如纳入标准#4中所描述。如第7.2.10节所描述的,将采集骨髓瘤应答。
7.2.2体格检查和神经系统检查
将在以下时间进行全面的体格检查,包含神经系统检查:筛查时;调理化疗开始前72小时内;P-BCMA-101施用之前第-5天、第0天以及施用之后大约1小时;第1天、第4天、第7天、第10天;第2周、第3周、第4周、第6周和第8周,以及从第3个月开始,每3个月一次,持续24个月。施用P-BCMA-101后,应按照观察到的AE或按照机构的标准的临床指示重复进行体格检查,包含神经系统检查(或研究者认为合适的任何其它评估),但最少每次研究访视进行一次。
7.2.3.生命体征
生命体征,包含血压、心率、呼吸频率、O2饱和度和体温,将在访视时获得,如事件时间表中所概述的。在第0天,将在P-BCMA-101施用之前和之后大约一小时采集生命体征(温度、呼吸频率、心率、O2饱和度和血压),然后每15分钟(+/-5分钟)一次,持续至少一小时,并且直到这些体征令人满意且稳定。将在筛选、纳入和白细胞去除术时获得体重。仅将在筛选时记录身高。
7.24.体力状态
将在筛选时和第-5天使用附录15.1中所描述的ECOG体力量表对ECOG体力状态进行评估。
7.2.5.临床安全性评估
将在整个研究过程中评估受试者的AE。将按照NCICTCAE 4.03版标准对AE进行分级。第8节提供了AE和SAE评估和报告的详细信息。
7.2.6.心脏评估
将在筛选时、第0天(P-BCMA-101施用之前和之后大约1小时)、第1天、第4天、第7天、第4周并且从第3个月开始每3个月一次持续24个月获得12导联心电图(ECG)。将仅在筛选时获得超声心动图。
7.2.7.实验室评估
7.2.7.1.临床化学和血液学
将如事件时间表(化学小组、包含B和T细胞在内的血液学、凝血)中所概述的进行临床化学和血液学实验室评估。
化学小组将包含钠、钾、氯化物、镁、碳酸氢盐、血尿素氮、肌酐、钙、白蛋白、葡萄糖、乳酸脱氢酶(LDH)、总蛋白、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)/血清谷氨酸草酰乙酸转氨酶(SGOT)、胆红素(总胆红素和直接胆红素)和碱性磷酸酶。凝血评估将包含PTT(部分促凝血酶原激酶时间)和PT(凝血酶原时间)或国际归一化比率(INR)。肿瘤溶解(尿酸和磷酸盐)的评估将在基线处和第1天、第4天、第7天进行,然后根据临床上所指示的进行。
在第0天,应在P-BCMA-101施用之前和之后大约1小时获得化学小组、包含B和T细胞在内的血液学和凝血评估。在P-BCMA-101施用后,这些(或研究者认为适当的任何其它评估)应根据观察到的AE或机构的标准如临床上所指示的重复,但最少第1天、第4天、第7天和第10天并且如事件时间表中所概述的每日一次。
血液学实验室评估将包含全血细胞计数、血小板、B(CD19)和T(CD3)细胞计数以及CD4和CD8(在除第-3天和第-4天之外的所有时间点),并且在施用P-BCMA-101之前的时间点需要对循环骨髓瘤/浆细胞进行评估(例如,通过流式细胞术或具有人工差异的CBC)。如果在纳入和基线样品中鉴定出循环骨髓瘤/浆细胞,请联系发起人并参考排除标准#3和#10。
7.2.7.2.妊娠测试
有生育能力的女性受试者必须在筛选时血清妊娠测试为阴性,并且在开始调理化疗前72小时内尿妊娠测试为阴性。将在每次P-BCMA-101给药之前以及从第2周开始的后续治疗后访视时进行尿妊娠测试。
队列R和RP中的女性受试者必须在开始来那度胺之前两次妊娠测试为阴性。第一次测试应在受试者开始来那度胺疗法前10-14天内进行,第二次测试应在受试者开始来那度胺疗法前24小时内进行,并且然后在第一个月期间每周进行一次测试,之后在月经周期规律的女性中每月进行一次测试或在月经不规律的女性中每2周进行一次测试。
7.2.7.3.感染性疾病筛查
将在筛查HIV 1和2抗体、乙型肝炎表面抗原、丙型肝炎抗体和HTLV时进行实验室测试。
7.2.8.细胞因子释放综合征
将获得用于检测CRS标志物的血液样品:CRP、铁蛋白、细胞因子IL-6、IL-2、IL-15、TNF-α和IFN-γ,如事件时间表中所指示的。
7.2.9.小型精神状态检查
将按照事件时间表中所指示的进行小型精神状态检查(MMSE)。MMSE应包含所有时间点的受试者笔迹样品。
7.2.10.疾病应答评估
7.2.10.1.PET-CT评估
通过PET-CT扫描进行的疾病评估将在开始调理化疗前7天内在基线访视时进行,然后按照临床上所指示的进行(例如,如果在需要成像的基线处发现软组织浆细胞瘤,则每8周进行一次,作为应答评估的一部分或确认应答)。
7.2.10.2.应答和应答率
将在以下时间抽取用于评估骨髓瘤应答的实验室样品:筛选时;开始调理化疗后7天内的基线访视时;第0天(P-BCMA-101施用前);第2周、第3周、第4周、第6周、第8周;第3个月、第4个月、第5个月、第6个月、第7个月、第8个月、第9个月、第12个月、第15个月、第18个月、第21个月和第24个月。
将根据国际骨髓瘤工作组标准并基于标准评估对每名受试者进行骨髓瘤应答评估,如临床上所指示的(例如,评估表明应答确认后≤1周),如血清蛋白电泳(SPEP)、尿蛋白电泳(UPEP)、血清免疫固定(SIFE)、尿液免疫固定(UIFE)、血清游离轻链(FLC)、PET/CT(正电子发射断层扫描/计算机断层扫描,肝脏背景)和/或骨髓活检/抽吸物。必须在开始调理化疗前7天内完成基线骨髓瘤应答评估。必须在筛选或基线(通常在开始调理化疗后7天内)和第4周、第3个月、第6个月和第12个月时采集新鲜的骨髓活检和抽吸物,然后按照临床上所指示的进行,或具有医学监查员豁免。应答率将以每个最佳总体应答类别中的受试者数量除以研究人群中的受试者数量的方式确定。
7.2.10.3.应答时间
对于有应答的受试者,应答时间将从P-BCMA-101施用时间到首次记录的应答时间(部分应答[PR]或更好)进行评估。
7.2.10.4.应答持续时间
对于有应答的受试者,将从首次记录的应答(PR或更好)到确认疾病进展的时间(将审查其它原因的死亡)对应答持续时间进行评估。
7.2.10.5无进展生存
将对所有受试者进行从P-BCMA-101施用时间到确认疾病进展或死亡时间的无进展生存期(PFS)评估。
7.2.10.6整体生存
将对所有受试者进行从P-BCMA-101施用时间到死亡时间的整体生存(OS)评估。
7.2.11长期随访
将在本研究中对在本研究中用P-BCMA-101治疗的所有受试者进行随访,持续至多2年。在受试者中止此方案后,同意的受试者将转入到单独的长期安全性随访方案(P-BCMA-101-002)中,并且在最后一次给药P-BCMA-101后进行共15年的随访。
7.3探索性评估
7.3.1.P-BCMA-101 T细胞的扩增和持久性
将在事件时间表中描述的P-BCMA-101 T细胞的血液样品中对P-BCMA-101 T细胞(例如,血液的载体拷贝数/mL)进行量化。
7.3.2.P-BCMA-101 T细胞组成
将使用事件时间表中所描述的P-BCMA-101 T细胞的血液样品对P-BCMA-101 T细胞(例如,表型、克隆性等)进行评估。
7.3.3.免疫应答评估
将如事件时间表中所指示的(用于免疫原性测定的血液样品)采集用于评估对P-BCMA-101的免疫原性的样品。
7.3.4.可溶性BCMA水平
将如事件时间表中所指示的(用于BCMA和其它生物标志物的血液样品)在血液样品中测量可溶性BCMA。
7.3.5.MM细胞上的BCMA表达
将在基线处并且如事件时间表中所指示的(将肿瘤归档至中心实验室、新鲜骨髓和肿瘤样品和/或用于BCMA和其它生物标志物的血液样品)评估来自归档的或新鲜的肿瘤样本(例如,骨髓)的细胞的BCMA。
7.3.6.BCMA抗原密度/表达、循环可溶性BCMA与临床应答之间的关系
可溶性BCMA和BCMA表达结果将与临床应答相关。
7.3.7.受体B和T细胞的水平
将如事件时间表(化学小组、包含B和T细胞计数的血液学、凝血)中所指示的在血液学样本中对受体B和T(CD4+和CD8+)细胞的水平进行量化。
8.记录不良事件
主要研究者负责检测、记录和报告符合AE或严重不良事件(SAE)的定义的事件。单独的AE应由研究者评估并通过eCRF报告给发起人。这包含对强度、研究产品和/或伴随疗法与AE之间的因果关系、严重性等的评估。
8.1收集AE和SAE信息的时间段
将从纳入开始直到第24个月的访视或退出方案(以较短者为准)为止采集所有AE和SAE。
8.2不良事件的定义
根据国际协调会议(ICH),AE是在接受药物产品的受试者或临床研究受试者中发生的任何不幸医学事件。事件成为AE不一定与研究治疗有因果关系。因此,AE可以是与研究产品的使用在时间上相关联的任何不利和非预期的征兆(包含异常的实验室发现)、症状或疾病,而无论其是否被视为与研究产品有关。如果预先存在的病状在研究期间恶化,才应将其报告为AE。研究中癌症的进展和其症状不被视为AE,除非研究者认为其与药物有关。如果新的异常实验室发现需要治疗或被研究者认为具有临床意义时,才应将其视为AE。
应使用诊断或可能的诊断将AE记录在eCRF中,并且根据强度、因果关系和严重性进行评级。在没有诊断的情况下,可能会记录个别症状或发现,并且在额外信息可用之后更新eCRF以反映最终诊断。
应遵循所有AE,直到:
已消退或改善到基线。
研究者确认预计不会有进一步的改善。
在研究完成或中止时,将跟踪AE30天或直到满足上述标准之一。将继续记录并监测进行中的AE,直到长期随访研究。
8.2.1.强度评估
将根据NCICTCAE 4.03版对不良事件进行分级。研究者将使用此五分量表(1-5级)评估所有AE的强度并记录在eCRF上。应根据表4对NCI CTCAE中未明确列出的AE进行分级:
表4:NCI CTCAE 4.03版中未指定的AE分级
8.2.2.因果关系评估
研究者将根据他/她的最佳临床判断评估AE和研究产品(P-BCMA-101和/或利米多赛,如果已施用)之间的因果关系。对可能/很可能/肯定相关的评估旨在传达存在因果关系的证据,而不是不能排除关系。研究者在进行评估时应考虑替代性原因,如基础疾病的自然历史、淋巴细胞清除化疗、伴随药物和其它风险因素。以下量表将用作指导:
不相关-受试者没有接受研究产品;与研究产品施用有关的AE发作时间顺序不合理;或者存在另一个极有可能导致AE的原因。
不太可能相关-AE与T细胞输注没有合理的时间相关性;AE更有可能通过另一个或多个原因来解释,但在多因素背景下,T细胞输注略微有可能对事件发生或事件的严重程度的产生理论上的影响。
可能相关-有证据表明暴露于研究产品;与T细胞输注有关的AE发作的时间顺序合理;有合理的解释说明研究产品引起了AE;以及与其它解释一样,研究产品同样有可能引起AE。
很可能相关-有证据表明暴露于研究产品;与T细胞输注有关的AE发作的时间顺序合理;AE示出的模式与先前对研究产品的了解一致;或者AE比任何其它原因更有可能通过研究产品解释。
绝对相关-有证据表明暴露于研究产品;与T细胞输注有关的AE发作的时间顺序合理;AE示出的模式与先前对研究产品的了解一致;或者AE最有可能是由研究产品引起的,并且任何其它原因都是不可能的。
如果接收到额外信息,则研究者可以改变他/她对因果关系的看法,并相应地修改AEeCRF。研究者因果关系评估是发起人将用于确定SAE监管报告要求的标准之一。
8.3报告严重不良事件(SAE)
SAE是满足以下条件的任何AE:
导致死亡(注意:死亡应记录为结果,并且导致死亡的事件应记录为事件)。
危及生命(注意:术语“危及生命”是指受试者在事件发生时面临即时死亡风险的事件;其并不指如果更严重的话假设可能导致死亡的事件)。
需要住院或延长现有住院时间,但与尚未恶化的先前存在的病状相关的选择性或诊断性程序除外,包含研究中的疾病(例如,研究指定的程序和住院)。
导致持续或显著的能力丧失。
是先天性异常/出生缺陷。
具有医学意义或需要干预以预防以上列出的一种或多种结果。
在确定AE是否具有足够显著的医学重要性以在上述定义之外被归类为严重时,应进行医学和科学判断。基于适当的医学判断,当重要的医学事件可能会危及受试者并且可能需要医学或外科手术干预以防止上文列出的结果之一时,这些可能不会导致死亡、危及生命或需要住院治疗的重要的医学事件可以被认为是严重的。例如,药物过量或滥用、未导致住院患者住院的癫痫或急诊科对支气管痉挛的强化治疗通常被认为是严重的。
此研究将遵守所有当地监管要求,并遵守ICH临床安全性数据管理指南、加速报告的定义和标准、主题E2和FDA IND安全性报告要求,21CFR 312.32的全部要求。
8.4.特别关注的不良事件(AESI)
AESI是关于CAR-T细胞产品的特别关注的事件,并且因此具有独特的报告要求,如第8.5节中所描述。P-BCMA-101的AESI目前包含:
1.在输注P-BCMA-101的30天内发生的任何死亡,无论归因如何。
2. 4级或更高级别的产品输注反应。
3. 4级或更高级别的细胞因子释放综合征。
4. 4级或更高级别的神经毒性。
5.新的恶性肿瘤。
6.先前存在的神经系统病症的新发病率或恶化。
7.先前风湿病或其它自身免疫性病症的新发病率或恶化。
8.血液系统病症的新发病率。
8.5.SAE和AESI的监管报告要求
必须在研究人员发现事件后24小时内通过电子邮件或传真发送填写好的SAE/AESI报告表将SAE/AESI报告给发起人或指定人员。SAE/AESI报告表将是安全性报告的主要数据来源。研究参考手册中描述了报告程序。在提交SAE/AESI报告表后不久,将需要每个事件项的Medidata内的eCRF条目。数据字段必须与SAE/AESI报告表上所报告的数据字段匹配。
8.6.怀孕
如进入标准中所描述的,受试者必须从筛选时间开始并且在整个研究期间进行节育(具有生育能力的男性和女性两者)。
队列R、RP或RIT中的女性必须承诺在开始治疗前4周、疗法期间、剂量中断期间和来那度胺中止后持续4周以及利妥昔单抗最后给药后12个月持续禁止性交或使用两种可靠的节育方法。
当向孕妇施用来那度胺时,其可能对胚胎-胎儿造成伤害,并且基于作用机制和发现,在怀孕期间禁用来那度胺。来那度胺存在于接受此药物的患者的精液中。因此,队列R或RP中的男性在服用来那度胺期间并且在停用来那度胺后至多4周在与具有生殖潜力的女性发生任何性接触时必须始终使用乳胶或合成避孕套,即使他们已经成功进行了输精管切除术。服用来那度胺的男性患者不得捐献精子。
没有关于P-BCMA-101或利米多赛在孕妇中的临床前或临床试验数据;然而,这种整体治疗方案理论上可能是胚胎毒性的。对母乳的影响尚不清楚,因此,应在从筛选开始的研究持续时间内以及接受最后剂量的研究产品(P-BCMA-101或利米多赛、来那度胺或利妥昔单抗)后至少12个月或者在没有证据表明受试者的血液中的继续存在/基因修饰细胞后四个月(以较长者为准)中止母乳喂养。
怀孕(或男性受试者的伴侣怀孕)不被视为AE/SAE,除非有理由相信怀孕可能是由于与研究产品相互作用而导致避孕失败的结果,或者妊娠中有不良胎儿结果。然而,研究者应立即向发起人报告所有怀孕情况。在研究期间怀孕并保持怀孕的女性将中止研究并进入LTFU研究。还必须向发起人报告怀孕的结果。
9.安全性监测
9.1.安全委员会
将建立包含研究者和发起人的临床代表的安全委员会,并且将定期审查所有受试者的数据并跟踪每个队列以确定剂量递增。安全委员会可以建议扩大队列以进一步评估安全性,并且如果在第一队列中观察到DLT,则在1期探索较低剂量并在2期期间继续管理安全、停止和暂停标准。
9.2.暂停给药或停止研究的标准
如果发生研究定义的DLT或任何与治疗相关的死亡,则新受试者的给药将暂停,直到安全委员会开会、审查事件并确定未来计划,其中可能包含停止研究、降低后续剂量水平、制定额外的安全性程序或研究修正、按计划继续研究或其它适合于事件的措施。如先前所描述的,如果一个队列中6名受试者中的2名或更多名受试者在1期期间具有DLT,并且在2期中>4级CRS的发生率>10%或>3级CRS的发生率>30%或神经毒性处于或低于对应剂量水平并且>10名患者接受治疗,则此剂量水平将超过MTD,并且任何进一步给药将以较低剂量水平进行。
10.统计和数据分析
此研究的1期是标准的3+3剂量队列设计,其旨在确定某一剂量,低于所述剂量将出现33%的DLT发生率。
此研究的2期是开放标签、单剂量、功效和安全性评估。所有终点的分析细节将在统计分析计划(SAP)中提供。
10.1.研究人群
意向治疗(ITT)群体将包含纳入到研究中的所有受试者。
安全性群体将包含接受P-BCMA-101施用的所有受试者。
按方案群体将包含接受方案指导剂量的P-BCMA-101的所有受试者(例如,接受少于方案指导剂量的患者将作为单独的亚组进行分析)。
10.2.样品大小计算
此研究的1期部分是标准的3+3剂量队列设计,其旨在确定某一剂量,低于所述剂量将出现33%的DLT发生率。因此,可以纳入至多120名受试者,以包含剂量递增、周期施用和组合施用期间有18个队列每队列6名受试者的可能性,以及可能被纳入以替代在DLT评估期完成之前中止的受试者或进一步评估队列发现的受试者。
对于此研究的2期部分,将测试应答率终点以排除使用最近批准的护理标准药剂达雷木单抗在p<0.05的情况下获得的≤30%的应答率。对于100名受试者样品,本研究的2期部分将有90%的能力检测到15个百分点的改善,超过30%的应答率。此能力计算基于对具有1侧0.05显著性水平的二项式比例的精确检验。
10.3.统计方法
人口统计和基线特性、安全性和功效数据将使用适当的描述性统计数据进行总结。数据分析将按剂量队列提供,并在适当的情况下为所有受试者组合提供。将计算连续变量的描述性统计数据,包含平均值、中位数、标准偏差和范围,并且将使用计数和百分比对分类数据进行汇总。对于应答率终点,将计算点估计值和双侧精确二项式95%置信区间。将使用卡普兰-梅尔方法对事件发生时间变量进行汇总。
将使用按队列的受试者的计数和百分比并针对组合的所有受试者对治疗中发生的AE(TEAE)进行汇总。也将按严重程度和关系对TEAE进行汇总。将使用按剂量队列的受试者的计数和百分比对伴随药物进行汇总。
将使用观察值的描述性统计和按队列从基线值的变化对生命体征、ECG测量和实验室结果进行总结。实验室结果也将按队列相对于正常范围(以下、之内或以上)进行汇总。
根据国际骨髓瘤工作组统一应答标准(附录15.2)(Rajkumar,2011;Kumar,2016;Cavo,2017),通过将每个受试者在P-BCMA-101施用后的最佳应答与对应的基线值进行比较来确定应答率。将在所有已接受P-BCMA-101的受试者中根据受试者已接受P-BCMA-101并获得PR、非常好的部分应答(VGPR)、完全应答(CR)或严格的完全应答(sCR)来确定整体应答率(ORR)。还将确定每个单独应答类别的应答率。同样,还将确定8周的稳定疾病(SD)率和最小应答(MR)率。对于有应答的受试者,将确定应答时间和应答持续时间。还将根据国际骨髓瘤工作组的标准确定所有受试者的OS和PFS。
一旦35名受试者被纳入、接受P-BCMA-101并随访4个月或者在4个月随访前进展,将进行无效分析。此分析集合被称为无效分析集合(FAS)。无效分析将使用无效指数(FI),其等于1减去基于FAS中观察到的BOR比例的条件把握度(CP)。如果FI高于0.80(即,如果CP降至低于0.20),则研究可能会停止。
接受额外P-BCMA-101 T细胞输注的受试者将作为单独子组接受针对所有结果的分析。
11.数据处理和记录保存
11.1.保密
将根据1996年健康保险流通与责任法案(HIPAA)和任何其它适用法律、法规和指南的要求对关于研究受试者的信息进行保密和管理。这些法规要求签署受试者授权,从而告知受试者以下内容:
将在此研究中从受试者收集哪些受保护的健康信息(PHI)
谁将有权访问所述信息以及原因
谁将使用或公开所述信息
研究受试者撤销对其PHI的使用授权的权利
如果受试者撤销对收集或使用PHI的授权,则根据规定,研究者保留使用在受试者授权的撤销之前所收集到的所有信息的能力。对于已撤销对收集或使用PHI的授权的受试者,应尝试在计划的研究期结束时获得对收集至少生命状态(即,受试者还活着)的许可。
11.2.数据管理
EDC系统将用于收集与此试验有关的数据。将通过eCRF捕获试验数据。场所工作人员将在EDC系统内输入eCRF数据,并且所有源文件验证和数据清理将由发起人或指定人员(例如,合同研究组织[CRO])进行。
将在发放EDC系统以供现场使用之前记录和批准EDC系统的规格。将在数据管理计划中限定eCRF数据验证。当数据输入到eCRF中时,将执行验证检查,并在必要时提出查询。提出的所有查询都将保存在EDC数据库中。
EDC系统是经过验证的软件程序,其被设计成符合CFR21第11部分的要求。所有用户都将通过唯一的用户名和密码访问系统。维护系统内进行的所有操作的完整审计历史记录。用户帐户确保每个用户仅可以进行适于其角色的任务,并且仅可以访问适于其角色的数据。
标准编码词典、世界卫生组织(WHO)药物和监管活动医学词典(MedDRA)将用于对药物、AE和病史进行编码。
当输入所有数据并完成所有数据清理后,数据将被锁定并且可用于分析和报告。
研究完成后,所有eCRF数据,包含所有相关联的查询和审计历史记录,都将通过CD或USB驱动器提供给研究发起人和场所两者。
11.3源文件
源数据是临床试验中重建和评估试验所必需的所有信息、临床发现、观察或其它活动的原始记录。源数据包含在源文件中。这些原始文件和数据记录的实例包含:医院记录、临床和办公室图表、实验室笔记、备忘录、受试者的日记或评估清单、药房配药记录、来自自动化仪器的记录数据、经核实后证明准确且完整的副本或转录本、缩微胶片、照相底片、缩微胶卷或磁性介质、X光片、主题文件、保存在药房、实验室和涉及临床试验的医疗技术部门的记录等。
研究者必须确保获得eCRF信息的源文件的可用性。
研究者必须准许发起人、相应的国家、地方或外国监管机构、IRB/IEC和审计员的授权代表检查设施并直接访问研究者场所文件和与此研究相关的所有源文件,无论介质类型如何。
11.4.病例报告表
对于每个纳入的受试者,完成的eCRF必须由主要研究者或授权代表审查和签署。如果受试者退出研究,则必须在eCRF上注明原因。
研究者应确保在eCRF和所有要求的报告中向发起人报告的数据的准确性、完整性、易读性和及时性。
11.5.记录保留
研究者负责在其所在国家/地区最后一次批准营销申请后将研究基本文件保留至少2年,并且直到其所在国家/地区没有未决或正在考虑的营销申请,或者自研究产品的临床开发正式中止以来已过去至少2年。如果与发起人达成的协议有要求,则这些文件应保留更长的时间段。在此类情况下,发起人负责通知研究者/机构关于何时不再需要保留这些文件。
12.研究监查、审计和检查
12.1.研究监查计划
本研究将根据书面监查计划进行监查。研究者将为此类监查活动分配足够的时间。研究者还将确保监查员或其它合规性或质量保证审查员有权访问所有上述研究相关文件和研究相关设施(例如,药房、诊断实验室等),并有足够的空间进行监查访视。
12.2.审计和检查
研究者将准许IRB/IEC、发起人、政府监管机构以及大学合规和质量保证小组对所有研究相关文件(例如源文件、监管文件、数据收集工具、研究数据等)进行研究相关监查、审计和检查。研究者将确保能够检查适用的研究相关设施(例如药房、诊断实验室等)。作为研究者参与此研究意味着接受政府监管机构和适用的大学合规和质量保证办公室的潜在检查。
15.附录
15.1.ECOG体力状态
表16.ECOG体力状态
15.2.IMWG统一应答标准
表17.按应答子类别的IMWG多发性骨髓瘤统一应答标准(Kumar,2016)*
/>
IMWG=国际骨髓瘤工作组。MRD=微小残留疾病。FLC=游离轻链。M蛋白=骨髓瘤蛋白。SPD=所测量病灶的最大垂直直径的乘积之和。SUV
§§浆细胞瘤测量应取自PET/CT的CT部分或MRI扫描或专用CT扫描(在适用的情况下)。对于仅皮肤受累的患者,应用尺子测量皮肤病变。肿瘤大小的测量将由SPD确定。
实例5-利米多赛和P-BCMA-101组合治疗
15.3.利米多赛
15.3.1.介.绍
利米多赛(又名AP1903)(另请参见利米多赛研究者手册)是一种研究性小分子药物,其先前已在1期人类研究中被评估为用诱导型胱天蛋白酶9(iC9)安全开关基因转导的用于细胞疗法的激活剂。利米多赛是一类被称为二聚化药物的化合物的成员,其通过诱导细胞内工程话蛋白质的聚集而起作用。利米多赛诱导的细胞死亡是通过表达包括通过柔性接头与人δ胱天蛋白酶-9连接的人FK506结合蛋白12(FKBP12)结构域的嵌合蛋白来实现的。利米多赛是细胞渗透性合成配体,其与在最小程度上与内源性FKBP相互作用的工程化的高亲和力版本FKBP12结合。这种嵌合蛋白在细胞内处于静止状态,直到施用利米多赛,所述嵌合蛋白与FKBP12结构域交联、启动经修饰的胱天蛋白酶-9分子的二聚化并使细胞凋亡(Zhou,2015a)。单次静脉内输注利米多赛触发表达iC9基因的细胞中的凋亡和最终细胞死亡,但不影响非转导细胞,并且其本身没有治疗益处。如果在受试者中发生某些严重的或危及生命的不良事件的情况下临床上指示此类选择性细胞杀伤,则建议使用利米多赛与P-BCMA-101结合作为‘救援疗法’。P-BCMA-101是专有的CAR-T产品,其由经过基因改造的自体T细胞组成,以靶向和消除表达BCMA的骨髓瘤癌细胞,并且这些T细胞还携带基于iC9的安全开关基因。利米多赛以0.4mg/kg的单次静脉内剂量施用。利米多赛药物产品以用于注射的无菌溶液的形式提供,在8mL溶液中含有40mg的利米多赛(5mg/mL),并且然后在输注施用前进一步稀释在0.9%普通无菌生理盐水中用于注射。
利米多赛的非临床研究表明,原代人T淋巴细胞被基于利米多赛的安全开关转导;(1)保留其功能,并且(2)可以通过高效、有效和特异性暴露于利米多赛来消除(Thomis,2001)。波赛伊达公司(Poseida)已经用利米多赛和含有基于iC9的安全开关的CAR-T细胞产品P-BCMA-101进行了体外和体内研究,获得了类似的结果。波赛伊达公司最近在大鼠中进行了GLP重复给药静脉内毒性研究。结果显示,在重复(三次)静脉内施用后,NOAEL>15mg/kg。没有观察到利米多赛的明显毒性作用。(请参阅利米多赛研究者手册获取进一步细节)。
先前已在包含健康志愿者在内的1期临床研究中对利米多赛进行了评估,并且在接受其它携带基于iC9的安全开关基因的基因修饰的T细胞产品治疗的移植患者中对移植物抗宿主病(GVHD)进行了评估,这支持了利米多赛与P-BCMA-101结合的临床用途的潜力。在迄今为止发布的关于利米多赛的临床研究中,没有明显的不良事件,并且生命体征、ECG、血清生物化学、血液学、凝血参数或尿液分析结果也没有临床上的显著变化。在患上GVHD并接受0.4mg/kg的利米多赛作为2小时输注的受试者中,在利米多赛输注后30分钟内消除了90%的经修饰T细胞,其中在接下来的24小时期间实现进一步对数耗竭。这些患者的GVHD完全消退,没有复发(Zhou,2015b;Iuliucci,2001;DiStasi,2011;Kapoor,2016;Zhou,2016)。
利米多赛的预期用途的风险收益似乎非常有利。在有效剂量范围(0.01-1.0mg/kg)之内和以上,利米多赛似乎具有一致和线性的药代动力学,并且实际上没有毒性。这与临床数据非常吻合,证明消除了由基于iC9的安全开关转导的同种异体T细胞引起的严重疾病(GVHD),以及预期类似地消除携带基于iC9的安全开关基因的自体CAR-T细胞,如果临床上需要的话。
15.3.2.研究用途
如第6.3节和研究参考手册(毒性参考手册)中所描述的,利米多赛可以用于对P-BCMA-101有显著不良反应的受试者。通常,除了其它标准措施(例如,托珠单抗、类固醇和/或细胞毒性/免疫抑制剂)之外,具有4级CRS的受试者可以接受利米多赛治疗(通常,使用利米多赛将优先于使用全身毒性细胞毒性剂)。对于对其它措施无应答的3级毒性,也可以考虑此选项。如果受试者出现无法控制的P-BCMA-101 T细胞扩增或其它可能与P-BCMA-101有关的临床上显著的3-4级毒性,则除了其它标准措施外,也将考虑使用利米多赛。建议研究者在使用前审查临床情况和潜在的混杂因素。如果时间准许,应咨询研究医学监查员并填写利米多赛使用表。没有绝对的预定义纳入或排除标准。
15.3.3.研究治疗
15.3.3.1.利米多赛施用
15.3.3.1.1.描述
利米多赛药物产品的剂型是注射用无菌溶液。此药物产品含有40mg的利米多赛,并且旨在在通过静脉内输注施用之前,进一步稀释在0.9%普通无菌生理盐水中。
无菌利米多赛溶液5mg/mL以带有灰色丁基胶塞和铝制封件的1型玻璃10mL小瓶中的8ml填充物的形式提供。表5中提供了5mg/mL利米多赛注射液的定量组成。
表5:利米多赛药物产品的定性和定量组成
a.实际数量将基于原料药的纯度进行调整。
b.也被称为Kollilphor
15.3.3.1.2.供应和储存
药物产品应在2℃-8℃下冷藏保存。在稀释和施用前,应根据以下方案说明将药物产品置于室温下并通过倒胃混合若干次以确保溶液清澈且均质。
15.3.3.1.3.制备
1.使用0.4mg/kg的剂量和5mg/mL的利米多赛注射液浓度,基于受试者体重计算要使用的利米多赛注射液的剂量体积-体积(mL)=0.4mg/kg×受试者体重(kg)/5mg/mL(表6中示出了实例)。每个小瓶含有8mL的利米多赛,因此可能需要超过1个小瓶。
2.将小瓶带到环境室温下。每个小瓶应通过倒置进行混合,以确保在使用前获得清澈且均质的溶液。目视检查是否有任何可见的微粒或混浊。使用无菌针头和无菌10mLB.D.鲁尔锁注射器(Luer-Lok syringe)将计算出的利米多赛注射液从小瓶中无菌转移到可商购获得的100mL不含EVA DEHP输注袋中,其中含有0.9%氯化钠注射液,USP带管。通过倒置进行混合。
3.以约50mL/小时的输注速度施用。
表6:利米多赛给药计算实例
15.3.3.1.4.给药和施用
如果有指示,则利米多赛应作为约2小时静脉内输注以0.4mg/kg的剂量施用。
15.3.4.伴髓药物和治疗
没有针对利米多赛的伴随药物和治疗的限制或要求。
15.3.5.评估和程序时间表
表7示出了在使用利米多赛的情况下要遵循的事件和程序的时间表。
如果发生第6.3节所描述的特定AE,则应考虑使用利米多赛。应填写利米多赛使用表格,并且如果时间允许,由医学监查员审查和批准。用于利米多赛的同意书将包含在主要研究ICF中。
用于P-BCMA-101 T细胞的血液样品将在利米多赛输注之前采集,然后在1小时、2小时、4小时、8小时、24小时、第2天、第4天、第7天、第2周、第3周、第4周时采集,并且用于利米多赛药代动力学的血液样品将在1小时、2小时、4小时、8小时、24小时时采集。临床化学、血液学和凝血实验室评估将在第1天、第2天、第4天、第7天以及第2周、第3周、第4周进行。访视可以在被禁止的窗口内进行调整,以与P-BCMA-101需要的研究访视一致,并且针对P-BCMA-101评估计划进行的实验室评估不需要针对利米多赛评估计划重复。
随访将按照P-BCMA-101事件时间表(表7)继续进行,其中在第6周、第8周、第3个月以及之后每3个月进行访视。
15.3.6.记录不良事件
参见第8节获取有关记录不良事件的程序。不良事件应记录在研究CRF中,并在适当的情况下标记分配给利米多赛的属性。
15.4.用P-BCMA-101再治疗
如果在受试者的疾病进展时制造中剩余足够的P-BCMA-101细胞,则经安全委员会批准,可以以至多已成功完成剂量限制毒性评估的最高剂量水平施用额外的细胞。为了接受额外的P-BCMA-101细胞输注,受试者将被分配新的受试者识别号,受试者必须满足如第4节中所概述的所有资格标准,并且除了白细胞去除术外,还将经受相同的筛选、纳入、调理化疗和后续程序,如表8和表9中所概述。
15.5.周期施用
在1期-周期施用期间,多剂量的P-BCMA-101将在2个周期(队列A和队列C)或3个周期(队列B)中静脉内施用2周。施用的总剂量可以从≤1期单个剂量递增期间确定的MTD开始。
在队列A和B的第一周期中,将施用总剂量的1/3。在队列A中,将在第2周期中施用至多总剂量的2/3。在队列B中,将在第2周期和第3周期中的每一个中施用至多总剂量的1/3。在队列C中,将在第1周期中施用至多总剂量的2/3,并且将在第2周期中施用至多总剂量的1/3。研究设计的示意图如图16(针对队列A和队列C)和图17(针对队列B)所示。
将使用针对单次施用所描述的相同的3+3剂量递增和/或递减规则。例如,如果当前单次施用的最大剂量为15×10
表10中示出了针对队列A、B和C的从筛选到调理化疗的事件时间表。表11中示出了针对队列A和队列C的并且表12中示出了针对队列B的用于周期给药的P-BCMA-101施用事件时间表。表13中示出了针对队列A、B和C的治疗后随访事件时间表。
表7:事件时间表(利米多赛)
(仅在如第6.3节和研究参考手册中所描述的特定不良事件的情况下使用)
1.确认符合第6.3节和研究参考手册(毒性管理手册)的AE,并且如果时间准许,则在第一次利米多赛施用前由医学监查员进行审查。
2.利米多赛的同意书将包含在主要研究ICF中,并且应在IRB批准后由受试者尽快完成。
3.在利米多赛输注前、利米多赛输注后1小时、2小时、4小时、8小时、24小时,然后在第2天、第4天、第7天、第2周、第3周、第4周采集用于P-BCMA-101 T细胞的血液样品。在利米多赛输注前和利米多赛输注后1小时、2小时、4小时、8小时和24小时采集用于利米多赛药代动力学的血液样品。
4.血液化学将包含钠、钾、氯化物、镁、碳酸氢盐、血尿素氮、肌酐、钙、白蛋白、葡萄糖、LDH、总蛋白、ALT、AST、胆红素(总胆红素和直接胆红素)、碱性磷酸酶、PTT和PT或INR。
血液学研究包含:
·全血细胞计数
·血小板
·B(CDl9)和T细胞计数(CD3)以及CD4和CD8
5.按照P-BCMA-101事件时间表继续随访;在第6周、第8周、第3个月以及之后每3个月进行访视。如果访视与P-BCMA-101事件时间表上的访视同时进行,如果在指定的访视窗口内,则无需重复访视。
6.AE记录在研究eCRF中,并在适当的情况下标记分配给利米多赛的属性。
表8:事件时间表-额外输注:从筛选/纳入到调理化疗
1.包含所需的纳入之前6个月的MM测量结果(包含血清蛋白电泳[SPEP]、尿蛋白电泳[UPEP]、血清免疫固定[SIFE]、尿液免疫固定[UIFE]、血清游离轻链[FLC]、MRD以及根据临床上所指示的,PET/CT和/或骨髓/肿瘤活检/抽吸物[骨髓活检],如果可用的话)。
2.在筛选/纳入时获得12导联ECG和超声心动图。
3.将在以下时间评估骨髓瘤应答(可以从在上个月内的任何结果中获得):筛查/纳入时;开始调理化疗后7天内的基线(注意:必须在最后一次骨髓瘤疗法完成(包含挽救疗法)与淋巴细胞清除化疗开始之间进行2次或更多次评估);第0天(在P-BCMA-101施用之前-因此,24小时尿液采集将在第-1天开始,以便在P-BCMA-101施用之前完成),并且如临床上所指示的,根据国际骨髓瘤工作组标准和标准评估,包含SPEP、UPEP、SIFE、UIFE和血清FLC。骨髓活检、抽吸物和微小残留疾病(MRD)(由中心实验室分析)必须在开始调理化疗的7天内完成,然后根据临床上所指示的进行,或者具有医学监查员豁免。将提交骨髓抽吸物的样品和骨髓活检的样品(如研究参考手册中所描述)以评估MRD、浆细胞频率、P-BCMA-101细胞、BCMA和其它生物标志物。还应提交任何髓外活检的一部分以评估P-BCMA-101细胞、BCMA和其它生物标志物。如果在筛查期间进行并提供了新的骨髓活检/抽吸物,则无需在基线访视期间重复。根据临床上所指示的进行PET/CT。
4.有生育能力的女性将在纳入时进行血清妊娠测试,并在开始调理化疗前72小时(3天)内进行尿液妊娠测试。
5.血液化学将包含钠、钾、氯化物、镁、碳酸氢盐、血尿素氮、肌酐、钙、白蛋白、葡萄糖、LDH、总蛋白、ALT、AST、胆红素(总胆红素和直接胆红素)、碱性磷酸酶、PTT和PT或INR。
血液学研究包含:
·全血细胞计数
·血小板
·所有时间点的B(CD19)和T细胞计数(CD3)以及CD4和CD8,第-3天、第-4天除外
·需要在P-BCMA-101施用前的时间点评估循环骨髓瘤/浆细胞(例如,通过流式细胞术或具有人工差异的CBC)。如果在纳入和基线样品中鉴定出循环骨髓瘤/浆细胞,请联系发起人并参考排除标准#3和#10。
6.将在纳入时评估P-BCMA-101细胞;例如,P-BCMA-101细胞血液的载体拷贝数/mL、表面标志物表型、克隆性等。在每个时间点对样品进行的细胞表征和表型评估将根据每个测定的时间相关性而有所不同。
7.将使用李氏准则(Lee,2014)对CRS进行分级。
8.在开始调理化疗的7天内在基线处获得PET/CT。
9.将在纳入访视时记录过敏症以及受试者在纳入前30天期间服用的所有处方药和非处方药、维生素、草药和营养补充剂。每次访视时都应记录所有药物、补充剂和过敏症(包含任何当前症状的严重程度)。如果可能的话,应根据研究者的判断,在纳入前中止不必要的药物/补充剂。
10.受试者在开始调理化疗时应继续满足进入标准或具有医学监查员批准。应在第-5天的72小时内重复以下评估,以重新评估进入标准:MMSE(应包含受试者笔迹样品);体格检查;生命体征;怀孕和化学小组、包含B和T细胞计数在内的血液学、凝血。
11.标记为“……的样品”或“……的血液样品”的实验室研究被送到中央实验室,而那些没有如此标记的实验室研究通常在研究场所进行。在P-BCMA-101-001A3(修正3)批准之前纳入的受试者将在研究场所继续评估骨髓瘤应答、HIV、乙型肝炎和丙型肝炎以及HTLV筛查、血清IgG以及细胞因子释放综合征标志物(CRS)。
表9:事件时间表-额外输注:P-BCMA-101施用和随访
1.在第0天、第1天、第4天、第7天、第4周、第3个月以及之后每3个月进行12导联ECG。
2.将在第0天(在P-BCMA-101施用之前-因此,24小时尿液采集将在第-1天开始,以便在P-BCMA-101施用之前完成)、第2周、第3周、第4周、第6周、第8周和第3个月、第4个月、第5个月、第6个月、第7个月、第8个月、第9个月、第12个月、第15个月、第18个月、第21个月和第24个月并且如临床上所指示的(例如,评估表明应答确认后≤1周)根据国际骨髓瘤工作组标准和标准评估,包含血清蛋白电泳(SPEP)、尿蛋白电泳(UPEP)、血清免疫固定(SIFE)、尿液免疫固定(UIFE)、血清游离轻链(FLC)评估骨髓瘤应答。骨髓活检、抽吸物和微小残留疾病(MRD)(由中心实验室分析)必须在第4周、第3个月、第6个月和第12个月完成,然后根据临床上所指示的进行,或者具有医学监查员豁免。将提交骨髓抽吸物的样品和骨髓活检的样品(如研究参考手册中所描述)以评估MRD、浆细胞频率、P-BCMA-101细胞、BCMA和其它生物标志物。还应提交任何髓外活检的一部分以评估P-BCMA-101细胞、BCMA和其它生物标志物。根据临床上所指示的进行PET/CT。
3.有生育能力的女性将在筛查后的所有指定访视时进行尿液妊娠测试。
4.血液化学将包含钠、钾、氯化物、镁、碳酸氢盐、血尿素氮、肌酐、钙、白蛋白、葡萄糖、LDH、总蛋白、ALT、AST、胆红素(总胆红素和直接胆红素)、碱性磷酸酶、PTT和PT或INR。肿瘤溶解(尿酸和磷酸盐)的评估将在基线处和第1天、第4天、第7天进行,然后根据临床上所指示的进行。血液学研究包含:
·全血细胞计数
·血小板
·B(CD19)和T细胞计数(CD3)以及CD4和CD8
5.将评估P-BCMA-101细胞;例如,P-BCMA-101细胞血液的载体拷贝数/mL、表面标志物表型、克隆性等。在基线处、第0天(P-BCMA-101施用后1小时)、第4天、第7天、第10天、第2周、第3周、第4周、第6周、第8周、第3个月、第4个月、第5个月、第6个月、第7个月、第8个月、第9个月以及之后每3个月进行评估。在每个时间点对样品进行的细胞表征和表型评估将根据每个测定的时间相关性而有所不同。
6.将使用李氏准则(Lcc,2014)对CRS进行分级。
7.在第0天,应在P-BCMA-101施用之前和之后大约1小时(+/-15分钟)获得MMSE(应包含受试者笔迹样品)、12导联ECG、体格检查、化学小组、血液学和凝血。将在P-BCMA-101施用之前和之后采集生命体征(温度、呼吸频率、脉搏、O2饱和度和血压),然后每15分钟(+/-5分钟)一次,持续至少一小时,并且直到这些体征令人满意且稳定。除非另有指示,否则应在P-BCMA-101施用之前获得其它第0天评估和样品。在P-BCMA-101施用后,这些评估(或任何其它被研究者认为有临床指征的评估)将如表9中所描述并且以观察到的不良事件临床上所指示的频率或根据机构的住院患者标准进行。
8.如果受试者在P-BCMA-101施用之后中止此研究,则应在开始替代性药物、放射或外科手术干预之前进行计划的下一次访视的事件,并记录为此研究的研究结束访视。如果受试者正在纳入方案P-BCMA-101-002,则受试者应在受试者中止P-BCMA-101-001方案之后同意并纳入方案P-BCMA-101-002,并且根据方案P-BCMA-101-002所规定与此方案中的P-BCMA-101的施用相关的时间表来进行并记录此方案的第一次访视的事件。
9.如果需要的话,第10天评估可以在第10天后至多2天进行,但不能与第2周评估在同一天进行。
10.每次访视时都应记录所有药物、补充剂和过敏症(包含任何当前症状的严重程度)。
11.标记为“……的样品”或“……的血液样品”的实验室研究被送到中央实验室,而那些没有如此标记的实验室研究通常在研究场所进行。在P-BCMA-101-001A3(修正3)批准之前纳入的受试者将在研究场所继续评估骨髓瘤应答、HIV、乙型肝炎和丙型肝炎以及HTLV筛查、血清IgG以及细胞因子释放综合征标志物(CRS)。
12.将在开始调理化疗的7天内在基线处获得PET/CT,然后按照临床上所指示的进行(例如,如果在需要成像的基线处发现软组织浆细胞瘤,则每8周进行一次,作为应答评估的一部分或确认应答)。
表10:事件时间表-从筛选到调理化疗:周期施用,队列A、B和C
1.包含所需的筛选之前6个月的MM测量结果(包含血清蛋白电泳[SPEP]、尿蛋白电泳[UPEP]、血清免疫固定[SIFE]、尿液免疫固定[UIFE]、血清游离轻链[FLC]、微小残留疾病[MRD]以及根据临床上所指示的,PET/CT和/或骨髓/肿瘤活检/抽吸物[骨髓活检],如果可用的话)。
2.仅在筛选访视时获得身高。
3.在筛选时获得12导联ECG和超声心动图。
4.将在以下时间评估骨髓瘤应笞(可以从在上个月内的任何结果中获得):筛查时;开始调理化疗后7天内的基线(注意:必须在最后一次骨髓瘤疗法完成(包含挽救疗法)与淋巴细胞清除化疗开始之间进行2次或更多次评估);第0天(在P-BCMA-101施用之前-因此,24小时尿液采集将在第-1天开始,以便在P-BCMA-101施用之前完成),开且如临床上所指示的,根据国际骨髓瘤工作组标准和标准评估,包含SPEP、UPEP、SIFE、UIFE和血清FLC。骨髓活检、抽吸物和MRD(由中心实验室分析)必须在开始调理化疗的7天内完成,然后根据临床上所指示的进行,或者具有医学监查员豁免。将提交骨髓抽吸物的样品和骨髓活检的样品(如研究参考手册中所描述)以评估MRD、浆细胞频率、P-BCMA-101细胞、BCMA和其它生物标志物。还应提交任何髓外活检的一部分以评估P-BCMA-101细胞、BCMA和其它生物标志物。如果在筛查期间进行并提供了新的骨髓活检/抽吸物,则无需在基线访视期间重复。根据临床上所指示的进行PET/CT。
5.有生育能力的女性将在筛选时进行血清妊娠测试,并在开始调理化疗前72小时(3天)内进行尿液妊娠测试。
6.血液化学将包含钠、钾、氯化物、镁、碳酸氢盐、血尿素氮、肌酐、钙、白蛋白、葡萄糖、LDH、总蛋白、ALT、AST、胆红素(总胆红素和直接胆红素)、碱性磷酸酶、PTT和PT或INR。
血液学研究包含:
·全血细胞计数
·血小板
·所有时间点的B(CD19)和T细胞计数(CD3)以及CD4和CD8,第-3天、第-4天除外
·需要在P-BCMA-101施用前的时间点评估循环骨髓瘤/浆细胞(例如,通过流式细胞术或具有人工差异的CBC)。如果在纳入和基线样品中鉴定出循环骨髓瘤/浆细胞,请联系发起人并参考排除标准#3和#10。
7.将在纳入时评估P-BCMA-101细胞;例如,P-BCMA-101细胞血液的载体拷贝数/mL、表面标志物表型、克隆性等。在每个时间点对样品进行的细胞表征和表型评估将根据每个测定的时间相关性而有所不同。
8.将使用李氏准则(Lee,2014)对CRS进行分级。
9.在开始调理化疗的7天内在基线处获得PET/CT。
10.将在筛选访视时记录过敏症以及受试者在筛选前30天期间服用的所有处方药和非处方药、维生素、草药和营养补充剂。每次访视时都应记录所有药物、补充剂和过敏症(包含任何当前症状的严重程度)。如果可能的话,应根据研究者的判断,在筛选前中止不必要的药物/补充剂。
11.受试者在开始调理化疗时应继续满足进入标准或具有医学监查员批准。应在第-5天的72小时内重复以下评估,以重新评估进入标准:MMSE(应包含受试者笔迹样品);体格检查;生命体征;怀孕和化学小组、包含B和T细胞计数在内的血液学、凝血。
12.纳入评估将在白细胞去除术前14天±3天进行或具有医学监查员批准。
13.白细胞去除术应在筛选后约28天内进行或具有医学监查员批准。可以在第5.1节和研究参考手册中找到用于进行白细胞去除术的指导(具体地产品和过程的表征,包含中点和终点计数与具有手工差异的CBC、血小板、B和T细胞(CD4和CD8)、骨髓瘤细胞、流式细胞术、机器性能)在单采血液成分术期间在研究场所单采血液成分术中心进行,并在单采血液成分术产物从单采血液成分术中心运送到其它位置进行分析、表征和制造P-BCMA-101细胞之前报告)。
14.标记为“……的样品”或“……的血液样品”的实验室研究被送到中央实验室,而那些没有如此标记的实验室研究通常在研究场所进行。在P-BCMA-101-001 A3(修正3)批准之前纳入的受试者将在研究场所继续评估骨髓瘤应答、HIV、乙型肝炎和丙型肝炎以及HTLV筛查、血清IgG以及细胞因子释放综合征标志物(CRS)。
表11:事件时间表-P-BCMA-101给药:周期施用,队列A和队列C
1.在第0天、第1天、第4天、第7天、第4周、第3个月以及之后每3个月进行12导联ECG。
2.将在第0天(在P-BCMA-101施用之前-因此,24小时尿液采集将在第-1天开始,以便在P-BCMA-101施用之前完成)、第2周期的第7天、第2周、第3周、第4周、第6周、第8周和第3个月、第4个月、第5个月、第6个月、第7个月、第8个月、第9个月、第12个月、第15个月、第18个月、第21个月和第24个月并且如临床上所指示的(例如,评估表明应答确认后≤1周)根据国际骨髓瘤工作组标准和标准评估,包含血清蛋白电泳(SPEP)、尿蛋白电泳(UPEP)、血清免疫固定(SIFE)、尿液免疫固定(UIFE)、血清游离轻链(FLC)评估骨髓瘤应答。
3.有生育能力的女性将在每个给药周期前进行尿液妊娠测试。
4.血液化学将包含钠、钾、氯化物、镁、碳酸氢盐、血尿素氮、肌酐、钙、白蛋白、葡萄糖、LDH、总蛋白、ALT、AST、胆红素(总胆红素和直接胆红素)、碱性磷酸酶、PTT和PT或INR。肿瘤溶解(尿酸和磷酸盐)的评估将在基线处和第1天、第4天、第7天进行,然后根据临床上所指示的进行。血液学研究包含:
·全血细胞计数
·血小板
·B(CD19)和T细胞计数(CD3)以及CD4和CD8
5.将评估P-BCMA-101细胞;例如,P-BCMA-101细胞血液的载体拷贝数/mL、表面标志物表型、克隆性等。在基线处、第0天(P-BCMA-101施用后1小时)、第4天、第7天、第10天、第2周、第3周、第4周、第6周、第8周、第3个月、第4个月、第5个月、第6个月、第7个月、第8个月、第9个月以及之后每3个月进行评估。在每个时间点对样品进行的细胞表征和表型评估将根据每个测定的时间相关性而有所不同。
6.将使用李氏准则(Lee,2014)对CRS进行分级。
7.在第0天,应在P-BCMA-101施用之前和之后大约1小时(+/-15分钟)获得MMSE(应包含受试者笔迹样品)、12导联ECG、体格检查、化学小组、血液学和凝血。血清肌酐应<2.0mg/dL,血清谷氨酸草酰乙酸转氨酶(SGOT)<3×正常上限,并且总胆红素<2.0mg/dL,或者有医学监查员批准以进行P-BCMA-101输注。将在P-BCMA-101施用之前和之后采集生命体征(温度、呼吸频率、脉搏、O2饱和度和血压),然后每15分钟(+/-5分钟)一次,持续至少一小时,并且直到这些体征令人满意且稳定。除非另有指示,否则应在P-BCMA-101施用之前获得其它第0天评估和样品。在P-BCMA-101施用后,这些评估(或任何其它被研究者认为有临床指征的评估)将如表11和表13中所描述并且以观察到的不良事件临床上所指示的频率或根据机构的标准进行。
8.如果受试者在第2周期的第10天之后中止此研究,则应在开始替代性药物、放射或外科手术干预之前进行计划的下一次访视的事件,并记录为此研究的研究结束访视。如果受试者在初始剂量之后但在第2周期的第10天之前中止此研究,则应在开始替代性药物、放射或外科手术干预之前进行针对第2周访视的评估,并记录为此研究的研究结束访视。如果受试者正在纳入方案P-BCMA-101-002,则受试者应在受试者中止P-BCMA-101-001方案之后同意并纳入方案P-BCMA-101-002,并且根据方案P-BCMA-101-002所规定与此方案中的P-BCMA-101的施用相关的时间表来进行并记录此方案的第一次访视的事件。
9.如果需要的话,第10天评估可以在第10天后至多2天进行,但不能与下一个第0天或第2周评估在同一天进行。
10.每次访视时都应记录所有药物、补充剂和过敏症(包含任何当前症状的严重程度)。
11.标记为“……的样品”或“……的血液样品”的实验室研究被送到中央实验室,而那些没有如此标记的实验室研究通常在研究场所进行。在P-BCMA-101-001 A3(修正3)批准之前纳入的受试者将在研究场所继续评估骨髓瘤应答、HIV、乙型肝炎和丙型肝炎以及HTLV筛查、血清IgG以及细胞因子释放综合征标志物(CRS)。
12.将基于受试者所在的队列重复P-BCMA-101周期施用。队列A和队列C受试者将完成第1剂量的第1周期(第0-10天)和第2剂量的第2周期(第0-10天)。一旦第2周期的第10天已经完成,则受试者继续到第2周。
表12:事件时间表-P-BCMA-101给药:周期施用,队列B
1.在第0天、第1天、第4天、第7天、第4周、第3个月以及之后每3个月进行12导联ECG。
2.将在第0天(在P-BCMA-101施用之前-因此,24小时尿液采集将在第-1天开始,以便在P-BCMA-101施用之前完成)、第2周期的第7天、第2周、第3周、第4周、第6周、第8周和第3个月、第4个月、第5个月、第6个月、第7个月、第8个月、第9个月、第12个月、第15个月、第18个月、第21个月和第24个月并且如临床上所指示的(例如,评估表明应答确认后≤1周)根据国际骨髓瘤工作组标准和标准评估,包含血清蛋白电泳(SPEP)、尿蛋白电泳(UPEP)、血清免疫固定(SIFE)、尿液免疫固定(UIFE)、血清游离轻链(FLC)评估骨髓瘤应答。
3.有生育能力的女性将在每个给药周期前进行尿液妊娠测试。
4.血液化学将包含钠、钾、氯化物、镁、碳酸氢盐、血尿素氮、肌酐、钙、白蛋白、葡萄糖、LDH、总蛋白、ALT、AST、胆红素(总胆红素和直接胆红素)、碱性磷酸酶、PTT和PT或INR。肿瘤溶解(尿酸和磷酸盐)的评估将在基线处和第1天、第4天、第7天进行,然后根据临床上所指示的进行。血液学研究包含:
·全血细胞计数
·血小板
·B(CD19)和T细胞计数(CD3)以及CD4和CD8
5.将评估P-BCMA-101细胞;例如,P-BCMA-101细胞血液的载体拷贝数/mL、表面标志物表型、克隆性等。在基线处、第0天(P-BCMA-101施用后1小时)、第4天、第7天、第10天、第2周、第3周、第4周、第6周、第8周、第3个月、第4个月、第5个月、第6个月、第7个月、第8个月、第9个月以及之后每3个月进行评估。在每个时间点对样品进行的细胞表征和表型评估将根据每个测定的时间相关性而有所不同。
6.将使用李氏准则(Lee,2014)对CRS进行分级。
7.在第0天,应在P-BCMA-101施用之前和之后大约1小时(+/-15分钟)获得MMSE(应包含受试者笔迹样品)、12导联ECG、体格检查、化学小组、血液学和凝血。血清肌酐应<2.0mg/dL,血清谷氨酸草酰乙酸转氨酶(SGOT)<3×正常上限,并且总胆红素<2.0mg/dL,或者有医学监查员批准以进行P-BCMA-101输注。将在P-BCMA-101施用之前和之后采集生命体征(温度、呼吸频率、脉搏、O2饱和度和血压),然后每15分钟(+/-5分钟)一次,持续至少一小时,并且直到这些体征令人满意且稳定。除非另有指示,否则应在P-BCMA-101施用之前获得其它第0天评估和样品。在P-BCMA-101施用后,这些评估(或任何其它被研究者认为有临床指征的评估)将如表12和表13中所描述,并且以观察到的不良事件临床上所指示的频率或根据机构的标准进行。
8.如果受试者在周期3第10天之后中止此研究,则应在开始替代性药物、放射或外科手术干预之前进行计划的下一次访视的事件,并记录为此研究的研究结束访视。如果受试者在初始剂量之后但在第3周期的第10天之前中止此研究,则应在开始替代性药物、放射或外科手术干预之前进行计划的下一次访视的估计,并记录为此研究的研究结束访视。如果受试者正在纳入方案P-BCMA-101-002,则受试者应在受试者中止P-BCMA-101-001方案之后同意并纳入方案P-BCMA-101-002,并且根据方案P-BCMA-101-002所规定与此方案中的P-BCMA-101的施用相关的时间表来进行并记录此方案的第一次访视的事件。
9.如果需要的话,第10天评估可以在第10天后至多2天进行,但不能与第2周评估在同一天进行。
10.每次访视时都应记录所有药物、补充剂和过敏症(包含任何当前症状的严重程度)。
11.标记为“……的样品”或“……的血液样品”的实验室研究被送到中央实验室,而那些没有如此标记的实验室研究通常在研究场所进行。在P-BCMA-101-001 A3(修正3)批准之前纳入的受试者将在研究场所继续评估骨髓瘤应笞、HIV、乙型肝炎和丙型肝炎以及HTLV筛查、血清IgG以及细胞因子释放综合征标志物(CRS)。
12.将基于受试者所在的队列重复P-BCMA-101周期施用。队列B受试者将完成第1剂量的第1周期(第0-10天)、第2剂量的第2周期(第0-10天)和第3剂量的第3周期(第0-10天)。一旦第3周期的第10天已经完成,则受试者继续到第2周。
表13:事件时间表-治疗后随访:周期施用队列A、B和C
1.在第0天、第1天、第4天、第7天、第4周、第3个月以及之后每3个月进行12导联ECG。
2.将在第0天(在P-BCMA-101施用之前-因此,24小时尿液采集将在第-1天开始,以便在P-BCMA-101施用之前完成)、第2周期的第7天、第2周、第3周、第4周、第6周、第8周和第3个月、第4个月、第5个月、第6个月、第7个月、第8个月、第9个月、第12个月、第15个月、第18个月、第21个月和第24个月并且如临床上所指示的(例如,评估表明应答确认后≤1周)根据国际骨髓瘤工作组标准和标准评估,包含血清蛋白电泳(SPEP)、尿蛋白电泳(UPEP)、血清免疫固定(SIFE)、尿液免疫固定(UIFE)、血清游离轻链(FLC)评估骨髓瘤应答。骨髓活检、抽吸物和微小残留疾病(MRD)(由中心实验室分析)必须在第4周、第3个月、第6个月和第12个月完成,然后根据临床上所指示的进行,或者具有医学监查员豁免。将提交髓抽吸物的样品和骨髓活检的样品(如研究参考手册中所描述)以评估MRD、浆细胞频率、P-BCMA-101细胞、BCMA和其它生物标志物。还应提交任何髓外活检的一部分以评估P-BCMA-101细胞、BCMA和其它生物标志物。根据临床上所指示的进行PET/CT。
3.有生育能力的女性将在筛查后的所有指定访视时进行尿液妊娠测试。
4.血液化学将包含钠、钾、氯化物、镁、碳酸氢盐、血尿素氮、肌酐、钙、白蛋白、葡萄糖、LDH、总蛋白、ALT、AST、胆红素(总胆红素和直接胆红素)、碱性磷酸酶、PTT和PT或1NR。肿瘤溶解(尿酸和磷酸盐)的评估将在基线处和第1天、第4天、第7天进行,然后根据临床上所指示的进行。血液学研究包含:
·全血细胞计数
·血小板
·B(CD19)和T细胞计数(CD3)以及CD4和CD8
5.将评估P-BCMA-101细胞;例如,P-BCMA-101细胞血液的载体拷贝数/mL、表面标志物表型、克隆性等。在基线处、第0天(P-BCMA-101施用后1小时)、第4天、第7天、第10天、第2周、第3周、第4周、第6周、第8周、第3个月、第4个月、第5个月、第6个月、第7个月、第8个月、第9个月以及之后每3个月进行评估。在每个时间点对样品进行的细胞表征和表型评估将根据每个测定的时间相关性而有所不同。
6.将使用李氏准则(Lee,2014)对CRS进行分级。
7.如果受试者在P-BCMA-101施用之后中止此研究,则应在开始替代性药物、放射或外科手术干预之前进行计划的下一次访视的事件,并记录为此研究的研究结束访视。如果受试者正在纳入方案P-BCMA-101-002,则受试者应在受试者中止P-BCMA-101-001方案之后同意并纳入方案P-BCMA-101-002,并且根据方案P-BCMA-101-002所规定与此方案中的P-BCMA-101的施用相关的时间表来进行并记录此方案的第一次访视的事件。
8.每次访视时都应记录所有药物、补充剂和过敏症(包含任何当前症状的严重程度)。
9.标记为“……的样品”或“……的血液样品”的实验室研究被送到中央实验室,而那些没有如此标记的实验室研究通常在研究场所进行。在P-BCMA-101-001 A3(修正3)批准之前纳入的受试者将在研究场所继续评估骨髓瘤应答、HIV、乙型肝炎和丙型肝炎以及HTLV筛查、血清IgG以及细胞因子释放综合征标志物(CRS)。
10.将在开始调理化疗的7天内在基线处获得PET/CT,然后按照临床上所指示的进行(例如,如果在需要成像的基线处发现软组织浆细胞瘤,则每8周进行一次,作为应答评估的一部分或确认应答)。
11.一旦受试者完成所有给药周期(队列A和队列C为2个周期,并且队列B为3个周期),则受试者将继续第2周访视(从最近的第0天起14天)。
实例6-P-BCMA-101组合施用
15.6.1期-组合施用
在1期-组合施用中,P-BCMA-101将与批准的疗法组合施用:
来那度胺
队列R:从P-BCMA-101输注前1周开始,每日口服来那度胺10mg,每28天中持续21天;以及
队列RP:从单采血液成分术前1周开始持续7天,以及从P-BCMA-101输注前1周开始每28天中持续21天,每日口服来那度胺10mg。
除非疾病进展,否则队列R和队列RP将继续使用来那度胺给药。请参阅来那度胺包装插页获取处方信息(来那度胺,2019)(应特别注意,来那度胺是假定的致畸剂,避免怀孕和监测是必需的)。以下是特定于此方案的额外建议。如果在P-BCMA-101施用后28天没有报告DLT并且血小板>50,000/μL并且中性粒细胞>1000/μL,则剂量可以增加至每日口服25mg,每28天中持续21天。如果在以此剂量治疗的前6名患者中报告了<2个DLT,则根据安全委员会的决定,所有患者的起始剂量可以增加至每日口服25mg,每28天中持续21天。在治疗期间,如果中性粒细胞减少至<1000/μL,则保持来那度胺直至中性粒细胞>1000/μL,然后以5mg的较低剂量重新开始。在治疗期间,如果血小板减少至<30,000/μL,则保持来那度胺直至血小板>30,000/μL,然后以5mg的较低剂量重新开始。如果肌酐清除率为30-60毫升/分钟,则最大来那度胺剂量应为每日10mg。如果肌酐清除率<30毫升/分钟,则维持来那度胺。在DLT的情况下,应中止来那度胺。此研究允许的最低剂量为每日5mg。研究者和安全委员会可以基于其它安全性发现决定适时中止来那度胺。患者应按照指示同时接受抗凝药物(例如,每日口服阿司匹林325mg)。不要与来那度胺一起使用糖皮质激素。
利妥昔单抗
队列RIT:除非疾病进展,否则在P-BCMA-101输注前12天和5天,然后每8周通过静脉内输注375mg/m
施用的P-BCMA-101的剂量将按照3+3设计递增或递减,从≤剂量递增期间测定的MTD开始。
表14中示出了针对组合施用的从筛选到调理化疗的事件时间表。表15中示出了针对组合施用的P-BCMA-101施用和随访的事件时间表。
表14:事件时间表-从筛选到调理化疗(组合施用)
/>
1.包含所需的筛选之前6个月的MM测量结果(包含血清蛋白电泳[SPEP]、尿蛋白电泳[UPEP]、血清免疫固定[SIFE]、尿液免疫固定[UIFE]、血清游离轻链[FLC]、微小残留疾病[MRD]以及根据临床上所指示的,PET/CT和/或骨髓/肿瘤活检/抽吸物[骨髓活检],如果可用的话)。
2.仅在筛选访视时获得身高。
3.在筛选时获得12导联ECG和超声心动图。
4.将在以下时间评估骨髓瘤应答(可以从在上个月内的任何结果中获得):筛查时;开始调理化疗后7天内的基线(注意:必须在最后一次骨髓瘤疗法完成(包含挽救疗法)与淋巴细胞清除化疗开始之间进行2次或更多次评估);第0天(在P-BCMA-101施用之前-因此,24小时尿液采集将在第-1天开始,以便在P-BCMA-101施用之前完成),并且如临床上所指示的,根据国际骨髓瘤工作组标准和标准评估,包含SPEP、UPEP、SIFE、UIFE和血清FLC。骨髓活检、抽吸物和MRD(由中心实验室分析)必须在开始调理化疗的7天内完成,然后根据临床上所指示的进行,或者具有医学监查员豁免。将提交骨髓抽吸物的样品和骨髓活检的样品(如研究参考手册中所描述)以评估MRD、浆细胞频率、P-BCMA-101细胞、BCMA和其它生物标志物。还应提交任何髓外活检的一部分以评估P-BCMA-101细胞、BCMA和其它生物标志物。如果在筛查期间进行并提供了新的骨髓活检/抽吸物,则无需在基线访视期间重复。根据临床上所指示的进行PET/CT。
5.R和RP队列中所有女性受试者:必须在开始疗法前获得两次阴性妊娠测试。第一次测试应在开具来那度胺疗法处方前10-14天内进行,第二次测试应在开具来那度胺疗法处方前24小时内进行,并且然后在第一个月期间每周进行一次测试,之后在月经周期规律的女性中每月进行一次测试或在月经不规律的女性中每2周进行一次测试。
6.血液化学将包含钠、钾、氯化物、镁、碳酸氢盐、血尿素氮、肌酐、钙、白蛋白、葡萄糖、LDH、总蛋白、ALT、AST、胆红素(总胆红素和直接胆红素)、碱性磷酸酶、PTT和PT或INR。
血液学研究包含:
·全血细胞计数(CBC)
·血小板
·所有时间点的B(CD19)和T细胞计数(CD3)以及CD4和CD8,第-3天、第-4天除外
·需要在P-BCMA-101施用前的时间点评估循环骨髓瘤/浆细胞(例如,通过流式细胞术或具有人工差异的CBC)。如果在纳入和基线样品中鉴定出循环骨髓瘤/浆细胞,请联系发起人并参考排除标准#3和#10。
7.将在纳入时评估P-BCMA-101细胞;例如,P-BCMA-101细胞血液的载体拷贝数/mL、表面标志物表型、克隆性等。在每个时间点对样品进行的细胞表征和表型评估将根据每个测定的时间相关性而有所不同。
8.将使用李氏准则(Lee,2014)对CRS进行分级。
9.在开始调理化疗的7天内在基线处获得PET/CT。
10.将在筛选访视时记录过敏症以及受试者在筛选前30天期间服用的所有处方药和非处方药、维生素、草药和营养补充剂。每次访视时都应记录所有药物、补充剂和过敏症(包含任何当前症状的严重程度)。如果可能的话,应根据研究者的判断,在筛选前中止不必要的药物/补充剂。
11.受试者在开始调理化疗时应继续满足进入标准或具有医学监查员批准。应在第-5天的72小时内重复以下评估,以重新评估进入标准:MMSE(应包含受试者笔迹样品);体格检查;生命体征;怀孕和化学小组、包含B和T细胞计数在内的血液学、凝血。
12.纳入评估将在白细胞去除术前14天±3天进行或具有医学监查员批准。
13.白细胞去除术应在筛选后约28天内进行或具有医学监查员批准。可以在第5.1节和研究参考手册中找到用于进行白细胞去除术的指导(具体地产品和过程的表征,包含中点和终点计数与具有手工差异的CBC、血小板、B和T细胞(CD4和CD8)、骨髓瘤细胞、流式细胞术、机器性能)在单采血液成分术期间在研究场所单采血液成分术中心进行,并在单采血液成分术产物从单采血液成分术中心运送到其它位置进行分析、表征和制造P-BCMA-101细胞之前报告)。
14.标记为“……的样品”或“……的血液样品”的实验室研究被送到中央实验室,而那些没有如此标记的实验室研究通常在研究场所进行。在P-BCMA-101-001A3(修正3)批准之前纳入的受试者将在研究场所继续评估骨髓瘤应答、HIV、乙型肝炎和丙型肝炎以及HTLV筛查、血清IgG以及细胞因子释放综合征标志物(CRS)。
15.队列R中的来那度胺:从P-BCMA-101输注前1周开始,每日口服来那度胺10-25mg,每28天中持续21天。
16.队列RP中的来那度胺:在单采血液成分术之前每日口服10mg,持续7天,然后从P-BCMA-101输注前1周开始,每日口服来那度胺10-25mg,每28天中持续21天。
17.队列RIT中的利妥昔单抗:在P-BCMA-101输注前12天和5天,然后每8周通过输注375mg/m2。
18.对于队列R、队列RP和队列RIT中的受试者,组合疗法应在适用的日期的调理化疗之前施用。
表15:事件时间表-P-BCMA-101施用和随访(组合施用)
1.在第0天、第1天、第4天、第7天、第4周、第3个月以及之后每3个月进行12导联ECG。
2.将在第0天(在P-BCMA-101施用之前-因此,24小时尿液采集将在第-1天开始,以便在P-BCMA-101施用之前完成)、第2周、第3周、第4周、第6周、第8周和第3个月、第4个月、第5个月、第6个月、第7个月、第8个月、第9个月、第12个月、第15个月、第18个月、第21个月和第24个月并且如临床上所指示的(例如,评估表明应答确认后≤1周)根据国际骨髓瘤工作组标准和标准评估,包含血清蛋白电泳(SPEP)、尿蛋白电泳(UPEP)、血清免疫固定(SIFE)、尿液免疫固定(UIFE)、血清游离轻链(FLC)评估骨髓瘤应答。骨髓活检、抽吸物和微小残留疾病(MRD)(由中心实验室分析)必须在第4周、第3个月、第6个月和第12个月完成,然后根据临床上所指示的进行,或者具有医学监查员豁免。将提交髓抽吸物的样品和骨髓活检的样品(如研究参考手册中所描述)以评估MRD、浆细胞频率、P-BCMA-101细胞、BCMA和其它生物标志物。还应提交任何髓外活检的一部分以评估P-BCMA-101细胞、BCMA和其它生物标志物。根据临床上所指示的进行PET/CT。
3.有生育能力的女性将在筛查后的所有指定访视时进行尿液妊娠测试。R和RP队列中所有女性受试者:必须在开始疗法前获得两次阴性妊娠测试。第一次测试应在开具来那度胺疗法处方前10-14天内进行,第二次测试应在开具来那度胺疗法处方前24小时内进行,并且然后在第一个月期间每周进行一次测试,之后在月经周期规律的女性中每月进行一次测试或在月经不规律的女性中每2周进行一次测试。
4.血液化学将包含钠、钾、氯化物、镁、碳酸氢盐、血尿素氮、肌酐、钙、白蛋白、葡萄糖、LDH、总蛋白、ALT、AST、胆红素(总胆红素和直接胆红素)、碱性磷酸酶、PTT和PT或INR。肿瘤溶解(尿酸和磷酸盐)的评估将在基线处和第1天、第4天、第7天进行,然后根据临床上所指示的进行。血液学研究包含:
·全血细胞计数
·血小板
·B(CD19)和T细胞计数(CD3)以及CD4和CD8
5.将评估P-BCMA-101细胞;例如,P-BCMA-101细胞血液的载体拷贝数/mL、表面标志物表型、克隆性等。在基线处、第0天(P-BCMA-101施用后1小时)、第4天、第7天、第10天、第2周、第3周、第4周、第6周、第8周、第3个月、第4个月、第5个月、第6个月、第7个月、第8个月、第9个月以及之后每3个月进行评估。在每个时间点对样品进行的细胞表征和表型评估将根据每个测定的时间相关性而有所不同。
6.将使用李氏准则(Lee,2014)对CRS进行分级。
7.在第0天,应在P-BCMA-101施用之前和之后大约1小时(+/-15分钟)获得MMSE(应包含受试者笔迹样品)、12导联ECG、体格检查、化学小组、血液学和凝血。将在P-BCMA-101施用之前和之后采集生命体征(温度、呼吸频率、脉搏、O2饱和度和血压),然后每15分钟(+/-5分钟)一次,持续至少一小时,并且直到这些体征令人满意且稳定。除非另有指示,否则应在P-BCMA-101施用之前获得其它第0天评估和样品。在P-BCMA-101施用后,这些评估(或任何其它被研究者认为有临床指征的评估)将如表3中所描述并且以观察到的不良事件临床上所指示的频率或根据机构的标准进行。
8.如果受试者在P-BCMA-101施用之后中止此研究,则应在开始替代性药物、放射或外科手术干预之前进行计划的下一次访视的事件,并记录为此研究的研究结束访视。如果受试者正在纳入方案P-BCMA-101-002,则受试者应在受试者中止P-BCMA-101-001方案之后同意并纳入方案P-BCMA-101-002,并且根据方案P-BCMA-101-002所规定与此方案中的P-BCMA-101的施用相关的时间表来进行并记录此方案的第一次访视的事件。
9.如果需要的话,第10天评估可以在第10天后至多2天进行,但不能与第2周评估在同一天进行。
10.每次访视时部应记录所有药物、补充剂和过敏症(包含任何当前症状的严重程度)。
11.标记为“……的样品”或“……的血液样品”的实验室研究被送到中央实验室,而那些没有如此标记的实验室研究通常在研究场所进行。在P-BCMA-101-001 A3(修正3)批准之前纳入的受试者将在研究场所继续评估骨髓瘤应答、HIV、乙型肝炎和丙型肝炎以及HTLV筛查、血清IgG以及细胞因子释放综合征标志物(CRS)。
12.将在开始调理化疗的7天内在基线处获得PET/CT,然后按照临床上所指示的进行(例如,如果在需要成像的基线处发现软组织浆细胞瘤,则每8周进行一次,作为应答评估的一部分或确认应答)。
13.队列R中的来那度胺:从P-BCMA-101输注前1周开始,每日口服来那度胺10-25mg,每28天中持续21天。
14.队列RP中的来那度胺:在单采血液成分术之前每日口服10mg,持续7天,然后从P-BCMA-101输注前1周开始,每日口服来那度胺10-25mg,每28天中持续21天。
15.队列RIT中的利妥昔单抗:在P-BCMA-101输注前12天和5天,然后每8周通过输注375mg/m2。
实例7-接受P-BCMA101治疗的多发性骨髓瘤患者的抗药物抗体应答和药代动力学评估
根据图18中示出的时间表,向患有骨髓瘤的患者单独或与利妥昔单抗组合施用P-BCMA-101。在第0天施用P-BCMA-101。在P-BCMA-101之前12天和5天施用利妥昔单抗,然后每8周施用直到骨髓瘤进展。通过使用qPCR随时间推移测量在外周血中循环的DNA的P-BCMA-101/μg的拷贝数来评估P-BCMA-101的药代动力学。使用中尺度发现(meso scalediscovery,MSD)测定随时间推移评估外周血中对P-BCMA-101的抗药物抗体(ADA)应答。在未使用利妥昔单抗的患者102-006(图19A)中,观察到对P-BCMA-101的抗体应答,并且P-BCMA-101在外周血中短时间持续存在,伴随骨髓瘤的短暂应答。在使用利妥昔单抗的患者113-003(图19B)中,未观察到对P-BCMA-101的抗体反应,并且P-BCMA-101在外周血中长时间以高水平持续存在,伴随骨髓瘤的长时间应答(扩展至最后评估的时间点)。尽管两名患者(使用或未使用利妥昔单抗)的P-BCMA-101拷贝数/ug DNA的峰值在约30天时出现,但在未使用利妥昔单抗治疗的患者中,P-BCMA-101拷贝数/ug DNA在约130天时下降至基线,而在使用利妥昔单抗治疗的患者中,P-BCMA-101拷贝数/ug DNA持续到190天。此外,在未使用利妥昔单抗的患者中,随着P-BCMA-101拷贝数/ug DNA的减少,临床预后从稳定疾病变为最小应答,并且还具有ADA阳性应答。相比之下,在使用利妥昔单抗的患者中,随着P-BCMA-101拷贝数/ug DNA持续,临床预后从稳定疾病稳定变为部分应答类别,并且具有ADA阴性应答。
共有九名患者接受了P-BCMA-101和利妥昔单抗的组合治疗,并且所述患者对治疗的应答注释如下:严格的完全应答(sCR);完全应答(CR);非常好的部分应答(VGPR);部分应答(PR);或最小应答(MR)。
通过引用并入
除非明确排除或以其它方式限制,否则本文引用的每篇文献,包含任何交叉引用的或相关的专利或申请均据此通过引用整体并入本文。任何文献的引用都不承认其是关于本文所公开或所要求的任何发明的现有技术,或其单独地或以与任何其它参考或参考组合的形式教示、表明或公开任何这种发明。进一步,在本文献中的术语的任何含义或定义与通过引用并入的文献中的同一术语的任何含义或定义相冲突的意义上,应当以在本文献中分配给所述术语的含义或定义为准。
其它实施例
虽然已经说明并描述了本公开的特定实施例,但是可以在不脱离本公开的精神和范围的情况下作出各种其它改变和修改。所附权利要求的范围包含本公开范围内的所有此类改变和修改。
序列表
<110>波赛伊达治疗公司(POSEIDA THERAPEUTICS, INC.)
<120>用于治疗癌症的组合物和方法
<130>POTH-057/001WO 325002-2527
<150>US 63/009,569
<151>2020-04-14
<160>45
<170>PatentIn 3.5版
<210>1
<211>89
<212>PRT
<213>智人(Homo sapiens)
<400>1
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Glu Val Thr Glu Asp Ser
1 5 1015
Leu Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Leu
202530
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Asn Leu Thr
354045
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
505560
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Lys Gly Gly His Arg Ser
65707580
Asn Pro Leu Ser Ala Glu Phe Thr Thr
85
<210>2
<211>594
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>piggybac转座酶
<400>2
Met Gly Ser Ser Leu Asp Asp Glu His Ile Leu Ser Ala Leu Leu Gln
1 5 1015
Ser Asp Asp Glu Leu Val Gly Glu Asp Ser Asp Ser Glu Val Ser Asp
202530
His Val Ser Glu Asp Asp Val Gln Ser Asp Thr Glu Glu Ala Phe Ile
354045
Asp Glu Val His Glu Val Gln Pro Thr Ser Ser Gly Ser Glu Ile Leu
505560
Asp Glu Gln Asn Val Ile Glu Gln Pro Gly Ser Ser Leu Ala Ser Asn
65707580
Arg Ile Leu Thr Leu Pro Gln Arg Thr Ile Arg Gly Lys Asn Lys His
859095
Cys Trp Ser Thr Ser Lys Ser Thr Arg Arg Ser Arg Val Ser Ala Leu
100 105 110
Asn Ile Val Arg Ser Gln Arg Gly Pro Thr Arg Met Cys Arg Asn Ile
115 120 125
Tyr Asp Pro Leu Leu Cys Phe Lys Leu Phe Phe Thr Asp Glu Ile Ile
130 135 140
Ser Glu Ile Val Lys Trp Thr Asn Ala Glu Ile Ser Leu Lys Arg Arg
145 150 155 160
Glu Ser Met Thr Ser Ala Thr Phe Arg Asp Thr Asn Glu Asp Glu Ile
165 170 175
Tyr Ala Phe Phe Gly Ile Leu Val Met Thr Ala Val Arg Lys Asp Asn
180 185 190
His Met Ser Thr Asp Asp Leu Phe Asp Arg Ser Leu Ser Met Val Tyr
195 200 205
Val Ser Val Met Ser Arg Asp Arg Phe Asp Phe Leu Ile Arg Cys Leu
210 215 220
Arg Met Asp Asp Lys Ser Ile Arg Pro Thr Leu Arg Glu Asn Asp Val
225 230 235 240
Phe Thr Pro Val Arg Lys Ile Trp Asp Leu Phe Ile His Gln Cys Ile
245 250 255
Gln Asn Tyr Thr Pro Gly Ala His Leu Thr Ile Asp Glu Gln Leu Leu
260 265 270
Gly Phe Arg Gly Arg Cys Pro Phe Arg Val Tyr Ile Pro Asn Lys Pro
275 280 285
Ser Lys Tyr Gly Ile Lys Ile Leu Met Met Cys Asp Ser Gly Thr Lys
290 295 300
Tyr Met Ile Asn Gly Met Pro Tyr Leu Gly Arg Gly Thr Gln Thr Asn
305 310 315 320
Gly Val Pro Leu Gly Glu Tyr Tyr Val Lys Glu Leu Ser Lys Pro Val
325 330 335
His Gly Ser Cys Arg Asn Ile Thr Cys Asp Asn Trp Phe Thr Ser Ile
340 345 350
Pro Leu Ala Lys Asn Leu Leu Gln Glu Pro Tyr Lys Leu Thr Ile Val
355 360 365
Gly Thr Val Arg Ser Asn Lys Arg Glu Ile Pro Glu Val Leu Lys Asn
370 375 380
Ser Arg Ser Arg Pro Val Gly Thr Ser Met Phe Cys Phe Asp Gly Pro
385 390 395 400
Leu Thr Leu Val Ser Tyr Lys Pro Lys Pro Ala Lys Met Val Tyr Leu
405 410 415
Leu Ser Ser Cys Asp Glu Asp Ala Ser Ile Asn Glu Ser Thr Gly Lys
420 425 430
Pro Gln Met Val Met Tyr Tyr Asn Gln Thr Lys Gly Gly Val Asp Thr
435 440 445
Leu Asp Gln Met Cys Ser Val Met Thr Cys Ser Arg Lys Thr Asn Arg
450 455 460
Trp Pro Met Ala Leu Leu Tyr Gly Met Ile Asn Ile Ala Cys Ile Asn
465 470 475 480
Ser Phe Ile Ile Tyr Ser His Asn Val Ser Ser Lys Gly Glu Lys Val
485 490 495
Gln Ser Arg Lys Lys Phe Met Arg Asn Leu Tyr Met Ser Leu Thr Ser
500 505 510
Ser Phe Met Arg Lys Arg Leu Glu Ala Pro Thr Leu Lys Arg Tyr Leu
515 520 525
Arg Asp Asn Ile Ser Asn Ile Leu Pro Lys Glu Val Pro Gly Thr Ser
530 535 540
Asp Asp Ser Thr Glu Glu Pro Val Met Lys Lys Arg Thr Tyr Cys Thr
545 550 555 560
Tyr Cys Pro Ser Lys Ile Arg Arg Lys Ala Asn Ala Ser Cys Lys Lys
565 570 575
Cys Lys Lys Val Ile Cys Arg Glu His Asn Ile Asp Met Cys Gln Ser
580 585 590
Cys Phe
<210>3
<211>21
<212>PRT
<213>智人(Homo sapiens)
<400>3
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 1015
His Ala Ala Arg Pro
20
<210>4
<211>24
<212>PRT
<213>智人(Homo sapiens)
<400>4
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
1 5 1015
Ser Leu Val Ile Thr Leu Tyr Cys
20
<210>5
<211>72
<212>DNA
<213>智人(Homo sapiens)
<400>5
atctacattt gggcaccact ggccgggacc tgtggagtgc tgctgctgag cctggtcatc60
acactgtact gc72
<210>6
<211>112
<212>PRT
<213>智人(Homo sapiens)
<400>6
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly
1 5 1015
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
202530
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
354045
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
505560
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
65707580
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
859095
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
100 105 110
<210>7
<211>336
<212>DNA
<213>智人(Homo sapiens)
<400>7
cgcgtgaagt ttagtcgatc agcagatgcc ccagcttaca aacagggaca gaaccagctg60
tataacgagc tgaatctggg ccgccgagag gaatatgacg tgctggataa gcggagagga 120
cgcgaccccg aaatgggagg caagcccagg cgcaaaaacc ctcaggaagg cctgtataac 180
gagctgcaga aggacaaaat ggcagaagcc tattctgaga tcggcatgaa gggggagcga 240
cggagaggca aagggcacga tgggctgtac cagggactga gcaccgccac aaaggacacc 300
tatgatgctc tgcatatgca ggcactgcct ccaagg 336
<210>8
<211>42
<212>PRT
<213>智人(Homo sapiens)
<400>8
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
1 5 1015
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
202530
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
3540
<210>9
<211>126
<212>DNA
<213>智人(Homo sapiens)
<400>9
aagagaggca ggaagaaact gctgtatatt ttcaaacagc ccttcatgcg ccccgtgcag60
actacccagg aggaagacgg gtgctcctgt cgattccctg aggaagagga aggcgggtgt 120
gagctg126
<210>10
<211>45
<212>PRT
<213>智人(Homo sapiens)
<400>10
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
1 5 1015
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
202530
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp
354045
<210>11
<211>135
<212>DNA
<213>智人(Homo sapiens)
<400>11
actaccacac cagcacctag accaccaact ccagctccaa ccatcgcgag tcagcccctg60
agtctgagac ctgaggcctg caggccagct gcaggaggag ctgtgcacac caggggcctg 120
gacttcgcct gcgac135
<210>12
<211>594
<212>PRT
<213>粉纹夜蛾(Trichoplusia ni)
<400>12
Met Gly Ser Ser Leu Asp Asp Glu His Ile Leu Ser Ala Leu Leu Gln
1 5 1015
Ser Asp Asp Glu Leu Val Gly Glu Asp Ser Asp Ser Glu Ile Ser Asp
202530
His Val Ser Glu Asp Asp Val Gln Ser Asp Thr Glu Glu Ala Phe Ile
354045
Asp Glu Val His Glu Val Gln Pro Thr Ser Ser Gly Ser Glu Ile Leu
505560
Asp Glu Gln Asn Val Ile Glu Gln Pro Gly Ser Ser Leu Ala Ser Asn
65707580
Arg Ile Leu Thr Leu Pro Gln Arg Thr Ile Arg Gly Lys Asn Lys His
859095
Cys Trp Ser Thr Ser Lys Ser Thr Arg Arg Ser Arg Val Ser Ala Leu
100 105 110
Asn Ile Val Arg Ser Gln Arg Gly Pro Thr Arg Met Cys Arg Asn Ile
115 120 125
Tyr Asp Pro Leu Leu Cys Phe Lys Leu Phe Phe Thr Asp Glu Ile Ile
130 135 140
Ser Glu Ile Val Lys Trp Thr Asn Ala Glu Ile Ser Leu Lys Arg Arg
145 150 155 160
Glu Ser Met Thr Gly Ala Thr Phe Arg Asp Thr Asn Glu Asp Glu Ile
165 170 175
Tyr Ala Phe Phe Gly Ile Leu Val Met Thr Ala Val Arg Lys Asp Asn
180 185 190
His Met Ser Thr Asp Asp Leu Phe Asp Arg Ser Leu Ser Met Val Tyr
195 200 205
Val Ser Val Met Ser Arg Asp Arg Phe Asp Phe Leu Ile Arg Cys Leu
210 215 220
Arg Met Asp Asp Lys Ser Ile Arg Pro Thr Leu Arg Glu Asn Asp Val
225 230 235 240
Phe Thr Pro Val Arg Lys Ile Trp Asp Leu Phe Ile His Gln Cys Ile
245 250 255
Gln Asn Tyr Thr Pro Gly Ala His Leu Thr Ile Asp Glu Gln Leu Leu
260 265 270
Gly Phe Arg Gly Arg Cys Pro Phe Arg Met Tyr Ile Pro Asn Lys Pro
275 280 285
Ser Lys Tyr Gly Ile Lys Ile Leu Met Met Cys Asp Ser Gly Tyr Lys
290 295 300
Tyr Met Ile Asn Gly Met Pro Tyr Leu Gly Arg Gly Thr Gln Thr Asn
305 310 315 320
Gly Val Pro Leu Gly Glu Tyr Tyr Val Lys Glu Leu Ser Lys Pro Val
325 330 335
His Gly Ser Cys Arg Asn Ile Thr Cys Asp Asn Trp Phe Thr Ser Ile
340 345 350
Pro Leu Ala Lys Asn Leu Leu Gln Glu Pro Tyr Lys Leu Thr Ile Val
355 360 365
Gly Thr Val Arg Ser Asn Lys Arg Glu Ile Pro Glu Val Leu Lys Asn
370 375 380
Ser Arg Ser Arg Pro Val Gly Thr Ser Met Phe Cys Phe Asp Gly Pro
385 390 395 400
Leu Thr Leu Val Ser Tyr Lys Pro Lys Pro Ala Lys Met Val Tyr Leu
405 410 415
Leu Ser Ser Cys Asp Glu Asp Ala Ser Ile Asn Glu Ser Thr Gly Lys
420 425 430
Pro Gln Met Val Met Tyr Tyr Asn Gln Thr Lys Gly Gly Val Asp Thr
435 440 445
Leu Asp Gln Met Cys Ser Val Met Thr Cys Ser Arg Lys Thr Asn Arg
450 455 460
Trp Pro Met Ala Leu Leu Tyr Gly Met Ile Asn Ile Ala Cys Ile Asn
465 470 475 480
Ser Phe Ile Ile Tyr Ser His Asn Val Ser Ser Lys Gly Glu Lys Val
485 490 495
Gln Ser Arg Lys Lys Phe Met Arg Asn Leu Tyr Met Ser Leu Thr Ser
500 505 510
Ser Phe Met Arg Lys Arg Leu Glu Ala Pro Thr Leu Lys Arg Tyr Leu
515 520 525
Arg Asp Asn Ile Ser Asn Ile Leu Pro Asn Glu Val Pro Gly Thr Ser
530 535 540
Asp Asp Ser Thr Glu Glu Pro Val Met Lys Lys Arg Thr Tyr Cys Thr
545 550 555 560
Tyr Cys Pro Ser Lys Ile Arg Arg Lys Ala Asn Ala Ser Cys Lys Lys
565 570 575
Cys Lys Lys Val Ile Cys Arg Glu His Asn Ile Asp Met Cys Gln Ser
580 585 590
Cys Phe
<210>13
<211>90
<212>PRT
<213>智人(Homo sapiens)
<400>13
Met Leu Pro Ala Pro Lys Asn Leu Val Val Ser Glu Val Thr Glu Asp
1 5 1015
Ser Leu Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe
202530
Leu Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Asn Leu
354045
Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro
505560
Gly Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Lys Gly Gly His Arg
65707580
Ser Asn Pro Leu Ser Ala Glu Phe Thr Thr
8590
<210>14
<211>270
<212>DNA
<213>人工序列(Artificial Sequence)
<220>
<223>FN3结构域共有序列
<400>14
atgctgcctg caccaaagaa cctggtggtg tctcatgtga cagaggatag tgccagactg60
tcatggactg ctcccgacgc agccttcgat agttttatca tcgtgtaccg ggagaacatc 120
gaaaccggcg aggccattgt cctgacagtg ccagggtccg aacgctctta tgacctgaca 180
gatctgaagc ccggaactga gtactatgtg cagatcgccg gcgtcaaagg aggcaatatc 240
agcttccctc tgtccgcaat cttcaccaca270
<210>15
<211>4
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>FN3共有序列的修饰
<400>15
Thr Glu Asp Ser
1
<210>16
<211>7
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>FN3结构域共有序列的修饰
<400>16
Thr Ala Pro Asp Ala Ala Phe
1 5
<210>17
<211>6
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>FN3结构域共有序列的修饰
<400>17
Ser Glu Lys Val Gly Glu
1 5
<210>18
<211>4
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>FN3结构域共有序列的修饰
<400>18
Gly Ser Glu Arg
1
<210>19
<211>5
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>FN3结构域共有序列的修饰
<400>19
Gly Leu Lys Pro Gly
1 5
<210>20
<211>7
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>FN3结构域共有序列的修饰
<400>20
Lys Gly Gly His Arg Ser Asn
1 5
<210>21
<211>958
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>CARTyrin
<400>21
Met Gly Val Gln Val Glu Thr Ile Ser Pro Gly Asp Gly Arg Thr Phe
1 5 1015
Pro Lys Arg Gly Gln Thr Cys Val Val His Tyr Thr Gly Met Leu Glu
202530
Asp Gly Lys Lys Val Asp Ser Ser Arg Asp Arg Asn Lys Pro Phe Lys
354045
Phe Met Leu Gly Lys Gln Glu Val Ile Arg Gly Trp Glu Glu Gly Val
505560
Ala Gln Met Ser Val Gly Gln Arg Ala Lys Leu Thr Ile Ser Pro Asp
65707580
Tyr Ala Tyr Gly Ala Thr Gly His Pro Gly Ile Ile Pro Pro His Ala
859095
Thr Leu Val Phe Asp Val Glu Leu Leu Lys Leu Glu Gly Gly Gly Gly
100 105 110
Ser Gly Phe Gly Asp Val Gly Ala Leu Glu Ser Leu Arg Gly Asn Ala
115 120 125
Asp Leu Ala Tyr Ile Leu Ser Met Glu Pro Cys Gly His Cys Leu Ile
130 135 140
Ile Asn Asn Val Asn Phe Cys Arg Glu Ser Gly Leu Arg Thr Arg Thr
145 150 155 160
Gly Ser Asn Ile Asp Cys Glu Lys Leu Arg Arg Arg Phe Ser Ser Leu
165 170 175
His Phe Met Val Glu Val Lys Gly Asp Leu Thr Ala Lys Lys Met Val
180 185 190
Leu Ala Leu Leu Glu Leu Ala Gln Gln Asp His Gly Ala Leu Asp Cys
195 200 205
Cys Val Val Val Ile Leu Ser His Gly Cys Gln Ala Ser His Leu Gln
210 215 220
Phe Pro Gly Ala Val Tyr Gly Thr Asp Gly Cys Pro Val Ser Val Glu
225 230 235 240
Lys Ile Val Asn Ile Phe Asn Gly Thr Ser Cys Pro Ser Leu Gly Gly
245 250 255
Lys Pro Lys Leu Phe Phe Ile Gln Ala Cys Gly Gly Glu Gln Lys Asp
260 265 270
His Gly Phe Glu Val Ala Ser Thr Ser Pro Glu Asp Glu Ser Pro Gly
275 280 285
Ser Asn Pro Glu Pro Asp Ala Thr Pro Phe Gln Glu Gly Leu Arg Thr
290 295 300
Phe Asp Gln Leu Asp Ala Ile Ser Ser Leu Pro Thr Pro Ser Asp Ile
305 310 315 320
Phe Val Ser Tyr Ser Thr Phe Pro Gly Phe Val Ser Trp Arg Asp Pro
325 330 335
Lys Ser Gly Ser Trp Tyr Val Glu Thr Leu Asp Asp Ile Phe Glu Gln
340 345 350
Trp Ala His Ser Glu Asp Leu Gln Ser Leu Leu Leu Arg Val Ala Asn
355 360 365
Ala Val Ser Val Lys Gly Ile Tyr Lys Gln Met Pro Gly Cys Phe Asn
370 375 380
Phe Leu Arg Lys Lys Leu Phe Phe Lys Thr Ser Gly Ser Gly Glu Gly
385 390 395 400
Arg Gly Ser Leu Leu Thr Cys Gly Asp Val Glu Glu Asn Pro Gly Pro
405 410 415
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
420 425 430
His Ala Ala Arg Pro Met Leu Pro Ala Pro Lys Asn Leu Val Val Ser
435 440 445
Arg Ile Thr Glu Asp Ser Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala
450 455 460
Ala Phe Asp Ser Phe Pro Ile Arg Tyr Ile Glu Thr Leu Ile Trp Gly
465 470 475 480
Glu Ala Ile Trp Leu Asp Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu
485 490 495
Thr Gly Leu Lys Pro Gly Thr Glu Tyr Ala Val Val Ile Thr Gly Val
500 505 510
Lys Gly Gly Arg Phe Ser Ser Pro Leu Val Ala Ser Phe Thr Thr Thr
515 520 525
Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser
530 535 540
Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly
545 550 555 560
Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp
565 570 575
Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile
580 585 590
Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys
595 600 605
Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys
610 615 620
Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val
625 630 635 640
Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn
645 650 655
Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val
660 665 670
Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg
675 680 685
Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys
690 695 700
Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg
705 710 715 720
Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys
725 730 735
Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg Gly Ser
740 745 750
Gly Glu Gly Arg Gly Ser Leu Leu Thr Cys Gly Asp Val Glu Glu Asn
755 760 765
Pro Gly Pro Met Val Gly Ser Leu Asn Cys Ile Val Ala Val Ser Gln
770 775 780
Asn Met Gly Ile Gly Lys Asn Gly Asp Phe Pro Trp Pro Pro Leu Arg
785 790 795 800
Asn Glu Ser Arg Tyr Phe Gln Arg Met Thr Thr Thr Ser Ser Val Glu
805 810 815
Gly Lys Gln Asn Leu Val Ile Met Gly Lys Lys Thr Trp Phe Ser Ile
820 825 830
Pro Glu Lys Asn Arg Pro Leu Lys Gly Arg Ile Asn Leu Val Leu Ser
835 840 845
Arg Glu Leu Lys Glu Pro Pro Gln Gly Ala His Phe Leu Ser Arg Ser
850 855 860
Leu Asp Asp Ala Leu Lys Leu Thr Glu Gln Pro Glu Leu Ala Asn Lys
865 870 875 880
Val Asp Met Val Trp Ile Val Gly Gly Ser Ser Val Tyr Lys Glu Ala
885 890 895
Met Asn His Pro Gly His Leu Lys Leu Phe Val Thr Arg Ile Met Gln
900 905 910
Asp Phe Glu Ser Asp Thr Phe Phe Pro Glu Ile Asp Leu Glu Lys Tyr
915 920 925
Lys Leu Leu Pro Glu Tyr Pro Gly Val Leu Ser Asp Val Gln Glu Glu
930 935 940
Lys Gly Ile Lys Tyr Lys Phe Glu Val Tyr Glu Lys Asn Asp
945 950 955
<210>22
<211>2874
<212>DNA
<213>人工序列(Artificial Sequence)
<220>
<223>CARTyrin
<400>22
atgggggtcc aggtcgagac tatttcacca ggggatgggc gaacatttcc aaaaaggggc60
cagacttgcg tcgtgcatta caccgggatg ctggaggacg ggaagaaagt ggacagctcc 120
agggatcgca acaagccctt caagttcatg ctgggaaagc aggaagtgat ccgaggatgg 180
gaggaaggcg tggcacagat gtcagtcggc cagcgggcca aactgaccat tagccctgac 240
tacgcttatg gagcaacagg ccacccaggg atcattcccc ctcatgccac cctggtcttc 300
gatgtggaac tgctgaagct ggagggagga ggaggatccg gatttgggga cgtgggggcc 360
ctggagtctc tgcgaggaaa tgccgatctg gcttacatcc tgagcatgga accctgcggc 420
cactgtctga tcattaacaa tgtgaacttc tgcagagaaa gcggactgcg aacacggact 480
ggctccaata ttgactgtga gaagctgcgg agaaggttct ctagtctgca ctttatggtc 540
gaagtgaaag gggatctgac cgccaagaaa atggtgctgg ccctgctgga gctggctcag 600
caggaccatg gagctctgga ttgctgcgtg gtcgtgatcc tgtcccacgg gtgccaggct 660
tctcatctgc agttccccgg agcagtgtac ggaacagacg gctgtcctgt cagcgtggag 720
aagatcgtca acatcttcaa cggcacttct tgccctagtc tggggggaaa gccaaaactg 780
ttctttatcc aggcctgtgg cggggaacag aaagatcacg gcttcgaggt ggccagcacc 840
agccctgagg acgaatcacc agggagcaac cctgaaccag atgcaactcc attccaggag 900
ggactgagga cctttgacca gctggatgct atctcaagcc tgcccactcc tagtgacatt 960
ttcgtgtctt acagtacctt cccaggcttt gtctcatggc gcgatcccaa gtcagggagc1020
tggtacgtgg agacactgga cgacatcttt gaacagtggg cccattcaga ggacctgcag1080
agcctgctgc tgcgagtggc aaacgctgtc tctgtgaagg gcatctacaa acagatgccc1140
gggtgcttca attttctgag aaagaaactg ttctttaaga cttccggatc tggagaggga1200
aggggaagcc tgctgacctg tggagacgtg gaggaaaacc caggaccaat ggcactgcca1260
gtcaccgccc tgctgctgcc tctggctctg ctgctgcacg cagctagacc aatgctgcct1320
gcaccaaaga acctggtggt gagccggatc acagaggact ccgccagact gtcttggacc1380
gcccctgacg ccgccttcga ttcctttcca atccggtaca tcgagacact gatctggggc1440
gaggccatct ggctggacgt gcccggctct gagaggagct acgatctgac aggcctgaag1500
cctggcaccg agtatgcagt ggtcatcaca ggagtgaagg gcggcaggtt cagctcccct1560
ctggtggcct cttttaccac aaccacaacc cctgccccca gacctcccac acccgcccct1620
accatcgcga gtcagcccct gagtctgaga cctgaggcct gcaggccagc tgcaggagga1680
gctgtgcaca ccaggggcct ggacttcgcc tgcgacatct acatttgggc accactggcc1740
gggacctgtg gagtgctgct gctgagcctg gtcatcacac tgtactgcaa gagaggcagg1800
aagaaactgc tgtatatttt caaacagccc ttcatgcgcc ccgtgcagac tacccaggag1860
gaagacgggt gctcctgtcg attccctgag gaagaggaag gcgggtgtga gctgcgcgtg1920
aagtttagtc gatcagcaga tgccccagct tacaaacagg gacagaacca gctgtataac1980
gagctgaatc tgggccgccg agaggaatat gacgtgctgg ataagcggag aggacgcgac2040
cccgaaatgg gaggcaagcc caggcgcaaa aaccctcagg aaggcctgta taacgagctg2100
cagaaggaca aaatggcaga agcctattct gagatcggca tgaaggggga gcgacggaga2160
ggcaaagggc acgatgggct gtaccaggga ctgagcaccg ccacaaagga cacctatgat2220
gctctgcata tgcaggcact gcctccaagg ggaagtggag aaggacgagg atcactgctg2280
acatgcggcg acgtggagga aaaccctggc ccaatggtcg ggtctctgaa ttgtatcgtc2340
gccgtgagtc agaacatggg cattgggaag aatggcgatt tcccatggcc acctctgcgc2400
aacgagtccc gatactttca gcggatgaca actacctcct ctgtggaagg gaaacagaat2460
ctggtcatca tgggaaagaa aacttggttc agcattccag agaagaaccg gcccctgaaa2520
ggcagaatca atctggtgct gtcccgagaa ctgaaggagc caccacaggg agctcacttt2580
ctgagccggt ccctggacga tgcactgaag ctgacagaac agcctgagct ggccaacaaa2640
gtcgatatgg tgtggatcgt cgggggaagt tcagtgtata aggaggccat gaatcacccc2700
ggccatctga aactgttcgt cacacggatc atgcaggact ttgagagcga tactttcttt2760
cctgaaattg acctggagaa gtacaaactg ctgcccgaat atcctggcgt gctgtccgat2820
gtccaggaag agaaaggcat caaatacaag ttcgaggtct atgagaagaa tgac2874
<210>23
<211>107
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>FKBP12多肽
<400>23
Gly Val Gln Val Glu Thr Ile Ser Pro Gly Asp Gly Arg Thr Phe Pro
1 5 1015
Lys Arg Gly Gln Thr Cys Val Val His Tyr Thr Gly Met Leu Glu Asp
202530
Gly Lys Lys Val Asp Ser Ser Arg Asp Arg Asn Lys Pro Phe Lys Phe
354045
Met Leu Gly Lys Gln Glu Val Ile Arg Gly Trp Glu Glu Gly Val Ala
505560
Gln Met Ser Val Gly Gln Arg Ala Lys Leu Thr Ile Ser Pro Asp Tyr
65707580
Ala Tyr Gly Ala Thr Gly His Pro Gly Ile Ile Pro Pro His Ala Thr
859095
Leu Val Phe Asp Val Glu Leu Leu Lys Leu Glu
100 105
<210>24
<211>321
<212>DNA
<213>人工序列(Artificial Sequence)
<220>
<223>FKBP12多肽
<400>24
ggggtccagg tcgagactat ttcaccaggg gatgggcgaa catttccaaa aaggggccag60
acttgcgtcg tgcattacac cgggatgctg gaggacggga agaaagtgga cagctccagg 120
gatcgcaaca agcccttcaa gttcatgctg ggaaagcagg aagtgatccg aggatgggag 180
gaaggcgtgg cacagatgtc agtcggccag cgggccaaac tgaccattag ccctgactac 240
gcttatggag caacaggcca cccagggatc attccccctc atgccaccct ggtcttcgat 300
gtggaactgc tgaagctgga g 321
<210>25
<211>5
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>接头
<400>25
Gly Gly Gly Gly Ser
1 5
<210>26
<211>15
<212>DNA
<213>人工序列(Artificial Sequence)
<220>
<223>接头
<400>26
ggaggaggag gatcc 15
<210>27
<211>281
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>截短的胱天蛋白酶9
<400>27
Gly Phe Gly Asp Val Gly Ala Leu Glu Ser Leu Arg Gly Asn Ala Asp
1 5 1015
Leu Ala Tyr Ile Ser Leu Met Glu Pro Cys Gly His Cys Leu Ile Ile
202530
Asn Asn Val Asn Phe Cys Arg Glu Ser Gly Leu Arg Thr Arg Thr Gly
354045
Ser Asn Ile Asp Cys Glu Lys Leu Arg Arg Arg Phe Ser Ser Leu His
505560
Phe Met Val Glu Val Lys Gly Asp Leu Thr Ala Lys Lys Met Val Leu
65707580
Ala Leu Leu Glu Leu Ala Gln Gln Asp His Gly Ala Leu Asp Cys Cys
859095
Val Val Val Ile Leu Ser His Gly Cys Gln Ala Ser His Leu Gln Phe
100 105 110
Pro Gly Ala Val Tyr Gly Thr Asp Gly Cys Pro Val Ser Val Glu Lys
115 120 125
Ile Val Asn Ile Phe Asn Gly Thr Ser Cys Pro Ser Leu Gly Gly Lys
130 135 140
Pro Lys Leu Phe Phe Ile Gln Ala Cys Gly Gly Glu Gln Lys Asp His
145 150 155 160
Gly Phe Glu Val Ala Ser Thr Ser Pro Glu Asp Glu Ser Pro Gly Ser
165 170 175
Asn Pro Glu Pro Asp Ala Thr Pro Phe Gln Glu Gly Leu Arg Thr Phe
180 185 190
Asp Gln Leu Asp Ala Ile Ser Ser Leu Pro Thr Pro Ser Asp Ile Phe
195 200 205
Val Ser Tyr Ser Thr Phe Pro Gly Phe Val Ser Trp Arg Asp Pro Lys
210 215 220
Ser Gly Ser Trp Tyr Val Glu Thr Leu Asp Asp Ile Phe Glu Gln Trp
225 230 235 240
Ala His Ser Glu Asp Leu Gln Ser Leu Leu Leu Arg Val Ala Asn Ala
245 250 255
Val Ser Val Lys Gly Ile Tyr Lys Gln Met Pro Gly Cys Asn Phe Leu
260 265 270
Arg Lys Lys Leu Phe Phe Lys Thr Ser
275 280
<210>28
<211>843
<212>DNA
<213>人工序列(Artificial Sequence)
<220>
<223>截短的胱天蛋白酶9
<400>28
tttggggacg tgggggccct ggagtctctg cgaggaaatg ccgatctggc ttacatcctg60
agcatggaac cctgcggcca ctgtctgatc attaacaatg tgaacttctg cagagaaagc 120
ggactgcgaa cacggactgg ctccaatatt gactgtgaga agctgcggag aaggttctct 180
agtctgcact ttatggtcga agtgaaaggg gatctgaccg ccaagaaaat ggtgctggcc 240
ctgctggagc tggctcagca ggaccatgga gctctggatt gctgcgtggt cgtgatcctg 300
tcccacgggt gccaggcttc tcatctgcag ttccccggag cagtgtacgg aacagacggc 360
tgtcctgtca gcgtggagaa gatcgtcaac atcttcaacg gcacttcttg ccctagtctg 420
gggggaaagc caaaactgtt ctttatccag gcctgtggcg gggaacagaa agatcacggc 480
ttcgaggtgg ccagcaccag ccctgaggac gaatcaccag ggagcaaccc tgaaccagat 540
gcaactccat tccaggaggg actgaggacc tttgaccagc tggatgctat ctcaagcctg 600
cccactccta gtgacatttt cgtgtcttac agtaccttcc caggctttgt ctcatggcgc 660
gatcccaagt cagggagctg gtacgtggag acactggacg acatctttga acagtgggcc 720
cattcagagg acctgcagag cctgctgctg cgagtggcaa acgctgtctc tgtgaagggc 780
atctacaaac agatgcccgg gtgcttcaat tttctgagaa agaaactgtt ctttaagact 840
tcc 843
<210>29
<211>394
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>诱导型促凋亡多肽
<400>29
Gly Val Gln Val Glu Thr Ile Ser Pro Gly Asp Gly Arg Thr Phe Pro
1 5 1015
Lys Arg Gly Gln Thr Cys Val Val His Tyr Thr Gly Met Leu Glu Asp
202530
Gly Lys Lys Val Asp Ser Ser Arg Asp Arg Asn Lys Pro Phe Lys Phe
354045
Met Leu Gly Lys Gln Glu Val Ile Arg Gly Trp Glu Glu Gly Val Ala
505560
Gln Met Ser Val Gly Gln Arg Ala Lys Leu Thr Ile Ser Pro Asp Tyr
65707580
Ala Tyr Gly Ala Thr Gly His Pro Gly Ile Ile Pro Pro His Ala Thr
859095
Leu Val Phe Asp Val Glu Leu Leu Lys Leu Glu Gly Gly Gly Gly Gly
100 105 110
Ser Gly Phe Gly Asp Val Gly Ala Leu Glu Ser Leu Arg Gly Asn Ala
115 120 125
Asp Leu Ala Tyr Ile Ser Leu Met Glu Pro Cys Gly His Cys Leu Ile
130 135 140
Ile Asn Asn Val Asn Phe Cys Arg Glu Ser Gly Leu Arg Thr Arg Thr
145 150 155 160
Gly Ser Asn Ile Asp Cys Glu Lys Leu Arg Arg Arg Phe Ser Ser Leu
165 170 175
His Phe Met Val Glu Val Lys Gly Asp Leu Thr Ala Lys Lys Met Val
180 185 190
Leu Ala Leu Leu Glu Leu Ala Gln Gln Asp His Gly Ala Leu Asp Cys
195 200 205
Cys Val Val Val Ile Leu Ser His Gly Cys Gln Ala Ser His Leu Gln
210 215 220
Phe Pro Gly Ala Val Tyr Gly Thr Asp Gly Cys Pro Val Ser Val Glu
225 230 235 240
Lys Ile Val Asn Ile Phe Asn Gly Thr Ser Cys Pro Ser Leu Gly Gly
245 250 255
Lys Pro Lys Leu Phe Phe Ile Gln Ala Cys Gly Gly Glu Gln Lys Asp
260 265 270
His Gly Phe Glu Val Ala Ser Thr Ser Pro Glu Asp Glu Ser Pro Gly
275 280 285
Ser Asn Pro Glu Pro Asp Ala Thr Pro Phe Gln Glu Gly Leu Arg Thr
290 295 300
Phe Asp Gln Leu Asp Ala Ile Ser Ser Leu Pro Thr Pro Ser Asp Ile
305 310 315 320
Phe Val Ser Tyr Ser Thr Phe Pro Gly Phe Val Ser Trp Arg Asp Pro
325 330 335
Lys Ser Gly Ser Trp Tyr Val Glu Thr Leu Asp Asp Ile Phe Glu Gln
340 345 350
Trp Ala His Ser Glu Asp Leu Gln Ser Leu Leu Leu Arg Val Ala Asn
355 360 365
Ala Val Ser Val Lys Gly Ile Tyr Lys Gln Met Pro Gly Cys Asn Phe
370 375 380
Leu Arg Lys Lys Leu Phe Phe Lys Thr Ser
385 390
<210>30
<211>1182
<212>DNA
<213>人工序列(Artificial Sequence)
<220>
<223>诱导型促凋亡多肽
<400>30
ggggtccagg tcgagactat ttcaccaggg gatgggcgaa catttccaaa aaggggccag60
acttgcgtcg tgcattacac cgggatgctg gaggacggga agaaagtgga cagctccagg 120
gatcgcaaca agcccttcaa gttcatgctg ggaaagcagg aagtgatccg aggatgggag 180
gaaggcgtgg cacagatgtc agtcggccag cgggccaaac tgaccattag ccctgactac 240
gcttatggag caacaggcca cccagggatc attccccctc atgccaccct ggtcttcgat 300
gtggaactgc tgaagctgga gggaggagga ggatccgaat ttggggacgt gggggccctg 360
gagtctctgc gaggaaatgc cgatctggct tacatcctga gcatggaacc ctgcggccac 420
tgtctgatca ttaacaatgt gaacttctgc agagaaagcg gactgcgaac acggactggc 480
tccaatattg actgtgagaa gctgcggaga aggttctcta gtctgcactt tatggtcgaa 540
gtgaaagggg atctgaccgc caagaaaatg gtgctggccc tgctggagct ggctcagcag 600
gaccatggag ctctggattg ctgcgtggtc gtgatcctgt cccacgggtg ccaggcttct 660
catctgcagt tccccggagc agtgtacgga acagacggct gtcctgtcag cgtggagaag 720
atcgtcaaca tcttcaacgg cacttcttgc cctagtctgg ggggaaagcc aaaactgttc 780
tttatccagg cctgtggcgg ggaacagaaa gatcacggct tcgaggtggc cagcaccagc 840
cctgaggacg aatcaccagg gagcaaccct gaaccagatg caactccatt ccaggaggga 900
ctgaggacct ttgaccagct ggatgctatc tcaagcctgc ccactcctag tgacattttc 960
gtgtcttaca gtaccttccc aggctttgtc tcatggcgcg atcccaagtc agggagctgg1020
tacgtggaga cactggacga catctttgaa cagtgggccc attcagagga cctgcagagc1080
ctgctgctgc gagtggcaaa cgctgtctct gtgaagggca tctacaaaca gatgcccggg1140
tgcttcaatt ttctgagaaa gaaactgttc tttaagactt cc 1182
<210>31
<211>18
<212>PRT
<213>明脉扁刺蛾病毒(Thosea asigna virus)
<400>31
Glu Gly Arg Gly Ser Leu Leu Thr Cys Gly Asp Val Glu Glu Asn Pro
1 5 1015
Gly Pro
<210>32
<211>21
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>GSG-T2A
<400>32
Gly Ser Gly Glu Gly Arg Gly Ser Leu Leu Thr Cys Gly Asp Val Glu
1 5 1015
Glu Asn Pro Gly Pro
20
<210>33
<211>63
<212>DNA
<213>人工序列(Artificial Sequence)
<220>
<223>GSG-T2A
<400>33
ggatctggag agggaagggg aagcctgctg acctgtggag acgtggagga aaacccagga60
cca63
<210>34
<211>19
<212>PRT
<213>A型马鼻炎(Equine rhinitis A)
<400>34
Gln Cys Thr Asn Tyr Ala Leu Leu Lys Leu Ala Gly Asp Val Glu Ser
1 5 1015
Asn Pro Gly
<210>35
<211>22
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>GSG-G2A
<400>35
Ser Gly Gln Cys Thr Asn Tyr Ala Leu Leu Lys Leu Ala Gly Asp Val
1 5 1015
Glu Ser Asn Pro Gly Pro
20
<210>36
<211>22
<212>PRT
<213>FMDV-O
<400>36
Val Lys Gln Thr Leu Asn Phe Asp Leu Leu Lys Leu Ala Gly Asp Val
1 5 1015
Glu Ser Asn Pro Gly Pro
20
<210>37
<211>25
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>GSG-F2A
<400>37
Gly Ser Gly Val Lys Gln Thr Leu Asn Phe Asp Leu Leu Lys Leu Ala
1 5 1015
Gly Asp Val Glu Ser Asn Pro Gly Pro
2025
<210>38
<211>19
<212>PRT
<213> 猪捷申病毒(Porcine Teschovirus)
<400>38
Ala Thr Asn Phe Ser Leu Leu Lys Gln Ala Gly Asp Val Glu Glu Asn
1 5 1015
Pro Gly Pro
<210>39
<211>22
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>GSG-P2A
<400>39
Gly Ser Gly Ala Thr Asn Phe Ser Leu Leu Lys Gln Ala Gly Asp Val
1 5 1015
Glu Glu Asn Pro Gly Pro
20
<210>40
<211>4897
<212>DNA
<213>人工序列(Artificial Sequence)
<220>
<223>PB-EF1a载体
<400>40
tgtacataga ttaaccctag aaagataatc atattgtgac gtacgttaaa gataatcatg60
cgtaaaattg acgcatgtgt tttatcggtc tgtatatcga ggtttattta ttaatttgaa 120
tagatattaa gttttattat atttacactt acatactaat aataaattca acaaacaatt 180
tatttatgtt tatttattta ttaaaaaaaa acaaaaactc aaaatttctt ctataaagta 240
acaaaacttt tatcgaatac ctgcagcccg ggggatgcag agggacagcc cccccccaaa 300
gcccccaggg atgtaattac gtccctcccc cgctaggggg cagcagcgag ccgcccgggg 360
ctccgctccg gtccggcgct ccccccgcat ccccgagccg gcagcgtgcg gggacagccc 420
gggcacgggg aaggtggcac gggatcgctt tcctctgaac gcttctcgct gctctttgag 480
cctgcagaca cctgggggga tacggggaaa agttgactgt gcctttcgat cgaaccatgg 540
acagttagct ttgcaaagat ggataaagtt ttaaacagag aggaatcttt gcagctaatg 600
gaccttctag gtcttgaaag gagtgggaat tggctccggt gcccgtcagt gggcagagcg 660
cacatcgccc acagtccccg agaagttggg gggaggggtc ggcaattgaa ccggtgccta 720
gagaaggtgg cgcggggtaa actgggaaag tgatgtcgtg tactggctcc gcctttttcc 780
cgagggtggg ggagaaccgt atataagtgc agtagtcgcc gtgaacgttc tttttcgcaa 840
cgggtttgcc gccagaacac aggtaagtgc cgtgtgtggt tcccgcgggc ctggcctctt 900
tacgggttat ggcccttgcg tgccttgaat tacttccacc tggctgcagt acgtgattct 960
tgatcccgag cttcgggttg gaagtgggtg ggagagttcg aggccttgcg cttaaggagc1020
cccttcgcct cgtgcttgag ttgaggcctg gcctgggcgc tggggccgcc gcgtgcgaat1080
ctggtggcac cttcgcgcct gtctcgctgc tttcgataag tctctagcca tttaaaattt1140
ttgatgacct gctgcgacgc tttttttctg gcaagatagt cttgtaaatg cgggccaaga1200
tctgcacact ggtatttcgg tttttggggc cgcgggcggc gacggggccc gtgcgtccca1260
gcgcacatgt tcggcgaggc ggggcctgcg agcgcggcca ccgagaatcg gacgggggta1320
gtctcaagct ggccggcctg ctctggtgcc tggcctcgcg ccgccgtgta tcgccccgcc1380
ctgggcggca aggctggccc ggtcggcacc agttgcgtga gcggaaagat ggccgcttcc1440
cggccctgct gcagggagct caaaatggag gacgcggcgc tcgggagagc gggcgggtga1500
gtcacccaca caaaggaaaa gggcctttcc gtcctcagcc gtcgcttcat gtgactccac1560
ggagtaccgg gcgccgtcca ggcacctcga ttagttctcg agcttttgga gtacgtcgtc1620
tttaggttgg ggggaggggt tttatgcgat ggagtttccc cacactgagt gggtggagac1680
tgaagttagg ccagcttggc acttgatgta attctccttg gaatttgccc tttttgagtt1740
tggatcttgg ttcattctca agcctcagac agtggttcaa agtttttttc ttccatttca1800
ggtgtcgtga gaattctaat acgactcact atagggtgtg ctgtctcatc attttggcaa1860
agattggcca ccaagcttgt cctgcaggag ggtcgacgcc tctagacggg cggccgctcc1920
ggatccacgg gtaccgatca catatgcctt taattaaaca ctagttctat agtgtcacct1980
aaattccctt tagtgagggt taatggccgt aggccgccag aattgggtcc agacatgata2040
agatacattg atgagtttgg acaaaccaca actagaatgc agtgaaaaaa atgctttatt2100
tgtgaaattt gtgatgctat tgctttattt gtaaccatta taagctgcaa taaacaagtt2160
aacaacaaca attgcattca ttttatgttt caggttcagg gggaggtgtg ggaggttttt2220
tcggactcta ggacctgcgc atgcgcttgg cgtaatcatg gtcatagctg tttcctgttt2280
tccccgtatc cccccaggtg tctgcaggct caaagagcag cgagaagcgt tcagaggaaa2340
gcgatcccgt gccaccttcc ccgtgcccgg gctgtccccg cacgctgccg gctcggggat2400
gcggggggag cgccggaccg gagcggagcc ccgggcggct cgctgctgcc ccctagcggg2460
ggagggacgt aattacatcc ctgggggctt tggggggggg ctgtccctct caccgcggtg2520
gagctccagc ttttgttcga attggggccc cccctcgagg gtatcgatga tatctataac2580
aagaaaatat atatataata agttatcacg taagtagaac atgaaataac aatataatta2640
tcgtatgagt taaatcttaa aagtcacgta aaagataatc atgcgtcatt ttgactcacg2700
cggtcgttat agttcaaaat cagtgacact taccgcattg acaagcacgc ctcacgggag2760
ctccaagcgg cgactgagat gtcctaaatg cacagcgacg gattcgcgct atttagaaag2820
agagagcaat atttcaagaa tgcatgcgtc aattttacgc agactatctt tctagggtta2880
atctagctag ccttaagggc gcctattgcg ttgcgctcac tgcccgcttt ccagtcggga2940
aacctgtcgt gccagctgca ttaatgaatc ggccaacgcg cggggagagg cggtttgcgt3000
attgggcgct cttccgcttc ctcgctcact gactcgctgc gctcggtcgt tcggctgcgg3060
cgagcggtat cagctcactc aaaggcggta atacggttat ccacagaatc aggggataac3120
gcaggaaaga acatgaccaa aatcccttaa cgtgagtttt cgttccactg agcgtcagac3180
cccgtagaaa agatcaaagg atcttcttga gatccttttt ttctgcgcgt aatctgctgc3240
ttgcaaacaa aaaaaccacc gctaccagcg gtggtttgtt tgccggatca agagctacca3300
actctttttc cgaaggtaac tggcttcagc agagcgcaga taccaaatac tgttcttcta3360
gtgtagccgt agttaggcca ccacttcaag aactctgtag caccgcctac atacctcgct3420
ctgctaatcc tgttaccagt ggctgctgcc agtggcgata agtcgtgtct taccgggttg3480
gactcaagac gatagttacc ggataaggcg cagcggtcgg gctgaacggg gggttcgtgc3540
acacagccca gcttggagcg aacgacctac accgaactga gatacctaca gcgtgagcta3600
tgagaaagcg ccacgcttcc cgaagggaga aaggcggaca ggtatccggt aagcggcagg3660
gtcggaacag gagagcgcac gagggagctt ccagggggaa acgcctggta tctttatagt3720
cctgtcgggt ttcgccacct ctgacttgag cgtcgatttt tgtgatgctc gtcagggggg3780
cggagcctat ggaaaaacgc cagcaacgcg gcctttttac ggttcctggc cttttgctgg3840
ccttttgctc acatgagatt atcaaaaagg atcttcacct agatcctttt aaattaaaaa3900
tgaagtttta aatcaatcta aagtatatat gagtaaactt ggtctgacag tcagaagaac3960
tcgtcaagaa ggcgatagaa ggcgatgcgc tgcgaatcgg gagcggcgat accgtaaagc4020
acgaggaagc ggtcagccca ttcgccgcca agctcttcag caatatcacg ggtagccaac4080
gctatgtcct gatagcggtc cgccacaccc agccggccac agtcgatgaa tccagaaaag4140
cggccatttt ccaccatgat attcggcaag caggcatcgc catgggtcac gacgagatcc4200
tcgccgtcgg gcatgctcgc cttgagcctg gcgaacagtt cggctggcgc gagcccctga4260
tgctcttcgt ccagatcatc ctgatcgaca agaccggctt ccatccgagt acgtgctcgc4320
tcgatgcgat gtttcgcttg gtggtcgaat gggcaggtag ccggatcaag cgtatgcagc4380
cgccgcattg catcagccat gatggatact ttctcggcag gagcaaggtg agatgacagg4440
agatcctgcc ccggcacttc gcccaatagc agccagtccc ttcccgcttc agtgacaacg4500
tcgagcacag ctgcgcaagg aacgcccgtc gtggccagcc acgatagccg cgctgcctcg4560
tcttgcagtt cattcagggc accggacagg tcggtcttga caaaaagaac cgggcgcccc4620
tgcgctgaca gccggaacac ggcggcatca gagcagccga ttgtctgttg tgcccagtca4680
tagccgaata gcctctccac ccaagcggcc ggagaacctg cgtgcaatcc atcttgttca4740
atcataatat tattgaagca tttatcaggg ttcgtctcgt cccggtctcc tcccaatgca4800
tgtcaatatt ggccattagc catattattc attggttata tagcataaat caatattggc4860
tattggccat tgcatacgtt gtatctatat cataata 4897
<210>41
<211>90
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>Centyrin
<400>41
Met Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Ile Thr Glu Asp
1 5 1015
Ser Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe
202530
Pro Ile Arg Tyr Ile Glu Thr Leu Ile Trp Gly Glu Ala Ile Trp Leu
354045
Asp Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro
505560
Gly Thr Glu Tyr Ala Val Val Ile Thr Gly Val Lys Gly Gly Arg Phe
65707580
Ser Ser Pro Leu Val Ala Ser Phe Thr Thr
8590
<210>42
<211>334
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>CARTyrin
<400>42
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 1015
His Ala Ala Arg Pro Met Leu Pro Ala Pro Lys Asn Leu Val Val Ser
202530
Arg Ile Thr Glu Asp Ser Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala
354045
Ala Phe Asp Ser Phe Pro Ile Arg Tyr Ile Glu Thr Leu Ile Trp Gly
505560
Glu Ala Ile Trp Leu Asp Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu
65707580
Thr Gly Leu Lys Pro Gly Thr Glu Tyr Ala Val Val Ile Thr Gly Val
859095
Lys Gly Gly Arg Phe Ser Ser Pro Leu Val Ala Ser Phe Thr Thr Thr
100 105 110
Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser
115 120 125
Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly
130 135 140
Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp
145 150 155 160
Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile
165 170 175
Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys
180 185 190
Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys
195 200 205
Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val
210 215 220
Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn
225 230 235 240
Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val
245 250 255
Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg
260 265 270
Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys
275 280 285
Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg
290 295 300
Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys
305 310 315 320
Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
325 330
<210>43
<211>90
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>Centyrin
<400>43
Met Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Ile Thr Glu Asp
1 5 1015
Ser Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe
202530
Pro Ile Arg Tyr Ile Glu Thr Leu Ile Trp Gly Glu Ala Ile Trp Leu
354045
Asp Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro
505560
Gly Thr Glu Tyr Ala Val Val Ile Thr Gly Val Lys Gly Gly Arg Phe
65707580
Ser Ser Pro Leu Val Ala Ser Phe Thr Thr
8590
<210>44
<211>1002
<212>DNA
<213>人工序列(Artificial Sequence)
<220>
<223>CARTyrin
<400>44
atggcactgc cagtcaccgc cctgctgctg cctctggctc tgctgctgca cgcagctaga60
ccaatgctgc ctgcaccaaa gaacctggtg gtgagccgga tcacagagga ctccgccaga 120
ctgtcttgga ccgcccctga cgccgccttc gattcctttc caatccggta catcgagaca 180
ctgatctggg gcgaggccat ctggctggac gtgcccggct ctgagaggag ctacgatctg 240
acaggcctga agcctggcac cgagtatgca gtggtcatca caggagtgaa gggcggcagg 300
ttcagctccc ctctggtggc ctcttttacc acaaccacaa cccctgcccc cagacctccc 360
acacccgccc ctaccatcgc gagtcagccc ctgagtctga gacctgaggc ctgcaggcca 420
gctgcaggag gagctgtgca caccaggggc ctggacttcg cctgcgacat ctacatttgg 480
gcaccactgg ccgggacctg tggagtgctg ctgctgagcc tggtcatcac actgtactgc 540
aagagaggca ggaagaaact gctgtatatt ttcaaacagc ccttcatgcg ccccgtgcag 600
actacccagg aggaagacgg gtgctcctgt cgattccctg aggaagagga aggcgggtgt 660
gagctgcgcg tgaagtttag tcgatcagca gatgccccag cttacaaaca gggacagaac 720
cagctgtata acgagctgaa tctgggccgc cgagaggaat atgacgtgct ggataagcgg 780
agaggacgcg accccgaaat gggaggcaag cccaggcgca aaaaccctca ggaaggcctg 840
tataacgagc tgcagaagga caaaatggca gaagcctatt ctgagatcgg catgaagggg 900
gagcgacgga gaggcaaagg gcacgatggg ctgtaccagg gactgagcac cgccacaaag 960
gacacctatg atgctctgca tatgcaggca ctgcctccaa gg 1002
<210>45
<211>63
<212>DNA
<213>智人(Homo sapiens)
<400>45
atggcactgc cagtcaccgc cctgctgctg cctctggctc tgctgctgca cgcagctaga60
cca63
- 用于治疗癌症的组合物和方法
- 用于治疗癌症的包含大麻二酚和第二治疗剂的组合物
- 用于癌症免疫疗法的CRISPR-CPF1相关方法、组合物和组分
- 用于治疗或预防癌症和肿瘤的麦芽酚铁组合物
- 化学个体、药物组合物及癌症治疗方法
- 用于预防和治疗癌症的药物组合物以及用于预防和治疗癌症的含有该药物组合物的保健食品
- 用于预防和治疗癌症的药物组合物以及用于预防和治疗癌症的含有该药物组合物的保健食品
