用于动物实验的血浆吸附装置
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及医疗器材技术领域,尤其涉及一种用于动物实验的血浆吸附装置。
背景技术
血液透析已有一百多年的发展历史,而血液净化是在血液透析基础上发展而来的一种技术。把患者血液引出体外并通过一种净化装置,除去其中某些致病物质,净化血液,达到治疗疾病的目的,这个过程即为血液净化。免疫吸附属于血液净化的一种,是一种新的治疗技术,主要用于治疗一些传统方法难以治疗的疾病。其原理主要是在载体上固定一定的抗体、抗原或者是某些具有特异性吸附性能的配基,利用配基的吸附性能,将患者血液中的毒蛋白或者其他内源性致病因子选择性或者特异性的清除,进而达到净化血液,缓解病症和治疗疾病的目的。
与血液灌流的全血吸附模式不同,为了治疗效果,免疫吸附多采用血浆吸附。现已有研究者采用血浆吸附模式进行犬、兔子或小型猪的血液灌流实验,但在这类血浆吸附案例中,一般使用动物股静脉建立血液体外循环通路,手术较为复杂且不可重复使用,对动物伤害也较大。同时体外血液循环需要用到专业的血液透析机或血液灌流机,成本较高,且无法在不影响全血循环的情况下提高血浆中有害成分的吸附效果。
有鉴于此,有必要设计一种用于动物实验的血浆吸附装置,以解决上述问题。
发明内容
本发明的目的在于提供一种操作简便且使用成本低,同时能安全有效的进行实验动物血浆吸附治疗,且能在不影响全血循环的情况下实现对吸附柱的清洗和平衡的用于动物实验的血浆吸附装置。
为实现上述发明目的,本发明提供了一种用于动物实验的血浆吸附装置,包括全血循环管路以及与所述全血循环管路通过膜型血浆分离器和第二静脉壶相连的血浆吸附和吸附柱处理管路,所述全血循环管路包括第一管路、与所述第一管路通过膜型血浆分离器连接的第四管路以及与所述第四管路通过第二静脉壶连接的第三管路,所述血浆吸附和吸附柱处理管路包括第二管路以及与所述第二管路连接的第五管路;所述第一管路、第二管路和第三管路上分别设置有第一压力表、第二压力表和第三压力表;所述第二管路上设置有吸附柱,所述第五管路远离第二管路一端连接有配套液袋。
作为本发明的进一步改进,所述第一管路和所述第二管路上还分别设置有第一蠕动泵和第二蠕动泵。
作为本发明的进一步改进,所述第一管路、第二管路和第三管路的管路压差范围为2-10KPa。
作为本发明的进一步改进,血液体外循环通路的建立方法为使用双腔静脉导管行颈静脉置管。
作为本发明的进一步改进,所述第一管路远离所述膜型血浆分离器一端与所述双腔静脉导管的动脉口连接。
作为本发明的进一步改进,所述第一管路上还设置有第一静脉壶,所述第一静脉壶上连接有用于抗凝剂添加的第六管路。
作为本发明的进一步改进,所述吸附柱内填充有以琼脂糖或纤维素为载体的免疫吸附剂,所述吸附柱的罐体容积为80~200ml。
作为本发明的进一步改进,所述动物为血流量≥30ml/min的动物。
作为本发明的进一步改进,所述血浆吸附装置中全血流速为40~100ml/min,血浆流速为8~20ml/min。
作为本发明的进一步改进,全血循环以及血浆吸附和吸附柱处理部分使用的管路为透析型人工肾一次性使用血液回路导管。
本发明的有益效果是:
1.本发明通过将血浆吸附处理过程分为全血循环以及血浆吸附和吸附柱处理两部分,并相应进行全血循环管路以及血浆吸附和吸附柱处理管路设置,一方面,可以在不影响全血循环的情况下实现对吸附柱的清洗和平衡,以保证血浆处理过程中吸附柱对有害成分的吸附效果,另一方面,结合利用第一压力表、第二压力表和第三压力表的设置,进行第一管路、第二管路和第三管路的管路压力监控,并通过第一蠕动泵和第二蠕动泵将三条管路压差控制在一定范围内,避免管路压差导致血压下降及膜型血浆分离器的膜发生破裂,从而使本发明的血浆吸附装置能适用于血流量≥30ml/min的动物的血浆吸附处理。
2.本发明通过对比格犬进行全身麻醉后,使用双腔静脉导管经颈静脉建立血管通路,简化了实验动物血管通路建立的手术步骤,且该血管通路可保留一月左右,能够对同一只实验动物重复进行血浆吸附实验,减轻了血管通路建立手术对实验动物造成的痛苦。同时,整个实验过程只需要蠕动泵即可满足动力供应需求,而不需要使用特定型号的血液透气机或血液灌流机,因此能大幅降低试验成本。另外,使用透析型人工肾一次性使用血液回路导管进行导液,能增大吸附柱的使用规格,即可以连接正常规格的吸附柱进行动物实验,而不需要自制缩小的吸附柱模型来进行实验,从而大大提高了实验结果的准确性和可靠性。
附图说明
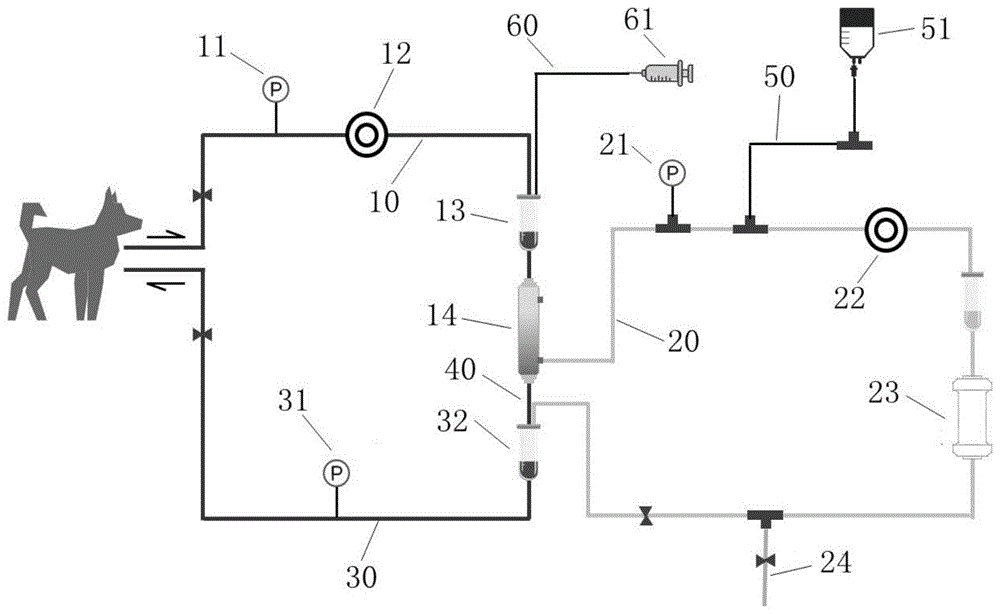
图1为本发明的用于动物实验的血浆吸附装置的结构示意图。
附图标记
10、第一管路;11、第一压力表;12、第一蠕动泵;13、第一静脉壶;14、膜型血浆分离器;20、第二管路;21、第二压力表;22、第二蠕动泵;23、吸附柱;24、废水排放管路;30、第三管路;31、第三压力表;32、第二静脉壶;40、第四管路;50、第五管路;51、配套液袋;60、第六管路;61、抗凝剂。
具体实施方式
为了使本发明的目的、技术方案和优点更加清楚,下面结合附图和具体实施例对本发明进行详细描述。
在此,还需要说明的是,为了避免因不必要的细节而模糊了本发明,在附图中仅仅示出了与本发明的方案密切相关的结构和/或处理步骤,而省略了与本发明关系不大的其他细节。
另外,还需要说明的是,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。
如图1所示,本发明提供了一种用于动物实验的血浆吸附装置,包括全血循环管路以及与全血循环管路通过膜型血浆分离器14和第二静脉壶32相连的血浆吸附和吸附柱处理管路,所述全血循环管路包括第一管路10、与第一管路10通过膜型血浆分离器14连接的第四管路40以及与第四管路40通过第二静脉壶32连接的第三管路30,所述血浆吸附和吸附柱处理管路包括第二管路20以及与第二管路20连接的第五管路50。
具体的,所述动物实验的血液体外循环通路的建立方法为使用双腔静脉导管行颈静脉置管,所述双腔静脉导管为5Fr或7Fr;第一管路10远离膜型血浆分离器14一端与双腔静脉导管的动脉口连接,且第一管路10上还依次设置有第一压力表11、第一蠕动泵12和第一静脉壶13,第一静脉壶13上还连接有用于抗凝剂61添加的第六管路60。抗凝剂61通过第六管路60输送至第一静脉壶13与血液进行混合后参与全血与血浆的循环,起到体外抗凝作用。
具体的,第二管路20一端通过膜型血浆分离器14与第一管路10连接,另一端通过第二静脉壶32与第三管路30连接,第二管路20上按照血浆输送方向设置有第二压力表21、第二蠕动泵22和吸附柱23,其中,第二管路20上在第二压力表21和第二蠕动泵22之间还连接有第五管路50,第五管路50远离第二管路20一端设置有配套液袋51,用于吸附柱23的清洗和平衡;第二管路20上在第二静脉壶32和吸附柱23之间还连接有废水排放管路24,用于吸附柱23清洗和平衡废液的排放。当进行血浆吸附时,全血经第一管路10进入膜型血浆分离器14进行血液有形成分与血浆的分离,其中血液有形成分经第四管路40流入第二静脉壶32,血浆经第二管路20进行吸附后,通过第二静脉壶32与血液有形成分混合,经第三管路30流入动物体内;当需要进行吸附柱23清洗及平衡时,通过阀门调节,全血经过膜型血浆分离器14后,不滤出血浆,而是直接通过第四管路40和第三管路30输回动物体内,同时通过第五管路50将清洗液和平衡液输入第二管路20内,并流入吸附柱23中进行吸附柱23的清洗和平衡,清洁废液则通过废水排放管路24流出,完成吸附柱23清洗及平衡后,调节阀门,继续进行血浆吸附。
具体的,第三管路30上设置有第三压力表31。在实验过程中,通过调节第一蠕动泵12和第二蠕动泵22,使第一管路10、第二管路20和第三管路30的管路压差控制在2-10KPa范围内,避免管路压差导致血压下降及膜型血浆分离器14的膜发生破裂。
具体的,膜型血浆分离器14的膜面积为0.2m
具体的,所述动物为血流量≥30ml/min的动物,在进行血浆吸附之前要进行全身肝素化;实验时,血浆吸附装置中全血流速为40~100ml/min,血浆流速为8~20ml/min。
具体的,全血循环以及血浆吸附和吸附柱处理部分使用的管路为透析型人工肾一次性使用血液回路导管。
下面结合具体的实施例对本发明提供的用于动物实验的血浆吸附装置进行说明。
实施例1
通过本发明的用于动物实验的血浆吸附装置进行比格犬的血浆吸附,具体步骤如下:
1.血浆吸附装置预冲处理
(1)预冲液准备:再生液,含肝素2500IU/500mL的生理盐水3000mL,含肝素12500IU/500ml的生理盐水1000ml,不含肝素的生理盐水。
(2)吸附柱预冲
a.使用再生液以100ml/min的流速对吸附柱进行预冲,再生液用量约为1L。
b.将再生液袋更换为生理盐水,使生理盐水以100ml/min流速对吸附柱进行平衡,生理盐水用量约为1L。
c.将生理盐水更换为含肝素2500IU/500mL的生理盐水,并以100mL/min流速对吸附柱23进行预冲,用量为1500mL;再将含肝素2500IU/500mL的生理盐水更换为含肝素12500IU/500ml的生理盐水,并以50mL/min对吸附柱23进行预冲,用量为500mL,期间使吸附柱23浸泡在含肝素12500IU/500ml的生理盐水中10~20min,使吸附柱23充分抗凝;最后将含肝素12500IU/500ml的生理盐水更换为不含肝素的生理盐水,并以100mL/min流速对吸附柱23进行预冲,排出其中的含肝素的生理盐水,用量为200mL。
(3)膜型血浆分离器预冲
使用含肝素2500IU/500mL的生理盐水以100mL/min流速对膜型血浆分离器14进行预冲,用量为1500mL;再将含肝素2500IU/500mL的生理盐水更换为含肝素12500IU/500ml的生理盐水,并以50mL/min对膜型血浆分离器14进行预冲,用量为500mL,期间使膜型血浆分离器14浸泡在含肝素12500IU/500ml的生理盐水中10~20min,使膜型血浆分离器14充分抗凝;最后将含肝素12500IU/500ml的生理盐水更换为不含肝素的生理盐水,并以100mL/min流速对膜型血浆分离器14进行预冲,排出其中的含肝素的生理盐水,用量为200mL。
2.管路连接
将吸附柱23、膜型血浆分离器14等按照本发明的用于动物实验的血浆吸附装置进行连接。
3.比格犬置管
先使用0.2ml/kg的舒泰50对比格犬进行全身麻醉,再使用双腔静脉导管行浅静脉置管建立血液体外循环通路。
4.使用血浆吸附装置对比格犬进行体外血浆吸附治疗
(1)抗凝:采用肝素抗凝,首剂量0.3mg~0.8mg/kg,治疗前10min静脉注射,治疗期间以每半小时10~15mg持续泵入,治疗结束前30min停止追加。
(2)开启第一蠕动泵12,使全血流速达到50~60ml/min,同时关闭膜型血浆分离器14中的血浆滤出通道,当膜型血浆分离器14和全血循环管路中完全充满血液且循环正常无溶血或破膜等情况发生时,再打开血浆滤出通道;开启第二蠕动泵22,使血浆流速设置不超过全血流速的20%,从而使第一管路10、第二管路20和第三管路30的管路压差控制在2-10KPa范围内,以避免血压下降及膜型血浆分离器14破膜。吸附时间为30min。
(3)回血:吸附结束后,关闭血浆滤出通道,采用生理盐水回血法,用生理盐水以30~40ml/min的速度将吸附柱23和管路中的血浆驱回动物体内,生理盐水消耗体积约200mL。在此过程中,膜型血浆分离器14的血液循环侧持续进行血液循环。
(4)再生平衡
a.再生:通过阀门调节,使全血经过膜型血浆分离器14后,直接通过第四管路40和第三管路30输回动物体内,同时通过阀门调节依次连通第五管路50、第二管路20和废水排放管路24,使再生液通过第五管路50输入第二管路20内,并以100ml/min的流速对吸附柱23进行再生冲洗,再生液用量约为500ml,冲洗5个柱体积后停止,冲洗废液则通过废水排放管路24流出。
b.平衡:将再生液更换为生理盐水,以100ml/min流速对吸附柱23进行平衡,5个柱体积后停止平衡,并将管路调节回血浆吸附模式。
(5)血浆的循环吸附
以步骤(2)-(4)为一个循环,进行循环吸附,循环吸附治疗3次为1个疗程。
(6)治疗结束
将第一管路10与双腔静脉导管的连接端接到生理盐水,然后从双腔静脉导管采血,用于测定血常规、血生化及凝血指标,此时暂停第一蠕动泵12。采血完成后,采用生理盐水回血法或空气回血法回血,吸附治疗结束。
按照比格犬的血浆吸附步骤对6只比格犬进行吸附治疗,治疗频率为每周2次,每只比格犬进行6个疗程的吸附治疗,其中,每只比格犬进行首次置管后可重复使用,无需重复置管。最后一次治疗完成后继续用普通饲料喂养实验动物7天,观察并记录动物的生命体征及有无不良事件,如动物外观、行为活动、精神状态、体温、摄食量、呼吸是否正常等。同时在第一次治疗前和最后一次治疗完成后7天分别采集静脉血,进行血常规、血生化及凝血相关指标检测,血常规检测结果见表1,血生化检测结果见表2,凝血相关指标检测结果见表3。
表1血常规检测结果
/>
备注:*、**分别表示有显著差异和极显著差异。
由表1可知,在治疗完成7天后:红细胞、血红蛋白、红细胞比积、血小板计数、血小板比容分别上升了12.01%、9.24%、12.33%、114.03%、92.86%;中性粒细胞比例降低了44.22%,平均红细胞血红蛋白含量和平均红细胞血红蛋白浓度略有降低。在置管及伤口缝合后,由于伤口包扎的不透气等原因,受试动物伤口处会有轻微发炎的迹象。因此在治疗过程中,会出现白细胞、淋巴细胞、单核细胞等炎症相关血细胞的上升。在治疗结束后7天,炎症消失,炎症相关细胞数量则恢复正常。另外,在治疗结束后及随访期内,受试动物血红蛋白、红细胞和血小板会有所增多,但仍在正常值范围内,推测与体外血液循环所造成的血液损失及治疗过程中的炎症反应有关。
由于治疗引起的血常规指标的变化,均在正常值范围内,且这些变化主要与手术及体外血液循环有关,与受试器械无关,因此,本发明的用于动物实验的血浆吸附装置不会对受试动物造成明显损害。
表2血生化检测结果
备注:*、**分别表示有显著差异和极显著差异。
由表2可知,治疗后7天:总胆固醇、甘油三酯、低密度脂蛋白胆固醇、钾分别上升27.77%、190.00%、98.13%、11.43%;钠和氯略有降低。对于受试动物血脂的变化,推测为以下原因:第一是吸附柱23的琼脂糖微球的非特异性吸附的影响,以及体外血液循环本身造成的损失;第二是肝素不仅有抗凝作用,还具有降血脂的作用;第三是受试动物在进行吸附治疗及采血样时禁食的影响。对于电解质的轻微变化,推测与抗凝、生理盐水的输入有关。
由于治疗引起的血生化指标的变化,与置管手术及非特异性吸附有关,因此,本发明的用于动物实验的血浆吸附装置不会对受试动物造成明显损害。
表3凝血相关指标检测结果
备注:“-”表示原始数值低于或高于仪器检测限,无法统计分析。
在治疗开始前,需要对受试动物注射含肝素钠的生理盐水进行首剂量抗凝,在治疗期间,含肝素钠的生理盐水也需要持续泵入防治凝血。因此治疗前的凝血结果或者低于或高于仪器检测限,或者有较大幅度的改变,都是由于抗凝剂61的输注。在治疗完成7天后,受试动物的凝血指标均恢复至正常水平,对受试动物生理活动无影响。
在最后一次治疗完成后7天内,受试动物生命体征平稳,无明显异常,且无严重不良事件发生,说明本发明的用于动物实验的血浆吸附装置不会对受试动物造成明显损害。
综上所述,本发明公开的用于动物实验的血浆吸附装置,通过将血浆吸附处理过程分为全血循环以及血浆吸附和吸附柱处理两部分,并相应进行全血循环管路以及血浆吸附和吸附柱处理管路设置,一方面,可以在不影响全血循环的情况下实现对吸附柱23的清洗和平衡,以保证血浆处理过程中吸附柱23对有害成分的吸附效果,另一方面,结合利用第一压力表11、第二压力表21和第三压力表31的设置,进行第一管路10、第二管路20和第三管路30的压力监控,并通过第一蠕动泵12和第二蠕动泵22将三条管路压差控制在一定范围内,避免管路压差导致血压下降及膜型血浆分离器14的膜发生破裂,从而使本发明的血浆吸附装置能适用于血流量≥30ml/min的动物的血浆吸附处理。另外,采用本发明的血浆吸附装置进行血浆吸附,手术简单且可重复使用,能大幅度减轻手术对实验动物造成的痛苦,同时体外血液循环不需要使用专业的血液透气机或血液灌流机,试验成本较低。使用本发明的血浆吸附装置对比格犬进行血浆吸附治疗前后,其基本生命体征无明显变化,且治疗前后的血液指标亦无显著变化,说明所述血浆吸附装置不会对受试动物造成明显损害,可安全用于动物的血浆吸附处理。
以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围。
- 一种应用于动物实验的实验动物临时养殖装置
- 一种实验动物房用可再生活性炭吸附装置
