一种CD4+T淋巴细胞的快速检测探针及其应用
文献发布时间:2024-04-18 19:52:40
技术领域
本发明属于生物检测领域,具体涉及一种CD4+ T淋巴细胞的快速检测探针及其应用。
背景技术
系统性免疫监测是评估免疫系统异常的重要工具,同时能实时监测治疗效果。这一手段在感染控制、疫苗开发、器官移植以及免疫疗法等领域具有广泛的应用价值。在系统性免疫监测中,CD4+ T淋巴细胞是评估免疫功能的重要指标,对于恶性肿瘤、自身免疫病、病毒感染、血液肿瘤以及器官移植患者的疾病监测具有重要的作用。特别是在人免疫缺陷病毒(HIV)感染进程中,CD4+ T淋巴细胞的浓度对于评估免疫功能缺陷状态具有非常重要的诊断价值。
然而,传统的免疫监测方法主要依赖于流式细胞术的免疫细胞表型分析,这种方法有许多缺陷。首先,流式细胞术的成本较高,且是单通量检测,这限制了其在大众健康筛查和资源匮乏地区的应用。其次,流式抗体的可扩展性较差,且非特异性结合的风险较高,这影响了免疫监测的敏感性与准确性。
为了解决这些问题,一些学者尝试通过改善仪器的液流装置和光学模块性能,提出了基于微流控的流式细胞术来实现CD4+ T淋巴细胞的自动化检测。然而,这种方法的前处理复杂,设备要求较高,并不适合进行高通量免疫检测。
除此之外,还有学者尝试引入无标记的拉曼流式细胞术来避免对细胞的标记和洗涤过程。然而,由于拉曼散射光与目标分子之间的相互作用力较弱,且受到周围细胞环境产生的背景信号干扰,导致该技术在临床应用中受到限制。
在现代免疫监测中,一种新的策略——杂化链反应(HCR)被视为构建高敏感性、高特异性、智能响应、普适性好的免疫细胞检测探针的有效方法。HCR是一种无酶催化的DNA自组装级联反应,由一对发夹结构的DNA链(Hairpin1,Hairpin2)所构成。当HCR探针处于亚稳定状态时,荧光基团由于与淬灭基团位置相近,会被淬灭基团所淬灭。当Hairpin被外界刺激下解螺旋时,荧光基团与淬灭基团之间的距离恢复而使荧光信号释放。HCR探针可以被设计为一种信号转换开关的检测探针。
然而,尽管HCR可以提高检测的敏感性,但其长时间的检测过程、繁琐的操作以及敏感性不足等问题限制了其在临床上的应用。其中存在两个主要因素:首先,适配体和互补链之间的高解离竞争会限制适配体探针的发夹结构转换动力学。研究表明,适配体探针中适配体功能区域的游离长度和对目标蛋白的亲和力对发卡结构开关的灵敏性有重要影响。当适配体互补链完全封闭适配体功能区域时,适配体探针几乎不会解链。因此,增加探针中适配体功能区域的游离长度和亲和力是提高探针敏感性的关键。然而,在适配体筛选过程中,保留了大量无功能的随机序列,并且缺乏有效的蛋白质-核酸相互作用分析,因此大部分适配体的功能区域仍然未知,这给构建高敏感性的适配体探针带来了困难。
其次,由于溶液中的随机碰撞以及细胞膜和HCR探针之间的电荷排斥力,当触发HCR时,Hairpin1和Hairpin2之间的自组装反应通常较为缓慢,这降低了检测的灵敏度。为了增加局部HCR探针的浓度,研究人员尝试将HCR探针通过共价键固定在金纳米颗粒和氧化石墨烯表面。这种方法可以显著提高局部探针的浓度,从而加快HCR的速度,提高检测的敏感性。然而,由于无法准确控制支架结构上HCR探针的密度、位置和方向,导致无法实现理想的检测信号放大效果。
综上所述,尽管在免疫监测技术方面已经有了许多改进和尝试,但目前开发智能、敏感的检测探针仍是高通量免疫监测的主要任务。
发明内容
本发明的目的在于提供一种CD4+ T淋巴细胞的快速检测探针及其应用。
本发明提供了一种检测CD4+ T淋巴细胞的探针,它由DNA四面体和2条用于检测的DNA单链组成;所述2条用于检测的DNA单链分别与DNA四面体的两条不同单链通过粘性末端互补配对连接;
所述DNA四面体由4条单链DNA经碱基互补配对形成;
所述用于检测的DNA单链其中一条带有荧光基团和荧光淬灭基团;所述2条检测DNA单链的序列分别如SEQ ID NO.5和SEQ ID NO.6所示。
进一步地,所述荧光基团为FAM、Cy5、Cy3、ROX、TAMRA中的至少一种,所述淬灭基团为BHQ1、BHQ2、Dabcyl中的至少一种;优选地,所述荧光基团为Cy5,所述淬灭基团为BHQ2。
进一步地,所述DNA四面体是4条单链DNA的序列分别选自SEQ ID NO.1~4的所示序列。
进一步地,DNA四面体上的2条单链连接的粘性末端的序列分别如SEQ ID NO.7和SEQ ID NO.8所示;2条用于检测的DNA单链连接的粘性末端的序列分别如SEQ ID NO.9和SEQ ID NO.10所示。
进一步地,它由如下方法制备而成:
(1)取DNA四面体的四条单链DNA,孵育得到DNA四面体;
(2)将2条用检测的DNA单链,与DNA四面体混合孵育,即得。
进一步地,制备方法如下:
(1)取DNA四面体的四条单链DNA,孵育得到DNA四面体;
(2)将2条用检测的DNA单链,与DNA四面体混合孵育,即得。
本发明还提供了一种上述的探针用于制备检测CD4+ T淋巴细胞浓度的试剂的用途;优选地,所述试剂是检测血液中CD4+ T淋巴细胞浓度的试剂。
本发明还提供了一种检测CD4+ T淋巴细胞的检测试剂盒,它包括以上述的探针。
进一步地,它还包括样品处理试剂和质控试剂。
本发明还提供了一种上述的探针或上述的检测试剂盒在制备检测人免疫缺陷病毒感染性疾病的试剂中的用途。
综上,本发明首次提出通过适配体筛选后优化合并DTF结构化HCR探针的策略,成功合成了CD4+ T淋巴细胞探针Hairpin-DTF。本发明CD4+ T细胞检测探针Hairpin-DTF相较于流式细胞术单细胞液流检测,一方面实现高通量样本检测,极大地缩短了检测的时间,一管样本可以重复多次测量,减少了操作误差;另一方面本发明缩减了操作流程,在样本红细胞裂解后,加入探针孵育30分钟,然后可以直接检测荧光强度,通过使用标准线性方程计算出CD4+ T淋巴细胞的浓度,整个过程无需洗涤。
同时,本发明探针能够准确检测血液中的CD4+T淋巴细胞,其特异性强、敏感性高,可以用于准确筛查人免疫缺陷病毒感染性疾病,也可以用途人免疫缺陷病毒感染性疾病的免疫缺陷分级,缩短了检测时间,降低了成本和操作难度,适用于人免疫缺陷病毒感染性疾病的早期筛查、病程监控以及偏远地区检测的需求,具有很好的应用前景。
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
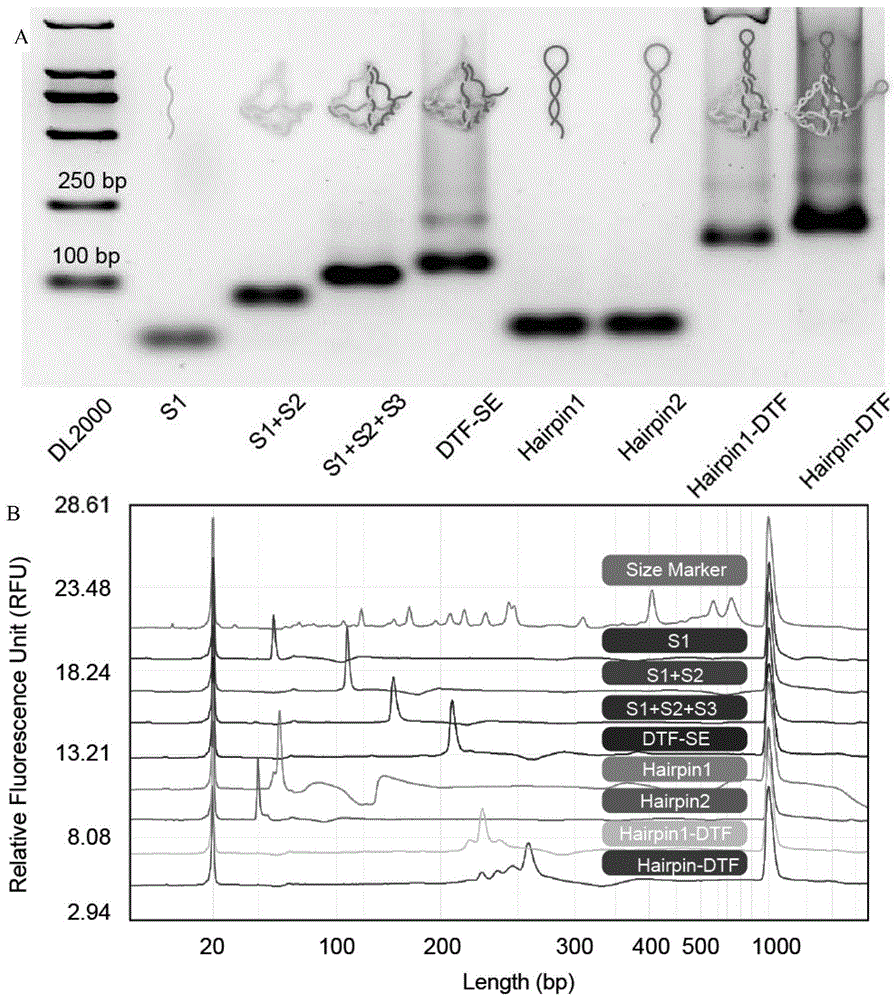
图1为Hairpin-DTF的合成图以及各物质的毛细电泳图。
图2为本发明探针荧光强度与细胞浓度的线性方程图。
图3为目标细胞的平均荧光强度图。
图4为本发明特异性检测结果图。
图5为本发明Hairpin-DTF在HIV临床样本准确性验证结果图。
图6为本发明Hairpin-DTF在HIV免疫缺陷分级的准确性结果图。
具体实施方式
本发明所用原料与设备均为已知产品,通过购买市售产品所得。
实施例1、制备本发明检测探针
一、制备方法
1、通过蛋白-核酸分子对接,设计适配体的功能区域,设计带有3’粘性末端(sticky end,SE)的Hairpin1-SE和Hairpin2-SE的序列(序列如表1所示)。
2、设计两个顶点带有粘性末端的DNA四面体框架核酸(DNA tetrahedralframework,DTF)的序列,包括S1-SE、S2-SE、S3、S4(如表1所示)。
3、合成Hairpin1-SE和Hairpin2-SE,并在Hairpin1-SE的茎段尾端的相对邻的dT碱基上化学共价相连上荧光基团Cy5、淬灭基团BHQ2(如表1所示)。
4、将四条DNA单链S1-SE、S2-SE、S3、S4加入无酶水溶解,并通过Nanodrop(Thermofisher Scientific)定量稀释至100uM。分别取2μL的S1-SE、S2-SE、S3、S4混合,并加入92μL的TM buffer(10mM Tris-HCl,10mM MgCl2),在热循环仪(ThermofisherScientific)中,通过95℃高温变性、4℃退火,合成具有SE的DTF(DTF-sticky end,DTF-SE)。
5、将合成后的Hairpin1-SE和Hairpin2-SE加入无酶水溶解,并通过Nanodrop(Thermofisher Scientific)定量稀释至10uM,在热循环仪中,经过95℃高温变性、4℃退火。
6、分别将16μL Hairpin1-SE和Hairpin2-SE加入100μL DTF-SE中,在25℃孵育30min,合成Hairpin-DTF。
7、将初步合成后的Hairpin-DTF通过液相色谱仪(high performance liquidchromatography,HPLC,固定相:Phenomenex BioSec-SEC-S2000,300*7.8mm;液流相:30mMTris-HCl,450mM NaCl,pH=7.4)进行纯化,并通过millipore30KDa的超滤管进行浓缩,得到1.2uM的Hairpin-DTF。
表1本发明相关序列
将前述序列分别编号如下:
SEQ ID NO.1(表1中S1):
ATTTATCACCCGCCATAGTAGACGTATCACCAGGCAGTTGAGACGAACATTCCTAAGTCTGAA
SEQ ID NO.2(表1中S2):
ACATGCGAGGGTCCAATACCGACGATTACAGCTTGCTACACGATTCAGACTTAGGAATGTTCG
SEQ ID NO.3(表1中S3):
ACTACTATGGCGGGTGATAAAACGTGTAGCAAGCTGTAATCGACGGGAAGAGCATGCCCATCC
SEQ ID NO.4(表1中S4):
ACGGTATTGGACCCTCGCATGACTCAACTGCCTGGTGATACGAGGATGGGCATGCTCTTCCCG
SEQ ID NO.5(表1中Hairpin1):
CAGCTTCCTTGAGCCTTACTGAAAATACTACCCAGTCATATATAGGGTAGTATTTTCAGTA
SEQ ID NO.6(表1中Hairpin2):
GGGTAGTATTTTCAGTCAGGCTCAAGGTACTGAAAATACTACCATATATATGACT
SEQ ID NO.7(表1中与S1相连的粘性末端):
tt tgtggtggtgagt
SEQ ID NO.8(表1中与S2相连的粘性末端):
tt gtgtggtgtgaag
SEQ ID NO.9(表1中与Hairpin1相连的粘性末端):
tt actcaccaccaca
SEQ ID NO.10(表1中与Hairpin2相连的粘性末端):
tt cttcacaccacac
二、检测表征
取合成后的Hairpin-DTF,通过琼脂糖凝胶电泳、毛细电泳表征表征材料的物理性质。
琼脂糖凝胶电泳、毛细电泳表征表征分别如图1A和图1B所示,从这两张图可以看出本发明成功合成DTF以及Hairpin-DTF。
实施例2、采用本发明探针检测CD4+ T淋巴细胞的方法
1、检测步骤
(1)质控样品制备:准备含有不同浓度(100/μL、200/μL、400/μL、600/μL、800/μL、1000/μL)的CD4+ T淋巴细胞的质控人血液样本immuno-trol cells(Beckman CoμLter),作为质控样品;
(2)待检样品制备:取待检验的临床样本混匀后,吸取50μL血液,加入到黑色96孔板中,并加入50μL红细胞裂解液,混匀后静置10min,得待检样品;
(3)分别在质控样品和待检样品中,加入20μL实施例1制备Hairpin-DTF(浓度为1.2uM),混匀后在25℃恒温摇床上静置30min;
(4)用酶标仪(Varioskan,Thermofisher scientific)测量荧光强度(激发光:640nm,发射光:670nm,激发带宽:12nm)。每管样本重复5次测量,统计平均值及标准差。
(5)以质控样品的检测结果分析CD4+ T淋巴细胞浓度-平均荧光的强度的线性回归,得到标准线性方程;根据标准线性方程,计算待测样本的CD4+T淋巴细胞浓度。
实施例3采用本发明探针检测CD4+ T淋巴细胞的方法
1、检测步骤
(1)待检样品制备:取待检验的临床样本混匀后,吸取50μL血液,加入到黑色96孔板中,并加入50μL红细胞裂解液,混匀后静置10min,得待检样品;
(2)在待检样品中,加入20μL实施例1制备Hairpin-DTF(浓度为1.2uM),混匀后在25℃恒温摇床上静置30min;
(3)用酶标仪(Varioskan,Thermofisher scientific)测量荧光强度(激发光:640nm,发射光:670nm,激发带宽:12nm)。每管样本重复5次测量,统计平均值及标准差。
(4)根据标准线性方程:y=0.347x+1.065,相关系数为0.965,Hairpin-DTF探针检测极限为32/100μL,计算待测样本的CD4+ T淋巴细胞浓度。
取实施例1制备的Hairpin-DTF,通过如下实验例证明本发明的有益效果:
实验例1、本发明探针敏感性验证
1、线性方程
为了验证Hairpin-DTF的敏感性,将从人血样本中分选出来的CD4+ T淋巴细胞,用PBS梯度稀释到终浓度为1000/μL、750/μL、500/μL、250/μL、100/μL、50/μL的细胞悬液。吸取100μL细胞悬液,加入到黑色96孔板中,分别加入20μL Hairpin-DTF,混匀后在25℃恒温摇床上震荡30min。之后,用酶标仪(Varioskan,Thermofisher scientific)测量荧光强度(激发光:640nm,发射光:670nm,激发带宽:12nm)。每管样本重复5次测量,统计平均值。
分析荧光强度与细胞浓度的线性相关性,发现相关系数R为0.965,线性相关性强,其线性方程为:y=0.347x+1.065。根据检测极限公式,计算出Hairpin-DTF探针检测极限为32/100μL。(图2)
2、最佳孵育时间
将从人血样本中分选出来的CD4+ T淋巴细胞,用PBS梯度稀释到终浓度为1000/μL,吸取100μL细胞悬液到流式管中,加入20μL Hairpin-DTF,混匀后在25℃恒温摇床上分别震荡0、10、20、30、40、50、60min。震荡后加入PBS,离心并洗涤细胞两次。最后加入200μLPBS重悬细胞沉淀,震荡后通过流式细胞仪(CytoFLEX,Beckman Coulter)检测细胞荧光强度,每个时间段设置三次重复测量。通过统计目标细胞的平均荧光强度(mean fluorescenceintensity,MFI),发现在前30min,MFI逐渐递增,而达到30min后,MFI进入平台期,表示Hairpin-DTF对细胞膜CD4蛋白的检测在30min内达到饱和状态。
实验结果表明,本发明Hairpin-DTF检测细胞膜CD4蛋白的分析荧光强度与细胞浓度的线性相关性性强,且最佳孵育时间为30min,(图3)其线性方程为:y=0.347x+1.065,相关系数R为0.965。Hairpin-DTF探针检测极限为32/100μL。
实验例2、本发明探针特异性检测
将细胞膜表面表达CD4蛋白的细胞,包括HuT-78细胞,U937细胞,以及细胞膜表面不表达CD4蛋白的细胞,包括HL-60细胞,A549细胞,用PBS洗涤两次,将浓度稀释为1000/μL、750/μL、500/μL、250/μL、100/μL、50/μL、0/μL的细胞悬液。
将上述细胞的各个浓度的细胞悬液吸取100μL,加入到黑色96孔板中,然后加入20μL Hairpin-DTF,混匀后在25℃恒温摇床上震荡30min。之后,用酶标仪(Varioskan,Thermofisher scientific)测量荧光强度(激发光:640nm,发射光:670nm,激发带宽:12nm)。每管样本重复5次测量,统计平均值。
实验结果如图4,分析荧光强度发现,HuT-78细胞,U937细胞的荧光强度会随着细胞浓度增加而递增,而HL-60细胞,A549细胞几乎不能检测出荧光。
实验结果表明,本发明针对细胞膜表面表达CD4蛋白的细胞特异性优良。
实验例3、本发明探针准确性验证
1、本发明探针临床样本准确性验证
为了评价Hairpin-DTF对临床样本的检测准确性,从四川大学华西医院实验医学科收集了18管来自不同患者的血液样本。同时,通过流式细胞术以及Hairpin-DTF探针检测血液中的CD4+T淋巴细胞的浓度。使用流式细胞仪检测前进行质控分析。
将待检验的临床样本混匀后,吸取50μL血液,加入到黑色96孔板中,并加入50μL红细胞裂解液,混匀后静置10min,加入20μL Hairpin-DTF,混匀后在25℃恒温摇床上静置30min。之后,用酶标仪(Varioskan,Thermofisher scientific)测量荧光强度(激发光:640nm,发射光:670nm,激发带宽:12nm)。每管样本重复5次测量,统计平均值。根据质控人血液样本的标准线性方程,计算待测样本的CD4+ T淋巴细胞浓度。
将流式细胞术以及Hairpin-DTF探针检测的结果进行一致性分析,根据Bland-Altman检测发现,所有的差异点均在95%置信区间以内,平均偏差为23.63,证明具有良好的一致性。(图5)
实验结果表明,本发明Hairpin-DTF探针的检测临床样本的准确性与流式细胞术相当,具有重要的应用价值和市场前景。
2、本发明探针HIV免疫缺陷分级的准确性验证
为了评价Hairpin-DTF在HIV免疫缺陷分级的准确性,从四川大学华西医院实验医学科收集确诊的不同免疫缺陷分级(正常、轻度、中度、重度)的HIV患者的人血样本各20例。
将待检验的临床样本混匀后,吸取50μL血液,加入到黑色96孔板中,并加入50μL红细胞裂解液,混匀后静置10min,加入20μL Hairpin-DTF,混匀后在25℃恒温摇床上静置30min。之后,用酶标仪(Varioskan,Thermofisher scientific)测量荧光强度(激发光:640nm,发射光:670nm,激发带宽:12nm)。每管样本重复5次测量,统计平均值。
根据质控人血液样本的标准线性方程,计算待测样本的CD4+ T淋巴细胞浓度,进而判断免疫缺陷分级(正常:>500/μL;轻度:350~500/μL;中度:200~350/μL;重度:<200/μL)。
根据计算结果,对比了临床诊断结果与Hairpin-DTF检测结果,进行了ROC曲线分析。图6A为重度与中度ROC曲线下面积0.9887,图6B为中度与轻度ROC曲线下面积0.9725,图6C为轻度与正常ROC曲线下面积1。
实验结果表明,本发明Hairpin-DTF探针能够准确检测血液中的CD4+T淋巴细胞浓度,不仅能够准确筛查HIV免疫缺陷疾病,还能够用准确HIV免疫缺陷分级。
综上,本发明首次提出通过适配体筛选后优化合并DTF结构化HCR探针的策略,成功合成了CD4+ T淋巴细胞探针Hairpin-DTF。本发明CD4+ T细胞检测探针Hairpin-DTF相较于流式细胞术单细胞液流检测,一方面实现高通量样本检测,极大地缩短了检测的时间,一管样本可以重复多次测量,减少了操作误差;另一方面本发明缩减了操作流程,在样本红细胞裂解后,加入探针孵育30分钟,然后可以直接检测荧光强度,通过使用标准线性方程计算出CD4+ T淋巴细胞的浓度,整个过程无需洗涤。
同时,本发明探针能够准确检测血液中的CD4+T淋巴细胞,其特异性强、敏感性高,可以用于准确筛查人免疫缺陷病毒感染性疾病,也可以用途人免疫缺陷病毒感染性疾病的免疫缺陷分级,缩短了检测时间,降低了成本和操作难度,适用于人免疫缺陷病毒感染性疾病的早期筛查、病程监控以及偏远地区检测的需求,具有很好的应用前景。
- 一种磷酸钒钠/多功能碳复合材料及其制备方法和作为电极材料的应用
- 一种钛硅碳-碳复合超级电容器电极材料及制备方法
- 一种限域合成二硫化钨@C复合电极材料的方法
- 一种钴原子锚定在碳纳米纤维上的钴单原子催化剂及其制备方法和应用
- 一种利用含碳生物质壳制备的硬碳前驱体、硬碳/石墨复合材料及其制备方法和应用
- 一种单原子限域碳材料复合电极及其制备方法和应用
- 一种孔限域锌单原子掺杂的多孔碳材料及其制备方法和作为锂离子电容器正极材料的应用
