一种人血清多肽AGDMP1及其在改善胰岛素抵抗中的应用
文献发布时间:2024-04-18 19:58:21
技术领域
本发明涉及代谢、糖尿病及肥胖治疗领域,具体地说是涉及一种人血清多肽AGDMP1及其在改善胰岛素抵抗中的应用。
背景技术
妊娠期糖尿病(Gestational diabetes mellitus,GDM)是指孕期首次发生或发现的糖代谢异常,是严重的妊娠期并发症之一。最新统计,GDM的发病率为16.7%,并呈急剧上升趋势。GDM不仅近期易引发糖尿病酮症酸中毒、产后出血、巨大儿、肩难产、新生儿呼吸窘迫综合征等并发症,而且母儿远期患2型糖尿病、肥胖、代谢综合征的风险大大增加,导致肥胖和糖尿病的恶性代际循环。目前GDM的治疗主要依靠胰岛素,但胰岛素的皮下注射剂型仍然使患者依从性较差,而且因胰岛素剂量导致的安全问题仍屡有发生。所以探索GDM更加天然安全有效简便的防治药物具有重要的临床意义。目前已知,糖尿病主要与遗传、免疫以及生活方式等因素相关,胰岛素抵抗是2型糖尿病发生的病理生理基础,同样也是GDM发病的根源。研究证实,孕前超重或肥胖的孕妇发生GDM的风险是正常孕妇的2.5-8倍,而中心性肥胖可通过增加胰岛素抵抗而增加GDM的风险。另外,孕期肥胖导致体内脂肪含量的增多也会大大增加产妇发生胰岛素抵抗的概率。所以从改善脂肪组织胰岛素抵抗切入,探讨其对脂肪胰岛素抵抗的改善作用,有可能找到妊娠期胰岛素抵抗防治的新线索。
随着质谱技术的发展,多肽组学极大拓宽了研究视野。多肽是一类由3-50个氨基酸残基组成的生物活性物质,具有分子量小、容易合成、高效低毒等特点,在多个领域的药物研发中受到重视。另外多肽,传统观念认为只是蛋白降解的产物,但现在发现,它们能够参与脂肪及葡萄糖代谢的调控。例如EPO蛋白断裂来源肽可改善小鼠高脂喂养导致的肥胖和胰岛素抵抗。白色脂肪组织分泌的多肽激素,经血液循环作用于肝脏可以促进葡萄糖的释放。目前利拉鲁肽等GLP-1类似物在糖尿病治疗中的也已经广泛应用。因此,研发出一种多肽可以通过改善GDM胰岛素抵抗来改善预后,可以为GDM的防治提供新手段。
发明内容
本发明的目的是提供一种人孕中期血清多肽AGDMP1。
本发明的另一目的是提供该多肽的应用。
本发明的目的可通过以下技术方案实现:
一种多肽AGDMP1,具有SEQ ID NO.1所示氨基酸序列。
作为本发明的一种优选,所述的多肽为在SEQ ID NO.1所示序列的羧基端连接了常见的穿模序列。
作为本发明的进一步优选,所述的多肽选自以下任意一条多肽:
Ac-TGPSVVGSGTTRPL-NH2(SEQ ID NO.1)
Ac-GRKKRRQRRRPPQQ-TGPSVVGSGTTRPL-NH2(SEQ ID NO.2)
Ac-GRKKRRQRRRPPQ-TGPSVVGSGTTRPL-NH2(SEQ ID NO.3)
Ac-CGRKKRRQRRRPPQ-TGPSVVGSGTTRPL-NH2(SEQ ID NO.4)
Ac-YGRKKRRQRRR-TGPSVVGSGTTRPL-NH2(SEQ ID NO.5)
Ac-RRRRRRRRR-TGPSVVGSGTTRPL-NH2(SEQ ID NO.6)
Ac-KFFKFFKFFK-TGPSVVGSGTTRPL-NH2(SEQ ID NO.7)
Ac-GRRRRRRRRRPPQ-TGPSVVGSGTTRPL-NH2(SEQ ID NO.8)。
本发明所述多肽的获得可按照氨基酸序列通过固相合成方法获得;或者通过宿主微生物或细胞内克隆并表达携带编码所述多肽之一的核苷酸序列的DNA片段,通过现有的重组DNA技术制备获得。所使用的表达载体和宿主细胞均为重组技术为公众所知的。表达载体例如pET载体、pGEX载体;宿主细胞例如大肠杆菌(Ecoli),放线菌(Actinomycetes),芽孢杠菌(Bacillus),链霉菌(Streptomyces),本发明所述的多肽可用常规的酶切方法将其从宿主细胞中分离,也可以通过常规的液相色谱法进行分离和纯化,上述的分离纯化方法都是本领域技术人员公知的技术。本发明多肽的合成与分离纯化可委托商业公司合成。
本发明所述的多肽在制备改善肥胖、II型糖尿病或妊娠期糖尿病患者的胰岛素抵抗的药物中应用。
本发明所述的多肽在制备改善肥胖、II型糖尿病或妊娠期糖尿病患者糖耐量异常或血糖水平的药物中应用。
本发明所述的多肽在制备减少减少肥胖、II型糖尿病、妊娠期肥胖孕妇、妊娠期糖尿病孕妇内脏脂肪的蓄积药物中的应用。
本发明所述的多肽在制备降低肥胖、II型糖尿病或妊娠期糖尿病患者血脂的药物中的应用。
有益效果:
人孕中期血清多肽AGDMP1,为Mucin-19来源肽,由14个氨基酸组成。进一步查阅Pubmed、Google scholar等数据库,均未发现相关报道。生物信息学分析及实验结果是:①AGDMP1来源于Mucin-19母蛋白2678-2691位氨基酸,②ProtParam在线分析发现它的理论分子量(Mw)1.33KDa、等电点(pI)9.41,属于小分子肽;不稳定系数18.61,属于稳定型多肽;脂肪系数(Aliphatic index)69.29、亲水性平均系数(GRAVY)-0.029,呈现疏水亲脂性。③将AGDMP1加到成熟的脂肪细胞中,发现可以改善成熟脂肪细胞的胰岛素信号通路的敏感性,也能提高成熟脂肪细胞的糖摄取。④小动物活体成像实验示:AGDMP1在体注射可以进入脂肪组织发挥作用。⑤GDM小鼠动物模型中孕期腹腔注射10mg/kg的AGDMP1可以明显改善孕鼠的胰岛素抵抗,减少孕鼠的内脏脂肪的蓄积,改善血糖。因此,AGDMP1可改善肥胖、II型糖尿病及妊娠期糖尿病患者的胰岛素抵抗,改善炎症状态,从而改善患者代谢紊乱;AGDMP1也可改善糖耐量异常及糖尿病患者的血糖水平,从而改善预后。
附图说明
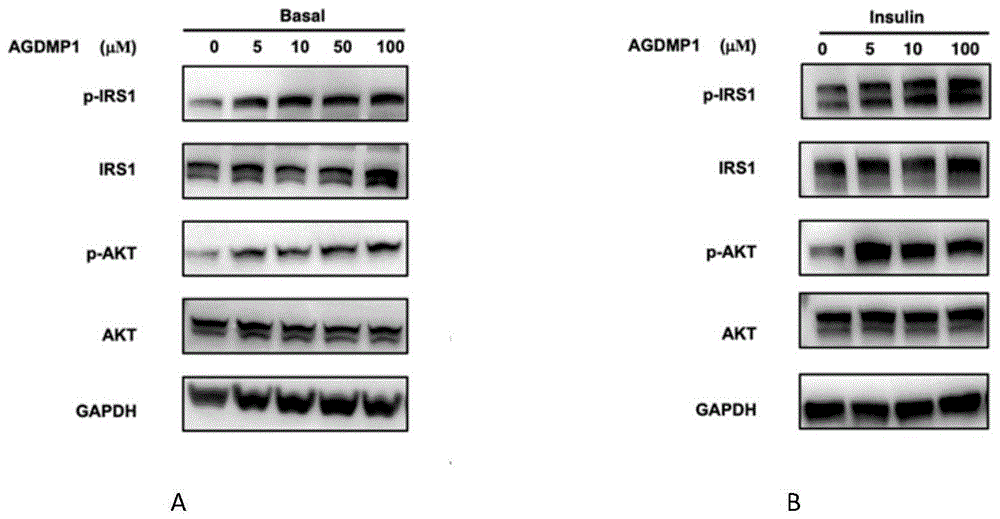
图1.成熟脂肪细胞中p-AKT、AKT、P-IRS-1、IRS-1的蛋白表达。
A为基础状态的成熟脂肪细胞Western Blot结果。
B为胰岛素刺激状态的成熟脂肪细胞Western Blot结果。
图2.成熟脂肪细胞中基础、胰岛素刺激、地塞米松(DXM)胰岛素抵抗状态下糖摄取的情况。
图3.AGDMP1在改善GDM模型小鼠胰岛素抵抗中的作用
A、B分别为GDM及GDM+AGDMP1组小鼠的基本体重和血糖特征;
C、D分别为GDM及GDM+AGDMP1组小鼠于G18.5天的空腹血糖及空腹胰岛素水平的差异;
E为GDM及GDM+AGDMP1组小鼠胰岛素注射后的血糖值及曲线下面积;
F、H分别为GDM及GDM+AGDMP1组小鼠皮下脂肪、内脏脂肪、棕色脂肪的表型;
G为GDM及GDM+AGDMP1组小鼠G18.5天血清甘油三酯、胆固醇、低密度脂蛋白、高密度脂蛋白的变化;
I为GDM及GDM+AGDMP1组I小鼠的内脏脂肪的AKT、p-AKT及GLUT4的蛋白水平的变化。
图4.AGDMP1进入全身组织并蓄积于内脏脂肪组织的表现
A为活体成像腹腔注射AGDMP1后整体分布特征;
B、C分别为腹腔注射AGDMP1后分布于各个组织的特征,C为腹腔注射AGDMP1后分布于各个组织的荧光强度值及对比。
具体实施方式
一、实验材料与方法
1.1细胞实验的材料与试剂
1.1.1人内脏脂肪细胞以原代分离的GDM患者剖宫产术中网膜脂肪细胞(申请伦理)为研究对象。选取GDM剖宫产手术患者,排除合并有子痫前期等并发症者,术中取网膜组织约5g,迅速4℃保存于DMEM高糖培养基中,超净台下漂洗后剪碎脂肪组织,用I型胶原酶消化处理,70μM的过滤器过滤,1000rpm室温下离心10min后获得的细胞沉淀即为原代脂肪细胞,接种于6孔板,用PAM前脂肪细胞生长培养基培养。
1.1.2主要试剂PAM培养基(美国Sciencell),地塞米松(Sigma),罗格列酮(Sigma),胰岛素(Sigma),异丁基甲基黄嘌呤(Sigma)
1.1.3主要试剂配置
AGDMP1的配置
以本实验实施例1中固相合成获得的多肽AGDMP1为例。取10mg多肽,用细胞培养用的PBS稀释成10mmol/L,-20℃储存备用。
胰岛素的配置:
25mg胰岛素溶于25ml0.01N HCl,正压抽滤,分装成1ml/管,封口胶封口,浓度为1mg/ml,-20冻存。
0.01N HCl配置:
25μl浓盐酸加入到50ml去离子水中。
2.1动物实验的材料与试剂
2.1.1实验动物6-8周C57BL/6小鼠来自南京医科大学动物中心生产部,实验动物饲养于南京医科大学实验动物中心独立换气系统(Individually Ventilated Cages,IVC)动物房。IVC动物房恒定光照每日12hrs(08:00~20:00),温度21~25℃,相对湿度30~70%,自由饮水和标准动物饲料喂养。本研究已通过南京医科大学动物伦理委员会审查和批准。
2.1.2主要试剂D12492高脂饲料(美国Research Diets);胰岛素检测试剂盒(Millipore);甘油三酯测定试剂盒(雷杜);总胆固醇测定试剂盒(雷杜);高密度脂蛋白测定试剂盒(雷杜);低密度脂蛋白测定试剂盒(雷杜);血糖测定仪及试纸(稳豪);链脲佐菌素(sigma);PBS(gibco);胰岛素(诺和灵。)
2.2主要试剂配置
2.2.1AGDMP1的配置
以本实验实施例1中固相合成获得的多肽AGDMP1为例。取10mg多肽,用细胞培养用的PBS稀释成1mg/kg,-20℃储存备用。
2.2.2胰岛素的配置
将诺和灵胰岛素用生理盐水稀释成0.5U/ml,即10ml生理盐水中加入50ul胰岛素原液。
2.2.3柠檬酸/枸橼酸钠缓冲液的配置
A液:枸橼酸21.01g加水定容至1000ml;B液:枸橼酸钠,29.41g加水定容至1000ml;使用时:A液9ml,B液41ml,加水至500ml,即可配成工作液。
实施例1
于孕中期16-20周分别收集外周血的血浆,排除染色体及基因等异常的样本,根据妊娠结局,分成GDM组和对照组,将临床样本进行质谱分析,建立多肽谱系。通过生物信息学分析,筛选出一系列新型多肽分子,其功能上可能涉及转录调节、生物合成、脂肪酸代谢进程、胰岛素信号通路等有关。而后利用原代内脏脂肪细胞离体实验,筛选出一条可以改善成熟脂肪细胞胰岛素敏感性的多肽,同时,这条多肽也可以改善GDM小鼠的胰岛素抵抗,该多肽序列
为Ac-GRKKRRQRRRPPQQTGPSVVGSGTTRPL-NH2。为了使该多肽更好的进入细胞膜,发挥功能,在羧基端加入穿模肽,序列为:
Ac-GRKKRRQRRRPPQQ-TGPSVVGSGTTRPL-NH2(SEQ ID NO.2),委托上海科肽生物科技有限公司通过固相法合成。以下实施例中使用的多肽AGDMP1序列均如SEQ ID NO.2所示。
实施例2多肽AGDMP1提高成熟脂肪细胞的胰岛素敏感性
1.实验方法
1.1细胞培养
将原代提取的内脏脂肪细胞传代扩增后用PAM(Preadipocyte Medium)生长培养基培养,为诱导前脂肪细胞分化为成熟脂肪细胞,原代内脏脂肪细胞在生长培养基中生长至100%汇合,并继续培养2天。其后,细胞在分化诱导液中培养4天,分化诱导液含有1μmol/L地塞米松、860nM胰岛素,0.5mmol/L异丁基甲基黄嘌呤(3-Isobutyl-1-methylxanthine,IBMX)、40nM/L罗格列酮以及5%FBS(Fetal Bovine Serum,FBS)的DMFM/F12,然后,细胞在含有50nM/L胰岛素的DMFM/F12再培养2天。最后在DMFM/F12中再维持2天,此时即可获得成熟的内脏脂肪细胞。所有细胞保持再含5%和95%空气加湿的培养箱中,培养温度为37℃。
1.2基础状态与胰岛素刺激处理
对于基础状态处理的成熟脂肪细胞,细胞用温热的磷酸盐缓冲盐水(PhosphateBuffer Saline,PBS)洗涤两次,置于无血清无胰岛素的DMFM/F12培养基中8h,加入化学合成AGDMP1,设置不同浓度加入到成熟脂肪细胞的培养上清中培养24h。
对于胰岛素处理,细胞用温热的磷酸盐缓冲盐水(Phosphate Buffer Saline,PBS)洗涤两次,然后置于无血清无胰岛素的DMFM/F12培养基中8h。加入化学合成AGDMP1,设置不同浓度加入到成熟脂肪细胞的培养上清中培养24h后进行胰岛素刺激处理。胰岛素刺激的条件为:胰岛素100nM,作用时间10min。
1.3 2-脱氧葡萄糖(2-deoxyglucose,2-DG)摄取
按照文献方法测定葡萄糖摄取。简而言之,成熟脂肪细胞用无血清培养基培养24h,用洗涤缓冲液(含20mmol/L HEPES,pH 7.4,140mmol/L NaCl5 mmoUL KCl,2.5mmol/LMgs04,1mmol/L CaCl)洗涤细胞,然后细胞脬育在1mL洗涤缓冲液中30min。再用100nmo1/L胰岛素刺激30分钟后,添加0.5μCi/ml 2-脱氧-D-2-[3H]葡萄糖(HTA Co.Lta,北京,中国〉和10μmol/L 2-脱氧葡萄糖(2-DG)。允许细胞在37℃下摄取2-DG 10min。随后,加入2mL含50mmol/L葡萄糖的PBS终止葡萄糖摄取。1mL洗涤缓冲液洗涤细胞两次,然后用0.5mL的0.1mol/L NaOH溶解细胞。
1.4Western Blot
Western blot被用于测定蛋白或磷酸化蛋白的表达,具体操作方法按既往研究进行。简而言之,细胞在裂解缓冲液中裂解,裂解缓冲液为RIPA(碧云天,强碱性)。细胞裂解物在冰上孵育30min,然后以12000g、4℃离心30min。将上清液等体积4×SDS-PAGE上样缓沖液混合,然后在95℃加热10min。使用SDS-PAGE凝胶分离蛋白质,电转移到硝酸纤维素膜上,并用特异性抗体检测蛋白表达。木研究中使用的所有抗体,包括GAPDH、AKT、P-AKT、IRS-1、P-IRS-1等,均来源于Cell Signal Technoloev公司。一抗使用的条件为:1:1000稀释,4℃孵育过夜:二抗使用的条件为:1:5000稀释,常温1-2h。
1.5GDM小鼠模型的构建
高脂饮食结合小剂量STZ诱导的GDM小鼠模型建立:借鉴国内外构建GDM小鼠模型的成熟经验,以6-8周C57BL/6小鼠为研究对象,共12只,合笼前4周前开始给予高脂饲料喂养,将雌鼠与雄鼠合笼,次晨检查阴道口及垫料,观察是否有阴栓纯在,发现阴栓确定为妊娠0.5天的小鼠。确认妊娠后连续三日腹腔注射小剂量(50mg/kg)链脲佐菌素(Streptozotocin,STZ)(STZ溶解于0.1mol/L、PH 4.2的柠檬酸/枸橼酸钠缓冲液中,现配现用,冰浴保存)。于妊娠第3.5天(妊娠早期)记录小鼠的随机血糖以确认造模成功(随机血糖大于11.1mmol/l为造模成功),随机分成GDM组(n=6)和AGDMP1组(n=6)。
1.6AGDMP1在GDM模型小鼠的作用
以1.5中建模成功的GDM模型孕鼠为研究对象,采用微量注射针每日一次定时腹腔注射AGDMP1药物(10mg/kg)至妊娠结束。每日称量小鼠体重,通过检测动物整体代谢水平(葡萄耐受性、胰岛素耐受性)、血液生化指标(空腹血糖、空腹胰岛素、血脂等)、组织水平(各部位脂肪含量、脂肪形态学改变)、基因及蛋白水平(脂肪组织中p-AKT及GLUT4胰岛素抵抗关键分子的表达)等指标变化,总体评估AGDMP1在改善GDM模型孕鼠胰岛素抵抗中的作用。
2.实验结果
2.1基础状态及胰岛素状态下AGDMP1改善成熟脂肪细胞的胰岛素敏感性
探究基础状态及胰岛素状态下AGDMP1对成熟脂肪细胞的胰岛素敏感性的影响,不同浓度(0、5、10、50、100nM)AGDMP1加入饥饿处理12h的成熟的脂肪细胞培养上清中作用24h。收集细胞,裂解细胞收集蛋白,通过Western Blot实验比较不同处理状态下内脏脂肪细胞中p-AKT的磷酸化和p-IRS1的蛋白表达,我们发现:AGDMP1在基础及胰岛素状态下对AKT和IRS1的总蛋白的表达无明显影响,但可以增加了p-AKT和p-IRS1的表达。(图1)。由于p-AKT、p-IRS-1的表达与胰岛素的敏感性成正相关,该结果提示,AGDMP1可以改善成熟脂肪细胞的胰岛素敏感性。
2.2AGDMP1改善成熟脂肪细胞的葡萄糖摄取
通过比较不同处理下成熟内脏脂肪细胞中葡萄糖的摄取,我们发现:AGDMP1增加了成熟内脏脂肪细胞的葡萄糖摄取(图2)。由于葡萄糖摄取反映胰岛素的敏感性,该结果提示,AGDMP1可以改善成熟脂肪细胞的胰岛素敏感性。
2.3AGDMP1可以改善GDM孕鼠的血糖和胰岛素抵抗
通过化学合成的AGDMP1腹腔注射作用于GDM小鼠,探究对GDM小鼠的血糖及胰岛素的影响。实验结果示:GDM组和GDM+AGDMP1干预组的体重无明显差异(图3A),但AGDMP1干预组孕鼠的随机血糖较GDM组孕鼠低(图3B),差异有统计学意义(p<0.05)。同时检测妊娠18.5天两组孕鼠的空腹血糖,发现AGDMP1干预组的空腹血糖也显著低于GDM组(图3C)。通过ELISA kit检测小鼠空腹12h的血清中胰岛素的水平,我们观察到相较于GDM组,多AGDMP1干预组小鼠血清中胰岛素显著降低(图3D)。以上提示AGDMP1可以在不改变GDM孕鼠体重的情况下改善GDM孕鼠的血糖。在小鼠妊娠16.5天时进行ITT试验,测量各个时间点的血糖值并计算血糖值曲线下面积(AUC),结果提示GDM+AGDMP1组在胰岛素注射前及注射后的15min,30min,60min,90min两者的差异有统计学意义(图3E),计算AUC,GDM+AGDMP组与GDM组也有显著性差异。提示AGDMP1干预后的小鼠的胰岛素敏感性更佳。另外,收集了两组小鼠的血清,通过生化检测血清中的甘油三酯,总胆固醇,低密度脂蛋白,高密度脂蛋白。对两组的数据进行了统计,结果表明,GDM+AGDMP1组的甘油三酯,总胆固醇,低密度脂蛋白的水平更低,而高密度脂蛋白的水平更高,差异有统计学差异(P<0.05)(图3G)。提示AGDMP1不仅可以改善GDM孕鼠的血糖表型,还可以改善血脂水平。我们在小鼠妊娠18.5天处死小鼠,比较皮下脂肪、内脏脂肪、棕色脂肪的大体标本,肉眼可见GDM+AGDMP1组的内脏脂肪大小较GDM组更小(图3H左)。收集小鼠的内脏脂肪,对其进行称重并计算内脏脂肪比重(内脏脂肪比重=内脏脂肪重量/小鼠体重×100%),对结果进行统计分析,发现AGDMP1干预组的内脏脂肪重量及内脏脂肪比重与GDM组明显有差异(图3F)。另外,我们使用HE染色切片检查各脂肪的脂滴的大小变化(图3H右),结果显示GDM脂肪组织中脂滴面积显著大于GDM+PDMUC组。这些结果提示AGDMP1可以改善GDM小鼠的内脏脂肪蓄积从而减轻内脏脂肪的胰岛素抵抗,进而改善GDM孕鼠的胰岛素抵抗。
2.4AGDMP1可进入脂肪组织并蓄积
利用小动物活体成像技术,探究化学合成的AGDMP1是否能进入内脏脂肪组织。化学合成了FITC标记的AGDMP1多肽,以6-8周的小鼠为研究对象,采用微量注射按10mg/kg浓度给药小鼠,1h后于小动物活体成像仪器上观察AGDMP的组织分布特征。结果显示:AGDMP1腹腔注射后可以进入血液循环,进入小鼠全身的各组织脏器器官(图4A)。处死小鼠,解剖各个脏器组织,分别于小动物活体成像仪器上观察各个组织中的荧光强度,肉眼可见肝脏、肾脏、胰腺、骨骼肌、皮下脂肪还有内脏脂肪组织中均有荧光蓄积(图4B、C)。测量各个组织的中的荧光强度,发现肝脏,胰腺、肾脏、胰腺、骨骼肌、皮下脂肪、内脏脂肪中的荧光强度较对照组有显著性差异,其中内脏脂肪中的荧光强度最高(图4C)。结合动物实验结果说明AGDMP1腹腔注射后不仅可以顺利进入内脏脂肪组织,而且可以提高脂肪组织的胰岛素敏感性,从而改善胰岛素抵抗。
- 一种化合物在制备改善胰岛素抵抗药物中的应用
- 一种组合物及在制备改善胰岛素抵抗、降血糖的药物中的应用
