一株蜡样芽孢杆菌LEE9及其应用
文献发布时间:2024-04-18 19:58:26
技术领域
本发明涉及植物生防菌菌株技术领域,具体涉及一株蜡样芽孢杆菌LEE9及其应用。
背景技术
目前,垂直传递内生菌的研究主要聚焦于植物种子传递内生菌上,少部分研究了无性繁殖植物,内生菌与植物内共生育种更是处于概念性阶段。葡萄的规模化种植和生产基本上是通过扦插繁殖的葡萄无性系品种,因此,探索基于垂直传递内生菌的葡萄内共生育种技术体系无疑有着重要的理论和现实意义。大量研究表明,内生菌能够显著影响宿主植物代谢,进而调控植物的生理生化品质,而那些垂直传递内生菌更是与宿主植物具有长期且跨世代的相互作用,可应用于改良植物,形成具有特定功能内生菌群的植物新品系(或新品种)。
因此,通过重塑垂直传递内生菌群结构可以实现植物跨代品质特征改良,即:植物内生菌改良策略。目前,通过内生菌改良植物性状并没有可参考的技术方法,许多技术环节的可行性需要探索,如垂直传递内生菌菌株的发掘、备选菌株对宿主的定向侵染和内共生化、再共生内生菌的垂直传递及其功能发挥(表达)等。其中,可用于植物内生菌改良的垂直传递内生菌资源的发掘是关键。本研究将以酿酒葡萄为例,尝试利用所发掘到的葡萄垂直传递内生菌菌株LEE9建立葡萄内生菌改良的技术方法体系,研究结果为进一步利用垂直传递内生菌(VTE)资源改善葡萄及其它作物的品质特征提供新的思路和必要的技术支撑。
因此,本发明公开一株蜡样芽孢杆菌LEE9及应用。
发明内容
本发明的目的在于,提供一株蜡样芽孢杆菌LEE9,从葡萄分离获得,具有针对多种病原真菌的广谱抗性,可以高效共生到目标植物如葡萄植株中,在葡萄植株各器官间系统传递,也可通过繁殖体传递到下一代葡萄植株中,使通过该菌株改良的葡萄获得长期甚至跨世代的生物防治效应;同时可作为新型的生防菌剂产品应用。
为实现上述技术目的,达到上述技术效果,本发明是通过以下技术方案实现:
一株蜡样芽孢杆菌LEE9,其分类命名为Bacillus cereus LEE9,保藏于中国典型培养物保藏中心,保藏编号为:CCTCC NO:M2023699,保藏时间为2023年05月15日,保藏地址为武汉大学。
进一步的,所述蜡样芽孢杆菌LEE9从葡萄分离获得,LEE9菌株从葡萄不同组织部位均能分离得到,所以将其认为是垂直传递内生菌;分离方法采用的是可培养试验方法,将其不同组织部位进行表明消毒后剪碎贴在牛肉膏蛋白胨培养基上,对其进行形态学鉴定以及测序确定其为蜡样芽孢杆菌。
进一步的,所述蜡样芽孢杆菌LEE9是芽孢杆菌属(Bacillus)中的一种;菌体细孢杆状,末端方,成短或长链,1.0~1.2×3.0~5.0微米。产芽孢,芽孢圆形或柱形,中生或近中生,1.0~1.5微米,孢囊无明显膨大。革兰氏阳性,无荚膜,运动。菌落大,表面粗糙,扁平,不规则。菌落形态:在普通琼脂平板培养基上,37℃,培养24h,可形成圆形或近似圆形、质地软、无色素、稍有光泽的白色菌落(似蜡烛样颜色)直径5-7mm。在蛋白胨酵母膏平板上菌落为灰白色,不透明,表面较粗糙,似毛玻璃状或融蜡状,菌落较大。
测序后返回序列如SEQ ID NO:1所示:
在NCBI官网进行序列比对,前后序列各剪去30bp,最后确定菌株为蜡样芽孢杆菌,相似度为99.53%。
本发明的另一目的在于,公开蜡样芽孢杆菌LEE9对不同属的病原真菌抑菌的应用;
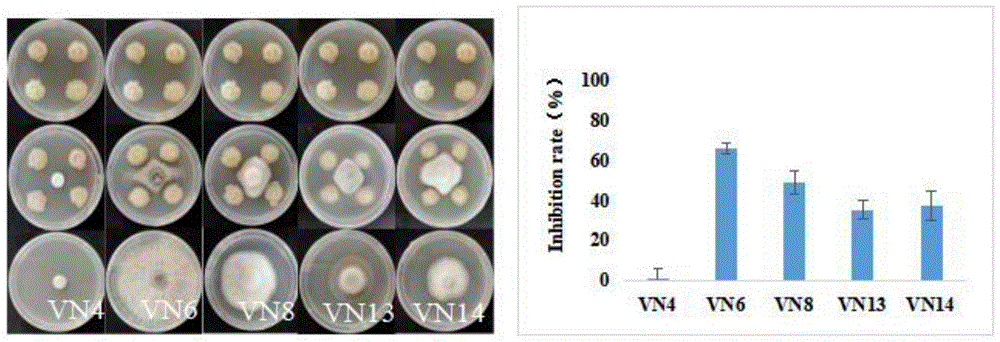
进一步的,所述LEE9菌株对VN6(Botryosphaeria dothidea)病原真菌抑菌率为66.18%;对VN4(Verticillium sp.)病原真菌抑菌率为1.32%;LEE9菌株对VN8(Fusariumgraminearum)、VN13(Alternaria alternata)和VN14(Pestalotiopsis trachycarpicola)三株病原真菌的抑菌率分别是49.18%、35.37%和37.53%。
本发明的另一目的在于,公开蜡样芽孢杆菌LEE9在作为葡萄植株长期共生生物防治菌剂产品中的应用;
进一步的,通过基于可培养结果追踪LEE9目标菌株和基于高通量测序结果追踪LEE9目标菌株证实与葡萄植株长期共生。
进一步的,葡萄植株长期共生的蜡样芽孢杆菌LEE9抑制病原真菌MH1(Botrytiscinerea)、VN8(Fusarium graminearum)、VN13(Alternaria alternata)、MH4(Cladosporium cladosporioides)的生长。
本发明的另一目的在于,公开蜡样芽孢杆菌LEE9在生物防治葡萄真菌性病害或防治产品中的应用。
本发明的有益效果为:
本发明公开蜡样芽孢杆菌LEE9,其分类命名为Bacillus cereus LEE9,保藏于中国典型培养物保藏中心,保藏编号为:CCTCC NO:M2023699,保藏时间为2023年05月15日;该菌株从葡萄分离获得,具有针对多种病原真菌的广谱抗性,更重要的是该菌株可以高效共生到目标植物如葡萄植株中,在葡萄植株各器官间系统传递,也可通过繁殖体传递到下一代葡萄植株中,使通过该菌株改良的葡萄获得长期甚至跨世代的生物防治效应;
通过该菌株成功改造的示例葡萄植株及其扦插繁殖后代具有对葡萄灰霉病、炭疽病、黑斑病等病原真菌的抗性。该菌株配合特有的处理方法,有望开发成为一种新型的生防菌剂产品,打破现有生防菌剂效果持续时间短,作用单一的缺陷。该生防菌所拮抗的病原真菌也是引发其它作物病害的病原菌,因此,除了葡萄之外,LEE9菌株也有望开发成为针对其它多种植物,特别是通过扦插繁殖植物的有效生防菌剂。
当然,实施本发明的任一产品并不一定需要同时达到以上所述的所有优点。
附图说明
图1为本发明实施例所述LEE9菌株对不同病原真菌都有很强的拮抗效应;
图2为本发明实施例所述图2-1侵染不同时间后葡萄扦插枝中LEE9菌株的跟踪检测(A:第1天,B:第10天,C:第30天);
图3为本发明实施例所述葡萄扦插枝不同部位LEE9菌株的跟踪检测;
图4为本发明实施例所述葡萄扦插枝不同天数不同部位LEE9菌株的跟踪检测(A:第230天;B:第280天;C:第340天);
图5为本发明实施例所述LEE9菌株ASV在不同处理葡萄植株不同组织部位中的相对丰度比较(CR为对照组的根部,R为LEE9处理组的根部,CS为对照组的老茎段,S为LEE9处理组的老茎段,CB为对照组叶片和新茎混合组,B为LEE9处理组叶片和新茎混合组);
图6为本发明实施例所述LEE9改良葡萄植株叶片对不同病原真菌的拮抗效应;
图7为本发明实施例所述葡萄植株采样部位图;
具体实施方式
为了更清楚地说明本发明实施例的技术方案,下面将结合附图对实施例对本发明进行详细说明。
一种蜡样芽孢杆菌LEE9,其分类命名为Bacillus cereus LEE9,保藏于中国典型培养物保藏中心,保藏编号为:CCTCC NO:M2023699,保藏时间为2023年05月15日,保藏地址为武汉大学。
所述蜡样芽孢杆菌LEE9菌株培养过程:挑取LEE9菌株边缘画线接种至牛肉膏蛋白胨培养基,于25℃培养箱中培养1-3d,至少纯化3次以上,即可得到纯化后的LEE9菌株。
实施例1
LEE9菌株对不同病原真菌都有很强的拮抗效应
如图1所示:
LEE9菌株对5株不同属的病原真菌均有抑菌效果,其中对VN6(Botryosphaeriadothidea)病原真菌抑菌率最高,抑菌率达66.18%,但对VN4(Verticillium sp.)病原真菌抑菌效果不明显,抑菌率仅有1.32%;LEE9菌株对VN8(Fusarium graminearum)、VN13(Alternaria alternata)和VN14(Pestalotiopsis trachycarpicola)三株病原真菌的抑菌率分别是49.18%、35.37%和37.53%(图1)。
实施例2
LEE9菌株可以葡萄植株形成长期的共生关系
方法一:基于可培养结果追踪LEE9目标菌株
第1天,LEE9菌株在处理组扦插枝的下段、中段和上段均能检测分离得到,分离率分别是96.67%、81.67%和73.33%,呈现逐渐递减的趋势;对照组扦插枝每段分离出少量LEE9的同属菌株,下段分离率为0.83%,中段和上段分离率分别是8.33%和10.83%(图2A)。
第10天,LEE9菌株在处理组扦插枝的下段、中段和上段也均能检测分离得到,分离率分别是24.17%、48.33%和59.17%,呈现逐渐递增的趋势;对照组扦插枝在上段和中段未检测出LEE9的同属菌株,仅在下段检测分离出LEE9的同属菌株,分离率为0.83%(图2B)。
第30天,LEE9菌株在处理组扦插枝的下段、中段和上段也均能检测分离得到,分离率分别为58.33%、31.67%和49.17%;对照组扦插枝每段分离出少量LEE9的同属菌株,上段、中段和下段分离率分别是6.67%、3.33%和1.67%(图2C)。
图2中,注:Bottom为葡萄扦插枝形态学侵染的下段,Middle为中段,Top为上段。***表示p<0.001,**表示p<0.01,*表示p<0.05。
第90天,将‘玫瑰蜜’葡萄植株分为根、老茎下段、中段、上段、新茎、叶6部分对LEE9菌株进行跟踪检测。结果可知,在LEE9处理组,每个部位均能检测分离出LEE9菌株,在根部、老茎下段、中段、下段、新茎、叶子的分离率分别26.67%、47.50%、60%、75%、27.50%、75.93%;对照组在老茎下段、中段、上段、叶子部位能检测分离出LEE9的同属菌株,分离率分别是0.83%、1.67%、0.83%、5.57%,在根部和新茎未检测出LEE9的同属菌株(图3)。
图3中,Root为根部,Bottom为葡萄扦插枝形态学侵染的下段,Middle为中段,Top为上段,Shoot为新茎,Blade为叶片。***表示p<0.001,**表示p<0.01,*表示p<0.05。
第230d,取葡萄植株的叶片进行可培养试验,在LEE9处理组分离出LEE9菌株的分离率为93%,对照组分离出LEE9的同属菌株,分离率是52%(图4A);第280d,在LEE9处理组的叶片分离出LEE9菌株的分离率为100%,对照组分离出LEE9的同属菌株,分离率是19%(图4B)。第340d,取葡萄植株新稍部位进行可培养试验,LEE9处理组分离出LEE9菌株的分离率为87.78%,对照组分离出LEE9的同属菌株,分离率是60%(图4C)。
图4中,***表示p<0.001,**表示p<0.01,*表示p<0.05。
方法二:基于高通量测序结果追踪LEE9目标菌株
第120d,基于高通量测序技术追踪LEE9菌株在不同处理组的分布情况。结果发现LEE9改良的葡萄植株在不同部位检测到LEE9菌株ASVs的平均相对丰度为1.223%,在对照组不同部位检测出LEE9菌株的ASVs的平均相对丰度为0.097%。其中,CR组和R组检测到LEE9菌株ASVs的平均相对丰度分别为0.023%和0.094%;CS组没有检测到LEE9菌株,S组检测到LEE9菌株ASVs的平均相对丰度为0.276%;CB组和B组检测到LEE9菌株ASVs的平均相对丰度分别为0.268%和3.3%,具有显著性差异(图5)。
实施例3
LEE9共生葡萄植株具有对不同病原真菌的抗性
待LEE9改良葡萄植株生长至第340d,选取LEE9改良葡萄植株的叶片和对照组的叶片,与不同病原真菌MH1(Botrytis cinerea)、VN8(Fusarium graminearum)、VN13(Alternaria alternata)、MH4(Cladosporium cladosporioides对峙培养3天后,从结果可看出,LEE9改良葡萄植株的叶片能更有效抑制中间病原真菌的生长,其中,LEE9改良葡萄植株的叶片对MH-1、VN8、VN13、MH14四株病原真菌的菌落生长抑制率分别为47.22%、45.27%、32.50%、13.46%;对照组叶片对MH-1、VN8、VN13、MH14四株病原真菌的菌落生长抑制率分别为12.78%、25.34%、9.38%、3.85%(图6)。
实施例4
LEE9生物防治葡萄真菌性病害的应用
1、准备需要进行生物防治的葡萄材料
样品可于当年的10月至第二年的2月在葡萄试验基地田采集,随机选取4株状况良好的多年生葡萄品种,在每株多年生葡萄植株中选择3株当年生茎,每枝当年生茎剪成4个小扦插枝,保证处理组和对照组都有上段或者下段的葡萄扦插枝条,分别装于无菌密封袋内,24h内带回实验室,放入4℃冰箱冷藏备用(图7)。
制备LEE9菌剂
待LEE9菌落形成,在超净工作台上,用打孔器在菌落打孔做成菌饼,将菌饼放入装有PDB培养液的锥形瓶中,每瓶接菌饼5块左右,随后放在摇床培养3至7天,得到无污染的菌丝球。随后离心,取沉淀,加入无菌水,制成浓度约为104~107的LEE9菌剂。
材料处理
取24枝葡萄扦插枝分别放入LEE9菌剂侵染3-5d,再取24枝与处理组相对应同一株当年生的葡萄扦插枝分别放入无菌水侵染3-5d;随后,将其全部取
出放入生根粉中侵泡7s-10s,接着扦插于灭过2次菌的基质土(红土:腐殖土:珍珠岩=3:3:1)中,做好标记后放入温室,浇适量无菌水保持土质湿润,一段时间后移栽至葡萄园大棚。
LEE9处理效果检测(目标菌株分离率或丰度检测方法)
方法一:可培养试验方法检测
(1)表面消毒:LEE9改良葡萄扦插枝扦插入土壤后的第1天、第10天、第30天、第90天、第230天、第280天、第340天,对其不同部位取样进行可培养试验。首先将采集到的样品在流水状态下冲洗30min,冲洗去尘土及部分表面微生物,然后将样品转移至超净工作台。其中,叶片、新茎和根用75%乙醇漂洗30s,无菌水冲洗2次,3%次氯酸钠漂洗4-5min,再次用无菌水冲洗5-6次;老茎段(原扦插枝)用75%乙醇漂洗1-2min,无菌水冲洗2次,接着用0.1%的升汞漂洗13-15min,无菌水冲洗5-6次。为确保消毒是否彻底,将最后一遍清洗样品的无菌水做为空白对照,涂布在琼脂培养基上观察7d,检测是否消毒完全。
(2)组织贴片培养:将表面消毒结束后的葡萄样品在滤纸上吸干,接着用无菌剪刀于超净工作台剪碎接种在牛肉膏蛋白胨培养基上。其中叶片剪成2mm2的小组织块,新茎和根剪碎至2mm的长度,每块平板贴10个组织块,不同部位接种10个平板。另外,将葡萄老茎段的表皮用无菌镊子撕去,把老茎段分成上中下三小段,每小段分别剪碎至0.3cm的长度,每块平板贴10个组织块,每种情况接10个平板。贴好封口膜,将培养皿放置26℃培养箱中培养,从第3天开始连续观察并记录组织块周围出现的内生菌。
(3)内生菌的分离与纯化
从培养皿上挑取形态不同的菌株,挑取边缘将其重新接种于含有双抗(青霉素和链霉素各50mg/L)的PDA培养基(真菌)或牛肉膏蛋白胨培养基(细菌)上,于25℃培养箱中培养3~7天后,挑取菌落边缘菌丝进行纯化,至少纯化3次,待菌落纯化后,合并相同形态的菌株,将纯化菌落接种于PDA或牛肉膏蛋白胨斜面,放置于4℃冰箱中保存备用。
(4)分子鉴定
采用CTAB法提取内生菌基因组DNA,得到的内生真菌用通用引物ITS4和ITS5为上、下游引物进行PCR扩增,PCR反应体系总体积为25μL:2×Taq PCR Mixture(2mmol/L)12.5μL,ITS4(10μmol/L)、ITS5(10μmol/L)各1μL,DNA模板1μL,无菌去离子水9.5μL。内生细菌用通用引物27F和1492R为上下游引物,PCR扩增体系(25μL)为:2×Taq PCR Mixture(2mmol/L)12.5μL,27F(10μmol/L)、1492R(10μmol/L)各1μL,DNA模板1μL,无菌去离子水9.5μL。内生菌扩增条件见表1、表2。将上述PCR产物送至上海生工生物公司测序。
真菌扩增条件:
表4-1 PCR反应条件
细菌扩增条件:
表4-2PCR反应条件
在NCBI数据库上对测序结果进行同源性分析及质量评估,检索并记录与上传序列相似度最高的序列种属信息并分类注释上传序列。目标菌株及不同发育阶段的样品通过Clustal Omega进行同源性比较,归纳各样品OTU。
统计分析方法
分离率(%)=内生菌菌株总数/组织块总数×100
方法二:高通量测序方法检测
待LEE9改良葡萄植株生长至第120d,对‘玫瑰蜜’葡萄植株不同部位进行取样,表面消毒步骤同上。随后将样品放入-80℃冰箱冻存。后续干冰寄送到杭州联川生物技术有限公司进行测序。
(1)ITS1文库构建
利用引物ITS1FI2(5'-GTGARTCATCGAATCTTTG-3')和ITS2(5'-TCCTCCGCTTATTGATATGC-3')对真菌(ITS2)可变区进行PCR扩增(表4-3,表4-4)。该测序工作委托杭州联川生物技术有限公司进行。
(2)16SrDNA文库构建
利用引物341F(5'-CCTACGGGNGGCWGCAG-3')和805R(5'-GACTACHVGGGTATCTAATCC-3')对细菌(V3-V4)可变区进行PCR扩增(表3,表4)。该测序工作委托杭州联川生物技术有限公司进行。
表3 PCR扩增反应体系
表4 PCR反应条件
(3)生信分析流程
Illumina高通量数据处理:从测序获得的双端数据,开始需要根据barcode信息对样品进行数据拆分,并去除接头和barcode序列,从而获得高质量的cleandata。通过使用qiime dada2 denoise-paired调用DADA2进行长度过滤和去噪。获得ASV(amliconsequence variants,即扩增序列变体)特征序列和ASV丰度表格,并去除在全体样本中,序列总数仅为1的ASV,根据NCBI数据库比对结果剔除不属于微生物的ASV(宿主植物序列),剔除样品中植物叶绿体(Chloroplast)和线粒体(Mitochondria)的ASV。
Alpha多样性分析:Alpha多样性指一个特定环境或系统内的多样性,主要用来反映物种多样性和丰富度以及测序深度。基于得到的ASV特征序列和ASV丰度表格进行alpha多样性分析,用Qiime2软件计算Observed_otus、Chao1、Goods_coverage、Shannon、Simpson指数。使用R软件(Version 3.4.4)绘制稀释曲线,小提琴图,并选用Kruskal-Wallis检验alpha多样性指数组间差异。
Beta多样性分析:Beta多样性用于比较不同分组间微生物群落整体组成是否有差异。通常由计算环境样品间的距离矩阵开始,该矩阵包含任意两个样品间的距离,主要通过主成分分析(Principal component analysis,PCA)、主坐标分析(Principal coordinatesanalysis,PCoA)、聚类分析(Clustering analysis,UPGMA)、非多维尺度分析(Multidimensional scaling,NMDS)、相似性分析(Analysis ofsimilarities,ANOSIM)、多元方差分析(PermANOVA,又称Adonis)等方法,观察样本之间的差异。
物种注释分析:物种注释采用QIIME2的插件ASV-classifier进行序列比对,使用SILVA以及Unite数据库对特征序列做物种分类及后续分析。根据ASV注释结果和各样品ASV表,获得界、门、纲、目、科、属、种水平物种丰度表,并针对不同水平物种丰度表进行不同样品(组)物种组成及差异分析,参数阈值:置信度>0.7。
实施例5
处理材料的培养和建立葡萄园
选择在改良葡萄植株中检测目标菌株LEE9分离率达到90%以上的葡萄植株移栽至大棚,至少每周浇水一次(根据土壤湿度灵活浇水)。待植株长高至30cm左右,开始用棍子和绳子固定葡萄植株,将蔓捆绑在木棍上,剪除卷须,抹芽除梢和摘心,减少养分过多消耗。待植株生长一段时间后(根至少有20cm以上),可移栽到室外,建立葡萄园。
实施例6
抗病性检测及抗病葡萄园建立
可以通过植株叶片的性状观察其感病情况。在肉眼难以观察叶片感病的情况下,可以通过植株离体叶片对不同病原菌的拮抗效果,判断改良葡萄植株的抗病能力,进而淘汰抗病能力弱的改良葡萄植株,选用抗病能力较强的改良葡萄植株建立新的葡萄园。
以上公开的本发明优选实施例只是用于帮助阐述本发明。优选实施例并没有详尽叙述所有的细节,也不限制该发明仅为所述的具体实施方式。根据本说明书的内容,可作很多的修改和变化。本说明书选取并具体描述这些实施例,是为了更好地解释本发明的原理和实际应用,从而使所属技术领域技术人员能很好地理解和利用本发明。本发明仅受权利要求书及其全部范围和等效物的限制。
- 一株防控腐烂茎线虫的蜡样芽孢杆菌HDN-1及其应用
- 一株降解金霉素的蜡样芽孢杆菌及其应用
