一种与脂肪肉瘤脂质代谢相关的潜在肿瘤抗原、免疫分型及其构建方法和应用
文献发布时间:2024-04-18 19:58:26
技术领域
本发明属于肿瘤预测及疫苗开发技术领域,具体涉及一种与脂肪肉瘤脂质代谢相关的潜在肿瘤抗原、免疫分型及其构建方法和应用。
背景技术
脂肪肉瘤(LPS)是最常见的软组织肉瘤,也是最被肿瘤学者忽视恶性肿瘤之一,多发于成年人。高分化LPS和去分化LPS共同构成LPS最常见的病理亚型。LPS好发于腹膜后间隙,具有鲜明的临床特点,包括:早诊早筛困难,初诊时多数肿瘤体积巨大;肿瘤多数压迫或侵犯周围重要血管及邻近组织器官导致手术完整切除困难,局部复发率高;肿瘤恶性程度伴随复发次数而逐渐增高,复发间期逐渐缩短;放化疗不敏感且可用药有限。脂质(脂肪酸和胆固醇)代谢失调是肿瘤最突出的代谢改变之一。然而,LPS中的脂质代谢机制尚不明确。近年来,免疫疗法包括CAR-T疗法和针对程序性细胞死亡蛋白1(PD-1)和PD-配体1(PD-L1)被已经广泛开发用于癌症治疗,然而只有特定病理类型的LPS(如去分化LPS)患者能够从免疫治疗中获益。毋庸置疑,LPS作为一种难治性恶性肿瘤,已成为危害人类健康、生命安全以及社会经济的重大疾病。因此,LPS的精准治疗亟需新的策略。
发明内容
鉴于此,本发明的目的在于提供一种与脂肪肉瘤脂质代谢相关的潜在肿瘤抗原、免疫分型及其构建方法和应用。通过脂质代谢分型进一步筛选在脂肪肉瘤中与脂质代谢相关的拷贝数扩增和突变的基因,并寻找其中与抗原提呈性免疫细胞显著相关、与肿瘤预后显著相关的分子作为潜在的mRNA疫苗抗原。并且,通过免疫热点基因用于预测基于脂肪肉瘤预后显著相关的潜在抗原所制备的疫苗对脂肪肉瘤患者的治疗效果,进而筛选出适合人群接种的mRNA疫苗。
为实现上述目的,本发明所采取的解决方案如下:
第一个方面,本发明提供一种与脂肪肉瘤脂质代谢相关的潜在肿瘤抗原,所述潜在肿瘤抗原包括以下抗原基因中的一种或多种:ACOT7、ARSJ、ARSK、CPT1B、CYP21A2、ELOVL2、FDX2、GSTM4、HACD1、HSD17B14、MTMR8、ORMDL2和TNFRSF21。
优选地,所述抗原基因ELOVL2与抗原呈递细胞呈现负相关性。
第二个方面,本发明还提供一种与脂肪肉瘤脂质代谢相关的潜在肿瘤抗原基因ELOVL2在制备用于治疗和预防脂肪肉瘤的产品中的应用。
优选地,所述产品包括脂肪肉瘤疫苗。
优选地,所述疫苗为mRNA疫苗。
第三个方面,本发明还提供一种与脂肪肉瘤预后相关的脂质代谢分型的构建方法,包括如下步骤:
从TCGA下载TCGA-SARC队列的转录组表达谱数据,所述数据仅包括脂肪肉瘤肿瘤样本;
通过MSigDB数据库获取741个脂质代谢相关基因集;
利用R包ConsensusClusterPlus根据741个脂质代谢相关基因对TCGA-SARC中脂肪肉瘤肿瘤样本进行无监督聚类分析,得到两个与脂肪肉瘤预后显著相关的脂质代谢亚型LMS1和LMS2;
对741个脂质代谢相关基因进行单因素COX回归,LASSO回归分析及多因素COX回归分析筛选出与脂肪肉瘤预后显著相关的脂质代谢基因,以得到与预后相关的脂质代谢基因的表达信息。
优选地,得到的所述与脂肪肉瘤预后相关的脂质代谢基因包括如下基因:ACOT7,ARSJ,ARSK,CPT1B,CYP21A2,ELOVL2,FDX2,GSTM4,HACD1,HSD17B14,MTMR8,ORMDL2和TNFRSF21。
第四个方面,本发明还提供一种与脂肪肉瘤预后相关的脂质代谢分型,所述脂质代谢分型由如上所述的741个脂质代谢相关基因构建方法得到,所述脂质代谢分型包括两个脂质代谢亚型LMS1和LMS2,所述脂质代谢分型能够用于预测基于如上所述的与脂肪肉瘤脂质代谢相关的潜在肿瘤抗原所制备的脂肪肉瘤疫苗对脂肪肉瘤患者的治疗效果。
优选地,所述两个脂质代谢亚型LMS1和LMS2可以作为与脂肪肉瘤预后相关的生物标志物,脂质代谢亚型LMS1的脂肪肉瘤肿瘤患者的预后治疗效果具有显著性。
第五个方面,本发明还提供如上所述的与脂肪肉瘤预后相关的脂质代谢分型作为生物标志物在制备用于治疗和预防脂肪肉瘤的mRNA疫苗中的应用,所述脂质代谢分型包括两个脂质代谢亚型LMS1和LMS2。
优选地,在TCGA-SARC队列检测到26个与免疫原性细胞死亡(ICD)调节因子相关的基因,其中12个基因在两个亚型LMS1和LMS2间差异表达,LMS1亚型中显著上调了CXCL10、FPR1和TLR4基因,所述用于治疗和预防脂肪肉瘤的mRNA疫苗对上调了CXCL10、FPR1和TLR4基因的LMS1亚型更有功效。
第六个方面,本发明还提供一种与脂肪肉瘤脂质代谢相关的免疫热点基因,所述与脂肪肉瘤脂质代谢相关的免疫热点基因为PLCG1,其构建方法包括如下步骤:
WGCNA共表达网络构建:对免疫相关基因中与预后相关的基因进行加权共表达网络分析,软阈值筛选后,以power=6构建网络,计算每个模块对应每个样本的eigengenes,检测得到eigengenes在脂质代谢亚型LMS1和LMS2中的分布存在显著差异;
预后模块识别和刻画:利用eigengenes对模块进行生存分析,显示Brown模块与预后显著相关;
基于预后模块识别模块中免疫相关hub基因:为得到预后相关模块Brown的hub基因,计算模块内基因与模块eigengenes的相关性,取与模块eigengenes相关性大于0.9的hub基因,再对hub基因进行单因素Cox回归分析,最后利用逐步向后方及多因素Cox回归分析法筛选得到3个独立的预后相关免疫hub基因PLCG1、ZC3HAV1L和NFAT5;
获得与脂肪肉瘤脂质代谢相关免疫热点基因PLCG1:为探究3个免疫hub基因与脂质代谢间的相关性,分析脂质代谢相关潜在抗原基因ELOVL2与3个hub基因表达间相关性,结果显示只有PLCG1与ELOVL2的表达呈显著正相关性。
第七个方面,本发明还提供一种预测脂肪肉瘤患者预后的风险评分模型,所述预测脂肪肉瘤患者预后的风险评分模型通过结合如上所述的潜在肿瘤抗原ELOVL2与如上所述的免疫热点基因PLCG1构建,构建的风险评分模型RiskScore=0.0469969754919514*ELOVL2+0.517433878453894*PLCG1,通过上述公式计算样本风险得分,并以最佳cut-off值为节点划分高低风险组。
现有技术相比,本发明的有益效果在于:
本发明提供了一种与脂肪肉瘤相关的脂质代谢分型、潜在抗原、免疫热点基因及其构建方法和应用。所述脂质代谢分型包括LMS1和LMS2,潜在抗原包括ELOVL2。本发明还提供了所述与脂肪肉瘤预后显著相关、且与脂质代谢分型相关的潜在抗原在制备用于治疗和预防脂肪肉瘤的产品中的应用。本发明还提供了一种免疫热点基因集及其构建方法和应用。通过WGCNA提取脂肪肉瘤相关的免疫热点基因,并鉴别了这些免疫热点基因的细胞特征和分子特征,免疫热点基因用于预测基于脂肪肉瘤预后显著相关的潜在抗原所制备的脂肪肉瘤疫苗对脂肪肉瘤患者的治疗效果,进而筛选出适合人群接种的mRNA疫苗,提高脂肪肉瘤疫苗对肿瘤患者的治疗和预防效果。
附图说明
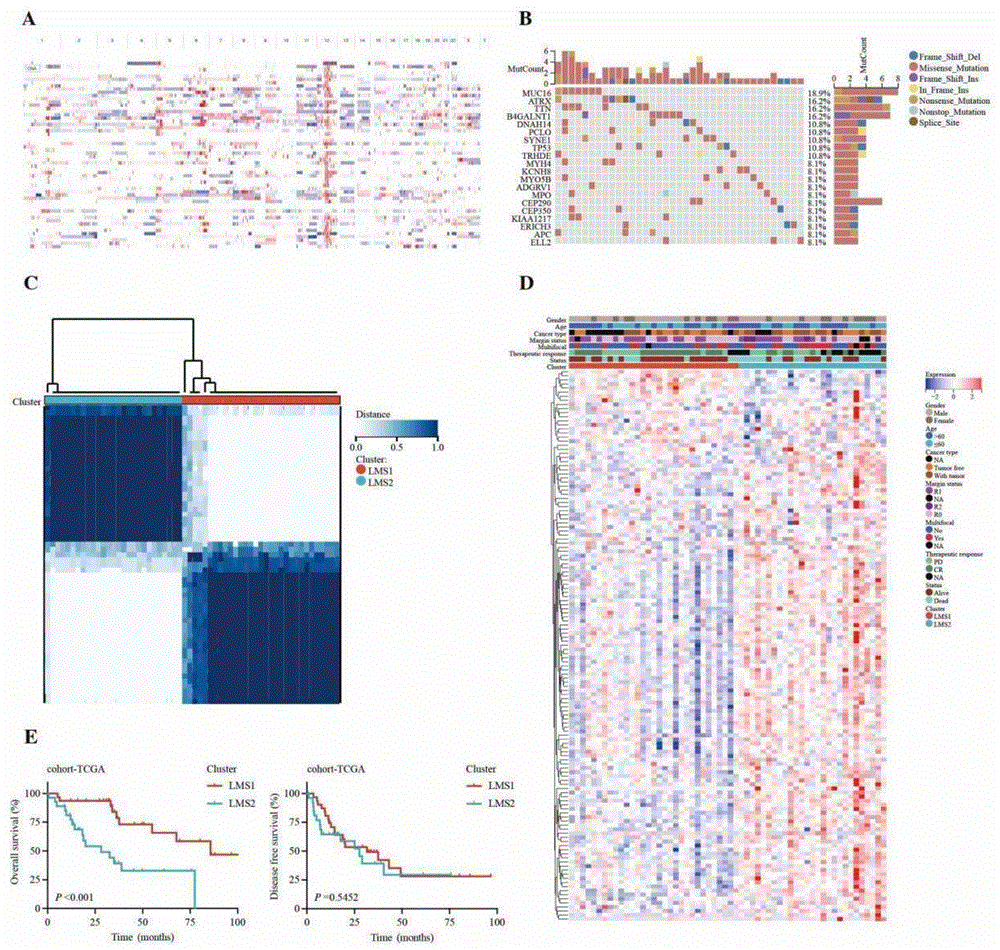
图1为本发明实施例中关于LPS相关脂质代谢分型的图例;图中,图1A为异常拷贝数基因在染色体上的位置分布;图1B为脂肪肉瘤突变基因瀑布图、突变基因数量分布与基因CNV变化;图1C为无监督聚类分析将LPS样本聚类为两个脂质代谢亚型;图1D为差异性基因热图;图1E为两个脂质代谢亚型LMS1和LMS2的Kaplan-Meier生存分析曲线。
图2为本发明实施例中关于亚型间差异性基因功能富集和免疫活性分析的图例;图中,图2A为不同脂质代谢亚型之间差异表达基因火山图;图2B和2C为不同脂质代谢亚型之间KEGG相关通路基因富集情况图。
图3为本发明实施例中关于亚型间免疫细胞浸润差异分析的图例;图中,图3A为两个脂质代谢亚型LMS1和LMS2的基质评分、免疫评分和ESTIMATE评分图;图3B为利用Xcell分析两个脂质代谢亚型LMS1和LMS2之间的免疫细胞浸润图;图3C为比较两个脂质代谢亚型LMS1和LMS2之间的已知泛癌免疫亚型分布图,其中C1为Wound Healing亚型,C2为IFN-γDominant亚型,C3为Inflammatory亚型,C4为Lymphocyte Depleted亚型,C6为TGF-βDominant亚型;图3D为比较两个脂质代谢亚型LMS1和LMS2之间的肿瘤突变负荷(TMB)图;图3E、3F为ICP和ICD在不同亚型间相关基因的表达差异,其中:****表示p<0.0001,***表示p<0.001,**表示p<0.01,*表示p<0.05,ns表示无统计学显著性。
图4为本发明实施例中关于预后相关潜在抗原识别图例;图中,图4A-4C为结合扩增、突变、OS数据和DFS数据,对抗原候选基因进行LASSO回归分析筛选得到13个与OS、DFS预后相关基因图;图4D为通过Kaplan-Meier曲线展示OS的显著关联基因表达与预后关联图。
图5为本发明实施例中关于潜在抗原与抗原呈递细胞浸润相关性分析图例;图中,图5A为突变基因集,拷贝数扩增基因集,脂质代谢基因集与生存复发相关基因交集的韦恩图;图5B为抗原基因ELOVL2与抗原呈递细胞APC(包括B cells、Macrophages和Dendriticcells)的相关性分析图。
图6为本发明实施例中对免疫相关基因中与预后相关的基因进行加权共表达网络分析不同脂质代谢亚型间存在的分布差异图例;图6A为样本分类树形图;图6B、6C为软阈值筛选展示图;图6D为模块eigengenes在亚型间分布的差异展示图。
图7为本发明实施例中利用eigengenes对模块进行生存分析图例;图7A为显示Brown模块与预后显著相关图;图7B为对预后相关模块Brown中的基因进行KEGG信号通路富集分析图。
图8为本发明实施例中为得到预后相关模块Brown的hub基因计算模块内基因与模块eigengenes的相关性图例;图中,图8A为6个模块间相关性分析;图8B为LASSO分析筛选Brown模块中3个hub基因;图8C,8D,8E为3个hub基因PLCG1、ZC3HAV1L和NFAT5的Kaplan-Meier生存分析曲线。
图9为本发明实施例中免疫热点基因与潜在抗原间相关性分析图例;图中,图9A为潜在抗原基因ELOVL2与免疫热点基因PLCG1在TCGA队列,GSE30929队列和FD队列内的相关性分析散点图。
图10为本发明实施例中潜在抗原与免疫热点基因构建风险评分模型图例;图中,图10A为所有样本结合潜在抗原ELOVL2与免疫热点基因PLCG1构建风险得分模型的风险得分、生存时间散点图及基因的表达热图;图10B为通过Kaplan-Meier曲线的高低风险组的生存差异分析图;图10C为绘制的模型ROC曲线图。
具体实施方式
以下结合具体实施例,对本发明的技术方案做进一步的描述,但是本发明的保护范围并不限于这些实施例。凡是不背离本发明构思的改变或等同替代均包括在本发明的保护范围之内。
实施例1:
本实施例1提供了一种与LPS预后显著相关的脂质代谢分型和潜在抗原,具体筛选过程如下:
1.1LPS相关脂质代谢分型
为鉴定脂质代谢异常在脂肪肉瘤中的潜在作用,以及筛选脂质代谢相关的潜在肿瘤抗原,首先从TCGA(https://portal.gdc.cancer.gov/)下载TCGA-SARC队列的转录组表达谱数据,数据包括LPS肿瘤样本58例。通过GEPIA(http://gepia2.cancer-pku.cn,version 2)绘制LPS相关的异常拷贝数基因在基因组染色体上位置的分布图以及基因突变信息(图1A所示异常拷贝数基因在染色体上的位置分布,图1B所示脂肪肉瘤突变基因瀑布图、突变基因数量分布与基因CNV变化)。
通过MSigDB数据库获取741个脂质代谢相关基因集。利用R包ConsensusClusterPlus对TCGA-SARC中LPS样本进行聚类分析,得到2个脂质代谢亚型LMS1和LMS2,以及相应差异性基因(图1C所示无监督聚类分析将LPS样本聚类为2个脂质代谢亚型,图1D所示差异性基因热图,图1E所示LMS1与LMS2亚型的Kaplan-Meier生存分析曲线)。
1.2亚型间差异性基因功能富集和免疫活性分析
为明确不同脂质代谢亚型之间差异性基因及其功能差异,利用R中的edgeR软件包对TCGA-SARC队列数据进行差异分析。差异基因筛选阈值为log2FC>1且FDR<0.05,得到558个上调表达基因,3586个下调表达基因,如图2A所示差异表达基因火山图。为了研究差异性基因的功能,使用R软件包clusterProfiler进行富集分析,KEGG相关通路基因富集情况如图2B和2C所示,分别表示上调基因和下调KEGG相关通路富集分析。
1.3亚型间免疫细胞浸润差异分析
利用ESTIMATE算法进一步分析,LMS1中基质评分、免疫评分和ESTIMATE评分显著高于LMS2,如图3A所示。利用Xcell分析LMS1和LMS2之间免疫细胞浸润的差异,如图3B所示(从图3B可以看出,LMS1的免疫细胞浸润比LMS2的免疫细胞浸润情况好)。比较LMS1和LMS2之间已知泛癌免疫亚型分布,如图3C所示,C3 Inflammatory亚型和C6 TGF-βDominant亚型两个免疫相关亚型在LMS1组内分布较多。比较LMS1和LMS2之间肿瘤突变负荷(肿瘤突变负荷(Tumor Mutational Burden,TMB)被定义为每百万碱基中被检测出的,体细胞基因编码错误、碱基替换、基因插入或缺失错误的总数。肿瘤突变负荷,就是评价基因突变频率高低的指标。肿瘤细胞基因突变频率高,则细胞表面,所携带的肿瘤抗原就多,容易受到机体免疫系统的攻击,而被杀死。因此,检测恶性肿瘤的肿瘤突变负荷,就可以预测患者对免疫治疗的效果,目前已成为临床上,预测癌症免疫治疗疗效的、具有良好前景的全新生物标志物。既往研究已经证实,肿瘤突变负荷高,与免疫治疗疗效呈正相关。肿瘤突变负荷TMB和突变用于量化与免疫治疗功效(包括mRNA)密切相关的肿瘤的数量。从图3D可以看出,LMS1和LMS2两种亚型的肿瘤突变负荷没有显著差异。比较ICP和ICD在不同亚型间相关基因的表达差异,如图3E,3F所示。其中:****表示p<0.0001;***表示p<0.001;**表示p<0.01;*表示p<0.05;ns表示无统计学显著性。
先前的研究表明,ICP(例如PD-L1和TIM-3)和免疫原性细胞死亡(ICD)调节因子(例如,CALR和HMGB1)在调节宿主抗肿瘤免疫中起到关键作用,这可能会影响mRNA疫苗的功效。因此,在两种免疫亚型中评估了ICP和ICD调节因子的差异表达。总的来说,免疫分型可以反映ICD调节因子和ICP的表达水平,因此可以作为mRNA疫苗的生物标志物。mRNA疫苗对ICP高表达的患者可能效果较差,而对ICD调节因子上调的患者更有效。图3E所示,在TCGA-SARC队列中检测到46个与ICP相关的基因,其中22个基因在两个亚型LMS1和LMS2之间差异表达。而LMS1亚型中显著上调了BTLA、CD200R1、CD244、CD27、CD28、CD40、CD40LG、CD48、CD86、HAVCR2、IDO1、IDO2、LAIR1、LGALS9、PDCD1、TIGIT、TNFRSF14、TNFRSF8、TNFSF14和VSIR。图3F所示,在队列中检测到26个与ICD调节因子相关的基因,其中12个基因在两个亚型LMS1和LMS2之间差异表达,而LMS1亚型中显著上调了CXCL10、FPR1和TLR4基因,用于治疗和预防脂肪肉瘤的mRNA疫苗对上调了CXCL10、FPR1和TLR4基因的LMS1亚型更有功效。
免疫分型可以反映ICD调节因子和ICP的表达水平,从而对mRNA疫苗形成一种生物标志物。mRNA疫苗对ICP高表达的患者无效,而对ICD调节因子的上调则更有效。
LMS1和LMS2两个脂质代谢亚型可以作为预后的生物标志物,LMS1肿瘤患者的预后可能更好。
1.4预后相关潜在抗原识别
进一步结合扩增、突变、OS数据和DFS数据,对抗原候选基因进行LASSO回归分析筛选得到13个与OS、DFS预后相关基因,被定义为潜在的脂质代谢相关肿瘤抗原,分别为ACOT7、ARSJ、ARSK、CPT1B、CYP21A2、ELOVL2、FDX2、GSTM4、HACD1、HSD17B14、MTMR8、ORMDL2和TNFRSF21,如图4A-C所示。
图4C中的风险评分RiskScore通过以下方法获得:
利用LASSO回归分析以缩小先前使用“glmnet”R包过滤的预后相关基因,使用最小lambda值为最佳值,通过多元Cox回归分析建立风险模型,构建风险得分模型RiskScore=1.866577428*ACOT7-0.040721477*ARSJ-0.451127087*ARSK+
0.479584604*CPT1B-0.000114123*CYP21A2+0.424535615*ELOVL2-1.414705024*FDX2-0.32557149*GSTM4+0.692304756*HACD1-0.670006158*HSD17B14-0.763286635*MTMR8-0.734212004*ORMDL2+1.159963024*TNFRSF21。
图4D示出了Kaplan-Meier曲线展示OS的显著关联基因表达与预后关联。分析扩增后的基因的存活相关性。表明这13种肿瘤抗原基因具有潜在的免疫刺激作用。
1.5潜在抗原与抗原递呈细胞浸润相关性分析
利用TIMER数据库在线分析预后相关潜在抗原与B cells,Macrophages,Dendritic cells的相关性。主要关注潜在抗原与抗原呈递细胞APC的相关性(即B细胞Bcells、巨噬细胞Macrophages、树突状细胞Dendritic cells)。如图5A所示抗原基因ELOVL2与抗原呈递细胞呈现负相关性。说明本实施例的1个与LPS预后显著相关的潜在抗原ELOVL2能够激活抗原呈递细胞,因此对于制备治疗和预防LPS的疫苗具有重要的指导意义。
抗原呈递细胞(Antigen-presenting cells,APC)是指能够摄取、加工处理抗原,并将处理过的抗原呈递给T细胞的一类免疫细胞。APC主要包括单核-吞噬细胞、树突状细胞、B细胞、朗格汉斯细胞以及肿瘤细胞的病毒感染的靶细胞等(其中树突状细胞的抗原呈递能力最强)。
抗原呈递细胞的作用是进行免疫识别、免疫应答和免疫调节,具有杀灭病原体、杀伤肿瘤细胞的功能。具体分析如下:抗原呈递细胞主要包括单核-吞噬细胞、树突状细胞、肿瘤细胞的病毒感染的靶细胞等,能够摄取、加工处理抗原,并将处理过的抗原呈递给T细胞的一类免疫细胞,其中巨噬细胞分布最广、树突状细胞的抗原呈递能力最强。抗原呈递细胞在机体的免疫识别、免疫应答、免疫调节中起重要作用,具有杀灭病原体、杀伤肿瘤细胞的功能,广泛分布于机体各组织以及器官中。
实施例2
本实施例2提供了一种与LPS预后显著相关的免疫热点基因和风险模型,所述方法包括利用构建的LPS患者的预后评分模型对患者样本进行预后风险评分,并以最佳cut-off值作为节点对LPS患者进行高低风险组划分,具体构建过程如下:
2.1WGCNA共表达网络构建
对免疫相关基因中与预后相关的基因进行加权共表达网络分析,软阈值筛选后,以power=6构建网络,之后计算每个模块对应每个样本的eigengenes,检测eigengenes不同脂质代谢亚型间是否存在分布差异。图6A为样本分类树形图;图6B和图6C为软阈值筛选展示;图6D为模块eigengenes在亚型间分布的差异展示。结果显示,模块的eigengenes在LMS亚型中的分布存在显著差异。
2.2预后模块识别和刻画
进一步利用eigengenes对模块进行生存分析,如图7所示,结果显示Brown模块与预后显著相关,如图7A所示。同时对预后相关模块Brown中的基因进行KEGG信号通路富集分析,如图7B。
2.3基于预后模块,识别模块中免疫相关hub基因
为了得到预后相关模块Brown的hub基因,进一步计算模块内基因与模块eigengenes的相关性,取与模块eigengenes相关性大于0.9的hub基因,再进一步对hub基因进行单因素Cox回归分析,最后利用逐步向后方及多因素Cox回归分析法进一步筛选得到3个独立的预后相关免疫hub基因,如图8所示。
2.4免疫热点基因与潜在抗原间相关性分析,获得免疫热点基因
为进一步分析免疫热点基因与潜在抗原间相关性,探究3个免疫hub基因与脂质代谢间的相关性,分析脂质代谢相关肿瘤抗原基因ELOVL2与3个hub基因表达间相关性,结果显示只有PLCG1与ELOVL2的表达呈显著正相关性(如图9所示),以此获得免疫热点基因PLCG1。
2.5潜在抗原与免疫热点基因构建风险评分模型
为进一步对LPS患者预后进行风险分层,结合潜在抗原ELOVL2与免疫热点基因PLCG1构建风险得分模型RiskScore=0.0469969754919514*ELOVL2+0.517433878453894*PLCG1,然后通过以上公式计算样本风险得分,并以最佳cut-off值为节点划分高低风险组,如图10所示,图10A为所有样本的风险得分,生存时间散点图及基因的表达热图。高低风险组的生存差异显著,如图10B为Kaplan-Meier曲线,验证进一步绘制模型ROC曲线,如图10C所示,得到1年AUC=0.72,3年AUC=0.75,5年AUC=0.73,表明模型的预测效能良好。风险模型基因可以作为生物标志物,用于预测患者的预后并确定适合mRNA疫苗的患者。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 一种与肾透明细胞癌预后显著相关的潜在抗原、免疫分型及其构建方法和应用
- 一种与前列腺癌显著相关的潜在抗原、免疫分型及其构建方法和应用
