一种iRGD肽/HA修饰的含DOX@siRNA的复合纳米粒
文献发布时间:2024-04-18 19:58:26
技术领域
本发明属于,具体涉及一种以SSBPEI-DOX@siRNAs为内核、iRGD-PEG-HA为外壳构建的SSBPEI-DOX@siRNAs/iRGD-PEG-HA复合纳米粒及其制备方法与其在制备肿瘤靶向药物中的应用。
背景技术
基因治疗是指通过基因转移技术,将外源正常基因导入靶细胞,纠正或补偿因基因缺陷和异常引起的疾病,以达到治疗目的的一种生物治疗方法。近年来,基因疗法已成为治疗各种疾病的重要手段之一。肿瘤基因治疗可以通过改变肿瘤细胞中基因的表达量,抑制肿瘤细胞的增殖生长等,并通过与化学疗法的结合达到协同肿瘤杀伤的目的。但由于基因在肿瘤治疗过程中存在靶向性差、易被血清降解等缺点,基因载体成为基因治疗研究中的重要部分。
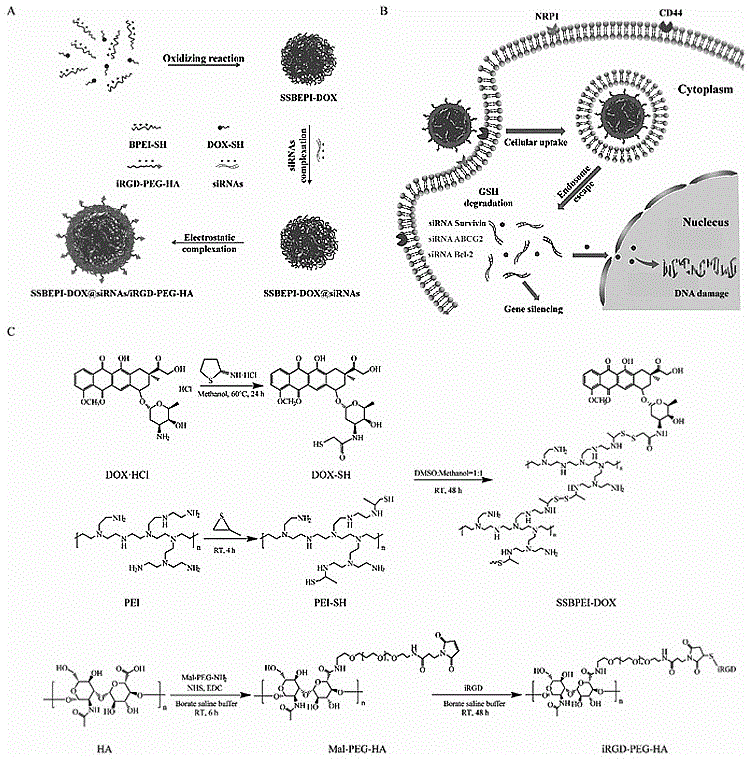
一个理想的基因载体需要具有高转染效率、肿瘤靶向性、低细胞毒性、血液长循环能力等特点。目前,最常见的商用基因载体是支化聚乙烯亚胺,其因具有质子海绵效应,可很快从内涵体逃逸,从而在携带基因时可得到较高的基因转染效率。大分子的聚乙烯亚胺具有高的基因转染效率,但细胞毒性大,低分子量的聚乙烯亚胺具有低毒性,但基因转染效率却很低。将低分子量的聚乙烯亚胺通过二硫键连接形成二硫键改性的大分子聚乙烯亚胺,既可实现高基因转染效率,同时,由于改性聚乙烯亚胺中的二硫键可被细胞内谷胱甘肽还原降解成低分子的聚乙烯亚胺,又能达到材料低毒性的目的。此外,由于肿瘤细胞中含有比正常组织要高出100~1000倍浓度的谷胱甘肽,二硫键改性的聚乙烯亚胺携带基因药物时更容易被肿瘤细胞中的谷胱甘肽降解,释放出基因药物进行基因治疗,因而具有一定肿瘤靶向性。但是,二硫键改性的聚乙烯亚胺作为基因载体还远远不够,为了进一步使得基因载体具有血液长循环能力和主动靶向性,本发明提供了一种SSBPEI-DOX@siRNAs/iRGD-PEG-HA复合纳米粒,由于iRGD肽和透明质酸(HA)可以与肿瘤细胞上的肿瘤神经纤毛蛋白-1(NRP1)和CD44受体特异性结合,因此该复合纳米粒中iRGD肽和HA的引入可使纳米粒更容易聚集在肿瘤部位,从而实现基因药物的肿瘤主动靶向递送;由于聚乙二醇具有良好的生物相容性和水溶性,聚乙二醇的引入可使得复合纳米粒具有良好的血液长循环能力,进而实现基因药物的肿瘤被动靶向递送。
发明内容
本发明的目的在于提供一种具有较好的生物相容性和还原响应性,能够有效结合基因治疗与化疗,且能靶向递送至肿瘤细胞中的SSBPEI-DOX@siRNAs/iRGD-PEG-HA复合纳米粒及其制备方法。
为实现上述目的,本发明采用如下技术方案:
一种iRGD肽/HA修饰的含DOX@siRNA的复合纳米粒,其是由低分子量的支化聚乙烯亚胺(BPEI)与硫化丙烯反应制得巯基修饰的支化聚乙烯亚胺(BPEI-SH);由盐酸阿霉素(DOX·HCl)与2-亚氨基硫烷盐酸盐(2-IT)反应制得巯基修饰的阿霉素(DOX-SH);然后将制得的BPEI-SH与DOX-SH反应,制得大分子的二硫键改性的支化聚乙烯亚胺/阿霉素复合物(SSBPEI-DOX);再将SSBPEI-DOX与siRNA进行静电结合,制得SSBPEI-DOX@siRNAs,最后在其表面通过静电结合修饰上iRGD肽和透明质酸(HA)修饰的聚乙二醇(iRGD-PEG-HA),从而构成以SSBPEI-DOX@siRNAs为内核、iRGD-PEG-HA为外壳的复合纳米粒SSBPEI-DOX@siRNAs/iRGD-PEG-HA。
所述SSBPEI-DOX@siRNAs/iRGD-PEG-HA复合纳米粒的制备包括如下步骤:
1)BPEI-SH的制备:将低分子量的支化聚乙烯亚胺(BPEI)溶解在去离子水中配制成溶液,并调节溶液的pH值至中性,冻干2~3天后,将所得冻干产物用无水甲醇溶解后,加入硫化丙烯,在氮气保护下于60~70℃搅拌反应18~24小时,再将反应液减压浓缩,所得产物溶解于无水甲醇中,用冷乙醚沉淀2~3次后,再经减压浓缩干燥,得到巯基修饰的支化聚乙烯亚胺(BPEI-SH);
2)DOX-SH的制备:将盐酸阿霉素(DOX·HCl)溶解在含1 mM EDTA的PBS溶液中,然后加入2-亚氨基硫烷盐酸盐(2-IT),在氮气保护且避光的条件下,室温下搅拌反应4小时,然后将得到的产物在超纯水中透析(MWCO 1000 Da)8小时除去杂质,再经冻干处理3天,得到巯基修饰的阿霉素(DOX-SH);
3)SSBPEI-DOX的制备:将BPEI-SH和DOX-SH溶解于二甲基亚砜与甲醇(5:1,v/v)的混合溶液中,室温下搅拌反应48小时,然后将得到的产物在超纯水中透析(MWCO 3500 Da)3天除去杂质,再经冻干处理3天,得到二硫键改性的支化聚乙烯亚胺/阿霉素复合物(SSBPEI-DOX);
4)iRGD-PEG-HA的制备:将透明质酸溶解在硼酸盐缓冲液中,然后分别加入NHS、EDC与氨基聚乙二醇马来酰亚胺(MAL-PEG-NH
5)SSBPEI-DOX@siRNAs/iRGD-PEG-HA复合纳米粒的制备:将SSBPEI-DOX水溶液与siRNA水溶液混合,使两者通过静电相互作用结合形成SSBPEI-DOX@siRNAs混悬液;并将一定量的iRGD-PEG-HA溶解在去离子水中,制得iRGD-PEG-HA水溶液;然后将iRGD-PEG-HA水溶液与SSBPEI-DOX@siRNAs混悬液混合,于4℃环境下孵育15分钟,以使两者通过静电相互作用形成SSBPEI-DOX@siRNAs/iRGD-PEG-HA复合纳米粒。
进一步地,步骤1)中所用低分子量的支化聚乙烯亚胺与硫化丙烯的摩尔比为1:5,其中所述支化聚乙烯亚胺的分子量范围为600~1800 Da;反应后所用无水甲醇与冷乙醚的体积比为1:2~3。
进一步地,步骤2)中所用盐酸阿霉素与2-亚氨基硫烷盐酸盐的摩尔比为1:5。
进一步地,步骤3)中BPEI-SH和DOX-SH的用量按硫含量比1:3进行换算。
进一步地,步骤4)中所用透明质酸、NHS、EDC、MAL-PEG-NH
进一步地,步骤5)中所述SSBPEI-DOX@siRNAs混悬液中,SSBPEI-DOX与siRNA的N/P(SSBPEI-DOX中氮原子的总数与siRNA中磷原子的总数的比值)为0.5~10:1;所述SSBPEI-DOX@siRNAs/iRGD-PEG-HA复合纳米粒中iRGD-PEG-HA与SSBPEI-DOX@siRNAs的质量比为0.5~2:1。
本发明中聚乙二醇的引入提高了载体的生物相容性和血液长循环能力;iRGD肽和HA可以与肿瘤细胞膜上的NRP-1和CD44蛋白特异性结合,而使该复合纳米粒主动靶向递送至肿瘤部位;SSBPEI-DOX可在肿瘤细胞内高浓度的谷胱甘肽还原下降解释放DOX,从而降低DOX毒性,且其可在肿瘤部位加速释放siRNA,以实现基因治疗。因此,本发明所得SSBPEI-DOX@siRNAs/iRGD-PEG-HA复合纳米粒可用于制备肿瘤靶向基因-药物。
本发明的有益效果主要体现在:
本发明所制备的SSBPEI-DOX@siRNAs/iRGD-PEG-HA复合纳米粒具有还原响应性,可在肿瘤细胞内高浓度的谷胱甘肽的还原下将二硫键改性的聚乙烯亚胺降解成低毒的低分子量聚乙烯亚胺,同时释放化疗药阿霉素,因此,其既可避免毒性大的分子聚乙烯亚胺的使用,又能实现肿瘤特异性的药物释放,从而实现基因-药物联合治疗的目的;而纳米粒中iRGD肽和透明质酸的引入可增加载体的主动靶向性,在携带siRNA和DOX进入细胞时可促进细胞对药物的摄取,实现肿瘤的主动靶向递送;纳米粒中聚乙二醇的引入可提高载体的生物相容性和血液长循环能力,实现药物的肿瘤被动靶向递送。因此,本发明所得复合纳米粒具体主/被动靶向性、生物相容性和血液长循环能力,可实现基因-药物的肿瘤靶向递送,为抗肿瘤药物筛选提供了新的途径。
附图说明
图1为本发明所述SSBPEI-DOX@siRNAs/iRGD-PEG-HA复合纳米粒的制备过程(A)、靶向给药原理(B)及反应流程(C)。
图2为实施例1所制备SSBPEI-DOX@siRNAs/iRGD-PEG-HA复合纳米粒的原子力显微镜图。
图3为通过动态光散射法测得的实施例1所制备SSBPEI-DOX@siRNAs/iRGD-PEG-HA复合纳米粒在有/无还原剂DTT存在下、随着时间变化的粒径曲线图。
图4为SSBPEI-DOX@siRNs和SSBPEI-DOX@siRNAs/iRGD-PEG-HA的凝胶阻滞分析图。
图5为不同纳米粒的溶血率对比图。
图6为A2780/DDP干细胞经不同纳米粒处理6、12、24、48、72小时后的细胞活性。
图7为A2780/DDP干细胞经不同纳米粒处理后的细胞摄取图。
图8为A2780/DDP干细胞经不同纳米粒处理后的细胞凋亡图。
具体实施方式
为了使本发明所述的内容更加便于理解,下面结合具体实施方式对本发明所述的技术方案做进一步的说明,但是本发明不仅限于此。
实施例1:
1. SSBPEI-DOX@siRNAs/iRGD-PEG-HA复合纳米粒的合成
(1)称取分子量为1200的支化聚乙烯亚胺10 g,溶解在300 mL的去离子水中得到BPEI
(2)将10 mg盐酸阿霉素溶解在含1 mM EDTA的PBS溶液中,配制成1 mol/L的DOX·HCl溶液,然后加入11.86 mg 2-亚氨基硫烷盐酸盐,在氮气保护且避光的条件下,室温下搅拌反应4小时,然后将得到的产物在超纯水中透析(MWCO 1000 Da)8小时,再经冻干处理3天,得到DOX-SH;
(3)准确称取10 g的BPEI-SH,溶解于250 mL二甲基亚砜与50 mL甲醇组成的混合溶液中,加入18.5 g DOX-SH,室温下搅拌反应48小时;将得到的产物在超纯水中透析(MWCO3500 Da)3天除去杂质,再冻干处理3天,得到暗红色SSBPEI-DOX粉末;
(4)准确称取10 g的透明质酸(HA),溶解在3 L硼酸盐缓冲液中,分别加入8.92 gNHS,14.56 g EDC与1.55 g MAL-PEG-NH
(5)将SSBPEI-DOX溶于去离子水中,配成2.56 g/L的SSBPEI-DOX水溶液,与1 mg/L的siRNA水溶液(siRNA-survivin Sense:GCAAAGGAAACCAACAAUA-dTdT;Antisense:UAUUGUUGGUUUCCUUUGC-dTdT;siRNA-Bcl-2Sense:GUACAUCCAUUAUAAGCUG-dTdT;Antisense:CAG CUUAUAAUGGAUGUAC-dTdT;siRNA-ABCG2siRNA Sense:CUGGAGAUGUUCUGAUAAA-dTdT;Antisense:UUUAUCAGAACAUCUCCAG-dTdT,序列中U代表尿嘧啶)按照体积比5:1混合,通过静电相互作用结合形成N/P比为5:1的SSBPEI-DOX@siRNAs悬浮液;取100 mL、2.56 mg/mL的iRGD-PEG-HA水溶液,将其与100 mL SSBPEI-DOX@siRNAs悬浮液(iRGD-PEG-HA与SSBPEI-DOX@siRNAs的质量比为1:1.5)共同于4℃孵育15分钟,制得SSBPEI-DOX@siRNAs/iRGD-PEG-HA。
2. 实验方法
a. 粒径分布:取4 μL所制备的SSBPEI-DOX@siRNAs/iRGD-PEG-HA复合纳米粒悬浮液滴加至新剥离的云母片中心,室温干燥后以1 Hz的扫描速度在空气中记录图像。
b. 还原响应性测试:取500 μL所制备的SSBPEI-DOX@siRNAs/iRGD-PEG-HA复合纳米粒悬浮液与DTT溶液(15 mM)孵育不同的时间,以不加DTT的组分作为对照,通过激光粒度仪测试SSBPEI-DOX@siRNAs/iRGD-PEG-HA复合纳米粒在有/无还原剂DTT存在下粒径的变化。每个样品重复测量3次,求出平均值与标准偏差。
3. 实验结果
图2为所得SSBPEI-DOX@siRNAs/iRGD-PEG-HA复合纳米粒的原子力显微镜图。由图中可见,该复合纳米粒以球形分布,分散性良好。
图3为所得SSBPEI-DOX@siRNAs/iRGD-PEG-HA复合纳米粒在有/无还原剂DTT存在下、随着时间变化的粒径曲线图。由图可见,SSBPEI-DOX@siRNAs/iRGD-PEG-HA复合纳米粒在无还原剂DTT存在下,粒子比较稳定,粒径变化不大,在加入还原剂DTT后,粒子解离,粒径逐渐变大,因而可释放出siRNA。
实施例2:SSBPEI-DOX@siRNAs/iRGD-PEG-HA的理化性质
1. 实验方法
(1)样品配制:将3.6 μL浓度为20 μM的siRNA-NC水溶液与SSBPEI-DOX水溶液按照不同的N/P(其中N/P=0.5:1,1:1,2:1,5:1,10:1)混合,于4℃环境下孵育15分钟,使两者通过静电相互作用形成SSBPEI-DOX@siRNA
(2)琼脂糖凝胶配制及凝胶电泳:称取0.3g琼脂糖置于锥形瓶,加入30mL 1×Tris-acetate-EDTA缓冲液摇匀,盖上一个小烧杯后,将锥形瓶放入微波炉中加热至琼脂糖完全溶解。将加热好的琼脂糖放在室温下冷却至60℃左右时,加入3 μL的溴化乙啶(EB),摇匀,然后将溶液转移至插好梳子的制胶板上,轻摇使溶液在制胶板上掌开形成均匀的胶层,室温下静置20分钟左右,待胶完全凝固后取掉梳子,将装有琼脂糖凝胶的制胶板内槽放入电泳槽中,倒入1×Tris-acetate-EDTA缓冲液至完全浸没凝胶板。向步骤(1)制备的样品中各加入6×RNA上样缓冲液,用移液枪取8 μL样品溶液,加到胶孔中,盖上电泳槽盖后通电,100 V进行电泳。可观察到RNA条带从负极向正极移动,待条带的移动距离为2 cm左右时,停止电泳。将凝胶放入到凝胶仪中曝光,得到图像。
2. 实验结果
所得SSBPEI-DOX@siRNA
表1 不同N/P比SSBPEI-DOX@siRNA
表2 不同W/W比SSBPEI-DOX@siRNA
图4为SSBPEI-DOX@siRNA
实施例3:SSBPEI-DOX@siRNAs/iRGD-PEG-HA血液相容性检测
1. 实验方法
(1)溶血实验:将来自雄性新西兰兔的新鲜血液收集在肝素化的离心管中,加入pH=7.4的冷PBS缓冲液稀释,以700×g离心10分钟。通过PBS缓冲液多次洗涤并离心,将红细胞从血清中分离出来。然后将红细胞重悬于PBS缓冲液中,并将其稀释成2%的红细胞溶液。分别制备SSBPEI-DOX、SSBPEI-DOX@siRNAs,SSBPEI-DOX@siRNA
(2)肿瘤细胞毒性:将待处理的A2780/DDP干细胞从培养箱中取出并置于超净工作台中,轻轻吹打收集细胞并计数后,将其稀释成浓度为8×10
2. 实验结果
图5为不同纳米粒的溶血率对比图。由图中可见,SSBPEI-DOX@siRNAs/iRGD-PEG-HA溶血率<5%,说明其具有良好血液相容性。
图6为经不同纳米粒处理后的A2780/DDP-CSCs细胞活性图。由图中可见,A2780/DDP干细胞与不同纳米粒共孵育6小时后,对细胞活力的影响没有显着差异。但SSBPEI-DOX@siRNAs/iRGD-PEG-HA处理的A2780/DDP-CSCs细胞活力随着时间的推移明显低于其他组,并且随着时间的推移差距扩大,最低达到23.73±4.71%。
实施例4:细胞对SSBPEI-DOX@siRNAs/iRGD-PEG-HA的摄取
1. 实验方法
利用流式细胞仪来证明本发明纳米粒是通过iRGD和HA介导的细胞内化途径来完成有效的摄取。其操作是将人卵巢癌干细胞A2780/DDP干细胞以2×10
2. 实验结果
图7为A2780/DDP干细胞经不同纳米粒处理后的细胞摄取情况图。由图可见,A2780/DDP干细胞经SSBPEI-DOX@siRNAs/iRGD-PEG-HA复合纳米粒处理后检测到有最强的荧光强度,而在相同条件下,细胞经SSBPEI-DOX@siRNAs/PEG-HA处理后,荧光强度明显下降,说明SSBPEI-DOX@siRNAs/iRGD-PEG-HA可更为有效的介导细胞对其的摄取,即表明iRGD肽修饰的纳米粒子可以更加精准的靶向A2780/DDP干细胞,从而增加细胞摄取。
实施例5:SSBPEI-DOX@siRNAs/iRGD-PEG-HA对肿瘤干细胞的杀伤作用
1. 实验方法
利用双凋亡实验来证明纳米粒包载的siRNA和DOX可以促进肿瘤干细胞的凋亡。其操作是将人卵巢癌干细胞A2780/DDP-CSCs以5×10
2. 实验结果
图8为A2780/DDP干细胞经纳米粒处理后的细胞凋亡图。由图中可见,使用纳米粒处理72小时之后,SSBPEI-DOX@siRNAs/iRGD-PEG-HA纳米粒处理的组别凋亡和坏死细胞的比例可以达到总数的42.9%,使用SSBPEI-DOX@siRNA
以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
- 一种脂质体修饰的阿霉素及含阿霉素的纳米粒子
- iRGD肽修饰共载姜黄素和胡椒碱脂质体及其制备方法
- 聚多巴胺修饰咪唑基纳米粒子复合纳滤膜的制备方法
