一种高浓度再生微脂的注射方法
文献发布时间:2024-04-18 19:58:26
技术领域
本发明涉及医药技术领域,尤其涉及一种高浓度再生微脂的注射方法。
背景技术
自体脂肪移植由Neuber在1893年第一次提出后,历经130年,随着技术的不断改进,已经广泛应用于整形外科领域。但术后脂肪成活率成为制约手术效果的重要因素。脂肪移植后的成活率受多种因素影响,这种机制十分复杂,从而导致吸收率难以预测。多年来学者们不断研究探索,试图找出一种标准化的安全高效的脂肪移植技术。直到1994年Coleman医生首次发表了Coleman脂肪移植技术。该技术主要包括三个部分:脂肪的获取、制备和移植。这项技术为我们后续的技术发展奠定了理论基础。依托于Coleman脂肪移植技术的标准化流程,脂肪移植术后成活率得到了极大的提高。但是脂肪成活率仍是不确定的,个体之间存在着极大差异。
脂肪间充质干细胞是存在于脂肪组织中的,具有多项分化潜能的干细胞,具有来源丰富、取材方便的优点,因此被认为是组织再生和修复的理想种子细胞。基于脂肪间充质干细胞的成脂分化能力构建组织工程脂肪,能有效提高脂肪移植的效果,为软组织的缺损重建提供了新的途径,在组织工程和再生医学领域中具有良好的应用前景。但是,目前脂肪间充质干细胞成脂分化的效率较低,而且成脂诱导时间长,难以满足临床上对脂肪组织的大量需求,限制了其在临床上的应用。
而CN 114403127 B公开了一种间充质干细胞冷藏保护液及保存方法,冷藏保护液包括如下组分:海藻糖、低分子肝素钙注射液、右旋糖酐40氯化钠注射液、人血白蛋白、复方电解质注射液。该冷藏保护液不含有DMSO等毒理成分,成分均为国家批准的注射级药辅材料,可直接静脉回输。本发明采用预冷式冷藏保存方法,能使细胞和保护液快速进入低温平衡状态而减少细胞损害,可用于间充质干细胞4℃冷藏条件下的长时间保存,并便于运输,减少了干细胞产品对地域的依赖性。
CN 110755454 B公开了一种间充质干细胞抗肝纤维化注射液,该注射液由45%-50%的复方电解质注射液、45-50%羟乙基淀粉200/0 .5氯化钠注射液、3%-7%人血白蛋白注射液、0 .2%-0 .4%榄香注射液、0 .2-0 .4%羟喜树碱、0 .3-0 .5%鹿瓜多肽注射液组成,其中人血白蛋白注射液的浓度为20%,复方电解质注射液和羟乙基淀粉200/0 .5氯化钠注射液的体积比为1:1,每ml注射液中含有人脂肪间充质干细胞1×10
因此,亟需开发一款能够长期储存,浓度高,效果好的脂肪细胞注射液产品,从而满足市场的需求,同时在此注射液产品的基础上,开发一种广泛应用于医疗美容的高浓度再生微脂的注射方法,为广大医美爱好者带去福音。
发明内容
为了解决上述问题,本发明首先提供一种高浓度再生微脂的注射液,所述注射液包含人脂肪间充质干细胞、复方电解质注射液、羟乙基淀粉200/0.5氯化钠注射液、人血白蛋白注射液和海藻糖,以及任选地的低分子肝素钙注射液。
优选的,所述复方电解质注射液为43.4%-50%(V/V)、羟乙基淀粉200/0.5氯化钠注射液为43.4%-50%(V/V)、人血白蛋白注射液0-10%(V/V)和1.5%-3%海藻糖(w/V)。
优选的,所述复方电解质注射液为43.4%-50%(V/V)、羟乙基淀粉200/0.5氯化钠注射液为43.4%-50%(V/V)、人血白蛋白注射液0-10%(V/V)和1.5%-3%海藻糖(w/V)。
优选的,所述复方电解质注射液为43.4%-50%(V/V)、羟乙基淀粉200/0.5氯化钠注射液为43.4%-50%(V/V)、人血白蛋白注射液0-10%(V/V)和1.5%-3%海藻糖(w/V)。
优选的,所述人脂肪间充质干细胞的制备方法为:使用EPO感染脂肪干细胞,同时使用诱导培养基诱导其分化,所述诱导培养基的组分包含10% FBS(胎牛血清)的低糖DMEM、脂肪酸、甘氨酸、缬氨酸和半胱氨酸。
本发明的另一方面提供一种诱导培养基,其组成为:10% FBS(胎牛血清)的低糖DMEM+脂肪酸+甘氨酸+缬氨酸+半胱氨酸。
其中甘氨酸的浓度为40-70mM,在一个具体实施方式中,其浓度可以为45mM、50mM、55mM、60mM、65mM。
其中缬氨酸和半胱氨酸的浓度为10-20mM,在一个具体实施方式中,其浓度可以为11mM、12mM、13mM、14mM、15mM、16mM、17mM、18mM、19mM。
其中脂肪酸的浓度为0.5-2mM,在一个具体的实施方式中,其浓度为0.6mM、0.7mM、0.8mM、0.9mM、1.0mM、1.1mM、1.2mM、1.3mM、1.4mM、1.5mM、1.6mM、1.7mM、1.8mM、1.9mM。
其中脂肪酸可以为棕榈酸、油酸、硬脂酸的一种或多种。
优选的,所述注射液不含低分子肝素钙注射液。
本发明还提供一种高浓度再生微脂的注射方法,所述方法为向目标对象注射前文所述的注射液。
优选的,所述对象为人或非人动物。
优选的,所述方法为非治疗目的。
最后,本发明还提供一种注射液或注射方法的应用,其特征在于,所述应用为以下一种或多种:(a)整容或整形;(b)皮肤修复;(c)脂肪获取、制备和移植;(b)减脂或增脂。
本发明的一种高浓度再生微脂的注射方法,具有以下优势:
1、采用Ad-EPO诱导脂肪组织的成活,提高移植脂肪的成活质量。
2、使用改进诱导培养可显著增加脂肪干细胞生长速度和成脂化率。
3、该方法操作简单,且无后遗症,在自体脂肪移植上,尤其是高浓度再生微脂的注射上具备良好的应用前景。
4、通过合理的组分配比,制备了稳定性较好的注射液,解决了细胞运输时间短、活力低的问题,增加了注射液保存及运输过程稳定性。本发明注射液24h内细胞活率维持在99%以上,48h后干细胞活率仍然高达97%,极大提高了临床使用安全性,同时提高产品的注射效果。
附图说明
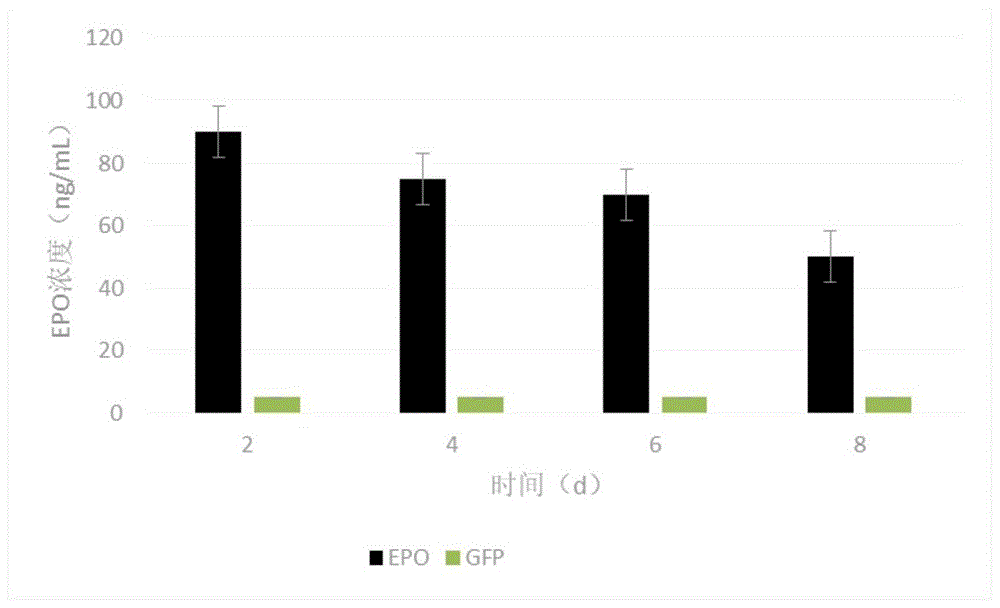
图1为用ELISA法检测上清中EPO的表达情况图;
图2为不同培养时间的OD值;
图3为脂肪移植物重量值;
图4为细胞活力分级结果。
具体实施方式
下面结合实施例对本发明做进一步的描述。这些实施例仅是对本发明的典型描述,但本发明不限于此。下述实施例中所用的试验方法如无特殊说明,均为常规方法,所使用的原料,试剂等,如无特殊说明,均为可从常规市场等商业途径得到的原料和试剂。
实施例1 腺病毒基因表达载体构建
重组腺病毒的构建过程如下:首先构建携带红细胞生长素基因的穿梭质粒PXCJL1-CMV/pA-EPO,然后LipofectAMIN介导该质粒以及5型腺病毒基因组的质粒GT4050共感染293细胞,采用细胞内质粒DNA同源重组法构建重组腺病毒Ad-EPO,并以噬斑分析法筛选单克隆重组腺病毒,PCR法鉴定阳性克隆之后进行扩增。
实施例2 ADSCs细胞分离提取
(1)大鼠使用0.1%戊巴比妥钠经腹腔注射麻醉后,电动剃毛器和 100mg/mL 硫酸钠脱毛剂给予双侧腹股沟区及下腹部区脱毛备皮。大鼠取仰卧位,四肢及头部固定于手术台上,常规消毒,铺无菌单;先于腹股沟区切开该处皮肤,显露皮下脂肪垫,以眼科剪刀切取约 1ml 脂肪组织。再于下腹部行纵向切口,暴露腹直肌及腹膜,剪刀纵形钝性分离,暴露双侧附睾,以眼科剪刀切取附睾周围组织脂肪约 1ml;
(2)用含有青链霉素(100μ/mL)的 PBS 液反复冲洗脂肪组织,在超净台下剔除脂肪表面的肉眼可分辨的血管、筋膜等结缔组织。对于来自腹股沟的脂肪需要再平行于大血管的走向切开脂肪,剔除肉眼可见的椭圆形的淋巴结。用眼科剪充分剪碎至约为 1 mm
(3)把剪碎的脂肪组织移入含有 0.1%的I型胶原酶消化液的离心管中,消化液体积为组织的 4 倍,在摇床上以 37℃消化 60 min 后,再次转移到超净台下,用 PBS轻轻吹打使细胞充分从组织团块上脱离下来;
(4)将上述细胞悬液以 1000 rpm/min 离心 5 min,吸弃上层脂肪和上清液,再加入 PBS 缓冲液重悬细胞再次离心洗涤,弃上清后向离心后的底部沉淀加入 10% FBS(胎牛血清)的低糖 DMEM 的培养液重悬细胞。细胞以 1×10
(5)细胞生长达到培养瓶底 80%-90%时,弃瓶内培养液,加入 0.25%胰酶 (含0.01%EDTA);显微镜下见细胞收缩呈圆形,大部分细胞开始从瓶底壁上脱落时,向培养瓶内加入等量的含有 10%血清的低糖 DMEM 培养基,轻轻吹打,使细胞完全脱壁;把细胞悬液置入离心管中以 1000 rpm/min 的速度离心去除上清液,用基础培养基重悬细胞,细胞悬液按 1:3 比例传入新的培养瓶中。取第 3 代或第 4 代 ADSCs 用于实验。
实施例3 脂肪干细胞中EPO表达情况
6孔内的脂肪干细胞感染Ad-EPO,病毒滴度为1.6X10
取原代脂肪干细胞接种于12孔板内,6X10
实施例4 ADSCs 诱导分化
诱导过程简述如下:
(1)配置成脂诱导培养基:
基础培养基:10% FBS(胎牛血清)的低糖 DMEM
改进培养基:10% FBS(胎牛血清)的低糖 DMEM+棕榈酸+甘氨酸+缬氨酸+半胱氨酸。其中甘氨酸的浓度为40-70mM,缬氨酸和半胱氨酸的浓度为10-20mM,棕榈酸的浓度为0.5-2mM。
(2)当细胞生长到铺满培养瓶的 90%时,用 0.25%胰酶进行消化,消化后的间
质干细胞按照 2×104 /cm2 的细胞密度接种于 2ml/孔完全培养基的六孔板中;
在 37℃,5% CO2的培养箱中培养,每 3-4 天换液一次,当细胞融合度达到100%时将完全培养基吸走,更换培养基继续培养。于各时间点(2d,4d,6d,8d,10d)MTT 检测细胞生长情况,实验分组如表1所示。
表1 脂肪干细胞诱导分组
成脂分化率的测定:然后分别在诱导培养10天后进行油红0染色,然后分别测定各分组的成脂分化率,具体结果见表2
测定方法:吸出培养基,用10%中性甲醛固定30min,蒸馏水冲洗,室温下用油红0染色20min,弃去多余的染料,在倒置显微镜下观察拍照,随机记录3个视野的染色阳性细胞数以及细胞总数,然后计算成脂分化率。
表2 诱导7天后的成脂分化率
通过上表中数据可以得知,按照Ad-EPO1-2中的方法诱导培养10天后的成脂率均高于Ad-GFP-1-2中的成脂率,尤其是按照Ad-EPO-1中的方法诱导培养后的成脂率最,纯度更高。表明本发明使用Ad-EPO配合改进诱导培养基干细胞体外诱导方法科学合理,诱导效果更好。
实施例5 裸鼠脂肪组织生长情况
将50只裸鼠随机分成五组,每组10只,如表3所示。
表3 裸鼠实验分组
AD-EPO-1:脂肪 1 mL+20 ul Ad-EPO/只 滴度:4X10
AD-EPO-2:脂肪 2 mL+20 ul Ad-EPO/只 滴度:4X10
AD-GFP-1:脂肪 1 mL+20 ul Ad-GFP/只 滴度:4X10
AD-GFP-2:脂肪 2 mL+20 ul Ad-GFP/只 滴度:4X10
生理盐水组:脂肪 1 mL+20 ul 生理盐水/只 生理盐水 0.9%氯化钠
用注射器将脂肪颗粒注射至裸鼠皮下,常规喂养小鼠,于10周后处死裸鼠,进行移植物解剖,并应用电子天平对标本进行称重。
表4 裸鼠脂肪组织称重
Ad-EPO组标本组织均生长良好,且体积较对照组大。应用电子天平称重结果显示(表3)8周后裸鼠头皮下脂肪移植物标本重量Ad-EPO-1组最高,对五组数据进行一维方差分析,Ad-EPO组与Ad-GFP组存在显著差异(P<0.01),且Ad-EPO-1与Ad-EPO-2存在显著差异(P<0.05)。对五组对三组脂肪移植物重量值应用SPSS13.0 进行统计学处理,做条形图,均值±标准差,结果如图3所示。
可见,在EPO的诱导下,脂肪干细胞的生长和分化均有显著的增强,并且使用改进的培养基培养后,对脂肪干细胞的生长和增殖也有显著增强。
实施例6 脂肪细胞活力检测
对脂肪注射10周后取出的每个标本进行病理切片HE染色观察,组织经石蜡固定,苏木精和伊红(Hemaloxylin and eosin,HE)染色,病理切片阅读由一位病理科老师采用盲法阅片,每组标本任选8张切片,每张切片任选5个高倍视野(X40)并制定评价项目:有活力的脂肪细胞(脂肪细胞均匀),评价标准采用 0-5的分级方法,0=没有,1=少部分表现,2=少部分到中等程度之间,3=中等程度,4=中等程度到多之间,5=多。每张切片的5个视野的值求平均值,这些数值作为评价裸鼠脂肪成活程度。
细胞活力分级结果如图4所示,五组脂肪移植物有活力脂肪细胞分级Ad-EPO-1组分级最高,与对照组差异有显著性(P<0.05)。表明本使用Ad-EPO的诱导以及改进的培养基培养得到的脂肪细胞活力显著增强。
实施例7 注射液制备
一、制备细胞保存和诱导液
(1)依据表5的组分和比例,在无菌条件下,依次取相应的比例的组分,混匀置0-8℃冷藏存储。
组分来源:
复方电解质注射液(商品名称:勃脉力A,上海百特医疗 用品有限公司,国药准字H20000475);
羟乙基淀粉200/0.5氯化钠注射液(商品名称:贺斯,北京费森尤斯卡比医药有限公司,国药准字H20030494,规格型号 500ml:15g羟乙基淀粉200/0.5与氯化钠4.5g);
人血白蛋白注射液(成都蓉生,国药准字S10940024 ,50ml:10g ,20%);
海藻糖(注射级)为Hayashibara生产,规格100g;
低分子肝素钙注射液为葛兰素史克 (天津) 有限公司生产 ,规格为 0 .4 m l :4100AXaIU;
二、制备注射液
(1)从细胞库液氮中取出含有实施例6所述的使用Ad-EPO的诱导以及改进的培养基培养得到的脂肪细胞的冻存管;
(2)将冻存管立即投入37℃ 温水中轻轻晃动,直至冻存液完全融解;
(3)用75%酒精擦拭冻存管,将冻存管中细胞悬液转移至加含有9mL生理盐水的15ml离心管,轻轻吹打均匀。可将多个同一批次的冻存管内细胞悬液及其洗涤液合并入1个50mL离心管内(注意:合并的细胞须为同一批次的,不同批次细胞禁止合并),同时吸出少许细胞用于细胞计数;
(4) 离心洗涤:1000rpm离心8min,弃上清液;
(5)根据细胞计数结果,通过上述配置的保存液重悬细胞,调整每ml注射液中含有间充质干细胞1×10
制备好的注射液需要在0-8℃避光环境下保存和运输,自分装之时起有效期为48小时。
表5 注射液组分和比例
效果对比
将上述实施例中配置的注射液1-8以及新鲜配置的每ml含有实施例6干细胞1×10
表格6 9种注射液中细胞活率对比
表格2可以看出,本发明的优选的第3组注射液,对干细胞保存效率明显高于其他,可以用于制备注射液。
应当理解的是,上述实施方式仅为达到目的的一种方式,本发明的保护范围不仅为上述实施方式,对于本领域技术人员来说,可以很容易的改变一种或者多种元件的结构特点来达到相同试验目的,皆因涵盖在本发明的保护范围之内,故本发明的保护范围应当以权利要求书的保护范围为准,即把权利要求的相同含义和范围内的所有变化包含在本发明之内。
- 一种脂溶性药物亚微囊葡萄糖注射液及其制备方法
- 一种注射用尼麦角林脂微球制剂及其制备方法
