一种橡胶树成熟体细胞胚的复幼及植株再生方法
文献发布时间:2024-04-18 19:58:30
技术领域
本发明属于植物组织和细胞工程技术领域,具体涉及一种橡胶树成熟体细胞胚的复幼及植株再生方法。
背景技术
橡胶树(Hevea brasiliensis Muell.Arg.)属大戟科橡胶树属,是多年生的异花授粉乔木,其所产的天然橡胶是重要的工业原料和物资。而通过体细胞胚发生途径来获得再生植株是植物组培苗工厂化生产和遗传转化的重要方法。
现有技术中,橡胶树经体细胞胚发生途径获得再生植株主要采用1.花药培养、2.内珠被培养和3.次生体胚循环增殖。
1.橡胶树花药培养技术是以处于单核期的橡胶树雄花为外植体,剥离雄蕊,接种于诱导愈伤培养基中诱导愈伤组织,再将愈伤组织接种于诱导体胚培养基诱导体胚发生,最后将成熟胚状体接种于植株再生培养基中诱导出完整小植株。2.橡胶树内珠被培养技术是以橡胶树授粉后45-75d天的幼果中的内珠被为外植体,诱导愈伤组织,再经愈伤组织分化体胚,最后由成熟的胚状体分化成植株。3.次生体胚循环增殖是以花药或内珠被诱导的初生胚为外植体,将胚状体切成2-3mm小块,诱导次生胚,此过程循环,直至获得足够量胚状体,最后诱导植株再生。
以上所说的再生技术体系均存在以下缺陷:①花药、内珠被再生体系:外植体的来源易受到季节和时间的制约,无法做到全年培养。橡胶树每年有三个花期,分别为春花、夏花和秋花,每次进行花药培养的时间有限。一般来说,橡胶树的春花的自然授粉的比率比夏花、秋花要高,因此内珠被的取材时间一般为春花自然授粉后45-75d也就是在中国海南每年的5月中旬至6月中旬为采样进行内珠被培养的最佳时期,这种较短的取材时间严重制约了内珠被的培养。(孙爱花等,橡胶树花药的培养,植物生理学通讯,2006,42(4):785-789;黄天带等,橡胶树内珠被研究进展,生命科学研究,2011,15(2):176-183)。②次生体胚循环增殖体系:次生体胚在室内扩繁逐渐累积激素,可能造成变异。③现有次生体胚循环增殖过程中,运用胚状体扩繁方法的增殖效率仅为8倍(利用胚状体快速繁殖巴西橡胶树自根幼态无性系的方法,CN101138326B,华玉伟等),繁殖系数还有待提高。
由此可见,上述缺点制约了橡胶树工厂化生产的成本和遗传转化体系的建立,因此,在橡胶树中建立更加高效的体细胞胚胎发生技术体系是本领域技术人员亟待解决的技术问题。
发明内容
本发明的目的在于提供一种橡胶树成熟体细胞胚的复幼及植株再生方法,以发育正常约1-1.5cm的子叶平展的成熟胚为外植体,通过增加一步2,4-D浸摇培养,再将其分割为小胚块并划破表皮更利于诱导愈伤组织,从而对次生体胚循环增殖途径进行优化。本发明的方法不受采样时间和季节的限制,取材方便,增殖系数高,可以完整保持母本植株的遗传稳定性。
为实现上述目的,本发明提供一种橡胶树成熟体细胞胚的复幼及植株再生方法,具体包括以下步骤:
(1)胚体选择:挑选发育正常的、颜色为淡黄色、大小为1-1.5cm的子叶平展的成熟胚体;
(2)胚体预培养:将选取的成熟胚体放入浓度为100mg/L的2,4-D溶液中,暗室培养,得到透光性增强且较为柔软状态的体胚;
(3)愈伤组织诱导:取出预培养后的成熟胚体,切块、划破各胚块表皮,置于愈伤组织诱导培养基中,进行暗培养,得到黄色且结构较为疏松的颗粒状组织;
(4)愈伤组织的继代:将步骤(3)得到的疏松的颗粒状组织接种于愈伤组织诱导培养基中,进行暗培养,得到淡黄色且结构较为致密的颗粒状组织;
(5)次生体胚诱导:将步骤(4)得到的致密的颗粒状组织接种于胚状体诱导培养基中,进行暗培养,得到胚状体;
(6)植株诱导:将得到的成熟胚状体接种于植株诱导培养基中,光照培养,即可得到橡胶树再生植株。
在一优选的实施方式中,所述步骤(2)中,所述成熟胚体和2,4-D溶液的质量体积比为1g:(20-30)ml。
在一优选的实施方式中,所述步骤(2)中,所述暗室培养条件为:在23-27℃的暗室中,以120-160rpm在摇床上浸摇2-4d。本发明中,使用特定浓度的2,4-D溶液浸摇成熟体胚,从而获得恢复幼态组织状态的外植体,如果浓度过高或多低,其诱导愈伤组织的外植体数量均较少,效率较低。
在一优选的实施方式中,步骤(3)中,选取的橡胶树无菌培养体胚,其发育时期为成熟子叶期的体胚。
在一优选的实施方式中,步骤(3)中,所述切块后的尺寸为3-5mm的胚块。如果胚块过小在后期培养过程中存活率较低,会降低繁殖系数;如果胚块过大在后期培养过程中伤口部位组织不进行脱分化形成愈伤组织而是以胚的状态继续生长还会造成材料浪费,因此,本发明中设计切块后胚块尺寸为3-5mm。
在一优选的实施方式中,步骤(3)中,所述划破各胚块表皮的操作可采用本领域技术人员所采用的任意方式,在胚块表面产生浅表伤口即可,例如以针刺划破各胚块表皮。可划出多道伤口,划破划伤胚块表皮即可。
在一优选的实施方式中,所述步骤(3)和步骤(4)中,所述愈伤组织诱导培养基以MS培养基为基础培养基,附加萘乙酸0.5-1.5mg/L,激动素1-2mg/L,天冬酰胺0.3g/L,肌醇0.1g/L,蔗糖50-70g/L,椰子水5%(V/V),Phytagel 2.2g/L;调培养基的pH至5.8-6.2。2,4-D作为生长素对于组织培养中的细胞增殖有积极影响,在本发明中由于额外进行了胚体预培养步骤,将胚体浸泡在高浓度的2,4-D溶液中浸摇2-4d,可以在胚块表面形成原形成层,制造出高压模型,利于出胚,因此,本发明所用的愈伤组织诱导培养基中无需额外加入生长素。
在一优选的实施方式中,
所述步骤(3)中,所述暗培养条件为:在23-27℃下,暗培养25-35d;
所述步骤(4)中,所述暗培养条件为:在23-27℃下,暗培养20-30d。
在一优选的实施方式中,所述步骤(5)中,所述胚状体诱导培养基是以MS培养基为基础培养基,附加2,4-D 0.05-0.07mg/L,吲哚乙酸0.5-1.5mg/L,激动素2-4mg/L,赤霉素0.4-0.6mg/L,肌醇0.1g/L,蔗糖50-70g/L,椰子水5%(V/V),活性炭0.1%(W/V),Phytagel2.2g/L,补充蒸馏水至1L;调培养基的pH至5.8-6.2。
在一优选的实施方式中,所述步骤(5)中,所述暗培养条件为:在24-28℃条件下进行暗培养,培养50-60d。
在一优选的实施方式中,所述步骤(6)中,所述植株诱导培养基是以MS培养基为基础培养基,附加细胞激动素0.2-0.5mg/L,赤霉素2-3mg/L,吲哚乙酸0.1-0.3mg/L,肌醇0.1g/L,活性碳0.1%(W/V),蔗糖30-50g/L,椰子水5%(V/V),Phytagel 2.2g/L,补充蒸馏水至1L;调培养基的pH至5.8-6.2。
在一优选的实施方式中,所述步骤(6)中,光照培养条件为:在24-28℃,光源采用光源组合盒,所述光源组合盒由白光和红光的LED灯珠按7:1数量共组成84个LED灯珠,总光照强度为3500-3800Lux,光照周期为12/12h(光照/黑暗)的光照条件下培养30-40d。
与现有技术相比,本发明所提供的一种橡胶树成熟体细胞胚的复幼及植株再生方法,具有如下优点:
1、本发明中,所用的外植体来源不受采样季节限制,可以全年不间断的进行橡胶树试管苗生产,克服了现有技术中,对外植体取材时间和季节上的制约。
2、本发明中所用的外植体取材方便,材料丰富,可以完整保持母本植株的遗传稳定性,增殖系数高,尤其适合大规模培育。
3、本发明还改进了一种新型的橡胶树体胚发生步骤,为橡胶树自根幼态无性系规模化繁育及转基因育种提供更高效的组培体系,对我国橡胶树产业发展及基因育种具有重要意义。
附图说明
从下面结合附图对本发明实施例的详细描述中,本发明的这些和/或其它方面和优点将变得更加清楚并更容易理解,其中:
图1为本发明实施例步骤1所用胚体实物图;
图2为本发明实施例步骤2胚体经预培养后的实物图;
图3为本发明实施例步骤3针刺划破胚块表皮实物图,其中,红色箭头为针刺划破位置;
图4为本发明实施例步骤3诱导得到的愈伤组织;
图5为本发明实施例步骤4诱导得到的球形胚;
图6为本发明实施例步骤5诱导得到的次生体胚;
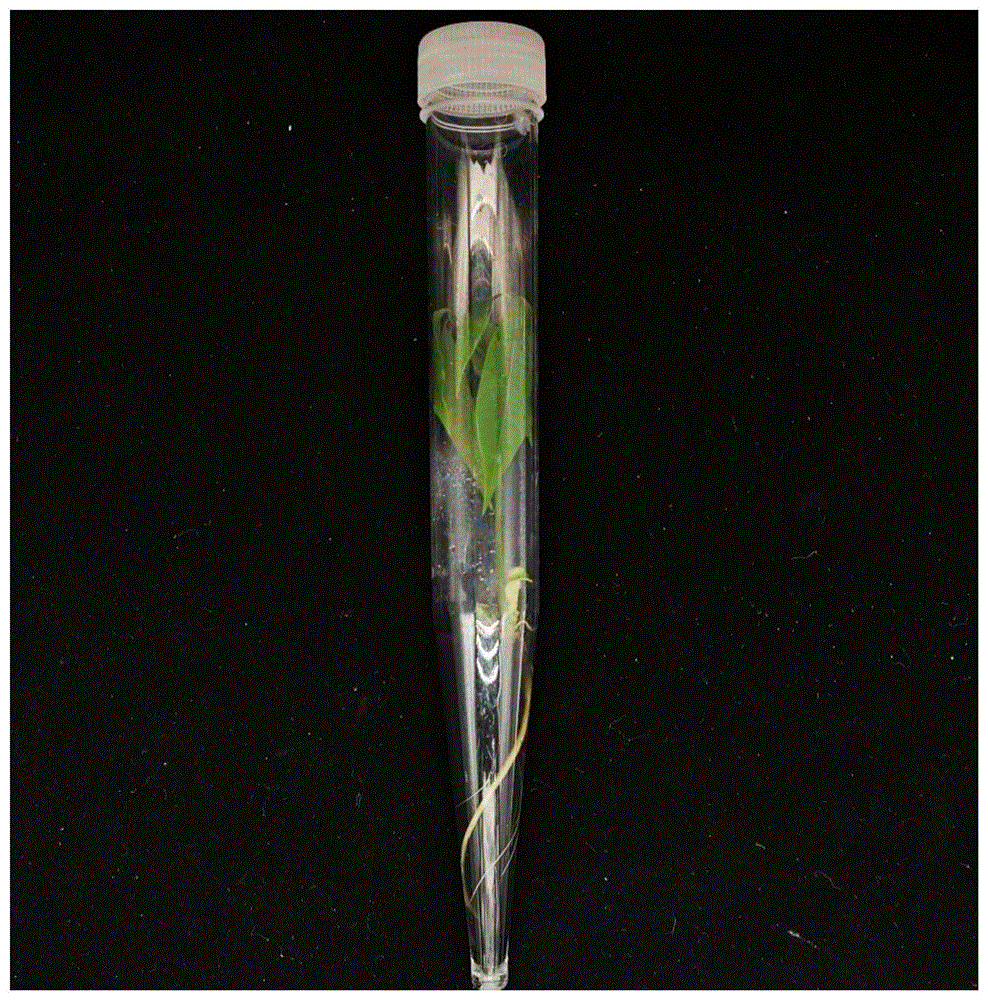
图7为本发明实施例步骤6得到的再生植株;
具体实施方式
若未特别指明,实施例中所用技术手段为本领域技术人员所熟知的常规手段,所用原料均为市售商品。
除非另有特别说明,本发明中用到的各种原材料、试剂、仪器和设备等均可通过市场购买得到或者可通过现有方法制备得到;
本实施例中,所用的橡胶树体胚名称为:无菌橡胶树体胚商业化品种73397,来源为:中国热带农业科学院橡胶研究所天然橡胶新型种植材料创新基地。
实施例
(1)胚体选择:选取无菌橡胶树体胚商业化品种73397,挑选发育正常的、颜色为淡黄色、大小为1-1.5cm的子叶平展的成熟胚体;
(2)胚体预培养:将选取的成熟胚体以质量体积比1g:20ml放入浓度为100mg/L的2,4-D溶液中,暗室培养,即在25℃的暗室中,以140rpm在摇床上浸摇3d,得到透光性增强且较为柔软状态的体胚;
(3)愈伤组织诱导:取出预培养后的成熟胚体,切成3-5mm的胚块、划破各胚块表皮,置于愈伤组织诱导培养基中,在25℃的暗室中,培养30d,得到黄色且结构较为疏松的颗粒状组织;
(4)愈伤组织的继代:将步骤(3)得到的疏松的颗粒状组织接种于愈伤组织诱导培养基中,在25℃的暗室中,培养25d,得到淡黄色且结构较为致密的颗粒状组织;
步骤(3)和(4)所用愈伤组织诱导培养基以MS培养基为基础培养基,附加萘乙酸1.5mg/L,激动素2mg/L,天冬酰胺0.3g/L,肌醇0.1g/L,蔗糖70g/L,椰子水5%(V/V),Phytagel 2.2g/L;调培养基的pH至5.8。
(5)次生体胚诱导:将步骤(4)得到的致密的颗粒状组织接种于胚状体诱导培养基中,在26℃的暗室中,培养55d,得到胚状体;
其中,所用胚状体诱导培养基是以MS培养基为基础培养基,附加2,4-D0.05mg/L,吲哚乙酸1mg/L,激动素2mg/L,赤霉素0.6mg/L,肌醇0.1g/L,蔗糖50g/L,椰子水5%(V/V),活性炭0.1%(W/V),Phytagel 2.2g/L,补充蒸馏水至1L;调培养基的pH至5.8。
(6)植株诱导:将得到的成熟胚状体接种于植株诱导培养基中,光照培养,即可得到橡胶树再生植株;
其中,光照培养条件为:在26℃环境中以光源组合盒为光源,光源组合盒具体由白光和红光的LED灯珠按7:1数量共组成84个LED灯珠,总光照强度为3600Lux,光照周期为12/12h(光照/黑暗)的光照条件下培养35d;
所用植株诱导培养基是以MS培养基为基础培养基,附加细胞激动素0.5mg/L,赤霉素3mg/L,吲哚乙酸0.3mg/L,肌醇0.1g/L,活性碳0.1%(W/V),蔗糖50g/L,椰子水5%(V/V),Phytagel 2.2g/L,补充蒸馏水至1L;调培养基的pH至5.8。
本实施例中,愈伤发生率为71.43%、胚块再生体胚数为30±7个、再生体胚增殖倍数为30倍。
对比例
1.不同发育时期橡胶体胚对胚块诱导愈伤的影响
根据橡胶树体胚形态进行分类,可划分为五个时期原胚期、球形胚期、心形胚期、鱼雷胚期、子叶胚期。由于原胚期、球形胚期、心形胚期体胚存在的时间较为短暂,取材的难易程度上不如其他时期容易。因此,选取鱼雷胚期、子叶胚期测试橡胶体胚对胚块诱导愈伤的影响,结果如表1所示。
表1不同发育时期橡胶体胚对胚块诱导愈伤的影响
由表1可以看出,子叶胚期的体胚做体胚循环体增殖,可获得相较于其他时期更高的愈伤发生率。而且,子叶胚期属于橡胶树体胚生长的最后一个阶段,处在这一阶段的橡胶树体胚具有易获得、颜色淡黄、子叶平展等特征,更适宜培育。
2.不同预培养时间对胚块诱导愈伤组织发生影响
选取发育正常的胚,颜色为淡黄色,大小适中约1-1.5cm的子叶平展的成熟胚。按质量体积比为1g:25ml将选取的成熟胚放入含有100mg/L的2,4-D溶液中,置于暗培养室140rpm的室温(25℃)摇床上浸摇1d、3d、5d。其结果如表2所示。
表2不同预培养时间对胚块诱导愈伤组织发生影响
由表2可以看出,预培养3d愈伤诱导率最高,达70%以上。由于胚状体浸泡在高浓度的2,4-D溶液中,且在摇床上浸摇2-4d,在胚状体表面形成了原形成层,若预培养时间太短(如1d),原形成层没有出现,时间过久(如5d),原形成层则分化成往球形胚发展,反而降低愈伤发生率。
3.不同预培养溶液配比对胚块诱导愈伤组织发生影响
选取发育正常的胚,颜色为淡黄色,大小适中约1-1.5cm的子叶平展的成熟胚。按质量体积比为1g:25ml将选取的成熟胚放入含有100mg/L 2,4-D溶液、100mg/L IAA溶液、50mg/L 2,4-D+50mg/L IAA溶液中,置于暗培养室140rpm的室温(25℃)摇床上浸摇3d。其结果如表3所示。
表3不同预培养溶液配比对胚块诱导愈伤组织发生影响
根据表3数据得知,以100mg/L 2,4-D溶液作为预培养溶液,在后期愈伤诱导阶段的愈伤诱导率最高,究其原因之一可能在于IAA为较易分解的激素,在摇的过程会分解,导致激素浓度下降,从而影响效果。因此,本发明方案选择100mg/L 2,4-D溶液作为预培养溶液。
4.不同胚块大小对诱导胚块愈伤组织发生影响
选取发育正常的胚,颜色为淡黄色,大小适中约1-1.5cm的子叶平展的成熟胚。按质量体积比为1g:25ml将选取的成熟胚放入含有100mg/L的2,4-D溶液中,置于暗培养室140rpm的室温(25℃)摇床上浸摇3d,后取出将其切为1-3mm、3-5mm、5-7mm大小的胚块并针刺划破表皮。其结果如表4所示。
表4不同胚块大小对诱导胚块愈伤组织发生影响
由表4可以看出,胚块大小为3-5mm的愈伤诱导率最高,可以达70%以上。1-3mm的胚块过小在后期培养过程中存活率较低,5-7mm的胚块过大在后期培养过程中伤口部位组织不进行脱分化形成愈伤组织而是以胚的状态继续生长。
5.不同愈伤诱导培养基对诱导愈伤发生影响:
选取发育正常的胚,颜色为淡黄色,大小适中约1-1.5cm的子叶平展的成熟胚。按质量体积比为1g:25ml将选取的成熟胚放入含有100mg/L 2,4-D溶液中,置于暗培养室140rpm的室温(25℃)摇床上浸摇3d,取出预培养后的成熟胚,将其切块和针刺划破胚块表皮,置于实施例1所述诱导愈伤培养基(A)、在(A)基础上添加15mg/L 2,4-D的诱导愈伤培养基(B)中暗培养30d,其结果如表5所示。
表5不同愈伤诱导培养基对诱导愈伤发生影响
由表5可以看出,A、B两种培养基诱导的愈伤组织发生率具有显著性差异,A培养基的愈伤发生率要显著性的高于B培养基,A培养基诱导愈伤生长量上要高于B培养基。由此可见,虽然A、B两种培养基均可诱导出愈伤组织,但B培养基在加入2,4-D的基础上诱导愈伤发生效果反而不及未加入2,4-D的培养基A。
6.增加预培养过程的次生体胚循环途径增殖效率:
选取发育正常的胚,颜色为淡黄色,大小适中约1-1.5cm的子叶平展的成熟胚。按质量体积比为1g:25ml将选取的成熟胚放入含有100mg/L 2,4-D溶液中,置于暗培养室140rpm的室温(25℃)摇床上浸摇3d,取出预培养后的成熟胚,将其切块和针刺划破胚块表皮,置于诱导愈伤培养基中暗培养30d,将得到的疏松的颗粒状组织接种于继代培养基中,进行暗培养25d,得到淡黄色且结构较为致密的颗粒状组织;接种于胚状体诱导培养中,在26℃条件下进行暗培养,培养55d,得到胚状体。所用培养基和培养条件均与实施例完全一致,将上述实验重复三次,每次实验设三组重复,评价其增殖效率,其结果如表6所示,胚状体如图6所示。
综上,多组实验可以看出本发明提供的技术方案可以稳定、高效的获得橡胶树植株,不受采样时间和季节的限制,取材方便,增殖系数高,为橡胶树自根幼态无性系规模化繁育及转基因育种提供更高效的组培体系。
前述对本发明的具体示例性实施方案的描述是为了说明和例证的目的。这些描述并非想将本发明限定为所公开的精确形式,并且很显然,根据上述教导,可以进行很多改变和变化。对示例性实施例进行选择和描述的目的在于解释本发明的特定原理及其实际应用,从而使得本领域的技术人员能够实现并利用本发明的各种不同的示例性实施方案以及各种不同的选择和改变。本发明的范围意在由权利要求书及其等同形式所限定。
- 一种橡胶树试管苗无菌根体细胞胚发生植株再生方法
- 一种橡胶树试管苗无菌根体细胞胚发生植株再生方法
