ASIC1在制备神经病理性疼痛治疗药物中的应用
文献发布时间:2024-04-18 19:58:53
技术领域
本发明属于医学技术领域,具体涉及ASIC1在制备神经病理性疼痛治疗药物中的应用。
背景技术
神经病理性疼痛是一种由神经系统原发性损伤和功能障碍引起的慢性痛。其临床特点是顽固性强,发病率高,病程长,痛觉过敏在数周、数月乃至数年内仍然持续存在。目前治疗慢性神经病理性疼痛的关键难题在于其发生、发展机制还不完全清楚。过去很多年的研究,都集中在神经元,发现初级感觉神经元兴奋性增加导致的外周敏化,以及炎性介质作用于中枢神经元产生的中枢敏化,是神经病理性痛发生和维持的重要病理基础。但近些年越来越多的证据表明:在神经病理性痛的发生、发展中,神经胶质细胞发挥着重要的作用。神经胶质细胞主要包括中枢神经系统的胶质细胞:星型胶质细胞,少突胶质细胞以及小胶质细胞;以及周围神经系统的胶质细胞:施万细胞和卫星细胞。研究表明:在脑和脊髓中,神经损伤后,激活的小胶质细胞及活化的星型胶质细胞可释放多种疼痛相关的细胞因子,趋化分子等物质调节神经元的兴奋性,促进慢性神经病理性痛的发生、发展和维持;而抑制小胶质细胞和星形胶质细胞的激活,可阻断或缓解多种慢性神经痛。在周围神经系统中,卫星细胞包绕着背根神经元,其激活早于中枢神经系统的神经胶质细胞,在神经病理性痛的发生过程中,起着重要作用。然而,施万细胞在周围神经损伤后,可分泌多种与疼痛相关的促炎/抑炎因子,但其在神经病理性痛发生、发展及维持过程中的作用及可能机制,目前仍知之甚少。
施万细胞作为周围神经系统特异的胶质细胞,支持、保护轴突,包绕其形成髓鞘。研究表明,施万细胞的功能极其活跃,在周围神经系统发育过程中,它通过分泌神经营养因子和信号分子,产生细胞外基质和细胞黏附分子等,在营养神经元、调节神经信号传导、维持内环境稳定等多方面都起着重要作用;在神经损伤的病理情况下,施万细胞可以清除变性崩解物,分泌促进轴突生长的多种营养因子,对轴突起黏附趋化作用等,形成对修复再生有利的微环境,促进损伤轴突的再生。而稳定的胞外微环境,尤其是pH,对细胞发挥正常的生理功能至关重要,正常生理环境下,细胞受到各种H
酸敏感离子通道(Acid-sensing ion channels, ASICs)是一类能够在很大pH范围内感受胞外H
发明内容
本发明的目的是研究施万细胞ASICs在慢性神经病理性疼痛中的作用,为ASIC1在细胞层面,作为治疗靶点提供更有力的证据。
首先,本发明通过real-time qPCR检测发现,与其它酸敏感离子通道亚型相比,施万细胞主要表达ASIC1;利用western blotting,免疫荧光检测发现,酸性细胞外液(pH5)模拟的酸性胞外环境以及慢性压迫性损伤诱导的慢性神经病理性疼痛均能显著引起ASIC1的表达增加。之后,利用ASICs抑制剂amiloride抑制ASICs的功能,通过机械痛及热痛的行为学检测发现,amiloride能有效缓解慢性压迫性损伤诱导的慢性神经病理性疼痛中的机械痛;同时,利用P0-Cre小鼠及ASIC1 MIR30shRNA-AAV病毒特异性敲降施万细胞ASIC1的表达,发现其也能显著缓解慢性压迫性损伤诱导的机械痛。
本发明确定了施万细胞中主要表达ASIC1,通过体内外模型模拟损伤后微环境发现,损伤微环境能显著上调ASIC1的表达,在小鼠背根神经节中,ASIC1主要表达在胞体,通过神经外膜下给予ASICs抑制剂amiloride,能显著改善慢性压迫性损伤诱导的机械痛,而通过病毒及转基因小鼠,特异性敲降施万细胞ASIC1的表达,同样可以缓解这一疼痛。这一发明为ASIC1在细胞层面作为靶向治疗点提供更有力的证据,为将来选择施万细胞ASIC1作为治疗神经病理性疼痛靶点,提供了一定的理论基础和价值依据。
附图说明
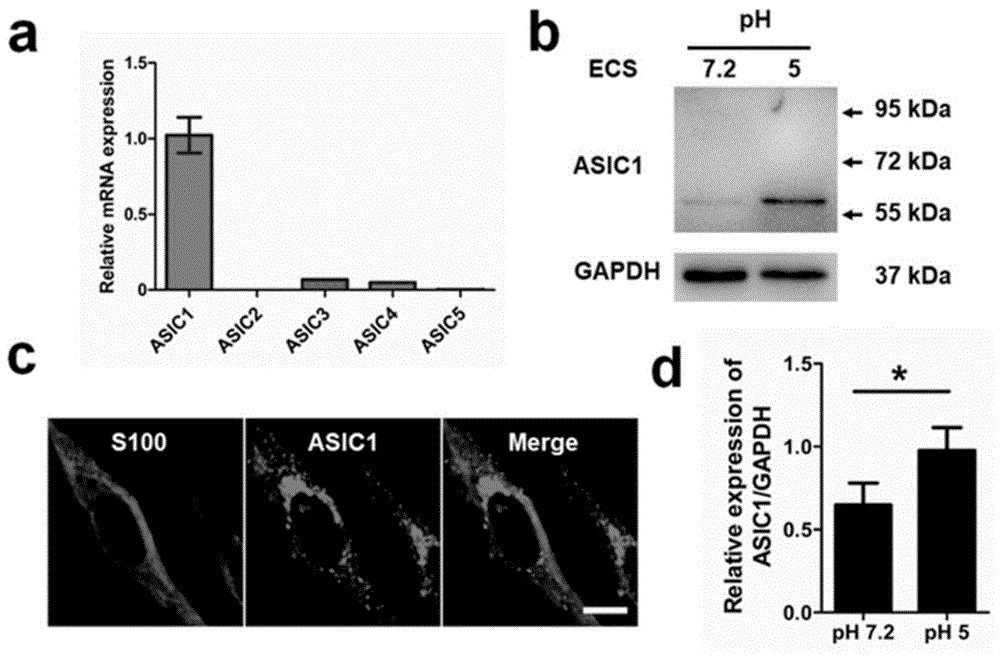
图1为施万细胞中ASIC1的表达结果以及酸性细胞外液对ASIC1表达的影响结果。
图2为慢性压迫性损伤诱导的神经病理性疼痛模型(CCI)对施万细胞ASIC1表达的影响结果。
图3为酸敏感离子通道抑制剂amiloride及条件性敲除施万细胞ASIC1对CCI诱导的慢性神经病理性疼痛的影响结果。
具体实施方式
下面将结合实施例对本发明的优选实施方式进行详细说明。需要理解的是以下实施例的给出仅是为了起到说明的目的,并不是用于对本发明的范围进行限制。本领域的技术人员在不背离本发明的宗旨和精神的情况下,可以对本发明进行各种修改和替换。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实验动物:本发明中主要使用的转基因小鼠是SPF级P0-Cre小鼠(购自JacksonLab,stock No.017927,已在南通大学实验动物中心繁育超10代);细胞培养使用出生1-2天的小鼠;其余实验使用的是8-12周的成年雄性小鼠。
实施例1
一、实验方法
1、施万细胞的培养及纯化:取出生1-2天的ICR小鼠,在培养室无菌超净台下经股骨后外侧肌间隙暴露分离取出坐骨神经,剪碎,1 mg/mL胶原酶A 37℃消化40 min,0.25%胰酶消化10-12 min,吹打后用培养基重悬接种。次日换成含有0.5 µM forskolin和10 ng/mLHRG,每2-3天换一次液,待细胞长至融合时,0.125%胰酶差速消化法纯化施万细胞(主要利用施万细胞贴壁能力比成纤维细胞弱)。
2、坐骨神经慢性压迫性损伤模型(CCI):小鼠在手术平台上用异氟烷气体持续麻醉,剃毛消毒后,在股骨外侧上方纵向切开皮肤,顺肌纹钝性分离肌肉,暴露坐骨神经,游离周围组织,在坐骨神经三叉分支的近端约5 mm处,用6.0的手术缝合线做三道结扎,间距约1mm,以不影响神经外膜的血运为度,关闭切口后缝合皮肤,消毒。使用的实验动物获得南通大学动物伦理委员会批准(No. S20180806-002)。
3、实时定量PCR:采用Trizol法提取各组实验小鼠坐骨神经损伤处的总RNA,分别定量1 µg后使用TaKaRa试剂盒进行总RNA反转录,并合成cDNA第一链,使用SYBR Green法定量检测ASICs各亚型的表达。
ASICs引物如下:
ASIC1,sense sequence:CTAGAGCAGAAGTTGAAAGAC(seq_1)
anti-sense sequence:GATTAGAGACCAAGAGACAGT(seq_2);
ASIC2,sense sequence:ATTGGTGCTAGTATCCTTACA(seq_3)
anti-sense sequence:CTCCCTTCCTCTTCTTCTTT(seq_4);
ASIC3,sense sequence:ATACAACCGTAGCGAGAC(seq_5)
anti-sense:CAACTCCGACACTTCATAAG(seq_6);
ASIC4,sense sequence:TGTGGTCTATACTCGCTATG(seq_7)
anti-sense:CTCCTGCTGGATGTCTAG(seq_8);
ASIC5,sense sequence:TTTGATGGCTTAGGTTTGTC(seq_9)
anti-sense sequence:AGTGCTGTAGGTAATGAAGT(seq_10);
GAPDH,sense sequence:TCCATGACAACTTTGGCATTG(seq_11)
anti-sense:CAGTCTTCTGGGTGGCAGTGA(seq_12)。
4、免疫细胞荧光染色:培养的细胞经预冷的0.1 M PBS漂洗后迅速转移至4%多聚甲醛(PFA)固定液,室温固定10 min。经0.2%破膜剂Triton X-100室温破膜10 min,10% 牛血清白蛋白(BSA)室温封闭1 h。然后用含有1% BSA,0.1 M PBS稀释以下一抗:anti-S100(1:400,mouse),anti-ASIC1(1:400,rabbit),根据实验需要,4℃ 孵育其中的一种或二种一抗过夜,经0.1 M PBS漂洗三遍后,根据一抗选用合适的二抗,室温避光标记1 h,经0.1 MPBS漂洗三遍后,在激光共聚焦显微镜下观察。
5、免疫印迹:动物经处理后,提取CCI结扎部位坐骨神经,加入含有蛋白酶抑制剂的细胞裂解液,超声波细胞粉碎仪冰上超声5 s后,冰上裂解30 min,14000 rpm 4℃离心30min,取上清,使用BCA蛋白定量试剂盒定量后,加入1/4体积的5´上样loading buffer,沸水浴10 min,分装-20℃保存。于10%的分离胶电泳后转膜,在5%脱脂牛奶中室温封闭2 h,加入一抗anti-ASIC1 (1:1000,rabbit),anti-GAPDH(1:10000,mouse)4℃孵育过夜,TBST洗膜3次,每次10 min,anti-rabbit HRP标记的二抗(1:1000),室温孵育2 h,ECL显色,化学发光成像仪曝光检测。
6、免疫组织荧光染色:小鼠经1%戊巴比妥钠深度麻醉后,固定四肢,暴露心脏,先使用生理盐水灌流至小鼠四肢和肝脏发白,后将灌流液换成4% PFA,灌流至小鼠全身变硬,小心取出坐骨神经及L4-L6背根神经节,放至4% PFA,4℃后固定8-12小时,再换至新鲜配制的30%蔗糖脱水至沉底(约2天)。利用冰冻切片机,将坐骨神经纵切成12 µm/片,背根神经节切成12 µm/片,贴至正电荷包被的载玻片,待后续免疫组织荧光染色。
免疫组织荧光染色具体步骤如下:0.01 M PBS清洗3次,每次10 min,后用0.3%Triton X-100室温破膜10 min;0.01 M PBS清洗3次,每次10 min,后用10% BSA室温封闭2小时;使用含有3% BSA及0.1% Triton X-100 的0.1 M PBS稀释如下抗体:anti-S100(1:300,mouse), anti-ASIC1(1:200,rabbit),4℃孵育1-2天,0.01 M PBS清洗3次,每次10min,然后根据一抗选择合适的荧光标记二抗,室温下避光标记2 h,0.01 M PBS清洗3次,每次10 min,最后使用90%的甘油封片,室温晾片,利用激光共聚焦显微镜进行图像采集。
7、坐骨神经外膜下注射:CCI模型ICR小鼠经麻醉后在股骨外侧上方纵向切开皮肤,钝性分离肌肉,暴露坐骨神经,在CCI第一道结扎处,于坐骨神经外膜下利用微量注射泵缓慢注射6 µL PBS,ASICs抑制剂amiloride;而P0-Cre小鼠经上述相应操作后,于坐骨神经外膜下利用微量注射泵缓慢注射6 µL ASIC1相关病毒(包括control病毒、干扰病毒-AAV2/9-CMV-bGlobin-Flex-EGFP-ASIC1MIR30shRNA),完成注射后停针约5-10 min,关闭切口,缝合皮肤并消毒。
8、疼痛行为学检测:所有动物行为学实验采取“双盲”的实验设计方案。小鼠在CCI模型前,筛选机械痛觉阈值均值在1.0左右,热痛阈值均值在10 s;于损伤后第十天,经坐骨神经外膜下给予ASICs抑制剂及病毒后检测机械痛和热痛的变化。
(1)机械痛觉异常实验:用von Frey纤维丝以up-down法推算50%缩足阈值:将一有机透明玻璃箱置于金属筛网上,待小鼠在有机玻璃箱中适应30 min 后,用von Frey纤维丝垂直刺激小鼠后肢 足底中部,持续时间1-2 s,小鼠出现抬足或舔足行为视为阳性反应,否则视为阴性反应。
(2)热痛觉过敏实验:将有机玻璃箱置于3 mm 厚玻璃板上,按Hargreaves 法用热辐射刺激以照射小鼠足底紧贴玻璃板部位。记录照射开始至小鼠出现抬足时间,截止时间为20 s。
二、实验结果
1、通过real-time qPCR检测发现,与其它酸敏感离子通道亚型相比,施万细胞主要表达ASIC1,且主要定位在细胞膜(图1中a-c所示);利用Western blot,免疫荧光检测发现,酸性细胞外液(pH5)模拟的酸性胞外环境以及慢性压迫性损伤诱导的慢性神经病理性疼痛均能显著引起ASIC1的表达增加(图1-2所示)。同时,利用免疫荧光及Nissl检测发现,在坐骨神经中,ASIC1主要表达在施万细胞中,而在DRG中其主要表达在胞体(图2中c-e所示)。
2、为了探究CCI诱导的ASIC1表达上调的意义,利用ASICs抑制剂amiloride抑制ASICs的功能,通过机械痛及热痛的行为学检测发现,amiloride能有效缓解慢性压迫性损伤诱导的慢性神经病理性疼痛中的机械痛,但对热痛无明显影响(图3中a-b);为了进一步阐明施万细胞ASIC1参与疼痛的调节,利用P0-Cre小鼠及ASIC1 MIR30shRNA-AAV病毒特异性敲降施万细胞ASIC1的表达,发现其也能显著缓解慢性压迫性损伤诱导的机械痛,对热痛也无显著影响(图3中c-d)。
以上结果确定了施万细胞中主要表达ASIC1,通过体内外模型模拟损伤后微环境发现,损伤微环境能显著上调ASIC1的表达,在小鼠背根神经节中,ASIC1主要表达在胞体,通过神经外膜下给予ASICs抑制剂amiloride,能显著改善慢性压迫性损伤诱导的机械痛,而通过病毒及转基因小鼠,特异性敲降施万细胞ASIC1的表达,同样可以缓解这一疼痛。
- 用于治疗神经病理性疼痛的组合物及其在制备神经病理性疼痛药物上的应用
- 一种再生GABA能神经元的方法及其在制备神经病理性疼痛基因治疗药物中的应用
