一种凡纳滨对虾miRNA及其模拟物在提高对虾应激的免疫能力中的应用
文献发布时间:2024-04-18 20:00:50
技术领域
本发明涉及水产养殖技术领域,具体涉及一种凡纳滨对虾miRNA及其模拟物在提高对虾应激的免疫能力中的应用。
背景技术
凡纳滨对虾俗称南美白对虾,隶属于节肢动物门,甲壳纲,十足目,对虾科,滨对虾属,由于其生长速度快,含肉率高,蛋白质丰富,抗病抗逆能力强,是世界范围内对虾养殖的主要品种。
凡纳滨对虾病害发生的直接原因为病原体感染,如WSSV或副溶血弧菌的感染,然而种种迹象表明环境胁迫在这些疾病的爆发过程中扮演着重要的角色。水中各种理化因子的剧烈变化对对虾而言是种胁迫,称为环境胁迫,环境胁迫会影响到对虾的免疫系统功能,而其分子机制仍不得而知。寻找方法解决环境胁迫对对虾免疫系统功能的影响是十分具有意义和价值的,目前关于miRNA应用于解决对虾环境胁迫下免疫功能破坏的研究还没有相关报道。
发明内容
为了解决现有技术存在的上述不足,本发明的目的是提供一种凡纳滨对虾miRNA及其模拟物在提高对虾应激的免疫能力中的应用,以解决环境胁迫影响对虾免疫系统功能的问题。
本发明解决上述技术问题的技术方案如下:
一种凡纳滨对虾miRNA及其模拟物在提高对虾应激的免疫能力中的应用。
进一步地,miRNA的核酸序列如SEQ ID NO.1或SEQ ID NO.2所示,miRNA模拟物根据SEQ ID NO.1或SEQ ID NO.2所示核酸序列合成。
一种提高对虾抗应激的免疫能力的试剂,上述的miRNA或miRNA模拟物。
进一步地,miRNA或miRNA模拟物的浓度为0.5~2ng/μL。
本发明具有以下有益效果:
本发明提供了凡纳滨对虾miRNA及其模拟物,可通过调控ROS含量、NO含量抑制细胞凋亡事件的发生和酯酶活力的降低,从而保证血细胞的免疫功能,提高对虾应激的免疫能力,对发展绿色环保对虾养殖业具有重要的现实意义。
附图说明
图1为凡纳滨对虾2个miRNA文库的长度分布图,其中柱状图左侧为0h,右侧为3h;
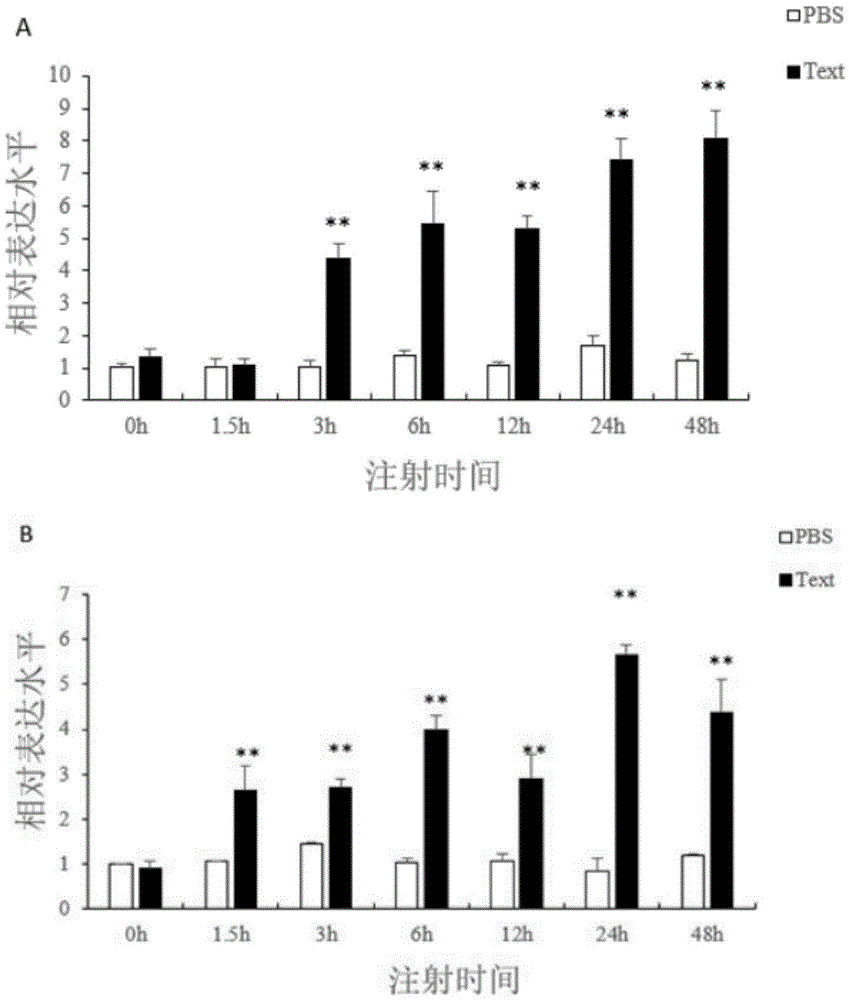
图2为所选miRNA(A)及靶基因(B)的表达量变化图(*p<0.05;**p<0.01);
图3为所选12个miRNA的qPCR检测和高通量测序结果相关性分析图;
图4为文库中表达量变化较为显著的免疫相关的9个miRNA扩增产物电泳图,其中M:DNA Marker DS2000,1:let-7a-5p,2:miR-7,3:miR-107,4:miR-182-5p,5:miR-184,6:miR-184-3p,7:miR-375,8:miR-375-3p,9:miR-750,u:u6 siRNA;
图5为感染副溶血弧菌后2个表达量差异较大的miRNA图,其中,A:miR-182,B:miR-750;
图6为最佳注射量检测图,其中,A:不同剂量mimics注射后miR-184表达量的变化;B:不同剂量inhibitors注射后miR-184表达量的变化m:DNA marker DL 2000,c:PBS注射对照组,m1:0.3ngmimics,m2:3ngmimics,m3:30ngmimics,u6:u6内参;i1:0.3nginhibitors,i2:3nginhibitors,i3:30nginhibitors;
图7为模拟物和抑制物注射后凡纳滨对虾的肝胰腺差异图,其中:菌液+PBS组,Ⅱ:PBS组,Ⅲ:菌液+模拟物组,Ⅳ:菌液+抑制物组;
图8为肝胰腺切片DAPI染色观察结果图;其中A:菌液+PBS组,B:PBS组,C:菌液+模拟物组,D:菌液+抑制物组;
图9为注射miRNA inhibitor和mimics后凡纳滨对虾血细胞的凋亡率图;
图10为注射miRNA inhibitor和mimics后凡纳滨对虾血细胞的酯酶活力影响结果图;
图11为注射miRNA inhibitor和mimics后凡纳滨对虾血细胞的ROS含量影响结果图;
图12为注射miRNA inhibitor和mimics后凡纳滨对虾血细胞的NO含量影响结果图。
具体实施方式
以下所举实例只用于解释本发明,并非用于限定本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
实施例1:miRNA及其模拟物的合成
1.miRNA文库的构建
以凡纳滨对虾为研究对象,选取Cu胁迫浓度5mg/L,胁迫时间为3h的血淋巴细胞,构建miRNA文库,未胁迫组的凡纳滨对虾血淋巴细胞为空白对照。
两组样品提取总RNA后,使用PAGE胶分离不同片段大小的RNA。切取18-30nt之间的条带,回收Small RNA;连接3’和5’接头后,进行PCR扩增,并对PCR产物进行切胶回收纯化完成文库的构建。构建好的文库用Illumina Genome Analyzer进行测序。两组样品分别产生28879125(0h)和24495187(3h)条原始序列,去除低质量的序列之后,两个样品共得到845582(0h)和1467075(3h)条clean reads,这些read又分为6个类别,各类别名称及所占比例如表1所示。
表1凡纳滨对虾RNA文库概述
2个文库中的miRNA的长度范围为20-23nt,其中大多数miRNA的长度为22nt,如图1所示。
2.miRNA的鉴定与分析
2.1miRNA的鉴定
将所得到的miRNA比对到miRBase v21.0(http://www.mirbase.org/),两个文库中分别鉴定到6014(0h)和5823(3h)个已知的miRNA。在这些已知的miRNA中,鉴定到218个保守的成熟体miRNA。此外,还分别鉴定到了62个(0h)和121个(3h)新miRNA。
2.2miRNA差异表达分析
对Cu胁迫前后的miRNA进行了差异表达分析,发现Cu胁迫诱导了4524个已知miRNA和73新miRNA的表达差异。其中,已知的miRNA中,显著上调的有4293个,显著下调的有231个;新miRNA中,显著上调的有44个,显著下调的有29个。已知miRNA中,上调和下调最显著的分别是miR-1175a-3p和miR-22;新miRNA中,上调和下调最显著的分别是novel-miR-46和novel-miR-8。表达量变化最显著的前5个已知miRNA和新miRNA如表2所示。
表2差异表达最显著的前5个已知miRNA和新miRNA
2.3miRNA及靶基因的验证
为验证miRNA测序的准确性,选取了9个已知miRNA和3个新miRNA进行实时荧光定量PCR(qPCR)验证。同时对两个方法得到的表达量差异进行相关性分析。
试验结果如图2和图3所示,结果表明测序得到的miRNA及其靶基因的表达量与qPCR的结果较一致,皮尔逊相关性系数为0.707,也进一步说明了高通量测序结果的准确性。
2.4差异表达miRNA靶基因的预测
利用miRanda和PITA对miRNA的靶基因进行预测,对于差异表达的4524个已知miRNA和73个新miRNA,分别预测到21348和12579个靶基因。有许多miRNA不止有一个靶基因,一些miRNA的靶基因与凋亡相关基因,如p53,caspase;免疫相关基因如CTLs,Cactus,Toll-protein,Spaetzle;应激反应相关基因如Hsp60,Hsp70,Hsp21,解毒相关基因如CYP450和GST等有关,如表3所示。
表3部分miRNA的靶基因
2.5差异表达miRNA靶基因的功能分析
为探索miRNA调控的潜在途径,对差异表达miRNA的靶基因进行GO和KEGG分析。根据GO分类,已知和新miRNA预测到的21348和12579个靶基因分别注释到56和52个GO条目。此外,KEGG分析显示,已知miRNAs的21348个靶基因注释到307条通路,而新miRNAs的12579个靶基因注释到308条通路。按照富集因子(rich-factor)降序排列前20个富集通路时发现阿米巴病通路(ko05146)和霍乱弧菌感染通路(ko05110)是Cu胁迫下最重要的通路。
3.免疫相关miRNA的筛选
3.1免疫相关miRNA及靶基因的筛选
预测到免疫相关的靶基因可以分为9个类别,分别是ProPO系统、氧化应激、解毒、蛋白酶/蛋白酶抑制剂、模式识别蛋白、热休克蛋白、凋亡相关蛋白、抗菌肽和其他免疫分子如表4所示。
表4应激反应相关的miRNA及靶基因信息
3.2miRNA的克隆
根据差异表达miRNA靶基因的KEGG和GO分析,挑选表达量差异较大的9个microRNA进行设计克隆测序,结果如图4、表5所示。
表5 9个免疫相关miRNA的测序结果
通过注射1x10
试验例1:
1.注射量的确定及注射后的组织学观察实验
(1)miR-182-5p和miR-750的模拟物和抑制物以miR-182-5p和miR-750的核苷酸序列为模板,通过生工生物公司合成,分别记为miR-182-5pmimics、miR-182-5p inhibitors、miR-750mimics和miR-750inhibitors,使用1×RNase-free PBS作为稀释液,NanoDrop ND-2000超微量分光光度计将浓度定量至1ng/μL,于-80℃保存备用。
(2)对2种miRNA进行过表达和抑制表达的功能验证,实验结果如图5所示,经过初步检测,以30ng的miRNA为最佳注射量。
(3)实验对虾分别注射30ng的miRNA模拟物和抑制物之后,再注射副溶血弧菌进行免疫刺激,并对其进行解剖观察鳃丝、肝胰腺充水溃烂程度。同时,取注射后的凡纳对虾肝胰腺用4%多聚甲醛进行固定,运用石蜡切片技术进行脱水、透明、浸蜡、包埋;切片厚度以5μm为佳。切片脱蜡复水至75%乙醇步骤,滴加200μL浓度为10μg/ml的DAPI染色液,避光染色30min后用荧光倒置显微镜镜检;通过观察细胞核完整度和破碎程度判定肝胰腺是否存在凋亡细胞。
实验结果如图6、图7和图8所示。解剖结果显示,注射miRNA抑制物+菌液组与注射PBS组的鳃丝出现相似程度的溃烂、肝胰腺出现充水肿大现象,并且注射模拟物+菌液组有加重的趋势;相反,注射miRNA模拟物+菌液组与注射菌液+PBS组鳃丝完整,肝胰腺无明显的肿大现象;镜检结果显示,注射miRNA抑制物+菌液组与注射PBS组的肝胰腺细胞核出现大面积破碎现象,并且注射模拟物+菌液组有加重的趋势;相反,miRNA模拟物+菌液组与注射菌液+PBS组肝胰腺显核仁饱满完整。实验结果表明,miRNA模拟物可以有效的保护对虾肝胰腺的组织完整性。
2.注射后血细胞凋亡情况检测
取注射后的血淋巴运用流式细胞术检测血细胞凋亡情况。实验结果如图9所示。结果显示,注射2种miRNA模拟物后,血细胞的凋亡率均显著下降,而注射2种miRNA抑制物后,血细胞的凋亡率均显著上调,结果表明2种miRNA模拟物可以有效的降低凡纳滨对虾的血细胞凋亡率。
3.注射后血细胞酯酶活力检测
取注射后的血淋巴运用Fluorescein diacetate(FDA)二乙酸荧光素染色法,通过流式细胞术检测血细胞酯酶活力。实验结果如图10所示。结果显示,注射2种miRNA模拟物后,酯酶活力均显著增加,注射miR-182-5p抑制物后,酯酶活力显著下降,注射miR-750抑制物后,酯酶活力有所降低,但与对照组相比无显著性差异。结果表明2种miRNA模拟物可以显著提高凡纳滨对虾得血细胞免疫水平,提高了抵御病原体的能力。
4.注射后血细胞中ROS含量的检测
取注射后的血淋巴运用2’,7’-二氯荧光黄双乙酸盐(DCFH-DA)染色法检测血细胞中ROS含量。实验结果如图11所示。结果显示,2个实验组分别在注射2种miRNA模拟物之后,ROS含量均显著降低;注射miR-182-5p抑制物后,ROS含量与对照组相比极显著增加。注射miR-750抑制物后,ROS含量有所增加,但与对照组相比,无显著性差异。结果表明2种miRNA模拟物可以有效清除ROS的积累,降低Cu胁迫对机体造成的氧化损伤。
5.注射后血细胞中NO含量的检测
取注射后的血淋巴运用DAF-FM diacetate(DA)NO荧光探针检测血液中一氧化氮(NO)含量。实验结果如图12所示。结果显示,注射2种miRNA模拟物可显著降低血细胞中NO含量,其中注射miR-182-5p抑制物后,NO含量增加,但与对照组无显著性差异。注射miR-750抑制物后,NO含量显著增加。结果表明2种miRNA模拟物可以显著降低NO的过度积累,降低Cu胁迫对机体造成的氧化损伤。
综上所述,本发明得到的2种miRNA及其模拟物,通过调控ROS含量、NO含量,抑制细胞凋亡事件的发生和酯酶活力的降低,从而保证血细胞的免疫功能,可以有效的提高对虾应激的免疫能力,对发展绿色环保对虾养殖业具有重要的现实意义。
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 一种三电极体系电化学测试装置及其电化学测试方法
- 便于携带的手动加压测试针头滤器泡点值的装置及方法
- 便于存放的手动加压测试针头滤器泡点值的装置及方法
- 精子简易检测试剂盒、装置及实施精子的简易检测的方法
- 便于实现自动化的试剂电化学测试装置及方法
- 便于实现自动化的试剂电化学测试装置及方法
