降低PDI活性的物质在治疗自身免疫性疾病产品中的应用
文献发布时间:2024-04-18 20:01:30
技术领域
本发明涉及医药领域,尤其涉及能够降低PDI(蛋白质二硫键异构酶)活性的小分子化合物、生物大分子以及其组合在治疗自身免疫性疾病产品上的应用。
背景技术
细胞因子介导的炎症信号通路在自身免疫性疾病发病机制中发挥核心作用。以类风湿性关节炎(Rheumatoid arthritis,RA)为例,其为一种典型的自身免疫性疾病,以侵蚀性关节炎为主要特征,其病理基础是滑膜炎。发病初期的关节表现为关节晨僵、肿胀、疼痛等。最后可发生关节畸形,并丧失关节正常的功能。
RA的发病机制非常复杂,一般认为TNF-α信号在其中发挥了关键作用。在RA中,TNF-α主要由患者外周血单核细胞和关节滑膜巨噬细胞分泌,TNF-α通常在关节病理组织中表达,50%的RA患者在关节滑膜中检测到TNF-α。TNF-α主要参与RA发病的三个病理过程。第一,TNF-α可增加血管内皮细胞粘附分子的表达,使血液中的白细胞通过与粘附分子的相互作用而集中到关节腔内。第二,TNF-α可刺激结缔组织细胞和多形核细胞产生前列腺素等小分子,并作为炎症的介质。第三,TNF-α刺激滑膜细胞和软骨细胞,减少破骨细胞的糖蛋白合成,增加糖蛋白降解,并产生胶原酶和其他中性蛋白酶释放骨钙,导致骨和软骨的破坏。鉴于此,在RA患者的免疫治疗中,使用TNF-α的单抗或可溶性TNF受体可明显改善患者的临床症状。尽管TNF-α抗体药物在商业上取得了巨大成功,但是其仍然不够完美,主要存在以下几条缺陷:1)有30%的RA患者对TNF-α抗体治疗没有响应;2)此类疗法增加患者感染的风险;3)患者体内会产生抗药抗体,因此导致耐药性。因此,开发针对RA治疗的新型药物靶点具有重要意义。
TNF-α作为RA治疗上的重要靶点,针对TNF-α的抗体药物在商业上取得了巨大成功,但是其仍然不够完美,主要存在以下几条缺陷:1)有30%的RA患者对TNF-α抗体治疗没有响应;2)此类疗法增加患者感染的风险;3)患者体内会产生抗药抗体,因此导致耐药性。因此,开发新的药物靶点以及活性物质对于RA的治疗具有重要意义。
发明内容
本发明的目的是提供一种能够缓解以类风湿性关节炎为代表的自身免疫性疾病的药物组分。
本发明实现上述目的所采用的技术方案如下:
降低PDI活性的物质在治疗自身免疫性疾病产品中的应用,所述降低PDI活性的物质包括(-)-Vinigrol。
进一步地,所述降低PDI活性的物质还包括16F16、LOC14、CCF642、ML359、Juniferdin、Bacitracin、E64FC26、KSC-34、PACMA31、3-Methyltoxoflavin、芦丁、PDI抗体中的一种或多种。
进一步地,所述降低PDI活性的物质在治疗类风湿性关节炎产品中的应用。
进一步地,所述降低PDI活性的物质联合TNF-α抗体在治疗自身免疫性疾病产品中的应用。
进一步地,所述降低PDI活性的物质联合TNF-α抗体在治疗类风湿性关节炎产品中的应用。
本发明的技术方案取得的技术效果如下:
1.降低PDI活性的物质分为小分子化合物(即(-)-Vinigrol、16F16、LOC14、CCF642、ML359、Juniferdin、Bacitracin、E64FC26、KSC-34、PACMA31、3-Methyltoxoflavin、芦丁)和生物大分子(即PDI抗体),利用这些物质中的一种或多种来获得一种治疗自身免疫性疾病的产品,能够用于治疗自身免疫性疾病(如类风湿性关节炎)。其作用原理是,PDI蛋白是治疗包括类风湿性关节炎在内的自身免疫性疾病的药物靶点,通过这些物质来抑制PDI活性可有效治疗包括类风湿关节炎在内的自身免疫性疾。经过实验测试,0.5mg/kg的PDI的小分子抑制剂(Vinigrol)和200μg/每只的大分子抑制剂(PDI抗体)在缓解模型小鼠的类风湿性关节炎方面具有明确的效果。
2.将降低PDI活性的物质与临床上广泛使用的TNF-α抗体联用,应用于治疗自身免疫性疾病(如类风湿性关节炎)中,可用于对TNF-α抗体治疗没有响应的患者,进而扩大RA患者治疗人群;此外将降低PDI活性的物质或相关组合与临床上广泛使用的TNF-α抗体联用,将获得更好的治疗效果。
附图说明
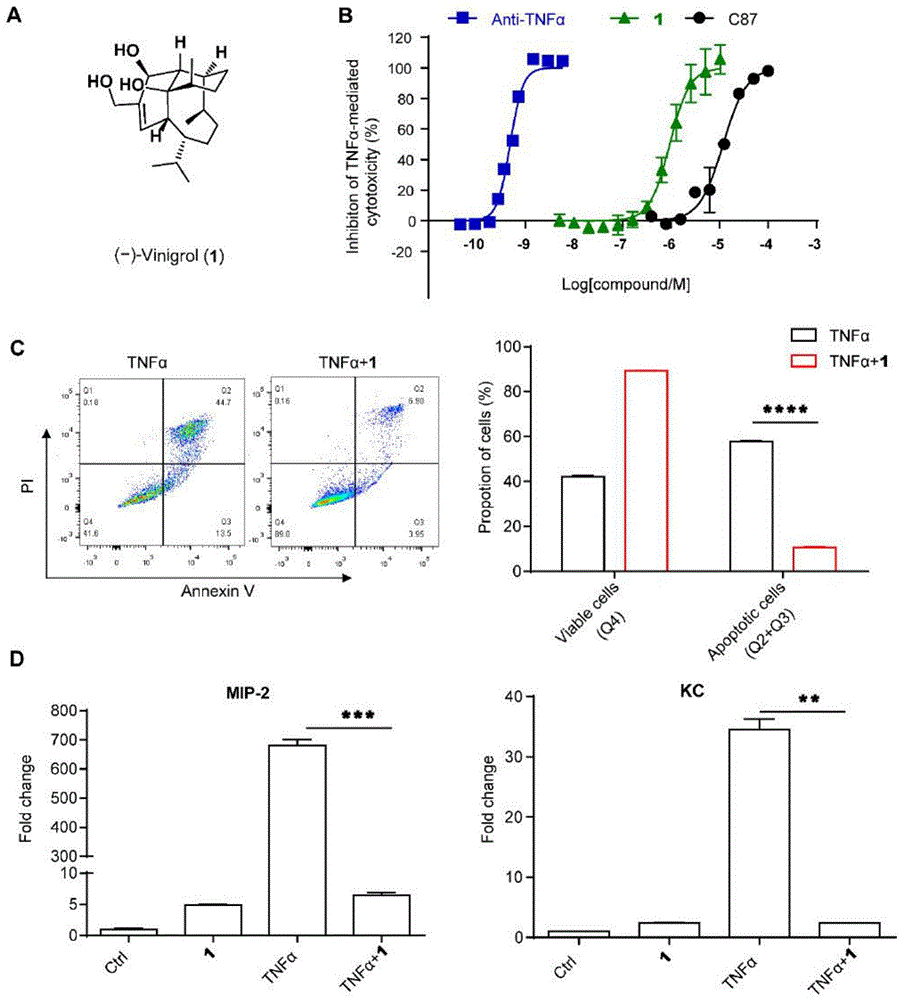
图1示出了(-)-Vinigrol在L929细胞中有效阻断TNF-α信号通路。
图2示出了Vinigrol通过激活ADAM17在多种细胞类型中诱导TNFR1的剪切。
图3示出了Vinigrol通过PDI激活ADAM17蛋白酶。
图4示出了Vinigrol抑制PDI蛋白的多种酶活性。
图5示出了Vinigrol在小鼠模型中改善胶原蛋白诱导的类风湿性关节炎。
图6示出了PDI抗体在小鼠模型中改善胶原蛋白诱导的类风湿性关节炎。
具体实施方式
为使本发明的上述技术方案中各项技术特征和各项优点或技术效果能更明显易懂,下文配合附图进行详细说明。
1、蛋白表达及纯化
重组的全长hPDI、hERp57、hERp46和hERp72蛋白以及hPDI截段蛋白hPDI-abb’、hPDI-abb’x、hPDI-bb’a’、hPDI-bb’a’c、hPDI-a、hPDI-ab、hPDI-a’c均在大肠杆菌BL21(DE3)中表达,并进行纯化。通过SDS-PAGE电泳及考马斯亮蓝染色检测蛋白质的纯度,并以牛血清白蛋白(BSA)制作标准曲线,通过BCA法测定蛋白质浓度。
2、拮抗TNF-α诱导的L929细胞毒性实验
按照现有技术文献的报道,可以利用L929细胞系检测待测物对TNF-α诱导的细胞毒性的抑制作用。简而言之,每个孔中加入约1×10
图1示出了(-)-Vinigrol在L929细胞中有效阻断TNF-α信号通路。
其中,A图示出了(-)-Vinigrol的结构式(1)。
B图示出了Vinigrol拮抗TNF-α诱导L929细胞死亡过程。
C图示出了流式细胞术检测Vinigrol抑制TNF-α诱导的L929细胞的凋亡过程。
D图示出了qRT-PCR检测Vinigrol对TNF-α激活的NF-κB靶基因的表达抑制情况。
3、流式细胞术评估TNFR1的剪切和细胞凋亡
为了检测Vinigrol是否在各种细胞类型中均可诱导TNFR1剪切,现用流式细胞术检测了细胞膜上TNFR1的表达。当细胞在六孔板中生长至70~80%融合时,使用下列小分子组合处理细胞8h:DMSO、20μM Vinigrol、10μM 16F16、DMSO+10μg/mL BFA(Brefeldin A)、20μM Vinigrol+10μg/mL BFA或10μM 16F16+10μg/mL BFA。处理完毕后,用PBS将细胞洗涤两次,随后小心吹打细胞,将细胞重悬于100uLPBS中。将细胞与PE标记的小鼠CD120a(TNFR I型/p55)抗体(Biolegend,55R-286)在冰上避光孵育30min。30min后用PBS洗一次细胞,随后可以通过流式细胞仪(BD LSRFortessa)检测荧光强度。使用人的细胞系(Hela细胞、A549细胞和HepG2细胞)时使用PE标记的人CD120a抗体(Biolegend,W15099A)检测。
为了检测TNF-α诱导的细胞凋亡是否被Vinigrol抑制,L929细胞经下列条件处理16h:10ng/mL TNF-α+1μg/mL Act D或10ng/mL TNF-α+1μg/mL Act D ng/mL+20μMVinigrol。处理完毕后,用胰蛋白酶收集培养皿上的细胞,同时通过离心收集上清液中的细胞。将收集好的细胞用PBS洗涤一次并重悬于195uL Annexin结合缓冲液(Beyotime,C1062)中。然后将5μLAnnexin-V-FITC(Beyotime,C1062)添加到体系中。在室温下在黑暗中孵育5min后,加入10uL PI(Beyotime,C1062)并于室温下在黑暗中继续孵育15min。通过之前报道的方法在流式细胞仪上分析了凋亡细胞的百分比。
图2示出了Vinigrol通过激活ADAM17在多种细胞类型中诱导TNFR1的剪切。
其中,A图示出了通过流式细胞术证明Vinigrol剂量依赖性降低L929细胞膜上TNFR1受体密度。L929细胞用DMSO(作为对照)或者递增剂量的Vinigrol处理4h。n=3。
B图示出了ADAM17抑制剂KP-457阻断Vinigrol诱导的L929细胞膜上TNFR1受体密度下降。Ctrl表示细胞用DMSO处理4h;1表示细胞用20μM Vinigrol处理4h;KP-457表示细胞用20μM的KP-457处理4h;1+KP-457表示细胞用20μM Vinigrol以及20μM KP457同时处理4h。n=3。
C图示出了流式细胞术检测L929细胞膜上TNFR1受体密度随着Vinigrol处理时间增加的变化情况。Ctrl表示细胞用DMSO处理8h,其他组表示用20μM Vinigrol处理所显示的时间长度。n=4。
D图示出了Vinigrol和BFA协同调节L929细胞膜上的TNFR1受体剪切,。L929细胞用DMSO(作为对照,ctrl)或所显示的条件处理8h。n=3。
E图示出了ELISA检测培养基上清液中可溶性TNFR1受体含量,其细胞处理条件如D图所示。n=3。
F图示出了通过流式细胞术证明Vinigrol和16F16降低了人细胞系的膜上TNFR1受体密度。用DMSO(作为对照,ctrl)、20μM Vinigrol或10μM 16F16处理HepG2、A549和Hela细胞8h。n=3。
G图示出了ELISA检测细胞培养基上清中sTNFR1的含量,其细胞处理如F图所示。n=3。
n代表生物学重复的数量。数据为平均值±s.e.m。对于A-E图,使用one-way ANOVA统计。对于F和G图,使用two-way ANOVA统计。*P<0.05,**P<0.01,***P<0.001,****P<0.0001。ns表示差异不显著。
4、ELISA检测可溶性TNFR1的含量
为了检测由Vinigrol诱导的细胞膜上剪切下来的可溶性TNFR1(sTNFR1)含量,将L929细胞以及HeLa细胞、A549细胞和HepG2细胞培养在有2mL培养基的六孔板中,并进行细胞处理。处理完毕后,收集细胞用于流式细胞术分析,同时收集培养基上清用于ELISA测定。测量前,将培养基在4℃条件下12000rpm离心10min。每个样品取100μL上清液使用ELISA试剂盒进行检测(Elabscience,E8-E-EL-M0010c,用于L929细胞的培养基检测;Multisciences,70-EK1109-48,用于人细胞系的培养基检测)。
5、检测ADAM17蛋白活性
为了检测Vinigrol对ADAM17活性的影响,在用Vinigrol处理后检测了L929细胞膜上ADAM17裂解荧光底物的速度。当L929细胞在六孔板中生长至70~80%融合时,用DMSO、20μM Vinigrol、2μM Vinigrol、10μM 16F16或1μM 16F16处理8h。8h后,用PBS将细胞洗涤两次,并小心将细胞吹起并以1×106细胞/mL的浓度重悬于活性检测缓冲液中(20mM Tris/HCl、154mM NaCl和1% FBS,pH 7.4)。然后将L929细胞以100μL等体积加入到黑色96孔板中,并加入10μM荧光底物(R&D,ES003)。反应在37℃下进行1h,每3min在酶标仪(SYNERGYH1,Biotek)中检测一次,激发波长为320nm,发射波长为405nm。按照现有技术文献报道,ADAM17对荧光底物的最大切割速度(Vmax)代表其蛋白酶活性。
图3示出了Vinigrol通过PDI激活ADAM17蛋白酶。
其中,A图示出了ADAM17特异的小分子抑制剂KP-457逆转Vinigrol对TNF-α诱导的L929细胞毒性的拮抗作用。1表示用10ng/mL TNF-α、1μg/mL ActD和递增浓度的Vinigrol处理L929细胞16h;1+KP-457表示用10ng/mL TNF-α、1μg/mL ActD、20μM Vinigrol和递增浓度的ADAM17抑制剂KP-457处理L929细胞16h。n=3。
B图示出了Vinigrol诱导ADAM17的蛋白酶活性增加。PDI的共价小分子抑制剂16F16作为阳性对照。n=3。
C图示出了PDI抗体诱导ADAM17的蛋白酶活性增加。n=3。
数据为平均值±s.e.m。One-way ANOVA,*P<0.05,**P<0.01,***P<0.001,****P<0.0001,ns表示没有显著性差异。n代表生物学重复的数量。
6、PDI蛋白活性测定
为了检测PDI蛋白的活性是否受Vinigrol影响,按照现有技术文献报道的方法进行了PDI蛋白的胰岛素还原活性、RNase氧化活性及分子伴侣活性的检测。
简而言之,对于胰岛素还原活性检测,将100μM Vinigrol、100μM 16F16(Sigma-Aldrich,SML0021)或DMSO与0.5μM PDI(PDI蛋白购自Sino Biological,50638-M08H;其它酶活检测中使用的PDI蛋白在实验室纯化得到)在37℃条件下孵育15min。然后在不存在(阴性对照)或存在上述反应体的情况下,将130μM胰岛素(Sigma-Aldrich)及0.1M磷酸钾缓冲液,pH 7.5、2.5mM EDTA、0.5mM DTT体系加入。使用EnSpire酶标仪(EnSpire)在25℃下记录650mm处的吸光度,该吸光度代表来自经PDI蛋白还原后沉淀的胰岛素B链的光散射。为了检测Vinigrol对PDI抑制的特异性,将不同浓度的Vinigrol与0.5μM PDI、0.5μMERp57、0.5μMERp46或0.5μM ERp72在37℃下预孵育15min。为了检测vinigro和芦丁抑制PDI活性的IC
对于RNase氧化活性检测,将DMSO、300μM Vinigrol或300μM 16F16与3μM PDI在25℃条件下预孵育2h。2h后,将上述体系加入到100mM Tris–acetate,pH 8.0、50mM NaCl、1mMEDTA、1mM GSH和0.2mM GSSG中,并检测已被还原的牛胰RNase A(Sigma Aldrich)(sRNaseA)的活化情况。
对于分子伴侣活性检测,将DMSO或300μM Vinigrol与7μM PDI在25℃下预孵育2h。随后在含有DMSO、7μM PDI、300μM Vinigrol或7μM PDI+300μM的反应缓冲液(100mM sodiumphosphate,pH 7.4,2.5mM EDTA)中利用RF-5301PC荧光分光光度计(SHIMADZU)检测已变性的GAPDH的聚集情况。
图4示出了Vinigrol抑制PDI蛋白的多种酶活性。
其中,A图示出了胰岛素还原实验中Vinigrol(100μM)抑制PDI(0.5μM)蛋白的还原活性。以100μM 16F16作为阳性对照。
B图示出了Vinigrol以剂量依赖的方式抑制PDI蛋白的还原活性。
C-E图示出了Vinigrol不抑制PDI蛋白家族的其它成员,包括ERp57(见C图)、ERp72(见D图)和ERp46(见E图)。
F图示出了在RNase氧化实验中Vinigrol(300μM)抑制PDI(3μM)蛋白的氧化活性。
G图示出了在变性的GAPDH重折叠实验中Vinigrol(300μM)抑制PDI(7μM)蛋白的分子伴侣活性。
7、qRT-PCR
利用RT-qPCR检测Vinigrol对TNF-α诱导基因表达的抑制效果。将在10cm培养皿中过夜培养的L929细胞用20μM Vinigrol预处理4h,随后用10ng/mL TNF-α再孵育1h,该组为实验组。细胞只用10ng/mL TNF-α单独处理1h来诱导NF-κB靶向基因表达。用DMSO或20μMVinigrol处理细胞4h作为阴性对照。处理完毕后收集细胞,如之前的研究报道一样(Cai etal.,2020),进行了RNA提取(Zymo Research,R2072)、cDNA合成(TransGen Biotech,AT311-03)和定量PCR(Kapa Biosystems,KM4101)。
使用的引物如下所列:
GAPDH-Forward 5-TTCACCACCATGGAGAAGGC-3;
GAPDH-Reverse 5-GGCATGGACTGTGGTCATGA-3;
KC-Forward 5-TCGTCTTTCATATTGTATGGTCAAC-3;
KC-Reverse 5-CGAGACGAGACCAGGAGAAAC-3;
MIP-2-Forward 5-CCCCCTGGTTCAGAAAATCATC-3;
MIP-2-Reverse 5-AACTCTCAGACAGCGAGGCACATC-3。
8、胶原蛋白诱导的类风湿关节炎小鼠模型
为了检测Vinigrol分子在体内条件下的作用效果,如先前的研究报道一样,建立了胶原蛋白诱导的类风湿关节炎小鼠模型。简而言之,使用200μg牛的II型胶原蛋白(CII,Chondrex)对6-8周龄的雄性DBA/1小鼠(Huafukang Co.Ltd.)进行皮内免疫,免疫前通过弗氏完全佐剂(Sigma-Aldrich,St Louis,MO,USA)将胶原蛋白乳化。三周后,再使用经弗氏不完全佐剂乳化的100μgII型胶原蛋白进行第二次免疫。随后监测小鼠关节炎的症状并记录临床评分进行详细评估。
临床评分的标准如下:
a.正常,0;
b.一处或者几处关节肿胀,1;
c.出现红斑以及中度肿胀从脚踝延伸到足中部的,2;
d.严重红斑和肿胀从脚踝延伸到跖骨关节,3;
e.包括踝部、足部和手指的完全红斑和肿胀,4。
临床评分的计算是通过将四肢的得分相加来获得,每只小鼠产生0-16的总得分。
将出现关节炎症状的模型小鼠随机分为对照组和治疗组。对于Vinigrol治疗组,在关节炎发作后(大约第26天),用生理盐水稀释Vinigrol(0.5mg/kg)并每隔一天腹腔注射一次。对照组中的模型鼠使用等量的生理盐水进行腹腔注射。对于PDI抗体治疗组,每周通过尾静脉注射200μg PDI抗体,连续四周。对照组使用200μg小鼠IgG2a同种型对照。治疗一个月后,对小鼠实施安乐死并收集关节样本进行进一步分析。
图5示出了Vinigrol在小鼠模型中改善胶原蛋白诱导的类风湿性关节炎。
其中,A图示出了在类风湿性关节炎小鼠模型中验证Vinigrol药效的实验设计。在第0天和第21天分别给小鼠注射胶原蛋白以诱发类风湿性关节炎。从第26天到第56天每隔一天腹腔注射0.5mg/kg的Vinigrol。每周2次记录小鼠关节肿胀程度来评估治疗效果。
B图示出了Vinigrol治疗有效降低了模型鼠的临床评分。对于对照组,n=7。对于0.5mg/kg Vinigrol治疗组,n=7。
C图示出了生理盐水及Vinigrol治疗的模型鼠关节切片的苏木精和伊红(H&E)染色代表性图片。对于上图,Bar=100μm;下图为放大的视野,Bar=50μm。
D图示出了对关节的病理学评分的定量统计。
E和F图示出了通过免疫组化检测生理盐水及Vinigrol治疗的模型鼠关节中TNFR1蛋白的表达。Bar=100μm。
数据为平均值±s.e.m,n代表小鼠的数量。对于B和D图,two-way ANOVA。对于F图,t-test。*P<0.05,**P<0.01。
图6示出了PDI抗体在小鼠模型中改善胶原蛋白诱导的类风湿性关节炎。
其中,A图示出了PDI抗体治疗有效降低了关节炎评分。对照组,n=3。PDI抗体治疗组,n=3。n表示老鼠的数量。
B图示出了对照组和PDI抗体治疗不影响小鼠的体重变化。
C图示出了IgG处理和PDI抗体处理的小鼠的爪切片的H&E染色。炎症、骨侵蚀和软骨损耗分别用红色、黄色或蓝色箭头指出。对于上图,Bar=250μm;下图为放大的视野,Bar=100μm。
D图示出了炎症、骨侵蚀和软骨损伤的组织学评估的定量统计。
数据为平均值±s.e.m。对于A和D图,two-way ANOVA,*P<0.05。
9、苏木精和伊红染色和免疫组织化学
为了进行病理学评估,将每只小鼠的爪子通过4%多聚甲醛(PFA)固定48h。然后将样品在5% EDTA溶液中脱钙、石蜡包埋、切片并用苏木精和伊红(H&E)染色。通过根据之前文献报道的参数对矢状切面进行评分来进行病理学评估。
具体评分标准如下:
a.正常滑膜,0;
b.滑膜肥大和炎症细胞浸润,1;
c.血管翳和软骨侵蚀,2;
d.软骨和软骨下骨的严重侵蚀,3;
e.关节完整性丧失和强直,4。
通过将所有四肢的得分相加并除以4来计算病理学得分,产生每只小鼠0-4的平均得分。为了测试Vinigrol对体内TNFR1受体剪切的影响,通过使用抗TNFR1抗体(AF-425-PB,R&D)进行免疫组织化学。
虽然本发明已以实施例公开如上,然其并非用以限定本发明,本领域的普通技术人员对本发明的技术方案进行的适当修改或者等同替换,均应涵盖于本发明的保护范围内,本发明的保护范围以权利要求所限定者为准。
- 一种跨应用的通知展示、通知内容封装方法和装置
- 一种远程隔离的秘钥访问方法、装置及系统
- 一种传感器网络跨层能量控制方法及装置
- 一种跨网络跨平台监控告警管理装置及方法
- 一种跨隔离网络下应用系统一站式展示的方法与装置
- 一种多网络隔离环境下的网络切换装置及其应用方法
