刺五加提取物在制备调节肠道菌群药物或保健品中的应用
文献发布时间:2024-04-18 20:02:18
技术领域
本发明涉及生物医药领域,具体涉及刺五加提取物在制备调节肠道菌群药物或保健品中的应用。
背景技术
刺五加是五加科植物刺五加Acanthopanax senticosus(Rupr.et Maxim.)Harms的干燥根和根茎或茎,具有益气健脾,补肾安神的功效。刺五加含有多种活性物质,可发挥保护心脑血管、抗氧化、抗疲劳、调节免疫功能等作用,具有良好的药用价值与保健产品开发潜力。随着液相质谱联用等技术的快速发展,刺五加的成分组成逐渐被丰富,形成了较为复杂的化学背景,一方面为功效开发奠定了基础,但同时也给机制研究等造成了较大困扰,对其活性成分的挖掘及与功效间的联系仍有待进一步探索。
近年来,人们发现肠道菌群对机体健康与疾病有着重要影响,肠道菌群甚至可被视为体内重要的“器官”,当菌群结构维持在正常稳态时,能够协调机体促进宿主健康,而菌群的失调则会引发疾病风险,且不仅局限于消化道内,还很可能波及全身。中医理论中,有“心合小肠”的记载,现代医药研究中又确证了“心-肠轴”的存在。许多天然产物口服吸收入血前会经历肠道细菌的代谢转化,可能导致其有效成分活性的增加、失活,或者生物利用度的改变等。另一方面,中药口服后对肠道菌群结构、丰度等也可能起一定的调节作用。
肠道菌群可被视为人体重要的内分泌器官,参与到机体稳态平衡的调节中。充分认识肠道菌群与刺五加的相互作用,对其认识与开发具有重要意义。
发明内容
为了解决现有技术中存在的技术问题,本发明人对于刺五加在肠道菌群的影响进行了深入探究,同时开发了刺五加-益生元共传递给药系统,从而为中药制剂的开发提供新思路。具体地,本发明包括以下内容。
本发明的第一方面,提供刺五加提取物在用于制备调节肠道菌群的药物、保健品或健康产品中的应用。
在某些实施方案中,根据本发明所述的应用,其中,所述刺五加提取物的制备方法如下:将刺五加浸膏配制成溶液,上样于已预先活化好的AB-8型大孔吸附树脂,静置吸附后进行梯度洗脱,所得梯度洗脱液通过减压浓缩与干燥得到刺五加干粉,即为刺五加提取物。
在某些实施方案中,根据本发明所述的应用,其中,所述梯度洗脱溶剂分别为蒸馏水、10%乙醇、20%乙醇、30%乙醇、40%乙醇、50%乙醇、75%乙醇和95%乙醇,每梯度洗脱5BV,洗脱流速为2BV/h。
在某些实施方案中,根据本发明所述的应用,其中,所得梯度洗脱液由30%乙醇溶剂洗脱得到。
在某些实施方案中,根据本发明所述的应用,其中,所述刺五加浸膏的制备如下:将刺五加根粉碎成粗粉,取刺五加粗粉,加入5-20倍体积75%乙醇,浸泡0.5-3小时后,加热回流提取,过滤并合并滤液,减压旋蒸回收乙醇,并进一步干燥得到刺五加浸膏。
在某些实施方案中,根据本发明所述的应用,其中,所述调节是指上调厚壁菌门/拟杆菌门比值,即F/B值。
在某些实施方案中,根据本发明所述的应用,其中,所述调节是指在属水平回调包括但不限于未分类的毛螺旋菌属(unclassified_Lachnospiraceae)、拟普雷沃氏菌属(Alloprevotella)、布劳特氏菌属(Blautia)、Mucispirillum菌属的菌群丰度,并增加益生菌包括但不限于乳杆菌属(Lactobacillus)的丰度。
在某些实施方案中,根据本发明所述的应用,其中,所述调节是指促进包括但不限于Allobaculum菌属和乳杆菌属(Lactobacillus)丰度增加。
在某些实施方案中,根据本发明所述的应用,其中,所述药物、保健品或健康产品包括益生元共传递微球。
在某些实施方案中,根据本发明所述的应用,其中,包括向受试者施用含刺五加提取物的药物、保健品或健康产品的步骤,所述受试者包括人类或动物。
在某些实施方案中,根据本发明所述的应用,其中,所述受试者为由药物引起菌群失调的受试者,该药物包括抗生素类药物,特别是阿霉素。
本发明中,保健品也称为保健食品,在一些情况下,其不以治疗疾病为目的,并且在规定剂量之内,对人体不产生任何急性、亚急性或者慢性危害。健康产品包括实现类似目的的营养品、健康食品、营养补充剂或功能性食品等。
本发明基于微生物组学与非靶向代谢组学技术,测定刺五加提取物给药后,阿霉素诱导的小鼠肠道菌群结构的改变及血清代谢物的变化,获得差异菌群与差异代谢物的相关信息。消化道是药物代谢转化的主要场所,肠道菌群对刺五加的作用主要体现在其对刺五加化合物成分的代谢方面。结果表明,刺五加提取物给药能够影响体内肠道菌群结构及血清代谢物水平,其具有调节肠道菌群等作用。此外,本发明还制备了刺五加提取物与海藻酸钠构建的益生元微球给药系统,为刺五加的制剂开发提供新思路。
附图说明
图1不同树脂对总酚酸的吸附与解吸附情况(图1的A、B);不同pH的上样母液对树脂吸附与解吸附的影响(图1的C),n=3。
图2刺五加经AB-8大孔树脂分离各洗脱部位产率(图2的A);刺五加经AB-8大孔树脂分离各洗脱部位总黄酮含量(图2的B);刺五加经AB-8大孔树脂分离各洗脱部位总酚酸含量(图2的C),n=3。
图3各组小鼠肠内细菌OTU的venn图(图3的A);门水平菌群丰度比较(图3的B);属水平菌群丰度比较(图3的C)。
图4肠道微生物Alpha多样性(图4的A);空白组与DOX组PCA分析图(图4的B);样品PCA分析图和PCoA分析图(图4的C)。
图5样品聚类热图。
图6LDA值分布柱状图。
图7门水平上肠道菌群与宿主代表性差异代谢物关联图。
图8属水平上肠道菌群与宿主代表性差异代谢物关联图。
图9菌群剥夺实验和菌群移植的验证实验设计图。
图10刺五加-海藻酸钠微球在人工胃液中的释放情况。
图11刺五加-海藻酸钠微球在人工肠液中的释放情况。
图12刺五加-海藻酸钠微球在属水平对肠道菌群丰度的影响(*P<0.05,**P<0.01)。
具体实施方式
现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为具体公开了该范围的上限和下限以及它们之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
除非另有说明,否则本文使用的所有技术和科学术语具有本发明所属领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
本发明中,益生元共传递微球是由β-D-甘露糖醛酸(M)和α-L-古洛糖醛酸(G)2种结构单元,以3种方式(MM段、GG段、MG段)通过(1→4)糖苷键链接而成的线性嵌段共聚物。在优选的实施方案中,益生元类药物、保健品或健康产品载体为海藻酸钠。
本发明中,刺五加-益生元共传递微球的制备方法包括:
(1)将海藻酸钠溶于水中得到海藻酸钠溶液;
(2)刺五加活性部位(即刺五加的Et30%提取物)与海藻酸钠混合,滴入金属离子溶液,经搅拌,冲洗,冷冻干燥,得到刺五加-益生元共传递微球。
在一个优选的实施方案中,海藻酸钠浓度为0.1-10%,优选1-8%,还优选2-6%,进一步优选3-5%,最优选4%。
在一个优选的实施方案中,刺五加的Et30%提取物与海藻酸钠的质量比为0.1-50:1,优选0.2-10:1,还优选0.4-5:1,进一步优选优选0.6-2:1,更优选0.8-1:1,最优选1:1。
在一个优选的实施方案中,金属离子溶液为钙离子的溶液,特别是氯化钙溶液。在金属离子溶液是氯化钙溶液的情况下,其浓度为0.1-10%,优选1-8%,还优选2-6%,进一步优选3-5%,最优选4%。
本领域技术人员应理解,只要能够实现本发明的目的,在涉及方法的步骤前后,或步骤之间还可包含其他步骤或操作,例如进一步优化和/或改善本发明所述的方法。
实施例1
本实施例为刺五加活性部位的制备与成分分析。
1、方法
1.1刺五加醇浸膏制备
将刺五加根粉碎成粗粉,取刺五加粗粉,加入10倍体积75%乙醇,浸泡1h后,加热回流提取2次,每次6h,过滤并合并滤液,减压旋蒸回收乙醇,并进一步干燥,得到刺五加醇浸膏。
1.2树脂型号的筛选
1.2.1树脂的预处理
取AB-8、D301、D303、D314、D315、D318、D900、聚酰胺粉30-60目、聚酰胺粉80-100目等9种不同材料或型号的树脂适量,加入足量乙醇浸泡过夜,装柱,以乙醇冲洗,至洗液与水1:3混合后不产生浑浊时,改用蒸馏水冲洗至流出液无醇味。然后加0.5M盐酸溶液静置2h,并继续以该浓度酸冲洗2BV,再以蒸馏水冲洗至洗液pH恢复中性。继续加入0.5M氢氧化钠溶液静置2h,冲洗2BV后,更换为蒸馏水冲洗,直至洗液pH恢复中性,备用。
1.2.2上样溶液的制备
取刺五加浸膏,制成浓度为20mg/mL的水溶液,过滤后作为上样母液,备用。
1.2.3静态吸附与解吸附实验
准确称取各型号树脂1g,分别置于100mL具塞锥形瓶中,各加入30mL刺五加母液,于25℃、120rpm条件下吸附2h,过滤,收集滤液,然后加入蒸馏水冲洗至洗脱液无色。再加入95%乙醇溶液30mL,于25℃、120rpm条件下解吸附2h后,过滤,收集洗脱液。测定上样母液、滤液和洗脱液中的总酚酸含量,计算相应吸附量与解吸附量。
吸附量=(C0-C1)*V1/W;解吸量=C2*V2/W;解吸率(%)=C2*V2/(W*Q)*100,公式中C0为上样母液中总酚酸的初始质量浓度,C1为吸附过后滤液中总酚酸的质量浓度,C2为洗脱液中总酚酸的质量浓度,V1为上样母液体积,V2为洗脱液体积,W为树脂的干重,Q为吸附量。
1.2.4考察上样母液pH改变对吸附与解吸附的影响
准确称取AB-8、D303型树脂和聚酰胺30-60目树脂1g,分别置于100mL具塞锥形瓶中,将刺五加母液用0.5M氢氧化钠调节pH分别为7、8、9和10,上样,洗脱,收集滤液与洗脱液,并测定总酚酸含量。
1.2.5AB-8型大孔吸附树脂分离
通过实验筛选,发现AB-8型大孔吸附树脂对刺五加提取物具有较好的吸附和解吸附特性,适用于刺五加醇浸膏的进一步纯化。具体柱层析操作方法如下:将刺五加浸膏配制成浓度约为80mg/mL的溶液,上样于已预先活化好的AB-8型大孔吸附树脂,上样量为50mg/g树脂,上样结束后,静置吸附过夜后进行梯度洗脱。梯度洗脱溶剂分别为蒸馏水、10%乙醇、20%乙醇、30%乙醇、40%乙醇、50%乙醇、75%乙醇和95%乙醇,每梯度洗脱5BV,洗脱流速为2BV/h。各梯度洗脱液通过减压浓缩与干燥,得到刺五加经AB-8大孔树脂分离纯化的各组分干粉,分别命名为水洗部分、Et10%(10%乙醇洗脱部分)、Et20%、Et30%、Et40%、Et50%、Et75%和Et95%,称重,备用。
1.2.6活性成分分析
测定吸光度,根据相应标准曲线计算各样品中的总酚酸、总黄酮含量测定。
2、实验结果
2.1刺五加浸膏制备
以75%乙醇回流提取刺五加药材,醇浸膏得率为8.78±0.16%。
2.2树脂筛选
2.2.1静态吸附结果
不同树脂对总酚酸的吸附与解吸附情况如图1的上图所示。从吸附量上比较,除D315和D318的吸附量较低,大多数树脂的吸附量在7-8.5mg/g。从解吸量比较,除AB-8树脂的解吸量超过7mg/g外,其他树脂的解析量多在4mg/g以下。作为普通型大孔吸附树脂的代表,AB-8型树脂的吸附量与解吸附量均具有较大优势。阴离子型树脂D301、D303、D314、D315、D318和D900中,D315和D318因吸附量过低而排除,剩余4种在吸附量上没有显著差异,在解吸率上,D303更有优势(P<0.05),因此选择D303作为阴离子型交换树脂代表进行接下来的研究。在聚酰胺型树脂中,80-100目比30-60目吸附量略多,在解吸率上30-60目优于80-100目(P<0.01),因此选择30-60目作为聚酰胺树脂型号进行后续研究。
2.2.2上样母液pH对吸附与解吸附的影响
图1的C显示了不同pH的上样母液在AB-8、D303和聚酰胺30-60目树脂上的吸附与解吸附情况。可以看出,不同pH的上样母液,对AB-8型树脂和聚酰胺30-60目树脂的吸附与解吸附情况没有显著影响。对于D303型树脂,会随着pH的升高,吸附量有一定增加,当pH为9时,具有最大吸附量,当pH进一步升高到10时,吸附量开始下降。但母液pH对洗脱效果影响并不显著,D303树脂的洗脱率仍在40%左右。综合考察结果,pH虽然会提升阴离子型树脂的吸附量,但解吸附存在困难,聚酰胺树脂的吸附与解吸附情况对比AB-8型树脂也没有明显优势,因此选择AB-8型树脂用于刺五加浸膏的进一步分离纯化。
2.3刺五加经AB-8型大孔吸附树脂分离后各组分产率
刺五加醇浸膏经AB-8型大孔吸附树脂吸附后,以不同浓度的乙醇溶液进行洗脱,所得各组分产率如图2的A所示。其中,水洗脱部分收率最高,约占58%,说明刺五加浸膏中水溶性成分占有较大比例。Et10%、Et20%和Et30%组分产率在5%-10%之间,Et40%、Et50%、Et75%和Et95%组分产率则低于5%。随着洗脱剂乙醇浓度的升高,洗脱组分从水易溶性向脂溶性变化。各组干燥后,除Et95%组分外,其余各组均可得黄色至棕黄色干燥粉末,Et95%组分可能因脂溶性过高,难以得到颗粒状粉末而呈现一定的油性特点。
2.4刺五加经AB-8型大孔吸附树脂分离后各组分总黄酮与总酚酸含量
2.4.1总黄酮含量
黄酮类化合物是刺五加的重要活性物质类别之一,主要可以黄酮苷类或苷元形式存在。刺五加醇浸膏经AB-8型大孔吸附树脂吸附后,以不同浓度的乙醇溶液进行洗脱,所得各组分总黄酮(以芦丁计)含量如图2的B所示。刺五加醇浸膏总黄酮含量约为20%,以其为参照,总黄酮含量较高的组分有Et10%、Et20%和Et30%,Et10%测得的总黄酮值以超过70%与其他组形成明显差距,其次是Et30%组,总黄酮含量为41.51±3.03%,Et20%的含量约35%位居其后。Et40%具有与醇浸膏相似总黄酮含量,而其余组总黄酮含量均明显低于醇浸膏。尽管根据产率,水洗脱部分占据醇浸膏的主要质量组成,但该组分中总黄酮含量仅在8%左右。Et95%组分总黄酮含量则为最低,为5%左右。
2.4.2总酚酸含量
刺五加中包括多种酚酸类物质,如绿原酸、新绿原酸、咖啡酸、奎宁酸、阿魏酸、原儿茶酸及其衍生物等。总酚酸(以咖啡酸计)含量如图2的C所示。刺五加醇浸膏总酚酸含量约为15%,除水洗脱部份和Et95%的总酚酸含量仅为7%左右,其他各组的总酚酸含量基本位于20%-30%区间。
实施例2
以下示出了刺五加活性部位Et30%组分的液质联用成分分析结果。结果如表1所示。
表1刺五加活性部位Et30%组分中主要化学成分信息
这些物质大多属于苷类、黄酮类、香豆素类或多酚类物质。Dicaffeoyl quinicacid(二咖啡酰奎宁酸)可能存在4个同分异构体,可能分别对应1,3-Dicaffeoyl quinicacid,1,4-Dicaffeoyl quinic acid,3,4-Dicaffeoyl quinic acid和3,5-Dicaffeoylquinic acid。化学物质基础的明确,为后续探究刺五加活性部位Et30%组分的分子机制奠定了基础。
实施例3
本实施例为刺五加活性部位对阿霉素诱导的小鼠的肠道菌群影响。
1、实验方法
1.1动物给药方案
雄性ICR小鼠(辽宁长生生物技术股份有限公司,许可证号SCXK(辽)2020-0001,相关动物实验操作均符合实验动物道德伦理委员会要求),随机分成4组,每组12只,分组如下:(1)空白组;(2)DOX组;(3)Et30%组分低剂量(25mg/kg)组(AS30L);(4)Et30%组分高剂量(75mg/kg)组(AS30H)。空白组每日灌胃10mL/kg的0.3%CMC-Na溶液,连续21日,并于第1、3、5、7日腹腔注射生理盐水10mL/kg。DOX组每日灌胃10mL/kg的0.3% CMC-Na溶液,连续21日,并于第1、3、5、7日腹腔注射DOX 2.5mg/kg。第(3)和第(4)组,分别按照低剂量25mg/kg/d和高剂量75mg/kg/d连续灌胃Et30%组分21天,均以0.3%CMC-Na溶液配制,每次给药体积为10mL/kg,同时在第1、3、5、7日腹腔注射DOX 2.5mg/kg。在实验动物处死取材前,禁食不禁水12h。小鼠安乐处死后,即刻截取其肠道结肠段样本(包括肠道内容物)至2mL冻存管中,然后立即用液氮速冻处理15min,保存至-80℃冰箱。
1.2肠内容物微生物组学研究
1.2.1肠内容物基因组DNA提取
使用TGuide S96磁珠法土壤/粪便基因组DNA提取试剂盒完成核酸的提取,并基于Illumina NovaSeq6000平台进行文库构建与测序,对原始数据进行拼接(FLASH,version1.2.11),将拼接得到的序列进行质量过滤(Trimmomatic,version 0.33)并去除嵌合体(UCHIME,version 8.1),得到高质量的Tags序列。
1.2.2OTU/ASV分析
在相似性97%的水平上对序列进行聚类(USEARCH,version 10.0),以测序所有序列数的0.005%作为阈值过滤可操作分类单元(Operational Taxonomic Unit,OTU)。使用DADA2进行降噪,得到ASV,以测序所有序列数的0.005%作为阈值过滤OUT。
1.2.3物种注释及多样性分析
利用细菌16S:Silva(Release138.1,http://www.arb-silva.de)数据库进行物种注释分析,获得分类信息并统计各样本的群落组成。对各样本的数据进行均一化处理后,应用Mothur version.v1.30(http://www.mothur.org/)进行Alpha多样性分析。采用PCA,PcoA,样品热图、LefSe等分析方法进行Beta多样性分析。相关差异利用R语言进行分析及作图。
1.3非靶向代谢组学分析
1.3.1代谢物提取
取100μL血清样本,加入500μL含有内标(1000:2)的提取液(甲醇乙腈体积比=1:1,内标2-氯丙氨酸浓度2mg/L),涡旋混匀30s后于冰水浴超声10min,在-20℃静置1h后将样本12000rpm、4℃离心15min。吸取500μL上清液于1.5mL EP管中,于真空浓缩器中干燥。向干燥后的残留物加入160μL提取液(乙腈水体积比:1:1)复溶,涡旋30s再冰水浴超声10min,取上清液120μL加入进样瓶用于LC-MS分析。可每个样本各取10μL混合成QC样本进行上机检测。
1.3.2上机检测条件
用于代谢组学分析的液质联用系统由Waters Acquity I-Class PLUS超高效液相串联Waters Xevo G2-XS QTof高分辨质谱仪组成。
色谱条件:色谱柱:Waters Acquity UPLC HSS T3色谱柱(1.8μm 2.1*100mm);柱温:50℃;进样体积:1μL;流动相:流动相A:0.1%甲酸水溶液;流动相B:0.1%甲酸乙腈;流速0.4mL/min。
表2梯度洗脱表
质谱条件:Waters Xevo G2-XS QTof高分辨质谱仪能够在采集软件(MassLynxV4.2,Waters)控制下的MSe模式进行一级、二级质谱数据采集。在每个数据采集循环中,能够同时对低碰撞能量及高碰撞能量进行双通道数据采集。低碰撞能量2V,高碰撞能量区间为10-40V,扫描频率为0.2s/张质谱图。ESI离子源参数如下:毛细管电压:2000V(正离子模式)或-1500V(负离子模式);锥孔电压:30V;离子源温度:150℃;脱溶剂气温度500℃;反吹气流速:50L/h;脱溶剂气流速:800L/h。
1.3.3信息统计学分析
对代谢物进行多元统计分析,包括主成分分析(Principal component analysis,PCA)、偏最小二乘法分析(Partial least squares discriminant analysis,PLS-DA)等,揭示不同比对组别代谢组成的差异。利用代谢物-代谢物相关性分析揭示代谢物和样本之间的关系。最后,通过代谢通路等功能分析发现代谢物相关的生物学意义。
2、实验结果
2.1菌群测序及分析
2.1.1菌群测序结果评估
通过16SrRNA基因测序与质量筛选后,从小鼠结肠内容物样本中共获得了1468314个优化序列。根据97%的序列相似度,对序列进行OTU聚类划分,依照各组样品共有、特有的OTU信息,绘制venn图(图3的A)。如图所示,与空白组相比,模型DOX组细菌OTU数量较少,而给药组AS30L和AS30H组的数量则明显多于DOX组,且AS30H组数量高于AS30L组。提示模型组DOX造模会导致细菌总数降低,Et30%给药后能够提高结肠细菌总数。
2.1.2物种组成分析
根据生物分类学,可从界、门、纲、目、科、属、种七个分类水平对肠道微生物组成进行物种注释。在界水平,该方法检测到所有样本均包含细菌类别,部分样本检测到有属于古细菌范畴内的微生物。在其他分类水平上,代表性选取门和属水平上相对丰度较高的菌群进行展示,结果如图3的B和C所示。
在门分类水平上,拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)是各组肠道菌共同的主要组成部分,总丰度占比均超过80%,但相对丰度存在较大差异。在空白组中,拟杆菌门丰度最高,厚壁菌门相对较低,而模型DOX组则呈现相反的情况,均有显著性差异(P<0.05),F/B值(Firmicutes/Bacteroidetes)出现较大改变,该指标常用来评估菌群失调,说明DOX造模后,菌群可能出现失调,而刺五加Et30%组分给药可以一定程度回调该指标。另一方面,对比空白组,DOX组的变形菌门丰度下降,Campylobacterota、放线菌门(Actinobacteriota)、脱硫菌门(Desulfobacterota)和脱铁杆菌门(Deferribacterota)丰度略有上升。
在属水平上,与空白组对比,模型DOX组的unclassified_Lachnospiraceae、Lachnospiraceae_NK4A136_group、布劳特氏菌属(Blautia)、螺杆菌属(Helicobacter)、Mucispirillum等丰度升高,拟普雷沃氏菌属(Alloprevotella)、Parasutterella、拟杆菌属(Bacteroides)、副杆菌属(Parabacteroides)丰度下降。Et30%组分给药,可以一定程度回调unclassified_Lachnospiraceae、Alloprevotella、Blautia、Mucispirillum等丰度。此外,Et30%组分可能可以促进Allobaculum和Lactobacillus丰度增加。
2.1.3Alpha多样性分析
Alpha多样性反映的是单个样品物种丰富度及物种多样性,有多种衡量指标:Chao1、Ace、Shannon、Simpson。Chao1和Ace指数衡量物种丰富度,即物种数量的多少。Shannon和Simpson指数用于衡量物种多样性,受样品群落中物种丰富度和物种均匀度的影响。相同物种丰富度的情况下,群落中各物种具有越大的均匀度,则认为群落具有越大的多样性。Shannon指数值越大,Simpson指数值越大,说明样品的物种多样性越高。图4的A显示的是各组在OUT分类水平上的Alpha多样性指数结果,除Simpson指数上四组之间没有显著性差异,其他三项指标DOX组均处于较低水平。Chao1指数中,DOX组与其他各组均有差异(P<0.05),但空白组与Et30%给药组之间无明显差异;Ace中趋势与Chao1的趋势一致;Shannon指数,DOX组与Et30%给药组之间有显著性差异(P<0.01),但与空白组之间未见统计学差异。综合各项指标分析,结肠微生物丰富度与多样性在模型DOX组有一定下降,而给药Et30%组分能够有所提升,提示该组分对肠道菌群有一定干预作用。
2.1.4Beta多样性分析
Beta多样性指数一般用于比较多个样本间的差异,可通过主成分分析(PCA)、主坐标分析(PCoA)等对所有样本的OTU结果进行分析,由此比较组内样品的相似性与组间样品的差异性。
PCA运用方差分解,将多组数据的差异反映在二维坐标图上,坐标轴取能够最大反映方差的两个特征值。两个样品距离越近,则表示这两个样品的组成越相似。若各群落点投影到水平线距离差距越远,表示差异越大。在PCA图中(图4的B)可以看出,空白组与模型DOX组能够很好的分离,表明造模成功。
PCoA是一种与PCA类似的降维排序方法,原理是假设对N个样品有衡量它们之间差异或距离的数据,就可以用此方法找出一个直角坐标系,将N个样品表示成N个点,而使点间的欧式距离的平方正好等于原来的差异数据,实现定性数据的定量转换,从多维数据中提取出最主要的元素和结构。PCA与PCoA图(图4的C)展示了空白组、模型DOX组和给药高低剂量组的差异情况,空白组与DOX组有较为明显的分离情况,给药组有一定靠近空白组的趋势,表明Et30%组分给药可以调节DOX造模小鼠肠道菌群结构。
2.1.5聚类分析
为比较空白组、模型DOX组与Et30%给药组之间的样本相似度,采用了基于bray的聚类分析方法。如图5所示,空白组聚类较为紧密,说明组内样本相似性较高,其他组内样本有一定的分散。给药组相对模型组,与空白组聚类略近,推测给药组对菌群结构有所改善。
2.1.6物种差异分析
利用LEfSe分析(LDA>4,P<0.05)实现各组在所有分类水平上同时进行差异分析,以获得标志物种。同时采用线性判别分析(LDA)估算差异物种对差异的贡献度,帮助判断受干预因素影响的细菌类型,如图6所示。
在空白组中,对菌群改变起重要作用的微生物类群包括拟杆菌属(Bacteroides)、坦纳菌科(Tannerellaceae)、Parabacteroides和Erysipelatoclostridiaceae等。在DOX组中,主要为脱铁杆菌属(Mucispirillum)及脱硫弧菌属(Desulfovibrionaceae)。在Et30%给药组中,则主要是拟普雷沃氏菌属(Alloprevotella)、Ruminococcaceae、放线菌门(Actinobacteriota)、红蝽菌目(Coriobacteriales)、螺杆菌属(Helicobacter)、弯曲菌目(Campylobacterales)、Lachnospiraceae_NK4A136_group、Allobaculum、颤螺菌属(Oscillospiraceae)等。
2.1.7微生物组学与代谢组学联合分析
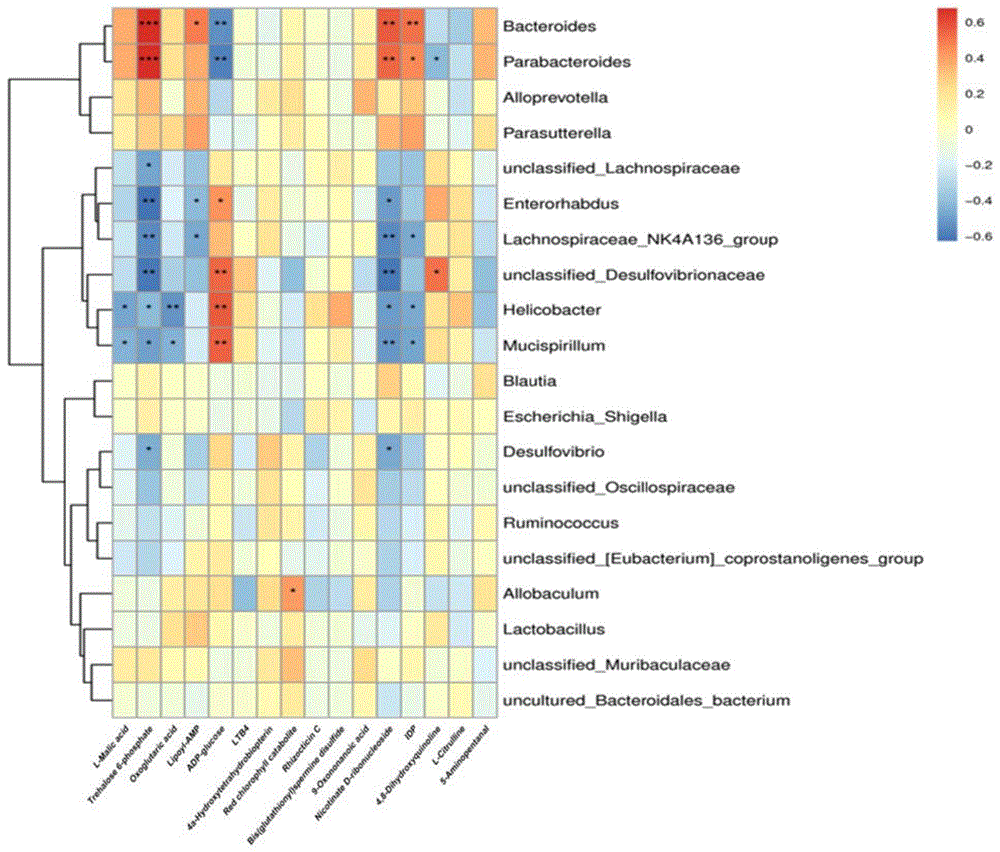
为深入阐明刺五加活性部位对DOX诱导的小鼠模型的作用效应,尤其是肠道菌群变化与差异代谢物之间关联。分别筛选了门分类水平上总丰度前10和属水平总丰度前20的物种与血清中能够富集于KEGG通路中的代表性差异代谢物进行Pearson相关性分析(P<0.05),结果如图7和8所示。
由图7和8可知,Campylobacterota和Deferribacterota与L-Malic acid、Oxoglutaric acid、Nicotinate D-ribonucleoside和IDP呈负相关,与ADP-glucose呈正相关。Firmicutes与Trehalose 6-phosphate、Nicotinate D-ribonucleoside呈负相关。Bacteroidota与L-Malic acid、Trehalose 6-phosphate、IDP呈正相关,与ADP-glucose呈负相关。在属水平上,Bacteroides和Parasutterella主要与Trehalose 6-phosphate、Nicotinate D-ribonucleoside、IDP呈正相关,与ADP-glucose呈负相关。Enterorhabdus、Lachnospiraceae_NK4A136_group、unclassified_Desulfovibrionaceae、Desulfovibrio、Helicobacter、Mucispirillum主要与Trehalose 6-phosphate、Oxoglutaric acid、Lipoyl-AMP、Nicotinate D-ribonucleoside和IDP呈负相关,与ADP-glucose呈正相关。
以上结果表明,肠道菌群与宿主代谢情况存在相关性,调节肠道菌群构成或可影响宿主体内代谢情况,进而影响宿主的健康状态。
3、讨论
高通量测序的微生物组学技术可以帮助对肠道微生物的研究更加全面和深入,通过对大量的序列数据进行分析,可以快速而准确地识别出肠道微生物的组成,了解不同菌群的相对丰度,考察不同环境或因素对菌群的影响等,以便更好地理解肠道微生物与机体健康、疾病之间的关系。
消化道内的微生物群体,在正常状态下是一个动态平衡生态系统,与宿主的代谢、免疫等功能等紧密关联。本研究发现,正常小鼠结肠内门水平以拟杆菌门为主,厚壁菌门和变形菌门次之。在以DOX造模后,明显出现拟杆菌门、变形菌门下降,而厚壁菌门增多的现象,说明小鼠体内菌群可能失去原有平衡。在门、属水平与LEfSe分析中发现,脱硫弧菌属(Desulfovibrionaceae)是DOX模型组中对菌群改变起重要作用的微生物类群。该菌群通常被认为是有害菌,其过度生长可能会对肠道健康产生不良影响。这些细菌可以产生硫化氢等有毒代谢产物,进而引发肠道炎症、肠道黏膜损伤等问题。此外一些研究发现,脱硫弧菌属的过度生长还可能与肠道疾病的发生有关,例如炎症性肠病、结肠癌等。
从属分类上看,空白组中Muribaculaceae、Alloprevotella、Parasutterella和拟杆菌属(Bacteroides)相对占有较大比例。Muribaculaceae属于拟杆菌门,可以帮助分解和消化复杂多糖类物质,如纤维素,产生短链脂肪酸,同时提供能量等。该菌群具有较好的生态适应性,可以适应不同的肠道环境和饮食结构,因此在各组中丰度没有明显差别。Alloprevotella是革兰氏阴性菌,是肠道微生物群中的常见成员之一。一些研究表明,它们可能参与多种肠道代谢反应,包括分解多糖和产生SCFAs等。Alloprevotella也可能参与调节免疫系统的功能,对抗肠道炎症和保护肠道黏膜屏障有重要作用。在AS高低剂量组中,相对于造模DOX,Alloprevotella的丰度有所上升。此外,DOX造模后,出现了Lachnospiraceae菌群丰度升高的现象(unclassified_Lachnospiraceae和Lachnospiraceae_NK4A136_group)。Lachnospiraceae属于革兰氏阳性菌,有研究认为其实潜在的有益菌群,可以参与多种代谢反应,包括分解膳食纤维、产生SCFAs、调节肠道黏膜屏障等。此外,Lachnospiraceae还可以影响免疫系统的功能,调节免疫细胞的数量和活性,从而维持肠道的健康状态。DOX造模使其升高的原因尚不清楚,可能的机制是阿霉素刺激肠道保护机制,增加有益微生物群,或者阿霉素本身也可作为广谱抗生素,一些菌群对其抗性较强,因此能够在肠道内逐渐积累丰度增加。LEfSe分析中Et30%的代表性菌群Ruminococcaceae是一类革兰氏阳性菌,一般被认为是有益的菌群,可参与膳食纤维的分解、产生SCFAs等,还可以帮助维持肠道黏膜屏障的完整性,抑制肠道病原微生物的生长,维护肠道的稳态。Oscillospiraceae是一类革兰氏阳性菌,可参与多种代谢过程,包括产生SCFAs、调节肠道pH值、增强肠道黏膜屏障等。最近的研究认为Oscillospiraceae可能对肠道健康有益,可以调节肠道免疫系统、增加肠道微生物群的多样性、抑制肠道炎症等。Allobaculum属于革兰氏阳性菌,可参与碳水化合物和脂质代谢、维生素合成等,有研究认为其可促进肠道免疫系统的正常功能、抑制肠道炎症反应等。Lactobacillus是公认的益生菌类,在空白组和DOX组中丰度无明显差别,但在刺五加给药组中发现该菌丰度提升,它可以发挥抑制肠道中有害菌的生长,调节肠道pH值,提高肠道黏膜屏障的功能,亦可增强肠道免疫系统的正常功能等。Campylobacterales是一类革兰氏阴性菌,在肠道中作用较为复杂。一方面,它们参与了多种代谢过程,包括产生能量、消化蛋白质、碳水化合物和脂类等,还可以产生一些对人类有益的代谢产物,如丙酮酸和乳酸等,有助于维持肠道微生物群的稳定性和功能。另一方面,Campylobacterales也被认为是肠道中的致病菌之一。如Campylobacter jejuni感染可以引起胃肠炎、腹泻等疾病。尽管近些年有关肠道菌群的研究不断增多,但对于一些菌群的认识仍十分有限,对其功能研究也不完善,一些菌群在肠道内可能具有双重作用,既参与辅助代谢,又在某些情况下存在致病风险。因从整体性与动态稳态的角度识别肠道菌群组成更有意义,此外对菌群的研究也需不断深入。
总之,本实施例通过微生物组学与非靶向代谢组学技术,发现刺五加活性部位给药能够在门水平回调DOX造成的F/B值升高,在属水平回调unclassified_Lachnospiraceae、Alloprevotella、Blautia、Mucispirillum等菌群丰度,并增加益生菌Lactobacillus丰度。在Alpha多样性分析中,发现DOX造模可能降低菌群多样性,而刺五加活性部位给药可以提升菌群多样性。在Beta多样性分析中,分析得到差异菌群,并对相关菌群的作用进行了分析与讨论。这些肠道菌群可能通过物质代谢、肠道pH改变、以及形成肠黏膜屏障等方面影响机体的健康。
实施例4
在以上研究中,本发明利用微生物组学与代谢组学考察了DOX造模及刺五加活性部位给药后相关肠道菌群变化。结果显示,造模药DOX对肠道菌群的组成也有较大影响,例如F/B值显著上升。刺五加活性部位给药后,部分菌群丰度能够向空白对照组回调,推测刺五加能够一定程度改善DOX造成的菌群紊乱情况。同时,体内代谢物也因造模与给药产生了变化,在联合分析中,建立了部分关键代谢物与菌株的联系,提示菌群的变化与体内代谢情况等存在关联。而刺五加活性部位与肠道菌群的关联需要进一步验证。
在本实施例中,利用菌群剥夺实验和菌群移植实验探究肠道菌群对于宿主健康和疾病的影响。菌群剥夺实验通常采用广谱抗生素,将动物的肠道菌群全部或部分清除,然后考察动物的生理表现。菌群移植实验则是将健康或疾病的肠道菌群移植到另外一个宿主的肠道中,然后观察该宿主的生理表现。利用这两种实验方法,可以更好地评价肠道菌在药物治疗中的作用,揭示肠道菌群与宿主健康之间的因果关系,在本研究中帮助判断刺五加活性部位发挥疗效是否有“心-肠轴”的参与。
菌群剥夺与菌群移植实验设计如图9所示,具体如下。
1、菌群剥夺方法
雄性ICR小鼠,按照是否进行菌群剥夺随机分成2组,菌群不剥夺组以正常饮食饮水适应性饲养2周后给药,菌群剥夺组于饮用水中添加抗生素混合物(0.5g/L氨苄西林、1g/L链霉素、0.5g/L万古霉素和1g/L庆大霉素),2周后将含有抗生素的水更换为正常水,再进行造模与给药研究。
两周后,将菌群不剥夺组小鼠随机分为3组:(1)空白组;(2)DOX组;(3)DOX+Et30%组(AS);将菌群剥夺组小鼠随机分为4组:(4)DOX组(B-DOX);(5)DOX+Et30%组(B-AS);(6)DOX+空白粪便移植组(Y-DOX);(7)DOX+Et30%粪便移植组(Y-AS)。造模:除空白组外,其余各组均于第1、3、5、7日腹腔注射DOX 2.5mg/kg,空白组注射生理盐水10mL/kg替代。给药:空白组、DOX、B-DOX组每日灌胃10mL/kg的生理盐水,AS、B-AS组每日灌胃Et30%组分75mg/kg,Y-DOX和Y-AS组每日分别灌胃对应供体的0.1mL粪便溶液(菌液)。连续给药21天后,对实验动物进行取材。
2、菌群移植实验小鼠供体与菌液制备
Y-DOX的粪便供体小鼠:在首次给药前一周至给药后21天,每日灌胃生理盐水。Y-AS的粪便供体小鼠:在首次给药前一周至给药后21天,每日灌胃Et30%组分75mg/kg。每日取供体小鼠的新鲜粪便约100mg于1.5mL无菌离心管中,加入1mL生理盐水重悬。涡旋30s使粪便样品充分混合,然后在4℃下以6000rpm离心10min,取上清液对受体小鼠进行菌群植入。
结果发现,在给药及造模前,先将小鼠分为2大组,一组正常饮水,另一种利用鸡尾酒抗生素法配制饮水,用以去除小鼠肠道内原有细菌。在菌群剥夺的2周内,两组小鼠的身体外观、精神状态、行动能力等未见有显著差异,饮食情况正常,剥夺组饮水量略少于未处理组,可能与抗生素水溶液气味等有关,但两组之间体重值未有明显差异,在造模前测定两组体重值,未处理组37.46±2.16g,菌群剥夺组37.71±3.02g。
菌群剥夺2周后,将两大组内小鼠根据实验方案随机分成各小组,开始造模与给药。各组分别于第1、2、3周结束时测定并记录体重。除空白组外,因其他各组随着DOX累积剂量的增加,在第一周内体重大体趋势呈现增长缓慢直至负增长,到比初始体重减轻。第7天时,AS组体重下降幅度最低,B-DOX组下降值最大,但B-DOX组、B-AS组、Y-DOX组和Y-AS组之间并未构成显著差异。第14天称量时,AS组和B-AS组的体重略有恢复,DOX组、B-DOX组、Y-DOX组体重趋势仍是下降,其中DOX组下降幅度较大,Y-AS组相比第7天时体重未见明显变化。第21天时,AS组和B-AS组体重继续增长,AS组体重超过初始值,DOX组、B-DOX组、Y-DOX组体重仍略有下降,B-DOX组、Y-DOX组相对DOX组下降幅度略减小。Y-AS组基本维持在原水平。在实验全程,空白组的体重基本为上涨趋势,后期逐渐趋于平稳。总之,在DOX造模的各组中,AS组体重增长值最高,B-AS组次之,说明刺五加活性部位给药可以改善DOX对机体的损伤,且肠道菌群的存在可能更有利于活性部位发挥效果。在菌群移植组中,移植了刺五加活性部位给药小鼠粪便菌群的Y-AS组比移植空白小鼠菌群的Y-DOX组体重下降更少,说明刺五加活性部位给药能够调节肠道菌群,或可使菌群中的有益菌提升,增强肠道免疫能力,以抵御DOX的不利刺激。
实施例5
本实施例示出了刺五加-益生元共传递微球制备与药效评价。
一、实验方法
1、刺五加-海藻酸钠微球制备
精密称取一定量海藻酸钠,溶于蒸馏水中,加热搅拌至充分溶解,得海藻酸钠溶液。精密称取氯化钙适量,配制一定浓度的氯化钙溶液。精密称取适量刺五加活性部位Et30%,将刺五加活性部位与海藻酸钠以一定比例混合均匀,用注射器将混合液滴入氯化钙溶液中,磁力搅拌30min,待微球形成后用蒸馏水反复冲洗,冷冻干燥,即得。
2、含量测定
精密称取刺五加苷E对照品10.20mg,置于25mL容量瓶中,加50%甲醇溶解并定容。混匀,精密量取1.0mL,置于10mL容量瓶中,加50%甲醇定容,供HPLC测定。色谱柱:AgilentZORBAX SB-Aq(250mm×4.6mm,5μm),检测波长:220nm,柱温:30℃,流动相:乙腈-0.1%磷酸,洗脱方式:梯度洗脱(见梯度洗脱表3),流速:1mL/min,进样量:10μL。
表3梯度洗脱表
3、稳定性考察
取同一批供试品溶液,按照色谱条件分别于0、2、4、8、12、24h进样测定,记录刺五加苷E的峰面积,计算样品中含量的RSD值。
4、包封率和载药量的测定
将干燥的刺五加-海藻酸钠微球研碎,精密称取样品,置具塞锥形瓶中,精密加入50%甲醇25mL,密塞,称定重量,超声处理(功率250W,频率50kHz)30min,放冷,再称定重量,用50%甲醇补足减失的重量,摇匀,0.22μm滤膜滤过,取续滤液,按2.2.3项下色谱条件测定刺五加苷E的含量,并按公式计算载药量和包封率。
5、正交实验设计
在预试制备刺五加-海藻酸钠微球的过程中,发现海藻酸钠溶液的浓度(A)、刺五加活性部位投药量与海藻酸钠的质量比(B)、氯化钙溶液的浓度(C)可能是影响微球制备的主要因素,因此选择这三个因素作为探究刺五加-海藻酸钠微球的最佳制备工艺的主要考察因素,每个因素选3个水平(表4),进行正交试验。
表4正交试验因素水平
6、考察刺五加-海藻酸钠微球的体外释放情况
6.1在人工胃液中的释放情况
称取0.5g微球,以人工胃液250mL为释放介质,温度37±0.5℃,转速50rpm,分别于0.5、1、1.5、2、4和6h量取释放介质2mL,同时补充等温度等体积的空白人工胃液,经0.22μm滤膜滤过,取续滤液,按所述色谱条件测定刺五加苷E的含量,进而计算刺五加-海藻酸钠微球在人工胃液条件下刺五加活性部位的体外释放量,并绘制体外释放曲线。
6.2在人工肠液中的释放情况
称取0.5g微球,以人工肠液250mL为释放介质,温度37±0.5℃,转速50rpm,分别于0.5、1、2、4、6、8和12h量取释放介质2mL,同时补充等温度等体积的空白人工肠液,经0.22μm滤膜滤过,取续滤液,按所述色谱条件测定刺五加苷E的含量,进而计算刺五加-海藻酸钠微球在人工肠液条件下刺五加活性部位的体外释放量,并绘制体外释放曲线。
7、给药方案
雄性ICR小鼠,随机分成4组,每组6只,分组如下:(1)空白组;(2)DOX组;(3)AS组;(4)SA-AS(刺五加-海藻酸钠)微球组。空白组每日灌胃10mL/kg的0.3% CMC-Na溶液,连续21日,并于第1、3、5、7日腹腔注射生理盐水10mL/kg。DOX组每日灌胃10mL/kg的0.3% CMC-Na溶液,连续21日,并于第1、3、5、7日腹腔注射DOX 2.5mg/kg。第(3)和第(4)组,分别连续灌胃Et30%组分和含Et30%组分的海藻酸钠微球,且Et30%组分的给药剂量均为75mg/kg/d,连续21日,同时在第1、3、5、7日腹腔注射DOX 2.5mg/kg。在实验动物处死取材前,禁食不禁水12h。
二、实验结果
1、稳定性结果
稳定性结果如表5。经计算,刺五加活性部位与刺五加-海藻酸钠微球中刺五加苷E含量的RSD(%)均小于2%,表明刺五加苷E在24h基本稳定。
表5样品的稳定性考察结果
2、刺五加-海藻酸钠微球制备工艺考察结果
根据预实验结果,选择海藻酸钠浓度(A)、刺五加活性部位投药量与海藻酸钠的质量比(B)、氯化钙溶液浓度(C)为主要考察因素。每个因素选定3个水平,测定刺五加-海藻酸钠微球的包封率(Y1)和载药量(Y2),并按照Y=(Y1+Y2)/2进行综合评分。根据正交实验结果极差R的大小,确定制备条件为海藻酸钠浓度4%,刺五加活性部位投药量与海藻酸钠的质量比为1:1,氯化钙溶液浓度为4%。
3、含量测定结果
根据正交实验优化后的制备工艺制备3批刺五加-海藻酸钠微球,该微球呈现棕黄色球形颗粒,外形较为圆整,包封率为23.48±0.51%,载药量为12.32±0.21%。并测定刺五加苷E的含量,结果如表6所示,该微球制剂中的刺五加苷E含量为12.81mg/g。
表6刺五加-海藻酸钠微球含量测定结果
4、刺五加-海藻酸钠微球的体外释放结果
4.1人工胃液中的释放结果
刺五加-海藻酸钠微球在人工胃液中的释放情况如图10所示,发现其在酸性介质中6h内累积释放度未超过20%,说明海藻酸钠微球对刺五加的释放具有一定阻滞作用,能够防止刺五加成分被胃液过多破坏。
4.2人工肠液中的释放结果
刺五加-海藻酸钠微球在人工肠液中的释放情况如图11所示,在1h内释放速率较快,可达30%,到12h累积释放可达96.45%,从释放曲线趋势上可以看出刺五加-海藻酸钠微球具有一定缓释释药性能。
5、刺五加-海藻酸钠微球对肠道菌群的影响
刺五加-海藻酸钠微球(SA-AS)给药后,菌群丰度在属水平上的情况如图12所示。与AS组对比,SA-AS组回调Lachnospiraceae(包括unclassified_Lachnospiraceae和Lachnospiraceae_NK4A136_group)、Mucispirillum更显著,且能进一步提升益生菌Lactobacillus的丰度,表明出该制剂对肠道菌群有更好的调节作用。
在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见得的。本申请说明书和实施例仅是示例性的。
- 一种青钱柳提取物在制备乳腺癌药物或保健品中的应用
- 凉粉草提取物在制备调节肠道菌群药物或保健品中的应用
- 一种葛根提取物在制备调节肠道菌群、降血脂的药物或保健品中的应用
