一种基于索烃骨架的拓扑蛋白质、制备方法及应用
文献发布时间:2024-01-17 01:23:59
技术领域
本发明涉及生命科学技术领域,尤其涉及一种基于索烃骨架的拓扑蛋白质、制备方法及应用。
背景技术
三聚体蛋白质在许多生理或疾病的治疗中展示出了出色的能力,如三靶点受体的免疫激活以及新冠病毒的中和等。三聚体蛋白质在尺寸上躲避了肾透过的作用,延长了体内半衰期。如果把目标蛋白质连入三索烃环内,更能限制其主链的构象,躲避多种蛋白酶的降解,从而提高稳定性。索烃是由两个及以上环状结构通过机械互锁的方法得到的拓扑结构,适用于蛋白质分子的设计与合成。通过调整蛋白质在索烃中的位置,可以控制其展示出目标活性口袋从而有望应用于对多靶标蛋白质的精准调控。
近几年主要的研究是针对蛋白质的同质索烃化,最早的例子追溯到Dawson和他的合作者,利用天然化学连接法将肿瘤抑制因子p53的缠结二聚基元进行环化,得到p53缠结二聚体的索烃结构(Yan, L. Z. and Dawson, P. E.,
进一步地,通过创造性地拆分SpyTag-SpyCatcher反应对以及改造p53的缠结二聚基元的静电相互作用性质,Zhang课题组又相继开发出了可以实现蛋白质偶联的异质索烃模板(Wu, X.-L., et al,
另外,传统的制备三聚体蛋白质的方法主要局限于体外的共价反应连接或体内的线性串联表达,反应复杂或影响蛋白质自身结构域的空间分布。
发明内容
为了解决现有技术中存在的问题,本发明提供了如下技术方案。
本发明第一方面提供了一种索烃骨架,由多个骨架单元组成,所述骨架单元为BTA或ATB,其中,BTA从N端到C端依次包括SpyCatcher(谍捕手,缩写为B)、anti-TRAP(抗色氨酸RNA结合衰减蛋白,缩写为T)和SpyTag(谍标签,缩写为A),ATB从N端到C端依次包括SpyTag(谍标签,缩写为A)、anti-TRAP(抗色氨酸RNA结合衰减蛋白,缩写为T)和SpyCatcher(谍捕手,缩写为B),BTA和ATB均为闭环结构且游离出N端和C端,BTA和ATB的氨基酸序列分别如序列表中SEQ NO1和SEQ NO2所示的氨基酸序列。
优选地,所述BTA和ATB的闭环结构通过SpyTag和SpyCatcher之间的异肽键形成。
优选地,所述SpyTag和SpyCatcher之间的异肽键为SpyCatcher序列中的赖氨酸与SpyTag序列中的天冬氨酸在SpyCatcher序列中的谷氨酸的催化作用下反应形成的。
优选地,在BTA或ATB中,SpyCatcher、anti-TRAP和/或SpyTag对应为突变体,所述突变体为在anti-TRAP、SpyTag和/或SpyCatcher的氨基酸序列上经过一个或多个氨基酸残基的取代、缺失或添加而衍生的肽链,且所述肽链的反应性能不变。
本发明第二方面提供了一种基于索烃骨架的拓扑蛋白质,通过将目标蛋白单独或同时插入到如第一方面所述的索烃骨架的N端、C端或链间得到。
优选地,所述目标蛋白为具有相同或不同序列的蛋白。
本发明第三方面提供了一种基于索烃骨架的拓扑蛋白质的制备方法,包括:设计如第二方面所述的基于索烃骨架的拓扑蛋白质的序列;构建所述拓扑蛋白质的序列对应的编码基因;对编码基因进行表达,得到蛋白质;对表达得到的蛋白质进行纯化,得到基于索烃骨架的拓扑蛋白质。
优选地,所述基于索烃骨架的拓扑蛋白质的制备方法还包括:在所述基于索烃骨架的拓扑蛋白质序列的N端设计His标签序列,利用该His标签序列通过镍亲和层析法对表达得到的蛋白质进行纯化。
优选地,所述基于索烃骨架的拓扑蛋白质的制备方法还包括:在所述基于索烃骨架的拓扑蛋白质序列的环内添加用于分析索烃骨架结构的TEV或TVMV酶切位点。
本发明第四方面提供了一种如第二方面所述的基于索烃骨架的拓扑蛋白质在抗体类似物展示、拓扑蛋白构建以及生物材料科学研究中的应用。
本发明的有益效果是:本发明提供的基于索烃骨架的拓扑蛋白质、制备方法及应用,首先合成适用于制备三聚蛋白质的索烃骨架,然后将索烃骨架作为模板发展成为若干种活性蛋白质的三价展示体系,实现了双特异性六价抗体的制备,从而提供了一种新的蛋白质展示方法。本发明索烃骨架的设计简单,合成路径简洁高效,是一种新型的蛋白质偶联策略。本发明实现了对目标蛋白质的三到多价展示或偶联不同活性的蛋白质,在保留其结构及活性的基础上,通过多价效应及稳定的三角架结构提升了亲合体的亲和力。在一定程度上提高了目标蛋白质的体内循环时间,提升了耐热变性能力。另外,本发明还可以对索烃骨架进行优化,通过控制骨架的折叠来调整或提升蛋白质偶联物的产率或性质。
附图说明
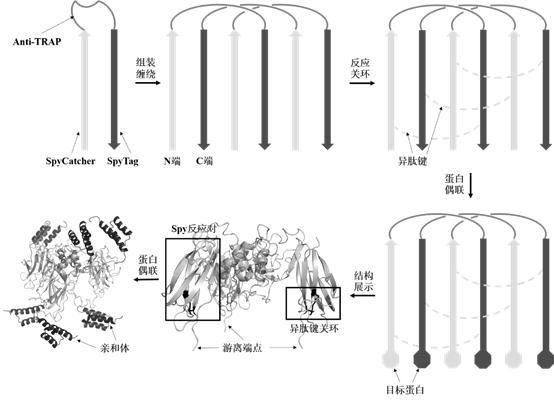
图1为本发明所述三索烃骨架的结构以及利用该骨架实现目标蛋白的三价展示过程示意图;
图2A-图2F为本发明所述索烃蛋白质骨架及其对照蛋白的初步表征结果示意图;
图3为本发明所述索烃蛋白质骨架的拓扑结构理论推断及实验验证结果示意图;
图4为本发明所述实施例3中索烃骨架融合蛋白的初步表征结果示意图;
图5为本发明所述对索烃骨架及其突变型的热变性温度的探索结果示意图;
图6为本发明所述索烃骨架及融合了目标蛋白后的蛋白质的抗热聚集能力实验结果示意图;
图7为本发明所述标记了荧光的融合蛋白样本在小鼠不同器官随时间的代谢结果示意图;
图8为本发明实施例3.5中基于索烃骨架融合的目标蛋白的亲和性质证明结果示意图;
图9为本发明实施例3.6中通过表征及亲和性质证明来优化设计融合目标蛋白的结果示意图。
具体实施方式
为了更好地理解上述技术方案,下面将结合说明书附图以及具体的实施方式对上述技术方案做详细的说明。
本发明的目的是:针对索烃的设计特点以及市场对三价抗体的诉求,找到或设计出可以实现蛋白质自然三聚的模板并通过组装反应的协同来生物合成出有效可控的三索烃蛋白质。另外,本发明提供的制备方法,可以通过体内一步表达得到稳定且相互独立的蛋白质三聚体模型。
实施例1
如图1所示,本发明实施例提供了一种索烃骨架,由多个骨架单元组成,所述骨架单元为BTA或ATB,其中,BTA从N端到C端依次包括SpyCatcher、anti-TRAP和SpyTag,ATB从N端到C端依次包括SpyTag、anti-TRAP和SpyCatcher,BTA和ATB均为闭环结构且游离出N端和C端,BTA和ATB的氨基酸序列分别如序列表中SEQ NO1和SEQ NO2所示的氨基酸序列。
其中,在骨架单元BTA或ATB中, anti-TRAP为抗色氨酸RNA结合衰减蛋白(T),可以作为缠结基元,是一种来源于枯草芽孢杆菌等部分含有TRAP的杆菌体内的蛋白质,分子量为5.6 kDa,在非变性条件下具有三聚的链缠结结构,用来辅助形成机械互锁结构;SpyCatcher(B)和SpyTag(A)可以作为反应基元,是一对源于化脓性链球菌的多肽-蛋白反应对,其中SpyTag为十三个氨基酸的短肽,SpyCatcher为分子量为13 kDa的蛋白质。可以通过SpyTag-SpyCatcher反应对的定点化学偶联反应,即SpyCatcher中的反应性赖氨酸在谷氨酸位点的催化下,同SpyTag中的天冬氨酸反应,形成共价键,实现BTA或ATB组成的三条肽链的环化,形成三索烃骨架。需要说明的是,可以通过选择BTA或ATB骨架单元的数量并将各个骨架单元环化,形成多索烃骨架。比如,选择三个BTA或ATB骨架单元,并将各个骨架单元环化,就可以形成三索烃骨架。
具体的,BTA或ATB的环化,可以通过SpyTag和SpyCatcher之间形成异肽键实现。即SpyCatcher序列中的赖氨酸与SpyTag序列中的天冬氨酸在SpyCatcher序列中的谷氨酸的催化作用下形成的异肽键。本发明实施例中,还可以利用其他的环化策略,如在BTA或ATB的N端和C端分别融合分离型内含肽的C端部分和N端部分,再利用内含肽结构重组反应进行自剪切实现环化;或利用酶(转肽酶Sortase或重组多肽连接酶Butelase)介导的环化以及其他蛋白质反应对介导的偶联、天然化学连接法等手段实现环化。
在本发明中,除了可以由SpyCatcher、anti-TRAP和SpyTag组成BTA或ATB之外,还可以由SpyCatcher、anti-TRAP和/或SpyTag的突变体组成BTA或ATB,所述突变体为在anti-TRAP、SpyTag和/或SpyCatcher的氨基酸序列上经过一个或多个氨基酸残基的取代、缺失或添加而衍生的肽链,且所述肽链的反应性能不变。即不会影响BTA或ATB肽链中参与异肽键形成的赖氨酸(SpyCatcher序列中第33位的K)、天冬氨酸(SpyTag序列中第7位的D)、催化位点谷氨酸(SpyCatcher序列中第79位的E)。其中,对氨基酸残基进行取代、缺失或添加,以及对相关功能的检测可以通过本领域的常规技术来实现。
实施例2
本发明实施例提供了一种基于索烃骨架的拓扑蛋白质,通过将目标蛋白质单独或同时插入到如实施例1所述的索烃骨架的N端、C端或链间得到。
其中,所述目标蛋白质可以为具有相同或不同序列的蛋白质。
具体的,可以通过在索烃骨架的环内连入无序蛋白质,如ELP或短肽GGS来调整环的尺寸。或者调整连接目标蛋白质(POI)的肽段的长度来控制三条POI手臂的摆动范围。更精确地,可以引入刚性片段,如阿尔法螺旋来严格控制三条POI间的距离。若将两种不同的蛋白质分别设计到索烃骨架的N端和C端,便可以得到双特异性的六价展示融合蛋白质,实现两种不同蛋白质基于三索烃骨架的偶联。同样可以调节连接肽的尺寸来控制两种不同蛋白质的位置。
本发明提供的索烃骨架可以作为一个模块,通过将各类型的POI合理设计融合到索烃骨架序列的N端、C端或链间(即环化到索烃骨架内部)形成拓扑蛋白质。在不影响蛋白质的活性的基础上,还能通过多价效应提升反应性,提升热稳定性及体内循环时间。
实施例3
本发明实施例提供了一种基于索烃骨架的拓扑蛋白质的制备方法,并将其应用于亲和小体以及纳米抗体的融合表达,其包括:设计如实施例2所述的基于索烃骨架的拓扑蛋白质的序列;构建所述拓扑蛋白质的序列对应的编码基因;对编码基因进行表达,得到蛋白质;对表达得到的蛋白质进行纯化,得到基于索烃骨架的拓扑蛋白质。
本发明提供的制备方法还包括:在所述基于索烃骨架的拓扑蛋白质序列的N端设计His标签序列,利用该His标签序列通过镍亲和层析法对表达得到的蛋白质进行纯化。
进一步地,在所述基于索烃骨架的拓扑蛋白质序列的环内添加用于分析索烃骨架结构的TEV或TVMV酶切位点。
根据本发明提供的方法设计的基于索烃骨架的拓扑蛋白质可如下示例所示:
(a)SpyCatcher-anti-TRAP-SpyTag-Affibody(EGFR):从N端到C端序列如序列表中的SEQ NO3所示,分为6×His标签(第6-11位)、反应基元SpyCatcher(第21-135位)、缠结基元anti-TRAP(第142-193位)、TEV酶切位点(第201-207位)、反应基元SpyTag(第208-220位)、目标蛋白质Affibody抗EGFR(第226-296位)。
(b)Affibody(EGFR)SpyCatcher-anti-TRAP-SpyTag:从N端到C端序列如序列表中SEQ NO4所示,分别为6×His标签(第6-11位)、目标蛋白Affibody抗EGFR(第16-85位)、反应基元SpyCatcher(第97-211位)、缠结基元anti-TRAP(第218-269位)、TEV酶切位点(第277-283位)、反应基元SpyTag(第284-296位)。
(c)Affibody(EGFR)SpyCatcher-anti-TRAP-SpyTag-Affibody(EGFR):从N端到C端序列如序列表中SEQ NO5所示,分别为6×His标签(第6-11位)、目标蛋白Affibody抗EGFR(第16-85位)、反应基元SpyCatcher(第97-211位)、缠结基元anti-TRAP(第218-269位)、TEV酶切位点(第277-283位)、反应基元SpyTag(第284-296位)、目标蛋白Affibody抗EGFR(第302-372位)。
(d)Affibody(HER2)SpyCatcher-anti-TRAP-SpyTag-Affibody(EGFR):从N端到C端序列如序列表中SEQ NO6所示,分别为6×His标签(第6-11位)、目标蛋白Affibody抗HER2(第16-85位)、反应基元SpyCatcher(第97-211位)、缠结基元anti-TRAP(第218-269位)、TEV酶切位点(第277-283位)、反应基元SpyTag(第284-296位)、目标蛋白Affibody抗EGFR(第302-372位)。
其中(a)为C端展示的三价Affibody抗EFGR蛋白(BTA-AffiEGFR),(b)为N端展示的三价Affibody抗EFGR蛋白(AffiEGFR-BTA),(c)为N端和C端同时展示的六价Affibody抗EFGR蛋白(AffiEGFR-BTA -AffiEGFR),(d)为N端和C端分别展示Affibody抗HER2和抗EFGR的双特异性蛋白(AffiHER2-BTA -AffiEGFR)。
在本发明实施例中,可以将上述融合蛋白序列构建到胞内或分泌表达载体上用来应对不同使用环境。具体的,可以将上述融合蛋白序列构建到pQE80L载体中,并转化到大肠杆菌BL21感受态中,便可实现上述基于索烃骨架的拓扑蛋白质的细胞合成,完成蛋白质的表达。在具体实施过程中,本发明中可以采用16-37 ℃范围的表达环境。表达的蛋白质纯化后可以经除菌处理并在4 ℃或-80 ℃存放。
本发明实施例中,可以利用常规表征手段,如尺寸排阻色谱(SEC)、十二烷基磺酸钠-聚丙烯酰氨凝胶电泳(SDS-PAGE)、液相色谱质谱(LC-MS)以及TEV酶解反应对所得到的索烃结构进行基本表征及其拓扑结构进行间接分析。
本发明在热稳定性方面,利用示差扫描量热法(DSC)对所得到的索烃结构进行熔融温度(
本发明在体内循环时间研究方面,可以利用小鼠进行荧光成像,分析不同时间点小鼠表现出的荧光信号强度变化,分析代谢位置及效率。
本发明通过简单的序列设计,可实现不同目标蛋白质基于索烃骨架进行偶联并进行三价展示。合成路径简洁高效,是一种新型的蛋白质偶联策略。该方法在不影响目标蛋白质的基本活性的基础上,通过多价效应提升了目标蛋白质与受体间的亲和力。较高的分子量及稳定的结构还能提升目标蛋白质在体内的循环时间,延长代谢周期。此外,还可以对索烃骨架进行优化,通过控制骨架的折叠来调整或提升蛋白质偶联物的产率或性质。
在具体实施过程中,制备基于索烃结构(索烃骨架)的融合蛋白(拓扑蛋白质)的具体步骤为:利用重组基因工程技术构建含有His6标签(用于蛋白质纯化)、SpyCatcher(反应基元)、anti-TRAP(缠结基元)、SpyTag(反应基元)、目标蛋白质亲和体(Affibody或者是Nanobody等其他蛋白,亦或者不加入目标蛋白质)的融合蛋白,即SpyCatcher-anti-TRAP-SpyTag-Affibody(或者SpyCatcher-anti-TRAP-SpyTag-Nanobody)的基因序列并插入到pQE80L表达载体中。然后将该表达载体转化到大肠杆菌BL21感受态中进行细胞表达,利用Ni亲和层析等蛋白提纯方法获得纯化的索烃蛋白质。得到的融合蛋白例如:
SpyCatcher-anti-TRAP-SpyTag-Affibody(EGFR);
Affibody(EGFR)SpyCatcher-anti-TRAP-SpyTag-Affibody;
Affibody(EGFR)SpyCatcher-anti-TRAP-SpyTag-Affibody(EGFR);
Affibody(HER2)SpyCatcher-anti-TRAP-SpyTag-Affibody(EGFR);
SpyCatcher-anti-TRAP-SpyTag-Nanobody(PD-L1)等。
上述融合蛋白的括号内物质为亲和体所对应的不同受体。
利用尺寸排阻色谱(SEC)、十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)以及液相质谱联用(LC-MS)对前驱体蛋白质及所制备得到的索烃结构进行初步表征;利用TEV酶切实验结合十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)间接证明蛋白质索烃的拓扑结构;利用示差扫描量热法(DSC)对所得到的索烃结构进行熔融温度(
在实施过程中,可以将SpyCatcher的K33、E79或SpyTag的D7进行点突变以得到线性的对照蛋白(比如B′TA-线性突变和ATB′-线性突变);将anti-TRAP中的四个半胱氨酸突变为丝氨酸以得到单环的对照蛋白(比如BT′A-单环突变和AT′B-单环突变)。上述三种突变方法的两两组合,可以得到各种对照蛋白用来研究不同条件下的融合蛋白的性质。
实施例3.1:索烃骨架融合蛋白的表达和纯化。
将上述质粒pQE80L转化到大肠杆菌BL21(
实施例3.2:基于索烃骨架的融合蛋白的表征及拓扑结构证明。
经尺寸排阻色谱(SEC)纯化后的样品利用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)及高效液相色谱-电喷雾质谱(LC-MS)进行初步表征。图2A-图2F显示了索烃蛋白质骨架及其对照蛋白的初步表征结果,包括BTA(图2A)、ATB(图2B)、BT′A-单环突变(图2C)、AT′B-单环突变(图2D)、B′TA-线性突变(图2E)以及ATB′-线性突变(图2F)的SEC及LC-MS数据,从图中可知实验数据与理论计算数据基本吻合。SEC结果显示,非变性条件下,野生型及线性突变主体均呈现为三聚状态,保留体积相近,而单环突变则呈现为单体状态。图3显示了索烃蛋白质骨架拓扑结构理论推断及实验验证结果,其中,SDS-PAGE结果如图3中的A图所示,在SDS-PAGE中,野生型呈现出以共价或机械键结合的三聚体为主产,有少量二聚体及单体副产的状态,单体流出位置与对照蛋白相近;在ATB系列对照样本中,线性突变体的流出位置要高于环化突变体,这是拓扑带来的对蛋白质空间构象限制的作用,然而同样的效果及分子量并没有出现在BTA的对照样本中,这可能是不同位置的构建对蛋白整体体积的限制作用不同,使得变性条件下蛋白质的展开程度不完全相同。
本发明实施例中,在索烃骨架融合蛋白序列中插入了烟草蚀纹病毒(TEV)蛋白酶酶切位点,将TEV蛋白酶按酶与底物浓度比为1:20进行混合,30 ℃酶切不同时间,取各时间点样本10 μL与5×蛋白质上样缓冲液混合,经金属浴98 ℃加热10 min后,利用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)进行结果分析。图3显示了索烃结构理论酶切结果(如图3中的B图)以及实际酶切结果(图3中的C图为ATB酶切结果,图3中的D图为BTA酶切结果)。酶切反应前为均一的线条,随着酶切反应的加深,出现了二聚体与线性单体的累积,其中二聚体出现两条条带,说明了存在部分线性二聚体的累积,这说明样本中包含有部分二索烃(即二聚体与一个单体机械互锁);而进一步酶切的样本中,环化单体出现了累积,却在初步酶切阶段没有明显累积,由此推测,产物中包含有三索烃结构(三索烃包含头尾互锁及头尾未互锁的链式三索烃)。对时间梯度样本的LC-MS实验结果(如图3中的E图)也证明了线性二聚体存在的阶段变化。这一结果包含在理论预测之中。
实施例3.3:基于索烃骨架的融合蛋白的制备与表征。
将设计好的下列蛋白a)- d)按照实施例1的步骤进行表达纯化,按照实施例2中的步骤进行初步表征,结果如图4所示。
a)SpyCatcher-anti-TRAP-SpyTag-Affibody(EGFR),即BTA-AffiEGFR(如图4中的A图);
b)Affibody(EGFR)SpyCatcher-anti-TRAP-SpyTag-Affibody,即AffiEGFR-BTA(如图4中的A图);
c)Affibody(EGFR)SpyCatcher-anti-TRAP-SpyTag-Affibody(EGFR),即AffiEGFR-BTA-AffiEGFR(如图4中的A图);
d)Affibody(HER2)SpyCatcher-anti-TRAP-SpyTag-Affibody(EGFR),即AffiHER2-BTA-AffiEGFR(如图4中的B图)。
实施例3.4:索烃骨架及目标蛋白偶联物的热稳定性质证明。
首先利用示差扫描量热法(DSC)探究本发明中索烃骨架的热稳定性。将样品稀释到浓度为1 mg/mL,利用差示扫描量热仪(MicroCal VP-DSC)进行测试,测试过程中,样品以每分钟2 ℃的速率从30 ℃扫描到95 ℃,所得数据通过微量热分析软件(MicroCalAnalysis Launcher software)进行处理。图5显示了索烃骨架的DSC曲线,包括BTA(如图5中的A图)、ATB(如图5中的B图)、BT′A-单环突变(如图5中的C图)、AT′B-单环突变(如图5中的D图)、B′TA-线性突变(如图5中的E图)、ATB′-线性突变(如图5中的F图)以及anti-TRAP(如图5中的G图),表1为所得到的结构的
表1
表中所示
随后,将同一管融合蛋白样品及骨架蛋白(溶剂为1×PBS)分别分装到不同小管中,利用金属浴在不同温度下热孵育一小时后,12000 rpm 离心10分钟,再取各温度点样本的上清液10 μL与5×蛋白质上样缓冲液混合,经金属浴98 ℃加热10 min后,利用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)进行结果分析,图6为实验结果。可以发现,随着浓度的提高,各条带的灰度未出现显著差异,表明融合蛋白样本及骨架样本都未发生热聚集而沉淀出来。以上结果说明,这一骨架具有良好的热稳定性,且不会因为融合了目标蛋白而不稳定甚至发生聚集沉淀。
在体内循环实验的研究中,利用NHS-Cy5标记野生型
实施例3.5:基于索烃骨架融合目标蛋白的亲和性质证明。
首先利用生物膜干涉实验来分析,受索烃骨架融合的目标蛋白质的分子活性是否会改变。将生物素化的受体干粉(含缓冲液所需磷酸盐),用蒸馏水配置成100 μM的浓储液,分装后于-20 ℃保存。包括人类 EGFR、人类HER2以及人类PD-L1等。
缓冲液配制:配制上样缓冲液(PBST+0.1% BSA抽滤除杂后待用)及洗脱液(用稀盐酸配制pH 2.2的甘氨酸盐酸溶液)。
样品制备:利用上样缓冲液稀释样品至1000 nM为最高浓度,3倍梯度稀释,每次稀释后将样品涡旋均匀,共七个浓度梯度,上样缓冲液为空白样品。
实验利用生物分子相互作用分析仪(Octet Red 96)检测样品同生物素化受体蛋白亲和能力,所用探针为SA探针(用于大分子生物素锚定)。固定好探针后运行程序,首次运行检测探针是否完好稳定,并锚定生物素化受体蛋白至信号平稳。检测时,探针流动流程为上样缓冲液60 s,受体锚定300 s,上样缓冲液60 s,样品结合200 s,解离200 s,(洗脱液5s,上样缓冲液 5 s)×3次,检测不同样本与相应受体的亲和力。结果如图8所示,实验样本的动力学数据参见表2,其中
表2
“EGFR”加粗字体为该样品在单次实验中所对应的受体。
实施例3.6:基于索烃骨架融合目标蛋白的骨架优化。
下面通过对三价展示KN035的骨架优化介绍本发明在多种不同蛋白展示序列上的可设计性。按照预先设计的SpyCatcher-anti-TRAP-SpyTag-Affibody(EGFR)的骨架,通过序列替换得到了SpyCatcher-anti-TRAP-SpyTag-Nanobody(PD-L1)的序列,这里用到的纳米抗体(Nanobody)为KN035,后面简写KN035。序列如SEQ NO7(BTA-KN035)所示。利用SDS-PAGE表征可以看出其三聚体主产条带弥散,存在少量寡聚蛋白,这或是序列折叠不充分导致的,在此序列基础上,优化了SpyCatcher-anti-TRAP结合处的连接肽,加入了一个TEV酶切位点,得到了SpyCatcher-TEV-anti-TRAP-SpyTag-KN035(序列如SEQ NO8所示,B-TEV-TA-KN035),SDS-PAGE表征显示这个样品可以很好地折叠,得到三聚体主产物,减少了寡聚蛋白的占比,表征结果见图9中的A图所示。但是生物膜干涉实验发现,相较于野生型蛋白质,其同PD-L1的亲和力下降了一个数量级,考虑到Nanobody较Affibody具有更大的分子尺寸及不同的亲和表位,本发明在原序列的基础上,延长SpyTag-KN035间的连接肽,以及将KN035转移到N端进行展示,分别得到了SpyCatcher-TEV-anti-TRAP-SpyTag-15L-KN035(序列如SEQ NO9所示,B-TEV-TA-15L-KN035)和KN035-SpyCatcher-anti-TRAP-SpyTag(序列如SEQ NO10所示,KN035-BTA)序列,表达纯化后的生物膜干涉实验发现,二者均在之前的基础上有效地提高了同PD-L1的亲和力,其中N端展示样本的亲和力更是提高了一个数量级。其中,经骨架优化的C端展示B-TEV-TA-KN035的生物膜干涉实验结果、经骨架及连接肽优化的C端展示B-TEV-TA-15L-KN035的生物膜干涉实验结果和N端展示KN035-BTA的生物膜干涉实验结果可分别如图9中的B图、C图和D图所示,具体数据可见表2所示。以上结果说明本发明对不同蛋白融合表达具有可设计性。
尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
- 一种基于钙-金属有机骨架材料及其制备方法与应用
- 一种基于金属有机骨架材料的吸附膜、制备方法及应用
- 基于吡啶骨架的氮杂烯烃及其制备方法、活化杂联烯及其制备方法和应用
- 一种基于索烃化的蛋白质偶联方法
- 一种基于索烃化的蛋白质偶联方法
