靶向塞内卡病毒A的纳米抗体筛选及其应用
文献发布时间:2024-04-18 19:58:26
技术领域
本发明属于抗体工程制药领域,具体的涉及一种靶向塞内卡病毒A的纳米抗体筛选及其应用。
背景技术
塞内卡病毒A(SenecavirusA,SVA)是小RNA病毒科的一员,它感染猪后使猪的蹄、口腔产生囊泡的症状。SVA是一种新兴的无膜、单股正链小核糖核酸病毒(Hales etal,2008)SVARNA全长约7.3kb。病毒多蛋白的侧面是5’和3’非翻译区(UTR),5’UTR包含一种二级RNA结构内部核糖体进入位点(IRES),对于不依赖帽的病毒RNA翻译非常重要(Hales etal,2008)。全长结构还包含一个大的开放阅读框(ORF),其编码多聚蛋白,3C pro(一种病毒编码的蛋白酶)对多聚蛋白加工,产生12种病毒蛋白,为典型的小核糖核酸病毒L-4-3-4布局,即前导蛋白(Lpro)-P1区(VP1、VP2、VP3、VP4)-P2区(2A、2B、2C)和P3区(3A、3B、3C、3D)蛋白(Leme et al,2017)。其中四个结构蛋白分别是VP4,VP2,VP3和VP1蛋白,8个非结构蛋白分别是L、2A、2B、2C、3A、3B、3C和3D(Reddyetal.2007:翁善钢2016),结构蛋白形成病毒衣壳,参与受体结合以及细胞侵入,而非结构蛋白主要负责病毒复制(Lin et al.2009),在病毒-宿主相互作用和病毒的先天免疫逃逸中起重要作用,也与病毒的毒力和发病机理相关(Ciomperlik et al,2016;Feng et al,2014:Hanson et al..2016:Li et al..2016,Shubin et al.,2015:Wang et al..2017:Xiang et al.,2016:Yu et al..2015:Zhang etal.,2013)。而且塞内卡病毒A和一种急性烈性疾病口蹄疫十分相似,从而造成巨大的经济损失。除猪外,奶牛还可以用作SVA的天然宿主,无症状的SVA阳性病例正在出现,这使得控制SVA的传播变得更加困难。而控制该病的最好手段就是开发疫苗和相应的诊断试剂,但由于缺乏鉴定中和表位以及亲和力强的抗体,因而相应的表位疫苗和灵敏的抗原诊断盒子并未有研发进展。因而发展一个具有高中和活性、特异性和灵敏性的抗体便更加的重要。
抗体指机体在抗原刺激下,由B淋巴细胞增殖分化的浆细胞所产生的一种可与相应抗原特异性结合的免疫球蛋白,可以为机体提供有效的保护。抗体是由4条多肽链以对称的结构组成的一种Y字形单体,其中两条较长的相对分子质量大的为重链,两条短的相对分子质量小的为轻链。重链以H链表示,轻链以L链表示。抗体分子链之间通过二硫键和非共价键进行连接,按结构可分为恒定区和可变区,可变区在顶端位置,是抗原的结合部位。在淋巴细胞进行分化的过程中,抗体可变区的V基因和恒定区的C基因位于DNA的不同区域,这些抗体基因进行重排构成多样的抗体重链或轻链,然后进行完整的转录和翻译。
1993年,Hamers–Casterman等发现,骆驼血清中除了常规的抗体外,还有大量类似免疫球蛋白G的分子。这类分子天然缺失传统抗体轻链和重链恒定区的一部分,但仍具备对抗原的结合力,这类抗体被称为重链抗体。即骆驼产生两种类型的抗体:(i)常规由重和轻链二聚体制成的抗体以及(ii)一类无轻链的IgG,仅由重链的二聚体制成(VHH,单域抗体)。与小鼠和人类抗体结合结构域(大约50kDa)相比,骆驼VHH在约15kDa处保留全抗原特异性。而且传统抗体分子量大,体外表达不稳定,容易聚沉,单域抗体分子质量小,稳定性强、可溶性好、易表达,制备成本低廉,因而VHH备受关注,克服大多数传统抗体的缺点。通过免疫骆驼科动物,经菌体展示,可筛选获得特异性单域抗体,由于其特异性好、分子量小、生物组织穿透力好、易于改造等优点,在诊断、疾病治疗等方面得到应用。单域抗体的生产大多数采用原核表达系统,虽然生产成本低产量高,但产生的单域抗体可能发生错误折叠而丧失生物活性。因此,开发一种高效产生单域抗体的方法具有重要意义。
VHH在多种病毒中被应用,包括艾滋病病毒,流感病毒,狂犬病病毒,脊髓灰质炎病毒,口蹄疫病毒,轮状病毒,丙型肝炎病毒,SARS-COV-1,MERS-COV和SARS-COV-2等。而在SVA中,目前有多个传统的特异性鼠源单抗被研究,但大多只具有特异性,不具有中和活性。
发明内容
基于当前SVA中传统的特异性鼠源单抗存在的限制,本发明通过特定方法筛选到了具有高特异性和高中和活性的VHH,这些单域抗体可用于后续的诊断方法建立、中和表位鉴定和治疗性抗体的制备。
第一方面,本发明提供一种塞内卡病毒A的单域抗体或其抗原结合片段,所述单域抗体或抗原结合片段选自52组中的一组或多组,所述每组单域抗体或抗原结合片段的重链可变区包含CDR-1、CDR-2和CDR-3,所述52组单域抗体或抗原结合片段的重链可变区CDR-1(VH-CDR-1)的氨基酸序列分别为SEQ ID NO.1~SEQ ID NO.52所示,重链可变区CDR-2(VH-CDR-2)的氨基酸序列分别为SEQ ID NO.53~SEQ ID NO.104所示,重链可变区CDR-3(VH-CDR-3)的氨基酸序列分别为SEQ ID NO.105~SEQ ID NO.156所示。
进一步的,所述单域抗体或抗原结合片段的重链可变区CDR-1(VH-CDR-1)的氨基酸序列优选为SEQ ID NO.2、SEQ ID NO.4、SEQ ID NO.5、SEQ ID NO.8、SEQ ID NO.10、SEQID NO.15、SEQ ID NO.27、SEQ ID NO.30、SEQ ID NO.34、SEQ ID NO.42、SEQ ID NO.47、SEQID NO.52;重链可变区CDR-2(VH-CDR-2)的氨基酸序列优选为SEQ ID NO.54、SEQ IDNO.56、SEQ ID NO.57、SEQ ID NO.60、SEQ ID NO.62、SEQ ID NO.67、SEQ ID NO.79、SEQ IDNO.82、SEQ ID NO.86、SEQ ID NO.94、SEQ ID NO.99、SEQ ID NO.104;重链可变区CDR-3(VH-CDR-3)的氨基酸序列优选为SEQ ID NO.106、SEQ ID NO.108、SEQ ID NO.109、SEQ IDNO.112、SEQ ID NO.114、SEQ ID NO.119、SEQ ID NO.131、SEQ ID NO.134、SEQ ID NO.138、SEQ ID NO.146、SEQ ID NO.151、SEQ ID NO.156。
进一步的,所述单域抗体或抗原结合片段的重链可变区CDR-1(VH-CDR-1)的氨基酸序列优选为SEQ ID NO.2、SEQ ID NO.5、SEQ ID NO.10、SEQ ID NO.27、SEQ ID NO.47;重链可变区CDR-2(VH-CDR-2)的氨基酸序列优选为SEQ ID NO.54、SEQ ID NO.57、SEQ IDNO.62、SEQ ID NO.79、SEQ ID NO.99;重链可变区CDR-3(VH-CDR-3)的氨基酸序列优选为SEQ ID NO.106、SEQ ID NO.109、SEQ ID NO.114、SEQ ID NO.131、SEQ ID NO.151。
进一步的,所述单域抗体或抗原结合片段的重链恒定区选自猪IgG、人IgG和/或鸡IgY。
进一步的,所述重链恒定区IgG包括IgG1、IgG2a、IgG2b和/或IgG4。
进一步的,所述抗原结合片段包括抗原结合的功能性片段。
进一步的,所述重链可变区的氨基酸序列SEQ ID NO.1~SEQ ID NO.52所示、SEQID NO.53~SEQ ID NO.104所示或SEQ ID NO.105~SEQ ID NO.156所示;具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%序列同一性或不超过8个氨基酸的变体。
本发明的一些实施方案中,所述抗体分离自骆驼单域抗体。
第二方面,本发明提供一种编码本发明第一方面所述的单域抗体或其抗原结合片段的核酸分子。
第三方面,本发明提供一种或包含第二方面所述核酸分子的载体或宿主细胞。
第四方面,本发明提供一种嵌合抗体,所述嵌合抗体包含本发明第一方面所述的单域抗体或其抗原结合片段。
第五方面,本发明提供一种组合物,所述组合物包含本发明的单域抗体或其抗原结合片段、核酸分子、载体或宿主细胞和/或嵌合抗体。
第六方面,本发明提供一种单域抗体或其抗原结合片段、核酸分子、载体或宿主细胞、嵌合抗体和/或本发明第五方面所述的组合物在制备诊断、预防和/或治疗病毒感染药物中的应用。
进一步的,所述应用可包括在制备预防和/或抑制塞内卡病毒A感染引起的疾病的药物中的应用。
第七方面,本发明提供一种检测塞内卡病毒A的试剂盒,所述试剂盒包括说明书和检测试剂,所述检测试剂为可检测本发明涉及的单域抗体或其抗原结合片段、核酸分子、载体或宿主细胞、嵌合抗原受体或其编码核酸分子、载体、经转化的免疫细胞和/或本发明第五方面所述的组合物的试剂。
有益效果:
该重组纳米抗体的免疫原性风险低,能有效阻断SVA病毒感染细胞,具有显著的SVA中和活性;因此,本发明提供的纳米抗体序列及表达载体在SVA鉴定中和表位、预防或治疗、诊断中具有很好的应用。
附图说明
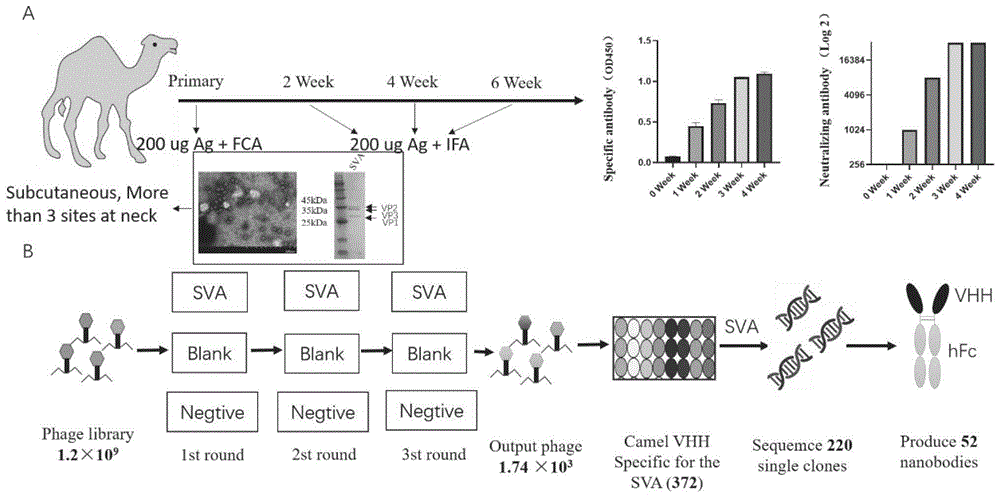
图1噬菌体展示技术筛选针对SVA单域抗体技术流程图(A为SVA抗原通过弗氏佐剂进行免疫骆驼;B为噬菌体ELISA筛选针对SVA抗原具有反应性的单域抗体);
图2构建含有Fc-VHH在pNFCG1-EB载体图示;
图3ELISA检测表达抗体的亲和性和特异性检测;
图4中和试验确定抗体的中和活性的检测。
具体实施方式
下面对本发明的具体实施方式作进一步说明。在此需要说明的是,对于这些实施方式的说明用于帮助理解本发明,但并不构成对本发明的限定。此外,下面所描述实施方式中所涉及的技术特征只要彼此之间未构成冲突就可以相互组合。
在本发明的上下文中,术语“抗体”和“免疫球蛋白”具有相同的含义并且没有区别地使用。在常规抗体中,两条重链通过二硫键相互连接,每条重链通过二硫键与轻链连接。有两种类型的轻链:λ(λ)和κ(κ)轻链。有五种主要类别的重链(或同位素),其决定了抗体的功能活性:IgM、IgD、IgG、IgA和IgE。每条链包含不同序列的结构域。轻链包含两个结构域:可变结构域(VL)和恒定结构域(CL)。重链包含四个结构域:可变结构域(VH)和三个恒定结构域(CH1、CH2和CH3,统称为CH。重链(VH)和轻链(VL)的可变区决定结合识别和抗原特异性。轻链(CL)和重链(CH)的恒定区的结构域赋予重要的生物学特性,例如抗体链结合、分泌、经胎盘移动性、补体结合和Fc受体结合。Fv片段是免疫球蛋白的Fab片段的N-末端部分,其由轻链和重链的可变部分组成。抗体的特异性在于抗体结合位点和抗原决定簇之间的结构互补性。抗体结合位点由主要来自高变区或互补决定区(CDR)的残基组成。
在本发明的上下文中,术语“CDR”是指氨基酸序列,它们一起限定抗体或免疫球蛋白的天然结合位点的天然Fv区的结合亲和力和特异性。一般的免疫球蛋白的重链和轻链各自具有三个CDR,分别表示H-CDR1、H-CDR2、H-CDR3和L-CDR1、L-CDR2、L-CDR3。因此,在本发明中选用的单域抗体只包含有3个CDR,其包含重链可变区的所有CDR,本发明筛选得到52组单域抗体的重链可变区CDR1,CDR2和CDR3。
本文所述术语“核酸分子”:是指多核苷酸中存在的任何一种或多种核酸区段,例如DNA或RNA片段。
本文所述术语“抗原结合片段”:是指包含能够与靶抗原结合的抗原结合区或抗原结合部分的分子,例如蛋白质或多肽。
本文所述术语“载体或宿主细胞”:术语“载体”是一种能够将目标基因转化为蛋白质的工具,通常由质粒、病毒或细胞系构成,如DNA、RNA、病毒载体、质粒、转座子、其他基因转移系统、或其组合。术语“宿主细胞”是指,可用于导入载体的细胞,如大肠杆菌、酵母细胞、哺乳动物细胞、噬菌体或其组合。
本文所述术语“变体”在本文中指,包含已经通过至少1个或1-20或1-10个,例如1或2或3或4或5个氨基酸取代、缺失和/或插入而具有氨基酸改变的目标抗体区域(例如重链可变区或轻链可变区或重链CDR区或轻链CDR区)的抗体,其中变体基本上保持改变之前的抗体分子的生物学特性。在一方面,本发明涵盖在本文中所述及的任何抗体的变体。在一个实施方案中,抗体变体保持改变前抗体的至少60%,70%,80%,90%,或100%的生物学活性(例如抗原结合能力或中和能力)。可以理解的,抗体的重链可变区或轻链可变区、或各CDR区可以单独改变或组合改变。
在本所述术语“嵌合抗体”:嵌合抗体为一种重组蛋白,其含有:包括来源于一个物种的抗体的互补决定区(CDR)的可变域,而抗体分子的恒定域来源于人类抗体的彼等区域。嵌合抗体的恒定域也可来源于其他物种,诸如猫或犬。
在本文所述“序列同一性”是指在比较窗中以逐个核酸或逐个氨基酸为基础的序列相同的程度。可以通过以下方式计算“序列同一性百分比”:将两条最佳比对的序列在比较窗中进行比较,确定两条序列中存在相同核酸碱基(例如,A、T、C、G、I)或相同氨基酸残基(例如,Ala、Pro、Ser、Thr、Gly、Val、Leu、Ile、Phe、Tyr、Trp、Lys、Arg、His、Asp、Glu、Asn、Gln、Cys和Met)的位置的数目以得到匹配位置的数目,将匹配位置的数目除以比较窗中的总位置数(即,窗大小),并且将结果乘以100,以产生序列同一性百分比。为了确定序列同一性百分数而进行的最佳比对,可以按本领域已知的多种方式实现,例如,使用可公开获得的计算机软件如BLAST、BLAST-2、ALIGN或Megalign(DNASTAR)软件。本领域技术人员可以确定用于比对序列的适宜参数,包括为实现正在比较的全长序列范围内或目标序列区域内最大比对所需要的任何算法。
本文所述术语“载体(vector)”表示构建体,其能够将一种或多种所关注的基因或序列递送入宿主细胞并且优选在宿主细胞中表达所述基因或序列。载体的实例包括但不限于病毒载体、裸DNA或RNA表达载体、质粒、粘粒或噬菌体载体、与阳离子凝聚剂相关的DNA或RNA表达载体、包囊化于脂质体中的DNA或RNA表达载体以及某些真核细胞,例如生产细胞。
在本所述术语“宿主细胞”、“宿主细胞系”和“宿主细胞培养物”可互换使用,并且可包括已经引入外源性核酸的细胞,包括这些细胞的子代。宿主细胞包括“转化子”和“转化的细胞”,其包括原代转化细胞以及由此来源的子代,而不考虑传代次数。子代在核酸含量上与亲代细胞可能不完全相同,但可能含有突变。本文包括与在初始转化的细胞中筛选或选择的细胞具有相同功能或生物学活性的突变子代。
本文所用的“阻断抗体”、“中和性抗体”、“具有中和活性的抗体”或“中和抗体”在本文中可互换地使用,指这样的抗体与靶抗原结合或与之相互作用并阻止靶抗原与结合配偶体如受体结合或缔合,因而抑制或阻断本将因靶抗原与结合配偶体如受体的相互作用而产生的生物学反应。
下述实施例中的实验方法,如无特殊说明,均为常规方法,下述实施例中所用的试验材料,如无特殊说明,均为可通过常规的商业途径购买得到。
实施例1靶向塞内卡病毒A的纳米抗体筛选
1、SVA制备及骆驼免疫
1.1选择两头健康、适龄骆驼,分别编号为S-1#和S-2#;
1.2免疫前取外周血5ml,分离血清,检测效价时作为阴性对照;
1.3在400ug SVA抗原(见图1)中加入等体积弗氏佐剂混合均匀,充分乳化后,采取颈部皮下多点注射法分别免疫两头骆驼。首次免疫使用弗氏完全佐剂,后续免疫使用弗氏不完全佐剂。免疫间隔时间为14天。
1.4第4次免疫后两周,取5ml全血,分离血清,检测血清效价(见图1)。
1.5分别取200ml骆驼外周血,Ficoll方法分离PBMC之后,用于构建骆驼VHH抗体库,两头骆驼混合建库。
纯化的SVA抗原用完全和不完全弗氏佐剂乳化,并分别在0、2、4和6周皮下和颈部多点(3个以上部位)注射(见图1A)。
2、骆驼纳米抗体免疫噬菌体库构建
2.1采用TriZol裂解液裂解PBMC细胞,分离总RNA。然后采用oligo-dT作为引物进行逆转录PCR反应,制备cDNA,用于后续扩增抗体基因。
2.2以cDNA为模板,分别扩增抗体基因。采用抗体重链可变区上游(GTC.CTG.GCT.GCT.CTT.CTA.CAA.GG)和CH2下游特征序列引物(GGT.ACG.TGC.TGT.TGA.ACT.GTT.CC),进行第一轮PCR扩增,电泳分离得到600bp左右的条带DNA作为第二轮PCR的模板。第二轮使用VHH的特征序列引物进行PCR扩增。
2.3在第二轮PCR扩增的引物两端添加酶切位点方便后续连接到载体上(F:AACATGCCATGACTCGCGGCTCAACCGG CCATGGCTGAK GT B CAG CTGCAG GC GTCTGG R GGAGG;R:GTTATTATTATTCAGATTATTAGT GCGGCCGCTGGAGACGGTGACC W GGGTCC)。经过PCR获得VHH基因之后,再经过限制性酶内切酶酶切,采用T4 DNA连接酶将酶切片段分别连入预先切好的噬菌体展示用载体中。连接产物经过乙醇沉淀脱盐后,采用电转化方法,转入TG1细菌感受态,构建成库容为1.2×10
3、噬菌体ELISA筛选病毒特异性的VHH抗体并测序
3.1包被:取ELISA平板用PH9.6包被液稀释靶蛋白,50ul/孔,在湿盒中37℃静置1h或4℃静置过夜。封闭:甩出多余包被液,并倒置平板在干净纸巾上拍甩去除残液,PBS洗板3次。
3.2加入封阻液,300ul/孔,37℃在湿盒中静置1h。一抗:甩出多余噬菌体溶液,并倒置平板在干净纸巾上拍甩去除残液,PBS洗板3次。用1%Milk-PBS1:1000稀释HRP兔抗M13,加入50ul/孔,37℃在湿盒中静置1h。
3.3显色:甩出多余溶液,并倒置平板在干净纸巾上拍甩去除残液,PBS洗板4次。TMB显色液,50ul/孔,2M H2SO4终止,450nm检测。
3.4将具有反应性的单克隆样本进行测序。
结果显示:VHH相文库由骆驼外周血淋巴细胞RNA构建而成,分别以SVA颗粒为靶抗原,FMDV颗粒为阴性抗原,无抗原为空白对照。经过三轮筛选,获得输出相位1.74×103。选择372个噬菌体单克隆和靶抗原SVA颗粒进行噬菌体ELISA,获得220个阳性克隆,通过Sanger法测序获得52个独特的VHH抗体序列(见表1-表3)。52种独特的VHH抗体与人Fc融合并在293T细胞中表达(见图1B)。
免疫3-4周后,骆驼表现出针对SVA的特异性抗体(1:2560000)和NAs水平(>16384)的平稳期。然后构建可分离的外周血淋巴细胞,包含1.3×10
表1VHH重链可变区CDR-1氨基酸序列表
表2VHH重链可变区CDR-2氨基酸序列表
表3VHH重链可变区CDR-3氨基酸序列表
/>
4、重组纳米抗体微量表达
4.1表达载体构建:将VHH序列插入pNFCG1-EB载体中,为后续表达重组VHH做准备。
4.2细胞准备:收集293细胞,调整细胞密度为1×10
4.3转染复合物配制:将1μg质粒稀释至40μl KPM培养基,混匀;将5μl T1(质粒:T1=1:5)稀释至40μl KPM培养基,混匀;室温孵育5min;将T1稀释液加入DNA稀释液,混匀;室温孵育30min。即为转染复合物。
4.4转染:将转染复合物加入细胞悬液,混匀。37℃,5%CO
4.5收集上清:培养72小时以上,收集上清,检测活性。
使用NcoI和NotI限制性位点将VHH序列克隆到pTT5真核载体中,其中载体包含分泌信号肽IL2,人IgG1-Fc。将293F的细胞密度调节至1×10
实施例2抗体的效果验证
1、重组纳米抗体特异性和结合活性检测
1.1包被:将抗原S用pH9.6碳酸包被液稀释到5μg/ml,96孔酶标板每孔包被100μl,4℃,过夜;
1.2封闭:弃酶标孔内液体,PBST洗三遍,用4%的脱脂奶粉-PBS封闭,300μl/孔,37℃,2hr;
1.3加入样品:弃酶标孔内液体,PBST洗三遍,加入样品,100μl/孔,对照组加PBS和培养基,37℃,1hr;
1.4二抗:弃酶标孔内液体,用PBST洗三遍,加入HRP-羊抗人IgG(Fc),1:5000稀释,100μl/孔,37℃,1hr;
1.5显色:弃酶标孔内液体,用PBST洗五遍,加入TMB显色液,100μl/孔,避光显色
1.6终止:显色后,每孔加入50μl 2M HCl终止反应;
1.7读数:酶标仪读A450值(如图3和表4所示)。
如图3所示,通过ELISA测定不同VHH与SVA的结合。将SVA以1μg/ml包衣,然后加入1μg/ml的VHH。将FMDV以1μg/ml的浓度包被为阴性,然后加入1μg/ml浓度的VHH。
结果如图3所示,在293F细胞中表达,结果发现在52个VHH中,只有VHH-11和VHH-51没有结合SVA。此外,剩余的50个VHH表现出与SVA的结合活性,并且它们都没有与FMDV反应,具有较好的特异性。
表4重组纳米抗体特异性和结合活性检测结果表
2、重组纳米抗体中和活性检测
采用1ug/mL初始浓度的抗体进行中和实验,从1:2开始系列稀释,每次稀释重复4个样品孔。将稀释的抗体与100个TCID50的CH-HuB-2017病毒在37℃共孵育1小时。添加50μLIBRS-2细胞(105个细胞/mL)到96孔板中,在37℃,5%CO2的培养箱中培养72小时,然后使用倒置显微镜观察细胞的病变。最后,中和抗体数值通过Reed-Muench方法计算(图4)。
结果显示:通过初始浓度为1μg/ml的抗体中和活SVA,在2倍系列稀释后获得高中和活性抗体,虚线表示高中和抗体(见图4)。
使用52个VHH和SVA进行中和活性分析。结果显示,抗体VHH-3、9、11、24、31、49和51没有显示出中和活性,其余45条抗体显示出了中和活性,其中,抗体VHH-2、4、5、8、10、15、27、30、34、42、47和52显示出高中和活性,抗体VHH-2、5、10、27和47显示出更高的中和活性(见表5)。
表5重组纳米抗体中和活性检测结果表
/>
- 检测塞内卡病毒抗体的多肽及其应用
- 一种塞内卡病毒猪源单克隆基因工程抗体及其制备方法和应用
