用于生产异丁烯的方法和组合物
文献发布时间:2023-06-19 18:32:25
相关申请交叉引用
本申请要求2020年5月15日提交的美国临时专利申请号63/010,409的权益,该申请以引用的方式整体并入本文。
背景技术
异丁烯是许多化学品和产品的关键前体。例如,异丁烯被用于生产丁基橡胶、对苯二甲酸和汽油性能添加剂(烷基化物)。烷基化物增加辛烷,改善燃烧,减少排放并防止发动机爆震。不幸的是,这些烯烃的生产需要由石油源进行的高能反应(蒸汽裂化)。需要生产有工业意义的烃的更高效反应。
异丁烯的生物生产已为人所知多年。多种真核生物、古细菌、细菌、真菌和植物天然地通过若干鉴别的路径生产低浓度的这些化合物。鉴于生产方面的重大进步,微生物过程可产生能用于工业应用的异丁烯。此外,使用微生物允许降低对石油源的依赖性,因为可以使用多种多样的原料,例如玉米秆、废水或粪肥。
产生异丁烯的一个特定微生物路径是甲羟戊酸(MVA)路径。MVA路径是用于产生异戊烯焦磷酸的主要途径,异戊烯焦磷酸是一大类生物代谢物的关键结构单元。这一路径中的最后一个酶是甲羟戊酸二磷酸脱羧酶(MVD)并且MVD具有脱去3-羟基异戊酸(3-HIV)的羧基得到异丁烯的能力(反应1)。已鉴别出灼热嗜酸古菌(Picrophilus torridus)(来自酸性环境的古细菌)的MVA路径中的酶是甲羟戊酸-3-激酶(M3K)。这种酶通过催化3-HIV磷酸化成不稳定的3-磷酸中间体,该中间体经历自发脱羧基形成异丁烯(反应2)而具有最高的异丁烯形成速率。
C
C
使用基于质粒的系统将MVD和M3K基因独立地工程改造至大肠杆菌中。当在大肠杆菌中表达M3K时,在合成培养基中,异丁烯生产速率达到高达507pmol min
尽管在生物工程方面取得了进展,但异丁烯的生物生产仍有限。这部分是因为需要抗生素(基于质粒)来维持或控制表达的低效表达系统受到限制。生物生产有限的另一个原因是因为未知的竞争性代谢路径。微生物代谢可被描述为一个复杂的网络,其中一个反应的产物可穿梭于若干不同的竞争反应。对于高效生物生产,需要将竞争反应减到最少。
为了克服这些障碍,本公开描述了将有关异丁烯的两种生物合成基因(M3K和MVD)插入大肠杆菌染色体中。此外,还可以通过将所述基因放于16S rRNA基因启动子的控制下并通过将所述基因放入已知具有较高表达水平的基因组的一部分中来增加表达水平。将所述基因放入染色体中还消除了对于使用抗生素将基因维持在质粒中的需求。此外,这些基因可以与原生路径一起作用以由如葡萄糖之类简单有机糖或如粪肥之类复杂碳产生异丁烯。本文所描述的异丁烯生产水平已被增加至304μmol L
发明内容
公开了包含第一大肠杆菌同源区和第二大肠杆菌同源区的核酸序列,其中所述第一大肠杆菌同源区包含原间隔子相邻基序(PAM)突变;组成型启动子;甲羟戊酸-3-激酶(M3K)基因;甲羟戊酸二磷酸脱羧酶(MVD)基因。
公开了包含一个或多个所公开的核酸序列的载体。
公开了包含核酸序列的重组细胞,其中所述核酸序列包含第一大肠杆菌同源区和第二大肠杆菌同源区,其中所述第一大肠杆菌同源区包含PAM突变;组成型启动子;M3K基因;MVD基因。
公开了制备重组细胞的方法,所述方法包含将所公开的线性核酸序列中的任一者施用至细胞,其中所述细胞将线性核酸序列并入细胞基因组中。在一些方面,重组细胞是细菌细胞。
公开了生产异丁烯的方法,所述方法包含在适于细菌生长以及M3K和MVD表达的条件下,培养所公开的重组细菌细胞中的任一种,所述核酸序列包含组成型启动子;M3K基因和MVD基因,其中所述MVD脱去3-羟基异戊酸(3-HIV)的羧基得到异丁烯,并且其中所述M3K催化3-HIV磷酸化成不稳定3-磷酸中间体,所述中间体经历自发脱羧基得到异丁烯。
所公开的方法和组合物的另外优势将部分地在以下描述中阐述,并且将部分地从描述中理解,或者可通过实践所公开的方法和组合物来学习。借助于所附权利要求中特别指出的元素和组合,将实现且获得所公开的方法和组合物的优点。应理解,前述一般描述和下述详细描述两者均仅为示例性和说明性的,并不是所要求保护的本发明的限制。
附图说明
并入本说明书中且构成本说明书的部分的附图示出了所公开的方法和组合物的若干实施例,并且连同说明书一起,作用于解释所公开的方法和组合物的原理。
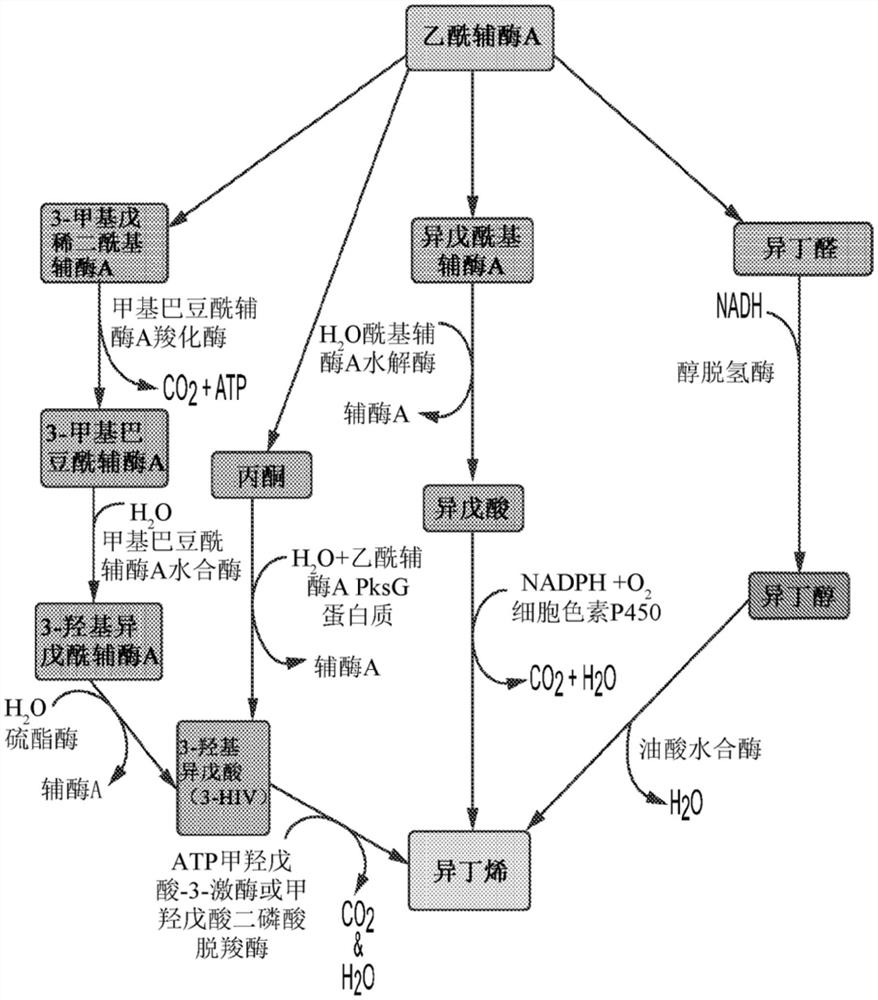
图1显示了用于生产工业石化异丁烯的MVA路径衍生物的图。
图2是包含插入大肠杆菌基因组中的M3K和MVD的核酸序列的示意图。
图3显示了溶剂诱导的失调。在溶剂暴露之后失调基因的总数(黑色条形)和相对数量(红色和蓝色条形)。所有数据是明显失调的基因,其中当与无溶剂对照相比较时,BonFerroni校正的p值<0.05。
图4显示溶剂暴露聚类。有关溶剂暴露对基因表达的影响的主成分分析。各成分描述了在由DESeq-2生成的似然估计内基因表达的变化。聚类较紧密的样本显示出比较类似的基因失调反应。处理组一和二独立地以包围处理组的椭圆形为界进行聚类。
图5显示了针对溶剂暴露的保守反应。在暴露于丙酮、异丁醇和异丁烯之后经历表达变化的应激反应基因的Log
图6显示了针对烃暴露的保守反应。在暴露于有机溶剂之后经历表达变化的应激反应基因的Log
图7显示太空飞行对基因表达的影响。太空飞行诱导的差异性表达的基因计数,比较了地面与ISS样本的相等时间点来筛选太空飞行诱导的作用。黑色条形是总基因并且彩色条形是失调基因的相对百分比。所有数据都是明显失调的基因,其中当与在地面上生长的样本相比较时,Bon Ferroni校正的p值<0.05。
图8显示聚类地面和ISS生长的废水生长试验。主成分分析图显示在MOPS+1%废水上生长的地面(正方形)和ISS(圆形)样本在不同时间点时基因表达变化的聚类。各成分描述了在由DESeq-2生成的似然估计内基因表达的变化。聚类较紧密的样本显示出比较类似的基因失调反应。
图9显示聚类地面和ISS的葡萄糖生长情况。主成分分析图显示在MOPS+0.5%葡萄糖上生长的地面(正方形)和ISS(圆形)样本在不同时间点时基因表达变化的聚类。各成分描述了在由DESeq-2生成的似然估计内基因表达的变化。聚类较紧密的样本显示出比较类似的基因失调反应
图10显示太空飞行诱导的应激反应失调。ISS上酸应激反应的表达和蛋白质修复系统随时间的变化。P
图11显示了ISS上CRISPR系统和易错聚合酶的表达增加。随着培养物老化,它们增加染色体保护系统的表达,持续14天,表达在30天时减少。P
图12显示了使用隐式马尔可夫模型(hidden Markov model)发现的所有M3K基因的系统发生树,该模型已经针对已知M3K酶进行训练。
具体实施方式
通过参考其中包含的具体实施例和实例的下述详细描述以及附图及其之前和之后的描述,可更容易地理解所公开的方法和组合物。
应理解,除非另有说明,否则所公开的方法和组合物并不限于特定的合成方法、特定的分析技术或特定的试剂,并且因此可以变化。还应理解,本文所使用的术语仅用于描述特定实施例的目的,而不旨在进行限制。
公开了可用于所公开的方法和组合物,可与所公开的方法和组合物结合使用,可用于制备所公开的方法和组合物,或者是所公开的方法和组合物的产物的材料、组合物和组分。本文公开了这些材料和其它材料,并且应理解,当公开这些材料的组合、子集、相互作用、组等时,虽然可能未明确公开这些化合物的每个不同个体以及共同组合和排列的特定提及,但各自在本文中特别考虑且描述。例如,如果公开并论述了核酸序列,并且论述可对包括所述核酸序列在内的多种分子作出的多种改良,那么除非明确指示相反,否则特定地涵盖所述核酸序列和可能的改良的每一组合和改变。因此,如果公开了一类分子A、B和C以及一类分子D、E和F以及组合分子的实例A-D,则即使每个并未个别叙述,每个也个别且共同加以考虑。因此,在该实例中,组合A-E、A-F、B-D、B-E、B-F、C-D、C-E和C-F各自特别加以考虑,并且应该视为由A、B和C;D、E和F;以及示例组合A-D的公开内容公开。同样地,还特别考虑且公开了这些的任何子集或组合。因此,例如,A-E、B-F和C-E的亚组特别加以考虑,并且应该视为由A、B和C;D、E和F;以及示例组合A-D的公开内容公开。该概念适用于本专利申请的所有方面,包含但不限于制备且使用所公开的组合物的方法中的步骤。因此,如果存在可执行的各种另外步骤,则应理解,这些另外步骤各自可用所公开方法的任何特定实施例或实施例的组合来执行,并且每个这样的组合特别加以考虑并且应该视为公开的。
A.定义
应理解,所公开的方法和组合物不限于所描述的特定方法、方案和试剂,因为这些可能会有所不同。还应理解,本文所使用的术语仅用于描述特定实施例的目的,并不旨在限制本发明的范围,所述本发明的范围仅受所附权利要求的限制。
须注意,除非上下文另外明确规定,否则如本文中和所附权利要求书中所使用,单数形式“一个(种)”和“所述”包括多个(种)参考物。因此,例如,提到“核酸序列”包括多个此类核酸序列,提到“MVD基因”是提到本领域技术人员已知的一个或多个MVD基因和其等效物等等。
在权利要求书和/或说明书中,当结合术语“包含(comprising)”使用时,词语“一个(a)”或“一种(an)”的使用可以指“一个(种)(one)”,而且还与“一个(种)或多个(种)(oneor more)”、“至少一个(种)(at least one)”和“一个(种)或多于一个(种)(one or morethan one)”一致。
在本申请通篇,术语“约”用于指示某个值包括用于确定该值的装置或方法的误差的标准差。
权利要求中术语“或”的使用是用于指“和/或”,除非明确指出仅指替代方案或替代方案相互排斥,否则本公开支持仅指替代方案以及“和/或”的定义。
如本文所使用,术语“氨基酸”和“氨基酸同一性”是指可以在所公开的任何抗体、变体或片段中的20种天然存在的氨基酸或任何非天然类似物中的一种。因此,如本文所使用,“氨基酸”意谓天然存在的和合成的氨基酸。例如,出于本发明的目的,高苯丙氨酸、瓜氨酸和正亮氨酸被认为是氨基酸。“氨基酸”还包括氨基酸残基诸如脯氨酸和羟脯氨酸。侧链可以处于(R)或(S)构型。在一些方面,氨基酸呈(S)或L-构型。如果使用非天然存在的侧链,则可以使用非氨基酸取代基,例如以防止或延缓体内降解。
术语“可操作地连接至”是指核酸与另一核酸序列的功能关系。启动子、增强子、转录和翻译终止位点以及其它信号序列是与其它序列可操作地连接的核酸序列的实例。例如,DNA与转录控制元件可操作连接是指DNA与启动子之间的物理和功能关系,因此,此类DNA的转录是利用特异性识别、结合和转录该DNA的RNA聚合酶,从启动子起始的。另一个实例是MVD基因和M3K基因的可操作连接,其中每个基因被适当地定位或定向以从同一启动子转录。
术语“同源性百分比”或“同源性%”在本文中与术语“同一性百分比(%)”可互换使用,并且是指当使用序列比对程序与野生型序列比对时,核酸或氨基酸序列同一性的水平。例如,如本文所使用,80%同源性意指与通过定义的算法确定的80%序列同一性相同的事物,并且因此,给定序列的同源物在给定序列的长度上具有大于80%的序列同一性。如本文所述,序列同一性的示例性水平包含但不限于与给定序列(例如,任何本发明多肽的编码序列)的80、85、90、95、98%或更大序列同一性。可用于确定两个序列之间同一性的示例性计算机程序包含但不限于可在互联网上公开获得的BLAST程序套件,例如,BLASTN、BLASTX和TBLASTX、BLASTP和TBLASTN。另见,Altschul等人,1990和Altschul等人,1997。在评估与GenBank DNA序列和其它公共数据库中的核酸序列相对的给定核酸序列时,通常使用BLASTN程序进行序列搜索。对于在GenBank蛋白质序列和其它公共数据库中针对氨基酸序列搜索已经在所有阅读框中翻译的核酸序列,优选BLASTX程序。BLASTN和BLASTX两者均使用开放间隙罚分11.0和扩展间隙罚分1.0的默认参数运行,并使用BLOSUM-62矩阵。(参见例如,Altschul,S.F.等人,《核酸研究(Nucleic Acids Res.)》25:3389-3402,1997)。为了确定两个或更多个序列之间的“同一性%”,使用例如Mac Vector版本13.0.7中的CLUSTAL-W程序对选定的序列进行优选的比对,所述程序使用默认参数进行操作,所述默认参数包含10.0的开放间隙罚分、0.1的扩展间隙罚分和BLOSUM 30相似度矩阵。
“任选的”或“任选地”意指随后描述的事件、环境或材料可能或可能不发生或存在,并且该描述包含其中事件、环境或材料发生或存在的情况,以及其中它不发生或不存在的情况。
范围在本文中可表示为从“约”一个特定值和/或到“约”另一个特定值。当表达这样的范围时,除非上下文另有明确说明,否则还特别考虑和认为公开的是从一个特定值和/或到另一个特定值的范围。类似地,当通过使用先行词“约”将值表示为近似值时,应理解,除非上下文另有明确说明,否则该特定值形成应被视为公开的另一个特别考虑的实施例。还应理解,除非上下文另有明确说明,否则每个范围的端点相对于另一个端点都是重要的,并且独立于另一个端点。最后,应当理解,除非上下文另有明确说明,否则还明确考虑了包含在明确公开的范围内的所有个别值和值的子范围,并且应当视为公开。无论在特定情况下是否明确公开了这些实施例中的一些或全部,前述都适用。
“抑制(Inhibit/inhibiting/inhibition)”意思指减小或降低活性、水平、反应、病症、疾病或其它生物参数。这可包括但不限于活性、反应、病症或疾病的完全清除。这还可包括例如与天然或对照水平相比,活性、反应、病症或疾病的10%抑制或降低。因此,在一些方面,与天然或对照水平相比,抑制或降低可以是10%、20%、30%、40%、50%、60%、70%、80%、90%、100%,或任何降低量。在一些方面,与天然或对照水平相比,抑制或降低是10-20%、20-30%、30-40%、40-50%、50-60%、60-70%、70-80%、80-90%或90-100%。在一些方面,与天然或对照水平相比,抑制或降低是0-25%、25-50%、50-75%或75-100%。
如本文所使用,“调节(Modulate/modulating/modulation)”意思指活性或功能或数量的变化。变化可以是活性、功能或数量的增加或减少、增强或抑制。
“促进(Promote/promotion/promoting)”是指活性、反应、病症、疾病或其它生物参数的增加。这可包括但不限于活性、反应、病症或疾病的起始。这还可包括例如与天然或对照水平相比,活性、反应、病症或疾病的10%增加。因此,在一些方面,与天然或对照水平相比,增加或促进可以是10%、20%、30%、40%、50%、60%、70%、80%、90%、100%或更高百分比,或其间任何促进量。在一些方面,与天然或对照水平相比,增加或促进是10-20%、20-30%、30-40%、40-50%、50-60%、60-70%、70-80%、80-90%或90-100%。在一些方面,与天然或对照水平相比,增加或促进是0-25%、25-50%、50-75%或75-100%或更高百分比,例如200%、300%、500%或1000%以上。在一些方面,与天然或对照水平相比,增加或促进可大于100%,例如与天然或对照水平相比,大于100%、150%、200%、250%、300%、350%、400%、450%、500%或更高百分比。
术语“片段”可以指蛋白质或核酸分子的一部分(例如至少5个、10个、25个、50个、100个、125个、150个、200个、250个、300个、350个、400个或500个等氨基酸或核酸),它与参考蛋白质或核酸大体上相同并且保留参考物的生物活性。在一些方面,所述片段或部分保留本文所描述的参考蛋白质或核酸的至少50%、75%、80%、85%、90%、95%或99%的生物活性。此外,参考肽的片段可以是参考多肽的连续或邻近部分(例如,十个氨基酸长的肽片段可以是该肽内的任何2-9个连续残基)。
“变体”可以是指与参考序列在某种方式上的差异,而不仅仅是一个或多个N-端和/或C-端氨基酸残基的简单删除。在变体包括氨基酸残基的置换时,所述置换可以被认为是保守的或非保守的。保守性取代是以下各组内进行的取代:Ser、Thr和Cys;Leu、Ile和Val;Glu和Asp;Lys和Arg;Phe、Tyr和Trp;以及Gln、Asn、Glu、Asp和His。变体可以包括至少一个置取代和/或至少一个添加,也可以存在至少一个缺失。变体还可以包括一个或多个非天然存在的残基。例如,变体可以包括在任何位置处,包括在半胱氨酸的位置处的硒代半胱氨酸(例如硒代-L-半胱氨酸)。许多其它“非天然”氨基酸替代物是本领域已知的并且可从商业来源获得。非天然存在的氨基酸的例子包括D-氨基酸、具有连接到半胱氨酸的硫原子的乙酰基氨基甲基基团的氨基酸残基、聚乙二醇化的氨基酸和式NH2(CH2)nCOOH的ω氨基酸,其中n是2-6个中性的非极性的氨基酸,诸如肌氨酸、叔丁基丙氨酸、叔丁基甘氨酸、N-甲基异亮氨酸和正亮氨酸。苯基甘氨酸可以置换Trp、Tyr或Phe;瓜氨酸和甲硫氨酸亚砜是中性的非极性的,半胱氨酸是酸性的,且鸟氨酸是碱性的。脯氨酸可以被羟脯氨酸置换并保留赋予脯氨酸性质的构象。
除非另有定义,否则本文使用的所有技术和科学术语都具有与所公开的方法和组合物所属领域的技术人员通常理解相同的含义。尽管与本文所述的那些类似或等价的任何方法和材料都可用于本方法和组合物的实践或测试,但特别有用的方法、装置和材料如所述的。本文引用的出版物和对于其引用的材料在此以引用的方式并入。本文中的任何内容均不应视为承认本发明无权凭借在先发明而先于此类公开内容。不承认任何参考文献构成现有技术。对参考文献的讨论陈述了其作者的主张,并且申请人保留质疑所引用文件的准确性和相关性的权利。应清楚地理解,尽管本文提及了许多出版物,但此类参考文献并不构成承认这些文件中的任一形成本领域公知常识的部分。
在本说明书的说明书和权利要求书自始至终,单词“包括(comprise)”和单词的变体,如“包括(comprising和comprises)”,意指“包含但不限于(including but notlimited to)”,并且不旨在排除例如其它添加剂、组分、整数或步骤。具体地说,在描述为包括一个或多个步骤或操作的方法中,特别考虑的是,每个步骤包括所列出的内容(除非该步骤包含限制性术语,如“由...组成”),这意味着每个步骤不旨在排除例如未在步骤中列出的其它添加剂、组分、整数或步骤。
B.核酸序列
公开了包含第一细菌同源区和第二细菌同源区的核酸序列,其中所述第一细菌同源区包含原间隔子相邻基序(PAM)突变;组成型启动子;甲羟戊酸-3-激酶(M3K)基因;甲羟戊酸二磷酸脱羧酶(MVD)基因。在一些方面,所述第一细菌同源区或第二细菌同源区可与打算施用该核酸序列的特定细菌(例如主题细菌)同源。例如,如果将所公开的核酸序列施用给大肠杆菌或引入大肠杆菌,则所述同源区可以是大肠杆菌同源区。
公开了包含第一大肠杆菌同源区和第二大肠杆菌同源区的核酸序列,其中所述第一大肠杆菌同源区包含原间隔子相邻基序(PAM)突变;组成型启动子;甲羟戊酸-3-激酶(M3K)基因;甲羟戊酸二磷酸脱羧酶(MVD)基因。
公开了包含第一大肠杆菌同源区和第二大肠杆菌同源区的核酸序列,其中所述第一大肠杆菌同源区包含PAM突变;组成型启动子;M3K基因,该基因包含SEQ ID NO:1的序列;MVD基因,该基因包含SEQ ID NO:2的序列。
公开了包含第一大肠杆菌同源区和第二大肠杆菌同源区的核酸序列,其中所述第一大肠杆菌同源区包含PAM突变;组成型启动子;M3K基因,该基因包含与SEQ ID NO:1的序列具有至少90%同一性的序列;MVD基因,该基因包含与SEQ ID NO:2的序列具有至少90%同一性的序列。
在一些方面,M3K基因和MVD基因中的一者或两者被优化。在一些方面,将M3K基因和MVD基因中的一者或两者针对大肠杆菌进行优化。核酸序列可经历密码子优化以便改善在宿主生物体中所关注序列的基因表达和或增加其翻译效率。例如,来源于灼热嗜酸古菌的M3K可经历密码子优化以在大肠杆菌中具有更好的表达。
在一些方面,MVD基因和M3K基因是可操作地连接的。
在一些方面,核酸序列是线性的。在一些方面,核酸序列是环形的。
在一些方面,所述核酸序列从5'至3'分别包含第一大肠杆菌同源区和第二大肠杆菌同源区,其中所述第一大肠杆菌同源区包含PAM突变;组成型启动子;M3K基因;MVD基因。
在一些方面,可使用M3K基因和MVD基因中的一者或两者的变体。变体可包括与M3K基因或MVD基因、得到所述基因的前体或序列的序列大体上类似的核苷酸序列。一方面,变体包括与M3K基因或MVD基因序列或其片段大体上类似的核苷酸序列。变体还可以包括与本文所公开的M3K基因或MVD基因的序列大体上类似的核苷酸序列。“变体”可以指与参考序列在某种方式上的差异,而不仅仅是N端和/或C端核苷酸的简单缺失。变体还可以或可替代地包含至少一个取代和/或至少一个添加,也可以存在至少一个缺失。在一些方面,打算使用的变体M3K基因或变体MVD基因可包含与M3K基因(SEQ ID NO:1)或MVD基因(SEQ ID NO:2)的序列展示至少80%序列同一性的序列。在一些方面,打算使用的M3K基因或MVD基因可包含与SEQ ID NO:1或2展示至少90%序列同一性的序列。在一些方面,打算使用的M3K基因或MVD基因可包含与SEQ ID NO:1或2展示至少91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性的序列。
或者或另外,变体可包含修饰,例如在M3K基因或MVD基因序列的一个或多个位置处的非天然残基。一方面,变体可以是M3K基因或MVD基因的最后一个核苷酸改变的序列。在一些方面,变体可以是在M3K基因或MVD基因的5'端处包含至少一个、至少两个或至少三个取代的序列。一方面,核苷酸取代可包括对参考序列的核苷酸取代,所述取代增加M3K基因或MVD基因或其变体的稳定性。核苷酸取代可以是一个或两个碱基的取代。在一些方面,核苷酸取代可以是三个碱基的取代。缺失和插入可包括一(1)个至约三(3)个碱基。取代、缺失、插入或其任何组合均可用于获得最终衍生物或变体。通常,这些改变是在几个核苷酸上完成的,以尽量减少分子的改变。然而,在某些情况下可以容忍较大的变化。
通常,各个变体序列之间的核苷酸同一性可以为至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%。因此,“变体序列”可以是与本发明的亲本或参考序列具有指定同一性并且共享生物学功能的序列,所述生物学功能包括但不限于亲本序列的至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的特异性和/或活性。例如,“变体序列”可以是与本发明的亲本或参考序列相比含有1个、2个或3个、4个核苷酸碱基变化并且共享或改善亲本序列的生物学功能、特异性和/或活性的序列。在一些方面,亲本或参考序列可以是miR-584-5p。
在一些方面,相较于亲本或参考序列,本文所公开的序列中的任一者可包括单个核苷酸变化。在一些方面,相较于亲本或参考序列,本文所公开的序列中的任一者可包括至少两个核苷酸变化。个别变体序列之间的核苷酸同一性可以是至少60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%。因此,“变体序列”可以是与本发明的亲本序列具有指定同一性并且共享生物学功能的序列,所述生物学功能包括但不限于亲本序列的至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的特异性和/或活性。变体序列还可以共享亲本序列的至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的特异性和/或活性。
1.细菌同源区
公开了包含第一细菌同源区的核酸序列。还公开了包含第二细菌同源区的核酸序列。在一些方面,公开了包含第一细菌同源区和第二细菌同源区的核酸序列。细菌同源区可被设计成允许所公开的包含细菌同源区的核酸序列使用同源重组将第一细菌同源区与第二细菌同源区之间的序列插入细菌染色体中。
公开了包含第一大肠杆菌同源区的核酸序列。还公开了包含第二大肠杆菌同源区的核酸序列。在一些方面,公开了包含第一大肠杆菌同源区和第二大肠杆菌同源区的核酸序列。大肠杆菌同源区被设计成允许所公开的包含大肠杆菌同源区的核酸序列使用同源重组将第一大肠杆菌同源区与第二大肠杆菌同源区之间的序列插入大肠杆菌染色体中。
在一些方面,第一大肠杆菌同源区或第二大肠杆菌同源区与大肠杆菌菌株MG1655同源。在一些方面,第一大肠杆菌同源区或第二大肠杆菌同源区与大肠杆菌菌株DH5α同源。在一些方面,第一大肠杆菌同源区或第二大肠杆菌同源区与大肠杆菌菌株K12同源。
在一些方面,大肠杆菌同源区可以是与大肠杆菌安全位点9序列同源的核酸序列。
在一些方面,第一大肠杆菌同源区包含PAM突变。在一些方面,PAM突变是野生型序列AAGG变为PAM突变CAAA的突变。在一些方面,PAM位点是向导RNA指导Cas蛋白以允许DNA的双链切割的位点。在一些方面,细菌同源区中PAM突变的存在可使向导RNA和Cas蛋白不能切割DNA。因此,在一些方面,将仅切割具有未突变的PAM位点的DNA序列,并且这些DNA序列应理解为未与包含细菌同源区的核酸经历同源重组。
在一些方面,细菌同源区的大小可以减小。例如,第一大肠杆菌同源区和第二大肠杆菌同源区可以从500bp切割到400bp(参见《ACS合成生物学(ACS Synth.Biol.)》2016,5,7,561-568,特此以引用的方式并入本文)。
2.启动子
在一些方面,可在所公开的核酸序列中使用任何已知的组成型启动子或调控型启动子。
在一些方面,组成型启动子是16S rRNA启动子。在一些方面,组成型启动子是T7A1启动子。
在一些方面,组成型启动子位于第一大肠杆菌同源区的3'端并且在M3K基因的5'端。
在一些方面,可使用与细菌表达系统相容的任何启动子。
3.M3K基因
作为MVA路径中的关键酶的M3K是一种ATP依赖性酶,该酶通过催化3-HIV磷酸化成不稳定3-磷酸中间体,该中间体经历自发脱羧基形成异丁烯,来催化3-羟基异戊酸(3-HIV)转化成异丁烯。
在一些方面,优化的M3K基因可包含以下核酸序列ATGGAGAACTATAATGTTAAAACCCGTGCATTTCCGACCATTGGTATTATTCTGCTGGGTGGCATTAGCGACAAAAAAAACCGTATTCCGCTGCATACCACCGCAGGTATTGCATATACCGGCATCAATAACGATGTGTACACCGAAACCAAACTGTATGTGAGCAAAGACGAAAAATCGTATATCGATGGCAAAGAAATCGATCTGAATAGCGATCGTAGCCCGAGCAAAGTGATCGATAAATTCAAACATGAAATCCTGATGCGTGTGAATCTGGATGATGAAAACAACCTGAGCATTGATAGCCGCAATTTTAACATTCTGAGCGGTAGCAGCGATAGCGGTGCAGCAGCACTGGGTGAATGCATTGAAAGCATCTTCGAGTACAACATCAACATCTTCACCTTTGAAAATGATCTGCAGCGTATTAGCGAAAGCGTTGGTCGTAGCCTGTATGGTGGTCTGACCGTTAATTATGCAAATGGTCGTGAAAGCCTGACCGAACCGCTGCTGGAACCGGAAGCATTTAACAACTTTACCATCATCGGTGCCCATTTTAACATTGATCGCAAACCGAGCAACGAAATCCACGAAAACATCATCAAACATGAGAACTATCGCGAACGTATTAAAAGCGCAGAGCGCAAAGCAAAAAAACTGGAAGAACTGAGCCGTAATGCCAACATTAAAGGCATTTTTGAACTGGCAGAAAGCGATACCGTGGAATATCATAAAATGCTGCATGATGTGGGCGTTGATATTATCAATGACCGCATGGAAAATCTGATTGAACGCGTGAAAGAGATGAAAAACAACTTCTGGAACAGCTATATTGTTACCGGTGGTCCGAATGTTTTTGTGATCACCGAGAAAAAAGATGTGGATAAAGCCATGGAAGGTCTGAATGATCTGTGTGATGATATTCGTCTGCTGAAAGTTGCAGGTAAACCGCAGGTTATCAGCAAAAACTTCTAATGA(SEQ ID NO:1)。还公开了M3K基因的变体或片段或者M3K的优化的基因序列。
因此,在一些方面,SEQ ID NO:1表示M3K的优化的基因序列。
在一些方面,野生型M3K是由以下核酸序列表示的灼热嗜酸古菌M3KATGGAAAATTACAATGTTAAGACAAGGGCGTTCCCAACAATAGGCATAATACTGCTTGGTGGGATCTCGGATAAAAAGAACAGGATACCGCTGCATACAACGGCAGGCATAGCATATACTGGTATAAACAATGATGTTTACACTGAGACAAAGCTTTATGTATCAAAAGATGAAAAATGCTATATTGATGGAAAGGAAATTGATTTAAATTCAGATAGATCACCATCGAAGGTTATTGATAAATTCAAGCATGAAATACTTATGAGAGTAAATCTTGATGATGAAAATAACCTTTCAATTGATTCAAGGAACTTTAATATATTAAGTGGCAGCTCAGATTCTGGGGCCGCTGCACTGGGAGAGTGCATAGAATCAATTTTTGAATACAATATAAATATATTTACATTTGAAAACGATCTTCAGAGGATATCAGAAAGTGTTGGAAGAAGCCTTTACGGTGGTTTAACAGTAAACTATGCCAATGGCAGGGAATCATTAACAGAGCCATTACTTGAGCCTGAGGCATTTAATAACTTTACAATAATTGGTGCACATTTTAACATTGATAGAAAACCATCAAATGAGATTCATGAAAATATCATAAAACATGAAAATTACAGGGAAAGAATAAAAAGTGCTGAGAGAAAGGCGAAAAAACTTGAGGAGCTATCAAGGAATGCAAACATAAAGGGTATCTTTGAACTTGCAGAATCCGATACAGTGGAATACCATAAAATGCTCCATGATGTTGGCGTTGACATAATAAATGATAGAATGGAGAACCTCATTGAAAGGGTAAAAGAAATGAAAAATAACTTCTGGAATTCATACATAGTTACCGGCGGCCCGAACGTTTTTGTAATAACAGAGAAAAAGGACGTTGATAAGGCAATGGAAGGATTAAATGATCTGTGCGATGATATAAGATTATTAAAAGTTGCAGGAAAGCCACAGGTCATTTCAAAAAACTTTTAA(SEQ ID NO:3)。
在一些方面,野生型M3K是来自以下物种中的一者或多者的M3K:铜积累酸原体(Acidiplasma cupricumulans)、阿曼嗜酸亚铁原体(Ferroplasma acidarmanus)、嗜肺性退伍军人杆菌(Legionella pneumophila)、星名氏嗜酸菌(Picrophilus oshimae)、嗜酸热原体(Thermoplasma acidophilum)、火山热原体(Thermoplasma volcanium)、热原体目古菌(Thermoplasmatales archaeon)、布氏锥虫(Trypansoma brucie)、嗜酸热原体(Thermoplasma acidophilum)、普通地下矿石原体(cuniculiplasma divulgatum)、蒂蒙链球菌(Streptococcus timonensis)、副乳房链球菌(Streptococcus parauberis)、嵴链球菌(Streptococcus cristatus)、藏羚羊链球菌(Streptococcus pantholopis)、婴儿链球菌(Streptococcus infantis)、脓肿分枝杆菌(Mycrobacterium abscessus)、泪腺嗜胨菌(peptoniphilu lacrimalis)。
表1显示了可在SEQ ID NO:1中优化的来自野生型M3K的核苷酸的实例。表1中提供的序列可以是可用于所公开的方法中的M3K基因的变体。
在一些方面,公开了与SEQ ID NO:1的序列包含至少85%、90%、95%或99%同一性的M3K基因序列。在一些方面,公开了与SEQ ID NO:1的序列包含至少90%同一性的M3K基因序列。在一些方面,M3K基因序列与SEQ ID NO:1在表1中所示优化核苷酸处100%相同。因此,在一些方面,SEQ ID NO:1与所公开的M3K基因之间的差异可存在于除表1中所列那些之外的任何核苷酸处。
4.MVD基因
作为MVA路径中的关键酶的MVD是一种ATP依赖性酶,该酶催化3-羟基异戊酸(3-HIV)经脱羧基而转化成异丁烯。
在一些方面,针对大肠杆菌优化的MVD可包含以下核酸序列ATGACCGTTTATACCGCAAGCGTTACCGCACCGGTTAATATTGCAACCCTGAAATATTGGGGTAAACGTGATACCAAACTGAATCTGCCGACCAATAGCAGCATTAGCGTTACCCTGAGCCAGGATGATCTGCGTACCCTGACCAGCGCAGCAACCGCACCGGAATTTGAACGTGATACCCTGTGGCTGAATGGTGAACCGCATAGCATTGATAATGAACGTACCCAGAATTGTCTGCGTGATCTGCGTCAGCTGCGTAAAGAAATGGAAAGCAAAGATGCAAGCCTGCCGACCCTGAGCCAGTGGAAACTGCATATTGTTAGCGAAAATAATTTTCCGACCGCAGCAGGTCTGGCAAGCAGCGCAGCAGGTTTTGCAGCACTGGTTAGCGCAATTGCAAAACTGTATCAGCTGCCGCAGAGCACCAGCGAAATTAGCCGTATTGCACGTAAAGGTAGCGGTAGCGCATGTCGTAGCCTGTTTGGTGGTTATGTTGCATGGGAAATGGGTAAAGCAGAAGATGGTCATGATAGCATGGCAGTTCAGATTGCAGATAGCAGCGATTGGCCGCAGATGAAAGCATGTGTTCTGGTTGTTAGCGATATTAAAAAAGATGTTAGCAGCACCCAGGGTATGCAGCTGACCGTTGCAACCAGCGAACTGTTTAAAGAACGTATTGAACATGTTGTTCCGAAACGTTTTGAAGTTATGCGTAAAGCAATTGTTGAAAAAGATTTCGCAACCTTTGCAAAAGAAACCATGATGGATAGCAATAGCTTTCATGCAACCTGTCTGGATAGCTTTCCGCCGATTTTTTATATGAATGATACCAGCAAACGCATTATTAGCTGGTGTCATACCATTAATCAGTTTTATGGTGAAACCATTGTGGCATATACCTTTGATGCAGGTCCGAATGCAGTTCTGTATTATCTGGCAGAAAATGAAAGCAAACTGTTTGCATTTATCTACAAACTGTTCGGTAGCGTTCCGGGTTGGGATAAAAAATTTACCACCGAACAGCTGGAAGCATTTAATCATCAGTTTGAAAGCAGCAATTTCACCGCACGTGAACTGGATCTGGAACTGCAGAAAGATGTTGCACGTGTTATTCTGACCCAGGTTGGTAGCGGTCCGCAGGAAACCAATGAAAGCCTGATTGAT GCAAAAACCGGTCTGCCGAAAGAATAA(SEQ ID NO:2)。还公开了MVD基因的变体或片段或者MVD的优化的基因序列。
在一些方面,野生型MVD是由以下核酸序列表示的酿酒酵母(Saccharomycescerevisiae)MVD
ATGACCGTTTACACAGCATCCGTTACCGCACCCGTCAACATCGCAACCCTTAAGTATTGGGGGAAAAGGGACACGAAGTTGAATCTGCCCACCAATTCGTCCATATCAGTGACTTTATCGCAAGATGACCTCAGAACGTTGACCTCTGCGGCTACTGCACCTGAGTTTGAACGCGACACTTTGTGGTTAAATGGAGAACCACACAGCATCGACAATGAAAGAACTCAAAATTGTCTGCGCGACCTACGCCAATTAAGAAAGGAAATGGAATCGAAGGACGCCTCATTGCCCACATTATCTCAATGGAAACTCCACATTGTCTCCGAAAATAACTTTCCTACAGCAGCTGGTTTAGCTTCCTCCGCTGCTGGCTTTGCTGCATTGGTCTCTGCAATTGCTAAGTTATACCAATTACCACAGTCAACTTCAGAAATATCTAGAATAGCAAGAAAGGGGTCTGGTTCAGCTTGTAGATCGTTGTTTGGCGGATACGTGGCCTGGGAAATGGGAAAAGCTGAAGATGGTCATGATTCCATGGCAGTACAAATCGCAGACAGCTCTGACTGGCCTCAGATGAAAGCTTGTGTCCTAGTTGTCAGCGATATTAAAAAGGATGTGAGTTCCACTCAGGGTATGCAATTGACCGTGGCAACCTCCGAACTATTTAAAGAAAGAATTGAACATGTCGTACCAAAGAGATTTGAAGTCATGCGTAAAGCCATTGTTGAAAAAGATTTCGCCACCTTTGCAAAGGAAACAATGATGGATTCCAACTCTTTCCATGCCACATGTTTGGACTCTTTCCCTCCAATATTCTACATGAATGACACTTCCAAGCGTATCATCAGTTGGTGCCACACCATTAATCAGTTTTACGGAGAAACAATCGTTGCATACACGTTTGATGCAGGTCCAAATGCTGTGTTGTACTACTTAGCTGAAAATGAGTCGAAACTCTTTGCATTTATCTATAAATTGTTTGGCTCTGTTCCTGGATGGGACAAGAAATTTACTACTGAGCAGCTTGAGGCTTTCAACCATCAATTTGAATCATCTAACTTTACTGCACGTGAATTGGATCTTGAGTTGCAAAAGGATGTTGCCAGAGTGATTTTAACTCAAGTCGGTTCAGGCCCACAAGAAACAAACGAATCTTTGATTGACGCAAAGACTGGTCTACCAAAGGAATAA (SEQ ID NO:4)。
在一些方面,可使用任何已知的MVD序列。
表2显示可在SEQ ID NO:2中优化的来自野生型MVD的核苷酸(SEQ ID NO:4)。表2中提供的序列可以是可用于所公开的方法中的MVD基因的变体。
表2
在一些方面,公开了与SEQ ID NO:2的序列包含至少85%、90%、95%或99%同一性的MVD基因序列。在一些方面,公开了与SEQ ID NO:2的序列包含至少90%同一性的MVD基因序列。在一些方面,MVD基因序列与SEQ ID NO:2在表2中显示的优化核苷酸处100%相同。因此,在一些方面,SEQ ID NO:2与所公开的MVD基因之间的差异可存在于除表2中所列那些外的任何核苷酸处。
C.载体
公开了包含本文所公开的核酸序列和构建体中的任一者的载体。
在一些方面,载体可以是病毒载体。在一些方面,载体可以是质粒。在一些方面,载体可以是表达载体。
术语“表达载体”包含含有处于适合细胞表达的形式(例如,连接到转录控制元件)的基因构建体的任何载体(例如,质粒、粘粒或噬菌体染色体)。“质粒”和“载体”可互换使用,因为质粒是载体的常用形式。此外,本发明旨在包含用于等效功能的其它载体。
在一些方面,载体可以是病毒载体。例如,病毒载体可以是逆转录病毒载体。在一些方面,载体可以是非病毒载体,如基于DNA的载体。
1.病毒和非病毒载体
有许多组合物和方法可用于在体外或体内将所公开的核酸递送至细胞。这些方法和组合物可以主要分为两类:基于病毒的递送系统和基于非病毒的递送系统。例如,核酸可以通过许多直接递送系统(如电穿孔、脂质转染、磷酸钙沉淀、质粒、病毒载体、病毒核酸、噬菌体核酸、噬菌体、粘粒)进行递送,或通过在细胞或载体(如阳离子脂质体)中转移遗传物质进行递送。合适的转染方法,包含病毒载体、化学转染子或物理-机械方法(如电穿孔和DNA的直接扩散),描述于以下文献中:例如,Wolff,J.A.等人,《科学(Science)》,247,1465-1468,(1990);和Wolff,J.A.《自然(Nature)》,352,815-818,(1991)。此类方法在本领域中是众所周知的并且很容易适用于与本文所述的组合物和方法一起使用。在某些情况下,这些方法将被修改为专门用于大DNA分子。进一步地,这些方法可以用于通过利用载体的靶向特性来靶向某些疾病和细胞群。
表达载体可以是用于将基因或基因片段递送到细胞中的任何核苷酸构建体(例如,质粒),或作为递送基因或基因片段的一般策略的一部分,例如,作为重组逆转录病毒或腺病毒的一部分(Ram等人《癌症研究(Cancer Res.)》53:83-88,(1993))。例如,本文公开了包含能够编码VMD2启动子的核酸序列的表达载体,所述启动子可操作地连接至编码Rap1a的核酸序列。
表达载体中存在的“控制元件”是载体的那些非翻译区-增强子、启动子、5'和3'非翻译区-它们与宿主细胞蛋白相互作用以进行转录和翻译。此类元件的强度和特异性可能有所不同。根据所利用的载体系统和宿主,可以使用任何数量的合适的转录和翻译元件,包含组成型和诱导型启动子。例如,当在细菌系统中克隆时,可以使用诱导型启动子,如pBLUESCRIPT噬菌粒(加利福尼亚州拉荷亚市的Stratagene公司(Stratagene,La Jolla,Calif.))或pSPORT1质粒(马里兰州盖瑟斯堡市的Gibco BRL公司(Gibco BRL,Gaithersburg,Md.))等的杂合lacZ启动子。如果需要产生含有编码多肽的序列的多个拷贝的细胞系,则基于SV40或EBV的载体可以有利地与适当的可选择标志物一起使用。
增强子通常是指在距离转录起始位点无固定距离处发挥作用并且可以位于转录单位的5'(Laimins,L.等人,《美国国家科学院院刊》78:993(1981))或3'(Lusky,M.L.,等人,《分子细胞生物学(Mol.Cell Bio.)》3:1108(1983))的DNA序列。此外,增强子可以在内含子内(Banerji,J.L.等人,《细胞(Cell)》33:729(1983))以及在编码序列本身内(Osborne,T.F.等人,《分子细胞生物学》4:1293(1984))。增强子的长度通常介于10bp与300bp之间,并且增强子以顺式发挥作用。增强子用于增加来自附近启动子的转录。增强子还通常含有介导转录调节的应答元件。启动子还可以含有介导转录调节的应答元件。增强子通常决定基因表达的调节。虽然现在已知许多来自哺乳动物基因的增强子序列(珠蛋白、弹性蛋白酶、白蛋白、-甲胎蛋白和胰岛素),但通常会使用来自真核细胞病毒的增强子进行一般表达。优选的实例是复制起点后侧的SV40增强子(bp 100-270)、巨细胞病毒早期启动子增强子、复制起点后侧的多瘤增强子和腺病毒增强子。
启动子或增强子可以通过触发其功能的光或特定化学事件而被特异性地激活。系统可以通过如四环素和地塞米松等试剂进行调节。还有一些方法可以通过暴露于辐射(如γ辐射)或烷基化化疗药物来增强病毒载体基因表达。
任选地,启动子或增强子区域可以充当组成型启动子或增强子以使本发明的多核苷酸的表达最大化。在某些构建体中,启动子或增强子区域在所有真核细胞类型中都具有活性,即使它仅在特定时间在特定类型的细胞中表达。
表达载体可以包含编码标志物产物的核酸序列。该标志物产物可用于确定基因是否已被递送至细胞并且一旦递送即被表达。标志物基因可以包含但不限于编码β-半乳糖苷酶的大肠杆菌lacZ基因和编码绿色荧光蛋白的基因。
在一些实施例中,标志物可以是可选择标志物。适用于哺乳动物细胞的可选择标志物的实例是二氢叶酸还原酶(DHFR)、胸苷激酶、新霉素、新霉素类似物G418、水霉素和嘌呤霉素。当此类可选择标志物被成功地转移到哺乳动物宿主细胞中时,如果置于选择性应激下,经转化的哺乳动物宿主细胞可以存活。有两种广泛使用的不同类别的选择性方案。第一类基于细胞的新陈代谢并使用缺乏独立于补充培养基生长的能力的突变细胞系。两个实例是CHO DHFR细胞和鼠LTK细胞。这些细胞在不添加如胸苷或次黄嘌呤等营养物的情况下缺乏生长能力。由于这些细胞缺乏完整核苷酸合成通路所必需的某些基因,因此除非在补充培养基中提供缺失的核苷酸,否则它们无法存活。补充培养基的另一种替代方案是将完整的DHFR或TK基因引入缺乏相应基因的细胞中,从而改变它们的生长要求。未用DHFR或TK基因转化的单个细胞将无法在未添加补充剂的培养基中存活。
可以与本文公开的组合物和方法一起使用的另一种类型的选择是显性选择,其是指在任何细胞类型中使用的选择方案并且不需要使用突变细胞系。这些方案通常使用药物来阻止宿主细胞的生长。那些具有新基因的细胞会表达一种传递耐药性的蛋白质,并能在选择中存活下来。这种主要选择的实例使用药物新霉素(Southern P.和Berg,P.,《分子与应用遗传学杂志(J.Molec.Appl.Genet.)》1:327(1982))、霉酚酸(Mulligan,R.C.和Berg,P.《科学》209:1422(1980))或潮霉素(Sugden,B.等人,《分子细胞生物学》5:410-413(1985))。这三个实例分别采用真核控制下的细菌基因来传递对适当药物G418或新霉素(遗传霉素)、xgpt(霉酚酸)或潮霉素的抗性。其它包含新霉素类似物G418和普拉霉素。
如本文所使用的,质粒或病毒载体是在无降解的情况下将所公开的核酸(如能够编码一种或多种所公开的肽的核酸序列)运输到细胞中并且包含启动子的药剂,所述启动子在基因被递送到的细胞中产生该基因的表达。在一些实施例中,本文公开的核酸序列源自病毒或逆转录病毒。病毒载体是例如腺病毒、腺相关病毒、疱疹病毒、牛痘病毒、脊髓灰质炎病毒、AIDS病毒、神经元营养病毒、辛德毕斯(Sindbis)病毒和其它RNA病毒,包含具有HIV骨架的这些病毒。还优选共享这些病毒的性质的任何病毒家族,所述性质使它们适合用作载体。逆转录病毒包含鼠马洛尼白血病病毒、MMLV和表达MMLV的期望性质的逆转录病毒作为载体。与其它病毒载体相比,逆转录病毒载体能够携带更大的遗传有效载荷,即转基因或标志物基因,因此是常用的载体。然而,它们在非增殖细胞中没有那么有用。腺病毒载体相对稳定且易于使用,具有高滴度,并且可以以气雾调配物形式递送,并且可以转染非分裂细胞。痘病毒载体很大,并且有几个插入基因的位点,它们是热稳定的并且可以在室温下储存。优选的实施例是病毒载体,所述病毒载体经过工程改造以抑制由病毒抗原引发的宿主生物体的免疫应答。这种类型的优选载体将携带白细胞介素8或10的编码区。
与将基因引入细胞中的化学或物理方法相比,病毒载体可以具有更高的交易能力(即,引入基因的能力)。通常,病毒载体含有非结构性早期基因、结构性晚期基因、RNA聚合酶III转录物、复制和衣壳化所必需的反向末端重复序列以及控制病毒基因组转录和复制的启动子。当被工程改造为载体时,病毒通常会去除一个或多个早期基因,并且将基因或基因/启动子盒插入病毒基因组中以代替去除的病毒DNA。这种类型的构建体可以携带多达约8kb的外来遗传物质。去除的早期基因的必要功能通常由细胞系提供,所述细胞系经过工程改造以反式表达早期基因的基因产物。
通常,逆转录病毒载体由以下文献描述:Verma,I.M.,“用于基因转移的逆转录病毒载体(Retroviral vectors for gene transfer.)”《微生物学(Microbiology)》,美国微生物学会(Amer.Soc.for Microbiology),第229-232页,华盛顿(Washington),(1985),所述文献特此通过引用整体并入。用于使用逆转录病毒载体进行基因疗法的方法的实例描述于以下文献中:美国专利第4,868,116号和第4,980,286号;PCT申请WO 90/02806和WO 89/07136;和Mulligan(《科学》260:926-932(1993));由于其对用于使用逆转录病毒载体进行基因疗法的方法的教导,所述文献的教导通过引用整体并入本文。
逆转录病毒本质上是一种包装,其中已装入核酸货物。核酸货物携带一个包装信号,所述包装信号确保复制的子分子将被有效地包装在包装外壳内。除了包装信号外,还有许多顺式所需的分子,用于复制和包装复制的病毒。通常,逆转录病毒基因组含有参与蛋白质外壳形成的gag、pol和env基因。通常被外源DNA替代的gag、pol和env基因将被转移到靶细胞。逆转录病毒载体通常含有用于掺入包装外壳的包装信号、指示gag转录单位的开始的序列、逆转录所必需的元件,包含:引物结合位点,其用于结合逆转录的tRNA引物;末端重复序列,其在DNA合成过程中指导RNA链的转换;富含嘌呤的序列5'到3'LTR,其用作合成DNA合成的第二链的引发位点;以及靠近LTR末端的特定序列,其使逆转录病毒的DNA状态能够插入宿主基因组中。取决于每个转录物的大小,该数量的核酸足以递送一对多的基因。优选的是,在插入物中包含阳性或阴性可选择标志物以及其它基因。
由于大多数逆转录病毒载体中的复制机器和包装蛋白已被去除(gag、pol和env),因此通常通过将它们置于包装细胞系中来产生载体。包装细胞系是已经用含有复制和包装机器但缺乏任何包装信号的逆转录病毒转染或转化的细胞系。当携带所选DNA的载体被转染到这些细胞系中时,通过辅助细胞以顺式方式提供的机器,含有所关注基因的载体被复制并包装成新的逆转录病毒颗粒。用于机器的基因组没有被包装,因为它们缺乏必要的信号。
已经描述了复制缺陷型腺病毒的构建(Berkner等人.,《病毒学杂志(J.Virology)》61:1213-1220(1987);Massie等人,《分子细胞生物学》6:2872-2883(1986);Haj-Ahmad等人,《病毒学杂志》57:267-274(1986);Davidson等人,《病毒学杂志》61:1226-1239(1987);Zhang“通过脂质体介导的转染和PCR分析产生和鉴定重组腺病毒(Generationand identification of recombinant adenovirus by liposome-mediatedtransfection and PCR analysis)”《生物技术(BioTechniques)》15:868-872(1993))。使用这些病毒作为载体的好处是它们可以传播到其它细胞类型的程度受到限制,因为这些病毒可以在初始感染的细胞内复制,但不能形成新的感染性病毒颗粒。已显示重组腺病毒在体内直接递送至气道上皮、肝细胞、血管内皮、CNS实质和许多其它组织部位后实现高效基因转移(Morsy,《临床研究杂志(J.Clin.Invest.)》92:1580-1586(1993);Kirshenbaum,《临床研究杂志》92:381-387(1993);Roessler,《临床研究杂志》92:1085-1092(1993);Moullier,《自然遗传学(Nature Genetics)》4:154-159(1993);La Salle,《科学》259:988-990(1993);Gomez-Foix,《生物化学杂志(J.Biol.Chem.)》267:25129-25134(1992);Rich,《人类基因疗法(Human Gene Therapy)》4:461-476(1993);Zabner,《自然遗传学》6:75-83(1994);Guzman,《循环研究(Circulation Research)》73:1201-1207(1993);Bout,《人类基因疗法》5:3-10(1994);Zabner,《细胞》75:207-216(1993);Caillaud,《欧洲神经科学杂志(Eur.J.Neuroscience)》5:1287-1291(1993);和Ragot,《普通病毒学杂志(J.Gen.Virology)》74:501-507(1993)),由于其对用于使用逆转录病毒载体进行基因疗法的方法的教导,所述文献的教导通过引用整体并入本文。重组腺病毒通过与特定细胞表面受体结合来实现基因转导,然后病毒通过受体介导的内吞作用以与野生型或复制缺陷型腺病毒相同的方式内化(Chardonnet和Dales,《病毒学(Virology)》40:462-477(1970);Brownand Burlingham,《病毒学杂志》12:386-396(1973);Svensson和Persson,《病毒学杂志》55:442-449(1985);Seth,等人,《病毒学杂志》51:650-655(1984);Seth,等人,《分子细胞生物学》,4:1528-1533(1984);Varga等人,《病毒学杂志》65:6061-6070(1991);Wickham等人,《细胞》73:309-319(1993))。
病毒载体可以是基于去除了E1基因的腺病毒的载体,并且这些病毒在如人293细胞系等细胞系中产生。任选地,从腺病毒基因组中去除E1和E3基因。
可用于将本发明的多核苷酸引入细胞中的另一类病毒载体基于腺相关病毒(AAV)。这种有缺陷的细小病毒是一种优选的载体,因为它可以感染许多细胞类型并且对人类没有致病性。AAV型载体可以运输约4到5kb,并且已知野生型AAV可稳定插入第19号染色体。优选含有这种位点特异性整合性质的载体。这类载体的一个特别优选的实施例是由加利福尼亚州旧金山市的阿维根公司(Avigen,San Francisco,CA)生产的P4.1 C载体,其可以含有单纯疱疹病毒胸苷激酶基因HSV-tk或标志物基因,如编码绿色荧光蛋白GFP的基因。
在另一种类型的AAV病毒中,AAV含有一对反向末端重复序列(ITR),其侧接至少一个盒,所述盒含有指导与异源基因可操作地连接的细胞特异性表达的启动子。本文中的异源是指非AAV或B19细小病毒天然的任何核苷酸序列或基因。通常已删除AAV和B19编码区,从而产生安全、无细胞毒性的载体。AAV ITR或其修饰赋予感染性和位点特异性整合,但不赋予细胞毒性,并且启动子指导细胞特异性表达。美国专利第6,261,834号通过引用整体并入本文,用于与AAV载体相关的材料。
病毒和逆转录病毒载体中的插入基因通常含有启动子或增强子以帮助控制所需基因产物的表达。启动子通常是当相对于转录起始位点位于相对固定的位置时发挥作用的一个或多个DNA序列。启动子含有RNA聚合酶和转录因子基本相互作用所需的核心元件,并且可以含有上游元件和应答元件。
其它有用的系统包含,例如,复制和宿主限制的非复制牛痘病毒载体。此外,所公开的核酸序列可以在基于非核酸的系统中递送至靶细胞。例如,所公开的多核苷酸可以通过电穿孔、或通过脂质转染、或通过磷酸钙沉淀来递送。所选择的递送机制将部分取决于所靶向的细胞的类型以及递送是在例如体内还是体外发生。
因此,除了所公开的表达载体之外,组合物还可以包括脂质,如脂质体,如阳离子脂质体(例如,DOTMA、DOPE、DC-胆固醇)或阴离子脂质体。如果需要,脂质体可以进一步包括有助于靶向特定细胞的蛋白质。包括肽和阳离子脂质体的组合物的施用可以施用至血液、靶器官,或被吸入呼吸道以靶向呼吸道细胞。例如,可以将包括本文所述的肽或核酸序列以及阳离子脂质体的组合物施用于受试者肺细胞。关于脂质体,参见例如,Brigham等人《美国呼吸细胞与分子生物学杂志(Am.J.Resp.Cell.Mol.Biol.)》1:95-100(1989);Felgner等人《美国国家科学院院刊》84:7413-7417(1987);美国专利第4,897,355号。此外,化合物可以作为微胶囊的组分施用,所述微胶囊可以靶向特定的细胞类型,如巨噬细胞,或者其中化合物的扩散或化合物从微胶囊的递送被设计用于特定的速率或剂量。
D.重组细胞
公开了包含本文所公开的核酸、核酸构建体以及肽和蛋白质的重组细胞。一方面,公开了包含核酸序列的重组细胞,其中所述核酸序列包含第一大肠杆菌同源区和第二大肠杆菌同源区,其中所述第一大肠杆菌同源区包含PAM突变;组成型启动子;M3K基因;MVD基因。
公开了包含核酸序列的重组细胞,其中所述核酸序列包含第一大肠杆菌同源区和第二大肠杆菌同源区,其中所述第一大肠杆菌同源区包含PAM突变;组成型启动子;M3K基因,该基因包含SEQ ID NO:1的序列;MVD基因,该基因包含SEQ ID NO:2的序列。
公开了包含核酸序列的重组细胞,其中所述核酸序列包含第一大肠杆菌同源区和第二大肠杆菌同源区,其中所述第一大肠杆菌同源区包含PAM突变;组成型启动子;M3K基因,该基因包含与SEQ ID NO:1的序列具有至少90%同一性的序列;MVD基因,该基因包含与SEQ ID NO:2的序列具有至少90%同一性的序列。
在一些方面,将所公开的核酸序列整合至重组细胞的基因组中。在一些方面,非整合式质粒核酸序列通常会需要抗生素抗性基因进行选择。因此,所公开的核酸序列整合至重组细胞的基因组中可以去除对于使用抗生素的需求。
在一些方面,重组细胞可以是细菌细胞。在一些方面,细菌是大肠杆菌。
在一些方面,M3K基因和MVD基因在已知具有较高表达水平的重组细胞基因组的区域中。例如,在一些方面,所述已知具有较高表达水平的基因组的区域是大肠杆菌的安全位点9区。
在一些方面,M3K基因和MVD基因是可操作地连接的。
在一些方面,M3K基因和MVD基因受组成型启动子控制。组成型启动子可以是例如16S rRNA启动子或T7A1启动子。本文所公开的组成型启动子中的任一者均可用于控制M3K和MVD基因。
E.制备重组细胞的方法
公开了制备重组细胞的方法,所述方法包含将所公开的线性核酸序列中的任一者施用至细胞,其中所述细胞将线性核酸序列并入其细胞基因组中。
在一些方面,将所公开的核酸序列并入细胞基因组中是使用该核酸序列的第一大肠杆菌同源区和第二大肠杆菌同源区,通过同源重组进行。
在一些方面,公开的制备重组细胞的方法是制备重组细菌细胞的方法。
在一些方面,所公开的方法还可包含将安全位点9(SS9)特异性gRNA施用至重组细胞。在一些方面,gRNA靶向位于SS9内的PAM位点。因此,如果PAM位点在重组期间变化,则gRNA不能将Cas9酶引导到此处以切割DNA。在一些方面,PAM位点在重组期间变化,因为第一同源区和/或第二同源区具有突变的PAM位点,所以当第一同源区和/或第二同源区接着重组至细胞基因组中时,野生型PAM位点不再存在,仅存在突变的PAM位点,并且gRNA不能将Cas9酶引导至DNA。
在一些方面,使用切割DNA的gRNA和Cas9酶可以用作经历同源重组的DNA序列的选择程序。例如,如果发生同源重组并且包含第一同源区和第二同源区的核酸序列重组至细胞基因组中,则细胞基因组将无法通过添加本文所公开的特定gRNA和cas酶来进行切割。第一同源区和第二同源区可包含突变型PAM位点,并且因此第一同源区与第二同源区同源重组至细胞基因组中将消除细胞基因组中的野生型PAM位点并将其置换为来自第一同源区和第二同源区的突变PAM位点。因此,细胞基因组无法通过添加gRNA和cas酶来进行切割。这种添加特定gRNA和cas酶的方法可用于仅选择经历同源重组的细胞,因为cas酶在野生型PAM位点处切割基因组后,未经历同源重组的细胞将死亡。
在一些方面,重组细胞包含Cas9或编码Cas9的基因。因此,Cas9可在细胞内表达,而不必外源地添加。如本文所使用,“Cas9”可以是野生型Cas9蛋白(即,自然界中存在的那些)、修饰过的Cas9蛋白(即,Cas9蛋白变体)或者野生型或修饰过的Cas9蛋白的片段。就野生型或修饰过的Cas9蛋白的催化活性来说,Cas9蛋白也可以是活性变体或片段。在一些方面,重组细胞包含任何Cas蛋白,如野生型或修饰过的。
在一些方面,仅将线性核酸序列并入细胞基因组中的细胞将保持存活。
F.生产异丁烯的方法
公开了生产异丁烯的方法,所述方法包含在适于细菌生长以及M3K和MVD表达的条件下,使所公开的重组细菌细胞中的任一种生长,所述重组细菌细胞包含核酸序列,所述核酸序列包含组成型启动子;M3K基因和MVD基因,其中所述MVD脱去3-羟基异戊酸(3-HIV)的羧基得到异丁烯,并且其中所述M3K催化3-HIV磷酸化成不稳定3-磷酸中间体,所述中间体经历自发脱羧基得到异丁烯。
在一些方面,细胞可在来自水处理厂的废水中生长以产生异丁烯。因此,在一些方面,传统培养液或培养基可被废水取代。
G.试剂盒
上述材料以及其它材料可以以任何合适的组合形式包装在一起,作为用于执行或帮助执行所公开的方法的试剂盒。如果给定试剂盒中的试剂盒组分被设计并适用于在所公开的方法中一起使用,则它是有用的。例如,公开了试剂盒,所述试剂盒包含第一大肠杆菌同源区、组成型启动子;M3K基因;MVD基因;及第二大肠杆菌同源区。所述试剂盒还可以含有载体。
实例
A.引言
在现代世界中,化石燃料的影响是不可避免的。除产生能量以外,化石燃料产品还被用于产生渗透社会的高价值工业化学制品和聚合物。这些聚合物被用于在世界各地产生塑料产品,并且产量在不断增加。2015年,全世界生产了估计3.22亿吨塑料。当前,世界各地利用的石化产品主要是通过粗石油产品的蒸汽裂化生产的。这一工艺需要高温、压力和缺氧条件。蒸汽裂化工艺有极高的能量要求,仅仅产热就需要7-15%的油输入。这占美国总能耗的14%。此外,在精炼工艺中还使用了熔融盐来减少焦炭的形成,又导致对污染物处置的要求。以此方式生产石化产品会放出对环境、经济和物种整体具有多种影响的大量温室气体(GHG)和潜在环境污染物。需要研究如何在减少当前生产方法的负面影响的情况下,持续地生产这些石化产品。
异丁烯(Isobutene/isobutylene)(3-甲基丙烯)是可从持续性生产工艺获益的一种此类石化产品。异丁烯是一种广泛使用的石化产品,其全球市场价值为每年约220亿USD,并且预期到2024年将升高至每年约310亿USD。它被用于产生燃料添加剂,例如分别通过异丁烷、甲醇和乙醇的亲电子加成产生异辛烷、甲基叔丁基醚(MTBE)和乙基叔丁基醚(ETBE)。更重要的是,异丁烯可聚合以制得在轮胎、垫圈、胶、软管等等中使用的异丁基橡胶(表3)。异丁基橡胶具有特殊意义,因为它是所制造的唯一气密性合成橡胶。异丁烯还可与异戊二烯聚合以制造异丁基-异戊二烯橡胶,该橡胶也被广泛使用,但其渗透性可随异丁烯与异戊二烯的比率而有所不同。由于异丁烯的在经济上的重要性,需要维持或增加产量以满足需求。
表3:由异丁烯合成的工业产品
1.工业化学品的生物生产
可增加碳中和以及减少污染的研究的一种方法是工业上重要的化学品的生物生产。虽然将石化产品的生产从蒸汽裂化原油转变成可再生的生产方法并不能减少所有排放,但它会改革其中的一个主要来源。存在由微生物以不同量生产的许多石化产品,这使得生物生产成为值得关注的一个研究方向;不过,利用这些化合物的生物生产被证实具有挑战性。人类利用微生物生产酒精已超过一千年,而如醚、酯、烷烃和烯醛之类其它高能化合物的生产现在正日益吸引人们的关注。许多工业上重要的化合物,例如乙醇、丁醇、甲烷、1,2-丙二醇和3-羟基丙酸可通过微生物发酵产生,并且对于这些化合中的一些,大规模生物生产已经在不同程度上成功实施。对于许多其它化合物,生物生产已得到证实,但尚未扩展超出实验室规模。微生物中常见的长链烃是通过延长-脱羧基反应或与脂肪酸的头对头缩合反应生产的。正在研究增大脂肪酸产量以将其转化成长链烃作为由微生物生产石油型燃料的方法。
已在多种细菌和真菌中检测到乙烯的微生物生产。它在植物相关微生物中尤其普遍,这可能是因为乙烯的作为植物生长调控激素的作用。乙烯的微生物生产是通过KMBA路径进行的,该路径将甲硫氨酸转化成2-氧代酸,即2-氧代-4-甲基硫代丁酸(KMBA),接着转化成乙烯。异戊二烯的生物生产也已在从放线菌到假单胞菌和芽孢杆菌的各种细菌群中发现。已经在古细菌、细菌和真菌的所有微生物生活领域中检测到异丁烯的微生物生产。异丁烯的微生物生产是由亮氨酸和缬氨酸分解代谢的分解产物进行的。
当前在工业化学品生物生产方面的研究集中于生产生物体的优化。这种优化是通过基因工程改造以及仔细地操作培养条件以克服效率低下问题来实现。下一代测序(NGS)加上基因组工程的进步允许发现新颖酶用于生物燃料生产以及并入细胞工厂中以通过生物手段生产更多的石化产品。现已验证了不同水平的甲烷、丙烷、异丁醇、乙烯、异丁烯、异戊二烯等等的生物生产。通过利用新阐明的CRISPR/Cas系统,可不依赖于抗生素抗性作为反选择来将基因组插入细菌中。利用这些新颖技术,有可能在单个重组事件中将生物燃料生产的完整路径插入宿主株中,而不会损害宿主基因组。
过去二十年里,我们作出了许多工作,以便将更多生物燃料以更实惠的价格投入市场。大部分的工作是由如大豆、玉米或棕榈树之类作物生产生物燃料或生物柴油。使用酵母,通过玉米发酵来生产乙醇是经济上可行的工艺的主要实例。然而,由于政府为从玉米生产乙醇提供了高水平的补贴,故指定这一工艺在经济上可行必须附带重要的告诫。此外,使用粮食作物作为生物燃料的原料越来越成问题,因为预期粮食生产的需求在接下来的40年里将升高多达60%。这导致现在一些国家不再为耕种用于生物燃料生产的粮食作物提供补贴。例如,2018年欧盟投票决定停止对用于生物柴油的棕榈油生产的补贴。这种不使用粮食作物的做法意味着需要更便宜的替代原料来进行生物燃料生产。近来开发的生物燃料工艺或是使用更难降解的原料(木质纤维素生物质)或是使用工程改造成由大气CO
废水是用于生产生物产品的一种潜在原料,它可帮助降低成本和增加经济可行性。由于污水污泥中存在相对较高浓度的脂质(二沉污泥是2-12wt%,而初沉污泥是15-30wt%),故使用废水作为原料将提供高能化合物,即脂肪酸用于代谢。来自农场、加工厂或市政设施的废水用作原料的可行性已在如氢气、甲烷、丁醇和丙酮等生物燃料的生产中得到证实。经显示,在来自农场和市政设施的废水中生长的藻类可有效去除污水中的溶解氮和磷以及将固体质量转化成脂质生物质。藻类生物质的高脂质含量意味着,它可以通过施加热和压力凝结成生物柴油。将生物质转化成生物燃料的另一个潜在机制是厌氧消化在废水流出物上生长的微藻类生物质以进行甲烷生产。来自农场及农业加工的废水已被用作氢气和甲烷的生物生产的原料。能够由微生物在废水上生长生产多种生物燃料展示了废水作为原料的可行性。
即便使用更便宜的原料,异丁烯和其它石化产品的生物生产也很难达到经济可行性。这主要是因为产生低效价的路径效率低下。所述工艺的所有阶段都必须进行优化,这将需要多学科团队。例如,工程师、建模者和合成生物学家团队可以一起工作以设计出从原料到生物反应器的整个优化系统,通过推导出代谢网络的数学模型以预测能量有利性来简化基因工程。为了减少或缓解对于使用昂贵糖原料的需求,使用如玉米秆之类木质纤维素材料作为生物燃料原料特别有吸引力。已经进行了一些有前景的研究,将大肠杆菌工程改造成能降解其它难降解的结构多糖,如果胶和纤维二糖。研究人员已证实,破坏甲基乙二醛合酶将改善大肠杆菌中戊糖和己糖的共代谢。这种失活有助于缓解对于大肠杆菌中碳分解代谢产物阻遏(carbon catabolite repression,CCR)系统的代谢节制。还研究了使用基于生物膜的生物反应器代替液体悬浮培养进行生物燃料的微藻生产。通过培养生物膜而不是浮游细胞,研究人员生产出与液体悬浮液相等量的生物燃料前体,但用于培养的培养基的体积明显减少。组合这些方法的多学科团队可以增加代谢效率,改善难降解原料的降解并减少培养物体积。这些又将降低生物燃料生产的成本并提高经济可行性。
2.用于增强生物生产的耐受性工程改造
经证实,增加溶剂耐受性的基因操作是增加生物燃料的生产效价的一种有效方法。大多数的生物燃料化合物会对细胞膜和核酸造成损伤。因此,随着生物燃料的浓度增加,它会抑制生产者的生长。增加对这些化合物的耐受性可以允许在抑制发生之前生产出较高浓度的化合物。对化合物的耐受性可以通过多种方式实现。反复且长期地暴露于生物燃料可用于驱动对目标化合物具有增加的耐受性的突变体的选择。此外,鉴别和表征在暴露于生物燃料之后显示转录增加的基因可帮助阐明突变或过表达的目标。被证实有效增加耐受性并且在一些情况下增加工业化学品的生产的方法是外排泵的过表达。外排泵是过表达或优化的合理目标,因为它们将去除细胞内环境中的生物燃料,以防进一步细胞内损伤。通过过表达响应于异戊烯醇暴露而上调的若干基因,将增加异戊烯醇耐受性和生产。这些基因的范围从伴侣蛋白ibpA到转运蛋白mdlB,再到转录活化物metR。丙酮丁醇梭菌(Clostridium acetobutylicum)被工程改造成通过过表达伴侣蛋白groELS来增强对丁醇和丙酮的生产和耐受性。
B.异丁烯的生物生产
1.引言
已发现利用多种前体的若干用于生产异丁烯的生物路径(图1)。经显示,异戊酸在细胞色素P450作用下脱羧基,以11nmol*min-1*mg蛋白质-1的速率生产异丁烯。这一反应需要NADPH、O2和充当NADPH还原酶的第二细胞色素P450酶。已知经由油酸水合酶使异丁醇脱水来生产异丁烯。不幸的是,有关生产速率的信息并不了解,由此限制与通过其它酶方法进行生产的比较。
先前显示的催化由3-羟基异戊酸(3-HIV)生产异丁烯的两种酶是甲羟戊酸二磷酸脱羧酶(MVD)和甲羟戊酸-3-激酶(M3K),并且这一研究集中于通过表达这两种酶进行异丁烯的生产。据报导,由纯化的MVD作用于3-HIV进行的异丁烯生产高达6.44±0.95_pmol*min-1*mg蛋白质-1。据报导,由纯化的M3K进行的异丁烯生产在30℃下达到26±2pmol*min-1*mg蛋白质,并且在50℃下达到2,880±140pmol*min-1*mg蛋白质。异丁烯生产的最高生物速率是通过M3K对3-HIV的作用实现,其中由MVD进行的生产是第二高的。经显示,两种酶各自通过独立的机制催化由与3-HIV反应进行的异丁烯生产。MVD在ATP依赖性反应中与3-HIV反应,并且在3-HIV磷酸化之后,催化去除羰基,同时释放无机磷酸酯,得到异丁烯(反应1)。类似地,M3K用以催化将磷酸酯基添加至3-HIV上以产生3-磷酸异戊酸(3-PIV),该3-PIV经历自发脱羧基,同时释放无机磷酸酯,产生异丁烯(反应2)。
C5H9O3+ATP→C4H8+CO2+Pi (1)
C5H9O3+ATP→C5H8O3P→C4H8+CO2+Pi (2)
由于这两种酶的作用模式不同,在一个生物体中表达两种酶可以使产量增大到高于仅表达两种酶之一的生物体所实现的产量。异丁烯的生物生产仍需要显著改进,因为当前的生产速率比达到经济可行性所需的生产速率要低约10
2.异丁烯生产
本文描述了将包含M3K和MVD的核酸序列整合到大肠杆菌基因组中。图2显示了包含插入大肠杆菌基因组中安全位点9(SS9)区处的M3K和MVD的核酸序列的实例。
先前已展示在全细胞培养物和无细胞提取物中由MVD和M3K两者进行的异丁烯的生物生产。在本研究之前并不知道在由中心染色体表达MVD和M3K的大肠杆菌中异丁烯的生产效率。通过同源重组,利用Cas9介导反向选择对大肠杆菌MG1655进行工程改造,以在该菌株的染色体中由SS9表达MVD和M3K。在所有引入的质粒都固化后,通过检测顶部空间中的异丁烯来验证成功的基因组工程改造。在来自非重组培养物的对照的顶部空间中未检测到异丁烯。先前已证实,在由质粒表达MVD或M3K的大肠杆菌培养物中生长的前48小时内,异丁烯生产是线性的,并且这一假设被用于计算生产速率。在24小时之后,测量经过工程改造的菌株的异丁烯生产情况。所测量的最高生产速率是144.68pmol*min
表4:由培养物进行的生物异丁烯生产
3.讨论
本研究首次展示通过由中心染色体转基因表达M3K和MVD来生产异丁烯。当表达野生型scMVD或突变型MVD时,先前通过在大肠杆菌中由质粒表达所得到的全细胞生物生产水平分别在2.57pmol/min*g细胞至98.13pmol/min*g细胞范围内。这一经过工程改造的菌株的异丁烯生产速率(135.70±7.78pmol/min*g细胞)始终比当前报导的由质粒得到的最高生产水平(507±137pmol/min*g细胞)低约5倍,但生产菌株可通过进一步优化予以改良。SS9处于染色体的组成型表达下;因此,预期与含有携带M3K或MVD的质粒的细胞相比,它不具有高基因拷贝数,导致异丁烯的生产速率较低。由中心染色体表达基因的益处在于,不必补充抗生素来维持基因,这在扩大规模时对于环境和经济是有利的。据报导,异丁烯的最高总体生物产量是2,880±140pmol/min*mg蛋白质。这是通过纯化的M3K酶与3-HIV在高温(50℃)下反应实现。由于3-HIV与M3K的反应是通过经历自发脱羧基的不稳定中间体进行,故反应速率的增加可能是由该反应的丰富的自由能引起。考虑到这一事实,将M3K和MVD插入耐热微生物中来确定是否能通过在较高温度下培养来提高生产效率可能是有益的。
已经对若干嗜热微生物作为生物化学细胞工厂的潜力开展研究。迄今为止最成功的生物体是激烈火球菌(Pyrococcus furious)。这一极端嗜热性古细菌最佳地在100℃下成长并且先前被工程改造用于增加氢产量,或产生如乳酸、乙醇和3-羟基丙酸(3-HP)等产物。通过一系列工程改造步骤,3HP产量已经确定并且递增地增加至比初始产量高10倍的水平。使用激烈火球菌所面临的一个难题是发现非天然酶具有足够热稳定性以使其在接近100℃的温度下仍有功能。鉴别出M3K的嗜热嗜酸古细菌灼热嗜酸古菌最佳地在60℃下生长。尽管这一温度明显低于培养激烈火球菌所需的温度,但它具有比其它生产生物燃料的生物体更高的热稳定性,并且其酶可以在激烈火球菌中发挥功能。鉴于生产速率和可用宿主生物体增加,值得研究是否表达M3K,因为M3K的热适应性要高于MVD,会在激烈火球菌中引起异丁烯的大量生产。
C.溶剂应激反应
与高能烃的生物生产相关的挑战有很多,其中之一是生物燃料在培养物中的积累可引起毒性,从而抑制所需燃料的进一步生产。经证实,阐明细胞工厂在溶剂暴露之后的应激反应是发现工程改造溶剂耐受性生物生产者的基因目标的一种有效方法。通过转录组图谱分析研究在溶剂暴露之后经过工程改造的微生物对生物相关溶剂的应激反应。将溶剂分成两类处理:内源产生的应激物(丙酮、异丁烯和异丁醇)和类似有机溶剂(液体烷烃3-甲基戊烷、己烷;液体烷烃3-甲基-1-戊烯和环己烯)。处理组中在处理后明显上调的基因的数量在155至254个的范围内,而各处理组中明显下调的基因的数量在185至1,214个的范围内(图3)。溶剂诱导的基因表达变化在两个处理组中并不一致。这通过图4中以下两个溶剂处理组的不同聚类来证实:内源性溶剂组和类似有机溶剂组。
最常响应于所有溶剂处理而上调的路径是热休克反应(基因家族clp、ibp、hsl)和噬菌体休克反应(基因家族psp;表5)。图5和6分别显示经历由内源性应激物和类似有机溶剂处理引起的表达变化的基因的共享子集。通过测试相对于阳性对照表达水平的变化来产生基因表达的所有变化,并且以Bon Ferroni校正的p值<0.05过滤基因。当暴露于丙酮、异丁醇或异丁烯时,分别有399个、831个和1384个基因经历明显的表达变化(图3)。当暴露于液体烷烃溶剂时,有535个基因在暴露于己烷之后有差异地表达并且有414个在暴露于3-甲基戊烷之后有差异表达(图3)。当暴露于液体烯烃溶剂时,有530个基因在用环己烯处理之后经历明显表达变化,并且有540个在暴露于3-甲基-1-戊烯之后经历变化(图3)。
表5
每个样本中生成的序列量在大多数样本中是一致的,但与其它在其处理中的生物重复样本相比,有四个样本具有减少的序列返回(sequence returns)。这些样本中质量较低的数据是由于在首次尝试期间对RNA文库制备方案缺乏经验。受影响最大的两个样本是一个对照复制样本和一个丙酮处理复制样本(图4)。环己烯样本和3-甲基戊烷样本中也各有一个样本产生较少的序列数据,但程度未达到在丙酮和对照样本中所观察到的程度。在包括和不包括离群值的情况下进行统计分析以确定离群值影响。DESeq2在生成模型以估计倍数变化方面被证实是稳健的,其中在包括或不包括离群值情况下两组分析之间并无重大差异。
当用丙酮、异丁醇或异丁烯处理时,最强上调反应出现在应激反应基因中,特别是涉及蛋白质修复以及细胞内pH值和克分子渗透压浓度调控的基因。涉及蛋白质保护和修复的基因ibpAB和clpAB的表达均增加(图5)。混合热休克蛋白和伴侣蛋白hslJORUV的表达,其中响应于丙酮和异丁醇处理上调,但对于异丁烯处理,表达无明显变化。编码伴侣蛋白groLS和dnaJK的基因增加表达(表5)。涉及由谷氨酸通过产生γ-氨基丁酸(GABA)引起的抗酸性的基因(gadABCE)在丙酮和异丁烯处理组中上调,但在异丁醇处理组中下调(图5)。涉及通过精氨酸转化成胍丁胺引起的抗酸性的基因adiACY在所有处理组中显示出混合反应,但响应于异丁醇下调的adiA除外,该基因不具有统计显著性(图5)。涉及甘油转化成甘油酮磷酸的基因(glpABC)的表达在全部三个处理组中增加(表5)。涉及减少生物膜材料生产的基因(bssRS)在所有处理组中上调(表5)。涉及脂肪酸生物合成的基因(accBC)在全部三个处理组中下调(表5)。多重抗生素抗性家族中的一个基因marA在全部三个处理组中上调;然而,marBC未通过质量过滤并显示出混合表达(表5)。
当用3-甲基戊烷和己烷处理时,最强增加的是应激反应基因,特别是涉及蛋白质修复和保护的基因(ibpAB、clpAB,图5;hslJORUV,表5)。两个处理组中噬菌体休克基因pspABCDE(表5)以及伴侣蛋白groLS、spy和dnaJK的表达(表5)高度上调。涉及由谷氨酸产生GABA或由精氨酸转化成胍丁胺引起的抗酸性的基因在两个处理组中都下调,但并非gad或adi基因家族的所有成员在两个处理组中都具有明显的表达变化(图6)。编码用于半乳糖醇代谢的蛋白质的基因gatABD的成员上调(表5),而gadE和adiY明显下调(图5)。甘油降解基因glpABC以及硝酸还原酶基因narGHJKP在两个处理组中上调(表5)。涉及产生多重抗生素抗性表型的基因marABC(表5)以及二羟基丙酮激酶基因dhaKLM(表5)响应于两种溶剂上调。编码鞭毛蛋白合成和组装的基因在两个处理组中也下调(表5)。
当用烯烃溶剂3-甲基-戊烯或环己烯处理时,基因表达的最强变化也出现在应激反应基因中,特别是涉及蛋白质修复和保护的基因。编码蛋白质保护和修复蛋白质的基因的表达在两个处理组中增加(ibpAB、clpAB,图6;hslJORUV,表5)。在两个处理组中噬菌体休克基因以及伴侣蛋白(pspABCDE、groLS、spy、dnaJK,表5)高度上调。半乳糖醇代谢(gatABD)在两个处理组中上调(表5)。二羟基丙酮激酶(dhaKLM)在两个处理组中上调(表5)。硝酸还原酶基因narGHJKP在两个处理组中上调(表5)。涉及产生多重抗生素抗性表型的基因响应于两种溶剂而上调(marABC,表5)。涉及由谷氨酸产生GABA或由精氨酸转化成胍丁胺引起的抗酸性的基因在两个处理组中下调。尽管并非所有的gad或adi基因家族成员在两个溶剂处理组中都经历明显表达变化,但gadE和adiY在两个处理组中有明显变化(图6)。
1.讨论
i.溶剂反应的转录组分析
在溶剂暴露之后,涉及热休克或氧化应激反应的基因出现一致上调。在所有溶剂处理组中,涉及保护蛋白质免于变性和聚集或涉及损伤之后蛋白质修复和再折叠的基因(clp ibp)出现上调。这些反应共同作用以响应于与非极性溶剂的相互作用而增加使蛋白质免于聚集的保护作用,再折叠受损蛋白质及降低膜流动性。在所有溶剂处理组中观察到的最强作用是在蛋白质保护和修复基因的过表达中。这表明溶剂暴露所具有的最强负面影响是通过蛋白质变性发生的。这对于生产菌株特别重要,因为异丁烯是气体并且具有极低水溶性。异丁烯最有可能具有有害相互作用的环境是它仍保持在细胞内时,因此修复它可能损害的蛋白质引起关注。由于还要进行一些工作来使生物燃料进行更可行的大规模实施方案,有必要设计对长期暴露于这些溶剂具有抗性的生产菌株。
有证据证实,改善生产菌株的耐受性可提高生产效价,并且已经研究了在暴露于如丁醇和异丁醇之类相关化合物之后的应激反应。通过重复暴露于异丁醇和随后再培养来进化产生异丁醇耐受性突变体。在这些异丁醇耐受性突变体中,它们在基因座acrA、gatY、marCRAB、rapZ和tnaA中发现插入突变体。当使工程改造用于异丁烯生产的菌株暴露于异丁醇时,与Atsumi等人2010的研究相比较,存在系统表达的混合反应。gatY和marCRAB基因座上调并且核糖核酸酶接头蛋白质rapZ下调(表5)。在Atsumi等人的研究中,他们能够通过先前描述的基因座缺失来建立原始群体中的异丁醇耐受性。通过缺失一些或全部基因座来赋予不同程度的耐受性。这一点很重要,因为它表明,并非在这些经过工程改造的细胞中所观察到的所有上调反应都能在过表达时引起增加的耐受性。尽管许多研究显示选择性过表达在应激反应期间高度表达的基因可提高应激耐受性,但Atsumi研究显示,不应盲目地假设所有上调反应都是这种情况。此外,值得注意的是,并非所有工程改造用于增强耐受性的菌株都显示增加的产量。然而,还有若干其它研究设法通过增加各种微生物的耐受性来增加若干化合物的产物效价。耐受性工程改造对于增加例如丁醇、乙醇、1-3-丙二醇和柠檬烯之类多种化合物的生产是有效的。
异丁烯在室温下是气体并且在20℃下具有30mg/L的水溶解度,这意味着它会主要积累在培养容器的顶部空间中。这使系统中持续产品收集变得简单。在系统中,有证据表明,已研究异丁醇耐受性的若干基因家族如mar和gat上调。这些高度表达的基因中一些基因的缺失赋予增加的耐受性,但并不增加产量。考虑到在废水上生长的所有样本中gat基因的表达以及这些基因的表达速率在稍后时间点不断增加,此指示从长期来看,gat基因缺失可被证明对于生产系统是有问题的。将需要以实验方式确定如mar、gat或arc之类基因家族的缺失是否会增加对异丁烯的耐受性,以及确定这些缺失对经过工程改造的菌株的生长速率的影响。有关通过耐受性工程改造增加生物燃料生产的最成功研究使用了在经过工程改造的菌株中观察到明显上调的一些相同应激反应的过表达。经过工程改造的生产菌株中ibpA的过表达不仅赋予增加的耐受性,而且还使异戊烯醇生产增加16%。当用异丁烯应激时经过工程改造的菌株中ibpAB明显上调将指示,这些基因是在过表达时产量提高的主要候选物。在异丁烯耐受性突变株经历工程改造后,接下来的步骤是研究这种耐受性工程改造对异丁烯生产的影响。确定耐受性工程改造对生产速率和总体异丁烯效价的影响将提供有关异丁烯毒性如何影响异丁烯生产的了解。
ii.废水代谢
当比较在MOPS基本培养基中以葡萄糖或废水作为碳源生长的样本时,碳利用和细胞运动存在若干显著差异。相较于葡萄糖培养物,在废水上生长的培养物显示较低的合成谷氨酸和将谷氨酸转化成GABA的基因的表达。在废水培养物中,编码涉及糖醇分解代解的酶的转录物数量较多。这些转录物中最普遍的转录物家族之一是gat基因。与葡萄糖培养物相比,半乳糖醇看来是废水中的主要糖组分,涉及半乳糖醇吸收和分解代解的gat基因明显上调证明了这一点。糖不是废水培养基中的唯一碳组分,不过与葡萄糖样本相比,脂质分解代解在第1天上调,但游离脂肪酸看来在第3天时已在培养基中耗尽,因为涉及β-氧化的基因在第3天时不再上调。在细胞死亡期之后,厌氧性β-氧化基因再次上调,这可能是因为在两种培养条件中,在稍后时间点可从死细胞获得的脂肪酸。
相较于在葡萄糖中生长的样本,在补充废水的培养基中生长的样本中,涉及活动性和趋化性的基因明显上调。这在早期时间点比较中最明显。不同于补充有葡萄糖的培养基,由于培养基是细颗粒悬浮液/溶液混合物,增加活动性(flg和fli基因)和趋化性(cheAW和tsr基因)在废水系统中售有益的。带有碳的颗粒物质不可用于被动吸收;因此,细胞将需要连接至粒子表面并在水界面处将其降解。需要注意的是,并非所有的碳在废水培养基中都呈悬浮状态,并且随着培养物老化,悬浮材料的量将减小。这将指示趋化性反应对于在废水上早期生长很重要,但随着培养物老化将不再有利。随着培养物老化,涉及脂多糖(LPS)生产的基因的表达增加以及生物膜形成证实了这一点。
D.太空飞行暴露对经过工程改造的大肠杆菌的影响
1.引言
尽管地球上塑料的生产随着时间的推移而不断增加,但有一个人类聚居的环境当前不具有大规模生产能力,即太空。在ISS上生活的宇航员代表着人类最遥远的居住地,也是最接近地球外领土殖民化的地方。在ISS上没有材料生产,任何宇航员在太空中使用的所有材料都必须运往现场。运输极其昂贵,范围从每次行程$1,000-$10,000,并且具有潜在的危险。此外,当在空气泄漏可能致命的飞船中工作时,对于不透气合成橡胶的要求尤其高。将这一要求与人类废弃物作为微生物原料的可用性结合起来,并且所有这些因素一起提出一个问题:暴露于太空飞行对于经过工程改造的微生物会有什么影响?
当前对于在ISS上大量生产聚合物或任何其它具有工业意义的材料的需求很低,但了解太空飞行暴露对于生物生产的潜在影响的益处却很高。一般来说,要了解太空飞行对生物系统的影响,还有大量工作要做,而这不仅仅是针对生物燃料生产者的。因此,ISS提供了研究太空飞行暴露对生物燃料生产菌株的影响的独特机会。确定太空飞行对生物燃料生产者的影响是汇集在地球外生产生物燃料所需的知识的起点。在人类研究地球以外的大规模生产之前,还需要大量的技术投资和进步;但基础研究科学,如确定太空飞行对生物生产菌株的影响将帮助未来的研究人员推动这些技术的进步。
当与太空的真空相比较时,ISS的保护和可居住性非常出色,它提供了与在地球上所经历的环境明显不同的环境。NASA报导,在地球上的一年时间里,人类暴露于约3毫西弗(milliSieverts,mSv)的破坏性背景辐射。相比之下,在6个月时间段内,在ISS上的宇航员将暴露于160mSV。在一年时间里,这比在大气保护下的辐射暴露量多出超过100倍。这种大剂量的高能辐射很可能会影响经过工程改造的菌株的基因表达和总体基因组组成。先前在ISS上所作的工作对由暴露于辐射引起的如枯草芽孢杆菌(Bacillus subtilus)之类微生物的突变率进行了定量。在这项研究中,长期暴露于高剂量辐射使得突变率相较于在地面上生长的对照增加超过三个数量级。这一相对较高的辐射暴露还可以通过SOS反应系统的表达来证实,辐射暴露引起dinABD和umuCD所编码的易错聚合酶的表达增加。
先前的研究显示了当微生物暴露于太空飞行时的不同影响,包括增加的生长速率、生物膜形成、毒力和次级代谢物的生产。这为生物燃料生产者暴露于太空飞行的潜在益处提供了一些证据。生物膜形成增加将允许在减少的体积的培养基中生物质的产生增加。由于前体是内源性生产的,而不是从环境提取的,故生长速率增加会引起异丁烯生产的增加。最后,如果暴露于太空飞行可用于增加次级代谢物3-HIV的微生物生产,则这可进一步增强生产可行性。
据悉,微重力不会显著影响代谢的细胞内动力学。然而,对细胞质量转移的影响更为显著。假设考虑到重力驱动的流动缺乏,细胞外养分的吸收受到扩散速率的限制。当将在ISS上大肠杆菌细胞培养物的大小与在地球上细胞培养物的大小相比较时,扩散对于在微重力下养分吸收的重要性的证据是显而易见的。在49小时的微重力暴露之后,大肠杆菌细胞已减少至在地球上培养的其对应物的体积的37%。这种细胞缩减将改变细胞的表面积与体积比以有利于增加扩散速率,由此帮助细胞在这种具有挑战性的环境中维持营养平衡。由于这依赖于在ISS上培养物中的扩散,当与地面样本相比较时,应当能检测到编码孔蛋白和转运蛋白的转录物的表达差异以帮助营养吸收。
传送至太空中的大肠杆菌还经历了冷冻应激。在-80℃下冷冻细胞将诱导冷休克反应的表达。冷休克效应已经在若干系统中得到充分研究,因为长期培养物储存的主要方法就是冷冻干燥。当细胞进入冷休克时,它们开始阻遏翻译并增加脂质A层中棕榈油酸酯的含量。增加脂肪酸链的不饱和度将允许随着温度降低而增加膜流动性。第二个反应是在由温度降低引起的超螺旋增加下用于染色体维持的csp基因的诱导。当大肠杆菌培养物从冷冻中恢复时,SOS修复系统的诱导通常被活化。当确定太空飞行的影响时,需要考虑这些转录变化。
经显示,微重力条件可增加并简化代谢路径。使用微重力鉴别不需要的竞争路径允许从基因上去除这些路径,并因此允许更高效的异丁烯生产。
2.对基因表达的影响
为了能够在地球外扩展文明,还需要在地球外扩展制造。在能够执行这个非常遥远的概念之前,需要对地球外部环境中的生物过程有更详细的了解。在设计出测量在微重力下微生物异丁烯生产的方法之前,需要了解太空飞行对经过工程改造的菌株的影响。这些影响是通过比较在地面上与在ISS上相应时间点的基因表达数据研究的。对于在ISS上的废水样本,在第一天和第三天的明显失调的基因的数量分别在1047至755范围内(图7)。由于针对冷冻效应筛选引起的测序约束,故并未比较第7天地面样本与第7天ISS样本。在废水上生长的第14天或第30天ISS样本的所有重复实验都没有提取到足够的mRNA用于测序。对于所有成对的时间点(第1天、第3天、第14天、第30天),利用葡萄糖培养物测试地面与ISS样本比较。当比较来自ISS与来自地面的第14天(图7)培养物时,在葡萄糖上生长的ISS样本中观察到最强的基因表达变化。第1天和第30天明显失调的基因的数量分别在2,216至606范围内(图7)。在第14天观察到基因表达的最强变化,并且当比较第1天地面与ISS样本时,具有相当的反应,分别是2588个对比2216个明显表达的基因。
此外,通过比较地面和ISS样本的基因表达随时间的变化来研究在饥饿条件下生长延长的影响(图8和9)。在UAA处在葡萄糖上生长的培养物随时间推移并未显示出与在ISS上观察到的反应相当的较强差异表达反应。首先比较样本在第1天的表达,接着也比较后续时间点。在后续时间点比较中很少有基因(如果有的话)通过统计过滤,因此,这些比较将不再讨论。差异表达的基因的数量范围从冷冻后第3天的165个基因至第14天的95个基因。
在UAA处和在ISS上生长的所有样本中都检测到M3K和MVD转录物,但并不总是处于恒定的丰度。在UAA处生长的培养物中,转录物丰度(1.9%-2.0%)在30天内并无明显变化。在第1天和第3天样本中转录物丰度最高,并且在第1天,废水样本中与MVD比对的转录物达到1.98%且与M3K比对的转录物达到2.2%。一周后,废水样本中M3K的转录物丰度减小至0.88%且MVD的转录物丰度减小至0.81%。在第1天的葡萄糖样本中,有1.87%的序列与MVD比对且2.11%的序列与M3K比对。第30天,转录物丰度随时间推移而减小至其最低点。第30天葡萄糖样本对于M3K具有0.93%的比对率且对于MVD具有0.83%的比对率。必须指出,M3K与MVD之间存在高度序列同源性,这会影响序列检测。
为了确定在24小时培育后冷冻所具有的影响,对来自地面和ISS的冷冻或未冷冻的样本进行比较。将从未冷冻的第3天培养物与初始24小时培育结束时在-80℃冷冻48小时且接着再生长48小时的样本相比较。当将未冷冻的来自地面的第3天样本与ISS样本相比较时,葡萄糖和废水培养物中冷休克家族中的多个基因(clpABCDEFGHI)明显上调。通过统计过滤的最强反应出现在两种培养物的cspAI中(表A-4)。当将冷冻的第3天地面样本与ISS样本相比较时,任一ISS培养物中只有cspA上调,并且与未冷冻的样本相比较,该反应要低约3倍。在确定冷冻的影响的两种比较中,当将第3天的未冷冻样本与第3天ISS样本相比较时,观察到最高比例的强上调反应(L2FC>1)。冷冻的第30天培养物当彼此相比较或与ISS样本相比较时,显示无冷休克反应。
3.废水
通过比较对照值(第1天)与后续时间点的地面(第3天、第14天、第30天)或ISS(第3天、第7天)样本的成对测试来确定基因表达的变化。在Bon Ferroni调整的p值<0.05下,过滤样本。第3天和第14天地面培养物中明显失调的基因的数量分别在779至1,841的范围内。在ISS上的培养物中,第3天和第7天经历明显表达变化的基因的数量分别在1,055至1,759范围内。
相较于地面样本,传送至ISS的样本在第1天显示出较高的转录活性水平。ATP合酶、泛酸激酶和涉及细胞内陷的Tol-Pal基因上调。第1天ISS样本显示许多糖酵解基因(gapA、pgi、fbaA、eno、pgk)明显上调。相较于地面样本,ISS样本显示涉及活动性及趋化性的系统的高水平表达(flg、fli、che)。当在第3天比较ISS与地面样本(使用冷冻样本以减小混淆变量)时,抑制翻译过程、DNA复制和起始静止期生理变化的基因的表达增加。相较于在UAA处生长的样本,存在废水上生长的ISS培养物中生物膜形成以及类粘蛋白产生和铁储存增加的转录证据。
在ISS上生长的样本分组存在明确模式(图8)。在第3天之后,对所有样本进行严密分组并与地面样本分开。此外,最接近ISS第3天的分组样本是在24小时后冷冻以模拟ISS样本错误的地面第3天样本。第14天和第30天只有来自地面样本的数据,因为无法从ISS样本的一些重复样本中提取足够的mRNA进行测序。第14天和第30天地面样本紧密地聚类在一起,由此指示在第7天之后生长条件的变化到第30天时保持相对稳定。来自第14天和第30天的地面样本中存在的涉及易错DNA复制、二肽转运和氨基酸降解的基因上调证实了这一点。
在ISS上的整个生长过程中,基因表达明显改变。第3天样本显示glp基因上调,指示甘油酮磷酸(二羟基丙酮磷酸)和对苯二酚的积累。在第3天和第7天,涉及乙酸分解代解和硝酸还原的基因(ack、nar)上调。第3天和第7天样本显示将不饱和脂肪酸转化成饱和脂肪酸的基因(cfa)上调,这将降低膜流动性。甘油发酵(glp基因)在第3天上调,但其表达在第7天减少。edd和eda基因上调,指示培养物将葡糖酸转化成G3P。酸反应基因(clc)上调,但其它应激反应并不明显。到第14天,只有三分之二的生物重复样本产生可用于测序的数量的mRNA,并且只有三分之一的来自ISS的第30天废水培养物产生输入至rRNA耗尽中以适当地平衡文库所需的5μg总RNA。
4.葡萄糖
分别通过后续时间点的地面(第1天、第3天、第14天、第30天)和ISS(第1天、第3天、第7天、第14天、第30天)样本与第1天样本的成对测试来确定基因表达随时间的变化。在BonFerroni p值<0.05下,过滤样本。当比较后续时间点的ISS样本与第1天样本相比较时,明显差异表达的基因的数量存在显著差异。第3天和第14天明显表达的基因的数量分别在2,223至3,114个基因的范围内。一个测序重复样本未产生与其它重复样本相当的量的序列数据。这是葡萄糖第1天样本,该样本在经历珠粒清除的同时,经历过度干燥,并具有较差回收率。在存在和不存在这一数据点的情况下重复分析,以确定离群值对DESeq-2结果是否具有明显影响,并且它未显示出显著影响。
从在葡萄糖上生长的样本收集的基因表达数据存在不太明显的趋势(图9)。对在空间站的第1天、第3天、第7天和第30天进行严密分组,其中第14天有广泛分布。地面样本的聚类更零散,其中最值得关注的分组是第3天ISS和冷冻地面样本的紧密聚类以及所有第14天和第30天地面样本的聚类。在废水样本中也观察到第3天冷冻地面样本与第3天ISS样本的聚类,显示意外冷冻对第3天基因表达的影响。第14天和第30天地面样本的紧密分组将指示,群体已经确立并且在基因表达方面保持相对稳定。更值得关注的是第7天和第30天的ISS紧密分组,其中在第14天的分散指示基因表达在第7天与第14天之间的某一时间的转变。
葡萄糖样本在空间站中的基因表达随时间的变化显示出酸应激反应基因的混合表达(gad、adi;图10,表6)。ISS培养物中涉及蛋白质保护、修复和再循环的基因的表达显示出混合反应,具有表达随时间减少的一般趋势(clp、dna、ibp;图10,表6)。
第3天之后,涉及厌氧代谢的若干基因上调,指示环境中的氧已耗尽(glp、pflA、nar;表6)。从第14天起,存在编码众多代谢转运蛋白的基因的表达。到第14天时,涉及鼠李糖(6-脱氧-L-甘露糖)以及半乳糖吸收和降解的基因上调(rha、gat;表6)。氨基酸丝氨酸、组氨酸、鸟氨酸、赖氨酸、精氨酸和苏氨酸的吸收和分解代谢上调。在第14天和第30天观察到的主要代谢反应涉及再循环氨基酸、细胞多糖和脂肪酸。
随着培养物老化,转录物增加,这可能会引起突变率的增加。由在第14天达到最大表达的增加所编码的易错聚合酶的表达(din、umu;图11、表6)。cas1-3所编码的内源性CRISPR-Cas系统表达上调,在第14天达到最高表达(图11、表6)。在第7天之后的时间点,在ISS上多个插入序列(IS)的表达明显高于先前时间点的表达。此外,当将在ISS上的样本与在地球上的样本相比较时,多个插入序列明显上调。
表6
相较于地面样本,在两组ISS样本中,涉及生长的基因在前三天里上调。在第1天和第3天观察到涉及细胞分裂、翻译起始、ATP合成、CoA合成、脂肪酸合成和蛋白质输出的基因上调,但到第7天时消失(表7)。七天之后,涉及静止期起始的蛋白质和酸应激反应蛋白质上调以处理发酵副产物的毒性积累。此外,在第7天并且直至第30天,所有样本都显示氨基酸分解代解基因的表达增加。当将地面样本与ISS样本相比较时,ISS样本中din、ppk和umu基因上调,这些基因编码易错DNA聚合酶系统和其调控因子(图11、表7)。相较于地面样本,ISS培养物中有关氨基酸转运和分解代解的ast基因的表达减少(表7)。由于这是在静止期生长延长下的主要代谢模式,故这将指示代谢速率降低,但突变率增加。ISS样本中Cas1-3系统的表达相较于地面样本增加也证实了这一点(表7)。
表7:太空飞行诱导的基因失调
5.讨论
在ISS上的早期时间点,ATP合成酶、泛酸激酶、涉及细胞内陷和Z环形成的基因的转录增加。这指示在ISS上的样本中细胞分裂和养分循环速率增加,与先前观察到的趋势一致。当将在ISS上的早期时间点与在地面上的这些时间点相比较时,辛酸的生产上调。脂肪酸生物合成也上调,由此可能增强脂酰基-蛋白质或脂酰基-多糖的生产。这将与所报导的暴露于太空飞行的大肠杆菌培养物中细胞包膜体积增加一致。在前72小时生长中的生长速率增加具有特殊意义。这一时间范围对应于在经过工程改造的培养物在前三天生长中异丁烯的最高生产速率(线性生产速率直至48小时)以及M3K和MVD转录物丰度的最高水平。这些因素证实了在微重力条件下指数生长期间增加异丁烯生产的可能性。不幸的是,由于运输重量的限制,太空飞行对异丁烯生产的影响未能得到研究,但M3K和MVD的增加的生长速率、代谢过程和高转录水平的证据将指示异丁烯生产速率可升高。
为了确定太空飞行暴露是否会对M3K和MVD的表达造成影响,在ISS上进行的30天实验的过程中,将转录物的丰度映射至这些蛋白质中的每一种。一个主要差异出现在ISS与地面样本之间。在早期时间点,地面和ISS样本上映射至M3K和MVD的转录物的丰度类似,都在总映射读段的1.9%至2.2%之间。然而,在地球上生长的培养物种,转录物丰度在第3天之后没有降低。对于地面培养物,在后续时间点时,M3K和MVD转录物比对率仍>2.0%,其中在ISS上,M3K和MVD丰度下降到1.0%以下。M3K和MVD处于组成型表达,由此提出了一个问题,即,这些基因的转录物丰度为什么会随时间变化,以及为什么它仅在某些条件下发生?关于这一问题的一个解释可以是在第14天和第30天,当与地面样本相比较时,ISS样本中代谢基因的表达水平降低。这也可以部分地通过在ISS上培养物所采取的基因沉默措施来解释。将比较地面与ISS培养物时,在第3天之后,在ISS上的II型和I-e型系统上调。I-e型级联系统是敲减宿主内部的外来转录物的RNA干扰系统。这一干扰RNA的表达增加可以解释在第3天之后于ISS上生长的培养物中观察到的M3K和MVD的转录物丰度降低。
当将来自地面与来自ISS的第1天样本相比较时,ISS样本中的一般应激反应基因rpoS和osmY以及gadABCDE基因上调。在第1天,冷休克反应基因cspABEF相较于地面样本也有明显上调。有趣的是,在第1天,热休克反应基因hslJORUV的转录也相较于地面和稍后的ISS样本增加。一般应激反应基因的转录大部分在第3天时消失(当与经历冷冻的地面样本相比较时)并且当将所有后续ISS时间点与第1天相比较时,在第1天也是最强的。当将第3天ISS样本与在24小时的时候未冷冻的地面样本相比较时,一般应激反应仍降低,但csp基因的表达较高。第1天培养物中热休克和冷休克反应的这种表达指示,第1天培养物存在不止一个应激源。在运送之前,将样本在-80℃冷冻,并且它们在运送期间可能会经历部分解冻和再冷冻。这种冷冻-解冻循环将诱导一般SOS反应系统的应激反应以及冷休克适应,以增加膜流动性。促成应激反应的高表达的第二个因素可能来自于在火箭发射期间增加的压力。先前在大肠杆菌中进行的研究显示,当暴露于高压时,热休克和冷休克基因以及SOS反应基因的表达增加。然而,值得注意的是,大肠杆菌已被证实在高达吉帕斯卡压力(gigapascal pressures)下仍具有活性并存活,而这些压力远高于培养物所能经历的任何压力。这将指示,尽管压力增加可能诱导应激反应,但它不应降低培养物的活力。最后,在高辐射环境中培养运送培养物之后,与地面对照相比较,这也会诱导SOS基因的表达。观察到应激反应系统的表达将有助于缓解这些不同的应激物,例如热休克蛋白、伴侣蛋白、聚合酶,这些应激物都指示在第1天培养物中存在若干组分一起诱导极强的应激反应。
在第3天之后,负责将赖氨酸转化成尸胺以处理混合酸发酵副产物的cad基因上调。从第3天起,涉及聚胺代谢的基因上调,聚胺代谢主要利用亚精胺和腐胺循环。这些基因吸收精氨酸并将其转化成胍丁胺,接着将胍丁胺转化成腐胺,接着转化成亚精胺,并进行亚精胺的输出/分解代解。这种聚胺生物合成和中和看起来可用于对照酸应激,而不是将谷氨酸转化成GABA,因为在第1天之后的所有时间点,gad基因均下调。GABA的生产最可能通过聚胺代谢进行。在第3天之后聚胺代谢上调最可能是由于随着培养物老化,需要中和培养基中由濒死细胞裂解产生的大量氨基酸所引起的氮毒性。
一周之后,有证据表明,鼠李糖吸收可能因来自裂解的细胞的细胞多糖降解而增加。有证据表明,涉及针对低pH值的各种反应的基因的表达增加。草酸分解代解上调将活化酸耐受性反应(ATR),并且用于胶囊生产的结肠酸的产生增加也将增加对低pH值的耐受性。当培养物到达后期生长阶段时,编码涉及脂肪酸降解和单羧酸吸收以及如丝氨酸、赖氨酸、精氨酸和苏氨酸等一些特定氨基酸的基因的转录物的表达增加。从涉及葡萄糖和混合酸发酵副产物代谢的基因的表达到脂肪酸和氨基酸分解代解的变化指示,培养物已达到在延长的静止期培养物中所发现的高细胞周转率。处于这一生长阶段的培养物已耗尽所供应的初始养分,并且正在降解死亡细胞以提供养分。
从第3天起,将甘油转化成糖酵解中间体甘油酮磷酸(DHAP)的glp基因上调。在葡萄糖饥饿情况下,大肠杆菌中表达甲基乙二醛路径作为Embden-Meyerhof-Parnas(EMP路径)的低能旁路。并无有力证据证实培养物中甲基乙二醛合酶基因伴随上调。DHAP将经甲基乙二醛转化成丙酮酸,但并无明确的mgsA表达模式。这可能是由甲基乙二醛的高毒性引起。其他研究人员已显示,细胞中甲基乙二醛合酶的水平无法通过转录物丰度准确地反映。此外,当比较地面与ISS样本时,涉及后期乙醛酸循环的基因,如aceBK在稍后时间上调。综合这些信息,可能的情形是,细胞使用甲基乙二醛循环分解代谢G3P和PEP,同时从细胞排出乙酸。
当将在ISS上的培养物与地面培养物相比较时,易错聚合酶、重组蛋白和插入序列上调。增加突变率的基因的表达增加在7天后的时间点中最高。这与先前报导的在生长较长时间段的培养物中产生的赋予静止期生长优势(GASP)的突变型表型相符。GASP表型定义为突变型培养物胜过相同亲本菌株的非突变型培养物的能力;即,如果将生长10+天的细胞引入含相同菌株的未老化细胞的共培养物中,则在7-10天之后,只有先前老化的细胞会保留下来。这一表型是由对环境无生理反应的基因变化所编码;通过将突变引入赋予原生细胞GASP表型的未老化细胞群中,证实了这一点。赋予GASP表型的四种突变已经得到阐明,并且是rpoS(替代性σ因子)、lrp(亮氨酸反应性蛋白质)和gltIJKL簇(谷氨酸和天冬氨酸转运)突变。所有这些突变都使得分解至少一个氨基酸作为主要能源的能力增加。长期生长培养物中涉及氨基酸吸收和分解代解的基因的表达增加证实了培养物中存在GASP突变体的可能性。由于环境中可获得的碳是来自其它细胞的裂解,故氨基酸代谢对于延长的静止期培养物变得至关重要。经显示,蛋白质在大肠杆菌中占细胞干质量的高达55%。这意味着在细胞死亡期之后,蛋白质或肽将构成环境中可用碳的很大一部分。在第14天及之后,培养物种涉及二肽和氨基酸转运和分解代解的基因的表达增加指示,这是在延长的静止期间培养物中的主要代谢。
然而,转录组数据中存在一些混淆的结果。后续培养物中并未一致地检测到σ因子表达的变化。这可能是由于在组装初级测序文件时,这些σ因子的突变使mRNA转录物不能与参考基因组进行适当地比对。如果在这些基因中存在indels,但它们仍具有功能性,则这一mRNA的测序将由于大量空位或错配罚分而产生无法组装成较大骨架的片段。保持功能性的基因的突变可能导致对这些基因的表达的低估。IS插入的突变率较高,每代每个基因组有约3.5×10
E.方法:
以下描述整个所描述实例中使用的方法。
1.生长条件和培养基
所有质粒固化和克隆都是用大肠杆菌DH5α进行的,并且所有重组和异丁烯生产都是在大肠杆菌K12-MG1655中进行的。在振荡下,在37℃下,使生长用于质粒固化的所有培养物在补充有0.5%v/v酵母提取物(YE)和适当抗生素的胰蛋白酶大豆肉汤(TSB)中生长,但携带pCas的大肠杆菌DH5α除外,它是在30℃生长的。在振荡下,在37℃下使生长用于顶部空间分析的培养物在补充有1%v/v废水或0.5%w/v葡萄糖的MOPS基本培养基上生长24小时。
2.质粒构建、PCR和克隆
本研究中使用的所有引物列于表8中。根据生产商的方案,所有质粒提取都是使用Thermo Scientifics'GeneJet Plasmid Miniprep试剂盒进行的。质粒pCas(Addgene#62225)、pSS9(Addgene#71655)、SS9_RNA(Addgene#71656)和pTargetF(Addgene#62226)是购买的或是从Ryan Gill博士的实验室获得的礼物。pCas含有阿拉伯糖诱导型表达的λred重组酶基因exo、bet和gam,以及组成型表达的Cas9。pSS9含有600bp同源臂(H1、H2),所述同源臂匹配大肠杆菌染色体的基因间区域,所述大肠杆菌染色体在H1内的原间隔子中含有突变。通过将对应基因克隆至具有安比西林(ampicillin)抗性的Puc57主链中来构建MVD和M3K质粒。利用Gibson克隆,通过去除GFP并将M3K和MVD插入pSS9中同源臂H1与H2之间来构建新颖质粒pSS9-3KD。通过用BglII和XhoI限制消化,将含有侧接同源区的M3K和MVD的线性片段切除,并通过凝胶电泳纯化。使用这一片段进行重组实验并使用GoTac DNA聚合酶,在以下用作转化株DNA的条件下进行PCR扩增:在95℃热启动10分钟,随后是30个循环的95℃保持30秒,51℃保持30秒,72℃保持2.5分钟以及在72℃最终延伸5分钟。
表8:用于转化和测序的引物
3.λRed介导的重组
通过用Bio-Rad MicroPulser电穿孔,利用pCas转化大肠杆菌K12-MG1655。在30℃下,使转化的菌株在含卡那霉素(kanamycin)的250mL TSB中生长至OD600~0.4-0.6,此时,通过添加10mM L-阿拉伯糖诱导λred重组酶的表达。在诱导之后,使样本在30℃再生长两小时,并通过电穿孔,用SS9_RNA质粒和PCR扩增的线性片段共转化。在振荡下,使转化株在37℃LB中恢复八小时,接着将其平板接种于LB+四环素和卡那霉素上。从菌落选择转化株并使其在37℃生长过夜以使pCas固化,并通过用GC-MS检测培养物顶部空间中的异丁烯来证实成功基因整合。
4.废水样本制备
2018年9月,在位于阿拉斯加州安克雷奇(Anchorage,AK)的JohnAsplundM.Asplund废水处理设施,通过从二级流出物储罐泵送流出物来获取废水样本(2L)。通过巴氏灭菌(80℃下3小时),随后冷却(冷却至室温)、冷冻(-20℃)和解冻的异温序列来对废水样本灭菌。将所述序列进行四次,总计在80℃加热12小时,并进行四次冷冻-解冻循环。因为经显示,高压灭菌会明显改变废水的非生物特性,所以进行巴氏灭菌代替高压灭菌。将子样本(50mL)均质化以分解较大的颗粒物质(珠粒串珠;5分钟×5),将其以10mL/L(1%v/v)添加至MOPS基本培养基中并在4℃储存。
5.异丁烯的检测和定量
异丁烯的所有检测和定量是通过气相色谱法进行的。使所有样本在20mL Restek顶部空间小瓶中生长并使用与带有Restek Rxi 624sil-ms 30m×0.25mm ID×1.4μm dF柱的Agilent 6890N GC-FID联接的顶空自动进样器进行加工。分析标准品是由异丁烯的参考标准品(AirLiquide)稀释得到。在200RPM振荡下,在37℃下使样本在补充有50mM 3-HIV的3.9mL的MOPS基本培养基+1%废水中生长。在振荡(220rpm)下,在37℃下使重组大肠杆菌的过夜培养物在TSB+0.5%YE中生长。使培养物沉淀(5,000×g),去除上清液,并通过涡旋使细胞再悬浮于5uL不含核酸酶的H
6.溶剂耐受性转录组学
使经过工程改造的大肠杆菌菌株暴露于各种浓度的溶剂以评估溶剂暴露对基因表达的影响。所使用的溶剂如下:丙酮1%v/v、异丁醇1%v/v、3-甲基-1-戊烯0.75%v/v、3-甲基戊烷0.75%v/v、己烷0.75%v/v和环己烯0.5%v/v。异丁烯在室温下是气体,因此,培养基是在密封容器中通过使异丁烯鼓泡穿过TSB培养基持续3分钟来制备,接着,使用该培养基生长培养物。当收集4×10
7.太空飞行转录组学
将样本传送至ISS以确定太空飞行对经过工程改造的菌株的影响。使用5mL通用冷冻管作为生长容器,所述容器中含有4mL MOPS基本培养基+0.5%葡萄糖,或MOPS基本培养基+1%废水。在振荡(220RPM)下,在37℃下使作为接种物的细胞在含有0.5% YE的TSB中生长过夜。以5,000×g使过夜培养物沉淀,去除上清液,通过涡旋使沉淀物再悬浮于10uL过滤灭菌的50%甘油中,并用再悬浮的细胞(100μL)接种各容器。在接种之后,对培养基进行涡旋并在-80℃冷冻以进行运输。一式三份制备样本以使其生长30天时间段。使样本亚群生长1天、3天、7天、14天和30天。制备相应的一组样本并使其在实验室中,在相同条件下生长以用作差异基因表达的对照,由此总计有30个容器(每个时间点2×3个容器)被接种并运送至太空站,并且有30个容器被接种并在实验室中生长。生长条件是25℃,不振荡。所有RNA提取是如上文所描述进行。
8.有关冷冻影响的解读
由于在ISS上存在人为误差,故需要另外的地面样本。在24小时的时间点结束时,从恒温箱中取出在ISS上的所有容器并在-80℃下冷冻。在72小时的时间点结束时,ISS上的研究人员意识到他们的错误,并从冷冻器中取出3、7、14和30天的样本并将其放回恒温箱中以完成培育。为了解释冷冻的影响,如上所陈述,在UAA制备另外两组一式三份的样本,并使其生长24小时。在24小时后,将样本冷冻48小时并放回25℃进行解冻。将一组样本再培育48小时(等效于来自ISS的第3天样本)并使另一组样本再生长29天以与第30天ISS样本相比较。
9.文库制备
遵循Illumina Script-Seq V2 RNA文库制备指南来制备文库,以产生500bp cDNA文库。每个文库具有12个用于多路分用的根据Script-Seq引物(表8)编索引的个别RNA样本。遵循Kappa的文库定量方案,通过qPCR定量汇集的文库。用5%的PhiX掺加物将各溶剂暴露文库稀释至4nM,并且各ISS比较文库使用1%的PhiX掺加物。在Illumina MiSeq上,使用V3 600循环试剂盒对文库进行测序以产生250bp的配对端读段。
10.RNA-Seq分析
将所有fastq文件分选成读段对,然后将其合并为单个fastq文件。使用TRIMMOMATIC,利用长度5的滑动窗和30的质量得分修剪这些文件。文件的最小长度设置成75bp。在针对接头污染或低序列质量进行修剪之后,使用FastQC检查序列。使用Bowtie2建构索引并比对fastq文件。比对是以端到端模式执行的,其中最小质量得分(S)是根据公式3计算,其中“L”是比对的片段的长度。罚分被设置成错配:-6,空位开放:-3,空位扩展:-3。
S=(-0.6)+(-0.6*L) (3)
文件是以未配对读段形式操作,因为它们已被串连成单个读段文件,并使用生成的SAM文件对基因计数并分配基因组坐标。在HTSeq中进行特征计数并通过定义以下集合,将特征分配给各读段:S(i),该集合由读段中位置ⅰ处重叠的特征构成。如果所有集合S(i)的并集仅含有一个项目,则将所述读段分配给所述特征。如果所述并集含有多于一个特征,则读段被指定为不明确的并且不分配为特征的计数。此外,与多个特征比对的任何读段都不被包括在内,并且指定为非唯一比对。施加至特征计数分配的最终约束是10的最小比对质量得分。比对质量得分(Q)是由Bowtie2,通过公式4计算,其中p是所计算的比对未被正确地分配至读段的真正位置的概率的估计。
Q=-10*log10(p) (4)
11.使用DESeq-2进行的差异基因表达分析
将根据HTSeq计数生成的特征计数文件重新格式化,作为根据处理条件(即,溶剂暴露、太空飞行暴露、冷冻和培育时长)分组的DESeqDataSets输入DESeq-2中。将计数矩阵以负二项分布形式拟合至广义线性模型(GLM),其中平均值和离散值是由离散因子的平衡和组内变化的规模因子计算。通过由以上描述的GLM拟合生成最大似然估计值(MLE)来估计倍数变化。接着,将描述对数倍数变化(LFC)的系数拟合到计数表中所有基因内MLE的分布的正态分布(以0为中心)。此处生成的分布用做第二组GLM拟合的先验值,并且最大先验值用做报导的LFC的最终值。对于分析,使用以二为底的对数进行变换,因此,将值报告为Log2倍数变化(L2FC)。这一估计LFC的方法有助于校正错误检测为强相互作用的低表达基因中的大绝对LFC值。这一最终分布也被用于计算有关差异表达的Walds测试中使用的标准误差。在Walds测试中,用LFC估计值除以其标准误差项。这一计算产生z统计量,将其再与正态分布相比较。接着,基于估计错误发现率(FDR),使由这一测试产生的P值通过独立过滤程序。接着,通过Benjamini和Hochberg的多重测试方法调整通过这一过滤器的基因。
12.表达网络
使用Cytoscape,由转录组数据生成表达网络。将基因表上传并使用GeneOntologyResource(GO)对本体功能进行注释。对于差异表达数据集,在经过调整的p值<0.05下,过滤上传的基因,接着在p值是0.01下,过滤所生成的网络。接着,为便于解释,根据log2倍数变化的强度以颜色编码基因。
F.结论
总体而言,经过工程改造的大肠杆菌菌株可以通过在组成型表达下,由中心染色体表达M3K和MVD来产生异丁烯。在暴露于溶剂应激后,存在热休克基因(ibpAB、hslJOR和clpABP)表达增加的保守反应以帮助保护和修复蛋白质损伤。编码伴侣蛋白groELS和dnaJK的基因的表达也升高,这些基因在以上所提到的过程中起支持作用。对于两种最相关的溶剂丙酮和异丁烯,在溶剂暴露之后,编码将谷氨酸转化为GABA以处理过量细胞内质子的酶gad基因的表达增加,但对于所有其它溶剂,所述基因的表达减少。此外,对于几乎所有溶剂处理,涉及将精氨酸转化成胍丁胺以处理低pH值的adiACY基因下调。然而,当与30天ISS培养物的长期应激反应相比较时,生长超过14天的培养物中ibpAB和adiAC基因上调,但clpABP和gadABCDE下调。这表明,由异丁烯生产引起的溶剂应激可能不像由次级代谢物积累引起的环境应激的影响那么强。由于长期生长样本中谷氨酸转化下调,而在暴露于高浓度异丁烯的培养物中上调,故可能改善培养物的耐受性以向培养基中补充另外谷氨酸。总体来说,本研究使得设计出由低成本原料产生异丁烯的生产菌株。本研究还阐明了根据经过工程改造的菌株中各种应激反应的转录组测序进行基因优化的若干途径。
本领域技术人员将认识到或能够使用不超过例行实验确定本文所述方法和组合物的具体实施例的许多等价物。这些等价物旨在由下述权利要求涵盖。
参考文献
1.Gourmelon G.,全球塑料生产增多,循环滞后(Global Plastic ProductionRises,Recycling Lags.):7。
2.Geyer R,Jambeck JR,Law KL.,所有塑料的生产、使用和归宿(Production,use,and fate of all plastics ever made.),《科学-进展(Science Advances.)》,2017;3:e1700782。
3.Narancic T,O'Connor KE.,解决塑料废弃物灾难的微生物生物技术(Microbial biotechnology addressing the plastic waste disaster.),《微生物生物技术(Microbial Biotechnology.)》,2017;10:1232-5。
4.Szklo A,Schaeffer R.,炼油厂的燃料规格、能量消耗和CO2排放(Fuelspecification,energy consumption and CO2 emission in oil refineries.),《能量(Energy.)》,2007;32:1075-92。
5.Centi G,Quadrelli EA,Perathoner S.,有关CO2转化的催化:在化学行业价值链中快速引入可再生能量的关键技术(Catalysis for CO2 conversion:a keytechnology for rapid introduction of renewable energy in the value chain ofchemical industries.),《能量与环境科学(Energy and Environmental Science.)》,2010;4:1166-9。
6.Schietekat C,Cauwenberge D,Van Geem K,Marin G.,基于计算流体动力学设计板翅式蒸汽裂化反应器(Computational Fluid Dynamics-Based Design of FinnedSteam Cracking Reactors.),《美国化学工程师学会(American Institute of ChemicalEngineers.)》2013;7:405-10。
7.Davis SJ,Caldeira K,Matthews HD.,由现有能量基础设施引起的未来CO2排放和气候变化(Future CO2 Emissions and Climate Change from Existing EnergyInfrastructure.),2010;5317。
8.Van Leeuwen BNM,Van Der Wulp AM,Duijnstee I,Van Maris AJA,StraathofAJJ.,异丁烯的发酵生产(Fermentative production of isobutene.),《应用微生物学与生物技术(Applied Microbiology and Biotechnology.)》,2012;93:1377-87。
9.Lynch S,Eckert C,Yu J,Gill R,Maness P-C.,克服底物限制以改良大肠杆菌中乙烯的生产(Overcoming substrate limitations for improved production ofethylene in E.coli.),《生物燃料技术(Biotechnology for Biofuels.)》BioMedCentral;2016;9:1-10。
10.Guo M,Song W,Buhain J.,生物能源与生物燃料:历史、现状和展望(Bioenergy and biofuels:History,status,and perspective.),《可再生与可持续能源评论(Renewable and Sustainable Energy Reviews.)》,2015;42:712-25。
11.Campbell-Platt G.,世界发酵食品展望(Fermented foods-a worldperspective.)《国际食品研究(Food Research International.)》1994;27:253-7。
12.Ladygina N,Dedyukhina EG,Vainshtein MB.,关于烃类的微生物合成的评论(A review on microbial synthesis of hydrocarbons.),《过程生物化学(ProcessBiochemistry.)》2006;41:1001-1014。
13.Antoni D,Zverlov VV,Schwarz WH.,来自微生物的生物燃料(Biofuels frommicrobes.),《应用微生物学与生物技术(Appl Microbiol Biotechnol.)》,2007;77:23-35。
14.Hawkins AB,Lian H,Zeldes BM,Loder AJ,Lipscomb GL,Schut GJ等人,工程改造成基于CO2生产3-羟基丙酸的激烈火球菌菌株的生物处理分析(Bioprocessinganalysis of Pyrococcus furiosus strains engineered for CO2-based 3-hydroxypropionate production.),《生物技术与生物工程(Biotechnology andBioengineering.)》,2015;112:1533-43。
15.Liu L,Zhu Y,Li J,Wang M,Lee P,Du G等人,由丙酸杆菌进行丙酸的微生物生产:现状、挑战和展望(Microbial production of propionic acid frompropionibacteria:Current state,challenges and perspectives.),《生物技术评论(Critical Reviews in Biotechnology.)》,2012;32:374-81。
16.Saxena RK,Anand P,Saran S,Isar J,Agarwal L.,1,2-丙二醇的微生物生产和应用(Microbial production and applications of 1,2-propanediol.),《印度微生物学杂志(Indian J Microbiol.)》,2010;50:2-11。
17.Edwards MC,Henriksen ED,Yomano LP,Gardner BC,Sharma LN,Ingram LO等人,在大肠杆菌中添加用于纤维二糖酶和分解果胶活性的基因以由富含果胶的木质纤维素生物质生产燃料乙醇(Addition of Genes for Cellobiase and Pectinolytic Activityin Escherichia coli for Fuel Ethanol Production from Pectin-RichLignocellulosic Biomass.),《应用与环境微生物学(Appl Environ Microbiol.)》,2011;77:5184-91。
18.Choi YJ,Lee SY.,短链烷烃的微生物生产(Microbial production ofshort-chain alkanes.)《自然(Nature)》.2013;502:571-4。
19.Schirmer A,Rude MA,Li X,Popova E,Cardayre SB del.,烷烃的微生物生物合成(Microbial Biosynthesis of Alkanes.),《科学(Science)》,2010;329:559-62。
20.Lynch S,Eckert C,Yu J,Gill R,Maness P-C.,克服底物限制以改良大肠杆菌中乙烯的生产,《生物燃料技术》,2016;9:1-10。
21.Wilson J,Gering S,Pinard J,Lucas R,Briggs BR.,气体烯烃的生物生产:乙烯、异戊二烯、异丁烯(Bio-production of gaseous alkenes:ethylene,isoprene,isobutene.),《生物燃料技术》,2018;11:234。
22.Nagahama K,Ogawa T,Fujii T,Fukuda H.,针对乙烯的生物合成路径对乙烯生产细菌分类(Classification of ethylene-producing bacteria in terms ofbiosynthetic pathways to ethylene.),《发酵与生物工程杂志(Journal ofFermentation and Bioengineering.)》,1992;73:1-5。
23.Van Leeuwen BNM,Van Der Wulp AM,Duijnstee I,Van Maris AJA,Straathof AJJ.,异丁烯的发酵生产(Fermentative production of isobutene.),《应用微生物学与生物技术》,2012;93:1377-1387。
24.Gogerty DS,Bobik TA.,由3-羟基-3-丁酸甲酯经二磷酸甲羟戊酸脱羧酶形成异丁烯(Formation of isobutene from 3-hydroxy-3-methylbutyrate bydiphosphomevalonate decarboxylase.),《应用与环境微生物学》,2010;76:8004-8010。
25.Alvarez TM,Paiva JH,Ruiz DM,Cairo JPLF,Pereira IO,Paix??o DAA等人,来自甘蔗土壤宏基因组的新颖纤维素酶5的结构和功能(Structure and function of anovel cellulase 5from sugarcane soil metagenome.),《公共科学图书馆·综合(PLoSOne)》,2013;8:1-9。
26.Alvarez TM,Goldbeck R,dos Santos CR,Paix??o DAA,Gon??alves TA,Franco Cairo JPL等人,从甘蔗土壤宏基因组鉴别的新颖内切木聚糖酶家族GH10的开发和生物技术应用(Development and Biotechnological Application of a NovelEndoxylanase Family GH10 Identified from Sugarcane Soil Metagenome.),《公共科学图书馆·综合》,2013;8。
27.Buermans HPJ,Den Dunnen JT.,下一代测序技术:发展与应用(Nextgeneration sequencing technology:Advances and applications.),《生物化学与生物物理学报(Biochimica et Biophysica Acta.)》,2014;1842:1932-1941。
28.Bentley FK,Melis A.,光合微生物在气相/水相两相光生物反应器中吸收二氧化碳和放出异戊二烯的扩散过程(Diffusion-based process for carbon dioxideuptake and isoprene emission in gaseous/aqueous two-phase photobioreactors byphotosynthetic microorganisms.),《生物技术与生物工程》,2012;
29.Johnson E.,新生物燃料登场:生物丙烷(New Biofuel debut:biopropane.)《生物燃料、生物产品与生物精炼(Biofuels,Bioproducts and Biorefining.)》,2012;6:246-56。
30.Guo X,Liu J,Xiao B.,由单室无膜微生物电解池中污水污泥厌氧消化生产氢和甲烷的生物电化学增强(Bioelectrochemical enhancement of hydrogen and methaneproduction from the anaerobic digestion of sewage sludge in single-chambermembrane-free microbial electrolysis cells.),《国际氢能杂志(InternationalJournal of Hydrogen Energy.)》,Elsevier Ltd;2013;38:1342-7。
31.Reisch CR,Prather KLJ.,用于大肠杆菌中基因组编辑的no-SCAR(无痕Cas9辅助重组工程)系统(The no-SCAR(Scarless Cas9 Assisted Recombineering)systemfor genome editing in Escherichia coli.),《科学报告(Scientific reports)》,Nature Publishing Group;2015;5:15096。
32.Bassalo MC,Garst AD,Halweg-Edwards AL,Grau WC,Domaille DW,MutalikVK等人,大肠杆菌中快速且高效的单步代谢路径整合(Rapid and Efficient One-StepMetabolic Pathway Integration in E.coli.),《ACS合成生物学(ACS SyntheticBiology)》,2016;acssynbio.5b00187。
33.Steen EJ,Kang Y,Bokinsky G,Hu Z,Schirmer A,McClure A等人,由植物生物质进行脂肪酸衍生燃料和化学品的微生物生产(Microbial production of fatty-acid-derived fuels and chemicals from plant biomass.),《自然》,NaturePublishing Group;2010;463:559-62。
34.Zhang F,Rodriguez S,Keasling JD.,用于高级生物燃料生产的微生物路径的代谢工程(Metabolic engineering of microbial pathways for advanced biofuelsproduction.),《生物技术新见(Current Opinion in Biotechnology)》,Elsevier Ltd;2011;22:775-83。
35.Gerbrandt K,Chu PL,Simmonds A,Mullins KA,MacLean HL,Griffin WM等人,木质纤维素乙醇的生命周期评估:影响计算的GHG排放量和能量使用的关键因素和方法的评述(Life cycle assessment of lignocellulosic ethanol:A review of keyfactors and methods affecting calculated GHG emissions and energy use.),《生物技术新见》,Elsevier Ltd;2016;38:63-70。
36.Popp J,Lakner Z,Harangi-Rákos M,Fári M.,生物能源扩张的作用:粮食、能源和环境(The effect of bioenergy expansion:Food,energy,and environment.),《可再生与可持续能源评论》,2014;32:559-78。
37.Podola B,Li T,Melkonian M.,多孔基材生物反应器:微藻生物技术的范式转换?(Porous Substrate Bioreactors:A Paradigm Shift in MicroalgalBiotechnology?)《生物技术趋势(Trends in Biotechnology.)》,2017;35:121-132。
38.Liu B,Benning C.,与众不同的微藻脂质代谢(Lipid metabolism inmicroalgae distinguishes itself.),《生物技术新见》,2013;24:300-309。
39.Converti A,Casazza AA,Ortiz EY,Perego P,Del Borghi M.,温度和氮浓度对用于生物柴油生产的眼点拟微绿球藻和普通小球藻的生长和脂质含量的影响(Effectof temperature and nitrogen concentration on the growth and lipid content ofNannochloropsis oculata and Chlorella vulgaris for biodiesel production.),《化学工程与加工:工艺强化(Chemical Engineering and Processing:ProcessIntensification.)》,2009;48:1146-1151。
40.Sun X-M,Ren L-J,Zhao Q-Y,Ji X-J,Huang H.,用于生产脂质和类胡萝卜素的微藻:重点关注压力调节和适应的评述(Microalgae for the production of lipidand carotenoids:a review with focus on stress regulation and adaptation.),《生物燃料技术》,2018;11:272。
41.Olkiewicz M,Torres CM,Jim??nez L,Font J,Bengoa C.,有关由城市初沉污水污泥生产生物柴油的规模放大和经济分析(Scale-up and economic analysis ofbiodiesel production from municipal primary sewage sludge.),《生物资源技术(Bioresource Technology.)》,2016;214:122-131。
42.Ditzig J,Liu H,Logan BE.,使用生物电化学辅助微生物反应器(BEAMR)由家庭废水生产氢气(Production of hydrogen from domestic wastewater using abioelectrochemically assisted microbial reactor(BEAMR).),《国际氢能杂志》,2007;32:2296-304。
43.De Clercq D,Wen Z,Fan F,Caicedo L.,大城市餐厅食物垃圾生产生物甲烷的潜力和项目级瓶颈:北京案例研究(Biomethane production potential fromrestaurant food waste in megacities and project level-bottlenecks:A casestudy in Beijing.),《可再生与可持续能源评论》,2016;59:1676-1685。
44.Wagner RC,Regan JM,Oh S-E,Zuo Y,Logan BE.,使用微生物电解池由猪废水生产氢气和甲烷(Hydrogen and methane production from swine wastewater usingmicrobial electrolysis cells.),《水研究(Water Research.)》,2009;43:1480-8。
45.Ogejo JA,Li L.,用火鸡加工废水提高冲洗的乳制品粪便的生物甲烷产量(Enhancing biomethane production from flush dairy manure with turkeyprocessing wastewater.)《应用能源(Applied Energy.)》,2010;87:3171-7。
46.Woertz I,Feffer A,Lundquist T,Nelson Y.,用于同时去除养分和生产生物燃料原料用脂质的在乳制品和城市废水中生长的藻类(Algae Grown on Dairy andMunicipal Wastewater for Simultaneous Nutrient Removal and Lipid Productionfor Biofuel Feedstock.)《环境工程杂志(Journal of Environmental Engineering.)》,2009;135:1115-1122。
47.Olkiewicz M,Plechkova NV,Fabregat A,Stüber F,Fortuny A,Font J等人,使用离子液体从初沉污水污泥高效提取脂质用于生物柴油生产[互联网](Efficientextraction of lipids from primary sewage sludge using ionic liquids forbiodiesel production[Internet].),Elsevier B.V.;2015.网址:http://dx.doi.org/10.1016/j.seppur.2015.08.038
48.Ward A,Ball A,Lewis D.,作为厌氧消化的原料的盐生微藻(Halophyticmicroalgae as a feedstock for anaerobic digestion.),《藻类研究(AlgalResearch.)》,2015;7:16-23。
49.Huffer S,Roche CM,Blanch HW,Clark DS.,用于生物燃料生产的大肠杆菌:弥合承诺与实践之间的差距(Escherichia coli for biofuel production:Bridging thegap from promise to practice.)《生物技术趋势》,Elsevier Ltd;2012;30:538-45。
50.Beasley JE,Planes FJ,Rezola A,Pey J,Tobalina L.,基于网络的代谢路径分析和基因表达数据整合的进展(Advances in network-based metabolic pathwayanalysis and gene expression data integration.),2014;16。
51.Lee S,J.Mitchell R.,使用转录组学推进生物燃料的观点(Perspectives onthe use of transcriptomics to advance biofuels.)《AIMS生物工程(AIMSBioengineering.)》,2015;2:487-506。
52.Kleijntjens RH.,《生物反应器(Bioreactors.)》,2000;14:329-47。
53.Wei\s s S,Tauber M,Somitsch W,Meincke R,Müller H,Berg G等人,通过添加固定于活化沸石上的半纤维素分解细菌来提高生物气的产量(Enhancement of biogasproduction by addition of hemicellulolytic bacteria immobilised on activatedzeolite.),《水研究》,2010;44:1970-1980。
54.Granata T.,微藻生产对生物质的依赖性以及与产量和生物燃料生物反应器扩大规模的关系:关于60多年藻类生物反应器数据的统计分析(Dependency ofMicroalgal Production on Biomass and the Relationship to Yield and BioreactorScale-up for Biofuels:a Statistical Analysis of 60+Years of Algal BioreactorData.),《生物能源研究(Bioenergy Research.)》,2016;1-21。
55.Foo JL,Jensen HM,Dahl RH.,使用耐受性工程改造改进大肠杆菌中微生物生物汽油的生产(Improving Microbial Biogasoline Production in Escherichia coliUsing Tolerance Engineering.),2014;5:1-9。
56.Rau MH,Calero P,Lennen RM,Long KS,Nielsen AT.,全基因组大肠杆菌应激反应和改善的对工业相关化学品的耐受性(Genome-wide Escherichia coli stressresponse and improved tolerance towards industrially relevant chemicals.),《微生物细胞工厂(Microbial Cell Factories.)》,2016;15:176。
57.Dunlop MJ,Dossani ZY,Szmidt HL,Chu HC,Lee TS,Keasling JD等人,使用外排泵工程改造微生物生物燃料耐受性和输出(Engineering microbial biofueltolerance and export using efflux pumps.),《分子系统生物学(Mol Syst Biol.)》,2011;7:487。
58.Mukhopadhyay A.,用于生产高级生物燃料和化学品的细菌的耐受性工程改造(Tolerance engineering in bacteria for the production of advanced biofuelsand chemicals.),《微生物学趋势(Trends in Microbiology.)》,2015;23:498-508。
59.Fisher MA,Boyarskiy S,Yamada MR,Kong N,Bauer S,Tullman-Ercek D.,通过工程改造大肠杆菌AcrB外排泵以分泌非天然底物正丁醇来增强对短链醇的耐受性(Enhancing Tolerance to Short-Chain Alcohols by Engineering the Escherichiacoli AcrB Efflux Pump to Secrete the Non-native Substrate n-Butanol.),《ACS合成生物学》,2014;3:30-40。
60.Chen B,Ling H,Chang MW.,用于改善酿酒酵母针对烷烃生物燃料耐受性的转运蛋白工程改造(Transporter engineering for improved tolerance against alkanebiofuels in Saccharomyces cerevisiae.),《生物燃料技术》,2013;6:21。
61.Tomas CA,Welker NE,Papoutsakis ET.,丙酮丁醇梭菌中groESL过表达引起溶剂产生和耐受性增加、代谢延长以及细胞转录程序的变化(Overexpression of groESLin Clostridium acetobutylicum Results in Increased Solvent Production andTolerance,Prolonged Metabolism,and Changes in the Cell's TranscriptionalProgram.),《应用与环境微生物学》,2003;69:4951-65。
62.Fukuda H,Fujii T,Sukita E,Tazaki M,Nagahama S,Ogawa T.,小红酵母中细胞色素P450和P450还原酶催化的异丁烯形成反应的重构:脱羧基及异丁烯形成(Reconstitution of the isobutene-forming reaction catalyzed by cytochromeP450 and P450 reductase from Rhodotorula minuta:decarboxylation with theformation of isobutene.),《生物化学和生物物理研究通讯(Biochem Biophys ResCommun.)》,1994;201:516-22。
63.Fujii T,Ogawa T,Fukuda H.,小红酵母中无细胞异丁烯形成系统的制备(Preparation of a Cell-Free,Isobutene-Forming System from Rhodotorulaminuta.),《应用与环境微生物学》,1988;54:583-4。
64.Allard M,Anissimova M,Marliere P.,由3-甲基巴豆酸生产异丁烯的方法(Methods for producing isobutene from 3-methylcrotonic acid)[互联网].2017[2019年6月8日引用].网址:https://patents.google.com/patent/WO2017085167A2/en
65.Rossoni L,Hall SJ,Eastham G,Licence P,Stephens G.,来自灼热嗜酸古菌的推定的甲羟戊酸二磷酸脱羧酶实际上是有较高异丁烯生物生产潜力的甲羟戊酸-3-激酶(The putative mevalonate diphosphate decarboxylase from Picrophilus torridusis in reality a mevalonate-3-kinase with high potential for bioproduction ofisobutene.),《应用与环境微生物学》,2015;81:2625-34。
66.Kim W,Tengra FK,Young Z,Shong J,Marchand N,Chan HK等人,太空飞行促进铜绿假单胞菌的生物膜形成(Spaceflight Promotes Biofilm Formation byPseudomonas aeruginosa.),《公共科学图书馆·综合》,2013;8:e62437。
67.Arunasri K,Adil M,Charan KV,Suvro C,Reddy SH,Shivaji S.,模拟微重力对大肠杆菌K12 MG1655生长和基因表达的影响(Effect of Simulated Microgravity onE.coli K12 MG1655 Growth and Gene Expression.),《公共科学图书馆·综合》,2013;8:e57860。
68.Aunins TR,Erickson KE,Prasad N,Levy SE,Jones A,Shrestha S等人,太空飞行改良响应于抗生素暴露的大肠杆菌基因表达并揭露氧化应激反应的作用(Spaceflight Modifies Escherichia coli Gene Expression in Response toAntibiotic Exposure and Reveals Role of Oxidative Stress Response.),《微生物学前沿(Front Microbiol)》[互联网].2018[2019年3月10日引用];9.网址:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5865062/
69.Moeller R,Reitz G,Nicholson the PT Wayne L,Horneck G.,暴露于太空和模拟火星条件的细菌孢子的诱变:来自EXPOSE-E太空飞行实验PROTECT的数据(Mutagenesis in Bacterial Spores Exposed to Space and Simulated MartianConditions:Data from the EXPOSE-E Spaceflight Experiment PROTECT.),《天体生物学(Astrobiology.)》,2012;12:457-68。
70.Rabbow E,Horneck G,Rettberg P,Schott J-U,Panitz C,L'Afflitto A等人,EXPOSE,国际空间站上的天体生物暴露设施--从提案到飞行(EXPOSE,anAstrobiological Exposure Facility on the International Space Station-fromProposal to Flight.),《生命起源与生物圈演化(Orig Life Evol Biosph.)》,2009;39:581-98。
71.Janion C.,大肠杆菌中DNA修复和诱变的诱导性SOS反应系统(Inducible SOSResponse System of DNA Repair and Mutagenesis in Escherichia coli.),《国际生物科学杂志(Int J Biol Sci.)》,2008;4:338-44。
72.Little JW,Mount DW.,大肠杆菌的SOS调节系统(The SOS regulatorysystem of Escherichia coli.),《细胞(Cell.)》,1982;29:11-22。
73.Gao H,Liu Z,Zhang L.,模拟微重力和太空飞行中的次级代谢(Secondarymetabolism in simulated microgravity and space flight.),《蛋白质与细胞(ProteinCell.)》,2011;2:858-61。
74.Venkateswaran K,Duc MTL,Horneck G.,受控栖息地中的微生物存在及其对空间条件的抵抗力(Microbial Existence in Controlled Habitats and TheirResistance to Space Conditions.),《微生物与环境(Microbes Environ.)》,2014;ME14032。
75.Zea L,Prasad N,Levy SE,Stodieck L,Jones A,Shrestha S等人,解释太空中细菌行为改变的分子遗传基础(A Molecular Genetic Basis Explaining AlteredBacterial Behavior in Space.),《公共科学图书馆·综合》,2016;11:e0164359。
76.Huang B,Li D-G,Huang Y,Liu C-T.太空飞行和模拟微重力对微生物生长和次级代谢的影响(Effects of spaceflight and simulated microgravity on microbialgrowth and secondary metabolism.),《军事医学研究(Mil Med Res)》[互联网].2018[2019年3月10日引用];5。网址:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5971428/
77.Kim HW,Matin A,Rhee MS.,微重力在不同养分条件下改变大肠杆菌O157:H7ATCC 35150、ATCC 43889和ATCC 43895的生理特征(Microgravity Alters thePhysiological Characteristics of Escherichia coli O157:H7 ATCC 35150,ATCC43889,and ATCC 43895under Different Nutrient Conditions.),《应用与环境微生物学》,2014;80:2270-8。
78.Zea L,Larsen M,Estante F,Qvortrup K,Moeller R,Dias de Oliveira S等人,太空中培养的大肠杆菌所展现的表型变化(Phenotypic Changes Exhibited byE.coli Cultured in Space.),《微生物学前沿》[互联网].2017[2019年5月25日引用];8。网址:https://www.frontiersin.org/articles/10.3389/fmicb.2017.01598/full
79.Phadtare S,Inouye M.,冷休克反应(The Cold Shock Response.)EcoSalPlus[互联网].2008[2019年4月1日引用];3。网址:http://europepmc.org/abstract/med/26443733
80.细菌冷休克反应的最新发展(Recent developments in bacterial cold-shock response.)-PubMed-NCBI[互联网].[2019年4月1日引用]。网址:https://www.ncbi.nlm.nih.gov/pubmed/15119823
81.Rosen R,Buchinger S,
82.Kandror O,DeLeon A,Goldberg AL.,海藻糖合成当大肠杆菌暴露于冷时被诱导且对在低温下存活至关重要(Trehalose synthesis is induced upon exposure ofEscherichia coli to cold and is essential for viability at lowtemperatures.),PNAS.,2002;99:9727-32。
83.Rodriguez-Vargas S,Estruch F,Randez-Gil F.,有关烘焙酵母中冷和冷冻应激的基因表达分析(Gene Expression Analysis of Cold and Freeze Stress inBaker's Yeast.),《应用与环境微生物学》,2002;68:3024-30。
84.Barria C,Malecki M,Arraiano CM.,细菌的冷适应(Bacterial adaptationto cold.),《微生物学(Microbiology.)》,2013;159:2437-43。
85.Jones PH,Prasad D.,灭菌技术对废水特性的影响(The Effect ofSterilization Techniques on Wastewater Properties.),《水污染控制联合会杂志(Journal(Water Pollution Control Federation.)》,1968;40:R477-83。
86.Bolger AM,Lohse M,Usadel B.,Trimmomatic:用于Illumina序列数据的灵活修剪器(Trimmomatic:A flexible trimmer for Illumina sequence data.),《生物信息学》,2014;30:2114-2120。
87.Langmead B,Salzberg SL.,使用Bowtie 2进行快速带空位的读段的比对(Fast gapped-read alignment with Bowtie 2.),《自然方法(Nature Methods.)》,2012;9:357-9。
88.Anders S,Pyl PT,Huber W.,HTSeq—用于处理高通量测序数据的Python框架(HTSeq-a Python framework to work with high-throughput sequencing data.),《生物信息学》,2015;31:166-9。
89.Love MI,Huber W,Anders S.,利用DESeq2对RNA-seq数据的倍数变化和离差的适度估计(Moderated estimation of fold change and dispersion for RNA-seqdata with DESeq2.),《基因组生物学(Genome Biol.)》,2014;15:550。
90.Benjamini Y,Hochberg Y.,控制错误发现率:一种实用而强大的多重测试方法(Controlling the False Discovery Rate:A Practical and Powerful Approach toMultiple Testing.),《皇家统计学会杂志系列B(方法)(Journal of the RoyalStatistical Society Series B(Methodological).)》,1995;57:289-300。
91.Cline M,Smoot M,Cerami E,Kuchinsky A,Landys N,Workman C等人,使用Cytoscape整合生物网络和基因表达数据(Integration of biological networks andgene expression data using Cytoscape.),《自然-实验室指南(Nature protocols)》,2007;2:2366-2382。
92.Ashburner M,Ball CA,Blake JA,Botstein D,Butler H,Cherry JM等人,基因本体论:统一生物学的工具(Gene Ontology:tool for the unification ofbiology.),《自然-遗传学(Nat Genet.)》,2000;25:25-9。
93.基因本体论资源:20年且持续强大(The Gene Ontology Resource:20yearsand still GOing strong.),《核酸研究(Nucleic Acids Res.)》,2019;47:D330-8。
94.Atsumi S,Wu T-Y,Machado IMP,Huang W-C,Chen P-Y,Pellegrini M等人,大肠杆菌中的进化、基因组分析和异丁醇耐受性的重建(Evolution,genomic analysis,andreconstruction of isobutanol tolerance in Escherichia coli.),《分子系统生物学(Molecular Systems Biology)》[互联网].2010[2019年3月7日引用];6。网址:http://msb.embopress.org/cgi/doi/10.1038/msb.2010.98
95.Fraley CD,Kim JH,McCann MP,Matin A.,大肠杆菌饥饿基因cstC参与氨基酸分解代解(The Escherichia coli Starvation GenecstC Is Involved in Amino AcidCatabolism.),《细菌学杂志(Journal of Bacteriology.)》,1998;180:4287-90。
96.Baquero F,Martínez J-L,Cantón R.,抗生素和在水环境中的抗生素抗性(Antibiotics and antibiotic resistance in water environments.),《生物技术新见》,2008;19:260-5。
97.Rizzo L,Manaia C,Merlin C,Schwartz T,Dagot C,Ploy MC等人,城市污水处理厂是抗生素抗性细菌和基因扩散至环境中的热点:评述(Urban wastewatertreatment plants as hotspots for antibiotic resistant bacteria and genesspread into the environment:A review.),《整体环境科学(Science of The TotalEnvironment.)》,2013;447:345-60。
98.Basen M,Sun J,Adams MWW.,工程改造极端嗜热性古菌用于温度相关产物形成(Engineering a Hyperthermophilic Archaeon for Temperature-Dependent ProductFormation.)Giovannoni SJ编辑,mBio[互联网].2012[2019年3月21日引用];3。网址:https://mbio.asm.org/lookup/doi/10.1128/mBio.00053-12
99.Nguyen TAD,Han SJ,Kim JP,Kim MS,Sim SJ.,在N2充气条件下极端嗜热真杆菌新阿波罗栖热袍菌的氢生产(Hydrogen production of the hyperthermophiliceubacterium,Thermotoga neapolitana under N2 sparging condition.),《生物资源技术(Bioresource Technology.)》,2010。
100.Zeldes BM,Keller MW,Loder AJ,Straub CT,Adams MWW,Kelly RM.,极端嗜热微生物作为生产燃料和工业化学品的代谢工程改造平台(Extremely thermophilicmicroorganisms as metabolic engineering platforms for production of fuels andindustrial chemicals.),《微生物学前沿》[互联网].2015[2019年3月21日引用];6。网址:https://www.frontiersin.org/articles/10.3389/fmicb.2015.01209/full
101.Lipscomb GL.,乙酰辅酶A合成酶I和II缺失会增加代谢工程改造的超嗜热激烈火球菌的3-羟基丙酸生产(Deletion of acetyl-CoA synthetases I and IIincreases production of 3-hydroxypropionate by the metabolically-engineeredhyperthermophile Pyrococcus furiosus),Elsevier Enhanced Reader[互联网].[2019年3月21日引用]。网址:https://reader.elsevier.com/reader/sd/pii/S1096717613001316?token=A3648545F2174A7085FD2258A38F713292A9D0D264EC1470069D78E7D4D5DD5CC46E3380285148C3DCF12DE8767DF339
102.Schut GJ,Nixon WJ,Lipscomb GL,Scott RA,Adams M.,有关极端嗜热古菌激烈火球菌中参与氢代谢的酶的突变分析(Mutational Analyses of the EnzymesInvolved in the Metabolism of Hydrogen by the Hyperthermophilic ArchaeonPyrococcus furiosus.)《微生物学前沿》[互联网].2012[2019年3月21日引用];3。网址:https://www.frontiersin.org/articles/10.3389/fmicb.2012.00163/full
103.Zeldes BM,Keller MW,Loder AJ,Straub CT,Adams MWW,Kelly RM.,极端嗜热微生物作为生产燃料和工业化学品的代谢工程改造平台,《微生物学前沿》[互联网].2015[2019年3月21日引用];6。网址:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4633485/
104.Angelov A,Fütterer O,Valerius O,Braus GH,Liebl W.,来自极端嗜热嗜酸菌灼热嗜酸古菌的重组葡萄糖/半乳糖脱氢酶的特性(Properties of the recombinantglucose/galactose dehydrogenase from the extreme thermoacidophile,Picrophilustorridus.)《FEBS杂志(The FEBS Journal.)》,2005;272:1054-62。
105.Fütterer O,Angelov A,Liesegang H,Gottschalk G,Schleper C,SchepersB等人,灼热嗜酸古菌的基因组序列及其在约pH 0下的寿命影响(Genome sequence ofPicrophilus torridus and its implications for life around pH 0.)《美国国家科学院院刊(Proceedings of the National Academy of Sciences.)》,2004;101:9091-6。
106.Brynildsen MP,Liao JC.,集成网络方法鉴别大肠杆菌的异丁醇反应网络(An integrated network approach identifies the isobutanol response network ofEscherichia coli.)《分子系统生物学(Molecular Systems Biology.)》,2009;5:277。
107.Reyes LH,Almario MP,Kao KC.,基因组文库筛选大肠杆菌中涉及正丁醇耐受性的基因(Genomic library screens for genes involved in n-butanol tolerancein Escherichia coli.)《公共科学图书馆·综合》,2011;6:e17678。
108.Cornet M,Rogiers V.,2-甲基丙烯(异丁烯)的代谢和毒性—评述(Metabolism and toxicity of 2-methylpropene(isobutene)-A review.)《毒理学评论(Critical Reviews in Toxicology.)》,1997;27:223-232。
109.Pubchem.,《异丁烯(Isobutene)》[互联网].[2019年3月10日引用]。网址:https://pubchem.ncbi.nlm.nih.gov/compound/8255
110.Dunlop MJ.,工程改造微生物的耐受性用于下一代生物燃料(Engineeringmicrobes for tolerance to next-generation biofuels.)《生物燃料技术》,2011;4:32。
111.Baer SH,Blaschek HP,Smith TL.,丁醇攻击和温度对丁醇耐受性丙酮丁醇梭菌的脂质组成和膜流动性的影响(Effect of Butanol Challenge and Temperature onLipid Composition and Membrane Fluidity of Butanol-Tolerant Clostridiumacetobutylicum.)《应用与环境微生物学》,1987;53:2854-61。
112.Chong H,Yeow J,Wang I,Song H,Jiang R.,通过重新连接全局调控因子cAMP受体蛋白(CRP)来改善大肠杆菌的乙酸耐受性(Improving Acetate Tolerance ofEscherichia coli by Rewiring Its Global Regulator cAMP Receptor Protein(CRP).)《公共科学图书馆·综合》,2013;8。
113.Chong H,Huang L,Yeow J,Wang I,Zhang H,Song H等人,通过重新连接全局调控因子cAMP受体蛋白(CRP)来改善大肠杆菌的乙酸耐受性,《公共科学图书馆·综合》[互联网].2013[2019年3月11日引用];8。网址:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3585226/
114.Burk MJ.,由糖可持续生产工业化学品(Sustainable production ofindustrial chemicals from sugars.)《国际糖业杂志(INTERNATIONAL SUGARJOURNAL.)》,2010;112:6。
115.Kacena MA,Merrell GA,Manfredi B,Smith EE,Klaus DM,Todd P.,太空飞行中的细菌生长:大肠杆菌和枯草芽孢杆菌的逻辑斯蒂生长曲线参数(Bacterial growthin space flight:logistic growth curve parameters for Escherichia coli andBacillus subtilis.)《应用微生物学与生物技术》,1999;51:229-34。
116.Roy B,Zhao J,Yang C,Luo W,Xiong T,Li Y等人,CRISPR/Cascade9介导的基因组编辑—挑战与机遇(CRISPR/Cascade 9-Mediated Genome Editing-Challengesand Opportunities.)《遗传学前沿(Front Genet)》[互联网].2018[2019年3月22日引用];9。网址:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6042012/
117.Cooper LA,Stringer AM,Wade JT.,确定大肠杆菌I-E型CRISPR-Cas系统的体内Cascade结合、干扰和引发的适应的特异性(Determining the Specificity ofCascade Binding,Interference,and Primed Adaptation In Vivo in the Escherichiacoli Type I-E CRISPR-Cas System.),mBio.2018;9:e02100-17。
118.Jones PG,Inouye M.,冷休克反应—热门话题(The cold-shock response-ahot topic.)《分子微生物学(Molecular Microbiology.)》,1994;11:811-8。
119.Ishii A,Oshima T,Sato T,Nakasone K,Mori H,Kato C.,利用DNA微阵列程序分析静水压力对大肠杆菌中转录的影响(Analysis of hydrostatic pressure effectson transcription in Escherichia coli by DNA microarray procedure.)《极端微生物(Extremophiles.)》,2005;9:65-73。
120.Marietou A,Nguyen ATT,Allen EE,Bartlett DH.,大肠杆菌K-12MG1655在高静水压力下生长的适应性实验室进化(Adaptive laboratory evolution ofEscherichia coli K-12MG1655 for growth at high hydrostatic pressure.)《微生物学前沿(Front Microbiol)》[互联网].2015[2019年5月27日引用];5。网址:https://www.frontiersin.org/articles/10.3389/fmicb.2014.00749/full
121.Zhao F,Bi X,Hao Y,Liao X.,高压CO2诱导存活但不可培养的大肠杆菌O157:H7及其特征(Induction of Viable but Nonculturable Escherichia coli O157:H7 by High Pressure CO2 and Its Characteristics.)《公共科学图书馆·综合》,2013;8:e62388。
122.Sharma A,Scott JH,Cody GD,Fogel ML,Hazen RM,Hemley RJ等人,在吉帕斯卡压力下的微生物活性(Microbial Activity at Gigapascal Pressures)《科学》,2002;295:1514-6。
123.Ohnishi K,Ohnishi T.,在太空中长期停留期间太空辐射的生物影响(TheBiological Effects of Space Radiation during Long Stays in Space.)《宇宙生物科学(Biol Sci Space.)》,2004;18:201-5。
124.Takahashi A,Ohnishi K,Yokota A,Kumagai T,Nakano T,Ohnishi T.,和平号空间站长期太空飞行后质粒DNA和大肠杆菌的突变频率(Mutation Frequency ofPlasmid DNA and Escherichia coli Following Long-term Space Flight on Mir.)《辐射研究杂志(J Radiat Res.)》,2002;43:S137-40。
125.Shah P,Swiatlo E.,细菌病原体中聚胺的多方面作用(A multifacetedrole for polyamines in bacterial pathogens.)《分子微生物学》,2008;68:4-16。
126.Casero RA,Pegg AE.,亚精胺/精胺N1-乙酰基转移酶—聚胺代谢的拐点(Spermidine/spermine N1-acetyltransferase--the turning point in polyaminemetabolism.)《美国实验生物学会联合会会志(The FASEB Journal.)》,1993;7:653-61。
127.Feehily C,Karatzas K a.G.,谷氨酸代谢在细菌对酸和其它应激反应中的作用(Role of glutamate metabolism in bacterial responses towards acid andother stresses.)《应用微生物学杂志(Journal of Applied Microbiology.)》,2013;114:11-24。
128.Samsonova NN,Smirnov SV,Altman IB,Ptitsyn LR.,大肠杆菌K12ygjG基因的分子克隆和表征(Molecular cloning and characterization of Escherichia coliK12 ygjG gene.)《BMC微生物学(BMC Microbiology.)》,2003;10。
129.Reitzer L.,大肠杆菌中的氮同化和总体调控(Nitrogen Assimilation andGlobal Regulation in Escherichia coli.)《微生物学年评(Annual Review ofMicrobiology.)》,2003;57:155-76。
130.Rhee HJ,Kim E-J,Lee JK.,生理聚胺:简单的原始应激分子(Physiologicalpolyamines:simple primordial stress molecules.)《细胞与分子医学杂志(Journal ofCellular and Molecular Medicine.)》,2007;11:685-703。
131.Fontenot EM,Ezelle KE,Gabreski LN,Giglio ER,McAfee JM,Mills AC等人,大肠杆菌K-12中草酸诱导的酸耐受性需要YfdW和YfdU(YfdW and YfdU are requiredfor oxalate-induced acid tolerance in Escherichia coli K-12.)《细菌学杂志》,2013;195:1446-55。
132.Reid AN,Whitfield C.,涉及大肠杆菌荚膜和胞外多糖组装的保守基因产物的功能分析:用于可拉酸生物合成的Wza和Wzc之间分子识别的证据(Functional Analysisof Conserved Gene Products Involved in Assembly of Escherichia coli Capsulesand Exopolysaccharides:Evidence for Molecular Recognition between Wza and Wzcfor Colanic Acid Biosynthesis.)《细菌学杂志》,2005;187:5470-81。
133.β-内酰胺诱导大肠杆菌中可拉酸的基因表达(β-Lactam induction ofcolanic acid gene expression in Escherichia coli),《FEMS微生物学快报(FEMSMicrobiology Letters)》,Oxford Academic[互联网].[2019年3月10日引用]。网址:https://academic.oup.com/femsle/article/226/2/245/578008
134.Pletnev P,Osterman I,Sergiev P,Bogdanov A,Dontsova O.,生存指南:处于静止期的大肠杆菌(Survival guide:Escherichia coli in the stationary phase.),《自然学报(Acta Naturae.)》,2015;7:22-33。
135.Navarro Llorens JM,Tormo A,Martínez-García E.,革兰氏阴性细菌的静止期(Stationary phase in gram-negative bacteria.),《FEMS微生物学评论(FEMSMicrobiol Rev.)》,2010;34:476-95。
136.Weber J,Kayser A,Rinas U.,葡萄糖限制性连续培养物中大肠杆菌的代谢通量分析。II.对饥荒和盛宴、甲基乙二醛路径活化和振荡行为的动态反应(Metabolicflux analysis of Escherichia coli in glucose-limited continuousculture.II.Dynamic response to famine and feast,activation of themethylglyoxal pathway and oscillatory behaviour.),《微生物学(英文版)(Microbiology)(Reading,Engl))》,2005;151:707-16。
137.Layton JC,Foster PL.,大肠杆菌中易错DNA聚合酶IV受应激反应σ因子RpoS控制(Error-prone DNA polymerase IV is controlled by the stress-response sigmafactor,RpoS,in Escherichia coli.)《分子微生物学》,2003;50:549-61。
138.Tang M,Shen X,Frank EG,O'Donnell M,Woodgate R,Goodman MF.,UmuD′2C是易错DNA聚合酶大肠杆菌pol V(UmuD′2C is an error-prone DNA polymerase,Escherichia coli pol V.),PNAS.1999;96:8919-24。
139.Tompkins JD,Nelson JL,Hazel JC,Leugers SL,Stumpf JD,Foster PL.,易错聚合酶DNA聚合酶IV在大肠杆菌中适应性突变期间引起短暂超突变(Error-PronePolymerase,DNA Polymerase IV,Is Responsible for Transient Hypermutationduring Adaptive Mutation in Escherichia coli.),《细菌学杂志》,2003;185:3469-72。
140.Lee H,Doak TG,Popodi E,Foster PL,Tang H.,插入序列引起的大肠杆菌基因组中大规模重排(Insertion sequence-caused large-scale rearrangements in thegenome of Escherichia coli.),《核酸研究》,2016;44:7109-19。
141.Finkel SE.,静止期间的长期存活:演变和GASP表型(Long-term survivalduring stationary phase:evolution and the GASP phenotype.),《自然综述:微生物学(Nature Reviews Microbiology.)》,2006;4:113-20。
142.Zinser ER,Kolter R.,增强氨基酸分解代解的突变引起静止期中的生长优势(Mutations Enhancing Amino Acid Catabolism Confer a Growth Advantage inStationary Phase.)《细菌学杂志》,1999;181:5800-7。
143.Zinser ER,Kolter R.,大肠杆菌在静止期间的进化(Escherichia colievolution during stationary phase.),《微生物学研究(Research inMicrobiology.)》,2004;155:328-36。
144.Zambrano MM,Kolter R.,静止期中的生命气息(GASPing for Life inStationary Phase.)《细胞》,1996;86:181-4。
145.肠内细菌混合培养物中的静止期生长优势(GASP)现象(growth advantagein stationary-phase(GASP)phenomenon in mixed cultures of enterobacteria),《FEMS微生物学快报》,Oxford Academic[互联网].[2019年3月10日引用]。网址:https://academic.oup.com/femsle/article/266/1/119/562771
146.Murrell JC.,细菌细胞生理学—分子方法(Physiology of the bacterialcell-A molecular approach):F.C.Neidhardt,J.L.Ingraham and M.Schaechter,Sinauer Associates,1990.£34.95(xii+第506页)ISBN 0 87893 608 4。《遗传学趋势(Trends in Genetics.)》,1991;7:341。
147.Tenaillon O,Barrick JE,Ribeck N,Deatherage DE,Blanchard JL,Dasgupta A等人,50,000代实验中基因组进化的节奏和模式(Tempo and mode of genomeevolution in a 50,000-generation experiment.),《自然》,2016;536:165-70。
148.Shen Y,Wan Z,Coarfa C,Drabek R,Chen L,Ostrowski EA等人,由下一代再测序数据评估变异等位基因概率的SNP发现方法(A SNP discovery method to assessvariant allele probability from next-generation resequencing data.),《基因组研究(Genome Res.)》,2010;20:273-80。
149.城市废水和污水污泥中的污染物(Pollutants in urban waste water andsewage sludge.),:273。
150.Statovci D,Aguilera M,MacSharry J,Melgar S.,西方饮食和养分对粘膜界面处微生物群和免疫反应的影响(The Impact of Western Diet and Nutrients onthe Microbiota and Immune Response at Mucosal Interfaces.),《免疫学前沿(FrontImmunol)》[互联网].2017[2019年3月11日引用];8。网址:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5532387/
151.Moore LB,Liu SV,Halliday TM,Neilson AP,Hedrick VE,Davy BM.,钠、氮和糖的尿液排泄量是非肥胖青少年饮食中钠、蛋白质和高糖摄入量的有效生物标志物(Urinary Excretion of Sodium,Nitrogen,and Sugar Amounts Are Valid Biomarkersof Dietary Sodium,Protein,and High Sugar Intake in Nonobese Adolescents.),《营养杂志(J Nutr.)》,2017;147:2364-73。
152.Tasevska N.,尿糖—总糖摄入量的生物标志物(Urinary Sugars-ABiomarker of Total Sugars Intake.),《营养学(Nutrients.)》,2015;7:5816-33。
153.Brockman IM,Prather KLJ.,用于重定向初级代谢物的通量的大肠杆菌中枢代谢的动态敲减(Dynamic knockdown of E.coli central metabolism for redirectingfluxes of primary metabolites.)《代谢工程(Metabolic Engineering.)》,2015;28。
154.Wagner C,Urbanczik R.,代谢网路的通量锥几何形状(The geometry ofthe flux cone of a metabolic network.),《生物物理学杂志(BiophysicalJournal.)》,2005;89:3837-45。
155.Kleijntjens RH.,《生物反应器》,2000;14:329-347。
156.Mannina G,Cosenza A,Di Trapani D,Laudicina VA,Morici C,
157.Zhang Y,Zhu Y,Zhu Y,Li Y.,工程改造微生物中生理功能的重要性(Theimportance of engineering physiological functionality into microbes.)。
158.Salazar AN,Gorter de Vries AR,van den Broek M,Wijsman M,de laTorre Cortés P,Brickwedde A等人,纳米孔测序使酿酒酵母参考菌株CEN.PK113-7D能够接近完全的从头组装(Nanopore sequencing enables near-complete de novo assemblyof Saccharomyces cerevisiae reference strain CEN.PK113-7D.),《FEMS酵母研究(FEMS Yeast Research.)》,2017;17:1-11。
159.Schmidt MH,Vogel A,Denton AK,Istace B,Wormit A,van de Geest H等人,使用纳米孔测序从头组装新颖潘那利番茄基因组(De novo Assembly of a NewSolanum pennellii Accession Using Nanopore Sequencing.),《植物细胞(The PlantCell.)》,2017;29:tpc.00521.2017。
序列表
<110> 阿拉斯加大学安克雷奇分校
<120> 用于生产异丁烯的方法和组合物
<130> 21002.0089P1
<150> 63/010,409
<151> 2020-04-15
<160> 4
<170> 专利版本 3.5
<210> 1
<211> 978
<212> DNA
<213> 人工序列
<220>
<223> 合成构建; M3K优化基因
<400> 1
atggagaact ataatgttaa aacccgtgca tttccgacca ttggtattat tctgctgggt 60
ggcattagcg acaaaaaaaa ccgtattccg ctgcatacca ccgcaggtat tgcatatacc 120
ggcatcaata acgatgtgta caccgaaacc aaactgtatg tgagcaaaga cgaaaaatcg 180
tatatcgatg gcaaagaaat cgatctgaat agcgatcgta gcccgagcaa agtgatcgat 240
aaattcaaac atgaaatcct gatgcgtgtg aatctggatg atgaaaacaa cctgagcatt 300
gatagccgca attttaacat tctgagcggt agcagcgata gcggtgcagc agcactgggt 360
gaatgcattg aaagcatctt cgagtacaac atcaacatct tcacctttga aaatgatctg 420
cagcgtatta gcgaaagcgt tggtcgtagc ctgtatggtg gtctgaccgt taattatgca 480
aatggtcgtg aaagcctgac cgaaccgctg ctggaaccgg aagcatttaa caactttacc 540
atcatcggtg cccattttaa cattgatcgc aaaccgagca acgaaatcca cgaaaacatc 600
atcaaacatg agaactatcg cgaacgtatt aaaagcgcag agcgcaaagc aaaaaaactg 660
gaagaactga gccgtaatgc caacattaaa ggcatttttg aactggcaga aagcgatacc 720
gtggaatatc ataaaatgct gcatgatgtg ggcgttgata ttatcaatga ccgcatggaa 780
aatctgattg aacgcgtgaa agagatgaaa aacaacttct ggaacagcta tattgttacc 840
ggtggtccga atgtttttgt gatcaccgag aaaaaagatg tggataaagc catggaaggt 900
ctgaatgatc tgtgtgatga tattcgtctg ctgaaagttg caggtaaacc gcaggttatc 960
agcaaaaact tctaatga 978
<210> 2
<211> 1191
<212> DNA
<213> 人工序列
<220>
<223> 合成构建; MVD优化基因序列
<400> 2
atgaccgttt ataccgcaag cgttaccgca ccggttaata ttgcaaccct gaaatattgg 60
ggtaaacgtg ataccaaact gaatctgccg accaatagca gcattagcgt taccctgagc 120
caggatgatc tgcgtaccct gaccagcgca gcaaccgcac cggaatttga acgtgatacc 180
ctgtggctga atggtgaacc gcatagcatt gataatgaac gtacccagaa ttgtctgcgt 240
gatctgcgtc agctgcgtaa agaaatggaa agcaaagatg caagcctgcc gaccctgagc 300
cagtggaaac tgcatattgt tagcgaaaat aattttccga ccgcagcagg tctggcaagc 360
agcgcagcag gttttgcagc actggttagc gcaattgcaa aactgtatca gctgccgcag 420
agcaccagcg aaattagccg tattgcacgt aaaggtagcg gtagcgcatg tcgtagcctg 480
tttggtggtt atgttgcatg ggaaatgggt aaagcagaag atggtcatga tagcatggca 540
gttcagattg cagatagcag cgattggccg cagatgaaag catgtgttct ggttgttagc 600
gatattaaaa aagatgttag cagcacccag ggtatgcagc tgaccgttgc aaccagcgaa 660
ctgtttaaag aacgtattga acatgttgtt ccgaaacgtt ttgaagttat gcgtaaagca 720
attgttgaaa aagatttcgc aacctttgca aaagaaacca tgatggatag caatagcttt 780
catgcaacct gtctggatag ctttccgccg attttttata tgaatgatac cagcaaacgc 840
attattagct ggtgtcatac cattaatcag ttttatggtg aaaccattgt ggcatatacc 900
tttgatgcag gtccgaatgc agttctgtat tatctggcag aaaatgaaag caaactgttt 960
gcatttatct acaaactgtt cggtagcgtt ccgggttggg ataaaaaatt taccaccgaa 1020
cagctggaag catttaatca tcagtttgaa agcagcaatt tcaccgcacg tgaactggat 1080
ctggaactgc agaaagatgt tgcacgtgtt attctgaccc aggttggtag cggtccgcag 1140
gaaaccaatg aaagcctgat tgatgcaaaa accggtctgc cgaaagaata a 1191
<210> 3
<211> 975
<212> DNA
<213> 灼热嗜酸古菌
<400> 3
atggaaaatt acaatgttaa gacaagggcg ttcccaacaa taggcataat actgcttggt 60
gggatctcgg ataaaaagaa caggataccg ctgcatacaa cggcaggcat agcatatact 120
ggtataaaca atgatgttta cactgagaca aagctttatg tatcaaaaga tgaaaaatgc 180
tatattgatg gaaaggaaat tgatttaaat tcagatagat caccatcgaa ggttattgat 240
aaattcaagc atgaaatact tatgagagta aatcttgatg atgaaaataa cctttcaatt 300
gattcaagga actttaatat attaagtggc agctcagatt ctggggccgc tgcactggga 360
gagtgcatag aatcaatttt tgaatacaat ataaatatat ttacatttga aaacgatctt 420
cagaggatat cagaaagtgt tggaagaagc ctttacggtg gtttaacagt aaactatgcc 480
aatggcaggg aatcattaac agagccatta cttgagcctg aggcatttaa taactttaca 540
ataattggtg cacattttaa cattgataga aaaccatcaa atgagattca tgaaaatatc 600
ataaaacatg aaaattacag ggaaagaata aaaagtgctg agagaaaggc gaaaaaactt 660
gaggagctat caaggaatgc aaacataaag ggtatctttg aacttgcaga atccgataca 720
gtggaatacc ataaaatgct ccatgatgtt ggcgttgaca taataaatga tagaatggag 780
aacctcattg aaagggtaaa agaaatgaaa aataacttct ggaattcata catagttacc 840
ggcggcccga acgtttttgt aataacagag aaaaaggacg ttgataaggc aatggaagga 900
ttaaatgatc tgtgcgatga tataagatta ttaaaagttg caggaaagcc acaggtcatt 960
tcaaaaaact tttaa 975
<210> 4
<211> 1191
<212> DNA
<213> 酿酒酵母
<400> 4
atgaccgttt acacagcatc cgttaccgca cccgtcaaca tcgcaaccct taagtattgg 60
gggaaaaggg acacgaagtt gaatctgccc accaattcgt ccatatcagt gactttatcg 120
caagatgacc tcagaacgtt gacctctgcg gctactgcac ctgagtttga acgcgacact 180
ttgtggttaa atggagaacc acacagcatc gacaatgaaa gaactcaaaa ttgtctgcgc 240
gacctacgcc aattaagaaa ggaaatggaa tcgaaggacg cctcattgcc cacattatct 300
caatggaaac tccacattgt ctccgaaaat aactttccta cagcagctgg tttagcttcc 360
tccgctgctg gctttgctgc attggtctct gcaattgcta agttatacca attaccacag 420
tcaacttcag aaatatctag aatagcaaga aaggggtctg gttcagcttg tagatcgttg 480
tttggcggat acgtggcctg ggaaatggga aaagctgaag atggtcatga ttccatggca 540
gtacaaatcg cagacagctc tgactggcct cagatgaaag cttgtgtcct agttgtcagc 600
gatattaaaa aggatgtgag ttccactcag ggtatgcaat tgaccgtggc aacctccgaa 660
ctatttaaag aaagaattga acatgtcgta ccaaagagat ttgaagtcat gcgtaaagcc 720
attgttgaaa aagatttcgc cacctttgca aaggaaacaa tgatggattc caactctttc 780
catgccacat gtttggactc tttccctcca atattctaca tgaatgacac ttccaagcgt 840
atcatcagtt ggtgccacac cattaatcag ttttacggag aaacaatcgt tgcatacacg 900
tttgatgcag gtccaaatgc tgtgttgtac tacttagctg aaaatgagtc gaaactcttt 960
gcatttatct ataaattgtt tggctctgtt cctggatggg acaagaaatt tactactgag 1020
cagcttgagg ctttcaacca tcaatttgaa tcatctaact ttactgcacg tgaattggat 1080
cttgagttgc aaaaggatgt tgccagagtg attttaactc aagtcggttc aggcccacaa 1140
gaaacaaacg aatctttgat tgacgcaaag actggtctac caaaggaata a 1191
- 用于直接从FFPE组织样本生产DNA文库的方法和组合物
- 一种用于提高母猪生产性能的中药组合物、中药微生态制剂及其制备方法
- 纤维素酶组合物和使用相同组合物用于改善木质纤维素生物质转化成可发酵糖的方法
- 用于压裂返排液处理的催化氧化组合物、方法及组合物的用途
- 具有内乙烯叉基的聚异丁烯组合物和用于制备该聚异丁烯聚合物组合物的方法
- 催化剂组合物和使用该催化剂组合物制备异丁烯类低聚物的方法
