具有高生物利用度的鲁拉西酮盐及其制法和应用
文献发布时间:2024-04-18 19:58:21
技术领域
本发明涉及药物化学及结晶工艺技术领域,尤其涉及鲁拉西酮盐、其制备方法、药物组合物及其应用。
背景技术
鲁拉西酮(lurasidone)的化学名为:(3aR,4S,7R,7aS)-2-[[(1R,2R)-2-[[4-(1,2-Benzisothiazol-3-yl)-1-piperazinyl]methyl]cyclohexyl]methyl]hexahydro-4,7-methano-1H-isoindole-1,3(2H)-dione,其化学结构式如下:
鲁拉西酮是日本住友制药公司开发的一种具有双重作用的非典型抗精神病药,对5-羟色胺受体和多巴胺D2受体均具有高度亲和力,用于治疗青少年(13-17岁)和成人精神分裂症以及Ⅰ型双相情感障碍相关的重度抑郁发作。鲁拉西酮比其他药物具有更低的体重增加倾向和不良代谢影响。但由于鲁拉西酮水溶性很差,口服吸收差,大大限制了它的临床应用。
对于可电离的游离碱或游离酸分子,其对应的盐型具有改善化合物的理化性质的潜力,如溶解度、结晶度、吸湿性、熔点、稳定性、生物利用度等。
美国专利公布号US8853395公开了鲁拉西酮盐酸盐的制备方法,盐酸盐也是目前鲁拉西酮上市药物所采用的盐型。即使盐酸鲁拉西酮比游离碱水溶性有一定的提高,但是仍然处于一个较低水平。本领域需要提供一种稳定的,溶解度和生物利用度更高的鲁拉西酮的新的药用形式。
发明内容
本发明的目的在于提供了一种溶解度高,溶出速率快以及生物利用度高的新型鲁拉西酮的盐、制备方法、药物组合物及其应用。
在本发明的第一方面,本发明提供了两种鲁拉西酮盐,其中鲁拉西酮与反离子的摩尔比为1:1;其中所述的反离子选自下组:α-酮戊二酸和反式乌头酸。
所述α-酮戊二酸和反式乌头酸结构如下所示:
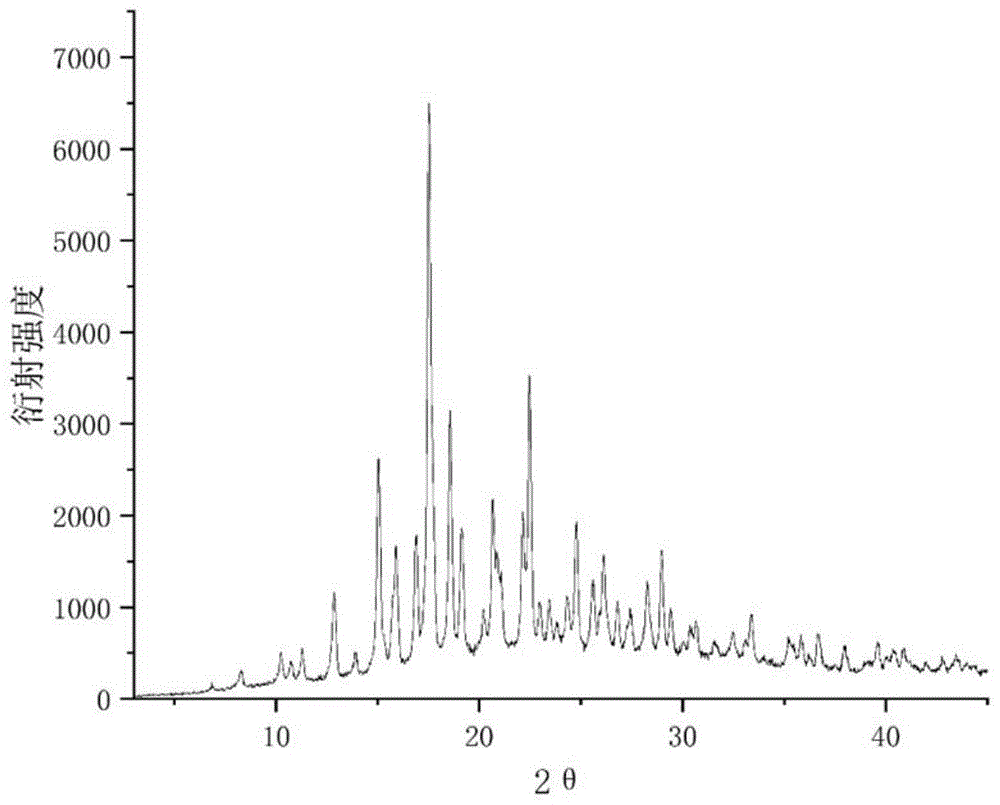
所述鲁拉西酮与α-酮戊二酸的盐的X-射线粉末衍射图在衍射角2θ为6.8°、8.3°、10.2°、10.7°、11.3°、12.9°、13.9°、15.1°、15.9°、16.9°、17.5°、18.6°、19.1°、20.2°、20.7°、22.1°、22.5°、24.7°、26.1°、29.0°处具有特征峰,误差为±0.2°。
在某些实施方式中,所述鲁拉西酮与α-酮戊二酸的盐具有基本上如图1所示的X-射线粉末衍射(XRPD)图。
在某些实施方式中,所述鲁拉西酮与α-酮戊二酸的盐具有基本上如图2所示的热重分析(TGA)图。
在某些实施方式中,所述鲁拉西酮与α-酮戊二酸的盐的差示扫描量热分析图谱在172±2℃有特征熔融峰,优选地,所述鲁拉西酮与α-酮戊二酸的盐具有基本上如图3所示的差示扫描量热分析(DSC)图。
在某些实施方式中,所述鲁拉西酮与α-酮戊二酸的盐的红外图谱至少在3435cm
在某些实施方式中,所述鲁拉西酮与α-酮戊二酸的盐为正交晶系,空间群为P2
在另一优选例中,所述鲁拉西酮与反式乌头酸的盐的X-射线粉末衍射图在衍射角2θ为5.4°、9.9°、10.9°、13.76°、16.74°、17.9°、18.5°、19.3°、19.8°、22.0°、23.6°、24.7°处具有特征峰,误差为±0.2°。
在某些实施方式中,所述鲁拉西酮与反式乌头酸的盐具有基本上如图6所示的X-射线粉末衍射(XRPD)图。
在具体实施方式中,所述鲁拉西酮与反乌头酸的盐具有基本上如图7所示的热重分析(TGA)图。
在具体实施方式中,所述鲁拉西酮与反式乌头酸的盐的差示扫描量热分析图谱在179±2℃有特征熔融峰,优选地,所述鲁拉西酮与反式乌头酸的盐具有基本上如图8所示的差示扫描量热分析(DSC)图。
在具体实施方式中,所述鲁拉西酮与反式乌头酸的盐的红外图谱至少在3421cm
在具体实施方式中,所述鲁拉西酮与反式乌头酸的盐为单斜晶系,空间群为P2
在本发明的第二方面,本发明提供了一种如本发明第一方面所述的鲁拉西酮盐的制备方法,所述制备方法包括以下步骤:
a.将鲁拉西酮和反离子溶解于有机溶剂中,形成鲁拉西酮与反离子的溶液;
b.对所述鲁拉西酮与反离子溶液进行结晶处理;
c.从所述溶液体系中分离得到鲁拉西酮与反离子的盐。
在具体实施方式中,步骤a中,将所述鲁拉西酮和反离子按摩尔比2:1至1:2溶解于所述有机溶剂中。
在具体实施方式中,步骤a中,所述有机溶剂选自甲醇、乙醇、丙酮、乙酸乙酯、乙腈、二氯甲烷、硝基甲烷中的任一种,或它们中任意两者的混合溶剂。
在具体实施方式中,步骤b中,所述结晶处理包括通过挥发去除所述有机溶剂和搅拌反应结晶。
在具体实施方式中,步骤b中,所述结晶处理包括在20℃至50℃温度范围内任意温度下进行进行。
在具体实施方式中,所述步骤c包括以下步骤之一:
c1:对所述溶液体系进行过滤,获得鲁拉西酮与反离子的盐;
c2:对所述溶液体系进行离心,获得鲁拉西酮与反离子的盐;
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
图1是本发明实施例1提供的鲁拉西酮与α-酮戊二酸的盐的x-射线粉末衍射(XRPD)图。
图2是本发明实施例1提供的鲁拉西酮与α-酮戊二酸的盐的热重分析(TGA)图。
图3是本发明实施例1提供的鲁拉西酮与α-酮戊二酸的盐的差示扫描量热分析(DSC)图。
图4是本发明实施例1提供的鲁拉西酮与α-酮戊二酸的盐的红外光谱(IR)图。
图5是本发明实施例1提供的鲁拉西酮与α-酮戊二酸的盐的单晶的不对称单元结构图。
图6是本发明实施例8提供的鲁拉西酮与反式乌头酸的盐的X-射线粉末衍射(XRPD)图。
图7是本发明实施例8提供的鲁拉西酮与反式乌头酸的盐的热重分析(TGA)图。
图8是本发明实施例8提供的鲁拉西酮与反式乌头酸的盐的差示扫描量热分析(DSC)图。
图9是本发明实施例8提供的鲁拉西酮与反式乌头酸的盐的红外光谱(IR)图。
图10是本发明实施例8提供的鲁拉西酮与反式乌头酸的盐的单晶的不对称单元结构图。
图11是本发明实施例1提供的鲁拉西酮与α-酮戊二酸的盐以及盐酸鲁拉西酮在pH2.0的溶出介质中粉末溶出速率对比图。
图12是大鼠(N=3)口服本发明实施例1的鲁拉西酮与α-酮戊二酸的盐以及盐酸鲁拉西酮(10mg/kg)后不同时间血液中药物浓度曲线图。
图13是本发明实施例8提供的鲁拉西酮与反式乌头酸的盐以及盐酸鲁拉西酮在pH2.0的溶出介质中粉末溶出速率对比图。
图14是大鼠(N=3)口服本发明实施例8的鲁拉西酮与反式乌头酸的盐以及盐酸鲁拉西酮(10mg/kg)后不同时间血液中药物浓度曲线图。
具体实施方式
本发明人经过广泛而深入的研究,通过大量筛选,首次开发了鲁拉西酮的一系列新颖的盐及其晶型。出乎意料地,这些盐及其特定晶型,在溶解度,引湿性,溶出速率以及生物利用度等方面存在明显的优势。在此基础上完成了本发明。
术语
在本文中,除非特别说明,各缩写均为本领域技术人员所理解的常规含义。
如本文所用,除非特别说明,加入溶剂或溶液的方式为直接倒入、匀速加入或缓慢滴加等。
多晶型物
固体不是以无定形的形式就是以结晶的形式存在。在结晶形式的情况下,分子定位于三维晶格格位内。当化合物从溶液或浆液中结晶出来时,它可以不同的空间点阵排列结晶(这种性质被称作“多晶型现象”),形成具有不同的结晶形式的晶体,这各种结晶形式被称作“多晶型物”。给定物质的不同多晶型物可在一个或多个物理属性方面(如溶解度和溶解速率、堆密度、晶习、堆积方式、流动性和/或固态稳定性)彼此不同。
结晶
可以通过操作使得目标化合物的达到过饱和状态从蒸汽、溶液或熔融物种析出晶体固体的过程。可以通过多种方法来完成,例如,在相对高的温度下溶解化合物,然后冷却溶液至过饱和状态;通过加热沸腾、常压蒸发、真空干燥或通过其它的一些方法来减小液体体积;通过加入不良溶剂,来降低目标化合物的在溶剂体系中的溶解度;此外,通过调节溶液pH值也可以降低溶解度。有关结晶方面的详细描述请参见Crystallization,第三版,J WMullens,Butterworth-Heineman Ltd.,1993,ISBN0750611294。
假如期望盐的形成与结晶同时发生,如果盐在反应介质中比原料溶解度小,那么加入适当的酸或碱可实现所需盐的直接结晶。如本文所用,术语“室温”一般指4-30℃,较佳地指20±5℃。
多晶型物的鉴定和性质
本发明在制备鲁拉西酮的盐后,采用如下多种方式和仪器对其性质进行了研究。
X射线粉末衍射
测定晶型的X射线粉末衍射的方法在本领域中是已知的。例如使用Rigaku D/max2550VB/PC型号的X射线粉末衍射仪,以2°每分钟的扫描速度,采用铜辐射靶获取图谱。
本发明的鲁拉西酮盐,具有特定的晶型形态,在X-射线粉末衍射(XRPD)图中具有特定的特征峰。
示差扫描量热分析
又称“差示量热扫描分析”(DSC),是在加热过程中,测量被测物质与参比物之间的能量差与温度之间关系的一种技术。DSC图谱上的峰位置、形状和峰数目与物质的性质有关,故可以定性地用来鉴定物质。本领域常用该方法来检测物质的相变温度、玻璃化转变温度、反应热等多种参数。
DSC测定方法在本领域中是已知的。例如可使用美国TA仪器(TA Instruments)公司的TA Q 2000差示扫描量热仪,以10℃每分钟的升温速率,从25℃升温至300
℃,获得晶型的DSC扫描图谱。
本发明的鲁拉西酮盐,在差示扫描量热分析(DSC)图中具有特定的特征峰。
药物组合物和施用方法
由于本发明的鲁拉西酮盐具有优异的精神分裂症和Ⅰ型双相情感障碍相关的重度抑郁发作疾病的治疗作用,因此本发明的鲁拉西酮盐以及含有本发明的晶型或由本发明的鲁拉西酮盐为主要活性成分的药物组合物可用于治疗精神分裂症和Ⅰ型双相情感障碍相关的重度抑郁发作疾病。
本发明的药物组合物包含安全有效量范围内的本发明的鲁拉西酮盐,及药学上可以接受的赋形剂或载体。
其中,“安全有效量”指的是:化合物(或晶型或无定型)的量足以明显改善病情,而不至于产生严重的副作用。通常,药物组合物含有1~2000mg本发明的盐/剂,更佳地,含有2.5~200mg本发明的盐/剂。较佳地,所述的“一剂”为一个胶囊或药片。
“药学上可以接受的载体”指的是:一种或多种相容性固体或液体填料或凝胶物质,它们适合于人使用,而且必须有足够的纯度和足够低的毒性。“相容性”在此指的是组合物中各组份能和本发明的活性成分以及它们之间相互掺和,而不明显降低活性成分的药效。药学上可以接受的载体部分例子有纤维素及其衍生物(如羧甲基纤维素钠、乙基纤维素钠、纤维素乙酸酯等)、明胶、滑石、固体润滑剂(如硬脂酸、硬脂酸镁)、硫酸钙、植物油(如豆油、芝麻油、花生油、橄榄油等)、多元醇(如丙二醇、甘油、甘露醇、山梨醇等)、乳化剂(如吐温
本发明的鲁拉西酮盐或药物组合物的施用方式没有特别限制,代表性的施用方式包括(但并不限于):口服、瘤内、直肠、肠胃外(静脉内、肌肉内或皮下)、和局部给药。
用于口服给药的固体剂型包括胶囊剂、片剂、丸剂、散剂和颗粒剂。在这些固体剂型中,活性成分与至少一种常规惰性赋形剂(或载体)混合,如柠檬酸钠或磷酸二钙,或与下述成分混合:(a)填料或增容剂,例如,淀粉、乳糖、蔗糖、葡萄糖、甘露醇和硅酸;(b)粘合剂,例如,羟甲基纤维素、藻酸盐、明胶、聚乙烯基吡咯烷酮、蔗糖和阿拉伯胶;(c)保湿剂,例如,甘油;(d)崩解剂,例如,琼脂、碳酸钙、马铃薯淀粉或木薯淀粉、藻酸、某些复合硅酸盐、和碳酸钠;(e)缓溶剂,例如石蜡;(f)吸收加速剂,例如,季胺化合物;(g)润湿剂,例如鲸蜡醇和单硬脂酸甘油酯;(h)吸附剂,例如,高岭土;和(i)润滑剂,例如,滑石、硬脂酸钙、硬脂酸镁、固体聚乙二醇、十二烷基硫酸钠,或其混合物。胶囊剂、片剂和丸剂中,剂型也可包含缓冲剂。
固体剂型如片剂、糖丸、胶囊剂、丸剂和颗粒剂可采用包衣和壳材制备,如肠衣和其它本领域公知的材料。它们可包含不透明剂,并且,这种组合物中活性成分的释放可以延迟的方式在消化道内的某一部分中释放。可采用的包埋组分的实例是聚合物质和蜡类物质。必要时,活性成分也可与上述赋形剂中的一种或多种形成微胶囊形式。
用于口服给药的液体剂型包括药学上可接受的乳液、溶液、悬浮液、糖浆或酊剂。除了活性成分外,液体剂型可包含本领域中常规采用的惰性稀释剂,如水或其它溶剂,增溶剂和乳化剂,例知,乙醇、异丙醇、碳酸乙酯、乙酸乙酯、丙二醇、1,3-丁二醇、二甲基甲酰胺以及油,特别是棉籽油、花生油、玉米胚油、橄榄油、蓖麻油和芝麻油或这些物质的混合物等。
除了这些惰性稀释剂外,组合物也可包含助剂,如润湿剂、乳化剂和悬浮剂、甜味剂、矫味剂和香料。
除了活性成分外,悬浮液可包含悬浮剂,例如,乙氧基化异十八烷醇、聚氧乙烯山梨醇和脱水山梨醇酯、微晶纤维素、甲醇铝和琼脂或这些物质的混合物等。
用于肠胃外注射的组合物可包含生理上可接受的无菌含水或无水溶液、分散液、悬浮液或乳液,和用于重新溶解成无菌的可注射溶液或分散液的无菌粉末。适宜的含水和非水载体、稀释剂、溶剂或赋形剂包括水、乙醇、多元醇及其适宜的混合物。
用于局部给药的本发明的鲁拉西酮盐的剂型包括软膏剂、散剂、贴剂、喷射剂和吸入剂。活性成分在无菌条件下与生理上可接受的载体及任何防腐剂、缓冲剂,或必要时可能需要的推进剂一起混合。
本发明的鲁拉西酮盐可以单独给药,或者与其他药学上可接受的化合物联合给药。
使用药物组合物时,是将安全有效量的本发明的鲁拉西酮盐适用于需要治疗的哺乳动物(如人),其中施用时剂量为药学上认为的有效给药剂量,对于60kg体重的人而言,日给药剂量通常为1~2000mg,优选2.5~500mg。当然,具体剂量还应考虑给药途径、病人健康状况等因素,这些都是熟练医师技能范围之内的。
本发明的主要优点包括:
(1)与现有技术相比,本发明提供的鲁拉西酮盐具有较大的溶解度,有利于生物利用度的提高,进而提高临床治疗效果。
(2)与现有技术相比,本发明提供的鲁拉西酮盐具有更高的溶出速率,有利于生物利用度的提高,进而提高临床治疗效果。
(3)与现有技术相比,本发明提供的鲁拉西酮盐具有更低的引湿性。低引湿性说明了该鲁拉西酮盐对包装和储存条件要求不苛刻,且在制备过程中无需特殊的干燥条件,简化了药物的制备和后处理工艺,利于工业化生产,显著降低了药物生产、运输和储存的成本。
通用方法
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。文中所述的较佳实施方法与材料仅作示范之用。
实验材料:鲁拉西酮购自上海佰世凯化学科技有限公司,纯度大于98%。α-酮戊二酸购自上海阿拉丁生化科技有限公司,纯度大于98%。反式乌头酸购自上海阿拉丁生化科技有限公司,纯度大于98%。
制备实施例:鲁拉西酮与α-酮戊二酸的盐的制备
实施例1
将鲁拉西酮0.1mmol和α-酮戊二酸0.1mmol按化学计量比1:1加入到1.5毫升甲醇中,完全溶解后,再在室温条件下缓慢挥发,得到鲁拉西酮与α-酮戊二酸的盐。
实施例2
将鲁拉西酮0.1mmol和α-酮戊二酸0.1mmol按化学计量比1:1加入到1毫升乙醇中,完全溶解后,再在30℃条件下缓慢挥发,得到鲁拉西酮与α-酮戊二酸的盐。
实施例3
将鲁拉西酮0.2mmol和α-酮戊二酸0.4mmol按化学计量比1:2加入到1毫升丙酮中,在室温条件下搅拌约12小时,过滤分离,得到鲁拉西酮与α-酮戊二酸的盐。
实施例4
将鲁拉西酮0.2mmol和α-酮戊二酸0.1mmol按化学计量比2:1加入到2毫升乙酸乙酯与乙醇的混合溶剂(体积比3:1)中,完全溶解后,再在室温条件下缓慢挥发,待有固体析出后过滤干燥,得到鲁拉西酮与α-酮戊二酸的盐。
实施例5
将鲁拉西酮0.1mmol和α-酮戊二酸0.1mmol按化学计量比1:1加入到1毫升乙腈中,完全溶解后,再在室温条件下缓慢挥发,得到鲁拉西酮与α-酮戊二酸的盐。
实施例6
将鲁拉西酮0.1mmol和α-酮戊二酸0.1mmol按化学计量比1:1加入到1毫升二氯甲烷中,完全溶解后,再在室温条件下缓慢挥发,得到鲁拉西酮与α-酮戊二酸的盐。
实施例7
将鲁拉西酮0.1mmol和α-酮戊二酸0.1mmol按化学计量比1:1加入到1毫升硝基甲烷中,完全溶解后,再置于50℃挥发条件下,得到鲁拉西酮与α-酮戊二酸的盐。
实验实施例1:
本发明提供的鲁拉西酮与α-酮戊二酸的盐,通过X-射线粉末衍射(XRPD)、热重分析(TGA)、差示扫描量热分析(DSC)以及红外(IR)等固态分析方法表征。
对实施例1制得的鲁拉西酮与α-酮戊二酸的盐的单晶进行单晶X-射线衍射分析,采用Bruker Smart Apex II型x-射线单晶衍射仪,测定条件为:石墨单色器,Cu-Kα射线
对实施例1制得的鲁拉西酮与α-酮戊二酸的盐固体样品进行X-射线粉末衍射分析,其采用理学电企仪器(北京)有限公司的Ultima IV衍射仪,采用Cu-Kα射线
分析结果见图1。
由图1可以看到,所述盐在衍射角2θ为6.8°、8.2°、10.2°、10.7°、11.23°、12.89°、13.89°、15.01°、15.9°、16.89°、17.5°、18.56°、19.1°、20.2°、20.67°、22.1°、22.4°、24.72°、26.1°、29.0°处具有特征峰,误差为±0.2°。
对实施例2-7制得的鲁拉西酮与α-酮戊二酸的盐固体样品如以上方式进行X-射线粉末衍射分析,结果显示其衍射峰与图1类似,也即,实施例2-7制得的盐应与实施例1制得的盐为同一物相。
对实施例1制得的鲁拉西酮与α-酮戊二酸的盐固体样品进行热重分析,其采用美国TA仪器有限公司Q500型热重分析仪,气氛为氮气,升温速率为10℃/分钟。其分析结果见图2。
对实施例1制得的鲁拉西酮与α-酮戊二酸的盐固体样品进行差示扫描量热分析,其采用美国TA仪器公司的Q2000差示扫描量热仪,气氛为氮气,加热速度为10℃/分钟。其分析结果见图3。
对实施例1制得的鲁拉西酮与α-酮戊二酸的盐固体样品进行红外分析,其采用美国安捷伦科技公司的Cary 630FTIR红外光谱分析仪于室温检测,检测范围为:4000–350cm
实验实施例2:鲁拉西酮与α-酮戊二酸的盐与盐酸鲁拉西酮的粉末溶出速率比较
受试样品来源:鲁拉西酮原料药购买自上海佰世凯化学科技有限公司,纯度大于98%;鲁拉西酮与α-酮戊二酸的盐由本发明制备实施例1提供的方法制备;盐酸鲁拉西酮依据专利US8853395所述实施例5方法制备。
实验方法:使用100目筛网,将制备的盐酸鲁拉西酮与鲁拉西酮反式乌头酸盐进行过筛处理。准确称量20毫克盐酸鲁拉西酮,及具有相应含量的鲁拉西酮与α-酮戊二酸的盐25毫克,分别在10毫升的溶出介质中磁力搅拌,每隔一段时间取0.1毫升溶液,经水相微孔滤膜过滤,用高效液相测定各个时间点的溶液中鲁拉西酮的浓度,最终得到两种盐的粉末溶出速率。
溶出介质:pH 2.0的甘氨酸-盐酸水溶液。
磁力转速:200转/分钟
溶出温度:37℃
取样时间:5、10、15、20、40、60、90、120分钟
液相条件:仪器:安捷伦Infinity1260
流动相:0.5%磷酸-三乙胺溶液(pH 2.2)、甲醇和乙腈(体积比30/15/55)的混合物。
柱温:35℃
流速:1mL/min
进样量:10μL
紫外检测波长为230nm
实验结果:
如图11所示,相比于盐酸鲁拉西酮,本发明的鲁拉西酮与α-酮戊二酸的盐在pH2.0的甘氨酸-盐酸水溶液中的溶出速率得到明显改善。α-酮戊二酸盐溶出的最高浓度是盐酸盐的5.4倍左右。且达到平衡时α-酮戊二酸盐的浓度依然高于盐酸盐。
实验实施例3:盐酸鲁拉西酮以及鲁拉西酮与α-酮戊二酸的盐在大鼠体内的血药浓度特征
将按照本发明制备实施例1制备的鲁拉西酮与α-酮戊二酸的盐以及依据专利US8853395所述方法制备的盐酸鲁拉西酮,悬浮于含有1%的HPMC水溶液中。
以给药剂量为10mg/kg(以鲁拉西酮计),将两种含有盐的水溶液,分别对清洁级大鼠(N=3)胃内给药,在给药后不同时间点内抽取大鼠眼眶血,使用液质联用色谱测定鲁拉西酮含量。
测试条件:
测试仪器:液相-安捷伦1260;质谱-美国Sciex公司的三重四级杆串联质谱仪
测试参数:液相方法:Agilent Extend-C18(1.8μm,2.1×50mm);流速:0.4mL/min;进样量:1μL;柱温:40℃;检测波长:230nm;
流动相:
质谱方法:离子源:ESI;流速:500L/min;喷雾电压4.5KV;离子源温度550℃;碰撞电压:20.9V;数据采集软件为Analyst;质荷比:Q1=493.3,Q2=166.1。
如图12和表1所示,结果证明:在大鼠口服同样剂量的条件下,鲁拉西酮与α-酮戊二酸的盐具备更好的生物吸收,其中血药浓度的峰值和生物利用度α-酮戊二酸的盐均明显高于盐酸鲁拉西酮。此外,α-酮戊二酸的盐相比于市售的盐酸鲁拉西酮血药浓度达峰时间更长,药物半衰期也更长,因此可以较长时间维持较高的血药浓度,有利于药物的疗效的提升以及降低血药浓度短时间剧烈变化造成的毒副作用。以上优势使得本发明所制备的盐相较于现有技术发明的盐酸盐在用药疗效及安全性上的提升上具有突出优势。
表1药代动力学参数
实验实施例4:鲁拉西酮与α-酮戊二酸的盐与盐酸鲁拉西酮的引湿性比较
将按照本发明制备实施例1制备的鲁拉西酮与α-酮戊二酸的盐以及依据专利US8853395所述方法制备的盐酸鲁拉西酮,使用动态水蒸汽吸附仪,评价两种盐的引湿性。
仪器型号:Intrinsic DVS型动态水蒸汽吸附仪(英国表面测试系统仪器有限公司)
测试条件:氮气吹扫速率15mL·min
结果如下表2所示:
表2不同相对湿度条件下盐酸鲁拉西酮与鲁拉西酮α-酮戊二酸盐的引湿性数据
从引湿性结果分析可知,本发明的鲁拉西酮与α-酮戊二酸的盐相对于盐酸鲁拉西酮,在其溶解度得到显著的提升时,其引湿性并没有升高,反而降低。
制备实施例:鲁拉西酮与反式乌头酸的盐的制备
实施例8
将鲁拉西酮0.1mmol和反式乌头酸0.1mmol按化学计量比1:1加入到2毫升甲醇中,完全溶解后,再在室温条件下缓慢挥发,得到鲁拉西酮与反式乌头酸的盐。
实施例9
将鲁拉西酮0.1mmol和反式乌头酸0.1mmol按化学计量比1:1加入到1毫升乙醇中,完全溶解后,再在35℃条件下缓慢挥发,得到鲁拉西酮与反式乌头酸的盐。
实施例10
将鲁拉西酮0.2mmol和反式乌头酸0.4mmol按化学计量比1:2加入到1毫升丙酮中,在室温条件下搅拌反应12小时,过滤分离,得到鲁拉西酮与反式乌头酸的盐。
实施例11
将鲁拉西酮0.2mmol和反式乌头酸0.1mmol按化学计量比2:1加入到3毫升乙酸乙酯和乙腈混合溶液(体积比1:1)中,完全溶解后,再在室温条件下缓慢挥发,待有固体析出后,过滤干燥,得到鲁拉西酮与反式乌头酸的盐。
实施例12
将鲁拉西酮0.1mmol和反式乌头酸0.1mmol按化学计量比1:1加入到1毫升乙腈中,完全溶解后,再在室温条件下缓慢挥发,得到鲁拉西酮与反式乌头酸的盐。
实施例13
将鲁拉西酮0.1mmol和反式乌头酸0.1mmol按化学计量比1:1加入到1毫升二氯甲烷中,完全溶解后,再在室温条件下缓慢挥发,得到鲁拉西酮与反式乌头酸的盐。
实施例14
将鲁拉西酮0.1mmol和反式乌头酸0.1mmol按化学计量比1:1加入到1毫升硝基甲烷中,完全溶解后,再置于50℃挥发条件下,得到鲁拉西酮与反式乌头酸的盐。
实验实施例5:
本发明提供的鲁拉西酮与反式乌头酸的盐,通过X-射线粉末衍射(XRPD)、热重分析(TGA)、差示扫描量热分析(DSC)以及红外(IR)等固态分析方法表征。
对实施例8制得的鲁拉西酮与反式乌头酸的盐的单晶进行单晶X-射线衍射分析,采用Bruker Smart Apex II型X-射线单晶衍射仪,测定条件为:石墨单色器,Cu-Kα射线
对实施例8制得的鲁拉西酮与反式乌头酸的盐固体样品进行X-射线粉末衍射分析,其采用理学电企仪器(北京)有限公司的Ultima IV衍射仪,采用Cu-Kα射线
对实施例9-14制得的鲁拉西酮与反式乌头酸的盐固体样品如以上方式进行X-射线粉末衍射分析,结果显示其衍射峰与图6类似,也即,实施例9-14制得的盐应与实施例8制得的盐为同一物相。
对实施例8制得的鲁拉西酮与反式乌头酸的盐固体样品进行热重分析,其采用美国TA仪器有限公司Q500型热重分析仪,气氛为氮气,升温速率为10℃/分钟。其分析结果见图7。
对实施例1制得的鲁拉西酮与反式乌头酸的盐固体样品进行差示扫描量热分析,其采用美国TA仪器公司的Q2000差示扫描量热仪,气氛为氮气,加热速度为10℃/分钟。其分析结果见图8。
对实施例1制得的鲁拉西酮与反式乌头酸的盐固体样品进行红外分析,其采用美国安捷伦科技公司的Cary 630FTIR红外光谱分析仪于室温检测,检测范围为:4000–350cm
实验实施例6:鲁拉西酮与反式乌头酸的盐与盐酸鲁拉西酮的粉末溶出速率比较
受试样品来源:鲁拉西酮原料药购买自上海佰世凯化学科技有限公司,纯度大于98%;鲁拉西酮与反式乌头酸的盐由本发明制备实施例8提供的方法制备;鲁拉西酮原料药购买自上海佰世凯化学科技有限公司,纯度大于98%。盐酸鲁拉西酮依据专利US8853395所述实施例5方法制备。
实验方法:使用100目筛网,将制备的盐酸鲁拉西酮与鲁拉西酮反式乌头酸盐进行过筛处理。准确称量20毫克盐酸鲁拉西酮,及具有相应含量的鲁拉西酮与反式乌头酸的盐约27毫克,分别加入到10毫升的溶出介质中,使用磁力搅拌器搅拌,每隔一段时间取0.1毫升溶液,经水相微孔滤膜过滤,用高效液相测定各个时间点的溶液中鲁拉西酮的浓度,最终得到两种盐的粉末溶出速率。
溶出介质:pH 2.0的甘氨酸-盐酸水溶液。
磁力转速:200转/分钟
溶出温度:37℃
取样时间:5、10、15、20、40、60、90、120分钟
实验结果:
如图13所示,相比于盐酸鲁拉西酮,本发明的鲁拉西酮与反式乌头酸的盐在pH2.0的甘氨酸-盐酸水溶液中的溶出速率得到明显改善。反式乌头酸溶出的最高浓度是盐酸盐的7倍左右。且达到平衡时反式乌头酸盐的浓度依然高于盐酸盐。
实验实施例7:盐酸鲁拉西酮以及鲁拉西酮与反式乌头酸的盐在大鼠体内的血药浓度特征
将按照本发明制备实施例8制备的鲁拉西酮与反式乌头酸的盐以及依据专利US8853395所述实施例5方法制备的盐酸鲁拉西酮,悬浮于含有1%HPMC的水溶液中。
以给药剂量为10mg/kg(以鲁拉西酮计),将两种含有盐的水溶液,分别对清洁级大鼠(N=3)胃内给药,在给药后不同时间点内抽取大鼠眼眶血,使用液质联用色谱测定鲁拉西酮含量。
测试条件:
测试仪器:液相-安捷伦1260;质谱-美国Sciex公司的三重四级杆串联质谱仪
测试参数:液相方法:Agilent Extend-C18(1.8μm,2.1×50mm);流速:0.4mL/min;进样量:1μL;柱温:40℃;检测波长:230nm;
流动相:
质谱方法:离子源:ESI;流速:500L/min;喷雾电压4.5KV;离子源温度550℃;碰撞电压:20.9V;数据采集软件为Analyst;质荷比:Q1=493.3,Q2=166.1。
如图14和表4所示,结果证明:两种盐在大鼠口服同样剂量的条件下,血液中的药物达到高峰浓度的时间相同,但鲁拉西酮与反式乌头酸的盐的血药浓度和药物半衰期明显高于盐酸鲁拉西酮的血药浓度。此外,从总体上看鲁拉西酮与反式乌头酸的盐相比于市售的盐酸鲁拉西酮药物具有更高的生物利用度。以上优势使得本发明所制备的盐相较于现有技术发明的盐酸盐在用药疗效及安全性的提升上具有突出优势。
表4盐酸鲁拉西酮与鲁拉西酮反式乌头酸盐大鼠药代动力学参数
实验实施例8:鲁拉西酮与反式乌头酸的盐与盐酸鲁拉西酮的引湿性比较
将按照本发明制备实施例8制备的鲁拉西酮与反式乌头酸的盐以及依据专利US8853395所述实施例5方法制备的盐酸鲁拉西酮,使用动态水蒸汽吸附仪,评价两种盐的引湿性。
仪器型号:Intrinsic DVS型动态水蒸汽吸附仪(英国表面测试系统仪器有限公司)
测试条件:氮气吹扫速率15mL·min
结果如下表5所示:
表5不同相对湿度条件下盐酸鲁拉西酮与鲁拉西酮反式乌头酸盐的引湿性数据
引湿性实验结果显示,本发明的盐不仅水中溶解性表现出了显著的提升,并且其引湿性并未提升,甚至在不同相对湿度下均表现出了相对于盐酸盐更低的引湿性。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 一种鲁拉西酮药物组合物和制法
- 一种鲁拉西酮药物组合物和制法
