用于获取质谱数据的方法和质谱系统
文献发布时间:2024-04-18 20:00:50
技术领域
本公开涉及用于在质荷比(m/z)范围内获取样品的质谱数据的方法。本公开还涉及用于执行这样的方法的质谱系统。
背景技术
在使用基于离子阱的质量分析器的质谱仪(诸如由Thermo Fisher Scientific
为了记录覆盖宽m/z范围的普通全扫描,源自样品的离子在阱(例如,C阱)中累积一定量的时间,然后被注入质量分析器(例如,轨道捕获质量分析器)中。累积离子的总时段(本文中称为“注入时间”)通常由自动增益控制(AGC)机制确定,该AGC机制控制C阱中的累积时间。AGC通常利用感兴趣的m/z范围的观测到的TIC以及先前扫描(例如,全扫描或短低分辨率“预扫描”)的相关联注入时间两者,但也可利用附加静电计设备来估计在离子阱中达到指定离子数(也称为AGC目标值)所必需的注入时间。与TIC本身一样,所得注入时间主要由样品中丰度最高的种类确定。考虑到注入时间同等地适用于所有样品成分并且通常来自m/z范围的所有离子同时进入离子阱,较低丰度的种类将根本不被分辨或者将在低S/N比下被检测,从而限制分析的动态范围。
先前已经描述了增大m/z范围的S/N比以及MS扫描的总动态范围的方法。WO-2006/129083描述了一种方法,该方法包括从多个选定的m/z范围顺序地注入离子,随后对离子的组合样品进行质量分析,并且使用AGC机制来实现目标离子数。
A.D.Southam等人(Anal.Chem.2007,79,4595)描述了一种增大傅里叶变换离子回旋共振(FT-ICR)质谱(特别是直接进样纳米电喷雾应用)的动态范围的方法,包括对多个相邻、重叠的m/z窗口进行连续注入和质量分析,随后拼接这些窗口以产生连续的全扫描光谱。该方法包括专用拼接算法,该专用拼接算法的主要目的在于保持或甚至提高FT-ICR质谱仪的高质量精度。
F.Meier等人(Nat.Methods 2018,15,440)描述了一种称为“BoxCar”的采集方法,并且WO-2018/134346描述了类似方法。这些公布旨在通过从全扫描m/z范围的分区顺序地注入离子并且对离子的两个或更多个组合样品执行质量分析来增大较低丰度种类的S/N以及全扫描的总动态范围,离子的两个或更多个组合样品稍后可以通过后处理算法拼接在一起以产生全扫描光谱。具体地说,宽m/z范围被划分成多个相邻、重叠的m/z窗口,该m/z窗口以交替方式被指派给两个或更多个“BoxCar扫描”(部分谱)。例如,在两个BoxCar扫描的情况下,窗口#1、#3、#5...被指派给扫描#1,窗口#2、#4、#6...被指派给扫描#2。对于每次扫描,来自所分配窗口的离子被顺序地注入,然后在质量分析器中被共同地测量。F.Meier等人聚焦于蛋白质组学应用,并且作者证明了与Q Exactive
BoxCar方法(WO-2018/134346)寻求提供一种用于替代标准全扫描而不干扰已建立的工作流(诸如蛋白质组学中的数据依赖性采集)并且不损害采集速度的方法。以如WO2006/129083中描述的通过选定的m/z范围的顺序注入和共同质量分析来复用该选定的m/z范围的基本方法为基础,BoxCar方法证明了通过获取复用的部分扫描可以有效地增大全扫描的动态范围。由于部分扫描中的每个m/z窗口具有相同的AGC目标值,因此由AGC分配的各个注入时间高度依赖于窗口中包含的种类的丰度。例如,较低丰度种类将被指派比较高丰度种类高的注入时间,从而降低高丰度种类的比例,以利于较低丰度种类,并且更好地利用可用的总离子注入时间(该总离子注入时间不像在标准全扫描中那样受丰度最高种类的限制)。
在US-8809770、US-9269553和US-9543134中已经描述了将前体m/z扫描范围分成固定或可变宽度的多个m/z窗口的想法。US-8809770使用不同的m/z选择窗口来产生碎裂谱,在该碎裂谱中搜索来自碎裂谱库的已知化合物。US-9269553和US-9543134描述了使用覆盖感兴趣的整个m/z范围的多个宽前体m/z选择窗口来获得多个碎裂谱。然而,这些文献中没有一个文献解决了通过前体的顺序注入和共同质量分析来增大前体的动态范围(MS
虽然上述方法已经引起质谱数据的采集方面的改进,但是本公开的目的是提供用于获取质谱数据的改进方法。具体地,本公开的一个目的是在获取质谱数据时获得高动态范围。
发明内容
本公开的一些实施方案涉及使用自动增益控制(AGC)机制的质谱(MS),该AGC机制确定分析物样品离子的注入时间以控制进入基于离子阱的质量分析器(例如,轨道捕获质量分析器或基于阱的飞行时间(ToF),在该ToF中离子进入阱,离子从该阱被喷射到ToF质量分析器中)的离子数。注入时间是也可以被描述为“累积时间”或“填充时间”的参数。进入基于离子阱的质量分析器的质量分析器中的离子数可以通过在计算出的时间段内填充提取离子阱来控制。离子从提取阱喷射到质量分析器中,使得离子仅可以在指定时间进入质量分析器。这个计算出的时间段是注入时间、累积时间或填充时间,并且本公开的一些实施方案涉及对确定这个参数的改进。
在本公开的一些实施方案中,扫描范围的自动划分可以用于将具有高丰度信号的m/z区域与具有低丰度信号的m/z区域分开,并且因此允许根据样品的组成来动态调整高动态范围(HDR)窗口(该HDR窗口在本文中也称为m/z子范围)。由于该方法准许动态调整,当样品的组成是高度时间依赖性的时,本文所述的方法可以是特别有利的,这可能是色谱实验中的情况。与诸如BoxCar方法的先前方法相比,可以实现动态m/z窗口的改进分配。具体地,本文所述的实施方案允许在相对短的时间尺度上对低丰度区域的动态聚焦,使得原则上可以诸如在扫描到扫描的基础上以高频率执行m/z范围的自动重新划分。
在一般意义上,本公开提供了用于在m/z范围的至少一部分内获取样品的质谱数据的方法。该方法包括:在m/z范围内接收样品的质谱数据,以及通过以下操作将m/z范围划分成一组或多组m/z子范围,每组包括一个或多个m/z子范围:将m/z范围分成多个m/z箱(bin);基于质谱数据来确定每个m/z箱的离子丰度指示;以及通过将具有对应于至少阈值程度的离子丰度的m/z箱指派给所形成的m/z子范围来形成一组或多组m/z子范围中的m/z子范围。该方法还包括针对每组m/z子范围对样品执行质量分析,从而获取一个或多个部分质谱数据集。通过基于质谱数据以这种方式划分m/z范围,可以动态地确定用于质量分析的m/z子范围。这允许快速地并且以在执行质量分析时防止非常高丰度的种类支配较低丰度的种类的方式确定多组m/z子范围。通过将m/z范围划分成箱且接着将那些箱分组在一起来划分m/z范围的这个过程可称为“聚类”。这个“聚类”的结果是被分组在一起的一个或多个m/z箱,该一个或多个m/z箱随后可以被处理以确定用于质量分析的m/z子范围。
在一些实施方案中,形成用于质量分析的m/z子范围的过程可以包括:(i)将全m/z范围分成箱(该箱可以是等距的),并且确定每个箱的TIC值(或离子丰度的其他度量,诸如信号强度的任意度量);(ii)将类似TIC量值的箱分组成不同大小的簇;以及(iii)处理簇列表以将光谱划分成m/z子范围(m/z窗口)。在每次迭代中,优选地划分全光谱范围。最终处理步骤(iii)可以涉及形成比步骤(ii)中形成的簇宽的m/z子范围。在一些场景中,在m/z子范围之间使用相对宽的重叠(与BoxCar方法相比)可以避免重新缩放在质量过滤器的侧翼区域(例如,四极杆的侧翼)中获得的峰的强度的需要。因此,在HDR实验中不需要记录伴随HDR全扫描的标准全扫描。这可以节省时间并且可以减少对后处理工作流的需要。
因此,概括地说,本公开还提供了一种用于在m/z范围的至少一部分内获取样品的质谱数据的方法,该m/z范围包括多组m/z子范围,每组包括一个或多个m/z子范围。该方法包括确定多组m/z子范围中的第一组m/z子范围(例如,用于执行第一子扫描)以及确定多组m/z子范围中的第二组m/z子范围(例如,用于执行第二子扫描),该第一组包括(至少)第一m/z子范围并且该第二组包括(至少)第二m/z子范围。该方法还包括使用具有对应于第一m/z子范围的第一响应曲线的第一质量过滤器对样品进行质量过滤以隔离第一组m/z子范围中的离子,该第一响应曲线具有相对高的透射区域和一个或多个相对低的透射区域;以及在第一组m/z子范围内对样品执行质量分析以获得第一部分质谱数据集。第一质量分析可以被描述为第一子扫描。然后,该方法包括使用具有对应于第二m/z子范围的第二响应曲线的第二质量过滤器对样品进行质量过滤以隔离第二组m/z子范围中的离子,该第二响应曲线具有相对高的透射区域和一个或多个相对低的透射区域;以及在第二组m/z子范围内对样品执行质量分析以获得第二部分质谱数据集。第二质量分析可以被描述为第二子扫描。
第一质量过滤器和第二质量过滤器可以是相同的质量过滤器或两个不同的质量过滤器。例如,第一质量过滤器和第二质量过滤器可以是两个四极杆,或者它们可以是单个四极杆。然而,可使用其他数量和类型的过滤器。在优选实施方案中,使用单个质量过滤器并执行每个子扫描。然而,在一些替代具体实现中,可使用一个仪器执行一个子扫描,可在另一仪器上执行另一子扫描,且可将所得部分光谱拼接在一起。
确定第一组m/z子范围和第二组m/z子范围的步骤包括设置第一组m/z子范围和第二组m/z子范围,使得第一响应曲线的相对高的透射区域至少部分地与第二响应曲线的相对高的透射区域重叠。第一响应曲线和第二响应曲线可以在m/z轴上彼此相邻,具有足够高的重叠度以确保高透射区域重合。通过使响应曲线的相对高的透射区域重叠,可以确保对于任何给定的m/z值,所获得的质谱数据都是从响应曲线的相对高的透射部分获得的。这意味着不需要补偿质量过滤器的响应曲线的不完美(例如,梯形)性质,因为将已经从响应曲线的低透射侧翼之外获得数据。因此,可能需要更少的数据后处理。
每组m/z子范围可以包括一个或多个m/z子范围。对于在一组m/z子范围内的每个子扫描,可以顺序地注入m/z子范围。对于注入的每个m/z子范围,优选地单独调谐质量过滤器,并且质量过滤器将具有与特定m/z子范围相关联的单独响应曲线。此外,HDR扫描可以包括多于两个子扫描。例如,可以识别两组、三组、四组或甚至更多组不同的m/z子范围。
本公开的一些实施方案提供用于调整质谱分析的注入时间的方法。例如,本公开的实施方案允许在m/z窗口之间重新分配累积的未使用的注入时间,这可以提高包含相对低丰度的离子的m/z区域中的灵敏度。具体地,当AGC算法确定超过实际可用时间的一组注入时间时,那些注入时间中的至少一些注入时间可被减少。这可以通过优先比其他注入时间更多地减少某些注入时间以保持动态范围来实现。例如,这可以通过重新分配来自m/z窗口的“备用”注入时间来实现,该m/z窗口被指派小于它们的注入时间的合理份额(例如,均等分布)的注入时间。然而,所有注入时间可以减少相等的因子。总可用注入时间可能受仪器的重复率约束,该重复率可以是用户定义的并且/或者是基于样品、实验等。例如,重复率可取决于在每个色谱(例如,液相色谱(LC))峰上需要测量的频率。因此,根据本公开的方法来调整注入时间可改善可用注入时间的利用,同时继续遵守对可用时间的约束。
因此,概括地说,本公开还提供了一种用于在m/z范围的至少一部分内获取样品的质谱数据的方法,该m/z范围包括一组一个或多个m/z子范围。该方法包括确定初始注入时间分布,该初始注入时间分布包括针对该一组一个或多个m/z子范围中的每个m/z子范围的初始注入时间。基于确定初始注入时间分布的总时间超过用于获取质谱数据的总可用注入时间,该方法确定包括针对每个m/z子范围的经调整的注入时间的经调整的注入时间分布。经调整的分布中的一个或多个经调整的注入时间可以与初始分布的对应初始注入时间相同(即相等)。即,不是每个和每一个m/z子范围的累积时间都将根据该累积时间的初始值得到调整。事实上,在本公开的实施方案中,经调整的分布的至少一个注入时间不同于初始分布的对应注入时间。
该方法然后包括根据经调整的注入时间分布对每个m/z子范围执行质量分析,以获得部分质谱数据集。确定经调整的注入时间分布包括减少针对相应m/z子范围的初始注入时间中的至少一个初始注入时间,使得针对该一组一个或多个m/z子范围的经调整的注入时间分布的总时间不大于用于获取质谱数据的总可用注入时间。
部分质谱数据集(从单独的子扫描获得的数据)可以被组合以提供覆盖全扫描范围的MS数据。因此,本公开还提供扫描拼接程序,该扫描拼接程序可用于将两个或更多个部分质谱数据集实时地转换成HDR全扫描,该HDR全扫描可像标准全扫描一样由采集后软件工具处理。因此,可以减少或避免附加的、潜在耗时的后处理步骤。在拼接程序中,两个相邻m/z子范围在它们的重叠区域处拼接在一起,当使用本文所述的HDR方法获得时,这两个相邻m/z子范围源自单独的部分质谱数据集。这个重叠区域内的拼接边界可以是可变的,并且可以被优化以保持出现在两个窗口的边界区域中的同位素分布。
本公开还提供一种混合方法。该混合方法涉及获得m/z范围的标准全扫描以及包括选定的非重叠m/z子范围的单个(或少量)HDR“缩放”扫描。标准全扫描可用作定量的参考点。在一些情况下,标准全扫描本身可以为高丰度峰提供足够的信息。HDR“缩放”扫描可以提供对全扫描的稀疏区域或特别感兴趣的区域的更深入的洞察。标准全扫描中的这些区域可以用来自HDR子扫描(或多个子扫描)的对应m/z窗口替代,以获得混合HDR全扫描。如果这个混合HDR工作流包括两个扫描事件,则扫描速率性能可以与使用两个HDR子扫描的方法相当。
因此,在一般意义上,本公开还提供了一种用于在m/z范围内获取样品的质谱数据的方法,包括:在m/z范围内对样品执行第一质量分析,从而获取第一质谱数据集;以及将m/z范围划分成一组或多组m/z子范围,每组包括一个或多个m/z子范围;以及针对每组m/z子范围对样品执行质量分析,从而获取一个或多个部分质谱数据集。因此,第一质谱数据集可以在全m/z范围内提供关于样品的信息,而一个或多个部分质谱数据集可充当针对全m/z范围的特定子范围的“放大”扫描。可以基于第一质谱数据集如上所述地执行划分。还可以基于(例如,从对同一样品执行的较早扫描获得的)较早的质谱数据集执行划分。可以将第一质谱数据集和一个或多个部分质谱数据集拼接在一起,以提供有效地作为单个全扫描的增强版本的质谱数据集。
通过下面的详细描述,上述优点和其他优点将变得明显。
附图说明
现在将参考附图通过举例的方式描述本公开,在附图中:
图1A示出了用于获取质谱数据的方法;
图1B示出了用于划分扫描范围的方法;
图2示出了四极杆透射侧翼的宽度与隔离宽度之间的关系;
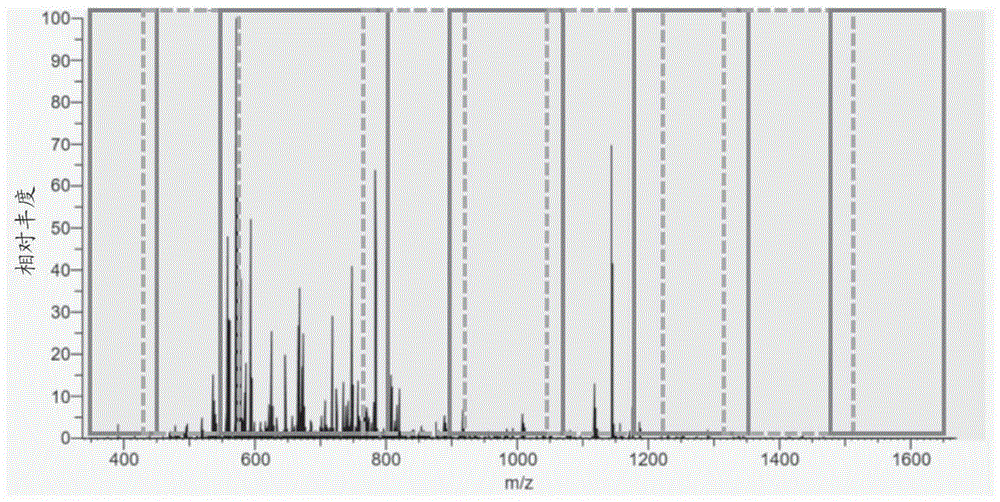
图3A至图3G示出了划分m/z范围的方法的示例;
图4A示意性地示出了四极杆透射侧翼;
图4B示出了m/z子范围的一组响应曲线;并且
图5示意性地示出了用于实施本文所述的方法的质谱系统。
具体实施方式
诸如BoxCar方法的现有方法代表有效地增大全扫描的动态范围和信噪比的基本方法。然而,已知系统通常不提供用于产生连续全扫描谱的完整在线(即,限于MS仪器)工作流,并且可能需要在实际数据采集之前进行后处理软件和/或校准工作以获得全扫描谱(与部分谱相对)。相比之下,本公开的实施方案可用于实施能够针对多种应用产生高动态范围全扫描的综合在线工作流,而无需针对每个应用个别地校准。这不仅可以节省用户时间,而且还可以考虑被设计成在全扫描上操作的算法而允许全扫描的进一步在线分析。
与标准全扫描相比,本文所述的高动态范围(HDR)扫描方法提供了记录和处理具有改进的动态范围的全MS扫描的改进方法。HDR扫描处理器实施算法步骤以(a)通过分析全光谱并将具有高信号的m/z区域与具有低信号的m/z区域隔离开来建立HDR扫描,(b)通过扩展AGC来充分利用可用样品注入时间,并且(c)将HDR扫描部分拼接在一起,该HDR扫描部分各自包括隔离的m/z区域的子集。所得到的扫描是可以用作标准全扫描的替代的HDR全扫描光谱。本文所述的方法与已建立的质谱系统和工作流相容,从而减少对附加预处理校准步骤和后处理重新缩放或拼接步骤的需要。
本文所述的HDR方法特别有利的场景是在具有低样品负荷的实验中,特别是单细胞蛋白质组学。已知的一组丰度最高的1000种-3000种蛋白质可以仅通过HDR扫描来完全分析,而不需要分离的前体的任何专用MS
与标准全扫描相比,除了增大的动态范围之外,HDR全扫描还允许更好地预测MS
因此,本公开还提供了一种基于MS
关于多个前体m/z窗口的使用,已知方法(诸如在US-8809770、US-9269553和US-9543134中描述的那些方法)采用选择m/z窗口来增强碎裂(MS
更具体地说,现有的解决方案具有以下限制:
●
●
●
为了解决上面概述的现有解决方案的限制并且因此创建整体HDR扫描工作流,本公开提出对原始“BoxCar”方法的各种扩展。在图1A中,示出了图示执行HDR扫描的一般概念的流程图。具体地,图1A示出了高动态范围(HDR)扫描的基本工作流。子扫描步骤的记录顺序(#i、#M+i、#2xM+i…)类似于WO-2018/134346的图1A中所示的BoxCar顺序。
扫描范围的自动划分
本公开的实施方案基于全m/z范围内的TIC分布自动地将感兴趣的扫描范围划分成多个m/z子范围,这允许选择可变位置和宽度的m/z子范围,并且使这些m/z子范围动态地适应样品的时间依赖性组成。本公开提供一种将给定m/z范围划分成一组m/z子范围的算法,该m/z子范围通常是重叠的,且接着可用于在两个或更多个复用子扫描(部分扫描)中依序从这些m/z子范围注入离子,如图1A所示。HDR算法接受以下输入参数:
表1
该算法提供了用于在m/z范围的至少一部分内获取样品的质谱数据的方法。该方法开始于在m/z范围内接收样品的质谱数据。首先,该算法将(全扫描范围)质谱(FM至LM)分成大小为min_width/2的m/z箱,并将TIC计算为每个箱的峰强度之和。以最高TIC箱开始且以TIC值的降序进行,将具有类似量值的TIC的相邻箱聚类在一起。划分程序的目的是将高强度区域与低强度区域分开,从而可以花费更多的(注入)时间来阐明低强度区域。因此,概括地说,该方法将m/z范围划分成一组或多组m/z子范围,每组包括一个或多个m/z子范围。通过以下操作来实现划分:将m/z范围分成多个m/z箱;基于质谱数据来确定每个m/z箱的离子丰度指示;以及通过将具有对应于至少阈值程度的离子丰度的m/z箱指派给所形成的m/z子范围来形成一组或多组m/z子范围中的m/z子范围。
具体地,划分m/z范围可以包括:(i)识别多个m/z箱中的初始m/z箱(例如,具有最高离子丰度);(ii)确定与初始m/z箱相邻(直接相邻,或可选地具有不直接相邻的一个或多个中间箱)的一个或多个m/z箱的离子丰度在至少阈值程度上对应于初始m/z箱的离子丰度;以及(iii)将初始m/z箱和与初始m/z箱相邻的一个或多个m/z箱指派给所形成的m/z子范围。
这个过程可以形成具有对应离子丰度的m/z箱的簇。一旦针对第一簇完成这个过程,就可以在m/z范围的剩余部分上迭代该过程以形成多个不同的簇。可以将多个不同的簇存储为簇列表L。因此,该方法可以还包括形成所形成的m/z子范围的补数。所形成的m/z子范围的补数是全m/z范围的排除所形成的m/z子范围的m/z值的集合。即,如果m/z范围从m/z
在该算法中,使用当前处理的箱的TIC的一半的阈值T(T=0.5×start_tic),这意味着具有TIC≥T的所有相邻箱将被添加到簇。即,在m/z箱之间可以存在阈值对应程度,该阈值对应程度是较低丰度的m/z箱的离子丰度(该离子丰度可以从例如总离子流推断)与较高丰度的m/z箱的离子丰度的预定义比率。这个预定义比率优选地至少为0.5,以确保获得可接受程度的对应。
此外,不超过T但位于两个相容箱之间的单个箱也被添加到簇,以便避免将光谱过度划分成不满足最小宽度要求的子范围。具体地,本文所述的方法可以有利地包括确定第一m/z箱和第二m/z箱具有对应于至少阈值程度的离子丰度;确定第一m/z箱与第二m/z箱之间(例如,直接在第一m/z箱与第二m/z箱之间)的第三m/z箱的离子丰度不在至少阈值程度上与第一m/z箱和第二m/z箱的离子丰度对应;以及将第一m/z箱、第二m/z箱和第三m/z箱指派给单个m/z子范围。
使用半宽而不是箱大小的全最小宽度min_width的原因是半宽增加了关于聚类步骤的灵活性,因为在当前处理的箱的任一侧上的类似TIC量值的箱可以被添加到簇以达到最小宽度。如果簇没有达到最小宽度(即,仅包括一个箱),则在任一侧将该簇对称地扩展min_width/4,或者通过使用箱的强度加权m/z质心并扩展总共min_width/4将该簇非对称地扩展。
也可以使用其他箱大小(min_width/N,N=整数≥1)。整数2是优选的,以在将相邻箱聚类在一起时提供更大灵活性(即,在左侧或右侧接合相邻箱),同时防止光谱的过度划分,该过度划分将导致不满足min_width要求的许多窗口。多个m/z箱中的每个m/z箱可具有可由用户配置的宽度;并且/或者多个m/z箱中的每个m/z箱具有(例如,由用户)预定义最小宽度的一半的宽度。
图1B示出如何处理一组簇。在从最高TIC簇开始并以TIC值的降序进行的情况下,使用列表L中的多个可用簇来将(全)扫描范围划分成多个m/z子范围,主要旨在将高TIC m/z区域与其中信号稀疏的那些区域分开。当选择TIC簇并计算划分的扫描范围时,选定的簇被存储在列表S中,并且覆盖整个扫描范围的一组划分的m/z子范围被存储在列表P中。在每次迭代中,从L中选择来自列表L的不与S中的现有簇重叠的新簇,并将该新簇添加到S。S中的簇以m/z的升序被迭代地处理,以(重新)划分扫描范围。因此,每当S被新簇扩展时,就重新生成m/z子范围的列表P。
在每次迭代中,簇向P添加至少一个且至多三个子范围(包括簇本身):如果簇与一个或两个现有边界相切,即,该簇在P或FM或LM中的现有子范围处开始和/或结束,则将一个(如果与两个边界相切)或两个(如果与一个边界相切)子范围添加到P。如果簇不与现有边界相切,则添加三个子范围,因为需要两个补数窗口以及簇本身来覆盖全m/z扫描范围。
即,在(如前所述,基于m/z箱的TIC)建立了簇列表L之后,该算法从L中选择最高TIC簇,并将该最高TIC簇添加到选定的簇列表S(该列表在第一次迭代中将仅包括一个簇)。然后,通过以m/z的升序处理聚类,仅使用S中的聚类(即,首先仅一个聚类,但是在后续迭代中将包括另外的聚类)来执行(重新)划分的步骤,以产生划分的扫描范围P。根据在每次迭代中,簇添加至少一个且至多三个子范围(三个子范围的最大值仅可添加一次)的原理,则如果单个簇在扫描范围的中间某处(即,簇不与全扫描范围的上限或下限重合),则P的第一版本将包括三个m/z窗口,即n=3。
然后,如果期望多于3个窗口(n 除了图1B所示的那些标准之外,还可以应用其他标准。举例来说,图1B中未示出且可在划分程序之后应用的一个标准如下:窗口的数量n必须等于或高于HDR子扫描的数量(否则,无法进行HDR采集)。如果不满足这个标准,则可以例如以用于聚类类似TIC量值的m/z箱的增大的阈值(例如,将阈值从0.5增大到0.75或0.9)重复划分程序,从而尝试执行更高数量的单独的簇。 列表L、S和P中的m/z子范围(该m/z子范围用于划分m/z范围)有时被称为初步子范围。在划分全m/z范围的过程中使用的任何m/z子范围都可以被描述为初步m/z子范围。在一些情况下,初步子范围可以与最终m/z子范围相同。然而,在一些情况下,可基于以上算法确定初步m/z子范围,并且接着可在形成将用于质量分析的m/z子范围的最终集合之前调整初步m/z子范围。 如上所述,在本文所述的划分程序中,可从m/z箱的单个簇形成多达三个m/z子范围。概括地说,基于相应初步m/z子范围(例如,列表S中的子范围)来形成一组或多组m/z子范围中的一个或多个m/z子范围可以包括:将相应初步m/z子范围指派给一组或多组m/z子范围;以及向一组或多组m/z子范围指派与相应初步m/z子范围相邻(例如在任一侧毗连)的一个或两个m/z子范围,其中与相应初步m/z子范围相邻的一个或两个m/z子范围中的每个m/z子范围从相应初步m/z子范围的一端延伸到另一初步m/z子范围的一端。这个过程可用于提供跨越m/z范围同时将高丰度区域与低丰度区域分开的m/z子范围的列表。优选地,该方法还包括增大一个或两个m/z子范围中的与相应初步m/z子范围相邻的一个m/z子范围中的至少一个m/z子范围的宽度。这可以确保获得重叠的m/z子范围,如下面进一步详细讨论的。 在划分过程中,优选地自动调整m/z子范围大小以考虑期望的子范围重叠,这通常通过线性关系overlap_offset+overlap_factor×window_width来计算。本质上,最初,形成不重叠的簇,然后这个步骤确定在先前步骤中发现的不重叠簇的期望重叠程度。当m/z子范围被添加到列表时,算法决定是调整当前m/z子范围还是前一m/z子范围(即,左侧的相邻m/z子范围): ●如果两个子范围具有相同的大小,则(通过减小当前子范围的下边界或者通过增大前一子范围的上边界)调整具有较高TIC的子范围。 ●如果当前子范围大于前一子范围,则使用针对当前子范围计算出的重叠来调整(增大)前一子范围的上边界。 ●如果前一子范围大于当前子范围,则使用针对前一子范围计算出的重叠来调整(减小)当前子范围的下边界。 划分过程可描述为最初包括以下步骤:将具有对应于至少阈值程度的离子丰度的m/z箱指派给第一初步m/z子范围(例如,初始簇),且将具有对应于至少阈值程度的离子丰度的m/z箱指派给第二初步m/z子范围(例如,第二簇)。该方法然后可以包括确定第一初步m/z子范围与第二初步m/z子范围重叠,并且丢弃第二初步m/z子范围而不将相应m/z箱指派给一组或多组m/z子范围中的m/z子范围。这确保获得不重叠的初步m/z子范围。然后可以如上所述处理这些不重叠的初步m/z子范围以获得期望重叠程度。 本公开的方法可以包括指派初始m/z箱和与初始m/z箱相邻的一个或多个m/z箱以形成第一初步m/z子范围。形成m/z子范围可以包括以下操作中的至少一个操作:通过增大第一初步m/z子范围的宽度来形成m/z子范围;通过增大与第一初步m/z子范围相邻的第二初步m/z子范围的宽度来形成m/z子范围。这个程序可以确保重叠窗口由最初不重叠的窗口形成。 该方法可以包括确定第一初步m/z子范围和与第一初步m/z子范围相邻的第二初步m/z子范围具有相同的宽度;确定第一初步m/z子范围和第二初步m/z子范围中的哪一者与更高离子丰度相关联(例如,基于TIC);以及增大第一初步m/z子范围和第二初步m/z子范围中与更高离子丰度相关联的一者的宽度。可以执行增大初步m/z子范围中的至少一个m/z子范围的宽度,以使得所形成的m/z子范围至少部分地重叠。例如,由于m/z子范围在不同组m/z子范围之间分布的方式,第一组m/z子范围中的一个m/z子范围可以至少部分地与不同组m/z子范围中的另一个m/z子范围重叠。 本公开的方法可以还包括:基于确定第一初步m/z子范围比第二初步m/z子范围宽,增大第二初步m/z子范围的宽度。替代地,基于确定第一初步m/z子范围比第二初步m/z子范围窄,可增大初步m/z子范围的宽度。这可以帮助确保所形成的子范围具有允许有效采集质谱数据的宽度。 形成一组或多组m/z子范围中的m/z子范围可以包括:通过将具有对应于至少阈值程度的离子丰度的m/z箱指派给相应初步m/z子范围来形成一个或多个初步m/z子范围;以及基于相应初步m/z子范围来形成一组或多组m/z子范围中的一个或多个m/z子范围。初步m/z子范围还可描述为m/z箱的簇。以此方式,可形成具有类似离子丰度的m/z箱的簇且随后用于形成m/z子范围。 在任何情况下,第一初步m/z子范围和第二初步m/z子范围可以有利地重叠一定量,该量:包括与第一初步m/z子范围或第二初步m/z子范围的宽度成比例的偏移;并且/或者包括恒定偏移。例如,可以使用线性关系overlap_offset+overlap_factor×window_width,或者也可以使用这个关系的一些变型。 考虑一对相邻子范围,另一选项将是总是独立于实际子范围宽度来调整较高TIC子范围的大小,以便确保较低TIC子范围不包括来自与较高TIC子范围共享的重叠区域的任何高强度信号,这将减小动态范围。然而,当重叠随着子范围宽度而增加时,宽的高TIC子范围的所得重叠可超过相邻的较窄的低TIC子范围的宽度且甚至与下下个子范围重叠。这将有悖于在每个HDR子扫描中使用非重叠子范围的概念。应当避免在单次扫描中重叠的m/z子范围,因为重叠区域接着被两次注入到分析仪中,这使峰强度失真并且使信号处理复杂化。由于重叠宽度取决于窗口大小(如果overlap_factor>0),所以针对大窗口计算出的重叠实际上可能超过相邻的较小窗口的宽度,并且甚至延伸到下下个窗口中,这将使HDR工作流复杂化。例如,考虑窗口ABCD,在A的重叠延伸到C中的情况下,覆盖A和C的子扫描将不满足非重叠窗口的要求。 此外,高TIC子范围通常比低TIC子范围窄。因此,基于上面概述的大小的调整通常与保持较低TIC子范围的动态范围的目的一致。 当表征过滤器的透射曲线时,阈值的95%可以适于限定高透射区域。可以使用表征响应曲线的其他方式。例如,第一响应曲线和/或第二响应曲线的相对高的透射区域可以是具有至少90%的离子透射、至少95%的离子透射或至少99%的离子透射的区域。 在实践中,可以通过首先记录给定m/z范围内的一组透射曲线并使用多个隔离宽度,然后将梯形函数拟合到原始数据来确定侧翼参数。这可用于直接产生侧翼宽度,而无需应用预定义高透射阈值。在任何情况下,每个响应曲线优选地是大致梯形的,并且可以在多个相对低的透射区域之间具有相对高的透射区域(例如,在高透射区域的任一侧的两个低透射流)。例如,确定第一组m/z子范围和第二组m/z子范围可以包括:基于使用第一质量过滤器和第二质量过滤器获得的质谱数据来确定第一响应曲线的第一梯形拟合和第二响应曲线的第二梯形拟合;以及基于第一梯形拟合和第二梯形拟合来确定第一响应曲线的相对高的透射区域和第二响应曲线的相对高的透射区域。 一旦包括所有重叠的子范围的精确m/z边界以及最终子范围宽度已知,则低透射侧翼的宽度可以被计算为lt_width=lt_offset+lt_factor×final_window_width。对于在仪器中采用的四极杆模型,这些参数可以容易地预先确定,然后在软件中硬编码。然而,如果这些参数的个体(样品间)变化太高,则该参数也可以针对每个仪器被单独地校准(在制造期间或者在由客户运行的常规系统校准期间)。 为了避免需要重新缩放位于四极杆低透射侧翼中的峰的强度,子范围重叠应显著大于侧翼区域。然后,在拼接程序中,子范围的侧翼区域中的峰可以从相邻子范围的对应的高透射区域获得。例如,重叠参数(偏移和因子)可以是5Th和15%,并且低透射参数可以是1Th和4%。对于100Th的子范围大小,这将导致20Th的重叠和5Th的低透射宽度。图1A示出了四极杆侧翼宽度的示例,该四极杆侧翼宽可以由具有良好质量的参数lt_offset 1Da andlt_factor 4%来描述。具体地,图1A示出了依赖于隔离子范围宽度的四极杆隔离轮廓侧翼的宽度。 如表达式lt_width=lt_offset+lt_factor×final_window_width所指示的,确定第一组m/z子范围和第二组m/z子范围可以包括基于第一响应曲线和/或第二响应曲线中的至少一者的宽度来确定第一响应曲线和第二响应曲线的重叠程度。例如,可以考虑相对低的透射区域的宽度。使用梯形侧翼的宽度典型地随着隔离宽度而增大的事实来设置重叠程度可以确保来自响应曲线的高透射区域的数据总是可用的。具体地,第一响应曲线的相对高的透射区域优选地与第二响应曲线的相对高的透射区域重叠的量大于:第一响应曲线的相对低的透射区域的宽度;和/或第二响应曲线的相对低的透射区域的宽度。 如上所述的m/z扫描范围的自动划分可以在样品分析开始时(例如,当样品组成在分析过程中没有显著变化时)执行一次。替代地,可在分析期间以规则间隔执行划分,这取决于样品组成随时间变化有多快。还可以在每次HDR扫描之后执行该程序。 例如,该方法可以包括将m/z范围划分成多个第一组m/z子范围,每个第一组包括一个或多个m/z子范围;针对每个第一组m/z子范围对样品执行第一质量分析,从而获取多个第一部分质谱数据集;基于由多个第一部分质谱数据集指示的离子丰度,将m/z范围划分成多个第二组m/z子范围,每个第二组包括一个或多个m/z子范围;以及针对每个第二组m/z子范围对样品执行第二质量分析,从而获取多个第二部分质谱数据集。在实验期间可以根据需要多次重复自动划分。例如,如果样品具有时间依赖性组成,则在某一时间段已经过去之后,曾经执行的划分对于样品可能不是最佳的。因此,可基于先前扫描的离子丰度在多个不同时间重复本公开的划分方法。 在本公开的实施方案中,可存在在m/z范围内对样品执行初步质量分析(例如,标准全MS 如图1A所示,将m/z范围划分成一组或多组m/z子范围包括优选地包括形成M组m/z子范围,每组m/z子范围包括W个m/z子范围。在这个具体实现中,按照m/z的顺序对m/z子范围进行编号(例如,按照m/z的递增顺序,但该m/z子范围也可以按照m/z的递减顺序)。对于i=1...M的每个值,第i组m/z子范围包括m/z子范围编号i、M+i、2M+i...(W-1)M+i。这种将m/z子范围分配给子扫描的方式有助于确保可在全m/z范围内实现高动态范围。应当理解,m/z子范围的总数可能不能被M和W完全除尽。例如,如果M=3且W=3(即MxW=9),但需要10个子范围,则一组m/z子范围可以包括附加的(即4个)m/z子范围。在子范围的总数不能被M和/或W除尽的情况下,可以使用用于将m/z子范围分配给不同组的相同方案(即i、M+i、2M+i...(W-1)M+i),其中将另外的m/z子范围简单地添加到(至少)一个组。 在一些实施方案中,m/z子范围可以被分配给子扫描,使得例如每个子扫描取得低强度和高强度m/z子范围的大致相等的份额。 在一些替代示例中,相应组中的每个m/z子范围的离子丰度可在至少阈值程度上对应于所形成的m/z子范围的离子丰度。这可能意味着对相应一组m/z子范围执行的子扫描不可能对非常高和非常低丰度离子的混合物执行。例如,划分m/z范围可以包括以下各项中的任一项或多项:将与样品中相对高的离子丰度相关联的一个或多个m/z子范围指派给一组或多组m/z子范围中的第一组m/z子范围;和/或将与样品中相对低的离子丰度相关联的一个或多个m/z子范围指派给一组或多组m/z子范围中的第二组m/z子范围;和/或将与样品中的中间离子丰度相关联的一个或多个m/z子范围指派给一组或多组m/z子范围中的第三组m/z子范围。每组m/z子范围可以包括具有对应于至少阈值程度(例如,某一预定义百分比)的离子丰度的m/z子范围,该m/z子范围可由诸如预扫描或先前HDR扫描的初步质谱数据集指示。 等距子范围 作为自动划分的替代方案,可以将从FM到LM的扫描范围划分成N个等距子范围(也称为窗口)。子范围或窗口宽度由下式计算: 子范围重叠的大小由overlap_size=overlap_offset+overlap_factor×window_width给出。考虑到重叠,m/z子范围的下边界由FM+(i–1)×(window_size–overlap_size)给出,其中i是子范围索引(i=1...N)。 定制子范围 由于注入到MS的样品的组成以及因此有价值的质量范围在由色谱支持的蛋白质组学实验期间通常随时间改变,因此允许用户定义多组时间依赖性m/z子范围或在感兴趣的m/z区域以线性方式改变的情况下定义“m/z梯度”可为有利的。然后仪器可以基于实验的保留时间(RT)选择该组子范围。 定制子范围的另一应用是当对于从一个LC运行到另一LC运行的结果的定量(例如,对于无标记定量)可能存在严格要求时。在这种情况下,允许仪器动态地调整子范围可以在同一研究的两次LC运行之间的峰强度比较中产生差异。这是因为动态创建的不同m/z子范围设置可以改变离子强度,并且引入由HDR方法(即简单地由仪器)引起的而不是由在两个LC运行中分析的样品之间的化学/生物差异引起的强度变化。为了避免这种影响,基于单个样品或样品混合物的第一参考LC运行可以完全动态地进行(如以上关于自动划分所描述的),以优化HDR/LC/MS方法。之后,对于所有测量,当测量感兴趣的实际样品时,可以将固定的一组定制m/z子范围和LC保留时间用于所有进一步的运行。 因此,一些实施方案包括从色谱仪(诸如液相色谱或气相色谱)接收样品。该方法可以包括对从色谱仪获得的一个或多个样品重复本文所述的方法(例如,划分和扫描)一次或多次,以获得样品的时间依赖性质谱数据。 子范围的定制、等距和/或自动划分的组合 可以在一次LC运行中同时使用两种或所有三种m/z子范围划分方法中的任一种方法。例如,基于关于样品的先验知识或者在HDR/LC/MS方法优化期间获得的知识,可以应用定制子范围以覆盖期望的m/z和/或RT范围。但是在这些已知范围之外,仍然可以以自动划分模式进行测量。这样,获得了在一次LC/MS扫描中以及甚至在一些MS扫描中的定制和自动划分子范围算法的组合。实际上,可以确保测量产生感兴趣的峰(目标模式)的数据,并且同时改善测量的整体动态范围,这对于标准数据处理或对于随后的回顾分析来说可能是感兴趣的。 自动划分的样例 如前所述,HDR扫描将扫描范围划分成一组重叠的m/z窗口或子范围,然后测量非重叠窗口的至少2个子集以获得至少2个单独的子扫描,并将子扫描拼接在一起以获得HDR全扫描。关于将m/z窗口分配给子扫描,可以考虑例如已经被划分成任意大小的12个m/z窗口(表示为A-L)的扫描范围,以及这些窗口将如何被分配给可用子扫描(在以下示例中为2个或3个): 窗口:ABCDEFGHIJKL 1)两个子扫描: 子扫描#1:ACEGIK 子扫描#2:BDFHJL 2)三个子扫描: 子扫描#1:ADGJ 子扫描#2:BEHK 子扫描#3:CFIL 在优选实施方案中,划分过程(即,如何获得示例中的窗口A-L)包括以下基本步骤: 1)将扫描范围划分成等距箱(优选宽度是最小窗口宽度的一半)并计算该等距箱的TIC。 2)对类似TIC量值的箱进行聚类以形成TIC簇。 3)将TIC簇迭代地转换成整个扫描范围的分区,以簇TIC的降序进行,直到已经达到期望数量的窗口。 示例:扫描范围m/z 100-1000 1)处理簇m/z 200-300(不与现有边界相切)(C=从选定的簇产生的窗口,F=补充以填充整个扫描范围的窗口): a.窗口#1:100-200(F) b.窗口#2:200-300(C) c.窗口#3:300-1000(F) 2)处理簇m/z 100-150(与扫描范围的下端相切): a.窗口#1:100-150(C) b.窗口#2:150-200(F) c.窗口#3:200-300(C) d.窗口#4:300-1000(F) 3)处理簇m/z 750-770(不与现有边界相切): a.窗口#1:100-150(C) b.窗口#2:150-200(F) c.窗口#3:200-300(C) d.窗口#5:300-750(F) e.窗口#6:750-770(C) f.窗口#7:770-1000(F) 4)处理簇m/z 280-320:与窗口#3重叠,跳过簇 5)… 这个程序独立于m/z窗口到子扫描的分配。考虑到诸如最小窗口宽度和期望窗口数量(总数量或每子扫描)的参数,该程序试图优化窗口大小以便基于TIC图案来隔离m/z区域。这些参数可以是用户定义的。一旦确定了窗口,计算重叠和四极杆透射侧翼(两者都由绝对m/z宽度和窗口宽度的缩放因子给出)可以如下面进一步详细描述的那样进行。 图3A至图3G示出了针对实际质谱数据自动划分m/z范围的过程的示例,该过程可以使用图1A和图1B中示出的方法来执行。图3A示出了示例性HeLa光谱,扫描范围m/z 350-1650,被划分成大小为50Th(对应于100Th的最小窗口宽度)的26个箱。如图3B所示,在确定每个箱的TIC值之后,将类似TIC量值的箱聚类在一起,以m/z 550-600处的最高TIC箱开始。m/z 600与800之间的四个相邻箱相加以形成范围从m/z 550到800的第一簇。所得的TIC簇按照它们的TIC值以降序排序。前10个簇在图3C中被标记(1=最高TIC簇)。 如图3D所示,划分程序以m/z 550-800处的最高TIC簇开始(该最高TIC簇在实边界内描绘)。为了完全覆盖整个扫描范围,两个窗口被补充(以虚线示出),从而产生三个窗口,m/z 350-550、m/z 550-800和m/z800-1650。在图3E中,第二簇(m/z 800-900)与第一簇相邻,从而产生四个m/z窗口。相应地调整右侧补数窗口的尺寸(m/z 900-1650)。在图3F中,第三簇(m/z 1100-1150)被延伸以满足100Th的所需最小宽度,从而产生m/z 1087.5-1187.5。由于该第三簇不与任何现有簇窗口的边界相切,因此添加m/z 900-1087.5处的第三补数窗口,从而产生六个窗口。该过程迭代地重复。 在图3G中,示出了完全划分的光谱,该光谱包括9个重叠的m/z窗口(5个簇窗口和4个补数窗口)。可以在划分程序期间或之后计算窗口重叠。在第一HDR子扫描中测量在实边界内描绘的窗口,而在第二HDR子扫描中测量在虚边界内描绘的窗口。第一HDR子扫描将提供第一组m/z子范围的部分质谱数据集,并且第二HDR子扫描将提供第二组m/z子范围的部分质谱数据集。 在本公开的优选实施方案中,m/z窗口可以适应样品的时间依赖性组成。例如,在第一HDR周期中,划分可以是基于标准(非HDR)全扫描,如图3所示。之后,可以使用先前的HDR扫描作为后续划分的基础,但可以使用标准(即,不是HDR扫描)。 AGC改进 1)注入时间的重新分配 为了克服可用的最大注入时间(最大IT)可能未被充分利用的问题,利用重新分配功能性来增强现有系统的AGC算法。注入时间的重新分配在注入时间的常规确定之后进行,并且可以以不干扰在Exploris 首先,计算m/z子范围的注入时间,而不强加任何上限以确保最大IT被所有子范围充分利用。即,该方法开始于确定初始注入时间分布,该初始注入时间分布包括针对该一组一个或多个m/z子范围中的每个m/z子范围的初始注入时间。一旦AGC已经基于先前的分析扫描或AGC预扫描确定了m/z子范围的注入时间,总注入时间就被计算为子范围的各个注入时间之和。如果和超过总最大IT,则注入时间被重新分配如下: 1.确定对应于可用于扫描的总最大IT的均等分布的注入时间: equal_IT=overall_max_IT/N 2.计算超过equal_IT的那些注入时间与作为减去低于或等于equal_IT的那些注入时间之后的剩余总注入时间的sum_remaining (sum_remaining≤overall_max_IT)的和sum_exceeding。 3.以升序对超过equal_IT的注入时间进行排序。 4.从步骤3开始处理排序的注入时间,从最低值开始: a.从当前分配的时间old_IT计算新的注入时间: b.将sum_overning变量减小old_IT。 c.将sum_remaining变量减小new_IT。 因此,该方法包括基于确定初始注入时间分布的总时间超过用于获取质谱数据的总可用注入时间来确定包括针对每个m/z子范围的经调整的注入时间的经调整的注入时间分布。确定经调整的注入时间分布可以包括使一个或多个相对长的初始注入时间比一个或多个相对短的初始注入时间在更大程度上减少。例如,较长初始注入时间可优先减少较大程度。 在上面概述的重新分配算法中,equal_IT充当阈值。步骤4a基于阈值equal_IT使用动态因子来针对某些子范围调整m/z子范围的当前分配的注入时间。以升序处理注入时间确保了较低注入时间不被减少超过equal_IT,并且最终的和不超过overall_max_IT。 作为示例,考虑具有N=10个子范围和100ms的总最大IT的HDR实验,产生10ms的均匀分配的注入时间,如表2所示。表1示出了来自现有AGC算法的针对10个m/z子范围的以ms为单位的注入时间(IT)(“旧IT”)以及从重新分配算法导出的IT值(“新IT”)。 表2 在用于初始AGC计算的每个子范围的最大IT设置为100ms的情况下,AGC为5个子范围指派≤10ms的注入时间,而剩余的5个子范围超过相等的注入时间(>10ms)。然后80.9ms的剩余时间(即,从100ms减去0.1ms、1、3ms、5ms和10ms)被重新分配到超过相等设置的5个子范围(#6-#10)。使用上述步骤4a-4c,首先将注入时间#6减小到10ms,然后将注入时间#7减小到约11ms...最后将注入时间#10减小到约23ms,产生100ms的总注入时间。因此,来自子范围#1至#4的未使用注入时间可以被分配到5个子范围中的4个子范围(#7至#10)。可以看出,几个经调整的注入时间(新IT)与初始注入时间(旧IT)相同。具体地说,经调整的注入时间分布包括与初始分布中的值不变的若干注入时间(#1-#5)。 因此,可以看出,确定经调整的注入时间分布包括减少针对相应m/z子范围的初始注入时间中的至少一个初始注入时间,使得针对一组一个或多个m/z子范围的经调整的注入时间分布的总时间不大于用于获取质谱数据的总可用注入时间。在这种情况下,针对子范围#6-#10的注入时间被减少。最长初始注入时间被减少到它们的初始值的大约22.51%,而窗口#6被减少到它的初始值的40%并且窗口#1-#15根本没有被减少。因此,可以使相对长的初始注入时间比一个或多个相对短的初始注入时间在更大程度上(例如,在绝对值方面,或在百分比方面)减少。 确定经调整的注入时间分布可以包括减少超过阈值注入时间的至少一个初始注入时间,并且可选地包括减少超过阈值注入时间的每个初始注入时间。在一些实施方案中,该方法包括将超过阈值注入时间的多个(例如,每个)初始注入时间减少缩放因子(该缩放因子可以是静态缩放因子,或者该缩放因子可以是诸如在上述算法的步骤4中迭代地计算出的动态缩放因子)。为了避免将相对短的注入时间减少太多,本公开的方法可以包括将阈值注入时间设置为针对每个m/z子范围的经调整的注入时间,对于该m/z子范围,减少缩放因子的初始注入时间小于阈值注入时间。 确定经调整的注入时间分布可以包括:对于初始注入时间小于阈值注入时间的每个m/z子范围,通过对初始注入时间与阈值注入时间之间的差求和来确定总备用注入时间;以及通过分配所述总备用注入,设置针对初始注入时间大于阈值注入时间的一个或多个m/z子范围的经调整的注入时间,从而增加针对初始注入时间大于阈值注入时间的一个或多个(例如,一些或每个)m/z子范围的初始注入时间。因此,可以实现“备用”注入时间的有效重新分配。阈值注入时间等于在一个或多个m/z子范围之间等分的总可用注入时间(equal_IT)。 作为上述分配方法的替代方案,由AGC计算出的注入时间可以简单地利用由总最大IT与计算出的注入时间之和的比率给出的缩放因子来同等地缩放。在表2中概述的示例中,缩放因子将是100/369.1=27%,因此子范围#1和#10将分别被指派0.027ms和27ms。为了防止缩放因子由非常高的注入时间支配,可以将上限应用于计算出的注入时间。因此,确定经调整的注入时间分布可以包括减少针对每个相应m/z子范围的初始注入时间。确定经调整的注入时间分布可以包括将针对每个相应m/z子范围的初始注入时间减少缩放因子(例如,全部减少相同的缩放因子,或者可以使用不同的缩放因子)。 此外,对于后处理分析比其他光谱区更感兴趣的那些光谱区中的m/z子范围可以是优选的,并且给出更高的注入时间(或AGC目标,见下文)。当(重新)分配AGC目标和/或注入时间时,这样的优先区域可以由用户预先指定并且由仪器考虑。 因此,该方法可以包括接收m/z子范围是感兴趣的m/z子范围的指示(该指示可以是用户输入,或者该指示可以被自动地确定);以及设置针对所述感兴趣的m/z子范围的相对高的经调整的注入时间。具体地,该算法可以指派比使用均等分布算法所指派的注入时间高的注入时间。 2)使用子范围特定的AGC目标 在当前的AGC具体实现中,由用户指定的用于全扫描的总AGC目标默认地在子范围之间等分。例如,对于具有1e6的AGC目标以及每HDR子扫描10次扫描的全扫描,每个子范围默认分配有1e5的目标值。然而,这种均等分布在某些情况下可能是有害的。例如,如果窄子范围的TIC由单个峰支配,则该TIC的AGC目标可以被减小以避免由空间电荷效应引起的质量偏差。检测TIC优势和相应地减少目标的程序可以由仪器针对每个子范围自动处理。另外,AGC目标的分布可以是基于用于后处理分析的光谱偏好。 因此,确定经调整的注入时间分布可以包括基于m/z子范围的离子丰度指示来调整(例如,减少)针对相应m/z子范围的初始注入时间。例如,确定经调整的注入时间分布可以包括基于m/z子范围的离子丰度由单个m/z峰引起的指示来减少针对相应m/z子范围的初始注入时间。例如,如果某一百分比的TIC(或丰度的另一量度)可归因于一个特定m/z值(或非常窄的m/z范围,诸如覆盖同位素簇的m/z范围),则这可被视为相应m/z子范围的离子丰度基本上由单个m/z峰引起的指示。 m/z子范围的拼接 在图1A所示的HDR扫描工作流的最后步骤中,来自HDR子扫描的m/z子范围的质谱数据被组合以产生全扫描光谱,该全扫描光谱可以像标准全扫描那样被进一步对待和处理。对于每个子范围,MS峰的质心和轮廓数据被复制到所得的全扫描光谱中。相邻子范围之间的重叠增加了灵活性,因为复制操作的开始和结束m/z值可以在重叠区域内单独确定,因为所包含的数据原则上是两次可用的。因此,概括地说,该方法包括通过设置第一组m/z子范围和第二组m/z子范围,使得第一响应曲线的相对高的透射区域至少部分地与第二响应曲线的相对高的透射区域重叠,来确定第一组m/z子范围和第二组m/z子范围。该方法可以包括使用本文所述的方法获得多个部分质谱数据集;以及将多个部分质谱数据集组合(例如,拼接)成单个质谱数据集。 该方法优选地包括主动地确定子范围以确保该子范围重叠。因此,可以存在确定第一响应曲线的相对高的透射区域是否至少部分地与第二响应曲线的相对高的透射区域重叠的步骤;以及基于确定第一响应曲线的相对高的透射区域不至少部分地与第二响应曲线的相对高的透射区域重叠,调整第一和/或第二组m/z子范围,使得第一响应曲线的相对高的透射区域至少部分地与第二响应曲线的相对高的透射区域重叠。给定的一组m/z子范围中的每个m/z子范围优选地至少部分地与不同的一组m/z子范围中的m/z子范围重叠。因此,不同组的m/z子范围可以共同跨越m/z范围。每组m/z子范围可以包括间隔开的多个m/z子范围。例如,多组m/z子范围中的每组m/z子范围中的m/z子范围可以沿着m/z轴交错。第一组m/z子范围中的每个m/z子范围与第二组m/z子范围中的m/z子范围邻接(例如,直接毗连)。 应当理解,当针对多组m/z子范围执行多个子扫描,其中每组m/z子范围包括多个m/z子范围时,将存在大量m/z子范围,该m/z子范围可以被扩展以确保该m/z子范围重叠。因此,例如,第一组m/z子范围可以包括第一组多个m/z子范围,并且第一质量过滤器可以具有多个响应曲线,对于第一组的每个m/z子范围,每个响应曲线包括:相对高的透射区域;以及一个或多个相对低的透射区域。即,第一子扫描的m/z子范围可以与沿着m/z轴间隔开的多个响应曲线相关联。类似地,第二组m/z子范围可以包括第二多个m/z子范围,并且第二质量过滤器可以具有多个响应曲线,对于第二组的每个m/z子范围,每个响应曲线包括:相对高的透射区域;以及一个或多个相对低的透射区域。在这种情况下,有利地,确定第一组m/z子范围和第二组m/z子范围的步骤可以包括设置第一组m/z子范围和第二组m/z子范围,使得:第一质量过滤器的相应响应曲线的每个相对高的透射区域至少部分地与第二质量过滤器的相应响应曲线的相对高的透射区域重叠。因此,可以形成多个重叠的m/z子范围。 应当理解,此方法可以扩展到任何数量的子扫描,并且不限于两组m/z子范围。例如,如果期望第三组m/z子范围,则与第三组相关的响应曲线可以至少部分地与左手侧的第二质量过滤器的响应曲线重叠,并且还可以与右手侧的第一质量过滤器的响应曲线重叠。本公开还可以扩展到第四组m/z子范围。在这种情况下:与第一组相关联的响应曲线可以与与第四组和第二组相关联的响应曲线重叠;与第二组相关联的响应曲线可以与与第一组和第三组相关联的响应曲线重叠;与第三组相关联的响应曲线可以与与第二组和第四组相关联的响应曲线重叠;与第四组相关联的响应曲线可以与与第三组和第一组相关联的响应曲线重叠。可以针对任意数量组的m/z子范围重复这个模式。 重叠区域的存在允许忽略来自子范围的四极杆侧翼区域的数据,该数据可以用来自相邻子范围的高透射区域的数据来替代。如果子范围重叠太小以至于不能延伸到侧翼区域之外,则在子范围的边缘处的峰强度的校正是必要的。这种强度校正通常需要在整个实验期间与HDR扫描一起获取标准全扫描,以及通过将HDR扫描的峰强度与标准全扫描的峰强度进行比较来确定校正因子的附加后处理步骤(例如,如F.Meier等人所述)。然而,如果重叠足够大,则可以避免全扫描的规则采集以及附加校正步骤以节省时间。 拼接程序在子范围w ●结束m/z应位于w ●结束m/z应当被选择为保持两个子范围中的同位素分布。应当避免切割同位素分布使得一部分来自子扫描#1而另一部分来自子扫描#2,以保持强度在分子种类水平一致。 在一般意义上,本文所述的方法可以包括确定在第一组m/z子范围中的第一m/z子范围与第二组m/z子范围中的第二m/z子范围的交集内的结束m/z值;并且在单个质谱数据集中包括:来自以下各项之间的质谱数据:结束m/z值;以及所述第一m/z子范围的端点;以及来自以下各项之间的质谱数据:结束m/z值;以及第二m/z子范围的端点。因此,可以存储来自重叠窗口的数据,其中结束m/z值充当截止点,在该截止点处单个数据集的m/z数据从第一窗口获得切换到从第二窗口获得。第一m/z子范围与第二m/z子范围的交集可以包括第一响应曲线的相对高的透射区域的至少一部分和第二响应曲线的相对高的透射区域的至少一部分。此外,可以基于第一和/或第二m/z子范围中同位素的分布(例如,被确定以避免分裂同位素峰簇)来确定结束m/z值。 如果不可能选择结束m/z使得仅从一个或另一子范围复制所有找到的同位素分布,即,如果所有可能的结束m/z值切割至少一个同位素分布,则从子范围中的一个子范围排他地复制重叠区域内的所有峰。如果第一子范围的重叠区域的噪声加权TIC高于第二子范围的噪声加权TIC,则从w 在图4A中,示意性地示出了重叠窗口w 图4B示出了沿着m/z轴间隔开的不同m/z子范围的一组响应曲线。单个质量过滤器可以在不同的m/z子范围内具有不同的响应曲线。示出了三个不同的响应曲线:第一响应曲线在m/z 一旦确定了重叠的m/z子范围,就可以使用具有对应于第一m/z子范围和第二m/z子范围的第一响应曲线和第二响应曲线的第一质量过滤器和第二质量过滤器来对样品进行质量过滤以分离第一m/z子范围和第二m/z子范围内的离子。第一响应曲线和第二响应曲线各自具有相对高的透射区域和一个或多个相对低的透射区域。然后,通过在第一m/z子范围和第二m/z子范围内对样品进行质量分析来获得部分质谱数据集。然后可以将这些部分质谱数据集拼接在一起(但它们可以简单地存储为单独的部分质谱)。 为了拼接子范围或窗口w 表3 分别为与窗口w ●对于窗口/子扫描1,确定仍然位于可用的高透射窗口内的最右同位素分布,即,该同位素分布的最高m/z峰最接近右边界o ●对于窗口/子扫描2,确定跨越窗口的最左同位素分布,即,该同位素分布的最低m/z峰最接近左边界o 通过将电荷状态检测/去卷积算法应用于子扫描,例如在US-10,593,530中描述的APD算法,可以在前一步骤中针对每个子扫描确定同位素分布,US-10,593,530通过引用并入本文。例如,本文公开的方法可以包括识别具有类似同位素簇的间距和/或强度的峰组的步骤。 基于m/z阈值scan1_thresh和scan2_thresh来确定用于复制来自子扫描1和2的信号的m/z阈值copy_thresh。将具有低于copy_thresh的m/z值的信号从子扫描1复制到所得的HDR扫描中。然后,在随后的循环中窗口2的复制操作在copy_thresh开始。如果scan1_thresh和scan2_thresh相等,则copy_thresh被设置为scan1_thresh。否则,如下确定copy_thresh: ●如果scan2_thresh>scan1_thresh,则将copy_thresh设置为scan2_thresh。原因在于,由于窗口1的更好的总S/N,在这种情况下使用来自子扫描1的更多信号(如果子扫描2具有更好的总S/N,则反之亦然)。 ●如果scan2_thresh≤scan1_thresh,则关于在前一步骤中发现的同位素分布(ISD)的S/N值来评估该ISD:如果针对窗口1所找到的ISD具有比针对窗口2所找到的ISD更好的S/N,则copy_thresh被设置为scan1_thresh(否则被设置为scan2_thresh)。 从子扫描1最后复制的峰(在copy_thresh=scan1_thresh的情况下)或从子扫描2首先复制的峰(在copy_thresh=scan2_thresh的情况下)可作为另一子扫描中的略微移位的副本出现。因此,可以针对最后的或第一个被包括的峰的副本检查另一子扫描,并且可以相应地调整阈值(如果必要的话)。即,可以存在确定第一部分质谱数据集是否与第二部分质谱数据集(例如,在重叠区域中)一致的步骤。如果这些集合不一致,则可以采取校正动作。例如,可以调整用于复制来自子扫描的信号的m/z阈值。替代地,当数据不一致时可以发出警告。 将峰质心、峰轮廓和噪声数据从子扫描1复制到HDR全扫描,直到达到copy_thresh。然后,处理对应于w 在一些情况下,本文所述的方法可以包括确定第一m/z子范围和第二m/z子范围中的哪一者与更高信噪比相关联;并且将多个部分质谱数据集组合成单个质谱数据集可以包括:在单个质谱数据集中包括来自第一m/z子范围和第二m/z子范围中与更高信噪比相关联的一者的质谱数据。因此,呈现良好信噪比的数据可用于本公开的拼接程序中。 混合HDR扫描 作为将多个HDR子扫描拼接在一起以获得HDR全扫描的上述方法的替代方案,可以使用“混合”方法,该方法包括标准全扫描和由选定的非重叠m/z子范围构成的单个HDR“缩放”扫描(或少量子扫描)。这具有保持标准全扫描作为用于定量的参考而单个HDR“缩放”扫描提供对全扫描的稀疏区域的更深入洞察的优点。标准全扫描中的这些区域可以用来自HDR扫描(子扫描)的对应m/z子范围替代,以获得混合HDR全扫描。如果这个混合HDR工作流包括两个扫描事件,则扫描速率性能与使用两个HDR子扫描的方法相当。 可以使用在步骤扫描范围的自动划分中描述的程序来确定全扫描中的稀疏区域。从所得的m/z子范围中,在HDR扫描中仅分析不重叠的具有低TIC值的那些m/z子范围,而具有高TIC值的那些m/z子范围不被单独分析,而是简单地从全扫描中取出。 为了获得混合HDR扫描,来自标准全扫描的光谱“部分”可以与如上所述的HDR子范围拼接。可以像HDR子范围那样对待来自全扫描的“部分”,区别在于该“部分”不呈现四极杆隔离的低透射侧翼,这使得拼接边界的选择更灵活。 一些应用需要具有增大的动态范围的尽可能快的方法。简单地说,为了使动态范围的增大最大化,同时使由附加全MS扫描引起的总分析时间的增加最小化,应当有可能以比“缩放”扫描更小的频率进行标准全MS扫描。仅当顺序测量标准和“缩放”子扫描时,也可以以降低的频率执行拼接。降低的频率的标准可以是基于LC峰宽。例如,如果化合物从LC洗脱的平均持续时间为约30秒,则标准全MS扫描和利用“缩放”子扫描的拼接可仅每10秒执行一次。同时,仍可每秒或每两秒(这是DDA中全MS扫描的典型周期)测量“缩放”扫描。这样,额外的MS扫描可以减少约10倍,信息/峰的损失最小。预期丢失的峰主要在总测量动态范围的中间,该丢失的峰在非常接近于RT和m/z域中的丰度峰处洗脱。这样的峰可具有大大减少的保留时间,因为它们与丰度峰一起被注入到仪器中,并且因此,它们的LC色谱流出曲线的仅顶部部分可被MS检测到。这种模式可用于总分析时间应尽可能小但仍需要MS分析的最高可能动态范围的应用中,例如大队列研究。 当改变离子光学设置(DC和RF电压)可能是有利的时,可以应用对HDR“缩放”模式的附加可能修改。这种替代离子光学设置可以不应用于所有的子扫描/扫描,而是仅应用于一些m/z窗口/范围,子扫描/扫描: 应用于仅选定的m/z窗口(目标方法) 应用于一个或几个子扫描(例如,仅应用于“缩放”子扫描或改为仅应用于全MS扫描) 例如,为了减少不稳定的离子碎裂,可以应用温和捕获设置。然而,这种模式可能增加注入时间并且减少仪器的稳定工作时间,因为更大部分的离子落在离子光学元件上并且导致更快的污染以及所导致的离子充电(这恶化了仪器鲁棒性)。事实上,可以将“温和捕获”设置仅应用于选定的m/z窗口(目标方法)或仅应用于“缩放”子扫描(以改善不稳定的低丰度离子的信号强度)或仅应用于全MS扫描(以减少对仪器鲁棒性的影响)。当使用不同的离子光学设置(DC和RF电压)时,可以获得对离子光学的额外控制,这不同于仪器的典型操作。GB-2,585,372描述了可以控制离子光学的方式,并且通过引用并入本文。GB2108949.5描述了优化离子光学以更好地透射不稳定离子,并且用于控制离子光学的方法也通过引用并入本文。 概括地说,在本公开的方法中,可使用不同仪器参数(例如离子光学设置,诸如DC和RF)执行至少一个质量分析。仪器参数可基于各种因素(诸如所分析的离子的m/z)或基于样品中的离子丰度来确定。该方法可以包括使用基于(例如,基于来自先前预扫描或先前HDR扫描的数据)样品中的离子丰度来确定的离子光学设置对相应集合的一个或多个m/z子范围执行质量分析。 在混合方法中,可存在在m/z范围内对样品执行全范围质量分析并且基于在m/z范围内对样品的全范围质量分析来调整至少一个部分质谱数据集的质谱数据的步骤。例如,可以使用全扫描使来自一个或多个部分扫描的数据标准化。使用标准扫描作为定量基线的这个相同过程也可以被实施用于完全跨越m/z范围的HDR子扫描,并且不排他地适用于混合标准/HDR扫描。 扫描数M和/或m/z窗口数N的自动优化(NxM优化) 等距和自动划分m/z窗口算法可以接收期望m/z窗口的总数N作为输入。在LC/MS实验期间,质谱的组成可显著变化:从非常稀疏的谱变化到非常密集的谱,在所有峰上具有相对均等的强度分布,到仅在1-3个丰度最高的峰中的大多数信号的浓度。因此,可以在LC/MS实验期间在不同时间点利用不同数量的m/z窗口来观察最佳执行的HDR扫描。因此,在一些实施方案中,可实时实施LC/MS实验期间对期望m/z窗口的最佳数量N的自动确定和选择。针对这个优化,可以定义标准和限制。 例如,每组m/z子范围中的m/z子范围的数量(N)可以是以下各项中的至少一项:常数;可由用户配置;并且/或者基于样品的质谱数据(从例如补充扫描或先前HDR扫描获得)来确定。另外或替代地,多组m/z子范围中的m/z子范围集合的数量(M)可以是以下各项中的至少一项:常数;可由用户配置;并且/或者基于(从例如补充扫描或先前HDR扫描获得的)样品的质谱数据动态地确定。N和/或M可以通过实验连续地变化。N和/或M可以根据如下所述的优化程序来确定。 因此,概括地说,本公开的方法可以对每组m/z子范围集合中的m/z子范围的数量和/或多组m/z子范围中的m/z子范围集合的数量执行优化程序。优化程序可以是基于以下各项中的至少一项:质量分析的动态范围;和/或用于执行质量分析的总可用时间。 用于NxM优化的可选起始条件和限制: 扫描和m/z划分方法:自动、等距或定制,或不同方法的组合, 或混合HDR扫描 子扫描的固定数量M或者所允许的子扫描数量的范围:从min_M到max_M 额外子扫描的一个循环的最大持续时间(包括m/z窗口与子扫描之间的所有注入时间和技术切换时间) m/z窗口的固定数量N或允许范围:从min_N到max_N。max_N可以定义为总质量范围与min_width(来自表1)的比率(LM与FM之间的增量) 参数N和M可以在这个阶段例如通过选择最小允许子扫描数量并且引入以下附加限制而被优化很少的附加时间:注入时间加上技术时间的总和不应超过额外子扫描的总持续时间。 可选的优化策略 参数N和M可被优化以实现: 最大动态范围 动态范围增益与额外子扫描的总持续时间的最大比率(即,在总测量时间的最小增加的情况下最佳获胜) 这种优化可以在实验期间重复进行,以随着样品组成的发展确定新的m/z子范围集合。 可选的NxM优化算法 每当发起m/z子范围的划分时,可以应用以下优化算法。从M和N的一对值开始: 1.针对每个允许的子扫描数M,重复以下步骤 2.针对选定的N和给定的起始条件和限制重复m/z窗口划分过程 3.利用所找到的窗口划分和在给定的M上的扩展,计算一个或多个优化标准并且将所有优化标准作为一个记录添加到优化历史 4.基于给定M的所有优化历史,选择下一窗口数N 5.基于所使用的优化方法,评估针对给定M的N的优化是否完成。可以使用梯度方法通过在整个允许的N范围上的简单迭代或使用另一方法来执行评估。如果N优化没有完成,则进行到步骤2。 6.如果完成对N的优化,则保存针对给定M的N优化的最终结果,并且与来自允许范围的另一M一起进行到步骤1。如果不再有来自允许范围的M可用,则进行到下一个。 7.针对每个允许的M比较所有找到的N个优化结果,并且选择最满足一个或多个优化标准的优化结果。 NxM优化的主要目标 应当避免扫描范围的过度划分。当增加m/z窗口数导致达到的动态范围减小时,发生这种情况。过度划分可由每m/z窗口的样品使用的减小的工作循环引起,例如: 1.考虑到在最后一个划分步骤之前的一个划分步骤上,具有低丰度峰的平均大小窗口将被指派2.5x注入时间并且没有达到AGC目标。 2.没有额外的NxM优化的划分算法将以每半个窗口大小1x注入时间结束,并且对于在窗口之间切换的技术时间将损失0.5x注入时间-3.即,在这个示例中,如果在最后一个步骤之前的一个步骤上停止划分算法,则可以针对每个峰实现2.5x信号增益。 在对实验时间有严格限制的情况下,当达到合理的动态范围增益时停止划分可能是重要的。此外,考虑窗口之间的技术切换时间(在Exploris 在仪器中实施HDR扫描的方法 在Exploris 然而,以下仪器可用于获取HDR扫描: ●通过将所有离子存储在捕获设备中来平行填充,周期性地释放该离子并且根据任何类型的离子迁移率或飞行时间在抵达时间时分离,选通期望窗口并且将该离子收集在最终存储设备中,随后注入到分析器中(如例如在US7829842、US7999223、US9064679、US9293316、US9812310、US10199208、US10224193中所描述)。 ●如上所述,但将离子顺序地从第一捕获设备扫描出,然后仅允许期望的非重叠窗口传到最终存储设备(如例如在US7157698/US7342224中所描述)。 ●通过m/z或迁移率将离子分离到存储设备的阵列中,然后在期望的时间将离子从它们中的一些释放出来并且选择非重叠窗口以转移到存储设备,用于随后注入分析器中(如例如在US9147563、US9293316/US9812310中所描述)。 在这些替代方法中,除了锐化到达最终存储设备(C阱)的最终窗口的形状之外,还可使用快速切换四极杆或任何另一质量过滤器。 图5示出了用于实施本文所述的方法的质谱系统。质谱系统是Thermo ScientificOrbitrap Exploris 应当了解,上述方法可以作为硬件和/或软件实施为一个或多个对应模块。例如,上述功能性可以作为由质谱系统的处理器执行的一个或多个软件组件实施。替代地,以上提到的功能性可以作为如一个或多个现场可编程门阵列(FPGA)和/或一个或多个专用集成电路(ASIC)和/或一个或多个数字信号处理器(DSP)和/或其他硬件布置上的硬件实施。在本文中包含或如上文所述的流程图中实施的方法步骤可以各自由对应的相应模块实施。此外,在本文中包含或如上文所述的流程图中实施的多个方法步骤可以由单个模块一起实施。这样的模块和硬件可以集成到质谱系统中。 应了解,只要本公开的实施例由计算机程序实施,则携载计算机程序的存储介质和传输介质形成本公开的方面。所述计算机程序可以具有一个或多个程序指令或程序代码,其当由计算机执行时执行本公开的实施例。如本文所用的术语“程序”可以是被设计成在计算机系统上执行的指令序列,并且可以包含子例程、功能、程序、模块、目标方法、目标实施方案、可执行应用程序、小程序、服务器小程序、源代码、目标代码、共享库、动态链接库,和/或被设计成在计算机系统上执行的其它指令序列。存储介质可为磁盘(诸如硬盘驱动器或软盘)、光盘(诸如CD-ROM、DVD-ROM或BluRay盘)或存储器(诸如ROM、RAM、EEPROM、EPROM、闪存或便携式/可拆卸存储器设备)等。传输介质可为通信信号、数据广播、两个或更多个计算设备之间的通信链接等。 除非另外说明,否则本说明书中所公开的每个特征均可替换为用于相同、同等或类似目的的替代特征。因此,除非另外说明,否则所公开的每个特征仅是一系列的等价或相似的属性特征的一个示例。 此外,可以对所描述的实施例作出许多变化,并且这些变化在阅读本说明书之后对于熟练的读者将是显而易见的。例如,虽然主要描述了轨道捕获质量分析器,但是本文所述的质量分析器可以是以下各项中的任一项或多项:轨道捕获质量分析器或基于阱的飞行时间(ToF),在该轨道捕获质量分析器或基于阱的ToF中,离子进入阱,从该阱将该离子喷射到ToF质量分析器中。 如本文所使用(包括在权利要求书中),除非上下文另有指示,否则本文中的术语的单数形式应被理解为包括复数形式,且当上下文允许时,反之亦然。例如,除非上下文另有指示,否则本文包括权利要求中的单数引用,诸如“一”或“一个”(诸如一个离子或一个m/z子范围)意指“一个或多个”(例如,一个或多个离子,或一个或多个m/z子范围)。在本公开的描述和权利要求书中,词语“包括”、“包含”、“具有”和“含有”以及词语的变体,例如“包括(comprising)”和“包括(comprises)”或类似者表示所描述的特征包含后面的附加特征,并且不打算(也不)排除其它组件的存在。此外,在第一特征被描述为“基于”第二特征时,这意味着第一特征完全基于第二特征,或者第一特征至少部分地基于第二特征。 本文提供的任何和所有示例或示例性语言(“例如(for instance)”、“诸如(suchas)”、“例如(for example)”以及类似语言)的使用旨在仅更好地说明本公开,并且除非另外要求,否则并不指示对本公开范围的限制。本说明书中的任何语言均不应被解释为指示实践本公开所必需的任何未要求的要素。 除非另有说明或上下文另外要求,否则本说明书中所述的任何步骤可按任何顺序或同时执行。此外,在一个步骤被描述为在一个步骤之后执行的情况下,这并不排除正在执行的中间步骤。 本说明书中所公开的所有方面和/或特征可按任何组合进行组合,这类特征和/或步骤中的至少一些互斥的组合除外。具体地,本公开的优选特征适用于本公开的所有方面和实施例并且可按任何组合使用。同样,以非必需组合形式所述的特征可单独(不按组合形式)使用。 以下编号的条款示出了本发明的其他有利实施方案。 1.一种用于在m/z范围的至少一部分内获取样品的质谱数据的方法,所述方法包括: 在m/z范围内接收样品的质谱数据; 通过以下操作将m/z范围划分成一组或多组m/z子范围,每组包括一个或多个m/z子范围: 将m/z范围分成多个m/z箱; 基于质谱数据来确定每个m/z箱的离子丰度指示;以及通过将具有对应于至少阈值程度的离子丰度的m/z箱指派给所形成的m/z子范围来形成一组或多组m/z子范围中的m/z子范围;以及 针对每组m/z子范围对样品执行质量分析,从而获取一个或多个部分质谱数据集。 2.根据条款1所述的方法,其中划分m/z范围包括: (i)识别多个m/z箱中的初始m/z箱; (ii)确定与初始m/z箱相邻的一个或多个m/z箱的离子丰度在至少阈值程度上对应于初始m/z箱的离子丰度;以及 (iii)将初始m/z箱和与初始m/z箱相邻的一个或多个m/z箱指派给所形成的m/z子范围。 3.根据条款2所述的方法,其中初始m/z箱是多个m/z箱中的具有最高离子丰度的m/z箱。 4.根据条款2或条款3所述的方法,所述方法包括形成所形成的m/z子范围的补数。 5.根据条款4所述的方法,所述方法包括对所形成的m/z子范围的补数重复步骤(i)、(ii)和(iii),从而形成一组或多组m/z子范围中的一个或多个另外的m/z子范围。 6.根据条款4或条款5所述的方法,所述方法包括迭代地形成所形成的m/z范围的补数并且对每个连续补数重复步骤(i)、(ii)和(iii),从而形成一组或多组m/z子范围中的多个另外的m/z子范围。 7.根据任一前述条款所述的方法,其中将m/z范围划分成一组或多组m/z子范围包括重复地形成m/z子范围,直到所形成的m/z子范围的总数不大于一组或多组m/z子范围中的m/z子范围的预定义总数。 8.根据任一前述条款所述的方法,其中将m/z范围划分成一组或多组m/z子范围包括形成各自包括W个m/z子范围的M组m/z子范围,其中m/z子范围以m/z的顺序编号,并且其中对于i=1...M的每个值,第i组m/z子范围包括m/z子范围编号i、M+i、2M+i...(W-1)M+i。 9.根据任一前述条款所述的方法,其中划分m/z范围包括: 确定第一m/z箱和第二m/z箱具有对应于至少阈值程度的离子丰度; 确定第一m/z箱与第二m/z箱之间的第三m/z箱的离子丰度不在至少阈值程度上与第一m/z箱和第二m/z箱的离子丰度对应;以及 将第一m/z箱、第二m/z箱和第三m/z箱指派给单个m/z子范围。 10.根据任一前述条款所述的方法,其中划分m/z范围包括: 将具有对应于至少阈值程度的离子丰度的m/z箱指派给第一初步m/z子范围; 将具有对应于至少阈值程度的离子丰度的m/z箱指派给第二初步m/z子范围; 确定第一初步m/z子范围与第二初步m/z子范围重叠;以及丢弃第二初步m/z子范围,而不将相应m/z箱指派给一组或多组m/z子范围中的m/z子范围。 11.根据任一前述条款所述的方法,其中划分m/z范围包括: 通过将具有对应于至少阈值程度的离子丰度的m/z箱指派给相应初步m/z子范围来形成一个或多个初步m/z子范围;以及 基于相应初步m/z子范围来形成一组或多组m/z子范围中的一个或多个m/z子范围。 12.根据条款11所述的方法,其中基于相应初步m/z子范围来形成一组或多组m/z子范围中的一个或多个m/z子范围包括: 将相应初步m/z子范围指派给一组或多组m/z子范围;以及向一组或多组m/z子范围指派与相应初步m/z子范围相邻的一个或两个m/z子范围,其中与相应初步m/z子范围相邻的一个或两个m/z子范围中的每个m/z子范围从相应初步m/z子范围的一端延伸到另一初步m/z子范围的一端; 优选地,其中所述方法还包括增大一个或两个m/z子范围中的与相应初步m/z子范围相邻的至少一个m/z子范围的宽度。 13.根据任一前述条款所述的方法,其中划分m/z范围包括指派初始m/z箱和与初始m/z箱相邻的一个或多个m/z箱以形成第一初步m/z子范围,其中形成m/z子范围包括以下各项中的至少一项: 通过增大第一初步m/z子范围的宽度来形成m/z子范围;以及/或者 通过增大与第一初步m/z子范围相邻的现有第二初步m/z子范围的宽度来形成m/z子范围。 14.根据条款13所述的方法,所述方法包括: 确定第一初步m/z子范围和与第一初步m/z子范围相邻的第二初步m/z子范围具有相同的宽度; 确定第一初步m/z子范围和第二初步m/z子范围中的哪一者与更高离子丰度相关联;以及 增大第一初步m/z子范围和第二初步m/z子范围中与更高离子丰度相关联的一者的宽度。 15.根据条款13或条款14所述的方法,所述方法包括: 基于确定第一初步m/z子范围比与第一初步m/z子范围相邻的第二初步m/z子范围宽,增大第二初步m/z子范围的宽度;或者 基于确定第一初步m/z子范围比第二初步m/z子范围窄,增大第一初步m/z子范围的宽度。 16.根据条款13至条款15中任一项所述的方法,其中增大第一初步m/z子范围和第二初步m/z子范围中的至少一者的宽度使得第一初步m/z子范围和第二初步m/z子范围至少部分地重叠。 17.根据条款16所述的方法,其中第一初步m/z子范围和第二初步m/z子范围重叠一定量,所述量: 包括与所述第一初步m/z子范围或所述第二初步m/z子范围的宽度成比例的偏移;以及/或者 包括恒定偏移。 18.根据任一前述条款所述的方法,所述方法包括: 将m/z范围划分成多个第一组m/z子范围,每个第一组包括一个或多个m/z子范围; 针对每个第一组m/z子范围对样品执行第一质量分析,从而获取多个第一部分质谱数据集; 基于由多个第一部分质谱数据集指示的离子丰度,将m/z范围划分成多个第二组m/z子范围,每个第二组包括一个或多个m/z子范围;以及 针对每个第二组m/z子范围对样品执行第二质量分析,从而获取多个第二部分质谱数据集。 19.根据条款18所述的方法,所述方法包括将m/z范围进一步划分一次或多次,并且执行一个或多个另外的质量分析以获得多个相应另外的部分质谱数据集。 20.根据任一前述条款所述的方法,其中: 多个m/z箱中的每个m/z箱具有可由用户配置的宽度;并且/ 或者 多个m/z箱中的每个m/z箱具有预定义最小宽度的一半的宽度。 21.根据任一前述条款所述的方法,其中m/z箱之间的阈值对应程度是较低丰度的m/z箱的离子丰度与较高丰度的m/z箱的离子丰度的预定义比率,优选地,其中所述预定义比率为至少0.5。 22.根据任一前述条款所述的方法,其中离子丰度指示是总离子流(TIC)。 23.一种用于在m/z范围的至少一部分内获取样品的质谱数据的方法,所述m/z范围包括一组一个或多个m/z子范围,所述方法包括: 确定初始注入时间分布,所述初始注入时间分布包括针对所述一组一个或多个m/z子范围中的每个m/z子范围的初始注入时间; 基于确定所述初始注入时间分布的总时间超过用于获取所述质谱数据的总可用注入时间,确定包括针对每个m/z子范围的经调整的注入时间的经调整的注入时间分布;以及 根据所述经调整的注入时间分布对每个m/z子范围执行质量分析,以获得部分质谱数据集; 其中确定所述经调整的注入时间分布包括减少针对相应m/z子范围的所述初始注入时间中的至少一个初始注入时间,使得针对所述一组一个或多个m/z子范围的所述经调整的注入时间分布的总时间不大于用于获取所述质谱数据的所述总可用注入时间。 24.根据条款23所述的方法,其中确定所述经调整的注入时间分布包括使一个或多个相对长的初始注入时间比一个或多个相对短的初始注入时间在更大程度上减少。 25.根据条款23或条款24所述的方法,其中确定所述经调整的注入时间分布包括减少超过阈值注入时间的至少一个初始注入时间,并且优选地包括减少超过阈值注入时间的每个初始注入时间。 26.根据条款23至条款25中任一项所述的方法,其中确定所述经调整的注入时间分布包括将超过阈值注入时间的多个初始注入时间减少缩放因子。 27.根据条款26所述的方法,其中确定所述经调整的注入时间分布包括将所述阈值注入时间设置为针对每个m/z子范围的所述经调整的注入时间,对于所述m/z子范围,减少所述缩放因子的所述初始注入时间小于所述阈值注入时间。 28.根据条款23至条款27中任一项所述的方法,其中确定所述经调整的注入时间分布包括: 对于所述初始注入时间小于所述阈值注入时间的每个m/z子范围,通过对所述初始注入时间与所述阈值注入时间之间的差求和来确定总备用注入时间;以及 通过分配所述总备用注入,设置针对所述初始注入时间大于所述阈值注入时间的一个或多个m/z子范围的经调整的注入时间,从而增加针对所述初始注入时间大于所述阈值注入时间的所述一个或多个m/z子范围的所述初始注入时间。 29.根据条款23至条款28中任一项所述的方法,其中确定所述经调整的注入时间分布包括: 确定超过所述阈值注入时间的每个初始注入时间的总和sum_exceeding,其中所述阈值注入时间是IT 通过从所述总可用注入时间中减去小于或等于IT 通过迭代地进行以下操作以升序处理超过所述阈值注入时间的每个初始注入时间: 通过计算 将sum_exceeding减小old_IT;以及 将sum_remaining减小new_IT。 30.根据条款23至条款29中任一项所述的方法,其中所述阈值注入时间等于在所述一个或多个m/z子范围之间等分的所述总可用注入时间。 31.根据条款23至条款30中任一项所述的方法,所述方法还包括: 接收m/z子范围是感兴趣的m/z子范围的指示;以及设置针对所述感兴趣的m/z子范围的相对高的经调整的注入时间。 32.根据条款23至条款31中任一项所述的方法,其中确定所述经调整的注入时间分布包括减少针对每个相应m/z子范围的所述初始注入时间。 33.根据条款23至条款32中任一项所述的方法,其中确定所述经调整的注入时间分布包括将针对每个相应m/z子范围的所述初始注入时间减少缩放因子。 34.根据条款23至条款33中任一项所述的方法,其中确定所述初始注入时间分布包括基于自动增益控制(AGC)算法来确定针对每个m/z子范围的初始注入时间。 35.根据条款23至条款34中任一项所述的方法,其中确定所述经调整的注入时间分布包括基于m/z子范围的离子丰度指示来调整针对所述相应m/z子范围的所述初始注入时间。 36.根据条款23至条款35中任一项所述的方法,其中确定所述经调整的注入时间分布包括基于m/z子范围的离子丰度基本上由单个m/z峰引起的指示来减少针对所述相应m/z子范围的所述初始注入时间。 37.一种用于在m/z范围的至少一部分内获取样品的质谱数据的方法,所述m/z范围包括多组m/z子范围,每组包括一个或多个m/z子范围,所述方法包括: 确定多组m/z子范围中的第一组m/z子范围以及确定多组m/z子范围中的第二组m/z子范围,所述第一组包括第一m/z子范围并且所述第二组包括第二m/z子范围; 使用第一质量过滤器对样品进行质量过滤以分离第一组m/z子范围中的离子,并且在第一组m/z子范围内对样品执行质量分析以获得第一部分质谱数据集,第一质量过滤器具有对应于第一m/z子范围的第一响应曲线,第一响应曲线具有相对高的透射区域和一个或多个相对低的透射区域;以及 使用第二质量过滤器对样品进行质量过滤以分离第二组m/z子范围中的离子,并且在第二组m/z子范围内对样品执行质量分析以获得第二部分质谱数据集,第二质量过滤器具有对应于第二m/z子范围的第二响应曲线,第二响应曲线具有相对高的透射区域及一个或多个相对低的透射区域; 其中确定第一组m/z子范围和第二组m/z子范围的步骤包括设置第一组m/z子范围和第二组m/z子范围,使得第一响应曲线的相对高的透射区域至少部分地与第二响应曲线的相对高的透射区域重叠。 38.根据条款37所述的方法,其中确定第一组m/z子范围和第二组m/z子范围包括: 确定第一响应曲线的相对高的透射区域是否至少部分地与第二响应曲线的相对高的透射区域重叠;以及 基于确定第一响应曲线的相对高的透射区域不至少部分地与第二响应曲线的相对高的透射区域重叠,调整第一和/或第二组m/z子范围,使得第一响应曲线的相对高的透射区域至少部分地与第二响应曲线的相对高的透射区域重叠。 39.根据条款37或条款38所述的方法,其中: 第一组m/z子范围包括第一组多个m/z子范围,并且第一质量过滤器具有多个响应曲线,对于第一组的每个m/z子范围,每个响应曲线包括:相对高的透射区域;以及一个或多个相对低的透射区域; 第二组m/z子范围包括第二组多个m/z子范围,并且第二质量过滤器具有多个响应曲线,对于第二组的每个m/z子范围,每个响应曲线包括:相对高的透射区域;以及一个或多个相对低的透射区域;并且 确定第一组m/z子范围和第二组m/z子范围的步骤包括设置第一组m/z子范围和第二组m/z子范围,使得:第一质量过滤器的每个响应曲线的每个相对高的透射区域至少部分地与第二质量过滤器的响应曲线的相对高的透射区域重叠。 40.根据条款37至条款39中任一项所述的方法,其中每个响应曲线在多个相对低的透射区域之间具有相对高的透射区域。 41.根据条款37至条款40中任一项所述的方法,其中每个响应曲线是大致梯形的。 42.根据条款37至条款41中任一项所述的方法,其中第一质量过滤器和第二质量过滤器是相同的质量过滤器。 43.根据条款37至条款42中任一项所述的方法,其中第一质量过滤器是四极杆并且/或者其中第二质量过滤器是四极杆。 44.根据条款37至条款43中任一项所述的方法,其中第一响应曲线和/或第二响应曲线的相对高的透射区域是具有至少90%的离子透射、至少95%的离子透射或至少99%的离子透射的区域。 45.根据条款37至条款44中任一项所述的方法,其中确定第一组m/z子范围和第二组m/z子范围包括: 基于使用第一质量过滤器和第二质量过滤器获得的质谱数据来确定第一响应曲线的第一梯形拟合和/或第二响应曲线的第二梯形拟合;以及 基于第一梯形拟合和/或第二梯形拟合来确定第一响应曲线的相对高的透射区域和第二响应曲线的相对高的透射区域。 46.根据条款37至条款45中任一项所述的方法,其中确定第一组m/z子范围和第二组m/z子范围包括基于第一响应曲线和/或第二响应曲线中的至少一者的宽度来确定第一响应曲线和第二响应曲线的重叠程度。 47.根据条款37至条款46中任一项所述的方法,其中确定第一组m/z子范围和第二组m/z子范围包括基于第一响应曲线和/或第二响应曲线中的至少一者的相对低的透射区域的宽度来确定第一响应曲线和第二响应曲线的重叠程度。 48.根据条款37至条款47中任一项所述的方法,其中第一响应曲线的相对高的透射区域与第二响应曲线的相对高的透射区域重叠的量大于:第一响应曲线的相对低的透射区域的宽度;和/或第二响应曲线的相对低的透射区域的宽度。 49.一种用于在m/z范围的至少一部分内获取样品的质谱数据的方法,所述方法包括根据针对每组m/z子范围的经调整的注入时间分布来执行根据条款1至条款22中任一项所述的方法,针对每组m/z子范围的经调整的注入时间分布通过执行根据条款23至条款36中任一项所述的方法来确定,优选地,其中针对通过执行根据条款37至条款48中任一项所述的方法所确定的第一m/z子范围和第二m/z子范围来执行所述方法。 50.一种用于在m/z范围的至少一部分内获取样品的质谱数据的方法,所述方法包括针对通过执行根据条款37至条款48中任一项所述的方法确定的第一m/z子范围和第二m/z子范围执行根据条款1至条款22中任一项所述的方法。 51.一种用于在m/z范围的至少一部分内获取样品的质谱数据的方法,所述方法包括根据针对每组m/z子范围的经调整的注入时间分布来执行根据条款37至条款48中任一项所述的方法,针对每组m/z子范围的经调整的注入时间分布通过执行根据条款23至条款36中任一项所述的方法来确定。 52.根据任一前述条款所述的方法,其中每组m/z子范围包括多个m/z子范围,并且其中给定的一组m/z子范围中的每个m/z子范围至少部分地与不同的一组m/z子范围中的m/z子范围重叠。 53.根据任一前述条款所述的方法,其中每组m/z子范围包括具有对应于至少阈值程度的离子丰度的m/z子范围。 54.根据任一前述条款所述的方法,其中至少一组m/z子范围包括与样品中相对高或相对低的离子丰度相关联的一个或多个m/z子范围。 55.根据任一前述条款所述的方法,其中使用基于样品中的离子丰度来确定的仪器参数执行至少一个质量分析。 56.根据任一前述条款所述的方法,所述方法包括使用不同的离子光学设置对相应一组中的一个或多个m/z子范围执行质量分析。 57.根据任一前述条款所述的方法,其中每个质量分析是MS 58.根据任一前述条款所述的方法,其中多组m/z子范围中的每组m/z子范围中的m/z子范围共同跨越m/z范围。 59.根据任一前述条款所述的方法,其中每组m/z子范围包括间隔开的多个m/z子范围。 60.根据任一前述条款所述的方法,其中多组m/z子范围中的每组m/z子范围中的m/z子范围沿着m/z轴交错。 61.根据任一前述条款所述的方法,其中第一组m/z子范围中的每个 m/z子范围与第二组m/z子范围中的m/z子范围邻接。 62.根据任一前述条款所述的方法,所述方法包括从色谱仪接收样品,优选地包括对从色谱仪获得的一个或多个样品重复根据任一前述条款所述的方法一次或多次,以获得样品的时间依赖性质谱数据。 63.根据任一前述条款所述的方法,所述方法包括在m/z范围内对样品执行全范围质量分析并且基于在m/z范围内对样品的全范围质量分析来调整至少一个部分质谱数据集的质谱数据。 64.根据任一前述条款所述的方法,其中: 每组m/z子范围中的m/z子范围的总数是以下各项中的至少一项:常数;可由用户配置;以及/或者基于样品的质谱数据来确定;并且/或者 多组m/z子范围中的m/z子范围集合的总数是以下各项中的至少一项:常数;可由用户配置;以及/或者基于样品的质谱数据来动态地确定。 65.根据条款64所述的方法,所述方法包括对每组m/z子范围集合中的m/z子范围的总数和/或多组m/z子范围中的m/z子范围集合的数量执行优化程序,其中优化程序是基于以下各项中的至少一项: 质量分析的动态范围;和/或用于执行质量分析的总可用时间。 66.一种用于在m/z范围的至少一部分内获取样品的质谱数据的方法,所述方法包括: 使用根据任一前述条款所述的方法来获得多个部分质谱数据集;以及 将所述多个部分质谱数据集组合成单个质谱数据集。 67.根据条款66所述的方法,其中第一组m/z子范围中的第一m/z子范围至少部分地与一组或多组另外的m/z子范围中的一个或多个另外的m/z子范围重叠。 68.根据条款66或条款67所述的方法,其中第一组m/z子范围中的每个m/z子范围至少部分地与第二组m/z子范围中的m/z子范围重叠,优选地,其中第一组m/z子范围中的每个m/z子范围至少部分地与第三组m/z子范围中的m/z子范围重叠。 69.根据条款66至条款68中任一项所述的方法,其中单个质谱数据集包括来自以下各项的质谱数据:多个部分质谱数据集中的第一部分质谱数据集;以及多个部分质谱数据集中的第二部分质谱数据集。 70根据条款66至条款69中任一项所述的方法,其中组合多个部分 质谱数据集包括: 确定在第一组m/z子范围中的第一m/z子范围与第二组m/z子范围中的第二m/z子范围的交集内的结束m/z值;以及 在所述单个质谱数据集中包括: 来自以下各项之间的质谱数据:所述结束m/z值;以及所述第一m/z子范围的端点;以及 来自以下各项之间的质谱数据:所述结束m/z值;以及第二m/z子范围的端点。 71.根据条款70所述的方法,包括基于第一和/或第二m/z子范围中的同位素分布来确定结束m/z值。 72.根据条款70或条款71所述的方法,其中第一m/z子范围与第二 m/z子范围的交集包括第一响应曲线的相对高的透射区域的至少一部分和第二响应曲线的相对高的透射区域的至少一部分。 73.根据条款66至条款72中任一项所述的方法,所述方法包括确定第一部分质谱数据集是否与第二部分质谱数据集一致的步骤。 74.根据条款66至条款73中任一项所述的方法,所述方法包括: 确定所述第一m/z子范围和所述第二m/z子范围中的哪一者与更高离子丰度相关联;并且 其中将多个部分质谱数据集组合成单个质谱数据集包括:在单个质谱数据集中包括来自第一m/z子范围和第二m/z子范围中与更高离子丰度相关联的一者的质谱数据。 75.根据条款66至条款74中任一项所述的方法,所述方法包括: 确定所述第一m/z子范围和所述第二m/z子范围中的哪一者与更高信噪比相关联;并且 其中将多个部分质谱数据集组合成单个质谱数据集包括:在单个质谱数据集中包括来自第一m/z子范围和第二m/z子范围中与更高信噪比相关联的一者的质谱数据。 76.一种质谱系统,所述质谱系统包括质量分析器、处理器和一个或多个质量过滤器,所述质谱系统被配置为执行根据任一前述条款所述的方法。 77.一种计算机程序,所述计算机程序包括指令,所述指令在由根据条款76所述的质谱系统的处理器执行时使得所述质谱系统执行根据条款1至条款75中任一项所述的方法。 78.一种计算机可读介质,所述计算机可读介质上存储有根据条款77所述的计算机程序。
- 一种肝胆外科用手术辅助装置
- 一种用于肝胆外科用的手术辅助装置及辅助方法
- 一种肝胆胰外科手术用辅助止血装置
