波浪状传感界面的碳纳米管场效应晶体管生物传感器、制备方法及应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及生物传感器技术领域,尤其是基于碳纳米管晶体管型生物传感器,具体而言涉及一种波浪状传感界面的碳纳米管场效应晶体管生物传感器及其制备方法。
背景技术
肺癌仍然是癌症死亡的主要原因。早期诊断和治疗被认为是降低肺癌发病率和死亡率的关键,I期肺癌患者的5年生存率可以达到90%。然而,早期癌症组织很难被发现,传统的临床检测方法,包括胸透后的支气管镜检查,痰液分析后的细胞学检查,以及低剂量计算机断层扫描(LDCT)都不能满足准确的检测要求。近来,许多临床病例证实,肺癌患者血清中存在一些蛋白质(如CEA)或细胞因子,甚至在早期阶段,称为血清肿瘤生物标志物,其丰度与肺癌的发展状况有关,其类型与不同组织学亚型有关。在这方面,血清肿瘤生物标志物的精确测量将为肺癌的无痛和无创诊断提供一个新的途径。尽管如此,在复杂的血清环境中准确识别微量标志物一直是个难题。
基于低维半导体材料的场效应晶体管(FET)生物传感器是新兴的检测技术,具有高灵敏度、快速响应、无标签和规模集成等固有优势。通过带电的生物分子和半导体通道之间的静电耦合,目标生物分子的浓度信息可以被高度敏感地检测并以可读的电信号传输。在各种纳米材料中,半导体碳纳米管薄膜具有超高的迁移率、与生物分子的尺寸相容性和良好的生物相容性等优点,这使得它成为高性能FET生物传感器的良好候选者,并引起广泛关注。
然而,高灵敏度总是伴随着较差的抗干扰能力,小尺寸意味着探针结合点的缺乏,导致CNT-FET生物传感器的实际性能远低于理论值。现有技术提出了一种浮动栅CNT-FET平台,它利用沉积在CNT上的Y
发明内容
本发明目的在于提供一种波浪状传感界面的碳纳米管场效应晶体管生物传感器,通过波浪状的传感界面,增加栅极比表面积使固定的探针更多,以提高晶体管型生物传感器的灵敏度。该碳纳米管场效应晶体管生物传感器尤其可用于早期肺癌筛查技术中血清标志物检测。
在另一方面的实施例中,本发明提供一种波浪状传感界面的碳纳米管场效应晶体管生物传感器,超灵敏检测肺癌血清标志物癌胚抗原,检测极限达到阿克量级。
根据本发明目的的第一方面,提出一种波浪状传感界面的碳纳米管场效应晶体管生物传感器,包括:
衬底,限定了第一表面和相对的第二表面,以第一表面作为后续制备的生长表面;
二氧化硅介质层,位于衬底的第一表面;
源极电极和漏极电极,位于衬底的第一表面,源极电极与漏极电极相对地设置并隔开排布;
位于二氧化硅介质层上表面的CNT沟道层,所述CNT沟道层位于源极电极与漏极电极之间的位置;
波浪状介电层,位于CNT沟道层的上表面,远离衬底一侧;
连接层,位于CNT沟道层上表面远离硅基衬底一侧;以及
溶液栅极和施加栅极电压的银丝,位于波浪状介电层和连接层上表面远离衬底一侧;
钝化层,使得在所述生物传感器在测量目标生物分子时,仅波浪状传感界面和施加栅极电压的银丝暴露在液体环境中;
其中,所述溶液栅极与所述源极电极、漏极电极及CNT沟道层均不接触。
在优选的实施例中,波浪状介电层选用为Y
作为可选的示例,所述源极电极与漏极电极采用的金属为Ti/Pd/Au三种金属,是具有一定厚度的条状电极。
作为可选的示例,所述源极电极与漏极电极的厚度相同,并且控制在60-80nm。
作为可选的示例,所述波浪状介电层为Y
作为可选的示例,所述连接层为金纳米颗粒,其理论厚度为0.3nm(对应于单颗的直径约为0.3nm),相邻的金纳米颗粒互不接触。
作为可选的示例,所述溶液栅极为0.01×PBS,体积为10μL。
作为可选的示例,所述施加栅极电压的银丝,其直径为0.4mm。
作为可选的示例,所述源极电极与漏极电极的长度在50μm以上,宽度在5μm以上,源漏之间的距离为20μm。
作为可选的示例,所述金属引线为与源漏电极同样的金属材料,长度在1000μm以上。
作为可选的示例,所述输出电极(pad)与源漏电极同样的金属材料,其边长为300μm。
作为可选的示例,所述源极电极与漏极电极均配置有独立的引线,用于信号引出;所述引线均被封装绝缘处理。
根据本发明目的的第二方面,提出一种波浪状传感界面的碳纳米管场效应晶体管生物传感器的制备方法,包括以下步骤:
步骤1、在衬底上沉积一层二氧化硅介质层;
步骤2、以二氧化硅介质层作为CNT的生长表面,沉积CNT薄膜;
步骤3、通过匀胶机对沉积有CNT薄膜的Si/SiO
步骤4、使用激光直写光刻机利用匀胶光刻显影工艺曝光出相应图形,利用反应离子刻蚀机对CNT薄膜进行刻蚀,获得连接源漏电极CNT沟道层;
步骤5、再次进行匀胶、曝光,利用电子束蒸镀在CNT沟道层上表面制备3nm的金属钇,通过270度热板在空气中对器件进行氧化形成氧化钇,然后在平整的氧化钇上表面滴加高浓度的离子缓冲液并施加一定的电压,源极接地,使栅源之间形成一定的电压差,通过电化学方法使得氧化钇在缓冲液和加压的作用下形成波浪状的表面;
步骤6,再一次进行匀胶、光刻、显影处理,在制备好的波浪状介质层表面用电子束蒸发镀膜仪蒸镀上金纳米颗粒;
步骤7,最后再次进行光刻显影步骤对源极电极、漏极电极以及金属引线进行封装,使得在所述生物传感器在测量目标生物分子时,仅波浪状传感界面和施加栅极电压的银丝暴露在液体环境中,其中所述波浪状传感界面由波浪状介电层作为基础并修饰金纳米颗粒构成,相邻的两颗金纳米颗粒之间不接触。
作为可选的实施方式,波浪状介电层为氧化钇,其厚度为6nm左右、化学刻蚀的溶液为高离子浓度的PBS缓冲液,施加电压为-1.5V。
由此,结合上述技术方案的波浪状传感界面的碳纳米管场效应晶体管生物传感器,其利用碳纳米管(CNT)作为沟道材料,以波浪状的氧化钇作为介电层,设计新型的晶体管型生物传感器,检测单元的尺寸为微米级,解决了传统的生物传感器程序复杂,成本高的缺点,能够在小尺寸的范围内集成多个传感单元。在制备工艺上可与标准的微纳加工工艺兼容,在生物相容性方面,可以用同种探针修饰的过程对多种生物探针进行固定从而达到检测多种目标分析物的目的。
根据本发明目的的第三方面,提出一种波浪状传感界面的碳纳米管场效应晶体管生物传感器在早期肺癌筛查血清标志物检测中的应用。
本发明提出的在波浪状传感界面的碳纳米管场效应晶体管生物传感器,尤其是可应用在早期肺癌筛查血清标志物检测中,其中的波浪状介电层氧化钇,在抗原与生物探针抗体结合后,形成电导值不同,由此实现对目标生物分子的检测。与现有技术采用电化学发光分析仪检测方法相比,现有技术检测过程中需要对待检液体进行预处理,且操作的仪器庞大昂贵,需要几个小时的时间才能得到结果,还可能因为仪器灵敏度较低的问题导致出现误诊的结果。而本发明设计的晶体管型生物传感器能够集成化,可由微纳加工制成,特殊的波浪状传感界面设计,使得晶体管栅极双电层电容更大,使得传感器的具有灵敏度高的特点,响应时间更快。
同时,本发明设计的传感器相较于平整界面的晶体管,比表面积更大能够固定更多的探针分子,使得传感器的线性范围更宽。
附图说明
附图不意在按比例绘制。在附图中,在各个图中示出的每个相同或近似相同的组成部分可以用相同的标号表示。为了清晰起见,在每个图中,并非每个组成部分均被标记。现在,将通过例子并参考附图来描述本发明的各个方面的实施例。
图1是本发明示例性实施例的波浪状传感界面的碳纳米管场效应晶体管生物传感器的三维示意图。
图2是本发明图1实施例的晶体管型生物传感器的从器件顶部俯视的各部分示意图。
图3是本发明图1实施例的生物传感器的制备流程示意图。
图4是本发明图1实施例的生物传感器的检测原理示意图。
图5是本发明图1实施例的生物传感器的测量过程中施加栅极电压和扫描电压的示意图。
图6(a)-6(b)是本发明图1实施例的生物传感器与平整介电层的生物传感器电容对比示意图。
图7(a)-7(b)是本发明图1实施例的生物传感器与平整介电层生物传感器同时检测不同浓度CEA分子时的转移曲线示意图。
图8是根据图1实施例的生物传感器与平整介电层检测CEA的线性校准曲线结果示意图。
图9是根据图1实施例的生物传感器的特异性测试结果示意图。
图10(a)-10(b)是根据图1实施例的生物传感器在胎牛血清环境下测试CEA灵敏度的结果示意图。
具体实施方式
为了更了解本发明的技术内容,特举具体实施例并配合所附图式说明如下。
在本公开中参照附图来描述本发明的各方面,附图中示出了许多说明的实施例。本公开的实施例不必定意在包括本发明的所有方面。应当理解,上面介绍的多种构思和实施例,以及下面更加详细地描述的那些构思和实施方式可以以很多方式中任意一种来实施,这是因为本发明所公开的构思和实施例并不限于任何实施方式。另外,本发明公开的一些方面可以单独使用,或者与本发明公开的其他方面的任何适当组合来使用。
波浪状传感界面的碳纳米管场效应晶体管生物传感器
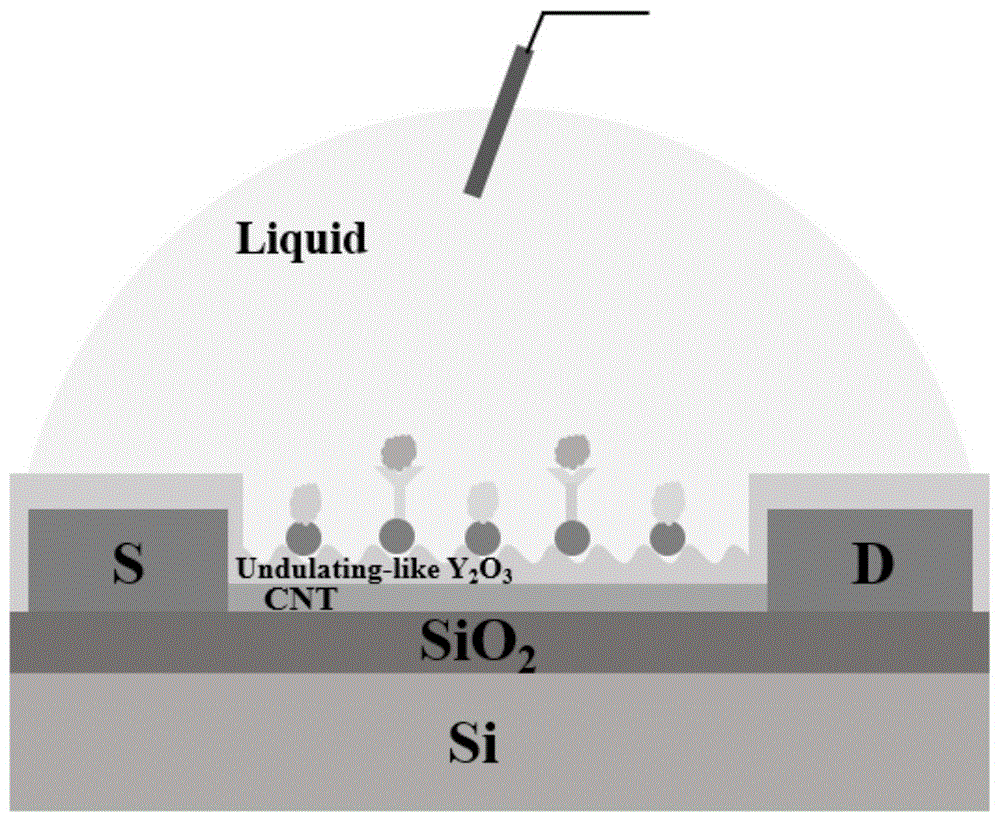
结合图1所示的示例性实施例的在波浪状传感界面的碳纳米管场效应晶体管生物传感器,其包括硅基衬底10、二氧化硅介质层20、漏极电极31、源极电极32、钝化层33、CNT沟道层40、波浪状介电层50以及连接层60。
其中,硅基衬底10限定了第一表面和相对的第二表面,结合图1所示,为了便于说明,以第一表面作为后续制备的生长表面。其中硅基衬底10可采用高掺杂的P型硅。
结合图1,二氧化硅介质层20位于硅基衬底10的第一表面。作为可选的示例,以二氧化硅介质层20为碳纳米管CNT的沉积基底,同时实现CNT与硅基衬底10之间的电性绝缘。
如图1的示例,漏极电极31与源极电极32位于二氧化硅介质层20远离衬底10的一侧表面。漏极电极31与源极电极32相对地设置并隔开布置,位于该二者之间沉积有CNT沟道层40。
如图1的示例,CNT沟道层40位于二氧化硅介质层20远离硅基衬底一侧(即二氧化硅介质层20的上表面),并位于漏极电极31与源极电极32之间的位置。CNT沟道层40具有一定的尺寸,随机平铺在二氧化硅介质层20的上表面,其单根碳纳米管的直径控制在1-3nm。
如图1的示例,波浪状介电层50,位于CNT沟道层40上方远离硅基衬底10的一侧,并且,波浪状介电层要完全覆盖整个CNT沟道区域,且整个漏极电极31、漏极电极32之间的区域均被波浪状介电层覆盖。
结合图2所示,漏极电极31、源极电极32均经由各自对应的金属引线70引到对应的两个输出电极80,实现信号的输出。
溶液栅极和施加栅极电压的银丝,位于波浪状介电层50和连接层50上表面,远离衬底的一侧。栅极的信号输入和输出是通过插入溶液中的银丝来传递的。其中,银丝的直径可选择为0.4mm
其中,溶液栅极可选0.01×PBS,体积为10μL。
在可选的实施例中,输出电极80可电连接至外部设备,例如半导体分析仪,电压信号输入可通过导线对输出电极进行加压,输出信号可通过引线及输出电极传输至外部设备进行信号分析。
可以理解为,金属引线70均经过绝缘封装处理,例如光刻胶S1813,在检测时其与导电部分相互绝缘。
结合图3所示,对于波浪状传感界面的碳纳米管场效应晶体管生物传感器的制备流程,在Si/SiO
CNT薄膜连接源漏极。
波浪状的传感界面是由氧化钇(Y
金纳米颗粒构成连接层60,其理论厚度为0.3nm(对应于单颗的直径约为0.3nm),相邻的金纳米颗粒互不接触。
如图2所示,在漏极电极31与源极电极32的表面以及金属引线70的外表面还制备有钝化层33,例如通过S1813光刻胶封装形成的钝化层,使得生物传感器的导电区域在检测溶液中的生物分子时,不受到溶液环境的影响,仅CNT沟道层和施加电压的银丝暴露在液体环境下。
作为可选的示例,源极电极与漏极电极的厚度相同,并且控制在60-80nm。
作为优选的示例,金属氧化物介电层选用高介电常数的氧化钇,其厚度平均大于等于6nm,利用电化学的方法进行刻蚀,氧化钇与高离子浓度溶液的反应产物附着在介电层上表面,呈现波浪状。电化学处理的溶液为高离子浓度的缓冲液。
作为可选的示例,源极电极31与漏极电极32的长度设计在50μm以上,宽度在5μm以上。源漏电电极之间的距离为20μm。在采用相同长度或者不同长度的漏极电极31与源极电极32的设计中,源极电极31与漏极电极32的长度可达到50μm、100μm,甚至500μm以上。
在可选的实施例中,漏极电极31与源极电极32的宽度可设计成具有相同尺寸或者不同的尺寸。
在优选的实施例中,漏极电极31与源极电极32采用金属Ti/Pd/Au三种,总厚度控制为60-80nm,其中Ti润湿性良好,可以使接触金属更好的附着在衬底上,高功函数的Pd与CNT薄膜接触后可形成P型沟道,Au是作为导电金属。
作为可选的示例,金属引线为与源漏电极同样的金属材料,长度在1000μm以上。
作为可选的示例,输出电极(pad)与源漏电极同样的金属材料,其边长为300μm。
结合图2所示,输出电极80(pad)的尺寸可设计成300*300μm或者根据需要自行设计尺寸,厚度60nm以上。
由此,与传统电化学类生物传感器相比,本发明示例性实施例的波浪状传感界面的碳纳米管场效应晶体管生物传感器,基于其微米级的尺寸可实现生物传感器小型化、易于集成的设计,实现便携、实时的监测体液中的生物分子;同时基于提出的波浪状的传感界面可提供的更多的探针结合位点,使得传感器的灵敏度进一步提高,从而解决传统晶体管型的生物传感器由于器件微型化的过程中探针位点较少的缺点,同时提高器件的电双层电容使得器件的灵敏度提升。
与传统的场效应晶体管型生物传感器相比,本发明提的波浪状传感界面的碳纳米管场效应晶体管生物传感器,基于电化学方法将平整的Y
制备方法
作为可选示例的波浪状传感界面的碳纳米管场效应晶体管生物传感器的制备过程,包括以下步骤:
步骤1、在硅基衬底上沉积一定厚度的SiO
步骤2、在SiO
步骤3、通过匀胶机对沉积有CNT薄膜的Si/SiO
步骤4、使用光刻机将源极电极(S)、漏极电极(D)、金属引线以及施加电压的金属pad进行曝光,使用电子束蒸发镀膜仪沉积一定厚度的金属,形成源极电极(S)、漏极电极(D)、金属引线以及输出电极;
步骤5、再次进行匀胶、曝光,利用电子束蒸镀在CNT沟道层上表面蒸镀金属钇,通过270度热板在空气中对器件进行氧化形成氧化钇,利用电化学刻蚀的方法将平整的介质层刻蚀成波浪状;电化学处理的溶液选择为高离子浓度的缓冲液;
步骤6,再一次进行匀胶、光刻、显影步骤,在制备好的波浪状介质层表面用电子束蒸发镀膜仪蒸镀上连接层;
步骤7,最后再次进行光刻显影步骤对源极电极(S)和漏极电极(D)以及金属引线进行封装,使得在所述生物传感器在测量目标生物分子时,仅所述波浪状的生物传感界面和施加栅极电压的银丝暴露在液体环境中。
作为一个具体的示例,图3所示例性地表示了波浪状传感界面的碳纳米管场效应晶体管生物传感器的一个具体制备过程,包括:
首先,使用紫外光刻机将器件的源极电极、漏极电极、伪参比栅极、金属引线进行曝光,使用电子束蒸发镀膜仪工艺沉积钛钯金三种金属,厚度分别为0.6/20/60nm,形成源极、漏极、金属引线和输出电极(Pad)。
然后,使用LOR和S1813两种光刻胶在匀胶机上对沉积有CNT薄膜的Si/SiO
接着,使用紫外光刻或者激光直写进行匀胶、光刻、显影等步骤形成制备介质层的图案,用电子束蒸发镀膜仪蒸镀3nm的金属钇,热板270度条件下空气中氧化30-40min使得金属钇变成氧化钇,在平整的氧化钇上表面滴加高浓度的离子缓冲液并施加一定的电压,源极接地,使栅源之间形成一定的电压差,此电化学方法使得氧化钇在缓冲液和加压的作用下形成波浪状的表面;
再次,应用匀胶光刻显影电子束蒸镀等步骤制备连接层金纳米颗粒;
最后,再进行匀胶、曝光,对器件的源极电极、栅极电极以及金属引线使用S1813光刻胶进行封装,以保证器件的导电区域在测量体液中的生物分子时不受到溶液环境的影响,只将CNT沟道层、伪参比栅极区域暴露出来,至此制备出波浪状传感界面的碳纳米管场效应晶体管生物传感器。
其中的SiO
优选地,CNT薄膜,其纯度优选达到99.99%以上的网状结构的碳纳米管。
其中的Si/SiO
源漏电极的长度最小控制在50μm以上,宽度最小控制在6μm以上,其厚度60nm以上。
源极电极、漏极电极可采用Ti/Pd/Au三种金属,厚度在60-80nm。
本发明的实施例中,以图4所示示例的方法制备的在片集成伪参比栅极的pH传感器,设计尺寸如下:
源极电极:长50um、宽6um、厚度80nm;
漏极电极:长50um、宽6um、厚度80nm;
输出电极(pad)尺寸为300*300μm以上,厚度为60nm。
肺癌血清癌症标志物CEA的检测
在测试之前需要对沟道表面进行功能化。
第一步:将碳纳米管场效应晶体管在用去离子水稀释的浓度为10mM巯基乙酸中处理一夜,常温下,用1×PBS和去离子水洗涤。在Au NPs表面形成Au-S键和羧基。
第二步:将浓度为0.4M EDC和0.1M NHS的混合溶液等体积的准备好,在4度的环境温度下将芯片在溶液中浸泡30分钟,然后用1×PBS和去离子水彻底清洗。
第三步:将100ug/ml Anti-CEA引入FET芯片,在4C的环境中孵育过夜。用含0.2%SDS的1×PBS、1×PBS、去离子水依次冲洗芯片除去未反应的抗体。
第四步:将芯片与浓度为0.1%牛血清白蛋白孵育浸泡1h,防止可能发生的非特异性结合事件,然后用去离子水冲洗。
在检测时,将待检液体滴在传感器沟道表面,使其与探针充分结合。然后冲洗掉未结合的目标物,再滴加0.01×PBS作为施加电压的栅极。当待测目标物的等电点小于PBS的pH时,目标分子呈负电,当待检溶液环境中的生物分子的浓度升高或降低时,沟道区域的半导体材料碳纳米管中的载流子空穴就是会升高或者降低,从而影响传感器的电流大小。因此,在随着待测分子浓度逐渐增加时传感器的电流会逐渐增加。
基于此原理,结合图4、5所示的检测示意图和施加电压示意图,我们在使用本发明实施例的生物传感器测试癌症标志物CEA时,在传感器的源极电极和漏极电极之间施加一定大小的电压V
每一个浓度的CEA与探针结合后我们可以扫描一个转移曲线,不同浓度的CEA转移曲线会不一样,我们发现浓度越大,转移曲线的阈值电压向正方向移动,曲线的开态电流逐渐增加,如图7(a)所示。其中传感器的灵敏度定义为:取每一个浓度下,一个确定的V
在一些实施例中,栅极施加的扫描电压,可采用半导体分析仪上的sweeping模式扫描。在检测过程中,扫描电压的范围可在-1~1V范围内。例如,采用-0.6~0.6V的扫描电压,与时间成关系。以每秒施加一个电压值,在-0.6~0.6V里面,一共采集200个I
测试对比
以前述实施例制备的生物传感器(CNT-FET)为基础进行测试与分析。
首先我们对比了平整和波浪两种传感界面的电容。循环伏安法(CV)被选为测试方法,通过电化学工作站,有三个电极,包括参考电极、计数器和工作电极。氯化银(Ag/AgCl)、铂(Pt)和附着有Y
在图7(a)和7(b)所示的示例中,对比了平整和波浪状两种传感界面的传感器在引入相同浓度的CEA时传感器的响应大小。每一个CEA的浓度下都有一个转移曲线,对转移曲线的开态电流进行提取后,将传感器的响应值与CEA的关系拟合出来(如图8),线性拟合的曲线中3倍的空白响应对应的CEA的弄对即为最低检测下限。
根据本发明实施例制备的生物传感器的相比于平整界面的生物传感器灵敏度要更高,其检测下限达到72ag/mL,而平整界面的生物传感器的检出下限为115ag/mL。
如图8所示,横坐标为CEA的浓度,纵坐标为漏源电流I
结合图8所示的两种传感界面的检测范围和检测浓度下限的对比,误差棒个数为8表示同样方式制备的8个传感表现了在不同CEA浓度下检测过程中出高度的一致性,可重复性使用。
结合图9所示,针对本发明的生物传感器做了特异性测试,非目标生物分子选择了SCCA、CYFRA21-1、IgG、HSA四种,其中浓度为1ng/mL,目标生物分子的浓度为100pg/mL。由响应的对比结果可知,非目标分子的响应均小于55%,而目标分子的响应超过260%。由此可见本发明所制备的生物传感器特异性良好。
在图10(a)和10(b)所表示为生物传感器检测胎牛血清样本中的CEA的转移曲线变化和响应随浓度的变化,在血清这一复杂的样本中,本发明提出的生物传感器仍能保持和在缓冲液中一样良好的性能,其检测范围也可达7个数量级,检测下限为155ag/mL。
由此可见,基于本发明的示例实施例的波浪状传感界面的碳纳米管场效应晶体管生物传感器,一方面采用波浪状传感界面并结合导体工艺来制备的生物传感器,实现提高传感器的栅极界面电容,从而来提高传感器的灵敏度。同时本发明的生物传感器由于自身小尺寸的优点易于集成到各种控制面板上,从而能够实现便携实时监测;另一方面,采用用波浪状传感界面并结合导体工艺来制备的生物传感器,基于其波浪状的特殊界面,有效的提高了传感器界面的比表面积,增加了传感器与探针分子的结合位点,从而能实现对生物传感器的宽浓度范围的检测,解决了平整界面的微米级晶体管型生物传感器由于其自身尺寸限制导致与探针结合位点少的问题。
虽然本发明已以较佳实施例揭露如上,然其并非用以限定本发明。本发明所属技术领域中具有通常知识者,在不脱离本发明的精神和范围内,当可作各种的更动与润饰。因此,本发明的保护范围当视权利要求书所界定者为准。
- 三维硅纳米线阵列场效应晶体管、生物传感器及制备方法
- 一种基于碳纳米管和三螺旋分子开关的试纸条生物传感器及其制备方法和应用
- 磺化碳纳米管复合辣根过氧化物酶的过氧化氢生物传感器及其制备与应用
- 一种碳纳米管场效应晶体管生物传感器及其制备方法
- 多通道场效应晶体管纳米生物传感器及其制备方法、应用
