表达系统及其构建方法和应用
文献发布时间:2024-04-18 19:58:30
技术领域
本申请涉及合成生物技术和基因工程领域,具体涉及一种表达系统及其构建方法和应用。
背景技术
质粒是一类独立于染色体的可自主复制的遗传因子,在代谢工程研究中被广泛用于目标基因的过表达。相比于基因组整合表达,利用人工质粒表达目标基因具有操作简单、拷贝数高、目标基因表达量高等优点。然而,目前人工开发的质粒载体经常存在不稳定性问题,即重组菌在培养过程中丢失质粒而失去原有的表型特征,进而造成发酵生产不稳定。多数人工质粒都携带有抗生素抗性基因,在实验室发酵过程中添加相应抗生素,可以维持质粒稳定;然而在工业发酵中,抗生素的添加不仅极大地增加成本,而且会限制特定发酵产品的使用范围。再者,抗生素的滥用存在生态安全方面的隐患,可能导致超级耐药菌的出现。因此,开发不依赖于抗生素筛选压力的质粒稳定表达系统,具有重要的应用价值。
研究者已开发了一些维持质粒稳定传代的方法。比如,利用毒素-抗毒素系统(如
发明内容
基于此,本申请提供
具体技术方案如下:
一种表达系统,所述表达系统包括
在其中一个实施例中,所述表达载体还包括目的基因。
一种表达系统的构建方法,包括如下步骤:
将上述表达载体转化至宿主细胞;及
敲除所述宿主细胞基因组上
nadK
所述的表达系统在外源蛋白如外源酶表达,或目标代谢产物合成中的应用。
相对于传统技术,本申请具备如下有益效果:
本申请基于nadK基因开发了一种载体稳定表达系统,既可以提高在不添加抗生素的条件下宿主细胞中载体的传代稳定性;又可促进外源蛋白或外源酶的表达,以及目标代谢产物的合成。进一步将上述的表达系统用于外源蛋白或外源酶的稳定高表达,以及各种目标代谢产物的合成。
附图说明
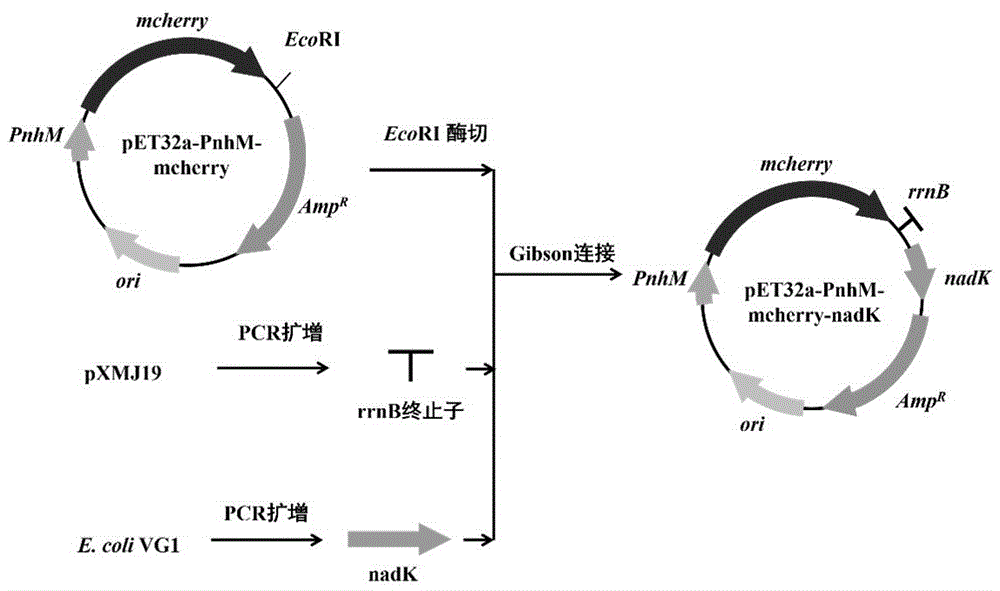
图1为携带
图2为重组大肠杆菌VG1△
图3为重组大肠杆菌VG1△nadK(pET32a-PnhM-mcherry-nadK)与VG1(pET32a-PnhM-mcherry)的质粒稳定性对比;
图4为重组大肠杆菌VG1△nadK(pET32a-PnhM-mcherry-nadK)与VG1(pET32a-PnhM-mcherry)的荧光强度对比;
图5为重组大肠杆菌VG1△nadK(pTU14-nadK)与VG1(pTU14)的质粒稳定性对比;
图6为重组枯草芽孢THY7△nadK(pHT08-Pg3-lacZ-nadK)与THY7 (pHT08-Pg3-lacZ)的质粒稳定性对比;
图7为重组红色红球菌THdAdN△nadK(pNVSm-SBMDB-nadK)与THdAdN(pNVSm-SBMDB)的质粒稳定性对比;
图8为重组谷氨酸棒杆菌ATCC13032△nadK(pXMJ19-Ptac-ssehasA-hasB-nadK)与ATCC13032 (pXMJ19-Ptac-ssehasA-hasB)的质粒稳定性对比。
具体实施方式
为使本申请的上述目的、特征和优点能够更加明显易懂,下面对本申请的具体实施方式做详细的说明。在下面的描述中阐述了很多具体细节以便于充分理解本申请。但是本申请能够以很多不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本申请内涵的情况下做类似改进,因此本申请不受下面公开的具体实施例的限制。
除非另有定义,本文所使用的所有的技术和科学术语与属于本申请的技术领域的技术人员通常理解的含义相同。本文中在本申请的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本申请。
本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
本申请一实施方式提供了一种表达载体,该表达载体包括
nadK
在一个具体示例中,表达载体还包括目的基因。
在一个具体示例中,表达载体还包括启动子和终止子。
在一个具体示例中,目的基因与
在一个具体示例中,表达载体为质粒。可选地,质粒包括pUC系列、pET系列、pNV系列和pXMJ19及其衍生质粒。进一步可选地,质粒包括pUC19、pET32a、pNV18、pXMJ19及其衍生质粒。
在一个具体示例中,目的基因包括目标代谢产物合成相关基因。可选地,目标代谢产物合成相关基因包括目标代谢产物合成相关酶基因。可选地,目标代谢产物包括但不限于透明质酸和PHA。可选地,PHA包括PHB。
在一个具体示例中,目的基因包括荧光报告基因、腈水合酶基因、β-半乳糖苷酶基因、透明质酸合成相关基因和PHA合成相关基因。
可选地,透明质酸合成相关基因包括编码透明质酸合成酶的基因hasA和编码UDP-葡萄糖脱氢酶的基因hasB中的一种或多种。
生物体内,透明质酸合成酶和/或UDP-葡萄糖脱氢酶可催化合成透明质酸。
可选地,PHA合成相关基因包括PHB合成相关基因,PHB合成相关基因包括编码β-酮硫解酶的基因phaA、编码乙酰乙酰辅酶A还原酶的基因phaB和编码PHA聚合酶的基因phaC中的一种或多种。
生物体内,β-酮硫解酶、乙酰乙酰辅酶A还原酶和/或PHA聚合酶可催化合成PHB。
在一个具体示例中,所述
在一个具体示例中,所述
本申请一实施方式还提供了
nadK
本申请一实施方式还提供了一种表达系统,通过表达载体回补宿主菌基因组中
在一个具体示例中,宿主细胞包括原核宿主细胞和真核宿主细胞。
可选地,原核宿主细胞包括大肠杆菌、枯草芽孢杆菌、红球菌和谷氨酸棒杆菌中的一种或多种。
该表达系统具有如下优势:一方面提高了宿主细胞(例如基因工程菌株)的表达载体的传代稳定性,在不添加抗生素的条件下传代培养12次,质粒保留率均大于93%,而对照菌的质粒保留率均低于45%;另一方面促进了各种外源蛋白的表达及目标代谢产物的合成,例如重要微生物合成产物如PHB、透明质酸和腈水合酶等的合成,其中PHB的产量提高15.6%,透明质酸产量提高30.4%,腈水合酶的发酵酶活提高26%。
在一个具体示例中,宿主细胞中
在一个具体示例中,
本申请一实施方式还提供了一种表达系统的构建方法,包括如下步骤:
将上述表达载体转化至宿主细胞;及
敲除宿主细胞基因组上
需要说明的是,表达系统的构建方法中的两个步骤可以不分先后顺序。只要能构建出本申请所述的表达系统即可。本领域技术人员可根据需要进行操作。
本申请一实施方式还提供了一种不依赖于抗生素筛选压力而维持载体(例如质粒)稳定传代的方法,将上述表达载体转化至宿主菌中,敲除所述宿主菌的基因组上
为了实现重组微生物稳定高表达外源蛋白及发酵合成目标代谢产物,本申请一实施方式还提供了一种高效表达外源蛋白和/或合成目标代谢产物的方法,包括:
含有上述的表达载体的
在一个具体示例中,红色荧光蛋白表达的培养基包括LB培养基。
在一个具体示例中,β-半乳糖苷酶表达的培养基包括含有0.5 mM~0.6 mM异丙基-β-D-硫代半乳糖苷的LB培养基。
在一个具体示例中,PHB发酵的培养基包括含有20 g/L~30 g/L葡萄糖的LB培养基。
在一个具体示例中,腈水合酶发酵的培养基包括葡萄糖25 g/L~28 g/L,尿素10g/L~15 g/L,酵母膏1 g/L~2 g/L,蛋白胨10 g/L~12 g/L,KH
在一个具体示例中,透明质酸发酵的培养基包括葡萄糖35 g/L~40 g/L,硫酸铵25g/L~30 g/L,玉米浆粉15 g/L~20 g/L,磷酸二氢钾1 g/L~2 g/L,磷酸氢二钾1 g/L~2 g/L,七水合硫酸镁2 g/L~3 g/L,七水合硫酸亚铁0.05 g/L~0.08 g/L,七水合硫酸锰0.05 g/L~0.08 g/L,pH值为7.0~7.2。
本申请一实施方式还提供了上述的表达系统在外源蛋白表达,或目标代谢产物合成中的应用。
可选地,外源蛋白包括外源酶。
可选地,目标代谢产物包括外源酶催化合成的目标代谢产物。
在一个具体示例中,外源蛋白包括但不限于荧光蛋白、β-半乳糖苷酶、腈水合酶、腈水解酶、环氧化物水解酶、透明质酸合成酶、UDP-葡萄糖脱氢酶、β-酮硫解酶、乙酰乙酰辅酶A还原酶和PHA聚合酶中的至少一种。
在一个具体示例中,目标代谢产物包括PHA和/或透明质酸。
下面将结合实施例对本申请的实施方案进行详细描述。应理解,这些实施例仅用于说明本申请而不用于限制本申请的范围。下列实施例中未注明具体条件的实验方法,优先参考本申请中给出的指引,还可以按照本领域的实验手册或常规条件,还可以按照制造厂商所建议的条件,或者参考本领域已知的实验方法。
下述的具体实施例中,涉及原料组分的量度参数,如无特别说明,可能存在称量精度范围内的细微偏差。涉及温度和时间参数,允许仪器测试精度或操作精度导致的可接受的偏差。
实施例1构建基因组
基于
1. 构建携带
红色荧光蛋白基因
质粒载体pET32a-PnhM-mcherry-nadK的构建方法如图1所示,具体如下:pET32a-PnhM-mcherry由
用于PHB合成的质粒载体pTU14-nadK的构建方法如下:pTU14质粒(CN1086203C)由
PnhM-mcherry序列(SEQ ID NO:1):
acatctacacattgacatccgttccgatgtgatgtaaaaattgtcacgcgcatgcttaattaagaaggagatatacatatggtgagcaagggcgaggaggataacatggccatcatcaaggagttcatgcgcttcaaggtgcacatggagggctccgtgaacggccacgagttcgagatcgagggcgagggcgagggccgcccctacgagggcacccagaccgccaagctgaaggtgaccaagggtggccccctgcccttcgcctgggacatcctgtcccctcagttcatgtacggctccaaggcctacgtgaagcaccccgccgacatccccgactacttgaagctgtccttccccgagggcttcaagtgggagcgcgtgatgaacttcgaggacggcggcgtggtgaccgtgacccaggactcctccctgcaggacggcgagttcatctacaaggtgaagctgcgcggcaccaacttcccctccgacggccccgtaatgcagaaaaagaccatgggctgggaggcctcctccgagcggatgtaccccgaggacggcgccctgaagggcgagatcaagcagaggctgaagctgaaggacggcggccactacgacgctgaggtcaagaccacctacaaggccaagaagcccgtgcagctgcccggcgcctacaacgtcaacatcaagttggacatcacctcccacaacgaggactacaccatcgtggaacagtacgaacgcgccgagggccgccactccaccggcggcatggacgagctgtacaagtga。
大肠杆菌nadK基因序列(SEQ ID NO:2):
tgctgatccatgataatttcttccggggcttgcccctcaggcgttttctgttctttactactcatgaatttctccgcgtttttttcgcattcatctcgctaacttcgcttattatggggatcagtttcagggtttcaagggaagcactcacattgtcatcaatcttcgcaacaaggacctcggaaaaatgaataatcatttcaagtgtattggcattgtgggacacccacggcaccccactgcactgacaacacatgaaatgctctaccgctggctgtgcacaaaaggttacgaggtcatcgttgagcaacaaatcgctcacgaactgcaactgaagaatgtgaaaactggcacgctcgcggagattgggcaactagctgatctcgcggtagtcgttggtggcgacggtaatatgctgggcgcggcacgcacactcgcccgttacgatattaaagttattggaatcaaccgtggcaacctgggtttcctgactgaccttgaccccgataacgcccagcaacagttagccgatgtgctggaaggccactacatcagcgagaaacgttttttgctggaagcgcaagtctgtcagcaagattgccagaaacgcatcagcaccgcgataaatgaagtggtgcttcatccaggcaaagtggcgcatatgattgagttcgaagtgtatatcgacgagatctttgcgttttctcagcgatctgatggactaattatttcgacgccaacaggctccaccgcctattccctctctgcaggcggtcctattctgaccccctctctggatgcgattaccctggtgcccatgttcccgcatacgttgtcagcacgaccactggtcataaacagcagcagcacgatccgtctgcgtttttcgcatcgccgtaacgacctggaaatcagttgcgacagccagatagcactgccgattcaggaaggtgaagatgtcctgattcgtcgctgtgattaccatctgaatctgattcatccgaaagattacagttatttcaacacattaagcaccaagctcggctggtcaaaaaaattattctaa。
上述过程所用引物如表1。
表1引物及序列
2. 利用Red重组方法构建基因组
将含有Red重组酶的质粒pEcCas(Addgene编号#73227)导入到上述的重组大肠杆菌VG1(pET32a-PnhM-mcherry-nadK)和VG1(pTU14-nadK)中,复苏培养后涂布含100 μg/mL氨苄青霉素和50 μg/mL卡那霉素的LB平板,得到VG1 (pEcCas+pET32a-PnhM-mcherry-nadK)和VG1 (pEcCas+pTU14-nadK),制备成电转化感受态细胞。
以
将nadK-arm-Sm分别电激转化(pEcCas+pET32a-PnhM-mcherry-nadK)和VG1(pEcCas+pTU14-nadK),复苏培养后涂布在含有100 μg/mL氨苄青霉素、50 μg/mL卡那霉素和50 μg/mL壮观霉素的LB平板上,37℃培养24小时,挑选单菌落进行PCR验证,确保
上述过程所用引物如表2。
表2引物及序列
实施例2构建基因组
本实施例利用CRISPR/Cas9方法构建基因组
首先构建携带
然后构建用于
枯草芽孢杆菌THY-7的基因组
枯草芽孢杆菌nadK序列(SEQ ID NO:3):
atgaaatttgccgtatcatcaaaaggagatcaagtttctgatacgctgaaaagcaaaatacaggcgtatttattggattttgatatggaactggatgaaaatgaaccggaaatcgttatttcagtcggaggcgacggaacgcttttgtatgcttttcacagatacagcgaccgtttggacaaaacagcatttgtcggcgttcacacaggtcatctgggtttttatgccgactgggttcctcatgaaattgaaaaacttgttcttgccatcgcgaaaacgccgtatcatacagtcgaatatccgcttctcgaagtcattgtgacctatcacgaaaacgagcgggaagaaagatacttagctttgaatgaatgtacgattaaaagcatcgaaggaagccttgttgctgatgtggaaatcaaagggcagctctttgaaaccttccggggcgacggcctctgcctgtcaactccatcaggcagcacagcctacaataaggcgctgggcggagcgattatccatccgtctatcagggcgatccagcttgcggaaatggcttcaattaataaccgcgtgttccgtacggtcgggtcacctctgcttctcccatcccatcatgattgcatgattaagccgagaaacgaagttgactttcaagtgacgattgaccatttaacccttctccataaggatgtaaagtcgatccgctgccaagttgcatccgaaaaagtgcggtttgcgagattccgtccgtttccattttggaaaagagtccaggattcgtttattggaaaaggtgaatag。
上述过程所用引物如表3。
表3引物及序列
实施例3构建基因组
本实施例的目的是利用同源重组双交换法构建基因组
首先构建携带nadK基因的质粒载体pNVSm-SBMDB-nadK,方法如下:质粒载体pNVSm-SBMDB(CN107177581A)由
构建用于敲除红色红球菌
进一步采用同源重组双交换的方法敲除红色红球菌THdAN基因组的
红色红球菌nadK序列(SEQ ID NO:4):
gtgaccacagatagtgcagcgcccggcccggagcgcgcgacccgcgaggtcctgctcgtgtcccactcgggacgggtcgagatcgccgcgacggcgcagcgcacggcgaagatcttcggcgaggccggcatcgggctgcgggtgctcgacgacgaggtcgccagcaccggtctgggtcccctggccggacccgagggccgggtccgcatcgtcgaacccggaccggacgccgcccggggttgcgagatggtgatcgtgctcggcggcgacggcagtttcctgcgcgccgccgaactggcccagtgcgcgacggtgcccgtgctcggaatcaacctgggacgcatcggtttcctcgccgaggccgagaccgagcatctcgaggaggcgctggcacaggtggtgcgccgcgagtaccgggtcgaggagcggatgacgctggacgtcgcgatccgggtcgacgacgcgatcgtcgaccggggatgggcgctcaacgaggccagcctcgagaacaagtcccgcctgggcgtgctcgaggtggtgctcgaggtcgacggtcggccggtgtcggcgttcggatgcgacggagtgctgatcgccaccccgaccggctcgaccgcctacgcgttctccgccggcggcccgatcgtctggccggaactcgaagcgttgctggtgattcccagcaacgcccacgctctgttcgcccggcccatggtgaccagcccggaatcgctgatcgccgtggagaccctcgccggcagccacgacgggctggtgttctgcgacggccgccgcaccctcgacctgcccgcgggtgggcggctcgaggtggtccgcggcaagcatcccgtgcggtgggtgcgcctggactcggcgccgttcgccgaccgaatggtgcgcaagttcgatcttccggtgaagggctggcggggaaggagactgtga。
上述过程所用引物如表4。
表4引物及序列
实施例4构建基因组nadK缺失型重组谷氨酸棒杆菌ATCC13032△nadK(pXMJ19-Ptac-ssehasA-hasB-nadK)
本实施例是利用同源重组双交换法构建基因组
首先构建质粒pXMJ19-Ptac-ssehasA-hasB-nadK,方法如下:质粒pXMJ19-Ptac-ssehasA-hasB(Cheng, et al., Biotechnology Journal, 2016, 11, 574–584)由
构建用于敲除谷氨酸棒杆菌
进一步采用同源重组双交换的方法敲除谷氨酸棒杆菌ATCC13032基因组的
谷氨酸棒杆菌nadK序列(SEQ ID NO:5):
atgactgcacccacgaacgctggggaactcaggcgagttttgctggttccacacaccgggcgttcttccaatattgaatccgccatcttggcagccaagctgctcgacgatgctggaatcgatgtgagggtgctgatcaatgatgcagatgatccaattgcagagcactccgttttaggccgtttcacccatgtcaggcacgctgcagacgccgctgacggcgcagaactagttctggtgctgggtggagatggcaccttcctccgcgcagcagatatggcccacgctgttgatttgcctgttctgggcatcaacctaggccatgtgggattcttggctgaatgggagtctgactcacttgaagaggcactcaaacgtgtgatcgaccgcgattaccgtattgaagatcgcatgaccttaactgtcgttgtcctagacggcggtggagaagaaatcggccgaggctgggctctcaatgaggtcagtattgaaaacttaaaccgcaggggagtgctcgatgcaaccctcgaggtagatgcacgaccagttgcttcctttggttgcgatggcgtgctgatttccaccccaaccggctccaccgcttatgcattttccgccggtggtcctgtactgtggccagaactcgatgccatcttggtggttcctaataacgcccacgcgctgtttaccaaaccgctggttgtgagcccaaaatccaccgtagctgtggaatccaattcagatacttcagcagcgatggccgtcatggatggtttccgtcccattcctatgcctccaggatcccgtgttgaggtcaccaggggtgagcgtcccgtgcgttgggtgaggcttgattcttcaccgtttaccgaccgacttgtgagcaaattaaggctccccgttaccggttggcggggtccgcaaaaacaggcggaaaataaagatcccaggtcagcggggtaa。
上述过程所用引物如表5。
表5引物及序列
实施例5重组菌株VG1△nadK(pET32a-PnhM-mcherry-nadK)及对照菌VG1(pET32a-PnhM-mcherry)的质粒稳定性和荧光强度评价
本实施例是评价基于
重组菌株VG1△nadK(pET32a-PnhM-mcherry-nadK)及对照菌VG1(pET32a-PnhM-mcherry),分别接种至不含抗生素的LB培养基,37℃传代培养累计12次,每次的转接比例为1%,培养时间为12小时,每次培养结束后测定mcherry荧光强度,将菌液适当稀释后涂布到不含或者含100 μg/mL氨苄青霉素的LB平板上,并进行菌落计数,计算质粒保留率(即抗生素平板与无抗生素平板上的菌落数的比值)。
传代过程中的质粒保留率如图3所示,转接12次后,对照菌VG1(pET32a-PnhM-mcherry)的质粒保留率仅有25%,而VG1△nadK(pET32a-PnhM-mcherry-nadK)的质粒保留率为95%,说明本申请的方法可以显著提高质粒的传代稳定性。传代过程中的荧光强度的变化如图4所示,质粒上过表达
实施例6重组菌株VG1△nadK(pTU14-nadK)和对照菌VG1(pTU14)的质粒稳定性和PHB产量评价
本实施例是评价基于
重组菌株VG1△nadK(pTU14-nadK)及对照菌VG1(pTU14),分别接种至不含抗生素、含20 g/L葡萄糖的LB培养基,37℃传代培养累计12次,每次的转接比例为1%,培养时间为12小时,每次培养结束后将菌液适当稀释后涂布到不含或者含100 μg/mL氨苄青霉素的LB平板上,并进行菌落计数,计算质粒保留率(即抗生素平板与无抗生素平板上的菌落数的比值)。第1次和第12次传代的培养液,按照1%的比例接种至含30g/L葡萄糖的LB培养基中,37℃、200 rpm培养48小时,测定PHB含量(测定方法参考CN1086203C)。
传代过程中的质粒保留率如图5所示,转接12次后,对照菌VG1(pTU14)的质粒保留率为45%,而VG1△nadK(pTU14-nadK)的质粒保留率为96%。第1次和第12次转接菌液的PHB产量如表6所示,VG1△nadK(pTU14-nadK)的初始PHB产量比对照菌提高15.6%;传代12次后,VG1△nadK(pTU14-nadK)的产量基本不变(初始水平的94.2%),而对照菌产量仅剩余39.2%。结果表明,本申请基于nadK的质粒稳定表达系统不仅可以提高大肠杆菌的质粒传代稳定性,而且对于PHB的合成有促进作用。
表6重组大肠杆菌的PHB产量对比
进一步,5 L发酵罐里发酵培养VG1△nadK(pTU14-nadK)和VG1(pTU14)。挑取单菌落接种到含20 g/L葡萄糖的LB培养基中,37℃培养12小时后,按照10%比例接种至5 L发酵罐(含40 g/L葡萄糖的LB培养基,装液量2 L),培养温度为37℃、初始搅拌转速为200-400rpm,pH控制为6.5-7.5,发酵过程中根据需要补加酵母膏、葡萄糖和硫酸铵,使发酵前期和中期的葡萄糖浓度维持在20~40 g/L,硫酸铵浓度维持在1~2 g/L,碳氮比保持在10~20之间;当溶氧降低时,逐步调整搅拌转速,使溶氧保持在5%以上,发酵48~65 h小时结束。在不添加抗生素条件下,发酵培养48小时,PHB产量高达152 g/L;而对比菌株VG1(pTU14)不添加抗生素的PHB产量仅为88 g/L,在添加抗生素条件下,PHB产量为102 g/L。基于
实施例7重组枯草芽孢杆菌THY-7△nadK(pHT08-Pg3-lacZ-nadK)和对照菌THY-7(pHT08-Pg3-lacZ)的质粒稳定性和β-半乳糖苷酶活性评价
本实施例是评价基于
重组菌株THY-7△nadK(pHT08-Pg3-lacZ-nadK)及对照菌THY-7 (pHT08-Pg3-lacZ),分别接种至不含抗生素、含有0.5mM异丙基-β-D-硫代半乳糖苷的LB培养基,37℃传代培养累计12次,每次的转接比例为1%,培养时间为12小时,每次培养结束后将菌液适当稀释后涂布到不含或者含5ug/mL氯霉素的LB平板上,并进行菌落计数,计算质粒保留率(即抗生素平板与无抗生素平板上的菌落数的比值)。第1次和第12次传代的培养液,测定β-半乳糖苷酶活性(测定方法参考Jiao, et al., Biotechnol. Bioeng., 2017, 114: 832-842.)。
传代过程中的质粒保留率如图6所示,转接12次后,对照菌THY-7 (pHT08-Pg3-lacZ)的质粒保留率仅为12%,而THY-7△nadK(pHT08-Pg3-lacZ-nadK)的质粒保留率达到97%。第1次和第12次转接菌液的β-半乳糖苷酶活性如表7所示,THY-7△nadK(pHT08-Pg3-lacZ-nadK)的初始β-半乳糖苷酶活性与对照菌几乎没有区别,但传代12次后显著高于对照菌。结果表明,基于
表7 重组枯草芽孢杆菌的β-半乳糖苷酶活性对比
实施例8重组红色红球菌THdAdN△nadK(pNVSm-SBMDB-nadK)和对照菌THdAdN(pNVSm-SBMDB)的质粒稳定性和腈水合酶活性评价
本实施例是评价基于
重组菌株THdAdN△nadK(pNVSm-SBMDB-nadK)及对照菌THdAdN (pNVSm-SBMDB),分别接种至不含抗生素的红球菌种子培养基(葡萄糖10-50 g/L,酵母膏1-4 g/L,蛋白胨1-10g/L,KH
传代过程中的质粒保留率如图7所示,转接12次后,对照菌THdAdN (pNVSm-SBMDB)的质粒保留率仅为34%,而THdAdN△nadK(pNVSm-SBMDB-nadK)的质粒保留率达到93%。使用第1次和第12次转接菌液进行发酵培养,腈水合酶活性如表8所示,THdAdN△nadK(pNVSm-SBMDB-nadK)的初始腈水合酶活性比对照菌提高25%,且传代12次酶活几乎没有降低;而对照菌在传代12次后酶活降低至原有水平的26%。结果表明,基于nadK的质粒稳定表达系统不仅可以提高重组红色红球菌的质粒传代稳定性,而且对于腈水合酶的表达具有明显的促进作用。
表8 重组红色红球菌的腈水合酶活性对比
实施例9重组谷氨酸棒杆菌ATCC13032△nadK(pXMJ19-Ptac-ssehasA-hasB-nadK)和对照菌ATCC13032 (pXMJ19-Ptac-ssehasA-hasB)的质粒稳定性和透明质酸产量评价
本实施例是评价基于
重组谷氨酸棒杆菌ATCC13032△nadK(pXMJ19-Ptac-ssehasA-hasB-nadK)和对照菌ATCC13032 (pXMJ19-Ptac-ssehasA-hasB),分别接种至不含抗生素、含有20g/L葡萄糖的LB培养基,30℃传代培养累计12次,每次的转接比例为1%,培养时间为24小时,每次培养结束后将菌液适当稀释后涂布到不含或者含5ug/mL氯霉素的LB平板上,并进行菌落计数,计算质粒保留率(即抗生素平板与无抗生素平板上的菌落数的比值)。第1次和第12次传代的培养液,接种至发酵培养基(葡萄糖40 g/L,硫酸铵30 g/L,玉米浆粉20 g/L,磷酸二氢钾1g/L,磷酸氢二钾1 g/L,七水合硫酸镁2 g/L,七水合硫酸亚铁0.05 g/L,七水合硫酸锰0.05g/L,pH值为7.2),28℃培养3小时后加入1mM异丙基-β-D-硫代半乳糖苷,继续培养至48小时,测定透明质酸浓度(测定方法参考Cheng,et al., Biotechnology Journal, 2016,11, 574–584)。
传代过程中的质粒保留率如图8所示,转接12次后,对照菌ATCC13032 (pXMJ19-Ptac-ssehasA-hasB)的质粒几乎完全丢失,而ATCC13032△nadK(pXMJ19-Ptac-ssehasA-hasB-nadK)的质粒保留率达到94%。使用第1次和第12次转接菌液进行发酵培养,透明质酸产量如表9所示,ATCC13032△nadK(pXMJ19-Ptac-ssehasA-hasB-nadK)的初始透明质酸产量比对照菌提高30.4%,传代12次后的产量为原水平的92%;而对照菌在传代12次后产量为零。结果表明,基于nadK的质粒稳定表达系统不仅可以提高谷氨酸棒杆菌的质粒传代稳定性,而且对于透明质酸的合成具有明显的促进作用。
表9 重组谷氨酸棒杆菌的透明质酸产量对比
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本申请的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本申请构思的前提下,还可以做出若干变形和改进,这些都属于本申请的保护范围。因此,本申请专利的保护范围应以所附权利要求为准,说明书可以用于解释权利要求的内容。
- PLC围手术期肝移植患者环状RNA差异性表达谱图谱模型及其构建方法和构建系统
- 肿瘤特异性基因表达盒、重组表达载体及构建方法和应用
- 肿瘤特异性基因表达盒、重组表达载体及构建方法和应用
- 一种应用酵母表达系统表达可溶性生长刺激表达基因2蛋白的方法
- 人源化细胞瞬时表达用表达载体、表达系统、构建方法及其应用
- β-甘露聚糖酶突变体食品级枯草芽孢杆菌表达载体、表达系统、构建方法和应用
