黑皮质素受体激动剂化合物的有机酸盐的晶型IV及其制备方法
文献发布时间:2024-04-18 19:58:53
技术领域
相关申请的交叉引用
本发明基于2021年5月7日提交的韩国专利申请号10-2021-0059133要求优先权权益,该韩国专利申请的全部公开内容作为本说明书的一部分并入。
技术领域
本发明涉及一种对黑皮质素受体表现出优异的激动剂活性的新型化合物的晶型IV、其制备方法以及包含其的药物组合物。
背景技术
瘦素蛋白是一种由脂肪细胞分泌的激素,其分泌量随着体脂含量的增加而增加。它调节下丘脑产生的各种神经肽的功能,从而调节各种体内功能,包括食欲、体脂含量和能量代谢(Schwartz等人,Nature 404,661-671(2000))。控制食欲和体重的瘦素蛋白信号转导是通过调节许多下游因子来进行,其中最具代表性的是黑皮质素、刺鼠相关肽(AgRP)和神经肽Y(NPY)激素。
当体内热量过多导致血液中瘦素浓度增加时,来自垂体腺的阿黑皮素原(POMC)蛋白激素的分泌增加,AgRP和NPY的产生减少。小肽激素α-黑素细胞刺激激素(MSH)由POMC神经元产生。该激素是次级神经元的黑皮质素-4受体(MC4R)的激动剂,最终导致食欲下降。同时,当瘦素浓度因热量不足而降低时,MC4R拮抗剂AgRP的表达增加,NPY的表达也增加,最终增强食欲。即,根据瘦素的变化,α-MSH激素和AgRP激素充当MC4R的激动剂和拮抗剂,因此参与食欲控制。
除MC4R以外,α-MSH激素还结合三种MCR亚型以诱导各种生理反应。迄今已经鉴定了五种MCR亚型。其中,MC1R主要在皮肤细胞中表达并参与调节黑色素沉着(皮肤色素沉着)。MC2R主要在肾上腺中表达,已知参与糖皮质激素的产生。其配体只有来源于POMC的促肾上腺皮质激素(ACTH)。主要在中枢神经系统中表达的MC3R和MC4R参与调节食欲、能量代谢和体脂储存效率,而在各种组织中表达的MC5R已知调节外分泌功能(Wikberg等人,PharmRes 42(5)393-420(2000))。特别地,激活MC4R受体诱导食欲下降和能量代谢增加,因此具有有效减轻体重的效果。因此,它已经被证明是抗肥胖药物开发的主要作用点(综述:Wikberg,Eur.J.Pharmacol 375,295-310(1999));Wikberg等人,Pharm Res 42(5)393-420(2000);Douglas等人,Eur J Pharm 450,93-109(2002);O'Rahilly等人,Nature Med 10,351-352(2004))。
MC4R在控制食欲和体重中的作用已通过在刺鼠蛋白异常表达动物模型(agouti小鼠)中的实验得到了初步证明。在agouti小鼠的情况下,发现由于基因突变之故,刺鼠蛋白在中枢神经系统中以高浓度表达,并在下丘脑中充当MC4R的拮抗剂,从而导致肥胖(Yen,TT等人,FASEB J.8,479-488(1994);Lu D.等人,Nature 371,799-802(1994))。随后的研究结果表明,与实际刺鼠蛋白类似的刺鼠相关肽(AgRP)在下丘脑神经中表达,已知这些肽是MC4R拮抗剂并参与控制食欲(Shutter等人,Genes Dev.,11,593-602(1997);Ollman等人,Science 278,135-138(1997))。
对动物脑内施用体内MC4R激动剂α-MSH产生了降低食欲的效果。当用MC4R拮抗剂SHU9119(肽)或HS014(肽)处理所述动物时,观察到食欲再次增加(Kask等人,Biochem.Biophys.Res.Comm.245,90-93(1998))。此外,在使用美拉诺坦II(MTII,Ac-Nle-c[Asp-His-DPhe-Arg-Trp-Lys]-NH2)及其类似激动剂HP228的动物研究中,在脑内、腹膜内或皮下施用后,发现了抑制食欲、减轻体重和增加能量代谢等功效。(Thiele T.E.等人,AmJ Physiol 274(1Pt 2),R248-54(1998);Lee M.D.等人,FASEB J 12,A552(1998);MurphyB.等人,J Appl Physiol 89,273-82(2000))。相比之下,向动物施用代表性SHU9119表现出显著且持续的采食量和体重增加,从而提供了MCR激动剂可能是抗肥胖剂的药理学证据。施用MTII后明显表现出来的食欲降低效果在MC4R敲除(KO)小鼠中没有观察到。该实验结果再次证明食欲降低效果主要通过激活MC4R来实现(Marsh等人,Nat Genet 21,119-122(1999))。
作用于中枢神经系统的食欲抑制剂是迄今开发的抗肥胖药物中的主要类型。其中,大部分是调节神经递质作用的药物。实例包括去甲肾上腺素剂(芬特明(phentermine)和马吲哚(mazindol))、血清素能剂、氟西汀(fluoxetine)和西布曲明(sibutramine)等。然而,除了食欲抑制以外,神经递质调节剂还通过许多亚型受体对各种生理作用具有广泛影响。因此,所述调节剂缺乏对每一种亚型的选择性,因此主要缺点是它们在长期施用时会伴随各种副作用。
同时,黑皮质素激动剂是神经肽,而不是神经递质。鉴于在MC4R基因KO小鼠中,除能量代谢外的所有功能都正常,因此黑皮质素激动剂作为作用点的优势在于它们仅会通过食欲抑制来诱导体重减轻,而不会影响其它生理功能。特别地,该受体是G蛋白偶联受体(GPCR),属于迄今开发的新药作用点中最成功的类别。因此,所述作用点与现有作用点有很大的不同,因为它相对容易确保对亚型受体的选择性。
作为利用黑皮质素受体作为作用点的实例,国际公开第WO 2008/007930号和第WO2010/056022号公开了作为黑皮质素受体激动剂的化合物。
此外,本发明的发明人已经进行了广泛的研究,并发明了一种具有优异的激动剂活性的下式1的新化合物,所述化合物对黑皮质素受体,特别是黑皮质素-4受体(MC4R)具有选择性;以及一种制备所述化合物的方法(申请号KR 10-2019-0141649(于2019年11月7日提交)):
[式1]
(其中R
同时,药物活性成分的晶体结构往往会影响药物的化学稳定性。不同的结晶条件和储存条件可以导致化合物的晶体结构发生变化,有时还会伴随产生其它形式的晶型。通常,无定形药物产品不具有规则的晶体结构,而且往往存在其它缺点,如产品稳定性差、粒径较小、过滤困难、容易结块和流动性差。因此,有必要改善产品的各种物理性能。因此,对于单一化合物,有必要研究具有高纯度和良好化学稳定性的晶体结构。
[现有技术文献]
[专利文献]
(专利文献1)国际专利申请公开号WO 2008/007930
(专利文献2)国际专利申请公开号WO 2010/056022
发明内容
技术问题
本发明的一个方面提供了一种具有优异的激动剂活性且对黑皮质素受体,特别是黑皮质素-4受体(MC4R)具有选择性的新型化合物的稳定晶型,以及其制备方法。
本发明的另一个方面提供了一种包含所述新型化合物的稳定晶型的药物组合物。
技术解决方案
根据本发明的一个方面,
提供了一种下式1化合物的有机酸盐的晶型IV,其中X射线粉末衍射(XRPD)图案存在具有i)、ii)或iii)中所述的衍射角(2θ值)的特征峰:
i)选自7.63±0.2°、9.36±0.2°、9.60±0.2°、12.59±0.2°、14.0±0.2°、14.99±0.2°、15.26±0.2°、16.76±0.2°、17.8±0.2°、18.86±0.2°、18.89±0.2°、19.00±0.2°、19.21±0.2°、19.37±0.2°、20.13±0.2°、20.38±0.2°、20.63±0.2°、20.72±0.2°、22.14±0.2°和22.33±0.2°的5个以上特征峰;
ii)选自8.47±0.2°、10.86±0.2°、11.99±0.2°、12.21±0.2°、13.47±0.2°、15.08±0.2°、15.19±0.2°、16.80±0.2°、17.25±0.2°、17.45±0.2°、17.86±0.2°、18.77±0.2°、20.26±0.2°、20.44±0.2°、21.51±0.2°、21.81±0.2°、22.00±0.2°、22.66±0.2°、24.97±0.2°和25.36±0.2°的5个以上特征峰;
选自4.27±0.2°、6.56±0.2°、8.87±0.2°、9.86±0.2°、14.72±0.2°、15.16±0.2°、15.74±0.2°、16.14±0.2°、16.72±0.2°、16.91±0.2°、17.09±0.2°、17.27±0.2°、17.52±0.2°、17.81±0.2°、18.00±0.2°、18.33±0.2°、19.67±0.2°、20.30±0.2°、21.23±0.2°和23.97±0.2°的5个以上特征峰,
[式1]
其中
R
由于式1化合物可以具有不对称的碳中心和不对称的轴或不对称的平面,因此它可以作为顺式或反式异构体、R或S异构体、外消旋体、非对映体混合物和单个非对映体存在,所有这些都在式1化合物的范围内。
在本说明书中,除非另有规定,否则为了方便起见,使用式1化合物来包括所有的式1化合物、其异构体及其溶剂化物。
在根据本发明的一个实施方式中,在式1中,R
在根据本发明的另一个实施方式中,在式1中,R
在根据本发明的一个实施方式中,溶剂化物可以包括水合物;以及与有机溶剂例如甲醇、乙醇、2-丙醇、1,2-丙二醇、1,3-丙二醇、正丁醇、1,4-丁二醇、叔丁醇、乙酸、丙酮、乙酸丁酯、乙酸甲酯、乙酸乙酯、乙酸丙酯、乙酸叔丁酯、乙酸异丁酯、甲基乙基酮、2-戊酮、四氢呋喃、乙腈、三氯甲烷、甲苯及其混合物的溶剂化物。
本发明提供了一种式1化合物的有机酸盐的晶型IV。
在根据本发明的一个实施方式中,所述有机酸盐是药学上可接受的盐,并且可以包括但不限于由下列酸形成的酸加成盐:无机酸,如盐酸、硫酸、硝酸、磷酸、氢溴酸和氢碘酸;有机羧酸,如酒石酸、甲酸、柠檬酸、乙酸、三氯乙酸、三氟乙酸、葡萄糖酸、苯甲酸、乳酸、富马酸和马来酸;或磺酸,如甲磺酸、苯磺酸、对甲苯磺酸或萘磺酸。
在根据本发明的另一个实施方式中,式1化合物的有机酸盐可以是由选自乳酸、苯磺酸和甲苯磺酸的至少一种有机酸形成的酸加成盐。
在根据本发明的另一个实施方式中,与式1化合物的无机酸盐或由除乳酸、苯磺酸和甲苯磺酸以外的有机酸形成的有机酸盐相比,式1化合物的选自乳酸盐、苯磺酸盐和甲苯磺酸盐的有机酸盐可以具有优越的物理性质,如化合物的稳定性和溶解度。然而,本发明的效果不限于此。
在根据本发明的一个实施方式中,式1化合物的有机酸盐的晶型IV可以是式1化合物的乳酸盐的晶型A,所述晶型在X射线粉末衍射图案中具有选自7.63±0.2°、9.36±0.2°、9.60±0.2°、12.59±0.2°、14.0±0.2°、14.99±0.2°、15.26±0.2°、16.76±0.2°、17.8±0.2°、18.86±0.2°、18.89±0.2°、19.00±0.2°、19.21±0.2°、19.37±0.2°、20.13±0.2°、20.38±0.2°、20.63±0.2°、20.72±0.2°、22.14±0.2°和22.33±0.2°的5个以上、7个以上、9个以上、10个以上、13个以上、15个以上、17个以上或者20个以上特征峰。
根据本发明的一个实施方式的晶型A在X射线粉末衍射图案中可以具有7.63±0.2°、9.36±0.2°、9.60±0.2°、12.59±0.2°、14.0±0.2°、14.99±0.2°、15.26±0.2°、16.76±0.2°、17.8±0.2°、18.86±0.2°、18.89±0.2°、19.00±0.2°、19.21±0.2°、19.37±0.2°、20.13±0.2°、20.38±0.2°、20.63±0.2°、20.72±0.2°、22.14±0.2°和22.33±0.2°的特征峰。
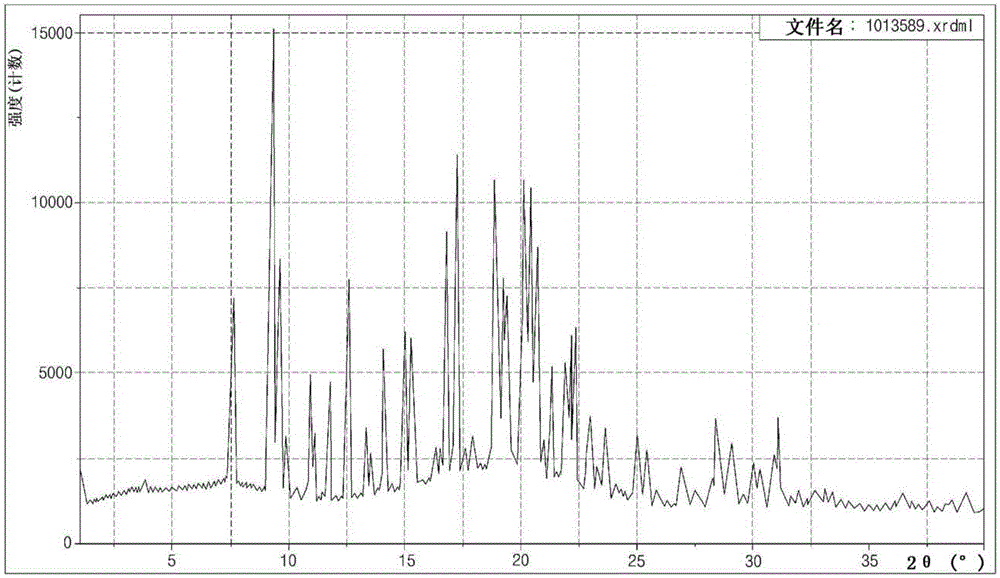
在根据本发明的一个实施方式中,晶型A可以具有图1所示的X射线粉末衍射(XRPD)图案。
在根据本发明的一个实施方式中,晶型A在热重分析(TGA)曲线中在约38℃至110℃的温度范围内的重量损失可以为5%以下、4%以下、3%以下、2%以下、1%以下或1%,和/或可能在超过约274℃时分解。
在根据本发明的一个实施方式中,晶型A在差示扫描量热(DSC)曲线中可以具有在约80℃至110℃处的吸热峰,这在TGA曲线中发生重量损失的温度范围内,并且可以具有在约110℃至120℃处的放热峰。
在根据本发明的一个实施方式中,晶型A可以具有图2所示的TGA(上)和/或DSC(下)曲线。
在根据本发明的一个实施方式中,如通过热台显微术(HSM)所测定,晶型A可以在约84.2℃至112.7℃熔融。
在根据本发明的一个实施方式中,晶型A可以具有图3和图4所示的HSM照片。
在根据本发明的一个实施方式中,晶型A在水溶液中的溶解度可以大于24mg/mL。
在根据本发明的另一个实施方式中,式1化合物的有机酸盐的晶型IV可以是式1化合物的苯磺酸盐的晶型B,所述晶型在X射线粉末衍射图案中具有选自8.47±0.2°、10.86±0.2°、11.99±0.2°、12.21±0.2°、13.47±0.2°、15.08±0.2°、15.19±0.2°、16.80±0.2°、17.25±0.2°、17.45±0.2°、17.86±0.2°、18.77±0.2°、20.26±0.2°、20.44±0.2°、21.51±0.2°、21.81±0.2°、22.00±0.2°、22.66±0.2°、24.97±0.2°和25.36±0.2°的5个以上、7个以上、9个以上、10个以上、13个以上、15个以上、17个以上或20个以上特征峰。
根据本发明的另一个实施方式的晶型B在X射线粉末衍射图案中可以具有8.47±0.2°、10.86±0.2°、11.99±0.2°、12.21±0.2°、13.47±0.2°、15.08±0.2°、15.19±0.2°、16.80±0.2°、17.25±0.2°、17.45±0.2°、17.86±0.2°、18.77±0.2°、20.26±0.2°、20.44±0.2°、21.51±0.2°、21.81±0.2°、22.00±0.2°、22.66±0.2°、24.97±0.2°和25.36±0.2°的特征峰。
在根据本发明的另一个实施方式中,晶型B可以具有图5所示的X射线粉末衍射(XRPD)图案。
在根据本发明的另一个实施方式中,晶型B在热重分析(TGA)曲线中在约39℃至150℃的温度范围内的重量损失可以为10%以下、8%以下、6%以下、5.5%以下或5.4%,和/或可以在超过约266℃时分解。所述重量损失可以表示在所述温度范围内蒸发了2.5摩尔水(H
在根据本发明的另一个实施方式中,晶型B在差示扫描量热(DSC)曲线中可以具有在约57℃至93℃处的宽吸热峰,这在TGA曲线中发生重量损失的温度范围内。
在根据本发明的另一个实施方式中,晶型B可以具有图6所示的TGA(上)和/或DSC(下)曲线。
在根据本发明的另一个实施方式中,如通过热台显微术(HSM)所测定,晶型B可以在约122℃至157℃,具体为121.8℃至157.8℃下熔融。
在根据本发明的另一个实施方式中,晶型B可以具有图7和图8所示的HSM照片。
在根据本发明的另一个实施方式中,晶型B在水溶液中的溶解度可以大于1mg/mL。
在根据本发明的另一个实施方式中,式1化合物的有机酸盐的晶型IV可以是式1化合物的甲苯磺酸盐的晶型C,所述晶型在X射线粉末衍射图案中具有选自4.27±0.2°、6.56±0.2°、8.87±0.2°、9.86±0.2°、14.72±0.2°、15.16±0.2°、15.74±0.2°、16.14±0.2°、16.72±0.2°、16.91±0.2°、17.09±0.2°、17.27±0.2°、17.52±0.2°、17.81±0.2°、18.00±0.2°、18.33±0.2°、19.67±0.2°、20.30±0.2°、21.23±0.2°和23.97±0.2°的5个以上、7个以上、9个以上、10个以上、13个以上、15个以上、17个以上或20个以上特征峰。
根据本发明的另一个实施方式的晶型C可以在X射线粉末衍射图案中具有4.27±0.2°、6.56±0.2°、8.87±0.2°、9.86±0.2°、14.72±0.2°、15.16±0.2°、15.74±0.2°、16.14±0.2°、16.72±0.2°、16.91±0.2°、17.09±0.2°、17.27±0.2°、17.52±0.2°、17.81±0.2°、18.00±0.2°、18.33±0.2°、19.67±0.2°、20.30±0.2°、21.23±0.2°和23.97±0.2°的特征峰。
在根据本发明的另一个实施方式中,晶型C可以具有图9所示的X射线粉末衍射(XRPD)图案。
在根据本发明的另一个实施方式中,晶型C在热重分析(TGA)曲线中在约46℃至135℃的温度范围内的重量损失可以为10%以下、8%以下、6%以下、5.5%以下或5.3%,和/或可以在超过约264℃时分解。
在根据本发明的另一个实施方式中,晶型C在差示扫描量热(DSC)曲线中可以具有在约104℃处的宽吸热峰,这在TGA曲线中发生重量损失的温度范围内。此外,晶型C可以具有在约138℃处的放热峰。所述宽吸热峰可能是由于挥发性物质的损失所致,但本发明的特征不限于此。
在根据本发明的另一个实施方式中,晶型C可以具有图10所示的TGA(上)和/或DSC(下)曲线。
在根据本发明的另一个实施方式中,晶型C可以是式1化合物的甲苯磺酸盐与甲基叔丁基醚(MTBE,甲基叔丁基醚)的溶剂化物的晶型。这可以通过根据本发明的另一个实施方式的晶型IV的脱溶剂过程中发生了晶体结构塌陷来证实。
在根据本发明的另一个实施方式中,根据
在根据本发明的另一个实施方式中,晶型C可以具有图11所示的1H NMR光谱。在本文中,甲苯磺酸盐的晶型C可以含有摩尔比为1:1的母体化合物和甲苯磺酸,并且可以含有摩尔比为0.8的MTBE。在本文中,证实了根据本发明的另一个实施方式的晶型C可能是通过晶型C脱溶剂过程中发生晶体结构塌陷而形成的溶剂化物的晶型,但本发明不限于此。
在根据本发明的另一个实施方式中,晶型C在水溶液中的溶解度可以大于10mg/mL。
在本说明书中,X射线粉末衍射(XRPD)分析示出了用PANalytical X'Pert ProMPD系统(Malvern Panalytical有限公司)得到的结果。
热重分析(TGA)和差示扫描量热(DSC)分析示出了用TGA/DSC 3(Mettler-Toledo控股公司)得到的结果。
热台显微术(HSM)示出了由使用Linkman热台(型号FTIR 600)与TMS 93控制器的Leica DM LP显微镜得到的结果。
溶解度表示通过向样品加水,目测证实样品完全溶解时,基于加入样品的水的最终体积得出的测量结果。实际样品的溶解度可能高于测量溶解度。
1
在本文中,温度值可以有±5℃的误差。
与粗式1化合物、无定形式1化合物、式1化合物的其它药学上可接受的盐或式1化合物的其它晶型相比,晶型IV可以具有更高的纯度,并且可以在物理和化学上更稳定。
此外,与已知的黑皮质素-4受体激动剂相比,式1化合物的有机酸盐的晶型IV对黑皮质素-4受体的激动能力和对疾病例如肥胖症、糖尿病、炎症、勃起功能障碍的预防或治疗效果可以更优异。然而,本发明的效果不限于此。
在另一个方面,本发明提供了一种制备晶型IV的方法,所述方法包括以下步骤:制备式1化合物与有机酸混合在第一结晶溶剂中的混合溶液;以及由所述混合溶液得到晶体。
首先,将由式1表示的化合物和有机酸溶解在结晶溶剂(也可称为‘第一结晶溶剂’,以区别于将来的任何额外步骤中额外引入的结晶溶剂(‘第二结晶溶剂’))中。
用于制备所述晶型IV的式1化合物可以是式1化合物、其盐、其异构体或其溶剂化物。
式1化合物可以通过申请号KR 10-2019-0141649(2019年11月7日提交)的说明书中所述的制备方法来获得。
有机酸可以不受特别限制地使用,只要它能形成式1化合物的药学上可接受的酸加成盐即可。
在根据本发明的一个实施方式中,有机酸可以是选自乳酸、苯磺酸和甲苯磺酸的至少一种。
第一结晶溶剂可以不受特别限制地使用,只要它是适用于化合物结晶的溶剂即可。在一个实施方式中,结晶溶剂可以包括有机溶剂。
有机溶剂可以包括脂族线性饱和烃类溶剂,如戊烷、己烷和庚烷;脂环族烃类溶剂,如环戊烷、环己烷和环庚烷;二烷基醚类溶剂,如二乙基醚、二丙基醚、二丁基醚、二异戊基醚、乙基甲基醚、甲基丙基醚、甲基丁基醚和乙基丙基醚;环醚类溶剂,如四氢呋喃和四氢吡喃;含芳族环的醚类溶剂,如二苯基醚和苯甲醚;酰胺类溶剂,如二甲基乙酰胺;酮类溶剂,如甲基异丁基酮;酯类溶剂,如乙酸异丙酯和乙酸异丁酯;醇类溶剂,如乙醇、丙醇、丁醇和戊醇;甲苯类溶剂,如甲苯;或其混合物。
在根据本发明的另一个实施方式中,第一结晶溶剂可以包括乙醇、甲苯、甲基叔丁基醚(甲基叔丁基醚,MTBE)、乙酸异丁酯或其混合物。
在根据本发明的一个实施方式中,第一结晶溶剂可以按足以完全溶解式1化合物的量使用。
在根据本发明的一个实施方式中,与式1化合物相比,混合溶液中可以含有过量摩尔比的有机酸。例如,混合溶液中式1化合物与有机酸的摩尔比可以为1:1至1:2。
将粗式1化合物溶解在第一结晶溶剂中可以在室温,例如15℃至30℃,具体在23℃至28℃的温度下在不搅拌或搅拌的情况下进行。
接下来,由式1化合物和有机酸已溶解在其中的混合溶液得到晶体。
例如,通过冷却溶液、通过蒸发溶剂、通过加入反溶剂用于过饱和、或通过使用浆液转化等方法,可以得到晶体。
在根据本发明的一个实施方式中,得到晶体的步骤可以包括向所述混合溶液中另外引入与所述第一结晶溶剂不同的第二结晶溶剂。
可以通过加入第二结晶溶剂以增加结晶粒子的生产率来改善所得到的晶型IV的收率或生产稳定性,但本发明不限于此。
第二结晶溶剂可以是上述第一结晶溶剂的有机溶剂。然而,优选地,可以选择和使用与用作第一结晶溶剂的溶剂不同的溶剂。
此外,在根据本发明的一个实施方式中,得到晶体的步骤还可以包括按任何顺序进行搅拌所述混合溶液和过滤所述混合溶液中的至少一项。
与粗式1化合物、无定形式1化合物、式1化合物的其它药学上可接受的盐或式1的任何晶型相比,如上得到的晶型IV可以具有更高的纯度,并且可以在物理上和化学上更稳定。然而,本发明的效果不限于此。
在另一个方面,本发明提供了一种药物组合物,所述药物组合物包含:(i)所述晶型IV;以及(ii)药学上可接受的载体。
根据本发明的晶型IV对黑皮质素受体,特别是黑皮质素-4受体(MC4R)表现出优异的激动作用。因此,本发明可以提供一种用于激动黑皮质素受体的药物组合物,所述组合物含有上述晶型IV作为活性成分。具体地,所述药物组合物可以是用于激动黑皮质素-4受体的功能的组合物。
此外,由于所述药物组合物可以表现出预防或治疗肥胖症、糖尿病、炎症和勃起功能障碍的优异效果,因此它可以是用于预防或治疗肥胖症、糖尿病、炎症或勃起功能障碍的组合物。然而,本发明的用途不限于所述疾病。
如本文所用,“载体”是指有助于将化合物引入细胞或组织中的化合物。
当出于临床目的施用本发明的晶型IV时,以单次剂量或以分次剂量施用于宿主的总日剂量可以优选在0.01至10mg/kg体重的范围内。然而,个别患者的具体剂量水平可以取决于所使用的具体化合物、患者的体重、性别、健康状况、饮食、药物的施用时间、施用方法、排泄率、药物组合、疾病的严重程度等而变化。
本发明的晶型IV可以按需要通过任何途径施用。例如,本发明的晶型IV可以通过注射或口服施用。
本发明的药物组合物可以为各种口服剂型,如片剂、丸剂、粉剂、胶囊、颗粒剂、糖浆或乳剂,或肠胃外剂型,如用于肌肉内、静脉内或皮下施用的注射制剂。
注射制剂可以根据已知的技术使用合适的分散剂、润湿剂、悬浮剂或赋形剂来制备。
可用于本发明的药物制剂的赋形剂包括但不限于甜味剂、粘合剂、增溶剂、增溶试剂、润湿剂、乳化剂、等渗剂、吸附剂、崩解剂、抗氧化剂、防腐剂、润滑剂、填充剂、芳香剂等。例如,作为赋形剂,可以使用乳糖、葡萄糖、蔗糖、甘露醇、山梨醇、纤维素、甘氨酸、二氧化硅、硅酸镁铝、淀粉、明胶、黄芪胶、海藻酸、海藻酸钠、甲基纤维素、羧甲基纤维素钠、水、乙醇、聚乙二醇、聚乙烯吡咯烷酮、氯化钠、氯化钙、橙香精、草莓香精、香草调味剂等。
当本发明的药物组合物为口服剂型时,使用的载体的实例可以包括但不限于纤维素、硅酸钙、玉米淀粉、乳糖、蔗糖、葡萄糖、磷酸钙、硬脂酸、硬脂酸镁、硬脂酸钙、明胶、滑石等。
当本发明的药物组合物是可注射制剂形式时,载体的实例可以包括但不限于水、盐水、葡萄糖水溶液、糖样水溶液、醇、二醇、醚、油、脂肪酸、脂肪酸酯、甘油酯等。
在另一个方面,提供了一种如上所述的晶型IV以用于激动黑皮质素受体,特别是黑皮质素-4受体(MC4R)的功能。
在一个实施方式中,提供了一种如上所述的晶型IV以用于治疗或预防肥胖症、糖尿病、炎症或勃起功能障碍。
在另一个方面,提供了一种激动黑皮质素受体,特别是黑皮质素-4受体(MC4R)的功能的方法,所述方法包括向受试者施用上述晶型IV的步骤。
在另一个方面,提供了一种治疗肥胖症、糖尿病、炎症或勃起功能障碍的方法,所述方法包括向受试者施用上述晶型IV的步骤。
有益效果
根据本发明的晶型IV对黑皮质素受体,特别是黑皮质素-4受体(MC4R)表现出优异的激动作用,因此可有效地用于预防或治疗肥胖症、糖尿病、炎症和勃起功能障碍。
根据本发明的晶型IV对黑皮质素-4受体表现出中靶效应,从而表现出体重减轻和饮食减少效果而不影响焦虑和抑郁。此外,它可以在没有任何安全问题如人类ether-a-go-go相关基因(hERG)抑制或诱变等副作用的情况下施用。
此外,根据本发明的晶型IV的纯度、收率、物理和化学稳定性比粗式1化合物、无定形式1化合物、式1化合物的其它药学上可接受的盐或式1的任何其它晶型更加优异。
具体地,所述晶型IV的溶解度、储存稳定性和生产稳定性可以优于式1化合物、无定形式1化合物、式1化合物的其它药学上可接受的盐或式1的任何其它晶型。
附图说明
图1是实施例1的XRPD结果的图。
图2是实施例1的TGA(上)和DSC(下)结果的图。
图3示出了实施例1的HSM照片(20x0.40倍率)。
图4示出了对实施例1进行干燥后的HSM照片(20x0.40倍率)。
图5是实施例2的XRPD结果的图。
图6是实施例2的TGA(上)和DSC(下)结果的图。
图7示出了对实施例2进行干燥后的HSM照片(20x0.40倍率)。
图8示出了对实施例2进行干燥后的HSM照片(20x0.40倍率)。
图9是实施例3的XRPD结果的图。
图10是实施例3的TGA(上)和DSC(下)结果的图。
图11是实施例3的
具体实施方式
下文将通过制备例和实施例更详细地描述本发明。然而,这些实施例仅说明本发明,本发明的范围不限于此。
制备例1:(2S,4S)-4-(N-((1s,4R)-4-甲基环己基)异丁酰胺基)吡咯烷-2-甲酸甲酯盐酸盐的制备
通过以下步骤A、步骤B、步骤C、步骤D和步骤E得到标题化合物。
步骤A:(2S,4S)-4-叠氮基吡咯烷-1,2-二甲酸1-(叔丁基)酯2-甲酯的制备
在氮气下将(2S,4R)-4-((甲基磺酰基)氧基)吡咯烷-1,2-二甲酸1-(叔丁基)酯2-甲酯(48.5g,150mmol)溶解在N,N'-二甲基甲酰胺(250ml)中,并加入叠氮化钠(19.5g,300ml)。在80℃搅拌16小时后,减压浓缩反应溶剂,加入水,用乙酸乙酯萃取两次。有机层用氯化钠水溶液和水进行洗涤,经无水硫酸镁干燥,并过滤。减压浓缩滤液,得到粗(2S,4S)-4-叠氮基吡咯烷-1,2-二甲酸1-(叔丁基)酯2-甲酯(39.59g,98%),未进行纯化便用于下一步。
MS[M+H]=271(M+1)
1
步骤B:(2S,4S)-4-氨基吡咯烷-1,2-二甲酸1-(叔丁基)酯2-甲酯的制备
将上述步骤A得到的(2S,4S)-4-叠氮基吡咯烷-1,2-二甲酸1-(叔丁基)酯2-甲酯(24.59g,91.0mmol)溶解在四氢呋喃(180ml)中,并在0℃缓慢加入1M三甲基膦四氢溶液(109.2ml,109.2mmol)。将混合物在相同温度下搅拌1小时,然后在室温下搅拌3小时。减压浓缩反应溶剂后,加入二氯甲烷(100ml)和水(150ml),并将混合物搅拌约30分钟。进行层分离并用二氯甲烷再次萃取,有机层经无水硫酸镁干燥并过滤。减压浓缩滤液,得到粗(2S,4S)-4-氨基吡咯烷-1,2-二甲酸1-(叔丁基)酯2-甲酯(20.62g,93%),未进行纯化便用于下一步。
MS[M+H]=245(M+1)
1H
步骤C:(2S,4S)-4-(((1s,4R)-4-甲基环己基)氨基)吡咯烷-1,2-二甲酸1-(叔丁
将上述步骤B得到的(2S,4S)-4-氨基吡咯烷-1,2-二甲酸1-(叔丁基)酯2-甲酯(20.62g,84.4mmol)溶解在二氯乙烷(150ml)中,并加入4-甲基环己酮(9.5ml,101.3mmol)。在0℃加入三乙酰氧基硼氢化钠(26.8g,126.6mmol),将混合物在室温下搅拌16小时。减压浓缩反应溶剂,加入水,用乙酸乙酯萃取两次。有机层用氯化钠水溶液进行洗涤,经无水硫酸镁干燥并过滤。减压浓缩滤液,并通过柱色谱法进行纯化,得到(2S,4S)-4-(((1s,4R)-4-甲基环己基)氨基)吡咯烷-1,2-二甲酸1-(叔丁基)酯2-甲酯(22.9g,80%)。
MS[M+H]=341(M+1)
1H
步骤D:(2S,4S)-4-(N-((1s,4R)-4-甲基环己基)异丁酰胺基)吡咯烷-1,2-二甲酸
将上述步骤C得到的(2S,4S)-4-(((1s,4R)-4-甲基环己基)氨基)吡咯烷-1,2-二甲酸1-(叔丁基)酯2-甲酯(37.29g,109.5mmol)溶解在二氯甲烷(500ml)中,加入三乙胺(61.1ml,438.1mmol),然后在0℃缓慢加入异丁酰氯(11.7ml,219mmol)。将混合物在室温下搅拌16小时后,减压浓缩反应溶剂,加入碳酸氢钠水溶液,用乙酸乙酯萃取两次。有机层用氯化钠水溶液和水进行洗涤,经无水硫酸镁干燥,并过滤。减压浓缩滤液,并通过柱色谱法进行纯化,得到(2S,4S)-4-(N-((1s,4R)-4-甲基环己基)异丁酰胺基)吡咯烷-1,2-二甲酸1-(叔丁基)酯2-甲酯(38.79g,86%)。
MS[M+H]=411(M+1)
1H
步骤E:(2S,4S)-4-(N-((1s,4R)-4-甲基环己基)异丁酰胺基)吡咯烷-2-甲酸甲酯
将上述步骤D得到的(2S,4S)-4-(N-((1s,4R)-4-甲基环己基)异丁酰胺基)吡咯烷-1,2-二甲酸1-(叔丁基)酯2-甲酯(34.0g,82.8mmol)溶解在二氯甲烷(200ml)中,在0℃加入4N盐酸在1,4-二
MS[M+H]=311(M+1)
制备例2:(3S,4R)-1-(叔丁基)-4-(4-氯苯基)吡咯烷-3-甲酸的制备
根据国际专利公开号WO 2004/092126所述的方法得到标题化合物。
MS[M+H]=282(M+1)
1H
制备例3:N-((3S,5S)-1-((3S,4R)-1-(叔丁基)-4-(4-氯苯基)吡咯烷-3-羰基)-5-(吗啉-4-羰基)吡咯烷-3-基)-N-((1s,4R)-4-甲基环己基)异丁酰胺(MC70)的制备
通过以下步骤A、步骤B和步骤C得到标题化合物。
步骤A:(2S,4S)-1-((3S,4R)-1-(叔丁基)-4-(4-氯苯基)吡咯烷-3-羰基)-4-(N-
将制备例1得到的(2S,4S)-4-(N-((1s,4R)-4-甲基环己基)异丁酰胺基)吡咯烷-2-甲酸甲酯盐酸盐(28.7g,82.73mmol)、制备例2得到的(3S,4R)-1-(叔丁基)-4-(4-氯苯基)吡咯烷-3-甲酸(24.5g,86.87mmol)、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(22.2g,115.83mmol)和1-羟基苯并三唑水合物(15.7g,115.83mmol)溶解在N,N'-二甲基甲酰胺(400ml)中,缓慢加入N,N'-二异丙基乙胺(72.0ml,413.66mmol)。将混合物在室温下搅拌16小时,减压浓缩反应溶剂,加入0.5N氢氧化钠水溶液,然后用乙酸乙酯萃取两次。有机层用氯化钠水溶液和水洗涤两次,经无水硫酸镁干燥,并过滤。减压浓缩滤液,并通过柱色谱法进行纯化,得到(2S,4S)-1-((3S,4R)-1-(叔丁基)-4-(4-氯苯基)吡咯烷-3-羰基)-4-(N-((1s,4R)-4-甲基环己基)异丁酰胺基)吡咯烷-2-甲酸甲酯(41.19g,87%)。
MS[M+H]=575(M+1)
步骤B:(2S,4S)-1-((3S,4R)-1-(叔丁基)-4-(4-氯苯基)吡咯烷-3-羰基)-4-(N-
将上述步骤A得到的(2S,4S)-1-((3S,4R)-1-(叔丁基)-4-(4-氯苯基)吡咯烷-3-羰基)-4-(N-((1s,4R)-4-甲基环己基)异丁酰胺基)吡咯烷-2-甲酸甲酯(39.4g,68.62mmol)溶解在甲醇(450ml)中,然后加入6N氢氧化钠水溶液(57.2ml,343.09mmol)。将混合物在室温下搅拌16小时,用6N盐酸水溶液将pH调节至约5,然后减压浓缩反应溶液。将浓缩物溶解在二氯甲烷中,然后通过滤纸滤出不溶性固体。减压浓缩滤液,得到粗标题化合物(38.4g,99%),未进行纯化便用于下一步。
MS[M+H]=561(M+1)
步骤C:N-((3S,5S)-1-((3S,4R)-1-(叔丁基)-4-(4-氯苯基)吡咯烷-3-羰基)-5-
将上述步骤B得到的(2S,4S)-1-((3S,4R)-1-(叔丁基)-4-(4-氯苯基)吡咯烷-3-羰基)-4-(N-((1s,4R)-4-甲基环己基)异丁酰胺基)吡咯烷-2-甲酸(38.4g,68.60mmol)、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(18.4g,96.04mmol)和1-羟基苯并三唑水合物(13.0g,96.04mmol)溶解在N,N'-二甲基甲酰胺(200ml)中,然后依次缓慢加入吗啉(5.9ml,68.80mmol)和N,N'-二异丙基乙胺(59.7ml,343.02mmol)。将混合物在室温下搅拌16小时,减压浓缩反应溶液,加入0.5N氢氧化钠水溶液,然后用乙酸乙酯萃取两次。有机层用氯化钠水溶液和水洗涤两次,经无水硫酸镁干燥,并过滤。减压浓缩滤液,并通过柱色谱法进行纯化,得到N-((3S,5S)-1-((3S,4R)-1-(叔丁基)-4-(4-氯苯基)吡咯烷-3-羰基)-5-(吗啉-4-羰基)吡咯烷-3-基)-N-((1s,4R)-4-甲基环己基)异丁酰胺(37.05g,86%,MC70)。
MS[M+H]=630(M+1)
实施例1:N-((3S,5S)-1-((3S,4R)-1-(叔丁基)-4-(4-氯苯基)吡咯烷-3-羰基)-5-(吗啉-4-羰基)吡咯烷-3-基)-N-((1s,4R)-4-甲基环己基)异丁酰胺乳酸盐的晶型的制备
将制备例3制备的化合物(MC70)和85%乳酸水溶液以1:1的摩尔比加入乙醇。然后,在室温下搅拌1天,并在室温下开盖蒸发溶剂。滴加庚烷,在室温下将混合物再搅拌1天,得到标题化合物(MC70的乳酸盐的晶型)。
实施例2:N-((3S,5S)-1-((3S,4R)-1-(叔丁基)-4-(4-氯苯基)吡咯烷-3-羰基)-5-(吗啉-4-羰基)吡咯烷-3-基)-N-((1s,4R)-4-甲基环己基)异丁酰胺苯磺酸盐的晶型的制备
[实施例2-1]
将制备例3制备的化合物(MC70)和苯磺酸以1:1的摩尔比加入乙醇,并在室温下将混合物搅拌1天。蒸发乙醇以使混合物凝胶化,加入庚烷,在室温下将混合物搅拌4天,得到呈溶液中的粘性固体形式的标题化合物(MC70的苯磺酸盐的晶型)。
[实施例2-2]
将制备例3制备的化合物(MC70)和苯磺酸以1:1的摩尔比加入甲苯,并在室温下将混合物搅拌4天。蒸发甲苯以使混合物凝胶化,加入MTBE,在室温下将混合物搅拌4天以保持凝胶状态,但蒸发MTBE,然后加入环己烷,在50℃下将混合物搅拌2天,得到呈固态的标题化合物(MC70的苯磺酸盐的晶型)。
[实施例2-3]
将制备例3制备的化合物(MC70)和苯磺酸以1:1的摩尔比加入MTBE,并在室温下将混合物以悬浮液状态搅拌1小时。在40℃将混合物再搅拌4天,蒸发MTBE,加入环己烷,并在50℃将混合物搅拌2天。在悬浮液中观察到晶型和无定形形式的混合状态。在60℃下将混合物搅拌6天,加入甲苯,在60℃将混合物搅拌6天,最终得到呈晶型与无定形形式的混合状态的标题化合物(MC70的苯磺酸盐的晶型)。
实施例3:N-((3S,5S)-1-((3S,4R)-1-(叔丁基)-4-(4-氯苯基)吡咯烷-3-羰基)-5-(吗啉-4-羰基)吡咯烷-3-基)-N-((1s,4R)-4-甲基环己基)异丁酰胺甲苯磺酸盐的晶型的制备
[实施例3-1]
将甲苯磺酸盐(对甲苯磺酸盐)以1:1的当量比加入到制备例3制备的化合物(MC70)在乙酸异丁酯中的溶液,然后在室温下搅拌1天。在室温下开盖蒸发一部分溶剂,然后加入环己烷,并在室温下将混合物搅拌1天。最后,加入MTBE,在室温下将混合物搅拌4天,然后在40℃下搅拌1天,得到标题化合物(MC70的甲苯磺酸盐的晶型)。
[实施例3-2]
将甲苯磺酸盐(对甲苯磺酸盐)以1:1的当量比加入到制备例3制备的化合物(MC70)在XX mL乙醇中的溶液,然后在室温下搅拌6小时。在室温下开盖,并注入氮气以蒸发溶液。然后,加入XX mL MTBE,在40℃下将混合物搅拌1天,然后在50℃下搅拌1天,得到标题化合物(MC70的甲苯磺酸盐的晶型)。
对于实施例1至实施例3的化合物,分析XRPD(图1、图5和图9)、TGA/DCS(图2、图6和图10)、HSM(图3、图7和图8)以及1H NMR(图11),并将结果的图示于图1至图11中。
比较例1:N-((3S,5S)-1-((3S,4R)-1-(叔丁基)-4-(4-氯苯基)吡咯烷-3-羰基)-5-(吗啉-4-羰基)吡咯烷-3-基)-N-((1s,4R)-4-甲基环己基)异丁酰胺甲苯己二酸盐的晶型的制备
将制备例3制备的化合物(MC70)加入乙醇,按1:1的当量比混入己二酸以制备混合溶液。搅拌混合溶液直到凝胶化,然后依次加入庚烷和MTBE,但没有形成晶体。
比较例2:N-((3S,5S)-1-((3S,4R)-1-(叔丁基)-4-(4-氯苯基)吡咯烷-3-羰基)-5-(吗啉-4-羰基)吡咯烷-3-基)-N-((1s,4R)-4-甲基环己基)异丁酰胺甲苯己二酸盐的晶型的制备
将制备例3制备的化合物(MC70)加入异丙醇,按1:8的当量比混入己二酸以制备混合溶液。搅拌混合溶液直到凝胶化,然后加入庚烷,但没有形成晶体。
实验例1.XRPD评价
由使用Cu辐射入射光束的Panalytical Xpert Pro MPD衍射仪得到粉末XRPD衍射图案。在玻璃样品架中压缩约20至30mg样品,使得所述样品具有平坦的表面,将仪器的发生器设为45kV(加速电压)和40mA(灯丝发射),然后在反射模式(不自旋)下进行测量。在步长为0.026°和每步时间为51秒的条件下测量4°至40°范围内的布拉格角(2θ)。
如从图1所示的光谱可见,证实了根据实施例1的乳酸盐的晶型IV是结晶物质。XRPD的具体值示于下表1中。
[表1]
/>
如从图5所示的光谱可见,证实了根据实施例2的苯磺酸盐的晶型IV是结晶物质。XRPD的具体值示于下表2中。
[表2]
/>
如图9所示的光谱可见,证实了根据实施例3的甲苯磺酸盐的晶型IV是结晶物质。XRPD的具体值示于下表3中。
[表3]
/>
实验例2.热重分析(TGA)和差示扫描量热法(DSC)
用Mettler-Toledo TGA/DSC 3+分析仪进行TGA和DSC组合分析。将样品放在开放的铝坩锅中,密封坩锅,将锅盖打孔,然后将坩锅插入TG炉中。通过在氮气下以10K/min的速率从25℃加热到最高350℃来进行测量。
如图2可见,根据TGA分析结果,根据实施例1的乳酸盐的晶型IV在约38℃至100℃的温度范围内的重量损失为约1.0重量%,并且在超过约274℃时发生分解。
此外,根据DSC分析结果,对于根据实施例1的乳酸盐的晶型IV,观察到了在约82℃和103℃处的吸热峰,并观察到了在约116℃处的放热峰。
如图6可见,根据TGA分析结果,根据实施例2的苯磺酸盐的晶型IV在约39℃至150℃的温度范围内的重量损失为约5.4重量%,并且在超过约266℃时分解。
此外,根据DSC分析结果,对于根据实施例2的苯磺酸盐的晶型IV,观察到在约57℃和93℃处的宽吸热峰。
如图10可见,根据TGA分析结果,根据实施例3的甲苯磺酸盐的晶型IV在约46℃至135℃的温度范围内的重量损失为约5.3重量%,并且在超过约264℃时分解。
此外,根据DSC分析结果,对于根据实施例3的甲苯磺酸盐的晶型IV,观察到在约104℃处的吸热峰,并观察到在约138℃(峰)处的放热峰。
实验例3.热台显微术(HSM)
由使用Linkman热台(型号FTIR 600)与TMS 93控制器的Leica DM LP显微镜测量HSM。用具有正交偏振器的λ板在10x0.22或20x0.40倍率下观察样品。将样品放在盖片上,并将另一个盖片放在样品上。然后,在加热载台时目视观察样品。为了研究气体释出,在一些情况下,可以向样品中加入一滴矿物油。使用SPOInsight彩色数码相机,用SPOT软件v.4.5.9捕捉图像。
如图3和图4可见,根据HSM分析结果,证实了根据实施例1的乳酸盐的晶型IV在约84.2℃至112.7℃下熔融。
如图7和图8所示,根据TGA分析结果,根据HSM分析结果,证实了根据实施例2的苯磺酸盐的晶型IV在约122℃至157℃下熔融。
实验例4.溶解度评价
通过向样品加水,在目测证实样品完全溶解时,基于加入样品的水的最终体积来测量溶解度。
根据评价结果,根据实施例1的乳酸盐的晶型IV的溶解度大于24mg/mL。根据实施例2的苯磺酸盐的晶型IV的溶解度大于1mg/mL。此外,根据实施例3的甲苯磺酸盐的晶型IV的溶解度大于10mg/mL。
如上所述,证实了根据实施例1至实施例3的晶型在水中具有优异的溶解度。
- 喹啉类化合物柠檬酸盐的晶型、制备方法、组合物与应用
- 喹啉类化合物硫酸盐的晶型、制备方法、组合物与应用
- 黑皮质素受体激动剂化合物的晶型II及其制备方法
- 黑皮质素受体激动剂化合物的结晶形式II及其制备方法
