靶向热休克蛋白70的纳米抗体及其制备方法与应用
文献发布时间:2024-04-18 19:52:40
技术领域
本发明涉及生物技术领域,尤其涉及一种靶向热休克蛋白70的纳米抗体及其制备方法与应用。
背景技术
热休克蛋白(Heat shock protein,HSP),又称为应激蛋白(Stress protein.SP),它们是一组在结构上高度保守的多肽,广泛存在于原核、真核细胞中。热休克蛋白参与细胞内多种生命活动过程,例如:分子伴侣功能(维护细胞内蛋白稳态,促进蛋白的正确折叠及组装)、增强细胞耐热能力及热保护作用(增强细胞对高温的耐受性,维持胞内环境在高温下的稳态)、抗细胞凋亡作用(避免细胞在应激状态下产生的凋亡现象)、抗氧化作用(促进细胞产生SOD以抵御氧自由基的危害)、炎症保护作用(抑制细胞因子的作用,降低其在循环中的含量)。
该类型蛋白首先是在果蝇身上发现,通过将果蝇幼虫放置在32℃环境下30分钟后,研究人员发现其巨大唾液腺染色体上出现新的膨突,表明该区域转录活性增强,同时称其为“热休克反应”,在之后的研究中进一步发现热休克反应伴随着一组特殊的蛋白质产生,同时在动物、细菌上也观察到了相似的结果,热休克蛋白从此进入人们的视野。热休克蛋白按照其蛋白的大小共分为以下几个家族,分别为HSP100、HSP90、HSP70、HSP60以及小分子休克蛋白,每个家族都有着多种不同的成员。其中HSP70家族成员最多,HSP70家族下共有21种蛋白质,是一组的进化上高度保守的应激蛋白,主要包括HSP68、72、73;HSC70、GRP75、Bip等。
HSP70是一段含有641个氨基酸的高度保守多肽,主要由N端核苷酸结合结构域(NBD,45kDa/1~381aa)和底物结合结构域(SBD,25kDa/398~505aa)组成,除了两个主要的结构域之外,结构中还包含连接器(382~397aa)、SBD底部域(506~605aa)、C端域(606~641aa)。N端结合结构域(NBD)是一个V型结构框架,由两个ATP结合的子域组成,主要起到结合ATP、ADP的作用;底物结合结构域(SBD)同样由两个子域组成,分别是β-片结构域(SBDβ)和α螺旋(SBDα),主要结合多种HSP70底物蛋白。这两个结构域在ATP与ADP的作用下共同介导错误折叠底物蛋白的重新折叠,这也是目前HSP70研究的最为清晰的功能特点。HSP70在初始阶段首先与ATP结合,然后一个中介蛋白HSP40与错误折叠蛋白形成复合物,该复合物靠近HSP70进而促进ATP的水解,紧接着HSP40便脱离,同时ATP的水解伴随着HSP70构象的改变并增强其与错误折叠蛋白的结合能力。HSP70在帮助客户蛋白重新折叠后,一个核苷酸交换因子(NEF)被招募到Hsp70的NBD中,此时ADP从NBD中解离,客户蛋白也同时被释放,HSP70重新回到原始状态,在与下一个ATP结合后循环进行上述分子伴侣功能。
因此,研究靶向热休克蛋白70的纳米抗体,能够有利于对热休克蛋白70相关的疾病进行分析,并且有利于研究相应的与热休克蛋白70相关疾病的药物。
发明内容
本申请的目的在于提供一种靶向热休克蛋白70的纳米抗体及其制备方法与应用,旨在解决现有技术中缺乏可靶向热休克蛋白70的纳米抗体,以至于无法更好地利用热休克蛋白70靶点进行相关药物制备的问题。
为实现上述申请目的,本申请采用的技术方案如下:
第一方面,本申请提供了一种靶向热休克蛋白70的纳米抗体,所述纳米抗体包括纳米抗体Nb H5,其中,所述纳米抗体Nb H5的氨基酸序列如Seq.ID NO.1所示。
进一步,所述纳米抗体包括4个框架区FR1、FR2、FR3、FR4和3个互补决定区CDR1、CDR2、CDR3;
所述纳米抗体NbH5中,FR1的氨基酸序列如SEQ ID NO.2所示,FR2的氨基酸序列如SEQ ID NO.3所示,FR3的氨基酸序列如SEQ ID NO.4所示,FR4的氨基酸序列如SEQ ID NO.5所示,CDR1的氨基酸序列如SEQ ID NO.6所示,CDR2的氨基酸序列如SEQ ID NO.7所示,CDR3的氨基酸序列如SEQ ID NO.8所示。
进一步,所述纳米抗体NbH5的碱基序列如Seq.ID NO.9所示。
第二方面,本申请提供了靶向热休克蛋白70的纳米抗体在制备高表达HSP70的肿瘤组织的成像剂或示踪剂中的应用。
第三方面,本申请提供了靶向热休克蛋白70的纳米抗体在制备靶向治疗HSP70高表达的肿瘤药物中的应用。
第四方面,本申请提供了靶向热休克蛋白70的纳米抗体在制备蛋白降解靶向联合体药物中的应用。
进一步,所述靶向热休克蛋白70的纳米抗体与目标靶蛋白结合连接形成蛋白降解靶向联合体药物,并且在所述靶向热休克蛋白70的纳米抗体的作用下,诱导E3连接酶CHIP靠近,介导所述目标靶蛋白的泛素化降解。
第五方面,本申请提供了靶向热休克蛋白70的纳米抗体的制备方法,包括如下步骤:
设计并合成HSP70-NBD基因并及进行表达纯化,得到HSP70-NBD蛋白;
将所述HSP70-NBD蛋白包被在免疫管上进行富集筛选,得到噬菌体文库;
将所述噬菌体文库的洗脱液进行PCR扩增并进行ELISA验证,再进行二代测序,并根据测序结果合成纳米抗体的基因序列;
将所述纳米抗体的基因序列克隆至表达载体中得到重组质粒,将所述重组质粒转入宿主细胞中诱导表达并进行纯化,得到靶向热休克蛋白70的纳米抗体。
进一步,所述目的蛋白的浓度为25~27μg/mL。
进一步,所述表达载体选自pCold载体。
本申请第一方面提供的靶向热休克蛋白70的纳米抗体,所述纳米抗体包括纳米抗体NbH5,其中,所述纳米抗体NbH5的氨基酸序列如Seq.ID NO.1所示,由于HSP70具有启动泛素化蛋白酶体降解的功能,提供的靶向热休克蛋白70的纳米抗体NbH5与热休克蛋白70具有较高的亲和力,通过纳米抗体NbH5可靶向作用于热休克蛋白70,实现启动泛素化蛋白酶体降解的作用,有利于构建PROTAC复合物进行应用,具有非常大的临床应用价值。同时,由于纳米抗体分子量小,有利于进行药物组装,在形成PROTAC复合物时有利于定位并且不会影响靶向药物的作用,应用十分广泛。
本申请第二方面提供的靶向热休克蛋白70的纳米抗体在制备高表达HSP70的肿瘤组织的成像剂或示踪剂中的应用。由于提供的靶向热休克蛋白70的纳米抗体与热休克蛋白70具有较高的亲和力,通过纳米抗体NbH5可靶向作用于热休克蛋白70,因此,靶向热休克蛋白70的纳米抗体有利于应用在制备高表达HSP70的肿瘤组织的成像剂或示踪剂中,能够提高显影速度及显影效率。
本申请第三方面提供的靶向热休克蛋白70的纳米抗体在制备靶向治疗HSP70高表达的肿瘤药物中的应用。由于提供的靶向热休克蛋白70的纳米抗体与热休克蛋白70具有较高的亲和力,通过纳米抗体NbH5可靶向作用于热休克蛋白70,因此,靶向热休克蛋白70的纳米抗体有利于应用在制备靶向治疗HSP70高表达的肿瘤药物,有利于广泛应用。
本申请第四方面提供的靶向热休克蛋白70的纳米抗体在制备蛋白降解靶向联合体药物中的应用,由于HSP70具有启动泛素化蛋白酶体降解的功能,提供的靶向热休克蛋白70的纳米抗体用于制备蛋白降解靶向联合体药物,HSP70纳米抗体充当E3连接酶结合物,通过结合CHIP后并促进靶蛋白的泛素化降解,达到消除致病蛋白水平的效果,同时进一步为PROTAC复合物的构建提供全新的工具。
本申请第五方面提供的靶向热休克蛋白70的纳米抗体的制备方法,该制备方法基于噬菌体天然纳米抗体文库,通过三轮富集筛选以及ELISA验证,发现靶向热休克蛋白70的纳米抗体NbH5,与热休克蛋白70有较高的结合力,因此纳米抗体NbH5有着较好的应用价值,该制备方法快速、简便,有利于大量筛选,提高了筛选效率。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
其中:
图1为实施例1提供的高纯度的目的蛋白HSP70-NBD分析图。
图2为实施例1提供的噬菌体纳米抗体文库三轮富集分析图。
图3为实施例1提供的纳米抗体纯化的分析图。
图4为实施例1提供的纳米抗体纯化的分析图。
图5为实施例1提供的纳米抗体对HSP70具有很高的结合能力分析图。
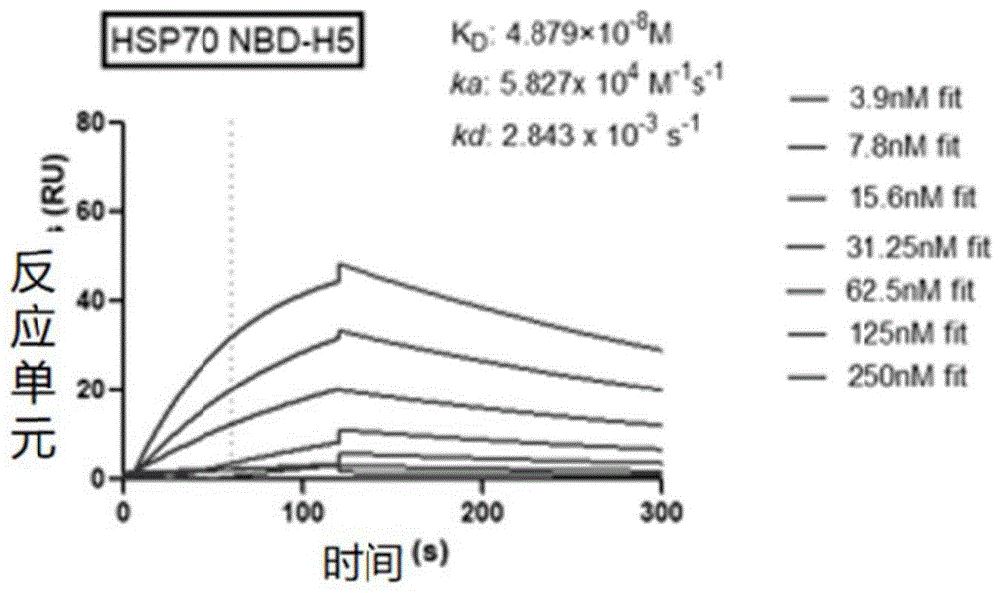
图6为实施例1提供的纳米抗体与HSP70具有很好的结合能力分析图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本申请实施例第一方面提供了一种靶向热休克蛋白70的纳米抗体,所述纳米抗体包括纳米抗体Nb H5,其中,所述纳米抗体Nb H5的氨基酸序列如Seq.IDNO.1所示。
本申请实施例第一方面提供的靶向热休克蛋白70的纳米抗体,所述纳米抗体包括纳米抗体NbH5,其中,所述纳米抗体NbH5的氨基酸序列如Seq.ID NO.1所示,由于HSP70具有启动泛素化蛋白酶体降解的功能,提供的靶向热休克蛋白70的纳米抗体NbH5与热休克蛋白70具有较高的亲和力,通过纳米抗体NbH5可靶向作用于热休克蛋白70,实现启动泛素化蛋白酶体降解的作用,有利于构建PROTAC复合物进行应用,具有非常大的临床应用价值。同时,由于纳米抗体分子量小,有利于进行药物组装,在形成PROTAC复合物时有利于定位并且不会影响靶向药物的作用,应用十分广泛。
在一些实施例中,纳米抗体Nb H5的氨基酸序列如Seq.ID NO.1所示,Seq.IDNO.1具体为:
MAVQLVESGGGLVQAGGSLRLSCAASGRTFSNYTMGWFRQAPGKEREFV AAISWSGKTTYYADSVKGRFTISRDNAKNTVYLQMNSLKHEDTAVYYCHVM TTGPNRYWGQGTQVTVSS。
在一些实施例中,所述纳米抗体包括4个框架区FR1、FR2、FR3、FR4和3个互补决定区CDR1、CDR2、CDR3。
其中,所述纳米抗体NbH5中,FR1的氨基酸序列如SEQ ID NO.2所示,SEQ ID NO.2具体为:MAVQLVESGGGLVQAGGSLRLSCAASGRTF。
FR2的氨基酸序列如SEQ ID NO.3所示,SEQ ID NO.3具体为:WFRQAPGKEREFVAAI。
FR3的氨基酸序列如SEQ ID NO.4所示,SEQ ID NO.4具体为:RFTISRDNAKNTVYLQMNSLKHEDTAVYYCHV。
FR4的氨基酸序列如SEQ ID NO.5所示,SEQ ID NO.5具体为:WGQGTQVTVSS。
CDR1的氨基酸序列如SEQ ID NO.6所示,SEQ ID NO.6具体为:SNYTMG。
CDR2的氨基酸序列如SEQ ID NO.7所示,SEQ ID NO.7具体为:SWSGKTTYYADSVKG。
CDR3的氨基酸序列如SEQ ID NO.8所示,SEQ ID NO.8具体为:MTTGPNRY。
在一些实施例中,所述纳米抗体NbH5的碱基序列如Seq.ID NO.9所示,SEQ IDNO.9具体为:
ATGGCGGTGCAGCTGGTGGAGTCTGGGGGAGGATTGGTACAGGCTGGGGGCTCTCTGAGACTCTCCTGTGCAGCCTCTGGACGCACCTTCAGTAACTATACCATGGGCTGGTTCCGCCAGGCTCCAGGGAAGGAGCGTGAGTTTGTTGCAGCGATCAGCTGGAGTGGTAAGACCACATACTATGCAGACTCCGTGAAGGGCCGATTCACCATCTCCAGAGACAACGCCAAGAACACGGTGTATCTGCAAATGAACAGCCTGAAACATGAGGACACGGCCGTTTATTACTGTCACGTCATGACGACTGGACCAAATCGCTACTGGGGCCAGGGGACCCAGGTCACCGTCTCCTCA。
本申请实施例第二方面提供了靶向热休克蛋白70的纳米抗体在制备高表达HSP70的肿瘤组织的成像剂或示踪剂中的应用。
本申请实施例第二方面提供的靶向热休克蛋白70的纳米抗体在制备高表达HSP70的肿瘤组织的成像剂或示踪剂中的应用。由于提供的靶向热休克蛋白70的纳米抗体与热休克蛋白70具有较高的亲和力,通过纳米抗体NbH5可靶向作用于热休克蛋白70,因此,靶向热休克蛋白70的纳米抗体有利于应用在制备高表达HSP70的肿瘤组织的成像剂或示踪剂中,能够提高显影速度及显影效率。
本申请实施例第三方面提供了靶向热休克蛋白70的纳米抗体在制备靶向治疗HSP70高表达的肿瘤药物中的应用。
本申请实施例第三方面提供的靶向热休克蛋白70的纳米抗体在制备靶向治疗HSP70高表达的肿瘤药物中的应用。由于提供的靶向热休克蛋白70的纳米抗体与热休克蛋白70具有较高的亲和力,通过纳米抗体NbH5可靶向作用于热休克蛋白70,因此,靶向热休克蛋白70的纳米抗体有利于应用在制备靶向治疗HSP70高表达的肿瘤药物,有利于广泛应用。
本申请实施例第四方面提供了靶向热休克蛋白70的纳米抗体在制备蛋白降解靶向联合体药物中的应用。
本申请实施例第四方面提供的靶向热休克蛋白70的纳米抗体在制备蛋白降解靶向联合体药物中的应用,由于HSP70具有启动泛素化蛋白酶体降解的功能,提供的靶向热休克蛋白70的纳米抗体用于制备蛋白降解靶向联合体药物,HSP70纳米抗体充当E3连接酶结合物,通过结合CHIP后并促进靶蛋白的泛素化降解,达到消除致病蛋白水平的效果,同时进一步为PROTAC复合物的构建提供全新的工具。
在一些实施例中,所述靶向热休克蛋白70的纳米抗体与目标靶蛋白结合连接形成蛋白降解靶向联合体药物,并且在所述靶向热休克蛋白70的纳米抗体的作用下,诱导E3连接酶CHIP靠近,介导所述目标靶蛋白的泛素化降解。
本申请实施例第五方面提供了靶向热休克蛋白70的纳米抗体的制备方法,包括如下步骤:
S01.设计并合成HSP70-NBD基因并及进行表达纯化,得到HSP70-NBD蛋白;
S02.将所述HSP70-NBD蛋白包被在免疫管上进行富集筛选,得到噬菌体文库;
S03.将所述噬菌体文库的洗脱液进行PCR扩增并进行ELISA验证,再进行二代测序,并根据测序结果合成纳米抗体的基因序列;
S04.将所述纳米抗体的基因序列克隆至表达载体中得到重组质粒,将所述重组质粒转入宿主细胞中诱导表达并进行纯化,得到靶向热休克蛋白70的纳米抗体。
本申请实施例第五方面提供的靶向热休克蛋白70的纳米抗体的制备方法,该制备方法基于噬菌体天然纳米抗体文库,通过三轮富集筛选以及ELISA验证,发现靶向热休克蛋白70的纳米抗体NbH5,与热休克蛋白70有较高的结合力,因此纳米抗体NbH5有着较好的应用价值,该制备方法快速、简便,有利于大量筛选,提高了筛选效率。
步骤S01中,设计并合成HSP70-NBD基因并及进行表达纯化,得到HSP70-NBD蛋白。
在一些实施例中,设计并合成HSP70-NBD基因并表达纯化蛋白用于纳米抗体筛选。表达纯化步骤如下:a),为防止形成包涵体和蛋白降解,拟通过不同浓度的IPTG在16℃低温进行诱导条件摸索;b),根据预实验诱导条件进行大量诱导表达,高压破菌仪工作条件1000W进行破菌;c),17000g,4℃离心30min,取上清与Ni填料4℃共孵育1小时;d),梯度浓度咪唑洗脱目的蛋白;e),Ni柱纯化后进行分子筛分离以去除杂蛋白,AKTA参数设置0.5mL流速/分钟,每1mL收集一次。f),根据电泳结果确定目的蛋白纯度,BCA法测定蛋白浓度。
步骤S02中,将所述HSP70-NBD蛋白包被在免疫管上进行富集筛选,得到噬菌体文库。
在一些实施例中,采用免疫管法对天然的羊驼源噬菌体展示纳米抗体文库进行筛选,所选择的噬菌体展示库容量为2x109。筛选步骤如下:a),将目的蛋白按25μg/mL浓度包被在免疫管上,进行3轮富集筛选;b),使用第三轮噬菌体洗脱液铺板,得到噬菌体文库。
步骤S03中,将所述噬菌体文库的洗脱液进行PCR扩增并进行ELISA验证,再进行二代测序,并根据测序结果合成纳米抗体的基因序列。
在一些实施例中,随机挑取192个单克隆进行ELISA验证,做Elisa的96孔板同时包被BSA作为对照,以ELISA读数大于对应BSA读数3倍且读数大于0.5为阳性标准;经过2次噬菌体ELISA鉴定的阳性单克隆送公司测序确定序列信息,提取序列获得纳米抗体蛋白序列,对序列进行对比分析,获得阳性序列的分布频率。
步骤S04中,将所述纳米抗体的基因序列克隆至表达载体中得到重组质粒,将所述重组质粒转入宿主细胞中诱导表达并进行纯化,得到靶向热休克蛋白70的纳米抗体。
在一些实施例中,将纳米抗体基因序列克隆入pcold载体,同时融合表达血凝素标签(hemagglutinin HA tag)用于后续检测。表达纯化步骤如下:a),为防止形成包涵体和蛋白降解,使用0.2mM浓度的IPTG在16℃低温进行诱导;b),根据预实验诱导条件进行大量诱导表达,高压破菌仪工作条件1000W进行破菌;c),17000g,4℃离心30min,取上清与Ni填料4℃共孵育1小时;g),Ni柱纯化后进行分子筛分离,AKATA参数设置0.5mL流速/分钟,每1mL收集一次,得到靶向热休克蛋白70的纳米抗体。
下面结合具体实施例进行说明。
实施例1
靶向热休克蛋白70的纳米抗体及其制备方法
试验过程:
1)HSP70-NBD纳米抗体表达纯化
设计并合成HSP70-NBD基因并表达纯化蛋白用于纳米抗体筛选。表达纯化步骤如下:a),为防止形成包涵体和蛋白降解,拟通过不同浓度的IPTG在16℃低温进行诱导条件摸索;b),根据预实验诱导条件进行大量诱导表达,高压破菌仪工作条件1000W进行破菌;c),17000g,4℃离心30min,取上清与Ni填料4℃共孵育1小时;d),梯度浓度咪唑洗脱目的蛋白;e),Ni柱纯化后进行分子筛分离以去除杂蛋白,AKTA参数设置0.5mL流速/分钟,每1mL收集一次。f),根据电泳结果确定目的蛋白纯度,BCA法测定蛋白浓度。
2)纳米抗体筛选及ELISA初步验证阳性克隆
采用免疫管法对天然的羊驼源噬菌体展示纳米抗体文库进行筛选,所选择的噬菌体展示库容量为2x109。筛选步骤如下:a),将目的蛋白按25μg/mL浓度包被在免疫管上,进行3轮富集筛选;b),使用第三轮噬菌体洗脱液铺板,随机挑取192个单克隆进行ELISA验证,做Elisa的96孔板同时包被BSA作为对照,以ELISA读数大于对应BSA读数3倍且读数大于0.5为阳性标准;c),经过2次噬菌体ELISA鉴定的阳性单克隆送公司测序确定序列信息,提取序列获得纳米抗体蛋白序列,对序列进行对比分析,获得阳性序列的分布频率。
3)纳米抗体的纯化表达
将纳米抗体基因序列克隆入pcold载体,同时融合表达血凝素标签(hemagglutinin HA tag)用于后续检测。表达纯化步骤如下:a),为防止形成包涵体和蛋白降解,使用0.2mM浓度的IPTG在16℃低温进行诱导;b),根据预实验诱导条件进行大量诱导表达,高压破菌仪工作条件1000W进行破菌;c),17000g,4℃离心30min,取上清与Ni填料4℃共孵育1小时;g),Ni柱纯化后进行分子筛分离,AKATA参数设置0.5mL流速/分钟,每1mL收集一次。
4)纳米抗体的Elisa实验
此实验用来验证在体外表达纯化的纳米抗体与体外纯化的抗原蛋白是否能够直接相互作用。步骤如下:a),将抗原蛋白用PBS稀释成5ug/ml,均为100ul/孔铺板,包被孔板,4℃静置过夜;b),3%PBS/BSA室温封闭2h,200ug/孔;c),1%BSA/PBST配置不同浓度的纳米抗体,100ug/孔,室温孵育1h;d),孵育二抗anti-HA HRP(1:3000),室温1h;e),TMB显色;e),终止液终止反应;g),用酶标仪在450nm处测定吸光值,并根据吸光值来制定曲线。
5)表面等离子共振实验(surface plasmon resonance,SPR)
此实验用来进一步验证抗原和纳米抗体的结合,并计算二者的平衡常数。纯化抗原蛋白被固定在芯片上,不同浓度的纳米抗体被顺序加入来分析与抗原蛋白的亲和力,记录360秒内的反应信号,制作动力学曲线,计算各相关参数。
结果分析:
(1)HSP70-NBD蛋白表达纯化
HSP70蛋白分子质量为70kDa左右,截取其标志性序列片段NBD与GST、His形成融合蛋白进行纯化,蛋白大小约43kDa,作为纳米抗体的筛选靶标。密码子优化后合成HSP70-NBD融合基因进行大肠杆菌诱导表达纯化,为了避免蛋白降解和包涵体的产生,用0.4mM的IPTG在16℃低温过夜进行诱导,最后通过Ni柱和分子筛纯化后得到了高纯度的目的蛋白用于后续纳米抗体筛选(如图1所示)。
(2)HSP70-NBD纳米抗体的筛选鉴定及纯化
首先对HSP70-NBD进行了噬菌体纳米抗体文库的筛选,二、三轮筛选之后,文库富集将近200和60倍(如图2所示),从第三轮所得文库挑取约192个克隆进行两次噬菌体ELISA作初步验证,初步鉴定出11个阳性克隆,进行测序,测序结果显示9条正常。根据纳米抗体前后序列可以从测序结果中获得纳米抗体序列,将9条序列翻译成氨基酸后排序并进行多序列比对,共得到6条不同的纳米抗体序列。后续我们将这6个纳米抗体进行纯化,并进行考马斯亮蓝染色(如图3所示)及WB验证(如图4所示)。另外,在初步的实验中我们发现A9、F10属于假阳性纳米抗体,在后续的进一步结合力验证实验中我们将其排除在外。
(3)HSP70-NBD纳米抗体的亲和力检测
通过ELISA进一步检测了HSP70-NBD纳米抗体与HSP70的结合,结果表明与对照组BSA相比,上述纯化所得的其中4条HSP70-NBD纳米抗体对实验组的HSP70结合力更高,表明纳米抗体对HSP70具有很高的结合能力(如图5所示)。接着使用Biacore,进一步检测了上述4条纳米抗体与HSP70的亲和力常数,得到1条亲和力在纳摩尔水平的纳米抗体NbH5(如图6),进一步说明纳米抗体NbH5与HSP70具有很好的结合能力。
综上,本申请提供的靶向热休克蛋白70的纳米抗体,所述纳米抗体包括纳米抗体NbH5,其中,所述纳米抗体NbH5的氨基酸序列如Seq.ID NO.1所示,由于HSP70具有启动泛素化蛋白酶体降解的功能,提供的靶向热休克蛋白70的纳米抗体NbH5与热休克蛋白70具有较高的亲和力,通过纳米抗体NbH5可靶向作用于热休克蛋白70,实现启动泛素化蛋白酶体降解的作用,有利于构建PROTAC复合物进行应用,具有非常大的临床应用价值。同时,由于纳米抗体分子量小,有利于进行药物组装,在形成PROTAC复合物时有利于定位并且不会影响靶向药物的作用,应用十分广泛。
以上所揭露的仅为本发明较佳实施例而已,当然不能以此来限定本发明之权利范围,因此依本发明权利要求所作的等同变化,仍属本发明所涵盖的范围。
