ENTPD2抗体、组合疗法、以及使用这些抗体和组合疗法的方法
文献发布时间:2023-06-19 09:30:39
相关申请的交叉引用
本申请要求2018年5月30日提交的美国临时申请号62/677,850的权益,所述美国临时申请的内容通过引用以其全文结合在此。
技术领域
本发明提供特异性结合胞外酶外核苷三磷酸二磷酸水解酶2(ENTPD2)的抗体或其抗原结合片段,例如单克隆抗体或其抗原结合片段,以及使用这些抗体或抗原结合片段的方法。
本发明还涉及组合疗法,该组合疗法包含抗人ENTPD2抗体或其抗原结合片段和至少一种另外的治疗剂。
序列表
本申请含有已经以ASCII格式电子递交的序列表并且该序列表特此通过引用以其全文并入。所述ASCII副本创建于2019年4月5日,名称为PAT058145-WO-PCT_SL.txt并且大小为635,873字节。
背景技术
细胞应激和细胞凋亡引发ATP释放到细胞外空间。增加的ATP浓度促进炎症快速发生,导致T细胞信号传导的放大,抑制调节性T细胞(Treg),并促进树突细胞和巨噬细胞中的炎性体活化。胞外酶外核苷三磷酸二磷酸水解酶2(ENTPD2)是水解5'-三磷酸的外核苷酶家族的一部分,并且是参与嘌呤能信号传导的膜内在蛋白质。ENTPD2催化三磷酸腺苷(ATP)向二磷酸腺苷(ADP)和一磷酸腺苷(AMP)的转化。反过来,AMP由分化簇73(CD73,也称为外-5'-核苷酸酶(外-5'NT))催化为腺苷。分子AMP与几种受体相互作用,这些受体包括腺苷A1、A2A、A2B和A3受体。A2A受体由于其在免疫细胞上的广泛表达而受到特别关注。AMP在肿瘤微环境中具有多效性,包括调节性T细胞(Treg)的扩增,干扰素(IFN)-γ介导的效应T细胞(Teff)应答的抑制,以及髓源性抑制细胞(MDSC)的扩增。参见,例如Allard B等人,CurrOpin Pharmacol[药理学研究现状]29:7-16(2016)和Allard D等人,Immunotherapy[免疫疗法]8:145-163(2016)。
在肝细胞癌的小鼠模型中,显示ENTPD2将细胞外ATP转化为AMP,其阻止单核细胞髓源性抑制细胞(MDSC)分化为树突细胞,从而促进体外和体内MDSC的维持(Chiu等人,NatCommun.[自然传播]8:517-28(2017)。
如本文所述,ENTPD2在癌细胞上表达。用于调节ENTPD2活性的新组合物和方法以及相关治疗剂是非常需要的。
发明内容
本发明提供了特异性结合胞外酶外核苷三磷酸二磷酸水解酶2(ENTPD2)的抗体或其抗原结合片段,例如单克隆抗体或其抗原结合片段。ENTPD2抗体或其抗原结合片段可用于治疗ENTPD2相关疾病,例如癌症。
在一方面,本文提供了特异性结合人ENTPD2蛋白的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含表1中提供的任何抗体或抗原结合片段的重链互补决定区1(HCDR1)、重链互补决定区2(HCDR2)、重链互补决定区3(HCDR3)、轻链互补决定区1(LCDR1)、轻链互补决定区2(LCDR2)和轻链互补决定区3(LCDR3)。在一些实施例中,此类抗体或抗原结合片段的HCDR1、HCDR2、HCDR3、LCDR1、LCDR2和LCDR3选自表1中提供的HCDR1、HCDR2、HCDR3、LCDR1、LCDR2和LCDR3序列。在一些实施例中,此类抗体或抗原结合片段包含表1中提供的重链可变区(VH)。在一些实施例中,此类抗体或抗原结合片段包含表1中提供的轻链可变区(VL)。
另一方面,本文提供了选自以下中的任何一种的抗体或抗原结合片段:
1)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:1的HCDR1序列、
包含SEQ ID NO:2的HCDR2序列、
包含SEQ ID NO:3的HCDR3序列、
包含SEQ ID NO:14的LCDR1序列、
包含SEQ ID NO:15的LCDR2序列、和
包含SEQ ID NO:16的LCDR3序列;
2)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:4的HCDR1序列、
包含SEQ ID NO:5的HCDR2序列、
包含SEQ ID NO:3的HCDR3序列、
包含SEQ ID NO:17的LCDR1序列、
包含SEQ ID NO:18的LCDR2序列、和
包含SEQ ID NO:19的LCDR3序列;
3)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:7的HCDR1序列、
包含SEQ ID NO:8的HCDR2序列、
包含SEQ ID NO:9的HCDR3序列、
包含SEQ ID NO:20的LCDR1序列、
包含SEQ ID NO:18的LCDR2序列、和
包含SEQ ID NO:16的LCDR3序列;
4)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:37的HCDR1序列、
包含SEQ ID NO:38的HCDR2序列、
包含SEQ ID NO:39的HCDR3序列、
包含SEQ ID NO:50的LCDR1序列、
包含SEQ ID NO:51的LCDR2序列、和
包含SEQ ID NO:52的LCDR3序列;
5)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:40的HCDR1序列、
包含SEQ ID NO:41的HCDR2序列、
包含SEQ ID NO:39的HCDR3序列、
包含SEQ ID NO:53的LCDR1序列、
包含SEQ ID NO:54的LCDR2序列、和
包含SEQ ID NO:55的LCDR3序列;
6)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:43的HCDR1序列、
包含SEQ ID NO:44的HCDR2序列、
包含SEQ ID NO:45的HCDR3序列、
包含SEQ ID NO:56的LCDR1序列、
包含SEQ ID NO:54的LCDR2序列、和
包含SEQ ID NO:52的LCDR3序列;
7)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:37的HCDR1序列、
包含SEQ ID NO:38的HCDR2序列、
包含SEQ ID NO:39的HCDR3序列、
包含SEQ ID NO:61的LCDR1序列、
包含SEQ ID NO:51的LCDR2序列、和
包含SEQ ID NO:52的LCDR3序列;
8)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:40的HCDR1序列、
包含SEQ ID NO:41的HCDR2序列、
包含SEQ ID NO:39的HCDR3序列、
包含SEQ ID NO:62的LCDR1序列、
包含SEQ ID NO:54的LCDR2序列、和
包含SEQ ID NO:55的LCDR3序列;
9)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:43的HCDR1序列、
包含SEQ ID NO:44的HCDR2序列、
包含SEQ ID NO:45的HCDR3序列、
包含SEQ ID NO:63的LCDR1序列、
包含SEQ ID NO:54的LCDR2序列、和
包含SEQ ID NO:52的LCDR3序列;
10)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:37的HCDR1序列、
包含SEQ ID NO:38的HCDR2序列、
包含SEQ ID NO:68的HCDR3序列、
包含SEQ ID NO:50的LCDR1序列、
包含SEQ ID NO:51的LCDR2序列、和
包含SEQ ID NO:52的LCDR3序列;
11)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:40的HCDR1序列、
包含SEQ ID NO:41的HCDR2序列、
包含SEQ ID NO:68的HCDR3序列、
包含SEQ ID NO:53的LCDR1序列、
包含SEQ ID NO:54的LCDR2序列、和
包含SEQ ID NO:55的LCDR3序列;
12)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:43的HCDR1序列、
包含SEQ ID NO:44的HCDR2序列、
包含SEQ ID NO:69的HCDR3序列、
包含SEQ ID NO:56的LCDR1序列、
包含SEQ ID NO:54的LCDR2序列、和
包含SEQ ID NO:52的LCDR3序列;
13)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:82的HCDR1序列、
包含SEQ ID NO:83的HCDR2序列、
包含SEQ ID NO:84的HCDR3序列、
包含SEQ ID NO:95的LCDR1序列、
包含SEQ ID NO:96的LCDR2序列、和
包含SEQ ID NO:97的LCDR3序列;
14)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:85的HCDR1序列、
包含SEQ ID NO:86的HCDR2序列、
包含SEQ ID NO:84的HCDR3序列、
包含SEQ ID NO:98的LCDR1序列、
包含SEQ ID NO:99的LCDR2序列、和
包含SEQ ID NO:100的LCDR3序列;
15)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:88的HCDR1序列、
包含SEQ ID NO:89的HCDR2序列、
包含SEQ ID NO:90的HCDR3序列、
包含SEQ ID NO:101的LCDR1序列、
包含SEQ ID NO:99的LCDR2序列、和
包含SEQ ID NO:97的LCDR3序列;
16)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:106的HCDR1序列、
包含SEQ ID NO:107的HCDR2序列、
包含SEQ ID NO:108的HCDR3序列、
包含SEQ ID NO:119的LCDR1序列、
包含SEQ ID NO:120的LCDR2序列、和
包含SEQ ID NO:121的LCDR3序列;
17)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:109的HCDR1序列、
包含SEQ ID NO:110的HCDR2序列、
包含SEQ ID NO:108的HCDR3序列、
包含SEQ ID NO:122的LCDR1序列、
包含SEQ ID NO:99的LCDR2序列、和
包含SEQ ID NO:123的LCDR3序列;
18)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:112的HCDR1序列、
包含SEQ ID NO:113的HCDR2序列、
包含SEQ ID NO:114的HCDR3序列、
包含SEQ ID NO:124的LCDR1序列、
包含SEQ ID NO:99的LCDR2序列、和
包含SEQ ID NO:121的LCDR3序列;
19)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:106的HCDR1序列、
包含SEQ ID NO:129的HCDR2序列、
包含SEQ ID NO:108的HCDR3序列、
包含SEQ ID NO:119的LCDR1序列、
包含SEQ ID NO:120的LCDR2序列、和
包含SEQ ID NO:121的LCDR3序列;
20)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:109的HCDR1序列、
包含SEQ ID NO:130的HCDR2序列、
包含SEQ ID NO:108的HCDR3序列、
包含SEQ ID NO:122的LCDR1序列、
包含SEQ ID NO:99的LCDR2序列、和
包含SEQ ID NO:123的LCDR3序列;
21)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:112的HCDR1序列、
包含SEQ ID NO:131的HCDR2序列、
包含SEQ ID NO:114的HCDR3序列、
包含SEQ ID NO:124的LCDR1序列、
包含SEQ ID NO:99的LCDR2序列、和
包含SEQ ID NO:121的LCDR3序列;
22)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:136的HCDR1序列、
包含SEQ ID NO:137的HCDR2序列、
包含SEQ ID NO:138的HCDR3序列、
包含SEQ ID NO:149的LCDR1序列、
包含SEQ ID NO:150的LCDR2序列、和
包含SEQ ID NO:151的LCDR3序列;
23)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:139的HCDR1序列、
包含SEQ ID NO:140的HCDR2序列、
包含SEQ ID NO:138的HCDR3序列、
包含SEQ ID NO:152的LCDR1序列、
包含SEQ ID NO:153的LCDR2序列、和
包含SEQ ID NO:154的LCDR3序列;
24)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:142的HCDR1序列、
包含SEQ ID NO:143的HCDR2序列、
包含SEQ ID NO:144的HCDR3序列、
包含SEQ ID NO:155的LCDR1序列、
包含SEQ ID NO:153的LCDR2序列、和
包含SEQ ID NO:151的LCDR3序列;
25)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:160的HCDR1序列、
包含SEQ ID NO:161的HCDR2序列、
包含SEQ ID NO:162的HCDR3序列、
包含SEQ ID NO:173的LCDR1序列、
包含SEQ ID NO:150的LCDR2序列、和
包含SEQ ID NO:174的LCDR3序列;
26)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:163的HCDR1序列、
包含SEQ ID NO:164的HCDR2序列、
包含SEQ ID NO:162的HCDR3序列、
包含SEQ ID NO:175的LCDR1序列、
包含SEQ ID NO:153的LCDR2序列、和
包含SEQ ID NO:176的LCDR3序列;
27)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:166的HCDR1序列、
包含SEQ ID NO:167的HCDR2序列、
包含SEQ ID NO:168的HCDR3序列、
包含SEQ ID NO:177的LCDR1序列、
包含SEQ ID NO:153的LCDR2序列、和
包含SEQ ID NO:174的LCDR3序列;
28)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:37的HCDR1序列、
包含SEQ ID NO:220的HCDR2序列、
包含SEQ ID NO:221的HCDR3序列、
包含SEQ ID NO:61的LCDR1序列、
包含SEQ ID NO:51的LCDR2序列、和
包含SEQ ID NO:52的LCDR3序列;
29)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:40的HCDR1序列、
包含SEQ ID NO:222的HCDR2序列、
包含SEQ ID NO:221的HCDR3序列、
包含SEQ ID NO:62的LCDR1序列、
包含SEQ ID NO:54的LCDR2序列、和
包含SEQ ID NO:55的LCDR3序列;
30)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:43的HCDR1序列、
包含SEQ ID NO:223的HCDR2序列、
包含SEQ ID NO:224的HCDR3序列、
包含SEQ ID NO:63的LCDR1序列、
包含SEQ ID NO:54的LCDR2序列、和
包含SEQ ID NO:52的LCDR3序列;
31)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:37的HCDR1序列、
包含SEQ ID NO:220的HCDR2序列、
包含SEQ ID NO:68的HCDR3序列、
包含SEQ ID NO:61的LCDR1序列、
包含SEQ ID NO:51的LCDR2序列、和
包含SEQ ID NO:52的LCDR3序列;
32)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:40的HCDR1序列、
包含SEQ ID NO:222的HCDR2序列、
包含SEQ ID NO:68的HCDR3序列、
包含SEQ ID NO:62的LCDR1序列、
包含SEQ ID NO:54的LCDR2序列、和
包含SEQ ID NO:55的LCDR3序列;
33)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:43的HCDR1序列、
包含SEQ ID NO:223的HCDR2序列、
包含SEQ ID NO:69的HCDR3序列、
包含SEQ ID NO:63的LCDR1序列、
包含SEQ ID NO:54的LCDR2序列、和
包含SEQ ID NO:52的LCDR3序列;
34)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:1的HCDR1序列、
包含SEQ ID NO:245的HCDR2序列、
包含SEQ ID NO:246的HCDR3序列、
包含SEQ ID NO:254的LCDR1序列、
包含SEQ ID NO:15的LCDR2序列、和
包含SEQ ID NO:255的LCDR3序列;
35)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:4的HCDR1序列、
包含SEQ ID NO:247的HCDR2序列、
包含SEQ ID NO:246的HCDR3序列、
包含SEQ ID NO:17的LCDR1序列、
包含SEQ ID NO:18的LCDR2序列、和
包含SEQ ID NO:256的LCDR3序列;
36)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:7的HCDR1序列、
包含SEQ ID NO:248的HCDR2序列、
包含SEQ ID NO:249的HCDR3序列、
包含SEQ ID NO:20的LCDR1序列、
包含SEQ ID NO:18的LCDR2序列、和
包含SEQ ID NO:255的LCDR3序列;
37)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:1的HCDR1序列、
包含SEQ ID NO:261的HCDR2序列、
包含SEQ ID NO:262的HCDR3序列、
包含SEQ ID NO:254的LCDR1序列、
包含SEQ ID NO:15的LCDR2序列、和
包含SEQ ID NO:16的LCDR3序列;
38)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:4的HCDR1序列、
包含SEQ ID NO:247的HCDR2序列、
包含SEQ ID NO:262的HCDR3序列、
包含SEQ ID NO:17的LCDR1序列、
包含SEQ ID NO:18的LCDR2序列、和
包含SEQ ID NO:19的LCDR3序列;
39)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:7的HCDR1序列、
包含SEQ ID NO:248的HCDR2序列、
包含SEQ ID NO:263的HCDR3序列、
包含SEQ ID NO:20的LCDR1序列、
包含SEQ ID NO:18的LCDR2序列、和
包含SEQ ID NO:16的LCDR3序列;
40)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:272的HCDR1序列、
包含SEQ ID NO:273的HCDR2序列、
包含SEQ ID NO:274的HCDR3序列、
包含SEQ ID NO:254的LCDR1序列、
包含SEQ ID NO:285的LCDR2序列、和
包含SEQ ID NO:16的LCDR3序列;
41)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:275的HCDR1序列、
包含SEQ ID NO:276的HCDR2序列、
包含SEQ ID NO:274的HCDR3序列、
包含SEQ ID NO:17的LCDR1序列、
包含SEQ ID NO:286的LCDR2序列、和
包含SEQ ID NO:19的LCDR3序列;
42)包含以下的抗体或其抗原结合片段:
包含SEQ ID NO:278的HCDR1序列、
包含SEQ ID NO:279的HCDR2序列、
包含SEQ ID NO:280的HCDR3序列、
包含SEQ ID NO:20的LCDR1序列、
包含SEQ ID NO:286的LCDR2序列、和
包含SEQ ID NO:16的LCDR3序列。
另一方面,本文提供了选自以下中的任何一种的抗体或抗原结合片段:
1)包含如下VH和VL的抗体或其抗原结合片段,该VH包含SEQ ID NO:10或与其具有至少约95%或更高同一性的序列,并且该VL包含SEQ ID NO:21或与其具有至少约95%或更高同一性的序列;
2)包含如下VH和VL的抗体或其抗原结合片段,该VH包含SEQ ID NO:25或与其具有至少约95%或更高同一性的序列,并且该VL包含SEQ ID NO:29或与其具有至少约95%或更高同一性的序列;
3)包含如下VH和VL的抗体或其抗原结合片段,该VH包含SEQ ID NO:33或与其具有至少约95%或更高同一性的序列,并且该VL包含SEQ ID NO:29或与其具有至少约95%或更高同一性的序列;
4)包含如下VH和VL的抗体或其抗原结合片段,该VH包含SEQ ID NO:46或与其具有至少约95%或更高同一性的序列,并且该VL包含SEQ ID NO:57或与其具有至少约95%或更高同一性的序列;
5)包含如下VH和VL的抗体或其抗原结合片段,该VH包含SEQ ID NO:46或与其具有至少约95%或更高同一性的序列,并且该VL包含SEQ ID NO:64或与其具有至少约95%或更高同一性的序列;
6)包含如下VH和VL的抗体或其抗原结合片段,该VH包含SEQ ID NO:70或与其具有至少约95%或更高同一性的序列,并且该VL包含SEQ ID NO:74或与其具有至少约95%或更高同一性的序列;
7)包含如下VH和VL的抗体或其抗原结合片段,该VH包含SEQ ID NO:25或与其具有至少约95%或更高同一性的序列,并且该VL包含SEQ ID NO:78或与其具有至少约95%或更高同一性的序列;
8)包含如下VH和VL的抗体或其抗原结合片段,该VH包含SEQ ID NO:91或与其具有至少约95%或更高同一性的序列,并且该VL包含SEQ ID NO:102或与其具有至少约95%或更高同一性的序列;
9)包含如下VH和VL的抗体或其抗原结合片段,该VH包含SEQ ID NO:115或与其具有至少约95%或更高同一性的序列,并且该VL包含SEQ ID NO:125或与其具有至少约95%或更高同一性的序列;
10)包含如下VH和VL的抗体或其抗原结合片段,该VH包含SEQ ID NO:132或与其具有至少约95%或更高同一性的序列,并且该VL包含SEQ ID NO:125或与其具有至少约95%或更高同一性的序列;
11)包含如下VH和VL的抗体或其抗原结合片段,该VH包含SEQ ID NO:145或与其具有至少约95%或更高同一性的序列,并且该VL包含SEQ ID NO:156或与其具有至少约95%或更高同一性的序列;
12)包含如下VH和VL的抗体或其抗原结合片段,该VH包含SEQ ID NO:169或与其具有至少约95%或更高同一性的序列,并且该VL包含SEQ ID NO:178或与其具有至少约95%或更高同一性的序列;
13)包含如下VH和VL的抗体或其抗原结合片段,该VH包含SEQ ID NO:225或与其具有至少约95%或更高同一性的序列,并且该VL包含SEQ ID NO:229或与其具有至少约95%或更高同一性的序列;
14)包含如下VH和VL的抗体或其抗原结合片段,该VH包含SEQ ID NO:233或与其具有至少约95%或更高同一性的序列,并且该VL包含SEQ ID NO:237或与其具有至少约95%或更高同一性的序列;
15)包含如下VH和VL的抗体或其抗原结合片段,该VH包含SEQ ID NO:241或与其具有至少约95%或更高同一性的序列,并且该VL包含SEQ ID NO:229或与其具有至少约95%或更高同一性的序列;
16)包含如下VH和VL的抗体或其抗原结合片段,该VH包含SEQ ID NO:250或与其具有至少约95%或更高同一性的序列,并且该VL包含SEQ ID NO:257或与其具有至少约95%或更高同一性的序列;
17)包含如下VH和VL的抗体或其抗原结合片段,该VH包含SEQ ID NO:264或与其具有至少约95%或更高同一性的序列,并且该VL包含SEQ ID NO:268或与其具有至少约95%或更高同一性的序列;或
18)包含如下VH和VL的抗体或其抗原结合片段,该VH包含SEQ ID NO:281或与其具有至少约95%或更高同一性的序列,并且该VL包含SEQ ID NO:287或与其具有至少约95%或更高同一性的序列。
另一方面,本文提供了选自以下中的任何一种的抗体或抗原结合片段:
1)包含如下重链和轻链的抗体,该重链包含SEQ ID NO:12或与其具有至少约95%或更高同一性的序列,并且该轻链包含SEQ ID NO:23或与其具有至少约95%或更高同一性的序列;
2)包含如下重链和轻链的抗体,该重链包含SEQ ID NO:27或与其具有至少约95%或更高同一性的序列,并且该轻链包含SEQ ID NO:31或与其具有至少约95%或更高同一性的序列;
3)包含如下重链和轻链的抗体,该重链包含SEQ ID NO:35或与其具有至少约95%或更高同一性的序列,并且该轻链包含SEQ ID NO:31或与其具有至少约95%或更高同一性的序列;
4)包含如下重链和轻链的抗体,该重链包含SEQ ID NO:48或与其具有至少约95%或更高同一性的序列,并且该轻链包含SEQ ID NO:59或与其具有至少约95%或更高同一性的序列;
5)包含如下重链和轻链的抗体,该重链包含SEQ ID NO:48或与其具有至少约95%或更高同一性的序列,并且该轻链包含SEQ ID NO:66或与其具有至少约95%或更高同一性的序列;
6)包含如下重链和轻链的抗体,该重链包含SEQ ID NO:72或与其具有至少约95%或更高同一性的序列,并且该轻链包含SEQ ID NO:76或与其具有至少约95%或更高同一性的序列;
7)包含如下重链和轻链的抗体,该重链包含SEQ ID NO:27或与其具有至少约95%或更高同一性的序列,并且该轻链包含SEQ ID NO:80或与其具有至少约95%或更高同一性的序列;
8)包含如下重链和轻链的抗体,该重链包含SEQ ID NO:93或与其具有至少约95%或更高同一性的序列,并且该轻链包含SEQ ID NO:104或与其具有至少约95%或更高同一性的序列;
9)包含如下重链和轻链的抗体,该重链包含SEQ ID NO:117或与其具有至少约95%或更高同一性的序列,并且该轻链包含SEQ ID NO:127或与其具有至少约95%或更高同一性的序列;
10)包含如下重链和轻链的抗体,该重链包含SEQ ID NO:134或与其具有至少约95%或更高同一性的序列,并且该轻链包含SEQ ID NO:127或与其具有至少约95%或更高同一性的序列;
11)包含如下重链和轻链的抗体,该重链包含SEQ ID NO:147或与其具有至少约95%或更高同一性的序列,并且该轻链包含SEQ ID NO:158或与其具有至少约95%或更高同一性的序列;
12)包含如下重链和轻链的抗体,该重链包含SEQ ID NO:171或与其具有至少约95%或更高同一性的序列,并且该轻链包含SEQ ID NO:180或与其具有至少约95%或更高同一性的序列;
13)包含如下重链和轻链的抗体,该重链包含SEQ ID NO:227或与其具有至少约95%或更高同一性的序列,并且该轻链包含SEQ ID NO:231或与其具有至少约95%或更高同一性的序列;
14)包含如下重链和轻链的抗体,该重链包含SEQ ID NO:235或与其具有至少约95%或更高同一性的序列,并且该轻链包含SEQ ID NO:239或与其具有至少约95%或更高同一性的序列;
15)包含如下重链和轻链的抗体,该重链包含SEQ ID NO:243或与其具有至少约95%或更高同一性的序列,并且该轻链包含SEQ ID NO:231或与其具有至少约95%或更高同一性的序列;
16)包含如下重链和轻链的抗体,该重链包含SEQ ID NO:252或与其具有至少约95%或更高同一性的序列,并且该轻链包含SEQ ID NO:259或与其具有至少约95%或更高同一性的序列;
17)包含如下重链和轻链的抗体,该重链包含SEQ ID NO:266或与其具有至少约95%或更高同一性的序列,并且该轻链包含SEQ ID NO:270或与其具有至少约95%或更高同一性的序列;或
18)包含如下重链和轻链的抗体,该重链包含SEQ ID NO:283或与其具有至少约95%或更高同一性的序列,并且该轻链包含SEQ ID NO:289或与其具有至少约95%或更高同一性的序列。
本文还提供了特异性结合人ENTPD2中的表位的抗体或其抗原结合片段,其中该表位包含以下残基中的至少一个(例如,至少两个、至少三个、至少四个、至少五个、至少六个、至少七个、至少八个、至少九个、至少十个、至少十一个、至少十二个、至少十三个、至少十四个、至少十五个、至少二十个):His50、Asp76、Pro78、Gly79、Gly80、Tyr85、Asp87、Asn88、Gly91、Gln94、Ser95、Gly98、Glu101、Gln102、Gln105、Asp106、Arg245、Thr272、Gln273、Leu275、Asp278、Arg298、Ala347、Ala350、Thr351、Arg392、Ala393、Arg394、或Tyr398。
本文还提供了特异性结合人ENTPD2中的表位的抗体或其抗原结合片段,其中该表位包含以下残基中的至少一个(例如,至少两个、至少三个、至少四个、至少五个、至少六个、至少七个、至少八个、至少九个、至少十个、至少十一个、至少十二个、至少十三个、至少十四个、至少十五个、至少二十个):Gly79、Gln250、Leu253、Trp266、Arg268、Gly269、Phe270、Ser271、Thr272、Gln273、Val274、Leu275、Asp278、Arg298、Ser300、Ser302、Gly303、Thr380、Trp381、Ala382、Gly390、Gln391、Arg392、Ala393、Arg394、或Asp397。
在一些实施例中,本文所述的抗体或其抗原结合片段具有IgG1、IgG2、IgG3或IgG4同种型。在一些实施例中,本文所述的抗体或其抗原结合片段具有IgG1同种型。在一些实施例中,本文所述的抗体或其抗原结合片段包含Fc区,该Fc区选自IgG1 Fc区、IgG2 Fc区、IgG4 Fc区、或IgG2/IgG4杂合Fc区。。在一些实施例中,本文所述的抗体或其抗原结合片段包含Fc区,该Fc区选自IgG1 Fc区。在一些实施例中,本文所述的抗体或其抗原结合片段包含修饰的Fc区。在一些实施例中,本文所述的抗体或其抗原结合片段包含修饰的Fc区,该修饰的Fc区相比于亲本抗体具有降低的抗体依赖性细胞毒性(ADCC)或补体依赖性细胞毒性(CDC)活性。
另一方面,本文提供了与表1中提供的任何抗体或抗原结合片段竞争结合人ENTPD2蛋白的抗体或其抗原结合片段。
另一方面,本文提供了与表1中提供的任何抗体或抗原结合片段基本上结合相同的ENTPD2表位的抗体或其抗原结合片段。
在一些实施例中,本文所述的抗体或其抗原结合片段结合人ENTPD2蛋白,其中解离常数(KD)小于10nM,例如KD小于5nM或KD小于3nM,例如如通过Biacore测量的。在一些实施例中,在25℃通过Biacore测量针对人ENTPD2的本文所述的抗体或其抗原结合片段。
在一些实施例中,本文所述的抗体或其抗原结合片段抑制至少40%、至少50%、至少60%、至少70%、至少80%、或至少90%的人ENTPD2酶活性。在一些实施例中,使用体外FRET测定测量人ENTPD2的酶活性,该体外FRET测定通过在细胞表面表达的重组ENTPD2或ENTPD2测量ATP至ADP的水解。
在一些实施例中,本文所述的抗人ENTPD2抗体或其抗原结合片段抑制ENTPD2水解三磷酸腺苷(ATP)的能力。在一些实施例中,使用体外FRET测定测量ENTPD2水解ATP的能力,该体外FRET测定通过在细胞表面表达的重组ENTPD2或ENTPD2测量ATP至ADP的水解。
在一些实施例中,本文所述的抗人ENTPD2抗体或其抗原结合片段干扰ATP与ENTPD2的结合或在ENTPD2的催化结构域内捕获ATP。在一些实施例中,使用体外FRET测定测量ENTPD2水解ATP的能力,该体外FRET测定通过在细胞表面表达的重组ENTPD2或ENTPD2测量ATP至ADP的水解。
在一些实施例中,本文所述的抗体或其抗原结合片段是人或人源化抗体或其片段。
另一方面,本文提供了编码本文所述的抗人ENTPD2抗体或其抗原结合片段的核酸。此类核酸可编码包含本文所述的ENTPD2抗体或其抗原结合片段的区段或结构域的多肽。
还提供了包含编码本文所述的抗人ENTPD2抗体或其抗原结合片段的核酸的运载体。在一些实施例中,运载体选自DNA运载体、RNA运载体、质粒、粘粒或病毒运载体。在一些实施例中,运载体是基于以下病毒中的任何一种的病毒运载体:慢病毒、腺病毒、腺相关病毒(AAV)、单纯疱疹病毒(HSV)、细小病毒、逆转录酶病毒、牛痘病毒、辛德毕斯病毒、流感病毒、呼肠孤病毒、新城疫病毒(NDV)、麻疹病毒、水疱性口炎病毒(VSV)、脊髓灰质炎病毒、痘病毒、塞内卡谷病毒、柯萨奇病毒、肠道病毒、粘液瘤病毒或马拉巴病毒。在一些实施例中,运载体是AAV运载体。在一些实施例中,运载体是慢病毒运载体。在一些实施例中,运载体进一步包含启动子,例如组织特异性启动子。在一些实施例中,运载体进一步包含可检测标记。
本文还提供了包含编码本文所述的抗人ENTPD2抗体或其抗原结合片段的核酸或核酸组的细胞或者包含这种核酸或核酸组的运载体。
另一方面,本文提供了包含以下的药物组合物:本文所述的抗人ENTPD2抗体或其抗原结合片段、编码这种抗体或抗原结合片段的核酸、包含这种核酸或核酸组的运载体、或包含本文所述的核酸或核酸组或运载体的细胞、和药学上可接受的载体运载体。
另一方面,本文提供了通过如下步骤产生抗人ENTPD2抗体或其抗原结合片段的方法:培养包含编码抗人ENTPD2抗体或其抗原结合片段的核酸或核酸组的细胞或包含这种核酸或核酸组的运载体,并从培养基中收集抗体或其抗原结合片段。
另一方面,本文提供了通过向受试者施用治疗有效量的以下各项来治疗对有需要的受试者的癌症的方法:本文所述的抗人ENTPD2抗体或抗原结合片段;编码这种抗体或抗原结合片段的核酸或核酸组;包含编码这种抗体或抗原结合片段的核酸的运载体;包含这种核酸或核酸组或运载体的细胞;或包含这样的抗体或抗原结合片段、核酸或核酸组、运载体或细胞的药物组合物。在一些实施例中,将抗体或其抗原结合片段、核酸或核酸组、运载体、细胞或药物组合物通过静脉内、肿瘤内或皮下途径向受试者给予。
另一方面,本文提供了通过以有效刺激受试者中的免疫应答的量向该受试者施用以下各项来刺激该免疫应答的方法:本文所述的抗人ENTPD2抗体或抗原结合片段,编码这种抗体或抗原结合片段的核酸或核酸组,包含编码这种抗体或抗原结合片段的核酸的运载体,包含这种核酸或核酸组或运载体的细胞,或包含这样的抗体或抗原结合片段、核酸或核酸组、运载体或细胞的药物组合物。
在一些实施例中,此类方法可以进一步包括向受试者施用至少一种另外的治疗剂。
在一些实施例中,此类方法可以进一步包括向受试者施用至少两种另外的治疗剂。
另一方面,本文提供了用作药物的本文所述的抗体或其抗原结合片段,编码这种抗体或其抗原结合片段的核酸或核酸组,包含这种核酸或核酸组的运载体或细胞,或包含这样的抗体或其抗原结合片段、核酸或核酸组、运载体或细胞的药物组合物。
另一方面,本文提供了用于在癌症的治疗中使用的本文所述的抗体或其抗原结合片段,编码这种抗体或其抗原结合片段的核酸,包含这种核酸或核酸组的运载体或细胞,或包含这样的抗体或其抗原结合片段、核酸或核酸组、运载体或细胞的药物组合物。
另一方面,本文提供了如下药物组合物,该药物组合物包含本文所述的抗体或其抗原结合片段,以及至少一种另外的治疗剂或治疗术。
在一些实施例中,该至少一种另外的治疗剂或治疗术选自化学疗法、靶向抗癌疗法、溶瘤细胞药物、细胞毒性剂、基于免疫的疗法、细胞因子、外科手术、放射程序、共刺激分子的激活剂、抑制分子的抑制剂、疫苗或细胞疗法中的一种或多种。
在一些实施例中,该至少一种另外的治疗剂是PD-1抑制剂,例如PD-1抗体。在一些实施例中,该PD-1抑制剂选自PDR001、纳武单抗(Nivolumab)、派姆单抗(Pembrolizumab)、匹地利珠单抗(Pidilizumab)、MEDI0680、REGN2810、TSR-042、PF-06801591、或AMP-224。
在一些实施例中,该至少一种另外的治疗剂是PD-L1抑制剂,例如PD-L1抗体。在一些实施例中,该PD-L1抑制剂选自FAZ053、阿特利珠单抗(Atezolizumab)、阿维鲁单抗(Avelumab)、度伐鲁单抗(Durvalumab)、或BMS-936559。
在一些实施例中,该至少一种另外的治疗剂是A2AR拮抗剂。在一些实施例中,该A2AR拮抗剂选自:
i.抗CD73抗体分子或其抗原结合片段,任选地其中该抗CD73抗体选自:
a.包含以下的抗CD73抗体分子:包含SEQ ID NO:295的氨基酸序列的重链可变区和包含SEQ ID NO:296的氨基酸序列的轻链可变区,或者与SEQ ID NO:295或296具有至少85%、90%、95%或更高同一性的氨基酸序列;
b.包含以下的抗CD73抗体分子:包含SEQ ID NO:299的氨基酸序列的重链可变区和包含SEQ ID NO:300的氨基酸序列的轻链可变区,或者与SEQ ID NO:299或300具有至少85%、90%、95%或更高同一性的氨基酸序列;
c.包含以下的抗CD73抗体分子:包含SEQ ID NO:302的氨基酸序列的重链可变区和包含SEQ ID NO:303的氨基酸序列的轻链可变区,或者与SEQ ID NO:302或303具有至少85%、90%、95%或更高同一性的氨基酸序列;
d.包含以下的抗CD73抗体分子:包含SEQ ID NO:304的氨基酸序列的重链可变区和包含SEQ ID NO:305的氨基酸序列的轻链可变区,或者与SEQ ID NO:304或305具有至少85%、90%、95%或更高同一性的氨基酸序列;
e.包含以下的抗CD73抗体分子:包含SEQ ID NO:306的氨基酸序列的重链可变区和包含SEQ ID NO:307的氨基酸序列的轻链可变区,或者与SEQ ID NO:306或307具有至少85%、90%、95%或更高同一性的氨基酸序列;或
f.包含以下的抗CD73抗体分子:包含SEQ ID NO:308的氨基酸序列的重链可变区和包含SEQ ID NO:309的氨基酸序列的轻链可变区,或者与SEQ ID NO:308或309具有至少85%、90%、95%或更高同一性的氨基酸序列;或
ii.PBF509/NIR178、CPI444/V81444、AZD4635/HTL-1071、维帕迪南(vipadenant)、GBV-2034、AB928、茶碱、伊曲茶碱、托扎迪南(Tozadenant)/SYN-115、KW-6356、ST-4206、和普瑞迪南(Preladenant)/SCH 420814;或
iii.5-溴-2,6-二-(1H-吡唑-1-基)嘧啶-4-胺,或其药学上可接受的盐;(S)-7-(5-甲基呋喃-2-基)-3-((6-(((四氢呋喃-3-基)氧基)甲基)吡啶-2-基)甲基)-3H-[1,2,3]三唑并[4,5-d]嘧啶-5-胺,或其药学上可接受的盐;(R)-7-(5-甲基呋喃-2-基)-3-((6-(((四氢呋喃-3-基)氧基)甲基)吡啶-2-基)甲基)-3H-[1,2,3]三唑并[4,5-d]嘧啶-5-胺,或其外消旋体,或其药学上可接受的盐;7-(5-甲基呋喃-2-基)-3-((6-(((四氢呋喃-3-基)氧基)甲基)吡啶-2-基)甲基)-3H-[1,2,3]三唑并[4,5-d]嘧啶-5-胺,或其药学上可接受的盐;以及6-(2-氯-6-甲基吡啶-4-基)-5-(4-氟苯基)-1,2,4-三嗪-3-胺,或其药学上可接受的盐。
在一些实施例中,该至少一种另外的治疗剂选自:
i.CTLA-4抑制剂,任选地其中该CTLA-4抑制剂选自艾匹利木单抗(Ipilimumab)或曲美利木单抗(Tremelimumab);
ii.TIM-3抑制剂,任选地其中该TIM-3抑制剂选自MBG453、TSR-022、或LY3321367;
iii.LAG-3抑制剂,任选地其中该LAG-3抑制剂选自LAG525、BMS-986016、TSR-033、MK-4280或REGN3767;
iv.GITR激动剂,任选地其中该GITR激动剂选自GWN323、BMS-986156、MK-4166、MK-1248、TRX518、INCAGN1876、AMG 228、或INBRX-110;
v.抗CD3多特异性抗体分子,任选地其中该抗CD3多特异性抗体分子是抗CD3 x抗CD123双特异性抗体分子(例如XENP14045)、或抗CD3 x抗CD20双特异性抗体分子(例如XENP13676);
vi.细胞因子分子,任选地其中该细胞因子分子是与可溶形式的IL-15受体α(IL-15Ra)复合的IL-15;
vii.巨噬细胞集落刺激因子(M-CSF)抑制剂,任选地其中该M-CSF抑制剂是MCS110;
viii.CSF-1R抑制剂,任选地其中该CSF-1R抑制剂是BLZ945;
ix.吲哚胺2,3-双加氧酶(IDO)和/或色氨酸2,3-双加氧酶(TDO)的抑制剂;
x.TGF-β抑制剂;
xi.溶瘤病毒;
xii.嵌合抗原受体(CAR)T细胞疗法。
在一些实施例中,该至少一种另外的治疗剂选自:1)蛋白激酶C(PKC)抑制剂;2)热休克蛋白90(HSP90)抑制剂;3)磷酸肌醇3-激酶(PI3K)和/或雷帕霉素靶蛋白(mTOR)的抑制剂;4)细胞色素P450的抑制剂(例如,CYP17抑制剂或17α-羟化酶/C17-20裂解酶抑制剂);5)铁螯合剂;6)芳香酶抑制剂;7)p53抑制剂,例如p53/Mdm2相互作用的抑制剂;8)细胞凋亡诱导剂;9)血管生成抑制剂;10)醛固酮合酶抑制剂;11)平滑(smoothened,SMO)受体抑制剂;12)催乳素受体(PRLR)抑制剂;13)Wnt信号传导抑制剂;14)CDK4/6抑制剂;15)成纤维细胞生长因子受体2(FGFR2)/成纤维细胞生长因子受体4(FGFR4)抑制剂;16)巨噬细胞集落刺激因子(M-CSF)的抑制剂;17)c-KIT、组胺释放、Flt3(例如FLK2/STK1)或PKC中的一种或多种的抑制剂;18)VEGFR-2(例如FLK-1/KDR)、PDGFRβ、c-KIT或Raf激酶C中一种或多种的抑制剂;19)生长激素抑制素激动剂和/或生长激素释放抑制剂;20)间变性淋巴瘤激酶(ALK)抑制剂;21)胰岛素样生长因子1受体(IGF-1R)抑制剂;22)P-糖蛋白1抑制剂;23)血管内皮生长因子受体(VEGFR)抑制剂;24)BCR-ABL激酶抑制剂;25)FGFR抑制剂;26)CYP11B2的抑制剂;27)HDM2抑制剂,例如HDM2-p53相互作用的抑制剂;28)酪氨酸激酶的抑制剂;29)c-MET的抑制剂;30)JAK的抑制剂;31)DAC的抑制剂;32)11β-羟化酶的抑制剂;33)IAP的抑制剂;34)PIM激酶的抑制剂;35)博库派恩(Porcupine)的抑制剂;36)BRAF(例如BRAF V600E或野生型BRAF)的抑制剂;37)HER3的抑制剂;38)MEK的抑制剂;39)脂质激酶的抑制剂;或表16中提供的一种或多种药剂。
在一些实施例中,将抗体或抗原结合片段、核酸或核酸组、运载体、细胞或药物组合物与该至少一种另外的治疗剂同时、在其之前、或在其之后给予。
在一些实施例中,给予该抗体或其抗原结合片段、核酸或核酸组、运载体、细胞或药物组合物具有以下效果中的一种或多种:
(a)受试者的肿瘤或病变部位中CD45+CD4-CD8+CD69+CD25+细胞的数量增加;
(b)受试者的肿瘤或病变部位中CD45+CD8-CD4+FOXP3-CD69+CD25+细胞的数量增加;
(c)受试者的血浆MCP1或IL-1β水平降低;或
(d)受试者的肿瘤或病变部位中MCP1水平上升。
另一方面,本文提供了本文所述的抗体或其抗原结合片段,编码这种抗体或其抗原结合片段的核酸,包含这种核酸的运载体或细胞,或包含这样的抗体或其抗原结合片段、核酸、运载体或细胞的药物组合物在用于癌症治疗的药物的生产中的用途。
另一方面,本文提供了一种治疗有需要的受试者的癌症的方法,这种方法包括将治疗有效量的本文所述的抗人ENTPD2抗体或抗原结合片段与选自PD-1抑制剂或PD-L1抑制剂的第二治疗剂组合向该受试者给予。
另一方面,本文提供了一种刺激受试者中的免疫应答的方法,这种方法包括将治疗有效量的本文所述的抗人ENTPD2抗体或抗原结合片段与选自PD-1抑制剂或PD-L1抑制剂的第二治疗剂组合向该受试者给予。
另一方面,本文提供了包含本文所述的抗人ENTPD2抗体或抗原结合片段的组合物,用于与选自PD-1抑制剂或PD-L1抑制剂的第二治疗剂组合在受试者癌症的治疗中使用。
另一方面,本文提供了包含本文所述的抗人ENTPD2抗体或抗原结合片段的组合物,用于与选自PD-1抑制剂或PD-L1抑制剂的第二治疗剂组合在受试者癌症的治疗中使用。
在一些实施例中,PD-1抑制剂是PD-1抗体。在一些实施例中,该PD-1抑制剂选自PDR001、纳武单抗、派姆单抗、匹地利珠单抗、MEDI0680、REGN2810、TSR-042、PF-06801591、或AMP-224。
在一些实施例中,PD-L1抑制剂是PD-L1抗体。在一些实施例中,该PD-L1抑制剂选自FAZ053、阿特利珠单抗、阿维鲁单抗、度伐鲁单抗、或BMS-936559。
在一些实施例中,癌症是ENTPD2+癌症。在一些实施例中,该癌症是结肠直肠癌(CRC)、胃癌(例如胃腺癌、胃恶性肿瘤)、食道癌(例如食道鳞状细胞癌(ESCC))、胰腺癌、胆管癌、肺癌(例如小细胞肺癌)、乳腺癌(例如乳腺腺癌)或卵巢癌。
本文提及的所有公开物、专利和登录号均通过引用以其全文特此并入,如同每个单独的出版物或专利被明确且单独地表明通过引用而并入。
附图说明
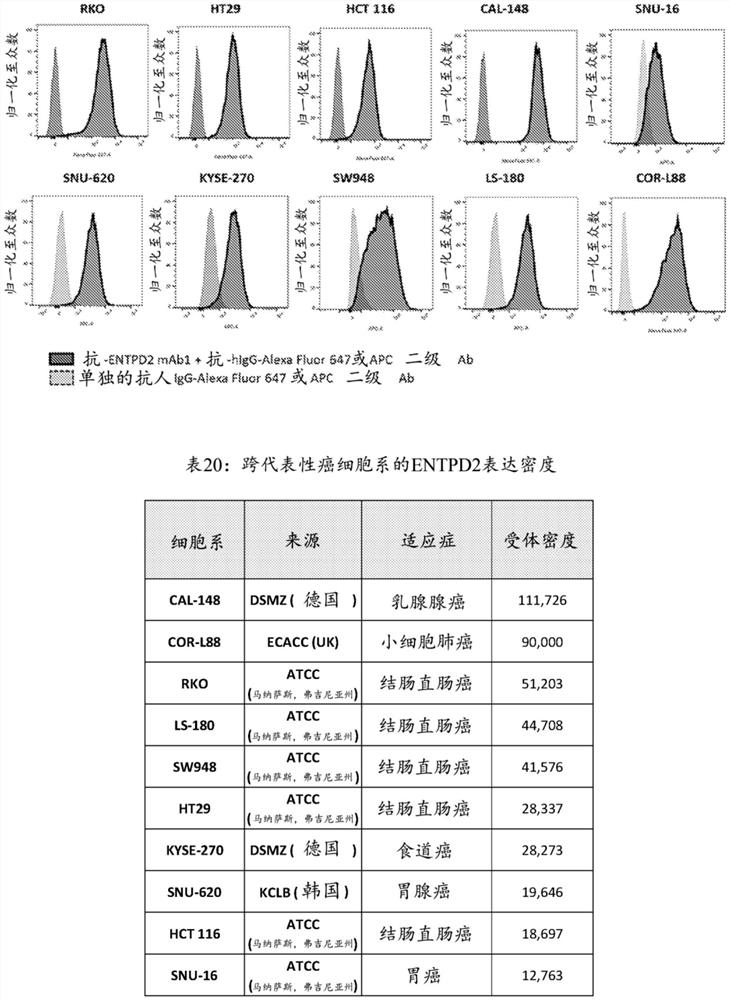
图1A描绘了通过流式细胞术测定的跨代表性癌细胞系的ENTPD2表达。图1B是显示跨代表性癌细胞系的ENTPD2受体密度的表(表20)。
图2描绘了福尔马林固定的石蜡包埋的原发性结肠直肠、食道和卵巢肿瘤组织中ENTPD2的代表性IHC染色图像。
图3A显示了抗人ENTPD2 FAb22重链(SEQ ID NO:330)和轻链(SEQ ID NO:334)的氨基酸序列,其中CDR加下划线(如由卡巴特(Kabat)定义),并且位于抗体-抗原界面的残基针对每个Fab标记为(*)。图3B显示了抗人ENTPD2 FAb23重链(SEQ ID NO:336)和轻链(SEQID NO:239)的氨基酸序列,其中CDR加下划线(如由卡巴特定义),并且位于抗体-抗原界面的残基用(*)标记。图3C显示了抗小鼠ENTPD2 FAb24重链(SEQ ID NO:338)和轻链(SEQ IDNO:340)的氨基酸序列,其中CDR加下划线(如由卡巴特定义),并且位于抗体-抗原界面的残基用(*)标记。
图4A显示了晶体学研究中使用的重组人ENTPD2(残基29-462,Y350A突变体)的氨基酸序列(SEQ ID NO:1014),其中二级结构元件示于氨基酸序列下面。条状代表α-螺旋并且箭头代表β-链。由于序列格式化中断的未标记箭头和条状与前面标记的结构元件相邻。非结构化区域未标记。人ENTPD2的可溶性细胞外结构域跨越残基29-462。该构建体利用N-末端GP67分泌信号肽(前面的以灰色突出显示的38个残基),其具有最后一个残基后的信号肽切割位点和C-末端六组氨酸(SEQ ID NO:1010)金属亲和标签以促进纯化。Asn129、Asn294、Asn378和Asn443是预测的N-连接糖基化位点,在晶体结构中观察到这些糖基化位点并以斜体显示。Asn64也是在这些晶体结构中未观察到的预测的N-连接糖基化位点。位于FAb22和FAb23复合物的抗原-Fab界面的残基分别由氨基酸序列下面的(*)和(:)符号指示。图4B显示了用于晶体学研究中的重组鼠ENTPD2(残基29-462)的氨基酸序列(SEQ ID NO:1015),其中二级结构元件示于氨基酸序列下面。条状代表α-螺旋并且箭头代表β-链。由于线条中断的未标记箭头和条状与前面标记的结构元件相邻。非结构化区域未标记。成熟的小鼠ENTPD2从Thr29开始。该构建体利用N-末端GP67分泌信号肽(残基1-38),其具有残基38后的信号肽切割位点和C-末端六组氨酸(SEQ ID NO:1010)金属亲和标签以促进纯化。Asn129、Asn294、Asn378和Asn443是斜体显示的潜在的N-连接糖基化位点。位于抗原-FAb24界面的残基用氨基酸序列下的(#)符号指示。
图5A显示了具有所示残基33-453的人ENTPD2胞外域apo晶体结构的动画演示图。两个视图旋转90度。标记了连续的二级结构元件。二硫化物显示为棒状。氨基和羧基末端分别标记为NT和CT。膜近端叶包含N-和C-末端(亚结构域1:Pro36-Ser161和Lys427-Phe461),并且阴影比膜远端叶(亚结构域2:Gly162-Gln426)更暗。底物ATP在叶间裂隙内深处结合。ATP结合位点的位置如图5B所示。显示的是ATP模拟物AMP-PNP,其叠加在来自大鼠ENTPD2共结构(PDB 3CJA)的人ENTPD2活性位点中。
图6示出了与人ENTPD2复合的抗人ENTPD2 FAb22的概观。两个视图相差90度显示。基于与大鼠ENTPD2共结构PDB 3CJA的叠加,AMP-PNP在ENTPD2活性位点中建模。Fab的重链阴影更暗。
图7示出了与人ENTPD2复合的抗人ENTPD2 FAb23的概观。两个视图相差90度显示。基于与大鼠ENTPD2共结构PDB 3CJA的叠加,AMP-PNP在ENTPD2活性位点中建模。Fab的重链阴影更暗。
图8示出了与小鼠ENTPD2复合的抗鼠ENTPD2 FAb24的概观。基于与大鼠ENTPD2共结构PDB 3CJA的叠加,AMP-PNP在ENTPD2活性位点中建模。Fab的重链阴影更暗。
图9是说明在同基因B16LM3肿瘤模型中抗小鼠ENTPD2 mAb13与抗PD-1Ab组合的长期功效的图。
图10A-10C是说明在同基因B16F10肿瘤模型中抗小鼠ENTPD2mAb13与抗PD-1Ab组合的功效的图,其与治疗后第8天肿瘤部位活化的CD8和CD4 T辅助细胞的流入增加相关。
图11A-11B描绘了人ENTPD2工程化模型B16LM3克隆B5的表征,说明通过FACS在体外表达人ENTPD2和通过IHC与Novus抗人CD39L1 Ab(1:40稀释)在体内肿瘤中人ENTPD2表达的持续性。
图12A-12B是说明人ENTPD2工程化B16LM3克隆B5模型中抗人ENTPD2 mAb1和mAb6与抗PD-1Ab组合的剂量应答功效的图。
图13A-13B是显示在人ENTPD2工程化B16LM3克隆B5异种移植模型(C57BL/6只小鼠)中用抗人ENTPD2 mAb1或同种型对照处理后的血浆IL-1b(图13A)和MCP-1(图13B)水平的点状图。图13C-13D是显示在人ENTPD2工程化B16LM3克隆B5异种移植模型(C57BL/6只小鼠)中用抗人ENTPD2 mAb1或同种型对照处理后的IL-1β(图13C)和MCP-1(图13D)水平的点状图。
图14是显示抗ENTPD2 mAb1与A2AR拮抗剂NIR178组合在人ENTPD2工程化B16LM3异种移植物模型(C57BL/6只小鼠)中的体内功效的图。
图15是显示抗ENTPD2 Ab在生物化学人ENTPD2功能测定中的代表性活性的图。抗人ENTPD2 mAb1、mAb17、mAb19和mAb21有效抑制重组人ENTPD2的催化活性。
图16A-16B描绘了在人或食蟹猴ENTPD2 NIH/3T3或RKO的基于细胞的功能测定中抗人ENTPD2抗体的代表性活性。
图17描绘了说明抗小鼠ENTPD2 mAb13、mAb14、mAb15在小鼠ENTPD2 NIH/3T3的基于细胞的功能测定中的体外功能活性的图。
具体实施方式
本发明提供了特异性结合胞外酶外核苷三磷酸二磷酸水解酶2(例如人ENTPD2蛋白)的抗体或其抗原结合片段,例如单克隆抗体或其抗原结合片段。ENTPD2抗体或其抗原结合片段可用于治疗ENTPD2相关疾病,例如癌症。
定义
如说明书和权利要求中所用,除非上下文另外明确指出,否则单数形式“一个”、“一种”和“该”也包括复数指示物。例如,术语“细胞”包括多个细胞,包括其混合物。
在整个说明书和随后的权利要求中,除非上下文另有要求,除非另有说明,否则单词“包含(comprise)”和变体例如“包含(comprises)”和“包含(comprising)”在本文中以其开放式和非限制性的意义使用。
当在本文中使用时,“由……组成”不包括在方面、实施例和/或权利要求部分中未指定的任何元素、步骤或成分。当在本文中使用时,“基本上由……组成”不排除不会实质上影响该方面、实施例和/或权利要求的基本和新颖特征的材料或步骤。
在本文的每个例子中,术语“包含”、“基本上由……组成”和“由……组成”中的任何一个可以用其他两个术语中的任一个替换。
所有数字标记,例如pH、温度、时间、浓度和分子量(包括范围),都是近似值,其以0.1的增量变化(+)或(-)。应该理解,尽管并非总是明确说明,但所有数字标号前面都有术语“约”。还应理解,尽管并非总是明确说明,但本文描述的试剂仅是实例,并且其等效物是本领域已知的。
如本文所用,外核苷三磷酸二磷酸水解酶2(ENTPD2)(也称为CD39抗原-样1、CD39-样-1、CD39L1、外-ATP二磷酸水解酶2、外-ATP酶、外-ATP酶2、外-ATPD酶2、NTPD酶-2、NTPD酶2)是指外-核苷三磷酸酯二磷酸水解酶家族(E-NTPD酶)(其是水解5'-三磷酸的外-核苷酶家族)的2型酶。ENTPD2酶由基因ENTPD2编码。人ENTPD2基因映射于染色体位置9q34.3,并且人ENTPD2基因的基因组序列可在GenBank中NC_000009.12处找到。ENTPD2人转录物变体的mRNA和蛋白质序列可在GenBank中找到,其登记号如下:
同种型1:NM_203468.2(mRNA)→NP_982293.1(具有495aa的蛋白质);
同种型2:NM_001246.3(mRNA)→NP_001237.1(具有472aa的蛋白质);
外核苷三磷酸二磷酸水解酶2同种型1[智人,NP_982293.1]
智人外核苷三磷酸二磷酸水解酶2(ENTPD2),转录物变体1,mRNA[NM_203468.2]
外核苷三磷酸二磷酸水解酶2同种型2[智人,NP_001237.1]
智人外核苷三磷酸二磷酸水解酶2(ENTPD2),转录物变体2,mRNA[NM_001246.3]
如本文所用,人ENTPD2蛋白还涵盖在其全长上与ENTPD2同种型中的任何一种具有至少约70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的蛋白质。鼠、食蟹猴和其他动物ENTPD2蛋白的序列是本领域已知的。
如本文所用,术语“抗体”是指源自与抗原特异性地结合的免疫球蛋白分子的蛋白质或多肽序列。抗体可以是多克隆或单克隆、多链或单链、或完整免疫球蛋白,并且可以源自天然来源或来自重组来源。例如,天然存在的IgG抗体可以是包含通过二硫键相互连接的至少两条重(H)链和两条轻(L)链的糖蛋白。每条重链包含重链可变区(本文中缩写为VH)和重链恒定区。重链恒定区包含三个结构域,即CH1、CH2和CH3。每条轻链包含轻链可变区(本文中缩写为VL)和轻链恒定区。轻链恒定区包含一个结构域,即CL。VH和VL区可进一步细分为高变区,称为互补决定区(CDR),它们散布着称为框架区(FR)的较保守的区。每个VH和VL由从氨基末端排到羧基末端按以下顺序排列的三个CDR和四个FR构成:FR1、CDR1、FR2、CDR2、FR3、CDR3、FR4。重链和轻链的可变区含有与抗原相互作用的结合结构域。抗体的恒定区可以介导免疫球蛋白与宿主组织或因子(包括免疫系统的各种细胞(例如,效应细胞)和经典补体系统的第一成分(C1q))的结合。抗体可以是单克隆抗体、人抗体、人源化抗体、骆驼源化(camelised)抗体或嵌合抗体。这些抗体可以属于任何同种型(例如IgG、IgE、IgM、IgD、IgA和IgY)、类别(例如IgG1、IgG2、IgG3、IgG4、IgA1和IgA2)或亚类。
术语“抗体片段”或“抗原结合片段”是指抗体的至少一部分,该至少一部分保留与抗原表位特异性地相互作用(例如,通过结合、空间位阻、稳定/去稳定、空间分布)的能力。抗体片段的实例包括但不限于Fab、Fab’、F(ab’)2、Fv片段、scFv抗体片段、二硫键连接的Fv(sdFv)、由VH和CH1结构域组成的Fd片段、线性抗体、单结构域抗体如sdAb(VL或VH)、骆驼科VHH结构域、由抗体片段(如包含在铰链区通过二硫键连接的两个Fab片段的二价片段)形成的多特异性抗体、和分离的CDR、或抗体的其他表位结合片段。抗原结合片段还可以掺入到单结构域抗体、大型抗体(maxibodies)、微型抗体(minibodies)、纳米抗体、细胞内抗体、双体抗体、三体抗体、四体抗体、v-NAR和bis-scFv中(参见例如,Hollinger和Hudson,NatureBiotechnology[自然生物技术]23:1126-1136,2005)。还可以将抗原结合片段移植到基于多肽如纤连蛋白III型(Fn3)的支架中(参见美国专利号6,703,199,其描述了纤连蛋白多肽微型抗体)。术语“scFv”是指融合蛋白,其包含至少一个包含轻链可变区的抗体片段和至少一个包含重链可变区的抗体片段,其中该轻链可变区和重链可变区例如通过合成接头(例如短柔性多肽接头)是连续连接的并且能够表达为单链多肽,并且其中scFv保留了它所来源的完整抗体的特异性。除非另有说明,否则如本文所用,scFv可以例如相对于多肽的N末端和C末端以任何顺序具有VL和VH可变区,该scFv可以包含VL-接头-VH或者可以包含VH-接头-VL。
如本文所用,术语“互补决定区”或“CDR”是指赋予抗原特异性和结合亲和力的抗体可变区内的氨基酸序列。例如,一般来说,每个重链可变区中存在三个CDR(例如HCDR1、HCDR2、和HCDR3),并且每个轻链可变区中存在三个CDR(例如LCDR1、LCDR2、和LCDR3)。给定CDR的精确氨基酸序列边界可以使用许多熟知的方案中的任一种来确定,包括以下中所述的那些:Kabat等人(1991),“Sequences of Proteins of Immunological Interest[免疫学相关蛋白质序列],”第5版。Public Health Service[公共卫生服务],NationalInstitutes of Health[国立卫生研究院],Bethesda,MD(“卡巴特”编号方案);Al-Lazikani等人,(1997)JMB 273,927-948(“乔西亚(Chothia)”编号方案),或其组合,和免疫遗传学(IMGT)编号(Lefranc,M.-P.,The Immunologist[免疫学家],7,132-136(1999);Lefranc,M.-P.等人,Dev.Comp.Immunol.[发育免疫学与比较免疫学],27,55-77(2003)(“IMGT”编号方案)。在针对给定CDR区(例如,HC CDR1、HC CDR2、HC CDR3、LC CDR1、LC CDR2或LC CDR3)的组合卡巴特和乔西亚编号方案中,在一些实施例中,这些CDR对应于被定义为卡巴特CDR的一部分的氨基酸残基,以及被定义为乔西亚CDR的一部分的氨基酸残基。如本文所用,根据“乔西亚”编号方案定义的CDR有时也称为“高变环”。
例如,根据卡巴特,重链可变结构域(VH)中的CDR氨基酸残基编号为31-35(HCDR1)(例如在位置35后的一个或多个插入)、50-65(HCDR2)、和95-102(HCDR3);并且轻链可变结构域(VL)中的CDR氨基酸残基编号为24-34(LCDR1)(例如在位置27后的一个或多个插入)、50-56(LCDR2)、和89-97(LCDR3)。作为另一个实例,根据乔西亚,VH中的CDR氨基酸编号为26-32(HCDR1)(例如在位置31后的一个或多个插入)、52-56(HCDR2)、和95-102(HCDR3);并且VL中的氨基酸残基编号为26-32(LCDR1)(例如在位置30后的一个或多个插入)、50-52(LCDR2)、和91-96(LCDR3)。通过结合卡巴特和乔西亚的CDR定义,CDR包含例如人VH中的氨基酸残基26-35(HCDR1)、50-65(HCDR2)和95-102(HCDR3)和人VL中的氨基酸残基24-34(LCDR1)、50-56(LCDR2)和89-97(LCDR3)或由其组成。根据IMGT,VH中的CDR氨基酸残基编号为大约26-35(CDR1)、51-57(CDR2)和93-102(CDR3),并且VL中的CDR氨基酸残基编号为大约27-32(CDR1)、50-52(CDR2)和89-97(CDR3)(根据“卡巴特”编号)。在IMGT下,可以使用程序IMGT/DomainGap Align确定抗体的CDR区。通常,除非特别指出,否则该抗体分子可包括一种或多种卡巴特CDR和/或乔西亚CDR的任何组合。
术语“表位”包括能够特异性结合免疫球蛋白或以其他方式与分子相互作用的任何蛋白质决定簇。表位决定簇通常由分子的化学活性表面基团组成,如氨基酸或碳水化合物或糖侧链,并且可以具有特定的三维结构特征以及特定的电荷特征。表位可以是“线性的”或“构象的”。构象表位和线性表位差别在于:在变性溶剂的存在下,对构象表位(而不是非构象表位)的结合丧失。
如本文所用的术语“单价抗体”是指结合靶分子上的单个表位的抗体。
如本文所用的术语“二价抗体”是指结合至少两个相同靶分子上的两个表位的抗体。二价抗体还可以使靶分子彼此交联。术语“二价抗体”还指结合至少两个相同靶分子上的两个不同表位的抗体。
术语“多价抗体”是指具有多于一个化合价的单个结合分子,其中“化合价”被描述为每分子抗体构建体中存在的抗原结合部分的数目。因此,单个结合分子可以结合靶分子上多于一个结合位点。多价抗体的实例包括但不限于二价抗体、三价抗体、四价抗体、五价抗体等,以及双特异性抗体和双互补位抗体。例如,对于ENTPD2,多价抗体(例如,ENTPD2双互补位抗体)分别具有针对ENTPD2的两个结构域的结合部分。
术语“多价抗体”还指单个结合分子,其对于两个分开的靶分子具有多于一个抗原结合部分。例如,结合ENTPD2的抗体(例如,人ENTPD2蛋白)和不是ENTPD2的第二靶分子。在一个实施里中,多价抗体是具有四个表位结合结构域的四价抗体。对于该靶分子上的每个结合位点,四价分子可以是双特异性和二价的。
如本文所用的术语“双特异性抗体”是指结合两种或更多种不同表位的抗体。在一些实施例中,双特异性抗体与两种不同的靶标结合。在一些实施例中,双特异性抗体结合单个靶分子上的两个不同表位。结合单个靶分子上的两个不同表位的抗体也称为“双互补位抗体”。
如本文所用,短语“单克隆抗体”或“单克隆抗体组合物”是指多肽(包括抗体、双特异性抗体等),它们具有基本上相同的氨基酸序列或源自相同的遗传来源。该术语还包括具有单分子组成的抗体分子的制剂。单克隆抗体组合物表现出对特定表位的单一结合特异性和亲和力。
如本文所用,短语“人抗体”包括具有可变区的抗体,其中框架区和CDR区两者均源自人来源的序列。此外,如果抗体含有恒定区,则恒定区还源自此类人序列,例如人种系序列或突变形式的人种系序列,或含有衍生自人框架序列分析的共有框架序列的抗体,例如,如描述于Knappik等人(2000.J Mol Biol[分子生物学杂志]296,57-86)。免疫球蛋白可变结构域(例如CDR)的结构和位置可使用众所周知的编号方案来定义,例如,卡巴特编号方案,乔西亚编号方案,或卡巴特和乔西亚的组合,和ImMunoGenTics(IMGT)编号(参见,例如Sequences of Proteins of Immunological Interest[免疫学相关蛋白质序列],美国卫生与公众服务部(U.S.Department of Health and Human Services)(1991),编辑Kabat等人;Al Lazikani等人,(1997)J.Mol.Bio.[分子生物学杂志]273:927948;Kabat等人,(1991)Sequences of Proteins of Immunological Interest[免疫学相关蛋白质序列],第5版,NIH公开号91-3242美国卫生与公众服务部(U.S.Department of Health and HumanServices);Chothia等人,(1987)J.Mol.Biol.[分子生物学杂志]196:901-917;Chothia等人,(1989)Nature[自然]342:877-883;Al-Lazikani等人,(1997)J.Mal.Biol.273:927-948和Lefranc,M.-P.,The Immunologist[免疫学家],7,132-136(1999);Lefranc,M.-P.等人,Dev.Comp.Immunol.[发育与比较免疫学],27,55-77(2003))。
本发明的人抗体可以包括不是由人序列编码的氨基酸残基(例如,通过在体外随机诱变或位点特异性诱变或通过在体内体细胞突变来引入的突变,或保守的替代,以促进稳定性或制造)。然而,如本文所用的,术语“人类抗体”不旨在包括其中源自另一种哺乳动物物种(例如小鼠)种系的CDR序列已被移植到人类框架序列中的抗体。
如本文使用的,短语“重组人抗体”包括通过重组方式制备、表达、产生或分离的所有人抗体,比如从动物(例如,小鼠)(该动物对于人免疫球蛋白是转基因的或转染色体的)或由其制备的杂交瘤中分离的抗体;从转化以表达人抗体的宿主细胞中分离的抗体(例如,来自转染瘤中);从重组,组合的人抗体文库中分离的抗体;以及通过任何其他方式(涉及将全部或部分的人免疫球蛋白基因、序列剪接到其他DNA序列)制备、表达、产生或分离的抗体。此类重组人抗体具有可变区,其中构架区和CDR区衍生自人种系免疫球蛋白序列。然而,在某些实施例中,可以对此类重组人抗体进行体外诱变(或,当使用转基因人Ig序列的动物时,进行体内体细胞诱变),并因此重组抗体的VH和VL区的氨基酸序列是衍生自人种系VH和VL序列的和与其相关的序列,这些序列在体内可能不天然存在于人抗体种系库中。
如本文所使用的术语“Fc区”是指包含抗体的CH3、CH2和恒定结构域的铰链区的至少一部分的多肽。任选地,Fc区可以包含在一些抗体种类中存在的CH4结构域。Fc区可以包含抗体恒定区的整个铰链区。在一个实施例中,本发明包括抗体的Fc区和CH1区。在一个实施例中,本发明包括抗体的Fc区和CH3区。在另一个实施例中,本发明包括Fc区、CH1区和来自抗体恒定结构域的Cκ/λ区。在一个实施例中,本发明的结合分子包含恒定区,例如重链恒定区。在一个实施例中,与野生型恒定区相比,这类恒定区是经修饰的。即,本文公开的本发明的多肽可以包含对三个重链恒定结构域(CH1、CH2或CH3)中的一个或多个和/或对轻链恒定区结构域(CL)的改变或修饰。实例修饰包括在一个或多个结构域中添加、缺失或取代一个或多个氨基酸。可以包括此类改变,以优化效应子功能、半衰期等。
如本文使用的,术语“亲和力”是指抗体和抗原在单个抗原位点处的相互作用强度。在每个抗原位点内,抗体“臂”的可变区通过弱非共价力在许多位点处与抗原相互作用;相互作用越多,亲和力越强。如本文所使用的,针对IgG抗体或其片段(例如Fab片段)的术语“高亲和力”是指对靶抗原具有10
如本文所用,术语“亲合力”是指抗体-抗原复合物的总体稳定性或强度的信息量度。它受三个主要因素控制:抗体表位亲和力;抗原和抗体二者的化合价;以及相互作用部分的结构布置。最终,这些因素决定了抗体的特异性,即特定抗体与精确抗原表位结合的可能性。
如本文所用,术语“结合特异性”是指单个抗体结合位点与一种抗原决定簇而不与不同的抗原决定簇反应的能力。抗体的结合位点位于分子的Fab部分中,并且由重链和轻链的高变区构建。抗体的结合亲和力是单个抗原决定簇与抗体上的单个结合位点之间的反应强度。它是在抗原决定簇与抗体的结合位点之间运行的吸引力和排斥力的总和。
术语“治疗”(“treat”或“treatment”)是指治疗性治疗和预防性或防护性措施,其中目的是预防或减缓不期望的生理变化或障碍。出于本发明的目的,有益或期望的临床结果包括但不限于减轻症状、降低疾病程度、疾病状态稳定(即,不恶化)、延迟或减缓疾病进展、改善或缓和疾病状态以及缓解(无论是部分还是全部),无论是可检测的还是不可检测的。“治疗”还可以意指与不接受治疗的预期存活相比延长存活。在其他实施例中,术语“治疗(treat、treatment和treating)”是指通过例如稳定可辨别的症状来物理地,或通过例如稳定物理参数来生理地,或通过两者,抑制增殖性障碍的进展。在其他实施例中,术语“治疗(treat、treatment和treating)”是指减少或稳定肿瘤大小或癌细胞计数。
术语“受试者”是指根据提供的本发明方法进行治疗的动物、人或非人。考虑了兽医应用和非兽医应用。该术语包括但不限于哺乳动物,例如人、其他灵长类动物、猪、啮齿动物如小鼠和大鼠、兔、豚鼠、仓鼠、牛、马、猫、狗、绵羊和山羊。典型的受试者包括人、农场动物和家养宠物,如猫和狗。在一些实施例中,受试者是人。
“有效量”是指足以实现有益的或希望的结果的量。例如,治疗量为达到所需疗效的量。所述量可与预防上有效量相同或不同,所述预防上有效量为预防疾病或疾病症状的发作所需的量。可以在一次或多次给与或应用或给药时施用有效量。治疗化合物的“治疗有效量”(即有效剂量)取决于所选的治疗化合物。可以从每天一次或多次至每周一次或多次来给予组合物。技术人员将理解,某些因素可以影响有效治疗受试者所需的剂量和时程,包括但不限于疾病或障碍的严重性、先前的治疗、受试者的一般健康状况和/或年龄,以及存在的其他疾病。此外,用治疗有效量的在此描述的治疗化合物对受试者进行的治疗可以包括单一治疗或一系列治疗。
术语“核酸”或“多核苷酸”是指单链或双链形式的脱氧核糖核酸(DNA)或核糖核酸(RNA)及其聚合物。术语“核酸组”可以例如包括编码抗体的轻链和重链或双特异性或多特异性抗体的结构域的分开的分离的核酸。除非特别限定,否则该术语涵盖含有已知的天然核苷酸类似物的核酸,这些核酸具有与参考核酸类似的结合特性并且以与天然存在的核苷酸类似的方式进行代谢。除非另外指出,否则特定的核酸序列还隐含地涵盖其保守修饰的变体(例如,简并密码子取代)、等位基因、直向同源物、SNP和互补序列以及明确指明的序列。具体地,简并密码子取代可以通过产生如下序列而获得,在这些序列中,一个或多个所选的(或全部)密码子的第三位被混合碱基和/或脱氧肌苷残基取代(Batzer等人,NucleicAcid Res.[核酸研究]19:5081(1991);Ohtsuka等人,J.Biol.Chem.[生物化学杂志]260:2605-2608(1985);和Rossolini等人,Mol.Cell.Probes[分子与细胞探针]8:91-98(1994))。
术语“肽”、“多肽”和“蛋白质”可互换使用,并且是指包含由肽键共价连接地氨基酸残基的化合物。蛋白质或肽必须含有至少两个氨基酸,并且对可构成蛋白质或肽序列的氨基酸的最大数量没有限制。多肽包括包含由肽键彼此相连的两个或更多个氨基酸的任何肽或蛋白质。如本文所用,该术语是指短链,例如其在本领域中通常也称为肽、寡肽和寡聚体,并且还是指较长的链,其在本领域中通常称为蛋白质,存在有很多类型的蛋白质。“多肽”包括例如生物活性片段、基本上同源的多肽、寡肽、同源二聚体、异源二聚体、多肽的变体、经修饰的多肽、衍生物、类似物、融合蛋白等。多肽包括天然肽、重组肽或其组合。
术语“保守序列修饰”是指不显著影响或改变含有氨基酸序列的抗体或抗体片段的结合特征的氨基酸修饰。此类保守修饰包括氨基酸取代、添加和缺失。可以通过本领域已知的标准技术(如定点诱变和PCR介导的诱变)将修饰引入本发明的抗体或抗体片段中。保守氨基酸取代是其中氨基酸残基被具有类似侧链的氨基酸残基置换的取代。具有相似侧链的氨基酸残基的家族已在本领域中进行了定义。这些家族包括具有碱性侧链(例如赖氨酸、精氨酸、组氨酸)、酸性侧链(例如天冬氨酸、谷氨酸)、不带电荷的极性侧链(例如甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸、色氨酸)、非极性侧链(例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸)、β分支侧链(例如苏氨酸、缬氨酸、异亮氨酸)以及芳香族侧链(例如酪氨酸、苯丙氨酸、色氨酸、组氨酸)的氨基酸。
术语“同源的”或“同一性”是指两个聚合分子之间,例如两个核酸分子(如两个DNA分子或两个RNA分子)之间或两个多肽分子之间的亚基序列同一性。当这两个分子中的亚基位置被相同的单体亚基占据时;例如,如果两个DNA分子中的每一个中的位置被腺嘌呤占据,则它们在该位置是同源的或相同的。两个序列之间的同源性是匹配位置或同源位置的数量的直接函数;例如,如果两个序列中一半的位置(例如,长度为十个亚基的聚合物中的五个位置)是同源的,则这两个序列是50%同源的;如果90%的位置(例如,10个中的9个)是匹配的或同源的,则这两个序列是90%同源的。“序列同一性”的百分比可以通过在比较窗口上比较两个最佳比对的序列来确定,其中该比较窗口中的氨基酸序列的片段与用于这两个序列的最佳比对的参考序列(其不包含添加或缺失)相比可以包含添加或缺失(例如,缺口或突出)。可以通过以下方法计算该百分比:测定在这两个序列中出现相同氨基酸残基的位置的数目以产生匹配位置数,将该匹配位置数除以该比较窗口中的位置总数,并将结果乘以100,从而得到序列同一性百分比。输出是主题序列关于查询序列的百分比同一性。
术语“分离的”意指从天然状态改变的或去除的。例如,天然存在于活体动物中的核酸或肽不是“分离的”,但是与其天然状态的共存材料部分或完全分开的相同核酸或肽是“分离的”。分离的核酸或蛋白质能以基本上纯化的形式存在,或者可以存在于非天然环境(例如像,宿主细胞)中。“分离的抗体”基本上不含具有不同抗原特异性的其他抗体(例如,特异性结合ENTPD2的分离的抗体基本上不含特异性结合除ENTPD2以外的抗原的抗体)。然而,特异性结合靶分子的分离的抗体可以与来自其他物种的相同抗原具有交叉反应性,例如,特异性结合ENTPD2的分离的抗体可以结合来自其他物种的ENTPD2分子。此外,分离的抗体可以基本上不含其他细胞物质和/或化学品。
除非另外定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的相同含义。尽管可以使用与本文所述那些方法和材料类似或等同的方法和材料来实践本发明,但是下面描述了合适的方法和材料。本文所提到的所有出版物、专利申请、专利和其他参考文献均通过引用以其全文并入。在冲突存在的情况下,则以包括定义在内的本说明书为准。此外,材料、方法和实施例仅是说明性的而不旨在限制。
本发明的一个或多个实施例的细节陈述于附图和下文的描述中。根据说明书和附图并且根据权利要求书,本发明的其他特征、目标和优点将是显而易见的。
与人ENTPD2特异性结合的抗体和抗原结合片段
在一方面,本文提供了,特异性结合ENTPD2蛋白的抗体或其抗原结合片段,例如单克隆抗体或其抗原结合片段(“ENTPD2抗体或抗原结合片段”或“抗ENTPD2抗体或抗原结合片段”)。在一些实施例中,本文提供了特异性结合人ENTPD2蛋白的抗体或其抗原结合片段,例如,单克隆抗体或其抗原结合片段(“人ENTPD2抗体或抗原结合片段”或“抗人ENTPD2抗体或抗原结合片段”)。
在一些实施例中,本文提供的抗ENTPD2抗体或其抗原结合片段(例如,抗人ENTPD2抗体或抗原结合片段)包括重链CDR1(HCDR1)、重链CDR2(HCDR2)、重链CDR3(HCDR3)和轻链CDR1(LCDR1)、轻链CDR2(LCDR2)和轻链CDR3(LCDR3)。在一些实施例中,本文提供的抗ENTPD2抗体或抗原结合片段(例如,抗人ENTPD2抗体或抗原结合片段)包括包含CDR1、CDR2和CDR3的重链可变区(VH)和包含CDR1、CDR2和CDR3的轻链可变区(VL)。在一些实施例中,本文提供的抗ENTPD2抗体或抗原结合片段(例如,抗人ENTPD2抗体或抗原结合片段)包括全长重链序列(HC)和全长轻链序列(LC)。
表1列出了特异性结合人ENTPD2蛋白的ENTPD2抗体或抗原结合片段的示例性序列。
表1.与人类ENTPD2结合的示例性单克隆抗体(MAB)和抗体片段(FAB)的序列
在一些实施例中,抗人ENTPD2抗体或抗体片段(例如,抗原结合片段)包含具有表1中所述的任何VH结构域的氨基酸序列的VH结构域。其他合适的抗人ENTPD2抗体或抗体片段(例如抗原结合片段)可包括如下氨基酸,所述氨基酸已经突变但在VH结构域中与表1中描述的序列中描绘的VH区具有至少80%、85%、90%、95%、96%、97%、98%或99%一致性。在某些实施例中,本公开还提供了特异性结合人ENTPD2的抗体或抗体片段(例如,抗原结合片段),其中这些抗体或抗体片段(例如,抗原结合片段)包含具有表1中列出的任一VH CDR的氨基酸序列的VH CDR。在具体实施例中,本发明提供了特异性结合人ENTPD2的抗体或抗体片段(例如,抗原结合片段),这些抗体或抗体片段包含一个、两个、三个、四个、五个或更多个具有表1中列出的任一VH CDR的氨基酸序列的VH CDR(或任选地,由其组成)。
在一些实施例中,抗人ENTPD2抗体或抗体片段(例如,抗原结合片段)包含具有表1中所述的任何VL结构域的氨基酸序列的VL结构域。其他合适的抗人ENTPD2抗体或抗体片段(例如抗原结合片段)可包括如下氨基酸,所述氨基酸已经突变但在VL结构域中与表1中描述的序列中描绘的VL区具有至少80%、85%、90%、95%、96%、97%、98%或99%一致性。本公开还提供了特异性结合人ENTPD2的抗体或抗体片段(例如,抗原结合片段),这些抗体或抗体片段(例如,抗原结合片段)包含具有表1中列出的任一VL CDR的氨基酸序列的VL CDR。具体地,本发明提供了特异性结合人ENTPD2的抗体或抗体片段(例如,抗原结合片段),这些抗体或抗体片段包含一个、两个、三个或更多个具有表1中列出的任一VL CDR的氨基酸序列的VL CDR(或任选地,由其组成)。
本文公开的其他抗人ENTPD2抗体或抗体片段(例如抗原结合片段)包括如下氨基酸,所述氨基酸已经突变但在CDR区中与表1中描述的序列中描绘的CDR区具有至少80%、85%、90%、95%、96%、97%、98%或99%一致性。在一些实施例中,其包括突变氨基酸序列,其中当与表1中描述的序列中描绘的CDR区相比时,CDR区中不超过1、2、3、4或5个氨基酸已经突变。
本文还提供了编码特异性结合人ENTPD2(例如表1中的核酸序列)的抗体及其抗原结合片段的VH、VL、全长重链和全长轻链的核酸序列。可优化此类核酸序列以在哺乳动物细胞中表达。
本文公开的其他抗人ENTPD2抗体包括如下那些抗体,其中这些氨基酸或编码这些氨基酸的核酸已经突变但与表1中描述的序列具有至少80%、85%、90%、95%、96%、97%、98%或99%一致性。在一些实施例中,抗体或其抗原结合片段包括突变氨基酸序列,其中当与表1中描述的序列中描绘的可变区相比时,在可变区中不超过1、2、3、4或5个氨基酸已经突变,但同时基本上保持相同的治疗活性。
由于每种提供的抗体与人ENTPD2结合,因此VH、VL、全长轻链和全长重链序列(氨基酸序列和编码该氨基酸序列的核苷酸序列)可以是“混合且匹配的”以产生本文披露的其他ENTPD2结合抗体。可以使用本领域已知的结合测定法(例如,ELISA,实例中描述的测定法)测试这种“混合且匹配的”ENTPD2结合抗体。当链被混合且匹配时,来自特定VH/VL配对的VH序列应当用结构上相似的VH序列替代。来自特定全长重链/全长轻链配对的全长重链序列应当用结构上相似的全长重链序列替代。来自特定VH/VL配对的VL序列应当用结构上相似的VL序列替代。来自特定全长重链/全长轻链配对的全长轻链序列应当用结构上相似的全长轻链序列替代。
因此,在一个实施例中,本发明提供了分离的单克隆抗体或其抗原结合片段,该单克隆抗体或其抗原结合片段具有:包含选自以下中任一项的氨基酸序列的重链可变区(VH):SEQ ID NO:10、25、33、46、70、91、115、132、145、169、225、233、241、250、264、281、328;和包含选自以下中任一项的氨基酸序列的轻链可变区(VL):SEQ ID NO:21、29、57、64、74、78、102、125、156、178、229、237、257、268、287、332;其中该抗体特异性结合人ENTPD2。
在另一个实施例中,本发明提供了(i)分离的单克隆抗体,该单克隆抗体具有:包含选自以下中任一项的氨基酸序列的全长重链(HC):SEQ ID NO:12、27、35、48、72、93、117、134、147、171、227、235、243、252、266、283、330;和包含选自以下中任一项的氨基酸序列的全长轻链(LC):SEQ ID NO:23、31、59、66、76、80、104、127、158、180、231、239、259、270、289、334;或(ii)包含其抗原结合部分的功能性蛋白质。
在另一个实施例中,本公开提供了人ENTPD2结合抗体或其抗体片段,该抗体或其抗体片段包含如表1中所述的重链CDR1、CDR2和CDR3以及轻链CDR1、CDR2和CDR3,或其组合。抗体的VH CDR1的氨基酸序列示于SEQ ID NO:1、4、6、7、37、40、42、43、82、85、87、88、106、109、111、112、136、139、141、142、160、163、165、166、185、187、188、206、207、208、213、214、215、272、275、277。抗体的VH CDR2的氨基酸序列示于SEQ ID NO:2、5、8、38、41、44、83、86、89、107、110、113、129、130、131、137、140、143、161、164、167、186、189、220、222、223、245、247、248、261、273、276、279。抗体的VH CDR3的氨基酸序列示于SEQ ID NO:3、39、68、84、108、138、162、221、246、262、277、274、9、45、69、90、114、144、168、190、224、249、263、274、280。抗体的VL CDR1的氨基酸序列示于SEQ ID NO:14、17、20、50、53、56、61、62、63、95、98、101、119、122、124、149、152、155、173、175、177、198、201、254。抗体的VL CDR2的氨基酸序列示于SEQ ID NO:15、18、51、54、96、99、120、150、153、199、285、286。抗体的VL CDR3的氨基酸序列示于SEQ ID NO:16、19、52、55、97、100、121、123、151、154、174、176、200、255、256。
鉴于这些抗体中的每一种都可以与ENTPD2结合且抗原结合特异性主要由CDR1、CDR2和CDR3区提供,VH CDR1、CDR2和CDR3序列以及VL CDR1、CDR2和CDR3序列可以是“混合且匹配的”(即,来自不同抗体的CDR可以被混合且匹配),但每种抗体必须含有VH CDR1、CDR2和CDR3以及VL CDR1、CDR2和CDR3以产生本文披露的其他ENTPD2结合分子。可以使用本领域已知的结合测定和实例中描述的那些结合测定(例如,ELISA)来测试这种“混合且匹配的”ENTPD2结合抗体。当VH CDR序列混合且匹配时,来自特定VH序列的CDR1、CDR2和/或CDR3序列应该用结构上相似的一个或多个CDR序列替代。同样地,当VL CDR序列混合且匹配时,来自特定VL序列的CDR1、CDR2和/或CDR3序列应该用结构上相似的一个或多个CDR序列替代。对于普通技术人员来说容易清楚的是,可以通过取代来自对于本披露单克隆抗体的本文所示CDR序列的具有结构相似序列的一个或多个VH和/或VL CDR区序列来产生新的VH和VL序列。
因此,本披露提供了包含以下的分离的单克隆抗体或其抗原结合区:重链CDR1,该重链CDR1包含选自下组的氨基酸序列,该组由以下组成:SEQ ID NO:1、4、6、7、37、40、42、43、82、85、87、88、106、109、111、112、136、139、141、142、160、163、165、166、182、187、188、206、207、208、213、214、215、272、275、277;重链CDR2,该重链CDR2包含选自下组的氨基酸序列,该组由以下组成:SEQ ID NO:2、5、8、38、41、44、83、86、89、107、110、113、129、130、131、137、140、143、161、164、167、183、189、220、222、223、245、247、248、261、273、276;重链CDR3,该重链CDR3包含选自下组的氨基酸序列,该组由以下组成:SEQ ID NO:3、39、68、84、108、138、162、221、246、262、277、274、9、45、69、90、114、144、168、190、224、249、263、274、280;轻链CDR1,该轻链CDR1包含选自下组的氨基酸序列,该组由以下组成:SEQ ID NO:14、17、20、50、53、56、61、62、63、95、98、101、119、122、124、149、152、155、173、175、177、195、201、254;轻链CDR2,该轻链CDR2包含选自下组的氨基酸序列,该组由以下组成:SEQ ID NO:15、18、51、54、96、99、120、150、153、196、285、286;和轻链CDR3,该轻链CDR3包含选自下组的氨基酸序列,该组由以下组成:SEQ ID NO:16、19、52、55、97、100、121、123、151、154、174、176、197、255、256;其中该抗体特异性结合人ENTPD2。
在某些实施例中,特异性结合人ENTPD2的抗体是表1中描述的抗体或抗体片段(例如,抗原结合片段)。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:重链互补决定区1(HCDR1),其包含SEQ ID NO:1、4、6或7的氨基酸序列;重链互补决定区2(HCDR2),其包含SEQ ID NO:2、5或8的氨基酸序列;重链互补决定区3(HCDR3),其包含SEQ ID NO:3或9的氨基酸序列;轻链互补决定区1(LCDR1),其包含SEQ ID NO:14、17或20的氨基酸序列;轻链互补决定区2(LCDR2),其包含SEQ ID NO:15或18的氨基酸序列;和轻链互补决定区3(LCDR3),其包含SEQ ID NO:16或19的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:1的氨基酸序列;HCDR2,其包含SEQ ID NO:2的氨基酸序列;HCDR3,其包含SEQID NO:3的氨基酸序列;LCDR1,其包含SEQ ID NO:14的氨基酸序列;LCDR2,其包含SEQ IDNO:15的氨基酸序列;和LCDR3,其包含SEQ ID NO:16的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:4的氨基酸序列;HCDR2,其包含SEQ ID NO:5的氨基酸序列;HCDR3,其包含SEQID NO:3的氨基酸序列;LCDR1,其包含SEQ ID NO:17的氨基酸序列;LCDR2,其包含SEQ IDNO:18的氨基酸序列;和LCDR3,其包含SEQ ID NO:19的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:6的氨基酸序列;HCDR2,其包含SEQ ID NO:2的氨基酸序列;HCDR3,其包含SEQID NO:3的氨基酸序列;LCDR1,其包含SEQ ID NO:14的氨基酸序列;LCDR2,其包含SEQ IDNO:15的氨基酸序列;和LCDR3,其包含SEQ ID NO:16的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:7的氨基酸序列;HCDR2,其包含SEQ ID NO:8的氨基酸序列;HCDR3,其包含SEQID NO:9的氨基酸序列;LCDR1,其包含SEQ ID NO:20的氨基酸序列;LCDR2,其包含SEQ IDNO:18的氨基酸序列;和LCDR3,其包含SEQ ID NO:16的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:37、40、42或43的氨基酸序列;HCDR2,其包含SEQ ID NO:38、41或44的氨基酸序列;HCDR3,其包含SEQ ID NO:39或45的氨基酸序列;LCDR1,其包含SEQ ID NO:50、53或56的氨基酸序列;LCDR2,其包含SEQ ID NO:51或54的氨基酸序列;和LCDR3,其包含SEQ IDNO:52或55的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:37的氨基酸序列;HCDR2,其包含SEQ ID NO:38的氨基酸序列;HCDR3,其包含SEQ ID NO:39的氨基酸序列;LCDR1,其包含SEQ ID NO:50的氨基酸序列;LCDR2,其包含SEQID NO:51的氨基酸序列;和LCDR3,其包含SEQ ID NO:52的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:40的氨基酸序列;HCDR2,其包含SEQ ID NO:41的氨基酸序列;HCDR3,其包含SEQ ID NO:39的氨基酸序列;LCDR1,其包含SEQ ID NO:53的氨基酸序列;LCDR2,其包含SEQID NO:54的氨基酸序列;和LCDR3,其包含SEQ ID NO:55的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:42的氨基酸序列;HCDR2,其包含SEQ ID NO:38的氨基酸序列;HCDR3,其包含SEQ ID NO:39的氨基酸序列;LCDR1,其包含SEQ ID NO:50的氨基酸序列;LCDR2,其包含SEQID NO:51的氨基酸序列;和LCDR3,其包含SEQ ID NO:52的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:43的氨基酸序列;HCDR2,其包含SEQ ID NO:44的氨基酸序列;HCDR3,其包含SEQ ID NO:45的氨基酸序列;LCDR1,其包含SEQ ID NO:56的氨基酸序列;LCDR2,其包含SEQID NO:54的氨基酸序列;和LCDR3,其包含SEQ ID NO:52的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:37、40、42或43的氨基酸序列;HCDR2,其包含SEQ ID NO:38、41或44的氨基酸序列;HCDR3,其包含SEQ ID NO:39或45的氨基酸序列;LCDR1,其包含SEQ ID NO:61、62或63的氨基酸序列;LCDR2,其包含SEQ ID NO:51或54的氨基酸序列;和LCDR3,其包含SEQ IDNO:52或55的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:37的氨基酸序列;HCDR2,其包含SEQ ID NO:38的氨基酸序列;HCDR3,其包含SEQ ID NO:39的氨基酸序列;LCDR1,其包含SEQ ID NO:61的氨基酸序列;LCDR2,其包含SEQID NO:51的氨基酸序列;和LCDR3,其包含SEQ ID NO:52的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:40的氨基酸序列;HCDR2,其包含SEQ ID NO:41的氨基酸序列;HCDR3,其包含SEQ ID NO:39的氨基酸序列;LCDR1,其包含SEQ ID NO:62的氨基酸序列;LCDR2,其包含SEQID NO:54的氨基酸序列;和LCDR3,其包含SEQ ID NO:55的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:42的氨基酸序列;HCDR2,其包含SEQ ID NO:38的氨基酸序列;HCDR3,其包含SEQ ID NO:39的氨基酸序列;LCDR1,其包含SEQ ID NO:61的氨基酸序列;LCDR2,其包含SEQID NO:51的氨基酸序列;和LCDR3,其包含SEQ ID NO:52的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:43的氨基酸序列;HCDR2,其包含SEQ ID NO:44的氨基酸序列;HCDR3,其包含SEQ ID NO:45的氨基酸序列;LCDR1,其包含SEQ ID NO:63的氨基酸序列;LCDR2,其包含SEQID NO:54的氨基酸序列;和LCDR3,其包含SEQ ID NO:52的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:37、40、42或43的氨基酸序列;HCDR2,其包含SEQ ID NO:38、41或44的氨基酸序列;HCDR3,其包含SEQ ID NO:68或69的氨基酸序列;LCDR1,其包含SEQ ID NO:50、53或56的氨基酸序列;LCDR2,其包含SEQ ID NO:51或54的氨基酸序列;和LCDR3,其包含SEQ IDNO:52或55的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:37的氨基酸序列;HCDR2,其包含SEQ ID NO:38的氨基酸序列;HCDR3,其包含SEQ ID NO:68的氨基酸序列;LCDR1,其包含SEQ ID NO:50的氨基酸序列;LCDR2,其包含SEQID NO:51的氨基酸序列;和LCDR3,其包含SEQ ID NO:52的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:40的氨基酸序列;HCDR2,其包含SEQ ID NO:41的氨基酸序列;HCDR3,其包含SEQ ID NO:68的氨基酸序列;LCDR1,其包含SEQ ID NO:53的氨基酸序列;LCDR2,其包含SEQID NO:54的氨基酸序列;和LCDR3,其包含SEQ ID NO:55的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:42的氨基酸序列;HCDR2,其包含SEQ ID NO:38的氨基酸序列;HCDR3,其包含SEQ ID NO:68的氨基酸序列;LCDR1,其包含SEQ ID NO:50的氨基酸序列;LCDR2,其包含SEQID NO:51的氨基酸序列;和LCDR3,其包含SEQ ID NO:52的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:43的氨基酸序列;HCDR2,其包含SEQ ID NO:44的氨基酸序列;HCDR3,其包含SEQ ID NO:69的氨基酸序列;LCDR1,其包含SEQ ID NO:56的氨基酸序列;LCDR2,其包含SEQID NO:54的氨基酸序列;和LCDR3,其包含SEQ ID NO:52的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:82、85、87或88的氨基酸序列;HCDR2,其包含SEQ ID NO:83、86或89的氨基酸序列;HCDR3,其包含SEQ ID NO:84或90的氨基酸序列;LCDR1,其包含SEQ ID NO:95、98或101的氨基酸序列;LCDR2,其包含SEQ ID NO:96或99的氨基酸序列;和LCDR3,其包含SEQ IDNO:97或100的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:82的氨基酸序列;HCDR2,其包含SEQ ID NO:83的氨基酸序列;HCDR3,其包含SEQ ID NO:84的氨基酸序列;LCDR1,其包含SEQ ID NO:95的氨基酸序列;LCDR2,其包含SEQID NO:96的氨基酸序列;和LCDR3,其包含SEQ ID NO:97的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:85的氨基酸序列;HCDR2,其包含SEQ ID NO:86的氨基酸序列;HCDR3,其包含SEQ ID NO:84的氨基酸序列;LCDR1,其包含SEQ ID NO:98的氨基酸序列;LCDR2,其包含SEQID NO:99的氨基酸序列;和LCDR3,其包含SEQ ID NO:100的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:87的氨基酸序列;HCDR2,其包含SEQ ID NO:83的氨基酸序列;HCDR3,其包含SEQ ID NO:84的氨基酸序列;LCDR1,其包含SEQ ID NO:95的氨基酸序列;LCDR2,其包含SEQID NO:96的氨基酸序列;和LCDR3,其包含SEQ ID NO:97的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:88的氨基酸序列;HCDR2,其包含SEQ ID NO:89的氨基酸序列;HCDR3,其包含SEQ ID NO:90的氨基酸序列;LCDR1,其包含SEQ ID NO:101的氨基酸序列;LCDR2,其包含SEQ ID NO:99的氨基酸序列;和LCDR3,其包含SEQ ID NO:97的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:106、109、111或112的氨基酸序列;HCDR2,其包含SEQ ID NO:107、110或113的氨基酸序列;HCDR3,其包含SEQ ID NO:108或114的氨基酸序列;LCDR1,其包含SEQ ID NO:119、122或124的氨基酸序列;LCDR2,其包含SEQ ID NO:99或120的氨基酸序列;和LCDR3,其包含SEQ ID NO:121或123的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:106的氨基酸序列;HCDR2,其包含SEQ ID NO:107的氨基酸序列;HCDR3,其包含SEQ ID NO:108的氨基酸序列;LCDR1,其包含SEQ ID NO:119的氨基酸序列;LCDR2,其包含SEQ ID NO:120的氨基酸序列;和LCDR3,其包含SEQ ID NO:121的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:109的氨基酸序列;HCDR2,其包含SEQ ID NO:110的氨基酸序列;HCDR3,其包含SEQ ID NO:108的氨基酸序列;LCDR1,其包含SEQ ID NO:122的氨基酸序列;LCDR2,其包含SEQ ID NO:99的氨基酸序列;和LCDR3,其包含SEQ ID NO:123的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:111的氨基酸序列;HCDR2,其包含SEQ ID NO:107的氨基酸序列;HCDR3,其包含SEQ ID NO:119的氨基酸序列;LCDR1,其包含SEQ ID NO:120的氨基酸序列;LCDR2,其包含SEQ ID NO:121的氨基酸序列;和LCDR3,其包含SEQ ID NO:108的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:112的氨基酸序列;HCDR2,其包含SEQ ID NO:113的氨基酸序列;HCDR3,其包含SEQ ID NO:114的氨基酸序列;LCDR1,其包含SEQ ID NO:124的氨基酸序列;LCDR2,其包含SEQ ID NO:99的氨基酸序列;和LCDR3,其包含SEQ ID NO:121的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:106、109、111或112的氨基酸序列;HCDR2,其包含SEQ ID NO:129、130或131的氨基酸序列;HCDR3,其包含SEQ ID NO:108或114的氨基酸序列;LCDR1,其包含SEQ ID NO:119、122或124的氨基酸序列;LCDR2,其包含SEQ ID NO:99或120的氨基酸序列;和LCDR3,其包含SEQ ID NO:121或123的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:106的氨基酸序列;HCDR2,其包含SEQ ID NO:129的氨基酸序列;HCDR3,其包含SEQ ID NO:108的氨基酸序列;LCDR1,其包含SEQ ID NO:119的氨基酸序列;LCDR2,其包含SEQ ID NO:120的氨基酸序列;和LCDR3,其包含SEQ ID NO:121的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:109的氨基酸序列;HCDR2,其包含SEQ ID NO:130的氨基酸序列;HCDR3,其包含SEQ ID NO:108的氨基酸序列;LCDR1,其包含SEQ ID NO:122的氨基酸序列;LCDR2,其包含SEQ ID NO:99的氨基酸序列;和LCDR3,其包含SEQ ID NO:123的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:111的氨基酸序列;HCDR2,其包含SEQ ID NO:129的氨基酸序列;HCDR3,其包含SEQ ID NO:108的氨基酸序列;LCDR1,其包含SEQ ID NO:119的氨基酸序列;LCDR2,其包含SEQ ID NO:120的氨基酸序列;和LCDR3,其包含SEQ ID NO:121的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:112的氨基酸序列;HCDR2,其包含SEQ ID NO:131的氨基酸序列;HCDR3,其包含SEQ ID NO:114的氨基酸序列;LCDR1,其包含SEQ ID NO:124的氨基酸序列;LCDR2,其包含SEQ ID NO:99的氨基酸序列;和LCDR3,其包含SEQ ID NO:121的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:136、139、141或142的氨基酸序列;HCDR2,其包含SEQ ID NO:137、140或143的氨基酸序列;HCDR3,其包含SEQ ID NO:138或144的氨基酸序列;LCDR1,其包含SEQ ID NO:149、152或155的氨基酸序列;LCDR2,其包含SEQ ID NO:150或153的氨基酸序列;和LCDR3,其包含SEQ ID NO:151或154的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:136的氨基酸序列;HCDR2,其包含SEQ ID NO:137的氨基酸序列;HCDR3,其包含SEQ ID NO:138的氨基酸序列;LCDR1,其包含SEQ ID NO:149的氨基酸序列;LCDR2,其包含SEQ ID NO:150的氨基酸序列;和LCDR3,其包含SEQ ID NO:151的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:139的氨基酸序列;HCDR2,其包含SEQ ID NO:140的氨基酸序列;HCDR3,其包含SEQ ID NO:138的氨基酸序列;LCDR1,其包含SEQ ID NO:152的氨基酸序列;LCDR2,其包含SEQ ID NO:153的氨基酸序列;和LCDR3,其包含SEQ ID NO:154的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:141的氨基酸序列;HCDR2,其包含SEQ ID NO:137的氨基酸序列;HCDR3,其包含SEQ ID NO:138的氨基酸序列;LCDR1,其包含SEQ ID NO:149的氨基酸序列;LCDR2,其包含SEQ ID NO:150的氨基酸序列;和LCDR3,其包含SEQ ID NO:151的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:142的氨基酸序列;HCDR2,其包含SEQ ID NO:143的氨基酸序列;HCDR3,其包含SEQ ID NO:144的氨基酸序列;LCDR1,其包含SEQ ID NO:155的氨基酸序列;LCDR2,其包含SEQ ID NO:153的氨基酸序列;和LCDR3,其包含SEQ ID NO:151的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:160、163、165或166的氨基酸序列;HCDR2,其包含SEQ ID NO:161、164或167的氨基酸序列;HCDR3,其包含SEQ ID NO:162或168的氨基酸序列;LCDR1,其包含SEQ ID NO:173、175或177的氨基酸序列;LCDR2,其包含SEQ ID NO:150或153的氨基酸序列;和LCDR3,其包含SEQ ID NO:174或176的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:160的氨基酸序列;HCDR2,其包含SEQ ID NO:161的氨基酸序列;HCDR3,其包含SEQ ID NO:162的氨基酸序列;LCDR1,其包含SEQ ID NO:173的氨基酸序列;LCDR2,其包含SEQ ID NO:150的氨基酸序列;和LCDR3,其包含SEQ ID NO:174的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:163的氨基酸序列;HCDR2,其包含SEQ ID NO:164的氨基酸序列;HCDR3,其包含SEQ ID NO:162的氨基酸序列;LCDR1,其包含SEQ ID NO:175的氨基酸序列;LCDR2,其包含SEQ ID NO:153的氨基酸序列;和LCDR3,其包含SEQ ID NO:176的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:165的氨基酸序列;HCDR2,其包含SEQ ID NO:161的氨基酸序列;HCDR3,其包含SEQ ID NO:162的氨基酸序列;LCDR1,其包含SEQ ID NO:173的氨基酸序列;LCDR2,其包含SEQ ID NO:150的氨基酸序列;和LCDR3,其包含SEQ ID NO:174的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:166的氨基酸序列;HCDR2,其包含SEQ ID NO:167的氨基酸序列;HCDR3,其包含SEQ ID NO:168的氨基酸序列;LCDR1,其包含SEQ ID NO:177的氨基酸序列;LCDR2,其包含SEQ ID NO:153的氨基酸序列;和LCDR3,其包含SEQ ID NO:174的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:37、40、42或43的氨基酸序列;HCDR2,其包含SEQ ID NO:220、222或223的氨基酸序列;HCDR3,其包含SEQ ID NO:221或224的氨基酸序列;LCDR1,其包含SEQ ID NO:61、62或63的氨基酸序列;LCDR2,其包含SEQ ID NO:51或54的氨基酸序列;和LCDR3,其包含SEQID NO:52或55的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:37的氨基酸序列;HCDR2,其包含SEQ ID NO:220的氨基酸序列;HCDR3,其包含SEQ ID NO:221的氨基酸序列;LCDR1,其包含SEQ ID NO:61的氨基酸序列;LCDR2,其包含SEQ ID NO:51的氨基酸序列;和LCDR3,其包含SEQ ID NO:52的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:40的氨基酸序列;HCDR2,其包含SEQ ID NO:222的氨基酸序列;HCDR3,其包含SEQ ID NO:221的氨基酸序列;LCDR1,其包含SEQ ID NO:62的氨基酸序列;LCDR2,其包含SEQ ID NO:54的氨基酸序列;和LCDR3,其包含SEQ ID NO:55的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:42的氨基酸序列;HCDR2,其包含SEQ ID NO:220的氨基酸序列;HCDR3,其包含SEQ ID NO:221的氨基酸序列;LCDR1,其包含SEQ ID NO:61的氨基酸序列;LCDR2,其包含SEQ ID NO:51的氨基酸序列;和LCDR3,其包含SEQ ID NO:52的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:43的氨基酸序列;HCDR2,其包含SEQ ID NO:223的氨基酸序列;HCDR3,其包含SEQ ID NO:224的氨基酸序列;LCDR1,其包含SEQ ID NO:63的氨基酸序列;LCDR2,其包含SEQ ID NO:54的氨基酸序列;和LCDR3,其包含SEQ ID NO:52的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:37、40、42或43的氨基酸序列;HCDR2,其包含SEQ ID NO:220、222或223的氨基酸序列;HCDR3,其包含SEQ ID NO:68或69的氨基酸序列;LCDR1,其包含SEQ ID NO:61、62或63的氨基酸序列;LCDR2,其包含SEQ ID NO:51或54的氨基酸序列;和LCDR3,其包含SEQ IDNO:52或55的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:37的氨基酸序列;HCDR2,其包含SEQ ID NO:220的氨基酸序列;HCDR3,其包含SEQ ID NO:68的氨基酸序列;LCDR1,其包含SEQ ID NO:61的氨基酸序列;LCDR2,其包含SEQID NO:51的氨基酸序列;和LCDR3,其包含SEQ ID NO:52的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:40的氨基酸序列;HCDR2,其包含SEQ ID NO:222的氨基酸序列;HCDR3,其包含SEQ ID NO:68的氨基酸序列;LCDR1,其包含SEQ ID NO:62的氨基酸序列;LCDR2,其包含SEQID NO:54的氨基酸序列;和LCDR3,其包含SEQ ID NO:55的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:42的氨基酸序列;HCDR2,其包含SEQ ID NO:220的氨基酸序列;HCDR3,其包含SEQ ID NO:68的氨基酸序列;LCDR1,其包含SEQ ID NO:61的氨基酸序列;LCDR2,其包含SEQID NO:51的氨基酸序列;和LCDR3,其包含SEQ ID NO:52的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:43的氨基酸序列;HCDR2,其包含SEQ ID NO:223的氨基酸序列;HCDR3,其包含SEQ ID NO:69的氨基酸序列;LCDR1,其包含SEQ ID NO:63的氨基酸序列;LCDR2,其包含SEQID NO:54的氨基酸序列;和LCDR3,其包含SEQ ID NO:52的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:1、4、6或7的氨基酸序列;HCDR2,其包含SEQ ID NO:245、247或248的氨基酸序列;HCDR3,其包含SEQ ID NO:246或249的氨基酸序列;LCDR1,其包含SEQ ID NO:17、20或254的氨基酸序列;LCDR2,其包含SEQ ID NO:15或18的氨基酸序列;和LCDR3,其包含SEQ IDNO:255或256的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:1的氨基酸序列;HCDR2,其包含SEQ ID NO:245的氨基酸序列;HCDR3,其包含SEQ ID NO:246的氨基酸序列;LCDR1,其包含SEQ ID NO:254的氨基酸序列;LCDR2,其包含SEQ ID NO:15的氨基酸序列;和LCDR3,其包含SEQ ID NO:255的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:4的氨基酸序列;HCDR2,其包含SEQ ID NO:247的氨基酸序列;HCDR3,其包含SEQ ID NO:246的氨基酸序列;LCDR1,其包含SEQ ID NO:17的氨基酸序列;LCDR2,其包含SEQ ID NO:18的氨基酸序列;和LCDR3,其包含SEQ ID NO:256的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:6的氨基酸序列;HCDR2,其包含SEQ ID NO:254的氨基酸序列;HCDR3,其包含SEQ ID NO:246的氨基酸序列;LCDR1,其包含SEQ ID NO:254的氨基酸序列;LCDR2,其包含SEQ ID NO:15的氨基酸序列;和LCDR3,其包含SEQ ID NO:255的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:7的氨基酸序列;HCDR2,其包含SEQ ID NO:248的氨基酸序列;HCDR3,其包含SEQ ID NO:249的氨基酸序列;LCDR1,其包含SEQ ID NO:20的氨基酸序列;LCDR2,其包含SEQ ID NO:18的氨基酸序列;和LCDR3,其包含SEQ ID NO:255的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:1、4、6或7的氨基酸序列;HCDR2,其包含SEQ ID NO:247、248或261的氨基酸序列;HCDR3,其包含SEQ ID NO:262或263的氨基酸序列;LCDR1,其包含SEQ ID NO:17、20或254的氨基酸序列;LCDR2,其包含SEQ ID NO:15或18的氨基酸序列;和LCDR3,其包含SEQ IDNO:16或19的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:1的氨基酸序列;HCDR2,其包含SEQ ID NO:261的氨基酸序列;HCDR3,其包含SEQ ID NO:262的氨基酸序列;LCDR1,其包含SEQ ID NO:254的氨基酸序列;LCDR2,其包含SEQ ID NO:15的氨基酸序列;和LCDR3,其包含SEQ ID NO:16的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:4的氨基酸序列;HCDR2,其包含SEQ ID NO:247的氨基酸序列;HCDR3,其包含SEQ ID NO:262的氨基酸序列;LCDR1,其包含SEQ ID NO:17的氨基酸序列;LCDR2,其包含SEQ ID NO:18的氨基酸序列;和LCDR3,其包含SEQ ID NO:19的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:6的氨基酸序列;HCDR2,其包含SEQ ID NO:261的氨基酸序列;HCDR3,其包含SEQ ID NO:262的氨基酸序列;LCDR1,其包含SEQ ID NO:254的氨基酸序列;LCDR2,其包含SEQ ID NO:15的氨基酸序列;和LCDR3,其包含SEQ ID NO:16的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:7的氨基酸序列;HCDR2,其包含SEQ ID NO:248的氨基酸序列;HCDR3,其包含SEQ ID NO:263的氨基酸序列;LCDR1,其包含SEQ ID NO:20的氨基酸序列;LCDR2,其包含SEQ ID NO:18的氨基酸序列;和LCDR3,其包含SEQ ID NO:16的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:272、275或278的氨基酸序列;HCDR2,其包含SEQ ID NO:273、276或279的氨基酸序列;HCDR3,其包含SEQ ID NO:274、277或280的氨基酸序列;LCDR1,其包含SEQ ID NO:17、20或254的氨基酸序列;LCDR2,其包含SEQ ID NO:285或286的氨基酸序列;和LCDR3,其包含SEQ ID NO:16或19的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:272的氨基酸序列;HCDR2,其包含SEQ ID NO:273的氨基酸序列;HCDR3,其包含SEQ ID NO:274的氨基酸序列;LCDR1,其包含SEQ ID NO:254的氨基酸序列;LCDR2,其包含SEQ ID NO:285的氨基酸序列;和LCDR3,其包含SEQ ID NO:16的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:275的氨基酸序列;HCDR2,其包含SEQ ID NO:276的氨基酸序列;HCDR3,其包含SEQ ID NO:274的氨基酸序列;LCDR1,其包含SEQ ID NO:17的氨基酸序列;LCDR2,其包含SEQ ID NO:286的氨基酸序列;和LCDR3,其包含SEQ ID NO:19的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:277的氨基酸序列;HCDR2,其包含SEQ ID NO:273的氨基酸序列;HCDR3,其包含SEQ ID NO:274的氨基酸序列;LCDR1,其包含SEQ ID NO:254的氨基酸序列;LCDR2,其包含SEQ ID NO:285的氨基酸序列;和LCDR3,其包含SEQ ID NO:16的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:HCDR1,其包含SEQ ID NO:278的氨基酸序列;HCDR2,其包含SEQ ID NO:279的氨基酸序列;HCDR3,其包含SEQ ID NO:280的氨基酸序列;LCDR1,其包含SEQ ID NO:20的氨基酸序列;LCDR2,其包含SEQ ID NO:286的氨基酸序列;和LCDR3,其包含SEQ ID NO:16的氨基酸序列。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:重链可变区(VH),该重链可变区(VH)包含SEQ ID NO:10的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)和轻链可变区(VL),该轻链可变区(VL)包含SEQ ID NO:21的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:重链可变区(VH),该重链可变区(VH)包含SEQ ID NO:25的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)和轻链可变区(VL),该轻链可变区(VL)包含SEQ ID NO:29的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:重链可变区(VH),该重链可变区(VH)包含SEQ ID NO:33的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)和轻链可变区(VL),该轻链可变区(VL)包含SEQ ID NO:29的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:重链可变区(VH),该重链可变区(VH)包含SEQ ID NO:46的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)和轻链可变区(VL),该轻链可变区(VL)包含SEQ ID NO:57的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:重链可变区(VH),该重链可变区(VH)包含SEQ ID NO:46的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)和轻链可变区(VL),该轻链可变区(VL)包含SEQ ID NO:64的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:重链可变区(VH),该重链可变区(VH)包含SEQ ID NO:70的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)和轻链可变区(VL),该轻链可变区(VL)包含SEQ ID NO:74的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:重链可变区(VH),该重链可变区(VH)包含SEQ ID NO:25的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)和轻链可变区(VL),该轻链可变区(VL)包含SEQ ID NO:78的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:重链可变区(VH),该重链可变区(VH)包含SEQ ID NO:91的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)和轻链可变区(VL),该轻链可变区(VL)包含SEQ ID NO:102的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:重链可变区(VH),该重链可变区(VH)包含SEQ ID NO:115的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)和轻链可变区(VL),该轻链可变区(VL)包含SEQ ID NO:125的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:重链可变区(VH),该重链可变区(VH)包含SEQ ID NO:132的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)和轻链可变区(VL),该轻链可变区(VL)包含SEQ ID NO:125的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:重链可变区(VH),该重链可变区(VH)包含SEQ ID NO:145的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)和轻链可变区(VL),该轻链可变区(VL)包含SEQ ID NO:156的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:重链可变区(VH),该重链可变区(VH)包含SEQ ID NO:169的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)和轻链可变区(VL),该轻链可变区(VL)包含SEQ ID NO:178的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:重链可变区(VH),该重链可变区(VH)包含SEQ ID NO:225的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)和轻链可变区(VL),该轻链可变区(VL)包含SEQ ID NO:229的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:重链可变区(VH),该重链可变区(VH)包含SEQ ID NO:233的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)和轻链可变区(VL),该轻链可变区(VL)包含SEQ ID NO:237的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:重链可变区(VH),该重链可变区(VH)包含SEQ ID NO:241的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)和轻链可变区(VL),该轻链可变区(VL)包含SEQ ID NO:229的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:重链可变区(VH),该重链可变区(VH)包含SEQ ID NO:250的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)和轻链可变区(VL),该轻链可变区(VL)包含SEQ ID NO:257的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:重链可变区(VH),该重链可变区(VH)包含SEQ ID NO:264的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)和轻链可变区(VL),该轻链可变区(VL)包含SEQ ID NO:268的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)。
在一些实施例中,特异性结合人ENTPD2的抗体或其抗原结合区包含:重链可变区(VH),该重链可变区(VH)包含SEQ ID NO:281的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)和轻链可变区(VL),该轻链可变区(VL)包含SEQ ID NO:287的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)。
在一些实施例中,特异性结合人ENTPD2的抗体包含:重链,该重链包含SEQ ID NO:12的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)和轻链,该轻链包含SEQ ID NO:23的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)。
在一些实施例中,特异性结合人ENTPD2的抗体包含:重链,该重链包含SEQ ID NO:27的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)和轻链,该轻链包含SEQ ID NO:31的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)。
在一些实施例中,特异性结合人ENTPD2的抗体包含:重链,该重链包含SEQ ID NO:35的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)和轻链,该轻链包含SEQ ID NO:31的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)。
在一些实施例中,特异性结合人ENTPD2的抗体包含:重链,该重链包含SEQ ID NO:48的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)和轻链,该轻链包含SEQ ID NO:59的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)。
在一些实施例中,特异性结合人ENTPD2的抗体包含:重链,该重链包含SEQ ID NO:48的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)和轻链,该轻链包含SEQ ID NO:66的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)。
在一些实施例中,特异性结合人ENTPD2的抗体包含:重链,该重链包含SEQ ID NO:72的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)和轻链,该轻链包含SEQ ID NO:76的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)。
在一些实施例中,特异性结合人ENTPD2的抗体包含:重链,该重链包含SEQ ID NO:27的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)和轻链,该轻链包含SEQ ID NO:80的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)。
在一些实施例中,特异性结合人ENTPD2的抗体包含:重链,该重链包含SEQ ID NO:93的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)和轻链,该轻链包含SEQ ID NO:104的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)。
在一些实施例中,特异性结合人ENTPD2的抗体包含:重链,该重链包含SEQ ID NO:117的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)和轻链,该轻链包含SEQ ID NO:127的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)。
在一些实施例中,特异性结合人ENTPD2的抗体包含:重链,该重链包含SEQ ID NO:134的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)和轻链,该轻链包含SEQ ID NO:127的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)。
在一些实施例中,特异性结合人ENTPD2的抗体包含:重链,该重链包含SEQ ID NO:147的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)和轻链,该轻链包含SEQ ID NO:158的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)。
在一些实施例中,特异性结合人ENTPD2的抗体包含:重链,该重链包含SEQ ID NO:171的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)和轻链,该轻链包含SEQ ID NO:180(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)。
在一些实施例中,特异性结合人ENTPD2的抗体包含:重链,该重链包含SEQ ID NO:227的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)和轻链,该轻链包含SEQ ID NO:231的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)。
在一些实施例中,特异性结合人ENTPD2的抗体包含:重链,该重链包含SEQ ID NO:235的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)和轻链,该轻链包含SEQ ID NO:239的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)。
在一些实施例中,特异性结合人ENTPD2的抗体包含:重链,该重链包含SEQ ID NO:243的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)和轻链,该轻链包含SEQ ID NO:231的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)。
在一些实施例中,特异性结合人ENTPD2的抗体包含:重链,该重链包含SEQ ID NO:252的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)和轻链,该轻链包含SEQ ID NO:259的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)。
在一些实施例中,特异性结合人ENTPD2的抗体包含:重链,该重链包含SEQ ID NO:266的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)和轻链,该轻链包含SEQ ID NO:270的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)。
在一些实施例中,特异性结合人ENTPD2的抗体包含:重链,该重链包含SEQ ID NO:283的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)和轻链,该轻链包含SEQ ID NO:289的氨基酸序列(或与其具有至少约90%、95%、99%或更高同一性的序列,和/或具有一个、两个、三个或更多个取代、插入、缺失或修饰的序列)。
在一些实施例中,本发明提供抗体或其抗原结合片段,该抗体或其抗原结合片段结合人ENTPD2蛋白,其中解离常数K
本文还提供了特异性结合人ENTPD2中的表位的抗体或其抗原结合片段,其中该表位包含以下残基中的至少一个(例如,至少两个、至少三个、至少四个、至少五个、至少六个、至少七个、至少八个、至少九个、至少十个、至少十一个、至少十二个、至少十三个、至少十四个、至少十五个、至少二十个):His50、Asp76、Pro78、Gly79、Gly80、Tyr85、Asp87、Asn88、Gly91、Gln94、Ser95、Gly98、Glu101、Gln102、Gln105、Asp106、Arg245、Thr272、Gln273、Leu275、Asp278、Arg298、Ala347、Ala350、Thr351、Arg392、Ala393、Arg394、或Tyr398。在一些实施例中,此类抗体或抗原结合片段包括但不限于如表1中披露的MAb1、MAb2、MAb3、MAb7、MAb17、MAb19、MAb20、MAb21、和Fab23。
本文还提供了特异性结合人ENTPD2中的表位的抗体或其抗原结合片段,其中该表位包含以下残基中的至少一个(例如,至少两个、至少三个、至少四个、至少五个、至少六个、至少七个、至少八个、至少九个、至少十个、至少十一个、至少十二个、至少十三个、至少十四个、至少十五个、至少二十个):Gly79、Gln250、Leu253、Trp266、Arg268、Gly269、Phe270、Ser271、Thr272、Gln273、Val274、Leu275、Asp278、Arg298、Ser300、Ser302、Gly303、Thr380、Trp381、Ala382、Gly390、Gln391、Arg392、Ala393、Arg394、或Asp397。在一些实施例中,此类抗体或抗原结合片段包括但不限于如表1中披露的MAb4、MAb5、MAb6、MAb16、MAb18、和Fab22。
一旦确定了抗原上的所需表位,就有可能例如使用本发明中所述的技术生成针对该表位的抗体。可替代地,在发现过程中,抗体的产生和表征可以阐明关于所需表位的信息。根据该信息,然后可以竞争性地筛选抗体以结合相同的表位。实现该目的的方法是进行交叉竞争研究以找到彼此竞争性结合的抗体,例如抗体竞争结合抗原。在国际专利申请号WO 2003/48731中描述了基于抗体的交叉竞争将其“分箱”的高通量方法。如本领域技术人员所理解的,实际上抗体可以特异性结合的任何东西都可以是表位。表位可包含抗体结合的那些残基。
通常,对特定靶抗原有特异性的抗体将优先识别蛋白质和/或大分子的复杂混合物中靶抗原上的表位。
可以使用本领域公知的任何数量的表位作图技术鉴定包含表位的给定多肽的区域。参见,例如Epitope Mapping Protocols in Methods in Molecular Biology[分子生物学方法中的表位映射方案],卷66(Glenn E.Morris,编辑,1996,Humana Press(胡玛纳出版社),托托华(Totowa),新泽西州)。例如,线性表位可以通过例如在固体支持物上同时合成大量肽来确定,所述肽对应于蛋白质分子的部分且肽与抗体反应的同时肽仍然附着于支持物。这些技术在本领域中是已知的并且描述于,例如美国专利号4,708,871;Geysen等人,(1984)Proc.Natl.Acad.Sci.USA[美国国家科学院院刊]8:3998-4002;Geysen等人,(1985)Proc.Natl.Acad.Sci.USA[美国国家科学院院刊]82:78-182;Geysen等人,(1986)Mol.Immunol.[分子免疫学]23:709-715。类似地,通过测定氨基酸的空间构象如通过X射线晶体学和二维核磁共振,可以容易地鉴定构象表位。参见例如,Epitope MappingProtocols[表位作图方案],同上。还可以使用标准抗原性和亲水性图来鉴定蛋白质的抗原区域,如使用例如可从牛津分子集团(Oxford Molecular Group)获得的Omiga 1.0版软件程序计算的那些图。该计算机程序采用Hopp/Woods方法(Hopp等人,(1981)Proc.Natl.Acad.Sci USA[美国国家科学院院刊]78:3824-3828)用于确定抗原性曲线且采用Kyte-Doolittle技术(Kyte等人,(1982)J.Mol.Biol.[分子生物学杂志]157:105-132)用于亲水性图。
抗体分子可以是多克隆或单克隆抗体。单克隆抗体可以通过杂交瘤技术或不使用杂交瘤技术的方法(例如重组方法)制备。在一些实施例中,可以重组地产生抗体,例如通过噬菌体展示或通过组合方法产生。
用于产生抗体的噬菌体展示和组合方法是本领域已知的(如描述在例如,Ladner等人美国专利号5,223,409;Kang等人国际公开号WO92/18619;Dower等人国际公开号WO91/17271;Winter等人国际公开WO 92/20791;Markland等人国际公开号WO 92/15679;Breitling等人国际公开WO 93/01288;McCafferty等人国际公开号WO 92/01047;Garrard等人国际公开号WO 92/09690;Ladner等人国际公开号WO90/02809;Fuchs等人(1991)Bio/Technology[生物技术]9:1370-1372;Hay等人(1992)Hum Antibod Hybridomas[人类抗体杂交瘤]3:81-85;Huse等人(1989)Science[科学]246:1275-1281;Griffths等人(1993)EMBO J[欧洲分子生物学学会杂志]12:725-734;Hawkins等人(1992)J Mol Biol[分子生物学杂志]226:889-896;Clackson等人(1991)Nature[自然]352:624-628;Gram等人(1992)PNAS[美国国家科学院院刊]89:3576-3580;Garrad等人(1991)Bio/Technology[生物技术]9:1373-1377;Hoogenboom等人(1991)Nuc Acid Res[核酸研究]19:4133-4137;和Barbas等人(1991)PNAS[美国国家科学院院刊]88:7978-7982)。
在一个实施例中,抗体是全人抗体(例如,在已经基因工程化为从人免疫球蛋白序列产生抗体的小鼠中制备的抗体),或非人抗体,例如啮齿动物(小鼠或大鼠)、山羊、灵长类动物(例如,猴)、骆驼抗体。
抗体可以是可变区或其一部分(例如,CDR)在非人生物(例如,大鼠或小鼠)中产生的抗体分子。嵌合抗体、CDR移植的抗体、和人源化抗体属于本发明。在非人生物(例如,大鼠或小鼠)中产生并且然后在例如可变框架或恒定区中修饰以降低在人中的抗原性的抗体属于本发明。
可以工程化嵌合和/或人源化抗体以使人患者对非人受试者中产生的抗体或来自非人抗体基因表达的抗体的免疫应答最小化。嵌合抗体包含非人动物抗体可变区和人抗体恒定区。此类抗体保留了原始单克隆抗体的表位结合特异性,但当向人给予时可能具有较低的免疫原性,并且因此更可能被患者耐受。例如,小鼠抗体(例如小鼠单克隆抗体)的一条或多条轻链的可变区中的一个或全部(例如,一个、两个或三个)和/或一条或多条重链的可变区中的一个或全部(例如,一个、两个或三个)各自都可以连接到人恒定区,例如但不限于IgG1人恒定区。嵌合单克隆抗体可通过本领域已知的重组DNA技术产生。例如,编码非人抗体分子的恒定区的基因可以用编码人恒定区的基因取代(参见Robinson等人,PCT专利公开PCT/US 86/02269;Akira,等人,欧洲专利申请184,187;或Taniguchi,M.,欧洲专利申请171,496)。另外,可以用于产生嵌合抗体的其他合适技术描述于例如美国专利号4,816,567、4,978,775、4,975,369、和4,816,397。
通过用来自人可变区的等效部分替换不参与抗原结合的可变区的部分,可以进一步“人源化”嵌合抗体。人源化抗体包含可变区中的一个或多个人框架区以及重链和/或轻链的非人(例如小鼠、大鼠或仓鼠)互补决定区(CDR)。在一些实施例中,人源化抗体包含除CDR区外的完全人序列。相对于非人源化抗体,人源化抗体通常对人类的免疫原性较低,并且因此在某些情况下提供治疗益处。可以使用本领域已知的方法产生人源化ENTPD2抗体。参见例如Hwang等人,Methods[方法]36:35,2005;Queen等人,Proc.Natl.Acad.Sci.U.S.A.[美国国家科学院院刊]86:10029-10033,1989;Jones等人,Nature[自然]321:522-25,1986;Riechmann等人,Nature[自然]332:323-27,1988;Verhoeyen等人,Science[科学]239:1534-36,1988;Orlandi等人,Proc.Natl.Acad.Sci.U.S.A.[美国国家科学院院刊]86:3833-3837,1989;美国专利号5,225,539、5,530,101、5,585,089、5,693,761、5,693,762、和6,180,370;以及WO 90/07861。
可以使用本领域已知的方法生成人ENTPD2抗体。例如,人类工程化技术用于将非人抗体转化为工程化人抗体。美国专利公开号20050008625描述了一种体内方法,其用于采用抗体中的人可变区替代非人抗体可变区,同时保持相对于非人抗体的相同结合特征或提供更好的结合特征的体内方法。该方法依赖于表位引导的采用完全人抗体替代非人参考抗体的可变区。得到的人抗体通常与参考非人抗体在结构上不相关,但结合与参考抗体的相同抗原上的相同表位。简而言之,在存在响应测试抗体与抗原的结合的报告系统的情况下,通过在细胞中“竞争物”和参考抗体(“lest抗体”)的多种杂合体的文库之间建立针对结合有限量的抗原的竞争来实现连续表位引导的互补替代方法。竞争物可以是参考抗体或其衍生物,如单链Fv片段。竞争物也可以是抗原的天然或人工配体,其结合与参考抗体相同的表位。对竞争物的唯一要求是它结合与参考抗体相同的表位,并且它与参考抗体竞争抗原结合。测试抗体具有来自非人参考抗体的一个共同的抗原结合V区,以及从多种来源(如人抗体的文库)中随机选择的另一个V区。来自参考抗体的共同V区用作指导,从而将测试抗体定位在抗原上的相同表位上并且以相同方向定位,使得选择偏向于对参考抗体的最高抗原结合保真度。
许多类型的报告系统可用于检测测试抗体与抗原之间的所需的相互作用。例如,互补报告片段可以分别与抗原和测试抗体连接,使得通过片段互补的报告基因激活仅在该测试抗体与该抗原结合时发生。当测试抗体和抗原报告片段融合物与竞争物共表达时,报告基因激活变得依赖于测试抗体与竞争物竞争的能力,该能力与测试抗体对抗原的亲和力成正比。可以使用的其他报告系统包含如美国专利申请系列号10/208,730(公开号20030198971)中披露的自身抑制的报告基因再激活系统(RAIR)或美国专利申请系列号10/076,845(公开号20030157579)中披露的竞争激活系统的再激活物。
利用连续表位引导的互补替代系统,进行选择以鉴定表达单个测试抗体以及竞争物、抗原和报告组分的细胞。在这些细胞中,每种测试抗体与竞争物一对一竞争结合有限量的抗原。报告基因的活性与结合至测试抗体的抗原的量成正比,而结合至测试抗体的抗原的量与测试抗体对抗原的亲和力和测试抗体的稳定性成比例。当表达为测试抗体时,测试抗体最初基于其相对于参考抗体的活性进行选择。第一轮选择的结果是一组“杂合”抗体,其中每个抗体由来自参考抗体的相同非人V区和来自文库的人V区组成,并且每个抗体都结合与参考抗体相同的抗原表位。在第一轮中选择的一种或多种杂合抗体具有与参考抗体相当或更高的对抗原的亲和力。
在第二V区替代步骤中,在第一步中选择的人V区用作指导,用于选择其余非人参考抗体V区进行多样的同源人V区文库的人替代。在第一轮中选择的杂合抗体也可以用作对于第二轮选择的竞争物。第二轮选择的结果是一组完全人抗体,其在结构上不同于参考抗体,但其与参考抗体竞争结合相同抗原。一些选择的人抗体结合与参考抗体的相同抗原上的相同表位。在这些选择的人抗体中,一种或多种以相当于或比参考抗体的亲和力更高的亲和力与相同表位结合。
使用小鼠或嵌合ENTPD2抗体,可以产生与人ENTPD2结合的具有相同结合特异性和相同或更好结合亲和力的人抗体。另外,这种人ENTPD2抗体也可以从通常生产人抗体的公司例如KaloBios,Inc.(山景城(Mountain View),加利福尼亚州(Calif.))商业获得。
在一些实施例中,本发明提供结合人ENTPD2蛋白并调节一种或多种ENTPD2活性/功能的抗体或其抗原结合片段,例如抑制例如至少40%、至少50%、至少60%、至少70%、至少80%、或至少90%的人ENTPD2的酶活性。在一些实施例中,使用体外FRET测定测量人ENTPD2的酶活性,该体外FRET测定通过在细胞表面表达的重组ENTPD2或ENTPD2测量ATP至ADP的水解。
在一些实施例中,本文所述的抗人ENTPD2抗体或其抗原结合片段抑制ENTPD2水解三磷酸腺苷(ATP)的能力。在一些实施例中,使用体外FRET测定测量ENTPD2水解ATP的能力,该体外FRET测定通过在细胞表面表达的重组ENTPD2或ENTPD2测量ATP至ADP的水解。
在一些实施例中,本文所述的抗人ENTPD2抗体或其抗原结合片段干扰ATP与ENTPD2的结合或在ENTPD2的催化结构域内捕获ATP。在一些实施例中,使用体外FRET测定法测量对ATP与ENTPD2结合的干扰或在ENTPD2催化结构域内捕获ATP,该体外FRET测定法通过在细胞表面上表达的重组ENTPD2或ENTPD2测量ATP水解成ADP。
与小鼠ENTPD2特异性结合的抗体和抗原结合片段
本发明还提供了特异性结合小鼠ENTPD2蛋白的抗体或其抗原结合片段,例如单克隆抗体或其抗原结合片段。表26列出了特异性结合小鼠ENTPD2蛋白的ENTPD2抗体或抗原结合片段的示例性序列。
表26.与小鼠ENTPD2结合的示例性单克隆抗体(MAB)和抗体片段(FAB)的序列
在一些实施例中,抗小鼠ENTPD2抗体或抗体片段(例如,抗原结合片段)包含具有表26中所述的任何VH结构域的氨基酸序列的VH结构域。其他合适的抗小鼠ENTPD2抗体或抗体片段(例如抗原结合片段)可包括如下氨基酸,所述氨基酸已经突变但在VH结构域中与表26中描述的序列中描绘的VH区具有至少80%、85%、90%、95%、96%、97%、98%或99%一致性。在某些实施例中,本公开还提供了特异性结合小鼠ENTPD2的抗体或抗体片段(例如,抗原结合片段),其中这些抗体或抗体片段(例如,抗原结合片段)包含具有表26中列出的任一VH CDR的氨基酸序列的VH CDR。在具体实施例中,本发明提供了特异性结合小鼠ENTPD2的抗体或抗体片段(例如,抗原结合片段),这些抗体或抗体片段包含一个、两个、三个、四个、五个或更多个具有表26中列出的任一VH CDR的氨基酸序列的VH CDR(或任选地,由其组成)。
在一些实施例中,抗小鼠ENTPD2抗体或抗体片段(例如,抗原结合片段)包含具有表26中所述的任何VL结构域的氨基酸序列的VL结构域。其他合适的抗小鼠ENTPD2抗体或抗体片段(例如抗原结合片段)可包括如下氨基酸,所述氨基酸已经突变但在VL结构域中与表26中描述的序列中描绘的VL区具有至少80%、85%、90%、95%、96%、97%、98%或99%一致性。本公开还提供了特异性结合小鼠ENTPD2的抗体或抗体片段(例如,抗原结合片段),这些抗体或抗体片段(例如,抗原结合片段)包含具有表26中列出的任一VL CDR的氨基酸序列的VL CDR。具体地,本发明提供了特异性结合小鼠ENTPD2的抗体或抗体片段(例如,抗原结合片段),这些抗体或抗体片段包含一个、两个、三个或更多个具有表26中列出的任一VLCDR的氨基酸序列的VL CDR(或任选地,由其组成)。
本文公开的其他抗小鼠ENTPD2抗体或抗体片段(例如抗原结合片段)包括如下氨基酸,所述氨基酸已经突变但在CDR区中与表26中描述的序列中描绘的CDR区具有至少80%、85%、90%、95%、96%、97%、98%或99%一致性。在一些实施例中,其包括突变氨基酸序列,其中当与表26中描述的序列中描绘的CDR区相比时,CDR区中不超过1、2、3、4或5个氨基酸已经突变。
本文还提供了编码特异性结合小鼠ENTPD2(例如表26中的核酸序列)的抗体及其抗原结合片段的VH、VL、全长重链和全长轻链的核酸序列。可优化此类核酸序列以在哺乳动物细胞中表达。
本文还提供了特异性结合小鼠ENTPD2中的表位的抗体或其抗原结合片段,其中该表位包含以下残基中的至少一个(例如,至少两个、至少三个、至少四个、至少五个、至少六个、至少七个、至少八个、至少九个、至少十个、至少十一个、至少十二个、至少十三个、至少十四个、至少十五个、至少二十个):Ser74、Cys75、Asp76、Tyr349、Tyr350、Asp353、Phe354、Thr357、Val358、Gly360、Gln385、Ala386、Arg387、Val388、Pro389、Gly390、Gln391、Thr393、Arg394、或Tyr398。
本发明的抗体还可以使用具有一种或多种VH和/或VL序列的抗体作为起始材料来制备,以将修饰的抗体工程化,该修饰的抗体可以具有与起始抗体相比改变的特性。可以通过修饰一个或两个可变区(即VH和/或VL)内例如在一个或多个CDR区内和/或在一个或多个框架区内的一个或多个残基将抗体工程化。另外或可替代地,可以通过修饰一个或多个恒定区内的残基将抗体工程化,例如从而改变抗体的一个或多个效应子功能。
可以进行的一种可变区工程化是CDR移植。抗体主要通过位于六个重链和轻链互补决定区(CDR)中的氨基酸残基与靶抗原相互作用。因此,CDR内的氨基酸序列在各个抗体之间比CDR外部的序列更加多样化。因为CDR序列与大多数抗体-抗原相互作用有关,所以可以通过构建表达运载体来表达模拟特定天然存在的抗体的特性的重组抗体,所述表达运载体包含被移植在来自具有不同特性的不同抗体的框架序列上的来自所述特定天然存在的抗体的CDR序列(参见例如,Riechmann,L.等人,1998Nature[自然]332:323-327;Jones,P.等人,1986Nature[自然]321:522-525;Queen,C.等人,1989Proc.Natl.Acad.,U.S.A.[美国国家科学院院刊]86:10029-10033;Winter的美国专利号5,225,539和Queen等人的美国专利号5,530,101、5,585,089、5,693,762和6,180,370)。
此类框架序列可以从包含种系抗体基因序列或重新排列的抗体序列的公共DNA数据库或公开参考文献获得。例如,人重链和轻链可变区基因的种系DNA序列可以在“VBase”人种系序列数据库(可从因特网www.mrc-cpe.cam.ac.uk/vbase获得)中找到,以及在卡巴特,E.A.,等人,1991Sequences of Proteins of Immunological Interest[免疫学相关蛋白质序列],第五版,美国卫生与公众服务部(U.S.Department of Health and HumanServices),NIH公开号91-3242;Tomlinson,I.M.,等人,1992J.fol.Biol.227:776-798;和Cox,J.P.L.等人,1994Eur.J Immunol.[欧洲免疫学杂志]24:827-836中找到。例如,人重链和轻链可变区基因的种系DNA序列和重新排列的抗体序列可以在“IMGT”数据库(可从因特网www.imgt.org获得;参见Lefranc,M.P.等人,1999Nucleic Acids Res.[核酸研究]27:209-212)中找到。
用于本发明的抗体及其抗原结合片段的框架序列的实例是与本发明的选择的抗体及其抗原结合片段所使用的框架序列在结构上相似的那些序列,例如,共有序列和/或本发明的单克隆抗体使用的框架序列。可以将VH CDR1、2和3序列以及VL CDR1、2和3序列移植到框架区上,所述框架区具有与框架序列所来源的种系免疫球蛋白基因中发现的序列相同的序列,或可以将CDR序列移植到与种系序列相比含有一个或多个突变的框架区上。例如,已经发现在某些情况下使框架区内的残基突变以维持或增强抗体的抗原结合能力是有益的(参见例如,Queen等人的美国专利号5,530,101、5,585,089、5,693,762和6,180,370)。
另一种类型的可变区修饰是使VH和/或VL CDR1、CDR2和/或CDR3区内的氨基酸残基突变,从而改善感兴趣的抗体的一种或多种结合特性(例如,亲和力),称为“亲和力成熟”。可以进行定点诱变或PCR介导的诱变以引入一个或多个突变,并且可以在如本文所述且在实例中提供的体外或体内测定中评估对抗体结合或其他感兴趣的功能特性的影响。可以引入保守修饰(如上所讨论的)。所述突变可以是氨基酸取代、添加或缺失。此外,通常CDR区内不超过一个、两个、三个、四个或五个残基被改变。
可以使用多种抗体/免疫球蛋白框架或支架,只要所得多肽包含至少一个特异性结合ENTPD2(例如,人ENTPD2蛋白)的结合区即可。这种框架或支架包括5种主要独特型的人免疫球蛋白、其抗原结合片段,并且包括其他动物物种的免疫球蛋白,优选具有人源化方面。就这点而言,单个重链抗体如在骆驼科动物中鉴定的那些抗体是特别令人感兴趣的。本领域技术人员将继续发现和开发新的框架、支架和片段。
在一个方面,本发明涉及使用非免疫球蛋白支架生成基于非免疫球蛋白的抗体的方法,在所述非免疫球蛋白支架上可以移植本发明的CDR。可以使用已知的或未来的非免疫球蛋白框架和支架,只要它们包含对靶ENTPD2蛋白有特异性的结合区即可。已知的非免疫球蛋白框架或支架包括但不限于纤连蛋白(化合物治疗剂公司(Compound Therapeutics,Inc.),沃尔瑟姆(Waltham),马萨诸塞州(Mass.))、锚蛋白(分子配偶体公司(MolecularPartners AG,苏黎世(Zurich),瑞士(Switzerland))、结构域抗体(Domantis,Ltd.,坎布里奇(Cambridge),马萨诸塞州(Mass.),和Ablynx nv,Zwijnaarde,比利时)、脂质运载蛋白(Pieris Proteolab AG,弗赖辛(Freising),德国)、小型模块化免疫药物(TrubionPharmaceuticals Inc.,西雅图(Seattle),华盛顿州(Wash.))、maxybody(Avidia,Inc.,山景城(Mountain View),加利福尼亚州(Calif.))、蛋白质A(亲合体公司(Affibody AG),瑞典)和affilin(γ-晶体蛋白或泛素)(SciI Proteins GmbH,哈雷(Halle),德国)。
纤连蛋白支架基于纤连蛋白III型结构域(例如,III型纤连蛋白的第十个模块(10Fn3结构域))。纤连蛋白III型结构域具有分布在两个β片层之间的7或8个β链,它们自身彼此包裹以形成蛋白质的核心且还含有将β链彼此连接且暴露于溶剂中的环(类似于CDR)。在β片层夹心的每个边缘处存在至少三个这样的环,其中所述边缘是垂直于β链方向的蛋白质的边界(参见美国专利号6,818,418)。这些基于纤连蛋白的支架不是免疫球蛋白,但整体折叠与最小功能性抗体片段(重链可变区)的折叠密切相关,所述最小功能性抗体片段包含骆驼和美洲驼IgG中的完整抗原识别单元。由于这种结构,非免疫球蛋白抗体模拟抗原结合特性,其在性质和亲和力上与抗体的那些抗原结合特性相似。这些支架可用于体外环随机化和改组策略,其类似于体内抗体亲和力成熟的过程。这些基于纤连蛋白的分子可以用作支架,其中可以使用标准克隆技术用本发明的CDR替代分子的环区。
锚蛋白技术基于使用具有锚蛋白衍生的重复模块的蛋白质作为支架,该支架用于承载可用于结合不同的靶标的可变区。锚蛋白重复模块是33个氨基酸多肽,其由两个反平行的α-螺旋和β-转角组成。可变区的结合主要通过使用核糖体展示来优化。
Avimer源自含有天然A结构域的蛋白质,如LRP-1。这些结构域天然地用于蛋白质间相互作用,并且在人类中超过250种蛋白质在结构上基于A结构域。Avimer由经由氨基酸接头连接的许多不同的“A结构域”单体(2-10)组成。可以使用例如美国专利申请公开号20040175756、20050053973、20050048512、和20060008844中描述的方法产生可与靶抗原结合的Avimer。
亲合体(affibody)亲和配体是由基于蛋白质A的IgG结合结构域之一的支架的三螺旋束组成的小而简单的蛋白质。蛋白质A是来自细菌金黄色葡萄球菌的表面蛋白。该支架结构域由58个氨基酸组成,其中13个随机化以生成具有大量配体变体的亲合体文库(参见例如,美国专利号5,831,012)。亲合体分子类似抗体,其分子量为6kDa,而抗体的分子量为150kDa。尽管其尺寸小,但是亲合体分子的结合位点与抗体的结合位点相似。
Anticalin是由Pieris ProteoLab AG公司开发的产品。它们源自脂质运载蛋白,脂质运载蛋白是一种广泛分布的小而健壮的蛋白质,其通常参与化学敏感或不溶性化合物的生理运输或储存。几种天然脂质运载蛋白存在于人体组织或体液中。蛋白质结构让人联想到免疫球蛋白,其中高变环在刚性框架的顶部。然而,与抗体或其重组片段相反,脂质运载蛋白由仅略微大于单个免疫球蛋白结构域的具有160至180个氨基酸残基的单个多肽链组成。构成结合口袋的四个环的组显示出明显的结构可塑性并且容许各种侧链。因此,结合位点可以在专有过程中重新成形,以便以高亲和力和特异性识别不同形状的规定靶分子。脂质运载蛋白家族的一种蛋白质,欧洲粉蝶的后胆色素结合蛋白(BBP)已被用于通过诱变四个环的组来产生anticalin。描述anticalin的专利申请的一个实例是PCT公开号WO199916873。
Affilin分子是小的非免疫球蛋白蛋白质,其针对对于蛋白质和小分子的特定亲和力而设计。可以从两个文库中非常快速地选择新的affilin分子,每个文库基于不同的人源支架蛋白。Affilin分子不显示与免疫球蛋白蛋白质的任何结构同源性。目前,使用两种affilin支架,其中一种是γ晶体,即人结构性眼晶状体蛋白质,而另一种是“泛素”超家族蛋白质。两种人支架都非常小,显示出高温稳定性并且几乎耐受pH变化和变性剂。这种高稳定性主要是由于蛋白质的扩大的β片层结构。WO200104144中描述了γ晶体衍生蛋白的实例,并且WO 2004106368中描述了“泛素类”蛋白质的实例。
蛋白质表位模拟物(PEM)是中等大小的环状肽类分子(MW 1-2kDa),其模拟蛋白质的β-发夹二级结构,它是参与蛋白质间相互作用的主要二级结构。
本发明的工程化抗体及其抗原结合片段包括如下这些:其中已对VH和/或VL内的框架残基进行了修饰,例如以改善抗体的特性。通常进行这样的框架修饰以降低抗体的免疫原性。例如,一种方法是将一个或多个框架残基“向回突变”为相应的种系序列。更具体地,已经历体细胞突变的抗体可以含有与衍生抗体的种系序列不同的框架残基。可以通过将抗体框架序列与衍生抗体的种系序列进行比较来鉴定这种残基。为了使框架区序列恢复为其种系构型,可以通过例如定点诱变将体细胞突变“向回突变”为种系序列。这种“向回突变的”抗体也旨在包括在本发明中。
另一种类型的框架修饰包括使框架区内或甚至一个或多个CDR区内的一个或多个残基突变以去除T细胞表位,从而降低抗体的潜在免疫原性。该方法也称为“去免疫化”,并在Carr等人的美国专利公开号20030153043中进一步详细描述。
除了在框架或CDR区内进行的修饰之外或作为在框架或CDR区内进行的修饰的替代方案,可以将本发明的抗体工程化以包含Fc区内的修饰,通常是为了改变抗体的一种或多种功能特性,如血清半衰期、补体结合、Fc受体结合和/或抗原依赖性细胞毒性。此外,本发明的抗体可以被化学修饰的(例如,一个或多个化学部分可以附接至抗体)或被修饰以改变其糖基化,从而再次改变抗体的一种或多种功能特性。以下更详细地描述了这些实施例中的每一个。Fc区中残基的编号是卡巴特的EU索引的编号。
在一个实施例中,修饰CH1的铰链区,使得铰链区中半胱氨酸残基的数目改变,例如增加或减少。该方法在Bodmer等人的美国专利号5,677,425中进一步描述。改变CH1铰链区中半胱氨酸残基的数目,以便例如促进轻链和重链的组装或增加或降低抗体的稳定性。
在另一个实施例中,使抗体的Fc铰链区突变以降低抗体的生物半衰期。更具体地,将一个或多个氨基酸突变引入Fc铰链片段的CH2-CH3结构域界面区域中,使得抗体具有相对于天然Fc铰链结构域SpA结合而言受损的葡萄球菌蛋白质A(SpA)结合。该方法在Ward等人的美国专利号6,165,745中进一步详细描述。
在另一个实施例中,修饰抗体以增加其生物半衰期。可以采用各种方法。例如,可以引入以下突变中的一种或多种:T252L、T254S、T256F,如Ward的美国专利号6,277,375中所述。可替代地,为了增加生物半衰期,可以在CH1或CL区内改变抗体,以含有从IgG的Fc区的CH2结构域的两个环采集的补救受体结合表位,如Presta等人的美国专利号5,869,046和6,121,022中所述。
在一个实施例中,通过用不同的氨基酸残基替代至少一个氨基酸残基来改变Fc区,以改变抗体的效应子功能。例如,可以用不同的氨基酸残基替代一个或多个氨基酸,使得抗体对效应配体具有改变的亲和力,但保留亲本抗体的抗原结合能力。改变亲和力的效应配体可以是例如Fc受体或补体的C1组分。该方法在Winter等人的美国专利号5,624,821和5,648,260中进一步详细描述。
在另一个实施例中,选自氨基酸残基的一个或多个氨基酸可以用不同的氨基酸残基替代,使得抗体具有改变的C1q结合和/或降低或消除的补体依赖性细胞毒性(CDC)。该方法在Idusogie等人的美国专利号6,194,551中进一步详细描述。
在另一个实施例中,改变一个或多个氨基酸残基,从而改变抗体固定补体的能力。该方法在Bodmer等人的PCT公开WO 94/29351中进一步描述。
在一些实施例中,ENTPD2结合抗体或其抗原结合片段含有人IgG1恒定区。在一些实施例中,人IgG1恒定区包括Fc区。
在一些实施例中,ENTPD2结合抗体或其抗原结合片段的Fc区包括一个或多个突变,该突变介导减少的或不介导抗体依赖性细胞毒性(ADCC)或补体依赖性细胞毒性(CDC)。在一些实施例中,IgG1恒定区的氨基酸残基L234和L235被取代为A234和A235。在一些实施例中,IgG1恒定区的氨基酸残基N267被取代为A267。在一些实施例中,IgG1恒定区的氨基酸残基D265和P329被取代为A265和A329。在某些实施例中,Fc区任选地包含选自以下中任何一种的赋予降低的效应子功能的突变或突变组合:D265A、P329A、P329G、N297A、D265A/P329A、D265A/N297A、L234/L235A、P329A/L234A/L235A、和P329G/L234A/L235A。在一些实施例中,Fc区包含选自以下中任何一种的赋予降低的效应子功能的突变或突变组合:D265A、P329A、P329G、N297A、D265A/P329A、D265A/N297A、L234/L235A、P329A/L234A/L235A、和P329G/L234A/L235A(所有位置通过EU编号)。
在另一个实施例中,修饰Fc区以增加抗体介导抗体依赖性细胞毒性(ADCC)的能力和/或通过修饰一个或多个氨基酸来增加抗体对Fc-γ受体的亲和力。该方法由Presta在PCT公开WO 00/42072中进一步描述。此外,已经绘制了人IgG1上针对Fc-γRI、Fc-γRII、Fc-γRIII和FcRn的结合位点,并且已经描述了具有改善的结合的变体(参见Shields,R.L.等人,2001J.Biol.Chen.[生物化学杂志]276:6591-6604)。例如,Fc区包含选自以下中任何一种的赋予增加的效应子功能的突变或突变组合:S239D、I332E、A330L、S298A、E333A、E333S、K334A、K236A、K236W、F243L、P247I、D280H、K290S、R292P、S298D、S298V、Y300L、V305I、A339D、A339Q、A339T、P396L(所有位置通过EU编号)。
在又另一个实施例中,修饰抗体的糖基化。例如,可以制备非糖基化的抗体(即,抗体缺乏糖基化)。可以改变糖基化以例如增加抗体对抗原的亲和力。这种碳水化合物修饰可以通过例如改变抗体序列内的一个或多个糖基化位点来实现。例如,可以进行一个或多个氨基酸取代,其导致消除一个或多个可变区框架糖基化位点,从而消除该位点的糖基化。这种糖基化可以增加抗体对抗原的亲和力。这样的方法在Co等人的美国专利号5,714,350和6,350,861中进一步详细描述。
另外或可替代地,可以制备具有改变的糖基化类型的抗体,如具有减少量的岩藻糖基残基的低岩藻糖基化抗体或具有增加的二等分GlcNac结构的抗体。已经证明这种改变的糖基化模式增加了抗体的ADCC能力。这种碳水化合物修饰可以通过例如在具有改变的糖基化机制的宿主细胞中表达抗体来实现。具有改变的糖基化机制的细胞已在本领域中描述,并且可用作宿主细胞,在该宿主细胞中表达本发明的重组抗体,从而产生具有改变的糖基化的抗体。例如,Hang等人的EP1,176,195描述了具有功能破坏的FUT8基因的细胞系,其编码岩藻糖基转移酶,使得在这种细胞系中表达的抗体显示出低岩藻糖基化。Presta的PCT公开WO 03/035835描述了变体CHO细胞系LecI3细胞,其将岩藻糖附接至Asn(297)连接的碳水化合物的能力降低,还导致在该宿主细胞中表达的抗体的低岩藻糖基化(还参见Shields,R.L.等人,2002J.Biol.Chem.[生物化学杂志]277:26733-26740)。Umana等人的PCT公开WO 99/54342描述了如下细胞系,该细胞系被工程化以表达糖蛋白修饰糖基转移酶(例如,β(1,4)-N乙酰基葡糖胺基转移酶III(GnTIII)),使得在工程化细胞系中表达的抗体显示出增加的二等分GlcNac结构,该二等分GlcNac结构导致抗体的ADCC活性增加(还参见Umana等人,1999Nat.Biotech.[自然生物技术]17:176-180)。
在一些实施例中,ENTPD2抗体具有IgG1同种型,其具有一个或多个突变(例如,相对于相同同种型的野生型Fc区)。在一些实施例中,该一种或多种突变选自N297A、N297Q(BoltS等人(1993)Eur J Immunol[欧洲免疫学杂志]23:403-411)、D265A、L234A、L235A(McEarchern等人,(2007)Blood[血液],109:1185-1192)、C226S、C229S(McEarchern等人,(2007)Blood[血液],109:1185-1192)、P238S(Davis等人,(2007)J Rheumatol[风湿病学杂志],34:2204-2210)、E233P、L234V(McEarchern等人,(2007)Blood[血液],109:1185-1192)、P238A、A327Q、A327G、P329A(Shields RL.等人,(2001)J Bioi Chern.276(9):6591-604)、K322A、L234F、L235E(Hezareh等人,(2001)J Viral 75,12161-12168;Oganesyan等人,(2008).Acta Crystallographica[晶体学报]64,700-704)、P331S(Oganesyan等人,(2008)Acta Crystallographica[晶体学报]64,700-704)、T394D(Wilkinson等人(2013)MAbs 5(3):406-417)、A330L、M252Y、S254T、和/或T256E,其中氨基酸位置根据EU或卡巴特编号惯例。在某些实施例中,根据EU或卡巴特编号惯例,Fc区还在对应于甘氨酸236的位置处包含氨基酸缺失。
在一些实施例中,根据EU或卡巴特编号惯例,抗体具有IgG1同种型,该IgG1同种型具有重链恒定区,该重链恒定区含有C220S突变。
在一些实施例中,根据EU或卡巴特编号惯例,Fc区含有选自L234F、L235E、P331S、D265A和/或N297Q的一个或多个突变。在一些实施例中,根据EU或卡巴特编号惯例,Fc区含有选自L234A、L235A、D265A、P329A、N297A、N297Q的一个或多个突变。
在某些实施例中,抗体具有IgG2同种型。在一些实施例中,抗体含有人IgG2恒定区。在一些实施例中,人IgG2恒定区包括Fc区。在一些实施例中,Fc区包含一个或多个修饰。例如,在一些实施例中,Fc区包含一个或多个突变(例如,相对于相同同种型的野生型Fc区)。在一些实施例中,该一个或多个突变选自V234A、G237A、P238S、H268A、H268E、H268Q、V309L、N297A、N297Q、V309L、A330S、P331S、C232S、C233S、M252Y、S254T、和/或T256E,其中氨基酸位置根据EU或卡巴特编号惯例。
在某些实施例中,抗体具有IgG4同种型。在一些实施例中,抗体含有人IgG4恒定区。在一些实施例中,人IgG4恒定区包括Fc区。在一些实施例中,Fc区包含一个或多个修饰。例如,在一些实施例中,Fc区包含一个或多个突变(例如,相对于相同同种型的野生型Fc区)。在一些实施例中,该一个或多个突变选自E233P、F234V、L234A、L235A、G237A、E318A(Hutchins等人(1995)Proc Natl A cad Sci USA[美国国家科学院院刊],92:11980-11984)、S228P、L236E、S241P、L248E(Reddy等人,(2000)J Immunol[免疫学杂志],164:1925-1933;Angal等人,(1993)Mol Immunol.[分子免疫学]30(1):105-8;US 8614299B2)、T394D、M252Y、S254T、T256E、N297A、和/或N297Q,其中氨基酸位置根据EU或卡巴特编号惯例。
在一些实施例中,Fc区还含有一个或多个选自M252Y、S254T和/或T256E的其他突变,其中氨基酸位置根据EU或卡巴特编号惯例。
在一些实施例中,本文所述的一种或多种IgG1变体可与A330L突变组合(Lazar等人,(2006)Proc Natl Acad Sci USA[美国国家科学院院刊],103:4005-4010),或与L234F、L235E、和/或P331S突变中的一种或多种组合(Sazinsky等人,(2008)Proc Natl Acad SciUSA[美国国家科学院院刊],105:20167-20172)以消除补体活化,其中氨基酸位置根据EU或卡巴特编号惯例。在一些实施例中,本文所述的IgG变体可与一种或多种突变(例如根据EU或卡巴特编号惯例,M252Y、S254T、T256E突变)组合以增强人血清中的抗体半衰期(Dall’Acqua等人,(2006)J Biol Chern,281:23514-23524;和Strohl等人,(2009)CurrentOpinion in Biotechnology[生物技术当前观点],20:685-691)。
在一些实施例中,根据EU或卡巴特编号惯例,本公开的IgG4变体可以与S228P突变组合(Angal等人,(1993)Mol Immunol[分子免疫学],30:105-108)和/或与Peters等人,(2012)J Biol Chern.13;287(29):24525-33中描述的一种或多种突变组合以增强抗体稳定性。
在一些实施例中,抗体具有如下Fc区,该Fc区选自IgG2 Fc区、IgG4 Fc区、或IgG2/IgG4杂合Fc区。
从包括新的世界成员如美洲驼物种(Lama paccos、大羊驼和瘦驼)在内的骆驼和单峰骆驼(双峰骆驼和Calelus dromaderius)家族成员获得的抗体蛋白质已经关于大小、结构复杂性和对于人类受试者的抗原性进行了表征。来自自然界中发现的该哺乳动物家族的某些IgG抗体缺乏轻链,因此在结构上不同于来自其他动物的抗体的具有两条重链和两条轻链的典型四链四级结构。参见PCT/EP 93/02214(1994年3月3日公开的WO 94/04678)。
通过基因工程化获得骆驼科动物抗体的区域(它是被鉴定为VHH的小的单个可变结构域)以产生对靶标具有高亲和力的小蛋白质,从而产生称为“骆驼科动物纳米抗体”的低分子量抗体衍生蛋白。参见提交于1998年6月2日的美国专利号5,759,808;还参见Stijlemans,B.等人,2004J Biol Chem[生物化学杂志]279:1256-1261;Dumoulin,M.等人,2003Nature[自然]424:783-788;Pleschberger,M.等人,2003Bioconjugate Chem[生物缀合化学]14:440-448;Cortez-Retamozo,V.等人,2002Int J Cancer[国际癌症杂志]89:456-62;和Lauwereys,M.等人,1998EMBO J[欧洲分子生物学组织杂志]17:3512-3520。骆驼科动物抗体和抗体片段的工程化文库可例如从比利时根特(Ghent)的Ablynx公司商购获得。与非人来源的其他抗体及其抗原结合片段一样,可以重组改变骆驼科动物抗体的氨基酸序列以获得更接近地类似于人序列的序列,即纳米抗体可以是“人源化的”。因此,可以进一步降低骆驼科动物抗体对人的天然低抗原性。
骆驼科动物纳米抗体的分子量为人IgG分子的约十分之一,并且该蛋白质的物理直径仅为几纳米。小尺寸的一个结果是骆驼科动物纳米抗体结合抗原位点的能力,所述抗原位点对于较大的抗体蛋白质是功能上不可见的,即,骆驼科动物纳米抗体可用作检测对于使用经典免疫学技术而言隐蔽的抗原的试剂,以及可用作可能的治疗剂。因此,小尺寸的又另一个结果是骆驼科动物纳米抗体可以由于结合靶蛋白的沟槽或狭窄裂缝中的特异性位点而抑制,因此可以具有与经典抗体相比更接近地类似于经典低分子量药物的功能的能力。
低分子量和紧凑的尺寸还导致骆驼科动物纳米抗体极其热稳定、对极端pH和蛋白水解消化稳定,并且抗原性差。另一个结果是骆驼科动物纳米抗体容易从循环系统移动到组织中,甚至穿过血脑屏障并且可以治疗影响神经组织的障碍。纳米抗体还可以促进跨越血脑屏障的药物转运。参见2004年8月19日公开的美国专利申请20040161738。这些特征与对人的低抗原性相结合显示了巨大的治疗潜力。此外,这些分子可以在原核细胞如大肠杆菌中完全表达,并且表达为具有噬菌体的融合蛋白并且是功能性的。
因此,本发明的特征是对ENTPD2具有高亲和力的骆驼科动物抗体或纳米抗体。在本文的一个实施例中,骆驼科动物抗体或纳米抗体在骆驼科动物中天然产生,即,在使用对于其他抗体的本文所述的技术用ENTPD2或其肽片段免疫后,由骆驼科动物产生。可替代地,ENTPD2结合骆驼科动物纳米抗体被工程化,即如本文实例中所述通过以ENTPD2为靶标使用淘选程序,例如从展现出适当诱变的骆驼科动物纳米抗体蛋白质的噬菌体文库中选择产生。通过基因工程可以进一步定制工程化纳米抗体,以在受体受试者中具有45分钟至两周的半衰期。在一个具体实施例中,骆驼抗体或纳米抗体通过将本发明的人抗体的重链或轻链的CDR序列移植到纳米抗体或单结构域抗体框架序列中而获得,如例如PCT/EP 93/02214中所述。
在另一方面,本发明的特征在于包含本发明的ENTPD2结合抗体或其片段的双特异性或多特异性分子。本发明的抗体或其抗原结合区可以衍生化或连接至另一种功能分子,例如另一种肽或蛋白质(例如,另一种抗体或受体的配体),以生成结合至少两个不同的结合位点或靶分子的双特异性分子。事实上,本发明的抗体可以衍生化或连接至多于一种的其他功能分子,以生成结合多于两个不同结合位点和/或靶分子的多特异性分子;这种多特异性分子也旨在由本文所用的术语“双特异性分子”涵盖。为了产生本发明的双特异性分子,本发明的抗体可以功能性地连接(例如,通过化学偶联、基因融合、非共价缔合或其他方式)至一种或多种其他结合分子,如另一种抗体、抗体片段、肽或结合模拟物,从而产生双特异性分子。
因此,本发明包括双特异性分子,其包含对ENTPD2的至少一种第一结合特异性和对第二靶表位的第二结合特异性。例如,第二靶表位是不同于第一靶表位的ENTPD2的另一表位。
另外,对于双特异性分子是多特异性的发明,除了第一和第二靶表位之外,所述分子还可以包含第三结合特异性。
在一个实施例中,本发明的双特异性分子包含至少一种抗体或其抗体片段的结合特异性,包括例如Fab、Fab'、F(ab')2、Fv或单链Fv。抗体也可以是轻链或重链二聚体或其任何最小片段,如Ladner等人的美国专利号4,946,778中所述的Fv或单链构建体。
双抗体是二价双特异性分子,其中VH和VL结构域在单个多肽链上表达,通过接头连接,所述接头太短而不允许在同一链上的两个结构域之间配对。VH和VL结构域与另一条链的互补结构域配对,从而产生两个抗原结合位点(参见例如,Holliger等人,1993Proc.Natl.Acad.Sci.USA[美国国家科学院院刊]90:6444-6448;Poijak等人,1994Structure[结构]2:1121-1123)。可以通过在相同细胞内表达具有结构VHA-VLB和VHB-VLA(VH-VL构型)或VLA-VHB和VLB-VHA(VL-VH构型)的两条多肽链来产生双抗体。它们中的大多数可以在细菌中以可溶性形式表达。单链双抗体(scDb)通过将两个形成双抗体的多肽链与约15个氨基酸残基的接头连接而产生(参见Holliger和Winter,1997CancerImmunol.Immunother.[癌症免疫学,免疫疗法],45(3-4):128-30;Wu等人,1996Immunotechnology[免疫技术],2(1):21-36)。scDb可以在细菌中以可溶的活性单体形式表达(参见Holliger和Winter,1997Cancer Immunol.Immunother.[癌症免疫学,免疫疗法],45(34):128-30;Wu等人,1996Immunotechnology[免疫技术],2(1):21-36;Pluckthun和Pack,1997Immunotechnology[免疫技术],3(2):83-105;Ridgway等人,1996ProteinEng.[蛋白质工程],9(7):617-21)。双抗体可以与Fc融合以生成“二-双抗体”(参见Lu等人,2004J.Biol.Chem.[生物化学杂志],279(4):2856-65)。
可用于本发明双特异性分子的其他抗体是鼠嵌合和人源化单克隆抗体。
本发明的双特异性分子可以通过使用本领域已知的方法缀合组分结合特异性来制备。例如,双特异性分子的每种结合特异性可以单独生成,然后彼此缀合。当结合特异性是蛋白质或肽时,多种偶联剂或交联剂可用于共价缀合。交联剂的实例包括蛋白质A、碳二亚胺、N-琥珀酰亚胺基-5-乙酰基-硫代乙酸酯(SATA)、5,5'-二硫代双(2-硝基苯甲酸)(DTNB)、邻亚苯基二马来酰亚胺(oPDM)、N-琥珀酰亚胺基-3-(2-吡啶基二硫代)丙酸酯(SPDP)和4-(N-马来酰亚胺基甲基)环己烷-1-羧酸磺基琥珀酰亚胺酯(磺基-SMCC)(参见例如Karpovsky等人,1984J.Exp.Med.[实验医学杂志]160:1686;Liu,M A等人,1985Proc.Natl.Acad.Sci.USA[美国国家科学院院刊]82:8648)。其他方法包括Paulus,1985Behring Ins.Mitt.第78期,118-132;Brennan等人,1985Science[科学]229:81-83)和Glennie等人,1987J.Immunol.[免疫学杂志]139:2367-2375)中描述的那些方法。缀合剂是SATA和磺基-SMCC,两者均可从Pierce Chemical Co.(罗克福德(Rockford),伊利诺伊州)获得。
当结合特异性是抗体时,它们可以通过两条重链的C-末端铰链区的巯基键合而缀合。在具体实施例中,铰链区被修饰为例如在缀合之前含有奇数个巯基残基。
可替代地,两种结合特异性可以在相同运载体中编码,并在相同宿主细胞中表达和组装。当双特异性分子是mAb×mAb、mAb×Fab、Fab×F(ab')2或配体×Fab融合蛋白时,该方法特别有用。本发明的双特异性分子可以是包含一个单链抗体和一个结合决定簇的单链分子,或包含两个结合决定簇的单链双特异性分子。双特异性分子可包含至少两个单链分子。用于制备双特异性分子的方法描述于例如在美国专利号5,260,203;美国专利号5,455,030;美国专利号4,881,175;美国专利号5,132,405;美国专利号5,091,513;美国专利号5,476,786;美国专利号5,013,653;美国专利号5,258,498;和美国专利号5,482,858中。
双特异性分子与其特异性靶标的结合可以通过例如酶联免疫吸附测定(ELISA)、放射免疫测定(REA)、FACS分析、生物测定(例如生长抑制)或蛋白质印迹测定来证实。这些测定中的每一种通常通过使用对感兴趣的复合物有特异性的标记试剂(例如,抗体)来检测特别感兴趣的蛋白质-抗体复合物的存在。
在另一方面,本发明提供了多价化合物,其包含与ENTPD2结合的本发明抗体及其抗原结合片段的至少两个相同或不同的抗原结合部分。抗原结合部分可以经由蛋白质融合或共价或非共价连接而连接在一起。可替代地,已经描述了双特异性分子的连接方法。四价化合物可以例如通过将本发明的抗体及其抗原结合片段与结合本发明的抗体及其抗原结合片段的恒定区(例如Fc或铰链区)的抗体或抗原结合片段交联而获得。
三聚结构域描述于例如Borean专利EP 1 012 280B1中。五聚模块描述于例如PCT/EP 97/05897中。
在一些实施例中,ENTPD2-结合抗体或其抗原结合片段是识别第一抗原和第二抗原的双特异性抗体。在一些实施例中,该第一抗原是人ENTPD2或其天然存在的变体。在一些实施例中,第二抗原可以是在一种或多种肿瘤细胞上表达的蛋白质、脂质、多糖或糖脂。
本发明提供了特异性结合ENTPD2(例如,人ENTPD2蛋白)的抗体并在体内具有延长的半衰期。
许多因素可以影响蛋白质在体内的半衰期。例如,肾过滤、肝代谢、蛋白水解酶(蛋白酶)降解和免疫原性应答(例如通过抗体中和蛋白质和通过巨噬细胞和树突细胞摄取)。可以使用多种策略来延长本发明的抗体及其抗原结合片段的半衰期。例如,通过与聚乙二醇(PEG)、reCODE PEG、抗体支架、聚唾液酸(PSA)、羟乙基淀粉(HES)、白蛋白结合配体和碳水化合物屏蔽的化学连接;通过与结合血清蛋白(如白蛋白、IgG、FcRn)的蛋白质的基因融合和转移;通过与结合血清蛋白的其他结合部分(如纳米抗体、Fab、DARPin、avimer、亲合体和anticalin)偶联(遗传地或化学地);通过与rPEG、白蛋白、白蛋白的结构域、白蛋白结合蛋白和Fc的基因融合;或通过掺入纳米载体、缓释配制品或医疗装置中。
为了延长体内抗体的血清循环,可以通过PEG与抗体的N-末端或C-末端的位点特异性缀合或经由赖氨酸残基上存在的ε-氨基,将惰性聚合物分子(如高分子量PEG)附接至具有或不具有多功能接头的抗体或其片段。为了使抗体聚乙二醇化,通常在一个或多个PEG基团附接至该抗体或抗体片段的条件下使该抗体、其抗原结合片段与聚乙二醇(PEG)(如PEG的反应性酯或醛衍生物)反应。聚乙二醇化可以通过酰化反应或烷基化反应采用反应性PEG分子(或类似的反应性水溶性聚合物)来进行。如本文所用,术语“聚乙二醇”旨在涵盖已用于衍生化其他蛋白质的任何形式的PEG,如单(C1-C10)烷氧基-或芳氧基-聚乙二醇或聚乙二醇-马来酰亚胺。在一个实施例中,待聚乙二醇化的抗体是非糖基化抗体。将使用导致最小生物活性损失的线性或支化聚合物衍生化。可以通过SDS-PAGE和质谱法密切监测缀合程度,以确保PEG分子与抗体的适当缀合。可以通过尺寸排阻或通过离子交换色谱法将未反应的PEG与抗体-PEG缀合物分离。可以使用本领域技术人员公知的方法,例如通过本文所述的免疫测定,测试PEG衍生化抗体的结合活性以及体内效果。聚乙二醇化蛋白质的方法是本领域已知的,并且可以应用于本发明的抗体及其抗原结合片段。参见,例如,Nishimura等人的EP 0154316和Ishikawa等人的EP 0401384。
其他改良的聚乙二醇化技术包括重构化学正交定向工程技术(ReCODE PEG),其经由包含tRNA合成酶和tRNA的重构系统将化学上指定的侧链掺入生物合成蛋白中。该技术能够将超过30个新氨基酸掺入大肠杆菌、酵母和哺乳动物细胞中的生物合成蛋白中。tRNA在琥珀密码子所定位的任何位置掺入规范性氨基酸,从而将琥珀从终止密码子转换成发出掺入化学上指定的氨基酸的信号的密码子。
重组聚乙二醇化技术(rPEG)也可用于血清半衰期延长。该技术一般包括将300-600个氨基酸非结构化蛋白质尾部与现有的药物蛋白质基因融合。因为这种非结构化蛋白质链的表观分子量比其实际分子量大约15倍,所以蛋白质的血清半衰期大大增加。与需要化学缀合和再纯化的传统PEG化相反,该制备过程大大简化并且产物是均匀的。
聚唾液酸化是另一种技术,它利用天然聚合物聚唾液酸(PSA)来延长活性寿命和提高治疗性肽和蛋白质的稳定性。PSA是唾液酸的聚合物(一种糖)。当用于蛋白质和治疗性肽药物递送时,聚唾液酸在缀合时提供保护性微环境。这增加了治疗性蛋白质在循环中的活性寿命并防止其被免疫系统识别。PSA聚合物天然存在于人体中。它被某些细菌采用,这些细菌已经进化了数百万年以用它来包被其细胞壁。然后,这些天然的聚唾液酸化细菌凭借分子模拟能够阻止身体的防御系统。PSA可以容易地大量产自这种细菌并具有预定的物理特征。即使与蛋白质偶联,细菌PSA也是完全非免疫原性的,因为它在化学上与人体中的PSA相同。
另一种技术包括使用与抗体连接的羟乙基淀粉(“HES”)衍生物。HES是一种源自蜡质玉米淀粉的改性天然聚合物,并可以通过人体的酶代谢。通常给予HES溶液以替代缺乏的血液体积并改善血液的流变学特性。抗体的Hes化能够通过增加分子的稳定性以及通过降低肾清除率来延长循环半衰期,从而导致生物活性增加。通过改变不同的参数如HES的分子量,可以定制多种HES抗体缀合物。
还可以生成具有增加的体内半衰期的抗体,其将一个或多个氨基酸修饰(即,取代、插入或缺失)引入IgG恒定结构域或其FcRn结合片段(优选Fc或铰链Fc结构域片段)。参见,例如,国际公开号WO98/23289;国际公布号WO 97/34631;和美国专利号6,277,375。
此外,抗体可以与白蛋白缀合,以使抗体或抗体片段在体内更稳定或在体内具有更长的半衰期。这些技术是本领域中公知的,参见例如,国际公开号WO 93/15199、WO 93/15200和WO 01/77137;和欧洲专利号EP 413,622。
增加半衰期的策略尤其可用于纳米抗体、基于纤连蛋白的结合剂以及需要增加体内半衰期的其他抗体或蛋白质。
本发明提供了抗体或其抗原结合片段,该抗体或其抗原结合片段特异性地结合与异源蛋白质或多肽(或其抗原结合片段,优选与至少10、至少20、至少30、至少40、至少50、至少60、至少70、至少80、至少90、或至少100个氨基酸的多肽)重组融合或化学缀合(包括共价和非共价缀合)的ENTPD2(例如,人ENTPD2蛋白质)的细胞外结构域以生成融合蛋白。特别地,本发明提供了融合蛋白,其包含本文所述抗体的抗原结合片段(例如,Fab片段、Fd片段、Fv片段、F(ab)
可以通过基因改组、基序改组、外显子改组和/或密码子改组(统称为“DNA改组”)的技术生成另外的融合蛋白。DNA改组可用于改变本发明的抗体及其抗原结合片段的活性(例如,具有更高亲和力和更低解离速率的抗体及其抗原结合片段)。通常参见,美国专利号5,605,793、5,811,238、5,830,721、5,834,252、和5,837,458;Patten等人,1997,Curr.Opinion Biotechnol.[当前生物技术观点]8:724-33;Harayama,1998,TrendsBiotechnol.[生物技术趋势]16(2):76-82;Hansson,等人,1999,J.Mol.Biol.[分子生物学杂志]287:265-76;以及Lorenzo和Blasco,1998,Biotechniques[生物技术]24(2):308-313)。抗体及其抗原结合片段或编码的抗体及其抗原结合片段可以通过在重组之前通过易错PCR、随机核苷酸插入或其他方法进行随机诱变来改变。编码特异性地结合ENTPD2(例如,人ENTPD2蛋白质)的抗体或其抗原结合片段的多核苷酸可以与一种或多种异源分子的一个或多个组分、基序、区域(section)、部分、结构域、片段等重组。
此外,抗体及其抗原结合片段可以与标记序列如肽融合以促进纯化。在一个实施例中,标记氨基酸序列是六组氨酸肽(SEQ ID NO:1010),如pQE运载体中提供的标签(凯杰公司(QIAGEN,Inc.),伊顿大街(Eton Avenue)9259号,查茨沃思(Chatsworth),加利福尼亚州,91311)等,其中许多是商购可得的。如Gentz等人,1989,Proc.Natl.Acad.Sci.USA[美国国家科学院院刊]86:821-824中所述,例如六组氨酸(SEQ ID NO:1010)提供了融合蛋白的方便纯化。用于纯化的其他肽标签包括但不限于对应于源自流感血凝素蛋白的表位(Wilson等人,1984,Cell 37:767)的血凝素(“HA”)标记以及“旗帜(FLAG)”标签。
在一个实施例中,本发明的抗体及其抗原结合片段与诊断剂或可检测剂缀合。这种抗体可用于监测或预后疾病或病症的发作、发展、进展和/或严重程度,其作为临床试验程序(如确定特定疗法的效果)的一部分。这种诊断和检测可以通过将抗体与可检测物质偶联来实现,该可检测物质包括但不限于各种酶,例如但不限于辣根过氧化物酶、碱性磷酸酶、β-半乳糖苷酶或乙酰胆碱酯酶;辅基,例如但不限于链霉亲和素/生物素和亲和素/生物素;荧光材料,例如但不限于伞形酮、荧光素、异硫氰酸荧光素、罗丹明、二氯三嗪基胺荧光素、丹磺酰氯或藻红蛋白;发光材料,例如但不限于鲁米诺;生物发光材料,例如但不限于荧光素酶、荧光素和水母素;放射性物质,例如但不限于碘(131I、125I、123I和121I)、碳(14C)、硫(35S)、氚(3H)、铟(115In、113In、112In和111In)、锝(99Tc)、铊(201Ti)、镓(68Ga、67Ga)、钯(103Pd)、钼(99Mo)、氙(133Xe)、氟(18F)、153Sm、177Lu、159Gd、149Pm、140La、175Yb、166Ho、90Y、47Sc、186Re、188Re、142Pr、105Rh、97Ru、68Ge、57Co、65Zn、85Sr、32P、153Gd、169Yb、51Cr、54Mn、75Se、113Sn和117Tin;以及使用各种正电子发射断层扫描的正电子发射金属和非放射性顺磁金属离子。
此外,抗体及其抗原结合片段可以与治疗部分或药物部分缀合。治疗部分或药物部分不应解释为限于经典的化学治疗剂。例如,药物部分可以是具有所需生物活性的蛋白质、肽或多肽。这种蛋白质可包括例如毒素,如相思豆毒素、蓖麻毒素A、假单胞菌外毒素、霍乱毒素或白喉毒素;蛋白质,如肿瘤坏死因子、α-干扰素、β-干扰素、神经生长因子、血小板衍生生长因子、组织纤溶酶原活化物、凋亡剂、抗血管生成剂;或生物反应调节剂如淋巴因子。
此外,抗体可以与治疗部分如放射性金属离子(如α-发射体,如213Bi)或用于将放射性金属离子(包括但不限于131In、131LU、131Y、131Ho、131Sm)与多肽缀合的大环螯合剂缀合。在一个实施例中,大环螯合剂是1,4,7,10-四氮杂环十二烷-N,N',N”,N”'-四乙酸(DOTA),其可以经由接头分子附接至抗体。这种接头分子是本领域公知的,并描述于Denardo等人,1998,Clin Cancer Res.[临床癌症研究]4(10):2483-90;Peterson等人,1999,Bioconjug.Chem.[生物缀合化学]10(4):553-7;和Zimmerman等人,1999,Nucl.Med.Biol.[核医学和生物学]26(8):943-50,这些文献中的每一个均通过引用以其全文并入。
用于将治疗部分与抗体缀合的技术是公知的,参见例如,Amon等人,“MonoclonalAntibodies For Immunotargeting Of Drugs In Cancer Therapy”[癌症疗法中用于药物免疫靶向的单克隆抗体],在Monoclonal Antibodies And Cancer Therapy[单克隆抗体和癌症疗法],Reisfeld等人,(编),第243-56页(艾伦丽思出版社公司(Alan R.Liss,Inc.)1985)中;Hellstrom等人,“Antibodies For Drug Delivery[用于药物递送的抗体]”,在Controlled Drug Delivery[药物控制释放](第2版)、Robinson等人(编),第623-53页(马塞尔德克尔出版社公司(Marcel Dekker,Inc.)1987)中;Thorpe,“Antibody Carriers OfCytotoxic Agents In Cancer Therapy:A Review[癌症疗法中细胞毒性剂的抗体载体:综述]”,在Monoclonal Antibodies[单克隆抗体]84:Biological And ClinicalApplications[生物和临床应用]、Pinchera等人(编),第475-506页(1985)中;“Analysis,Results,And Future Prospective Of The Therapeutic Use Of RadiolabeledAntibody In Cancer Therapy[放射标记的抗体在癌症疗法中的治疗用途的未来前景]”,在Monoclonal Antibodies For Cancer Detection And Therapy[用于癌症检测和治疗的单克隆抗体],Baldwin等人(编),第303-16页(Academic Press[学术出版社]1985)中以及Thorpe等人,1982,Immunol.Rev.[免疫学综述]62:119-58。
抗体也可以附接至固体支持物,这尤其科用于免疫测定或靶抗原的纯化。这种固体支持物包括但不限于玻璃、纤维素、聚丙烯酰胺、尼龙、聚苯乙烯、聚氯乙烯或聚丙烯。
编码抗体的核酸、运载体和宿主细胞
本文还提供的是编码本文所述的抗体或其抗原结合片段的核酸。此类核酸可以编码包含上述ENTPD2抗体或其抗原结合片段的区段或结构域的多肽。此类核酸或多核苷酸可编码至少一个CDR区,并且通常编码来自本文所述的ENTPD2抗体的重链或轻链的所有三个CDR区。此类核酸或多核苷酸还可以编码本文所述的ENTPD2抗体的重链和/或轻链的所有或基本上所有的可变区序列。此类核酸或多核苷酸还可以编码抗体的可变区和恒定区。由于密码的简并性,多种核酸序列将编码免疫球蛋白氨基酸序列中的每一种。例如,本发明的特征在于分别编码选自本文披露的一种或多种抗体分子的抗人ENTPD2抗体分子的重链和轻链可变区的第一和第二核酸。核酸可以包含如在表1中列出的核苷酸序列或与其基本上相同的序列(例如,与其具有至少约85%、90%、95%、或99%序列同一性,或与表1中示出的序列相差不多于3、6、15、30、或45个核苷酸的序列)。
在某些实施例中,核酸可以包含编码来自重链可变区的至少一个、两个、或三个CDR或高变环的核苷酸序列,该重链可变区具有如表1中列出的氨基酸序列,或与其基本上同源的序列(例如,与其具有至少约85%、90%、95%、或99%序列同一性的序列,和/或具有一个或多个取代,例如保守取代的序列)。在其他实施例中,核酸可以包含编码来自轻链可变区的至少一个、两个或三个CDR或高变环的核苷酸序列,该轻链可变区具有如表1中列出的氨基酸序列,或与其基本上同源的序列(例如,与其具有至少约85%、90%、95%、或99%序列同一性的序列,和/或具有一个或多个取代,例如保守取代的序列)。在又另一个实施例中,核酸可以包含编码来自重链和轻链可变区的至少一个、两个、三个、四个、五个、或六个CDR或高变环的核苷酸序列,这些重链和轻链可变区具有如在表1中列出的氨基酸序列,或与其基本上同源的序列(例如,与其具有至少约85%、90%、95%、或99%序列同一性的序列,和/或具有一个或多个取代,例如保守取代的序列)。
在某些实施例中,核酸可以包含编码来自重链可变区的至少一个、两个、或三个CDR或高变环的核苷酸序列,该重链可变区具有如在表1中列出的核苷酸序列,或与其基本上同源的序列(例如,与其具有至少约85%、90%、95%、或99%序列同一性的序列)。在另一个实施例中,核酸可以包含编码来自轻链可变区的至少一个、两个、或三个CDR或高变环的核苷酸序列,该轻链可变区具有如在表1中列出的核苷酸序列,或与其基本上同源的序列(例如,与其具有至少约85%、90%、95%、或99%序列同一性的序列)。在又另一个实施例中,核酸可以包含编码来自重链和轻链可变区的至少一个、两个、三个、四个、五个、或六个CDR或高变环的核苷酸序列,这些重链和轻链可变区具有如在表1中列出的核苷酸序列,或与其基本上同源的序列(例如,与其具有至少约85%、90%、95%、或99%序列同一性的序列)。
多核苷酸序列可以通过从头固相DNA合成或通过PCR诱变编码ENTPD2-结合抗体或其结合片段的现有序列来产生。核酸的直接化学合成可以通过本领域已知的方法完成,例如Narang等人,1979,Meth.Enzymol.[酶学方法]68:90的磷酸三酯方法;Brown等人,Meth.Enzymol.[酶学方法]68:109,1979的磷酸二酯方法;Beaucage等人,Tetra.Lett.[四面体快报],22:1859,1981的二乙基亚磷酰胺方法;和美国专利号4,458,066的固体支持方法。通过PCR向多核苷酸序列引入突变可以如以下文献中所述进行,例如PCR Technology:Principles and Applications for DNA Amplification[PCR技术:用于DNA扩增的原理和应用],H.A.Erlich(编辑),弗里曼出版社,纽约,纽约州(Freeman Press,NY,N.Y.),1992;PCR Protocols:A Guide to Methods and Applications[PCR方案:方法和应用指南],Innis等人,(编辑),学术出版社,圣地亚哥,加利福尼亚州(Academic Press,San Diego,Calif.),1990;Mattila等人,Nucleic Acids Res.[核酸研究]19:967,1991;以及Eckert等人,PCR Methods and Applications[PCR方法和应用]1:17,1991。
本文还提供了运载体(例如,表达运载体),该运载体包含编码多肽的核酸,该多肽包含本文所述的ENTPD2抗体或其抗原结合片段的区段或结构域。此类运载体可用于表达和/或产生ENTPD2-结合抗体或其抗原结合片段。术语“表达运载体”是指载体核酸分子,其中可以将所需的编码序列插入以引入可以表达它的细胞中。运载体可以是DNA运载体、RNA运载体、质粒、粘粒、或病毒运载体、或人工染色体(参见,例如,Harrington等人,Nat Genet[自然遗传学]15:345,1997)。例如,用于在哺乳动物(例如人)细胞中表达ENTPD2-结合抗体或其抗原结合片段的非病毒运载体包括pThioHis A、B和C;pcDNA3.1/His;pEBVHis A、B和C(英杰公司(Invitrogen),圣地亚哥(San Diego),加利福尼亚州(Calif.));MPSV载体;以及本领域已知的用于表达蛋白质的许多其他运载体。例如,一类运载体利用衍生自动物病毒的DNA元件,例如牛乳头瘤病毒,多瘤病毒、腺病毒、牛痘病毒、杆状病毒、逆转录酶病毒(劳氏肉瘤病毒,MMTV或MOMLV)或SV40病毒。另一类运载体利用衍生自RNA病毒的RNA元件,例如塞姆利基森林病毒(Semliki Forest virus),东部马脑炎病毒(Eastern EquineEncephalitis virus)和黄病毒。
有用的病毒运载体包括基于以下病毒中任一种的运载体:逆转录酶病毒、慢病毒、腺病毒、腺相关病毒、疱疹病毒(例如,单纯性疱疹病毒(HSV))、基于SV40的运载体、乳头状瘤病毒、HBP Epstein Barr病毒、牛痘病毒、Sinbis病毒、流感病毒、呼肠孤病毒、新城疫病毒(NDV)、麻疹病毒、水泡性口炎病毒(VSV)、细小病毒、脊髓灰质炎病毒、痘病毒、塞内卡谷病毒(Seneca Valley virus)、柯萨奇病毒、肠病毒、粘液瘤病毒、马拉巴病毒(marabavirus)、或塞姆利基森林病毒(SFV)。参见,Brent等人,同上;Smith,Annu.Rev.Microbiol.[微生物学年度评论]49:807,1995;和Rosenfeld等人,Cell[细胞]68:143,1992。
在一些实施例中,运载体是慢病毒运载体。衍生自逆转录病毒如慢病毒的运载体是实现长期基因转移的合适工具,因为它们允许转基因的长期稳定整合及其在子细胞中的繁殖。慢病毒运载体相对于衍生自肿瘤逆转录病毒如鼠白血病病毒的运载体具有附加优点,因为它们可以转导非增殖性细胞,例如肝细胞。它们还具有低免疫原性的附加优点。逆转录病毒运载体还可以是例如γ逆转录病毒运载体。γ逆转录病毒运载体可以包括例如启动子、包装信号(ψ)、引物结合位点(PBS)、一个或多个(例如两个)长末端重复序列(LTR)、和感兴趣的转基因(例如编码CAR的基因)。γ逆转录病毒运载体可能缺少病毒结构基因(如gag、pol、和env)。示例性γ逆转录病毒运载体包括鼠白血病病毒(MLV)、形成脾脏病灶病毒(SFFV)、和骨髓增殖性肉瘤病毒(MPSV),以及由其衍生的运载体。其他γ逆转录病毒载体描述于例如Tobias Maetzig等人,“Gammaretroviral Vectors:Biology,Technology andApplication[γ逆转录病毒载体:生物学/技术和应用]”Viruses.[病毒]2011年6月;3(6):677-713。
在一些实施例中,运载体是腺相关病毒(AAV)运载体,例如,重组AAV(rAAV)运载体。“AAV”是腺相关病毒的缩写,可用于指病毒本身或其衍生物。该术语涵盖所有亚型以及天然存在的和重组的形式,除非另有要求。缩写“rAAV”是指重组腺相关病毒,也称为重组AAV运载体(或“rAAV运载体”)。术语“AAV”包括例如,AAV 1型(AAV1)、AAV 2型(AAV2)、AAV 3型(AAV3)、AAV 4型(AAV4)、AAV 5型(AAV5)、AAV 6型(AAV6)、AAV 7型(AAV7)、AAV8型(AAV8)、AAV 9型(AAV9)、AAV 10型(AAV10,包括AAVrh10)、AAV 12型(AAV12)、鸟AAV、牛AAV、犬AAV、马AAV、灵长类AAV、非灵长类AAV、和绵羊AAV。“灵长类AAV”是指感染灵长类的AAV,“非灵长类AAV”是指感染非灵长类哺乳动物的AAV,“牛AAV”是指感染牛哺乳动物的AAV,等。
各种血清型AAV的基因组序列,以及天然反向末端重复序列(ITR),Rep蛋白和衣壳亚基的序列是本领域已知的。此类序列可以在文献中或在诸如GenBank的公共数据库中找到。参见,例如,GenBank登录号NC-002077(AAV1)、AF063497(AAV1)、NC-001401(AAV2)、AF043303(AAV2)、NC-001729(AAV3)、NC-001829(AAV4)、U89790(AAV4)、NC-006152(AAV5)、AF513851(AAV7)、AF513852(AAV8)、和NC-006261(AAV8);或在例如WO 2005033321(AAV1-9)的出版物中,其披露的内容通过引用结合在此。还参见,例如,Srivistava等人,(1983)J.Virology[病毒学杂志]45:555;Chiorini等人,(1998)J.Virology[病毒学杂志]71:6823;Chiorini等人,(1999)J.Virology[病毒学杂志]73:1309;Bantel-Schaal等人,(1999)J.Virology[病毒学杂志]73:939;Xiao等人,(1999)J.Virology[病毒学杂志]73:3994;Muramatsu等人,(1996)Virology[病毒学]221:208;Shade等人,(1986)J.Virol.[病毒学杂志]58:921;Gao等人,(2002)Proc.Nat.Acad.Sci.USA[美国国家科学院院刊]99:11854;Moris等人,(2004)Virology[病毒学]33:375-383;国际专利公开WO 00/28061、WO99/61601、WO 98/11244;以及美国专利号6,156,303。
如本文所用的“rAAV运载体”是指包含非AAV来源的多核苷酸序列(即,与AAV异源的多核苷酸)的AAV运载体,通常是用于细胞遗传转化的目的序列。在一些实施例中,异源多核苷酸可以侧接至少一个(有时两个)AAV反向末端重复序列(ITR)。术语rAAV运载体包括rAAV运载体颗粒和rAAV运载体质粒。rAAV运载体可以是单链(ssAAV)或自身互补序列(scAAV)。“AAV病毒”或“AAV病毒颗粒”或“rAAV运载体颗粒”是指由至少一种AAV衣壳蛋白质(通常由野生型AAV的所有衣壳蛋白质组成)和衣壳化的多核苷酸rAAV运载体组成的病毒颗粒。如果该颗粒包含异源多核苷酸(即,除了野生型AAV基因组的多核苷酸之外的,例如待递送至哺乳动物细胞的转基因),则其通常被称为“rAAV运载体颗粒”或简称为“rAAV运载体”。因此,rAAV颗粒的产生必然包括rAAV运载体的产生,因为这样的运载体包含在rAAV颗粒内。
在一些实施例中,运载体可以是含有核酸的重组DNA分子,该核酸编码结合人ENTPD2蛋白的抗体。如本文所用的“重组”是指运载体、多核苷酸、多肽或细胞是克隆;限制或连接步骤;和/或导致与自然界中发现的产物不同的构建体的其他过程的各种组合的产物(例如,涉及其中包含的多核苷酸或多肽)。重组病毒或运载体是包含重组多核苷酸的病毒颗粒。该术语分别包括原始多核苷酸构建体的复制和原始病毒构建体的重复。
重组运载体通常包括与待表达的核酸序列可操作地连接的一个或多个调节序列。术语“调节序列”包括启动子、增强子和其他表达控制元件(例如,聚腺苷酸化信号)。调节序列包括指导核苷酸序列的组成型表达的序列,以及组织特异性调节和/或诱导序列。表达运载体还可以包括设计用于优化信使RNA稳定性和宿主细胞中可翻译性的元件,和/或用于建立永久、稳定的细胞克隆的药物选择标记,这些克隆表达结合人ENTPD2蛋白的抗体。表达运载体的设计可以取决于诸如以下的这样的因素:待转化的宿主细胞的选择、所需蛋白质的表达水平等。用于生成这样的重组表达运载体的通用方法可以在以下文献中发现:Sambrook和Russell编辑.(2001)Molecular Cloning:A Laboratory Manual[分子克隆:实验室手册],第3版;Ausubel等人编辑系列(2007年更新至2010年)Current Protocols inMolecular Biology[当代分子生物学实验指南],以及本领域已知的其他方法。
“启动子”是控制序列,其是核酸序列的区域,在该区域中控制转录的起始和速率。它可能含有遗传元件,在这些元件上调节蛋白质和分子可能结合如RNA聚合酶和其他转录因子。短语“可操作地定位”、“可操作地连接”、“受控制”和“受转录控制”意指启动子处于与核酸序列相关的正确功能位置和/或方向以控制转录起始和/或该序列的表达。可以将启动子与“增强子”结合或不结合使用,该“增强子”是指参与核酸序列转录活化的顺式作用调节序列。
启动子可以是与基因或序列天然相关的启动子,如可以通过分离位于编码区段和/或外显子上游的5’非编码序列而获得。这样的启动子可以被称为“内源的”。类似地,增强子可以是与核酸序列天然相关的增强子,位于该序列的下游或上游。可替代地,通过将编码核酸区段定位在重组或异源启动子的控制下,将获得某些优点,所述重组或异源启动子是指在其天然环境中通常不与核酸序列相关的启动子。重组或异源增强子还指在其天然环境中通常不与核酸序列相关的增强子。此类启动子或增强子可以包括其他基因的启动子或增强子,以及从任何其他原核、病毒或真核细胞分离的启动子或增强子,以及非“天然存在的”启动子或增强子,即含有不同转录调节区的不同元件和/或改变表达的突变。除了合成地产生启动子和增强子的核酸序列之外,可以使用重组克隆和/或核酸扩增技术(例如PCR)结合本文公开的组合物产生序列(参见US4683202,US 5928906)。此外,预期也可以使用在非核细胞器(如线粒体,叶绿体等)中指导转录和/或序列表达的控制序列。
所用的启动子可以是组成型的、诱导型的、合成的、组织或细胞特异性的、和/或在适当的条件下用于指导所引入的DNA区段的高水平表达是有用的,例如有利于大规模生产重组蛋白和/或肽。另外,还可以掺入其他调节元件以改善编码结合人ENTPD2蛋白的抗体的核酸表达,例如增强子、核糖体结合位点、转录终止序列等。
在一些实施例中,使用组成型启动子以提供抗人ENTPD2抗体的恒定表达。组成型启动子的实例包括但不限于即时早期巨细胞病毒(CMV)启动子、猿猴病毒40(SV40)早期启动子、小鼠乳腺瘤病毒(MMTV)启动子、人免疫缺陷病毒(HIV)长末端重复序列(LTR)启动子、MoMuLV启动子、禽类白血病病毒启动子、爱泼斯坦-巴尔病毒(Epstein-Barr virus)即时早期启动子、劳斯肉瘤病毒(Rous sarcoma virus)启动子、以及人基因启动子,如但不限于肌动蛋白启动子、肌球蛋白启动子、延伸因子-1α启动子、血红蛋白启动子和肌酸激酶启动子。
诱导型启动子也被考虑作为本披露的一部分。诱导型启动子的使用提供了分子开关,该分子开关能够当需要该启动子可操作地连接的多核苷酸序列的表达时启动这种表达,或者当不需要表达时关闭表达。诱导型启动子的实例包括但不限于金属硫蛋白启动子、糖皮质激素启动子、孕酮启动子和四环素启动子。
在一些实施例中,使用组织或细胞特异性启动子从而仅在特定组织或细胞中提供抗人ENTPD2抗体的表达。组织或细胞特异性启动子或元件的特性以及表征其活性的测定法是本领域技术人员熟知的。实例包括人LIMK2基因(Nomoto等人,1999,Gene[基因],236(2):259-271)、生长激素抑制素受体2基因(Kraus等人,1998,FEES Lett.[FEES快报],428(3):165-170)、鼠科动物附睾视黄酸-结合基因(Lareyre等人,1999,J.Biol.Chem.[生物化学杂志],274(12):8282-8290)、人CD4(Zhao-Emonet等人,1998,Biochirn.Biophys.Acta[生物化学与生物物理学报],1442(2-3):109-119)、小鼠α2(XI)胶原(Tsumaki,等人,1998,J.Biol.Chem.[生物化学杂志],273(36):22861-22864)、D1A多巴胺受体基因(Lee,等人,1997,J.Auton.Nerv.Syst.[自主神经系统杂志],74(2-3):86-90)、胰岛素样生长因子II(Wu等人,1997,Biochem.Biophys.Res.Commun.[生物化学与生物物理研究通讯],233(1):221-226)、人血小板内皮细胞粘附分子-1(Almendro等人,1996,J.Immunol.[免疫学杂志],157(12):5411-5421)、肌肉肌酸激酶(MCK)启动子(Wang等人,Gene Ther.[基因治疗]2008年11月;15(22):1489-99)。
在一些实施例中,使用合成型启动子以提供抗人ENTPD2抗体的表达。合成型启动子可以显著超过天然启动子的转录效力。例如,可以选择不被内源性细胞机器或因子关闭或降低活性的合成型启动子。可以将其他元件(包括反式作用因子结合位点和增强子)插入合成型启动子中以提高转录效率。合成型启动子可以被合理设计和化学合成,以结合合成型和生物型启动子的最佳特征。将合成的寡核苷酸退火并通过若干过程连接以产生全长化学合成的启动子。合成型启动子可以是诱导型或细胞型特异性启动子。
特定的起始信号也可能需要编码序列的有效翻译。这些信号包括ATG起始密码子或相邻序列。可能需要提供外源翻译控制信号,包括ATG起始密码子。本领域普通技术人员将能够容易地确定这一点并提供必要的信号。众所周知,起始密码子必须与所需编码序列的阅读框在“框内”,以确保整个插入物的翻译。外源翻译控制信号和起始密码子可以是天然的或合成的。通过包含合适的转录增强子元件可以提高表达效率。
表达可以使用本领域已知的任何合适的宿主细胞,例如,哺乳动物宿主细胞、细菌宿主细胞、酵母宿主细胞、昆虫宿主细胞等。原核和真核表达系统都是广泛可用的。在一些实施例中,该表达系统是哺乳动物细胞表达,例如CHO细胞表达系统。在一些实施例中,可以对核酸进行密码子优化以促进在期望的宿主细胞中表达。重要的是使用启动子和/或增强子,该启动子和/或增强子有效指导DNA区段在选择用于表达的细胞类型、细胞器和生物体中的表达。分子生物学领域中的技术人员通常知道用于蛋白质表达的启动子、增强子和细胞类型组合的用途,例如,参见Sambrook等人,(2001)。
大多数转录的真核RNA分子将经历RNA剪接以从初级转录物中去除内含子。含有基因组真核生物序列的运载体可能需要供体和/或受体剪接位点以确保用于蛋白质表达的转录物的正确加工(参见Chandler等人,1997,Proc.Natl.Acad.Sci.USA[美国国家科学院院刊],94(8):3596-601)。
本披露的运载体或构建体通常包含至少一个终止信号。“终止信号”或“终止子”由参与RNA聚合酶特异性终止RNA转录物的DNA序列组成。因此,在某些实施例中,考虑了终止RNA转录物产生的终止信号。体内可能需要终止子以达到所需的信息水平。在真核系统中,终止子区还可以包含特定的DNA序列,该序列允许新转录物的位点特异性切割,从而暴露聚腺苷酸化位点。这表示特化的内源聚合酶在转录物的3’末端添加一段约200个A残基(聚A)。用这种聚A尾修饰的RNA分子似乎更稳定并且更有效地翻译。因此,在涉及真核生物的其他实施例中,优选终止子包含用于切割RNA的信号,并且更优选的是终止子信号促进信息的聚腺苷酸化。终止子和/或聚腺苷酸化位点元件可用于增强信息水平和/或使从盒到其他序列的读数最小化。预期用于本披露的终止子包括本文所述或本领域普通技术人员已知的任何已知的转录终止子,包括但不限于,例如,基因的终止序列(例如像牛生长激素终止子)或病毒终止序列(例如SV40终止子)。在某些实施例中,终止信号可以是缺乏可转录或可翻译的序列,例如由于序列截短。
在表达中,特别是真核表达中,通常将包括聚腺苷酸化信号以实现转录物的适当聚腺苷酸化。不认为聚腺苷酸化信号的性质对于本披露的成功实践是至关重要的,和/或可以采用任何这样的序列。优选的实施例包括方便和/或已知在各种靶细胞中良好地起作用的SV40聚腺苷酸化信号和/或牛生长激素聚腺苷酸化信号。聚腺苷酸化可以增加转录物的稳定性或可以促进细胞质转运。
为了在宿主细胞中繁殖运载体,它可以含有一个或多个复制位点的起点(通常称为“ori”),该起点是启动复制的特定核酸序列。可替代地,如果宿主细胞是酵母,则可以使用自主复制序列(ARS)。
在本披露的某些实施例中,可以通过在表达运载体中包括标记在体外或体内鉴定含有本披露的核酸构建体的细胞。此类标记物将赋予细胞可鉴定的变化,从而允许容易地鉴定含有表达运载体的细胞。通常,可选择标记是赋予允许选择的属性的标记。阳性可选择标记是其中标记的存在允许其选择的标记,而阴性可选择标记是其存在阻止其选择的标记。阳性可选择标记的实例是抗药性标记。
通常,包含药物选择标记有助于克隆和鉴定转化体,例如,赋予对新霉素、嘌呤霉素、潮霉素、DHFR、GPT、博莱霉素和组氨醇的抗性的基因是有用的选择标记。除了赋予允许基于条件的实施来区分转化体的表型的标记之外,还考虑了其他类型的标记,包括可筛选的标记(例如GFP),该标记是基于比色分析。可替代地,可以使用可筛选的酶,如单纯疱疹病毒的胸苷激酶(HSV-tk)或氯霉素乙酰转移酶(CAT)。本领域技术人员还将知道可能结合FACS分析如何使用免疫标记。所使用的标记物不被认为是重要的,只要它能够与编码基因产物的核酸同时表达即可。可选择和可筛选的标记的其他实例是本领域技术人员公知的。
表达运载体还可以提供分泌信号序列位置,以与通过插入的ENTPD2-结合抗体序列编码的多肽形成融合蛋白。更常见的是,所插入的ENTPD2-结合抗体序列在包含在运载体中之前与信号序列连接。用于接收编码ENTPD2-结合抗体轻链和重链可变结构域的序列的运载体有时也编码恒定区或其部分。这种运载体允许可变区表达为具有恒定区的融合蛋白,从而导致产生完整抗体及其抗原结合片段。通常,这种恒定区是人类的。
表达运载体的产生可利用包含多克隆位点(MCS)的运载体,该多克隆位点是含有多个限制酶位点的核酸区域,可以将其中任何一个与标准重组技术结合使用以消化运载体。参加Carbonelli等人,1999,Levenson等人,1998,和Cocea,1997。“限制性内切酶消化”是指用仅在核酸分子中的特定位置处起作用的酶催化切割核酸分子。这些限制性内切酶中的许多是可商购的。本领域技术人员广泛理解这些酶的用途。通常,使用在MCS内切割的限制性内切酶使运载体线性化或片段化,以使外源序列与运载体连接。“连接”是指在两个核酸片段之间形成磷酸二酯键的过程,这些核酸片段可以彼此邻接或不邻接。涉及限制性内切酶和连接反应的技术是重组技术领域的技术人员所熟知的。
用于引入含有感兴趣的多核苷酸序列的表达运载体的方法根据细胞宿主的类型而变化。例如,氯化钙转染通常用于原核细胞,而磷酸钙处理或电穿孔可用于其他细胞宿主(通常参见Sambrook等人,同上)。其他方法包括例如电穿孔、磷酸钙处理、脂质体介导的转化、注射和显微注射、冲击法/基因枪、病毒体、免疫脂质体、聚阳离子:核酸缀合物、裸DNA、人工病毒粒子、与疱疹病毒结构蛋白VP22的融合物、药剂增强的DNA摄取、离体转导、原生质体融合、逆转录转导、病毒转染、基于脂质的转染或其他常规技术。在原生质体融合的情况下,使细胞在培养基中生长并筛选适当的活性。对于重组蛋白的长期高产量生产,通常需要稳定的表达。例如,可以使用含有病毒复制起点或内源性表达元件和可选择标记基因的表达运载体来制备稳定表达多肽的细胞系。在引入运载体后,可以使细胞在富集培养基中生长1-2天,然后将它们转换为选择性培养基。所述可选择标记的目的是给选择带来阻力,并且它的存在允许能在选择性培养基中成功地表达引入的序列的细胞的生长。可以使用适合于细胞类型的组织培养技术来增殖抗性的、稳定转染的细胞。用于培养所得转染细胞和回收产生的抗体分子的方法和条件是本领域技术人员已知的,并且可以根据本说明书中所用的特定表达运载体和哺乳动物宿主细胞进行改变或优化。
本文还提供了包含本文所述的任何一种表达运载体的细胞。在一些实施例中,本披露内容的特征在于包括本文所述的核酸分子的宿主细胞。这些细胞可以是宿主细胞或治疗细胞。术语“宿主细胞”和“重组宿主细胞”在本文中可互换地使用,不仅指特定的受试细胞,而且指这种细胞的后代或潜在后代。因为某些变化可在后代中由于突变或环境影响而发生,这种子代可能在事实上与亲代细胞不同,但是仍然包括在如在此使用的术语范围内。
在一个实施例中,这些宿主细胞被基因工程化以包含编码抗体分子的核酸。在一个实施例中,通过使用表达盒使宿主细胞基因工程化。短语“表达盒”是指核苷酸序列,该序列能够影响在与这些序列相容的宿主中的基因的表达。此类盒可以包括启动子,具有或不具有内含子的开放阅读框和终止信号。还可以使用在实现表达中必需或有帮助的其他因子,例如诱导型启动子。
用于包含和表达ENTPD2-结合抗体链的宿主细胞可以是,但不限于,真核细胞或原核细胞,例如细菌细胞、昆虫细胞或人细胞。大肠杆菌是一种可用于克隆和表达本发明多核苷酸的原核宿主。适合使用的其他微生物宿主包括杆菌(如枯草杆菌)和其他肠杆菌科(如沙门氏菌属、沙雷氏菌属)以及各种假单胞菌属的种。在这些原核宿主中,还可以制备表达运载体,其通常含有与宿主细胞相容的表达控制序列(例如,复制的起点)。此外,将存在任何数量的各种公知的启动子,如乳糖启动子系统、色氨酸(trp)启动子系统、β-内酰胺酶启动子系统或来自噬菌体λ的启动子系统。启动子通常任选采用操纵基因序列控制表达且具有核糖体结合位点序列等,以用于启动和完成转录和翻译。其他微生物如酵母也可用于表达本发明的ENTPD2-结合多肽。也可以使用与杆状病毒运载体组合的昆虫细胞。合适的昆虫细胞包括,但不限于Sf9细胞。
在一个实施例中,哺乳动物宿主细胞用于表达和产生本发明的ENTPD2-结合抗体。例如,它们可以是表达内源免疫球蛋白基因的杂交瘤细胞系(例如,1D6.C9骨髓瘤杂交瘤细胞)或含有外源表达运载体的哺乳动物细胞系(例如,SP2/0骨髓瘤细胞)。这些包括任何正常的必死或正常或异常的永生的动物或人类细胞。例如,已经开发了许多能够分泌完整免疫球蛋白的合适宿主细胞系,包括CHO细胞系、各种Cos细胞系、HeLa细胞、骨髓瘤细胞系、转化的B细胞和杂交瘤。利用哺乳动物组织细胞培养表达多肽一般在例如Winnacker,FROMGENES TO CLONES[从基因到克隆],VCH出版商,纽约,纽约州,1987中讨论。哺乳动物宿主细胞的表达运载体可包括表达控制序列如复制的起点、启动子和增强子(参见例如,Queen,等人,Immunol.Rev.[免疫学评论]89:49-68,1986)和必要的处理信息位点如核糖体结合位点、RNA剪接位点、多腺苷酸化位点和转录终止子序列。这些表达运载体通常含有源自哺乳动物基因或源自哺乳动物病毒的启动子。合适的启动子可以是组成型的、细胞类型特异性的、阶段特异性的和/或可调制的或可调节的。有用的启动子包括但不限于金属硫蛋白启动子、组成型腺病毒主要晚期启动子、地塞米松诱导型MMTV启动子、SV40启动子、MRP pol III启动子、组成型MPSV启动子、四环素诱导型CMV启动子(如人类即早期CMV启动子)、组成型CMV启动子和本领域已知的启动子-增强子组合。
宿主细胞可用于产生或表达结合人ENTPD2蛋白的抗体。因此,本披露的特征还在于使用宿主细胞产生结合人ENTPD2蛋白的抗体的方法。在一个实施例中,该方法包括在合适的培养基中培养宿主细胞(其中已经引入编码抗体的重组表达运载体),从而产生结合人ENTPD2蛋白的抗体。在另一个实施例中,该方法进一步包括从培养基或宿主细胞中分离抗体。适合的真核细胞包括,但不限于Vero细胞、HeLa细胞、COS细胞、CHO细胞、HEK293细胞、BHK细胞、和MDCKII细胞。
产生单克隆抗体
单克隆抗体(mAb)可通过多种技术产生,包括常规单克隆抗体方法,例如Kohler和Milstein,1975Nature[自然]256:495的标准体细胞杂交技术。可以使用许多用于产生单克隆抗体的技术,例如B淋巴细胞的病毒或致癌转化。
用于制备杂交瘤的动物系统是鼠系统。小鼠中的杂交瘤产生是建立良好的程序。免疫方案和分离免疫脾细胞用于融合的技术是本领域已知的。融合配偶体(例如鼠骨髓瘤细胞)和融合程序也是已知的。
在一些实施例中,本发明的这些抗体是人源化的单克隆抗体。可以基于如上所述制备的鼠单克隆抗体的序列制备本发明的嵌合或人源化抗体及其抗原结合片段。编码重链和轻链免疫球蛋白的DNA可以从感兴趣的鼠杂交瘤中获得,并使用标准分子生物学技术工程化以含有非鼠(例如人)免疫球蛋白序列。例如,为了产生嵌合抗体,可以使用本领域已知的方法将鼠可变区与人恒定区连接(参见例如Cabilly等人的美国专利号4,816,567)。为产生人源化抗体,可以使用本领域已知的方法将鼠科动物CDR区域插入人框架中。参见例如,美国专利号5,225,539(属于Winter)和美国专利号5,530,101;5,585,089;5,693,762和6180370(属于Queen等人)。
在一些实施例中,本发明的这些抗体是人单克隆抗体。可以使用携带部分人免疫系统而不是小鼠系统的转基因或转染色体小鼠来生成这种针对ENTPD2的人单克隆抗体。这些转基因和转染色体小鼠包括在本文中分别称为HuMAb小鼠和KM小鼠的小鼠,并且在本文中统称为“人Ig小鼠”。
HuMAb
在一些实施例中,人抗体可以使用在转基因和转染色体上携带人免疫球蛋白序列的小鼠,如携带人重链转基因和人轻链转染色体的小鼠中产生。此类小鼠,在本文中被称为“KM小鼠”,在PCT公开WO02/43478(属于Ishida等人)中有详细描述。
仍此外,表达人免疫球蛋白基因的备选转基因动物系统是本领域可获得的,并且可用于产生ENTPD2-结合抗体及其抗原结合片段。例如,可以使用被称为Xenomouse(安根尼克斯公司(Abgenix,Inc.))的可替代的转基因系统。这样的小鼠描述于例如,美国专利号5,939,598;6,075,181;6,114,598;6,150,584和6,162,963(属于Kucherlapati等人)。
此外,表达人免疫球蛋白基因的备选转基因动物系统是本领域可获得的,并且可用于产生本发明的ENTPD2-结合抗体。例如,可以使用携带人重链转染色体和人轻链转染色体的被称为“TC小鼠”的小鼠;这样的小鼠描述于Tomizuka等人,2000Proc.Natl.Acad.Sci.USA[美国国家科学院院刊]97:722-727中。此外,本领域已经描述了携带人重链和轻链转染色体的牛(Kuroiwa等人,2002Nature Biotechnology[自然生物技术]20:889-894),并且可以用于产生本发明的ENTPD2结合抗体。
还可以使用针对筛选人免疫球蛋白基因文库的噬菌体展示方法来制备人单克隆抗体。用于分离人抗体的这种噬菌体展示方法在本领域中建立或在以下实例中描述。参见例如:美国专利号5,223,409;5,403,484;和5,571,698(属于Ladner等人);美国专利号5,427,908和5,580,717(属于Dower等人);美国专利号5,969,108和6,172,197(属于McCafferty等人);以及美国专利号5,885,793;6,521,404;6,544,731;6,555,313;6,582,915和6,593,081(属于Griffiths等人)。
本发明的人单克隆抗体也可以使用SCID小鼠制备,人免疫细胞已经重建至该SCID小鼠中,使得免疫时可以产生人抗体应答。这种小鼠描述于Wilson等人的美国专利号5,476,996和5,698,767中。
使经修饰的抗体工程化的方法
如上所述,本文所示的具有VH和VL序列或全长重链和轻链序列的ENTPD2-结合抗体可用于通过修饰全长重链和/或轻链序列、VH和/或VL序列或与其附接的一个或多个恒定区来产生新的ENTPD2-结合抗体。因此,在本发明的另一个方面,本发明的ENTPD2-结合抗体的结构特征用于产生结构上相关的ENTPD2-结合抗体,其保留本发明的抗体及其抗原结合片段的至少一种功能特性,如与人ENTPD2结合并且抑制人ENTPD2的功能特性。
例如,本发明的抗体及其抗原结合片段的一个或多个CDR区或其突变可以与已知的构架区和/或其他CDR重组组合以产生另外的重组工程化的本发明ENTPD2结合抗体及其抗原结合片段,如上所讨论。其他类型的修饰包括先前部分中描述的那些修饰。用于工程化方法的起始材料是本文提供的一种或多种VH和/或VL序列,或其一个或多个CDR区。为了产生工程化抗体,不必实际制备(即,表达为蛋白质)具有本文提供的一种或多种VH和/或VL序列的抗体,或其一个或多个CDR区。相反,一种或多种序列中包含的信息用作起始材料以产生源自一种或多种原始序列的一种或多种“第二代”序列,然后该一种或多种“第二代”序列进行制备并表达为蛋白质。
还可以通过筛选具有如US 20050255552所述的固定的CDR3序列或最小必需结合决定簇以及CDR1和CDR2序列的多样性的抗体文库来制备改变的抗体序列。所述筛选可以根据适合于筛选来自抗体文库的抗体的任何筛选技术进行,如噬菌体展示技术。
标准分子生物学技术可用于制备和表达改变的抗体序列。由一种或多种改变的抗体序列编码的抗体是保留本文所述的ENTPD2-结合抗体的一种、一些或全部功能特性的抗体,所述功能特性包括但不限于与人ENTPD2蛋白特异性结合并稳定人ENTPD2蛋白。
可以使用本领域可获得的和/或本文描述的标准测定如实例中所述的那些测定(例如,ELISA)评估改变的抗体的功能特性。
在一些实施例中,使本发明的抗体及其抗原结合片段工程化的方法中,可以沿着ENTPD2-结合抗体编码序列的全部或部分随机或选择性地引入突变,并且可以针对结合活性和/或如本文所述的其他功能特性筛选所得的经修饰的ENTPD2-结合抗体。本领域中已经描述了突变方法。例如,PCT公开WO 02/092780描述了使用饱和诱变、合成连接组装或其组合用于产生并筛选抗体突变的方法。可替代地,PCT公开WO03/074679描述了使用计算筛选方法来优化抗体的生理化学特性的方法。
抗体的特征
本发明的抗体及其抗原结合片段可通过各种功能测定来表征。例如,他们可以被表征为结合ENTPD2蛋白(例如,人ENTPD2蛋白)的能力。
抗体与ENTPD2(例如,人ENTPD2蛋白)结合的能力可以通过直接标记感兴趣的抗体来检测,或者所述抗体可以是未标记的并且使用本领域已知的各种夹心式测定形式间接检测结合。
在一些实施例中,本发明的ENTPD2-结合抗体及其抗原结合片段阻断参考ENTPD2-结合抗体结合ENTPD2蛋白(例如,人ENTPD2蛋白)或与参考ENTPD2-结合抗体竞争结合ENTPD2蛋白(例如,人ENTPD2蛋白)。这些可以是上述完全人或人源化ENTPD2-结合抗体。它们还可以是与参考抗体结合相同表位的其他人、小鼠、嵌合或人源化ENTPD2-结合抗体。阻断参考抗体结合或与参考抗体竞争结合的能力表明测试中的ENTPD2-结合抗体结合与参考抗体所定义的相同或相似的表位,或结合与参考ENTPD2-结合抗体所结合的表位足够接近的表位。这种抗体尤其可能具有针对参考抗体鉴定的有利特性。阻断参考抗体或与参考抗体竞争的能力可以通过例如竞争结合测定来确定。使用竞争结合测定,检查所述测试中的抗体抑制参考抗体与共同抗原(如ENTPD2蛋白(例如,人ENTPD2蛋白))的特异性结合的能力。如果过量的测试抗体实质上抑制参考抗体的结合,则测试抗体与参考抗体竞争与抗原的特异性结合。实质性抑制意指测试抗体通常使参考抗体的特异性结合降低至少10%、25%、50%、75%或90%。
许多已知的竞争结合测定可用于评估抗体与参考抗体竞争结合特定蛋白质,该特定蛋白质在这种情况下是ENTPD2(例如,人ENTPD2蛋白)。这些测定法包括,例如固相直接或间接放射免疫测定(RIA)、固相直接或间接酶免疫测定(EIA)、夹心式竞争测定(参见Stahli等人,Methods in Enzymology[酶学方法]9:242-253,1983);固相直接生物素-亲和素EIA(参见Kirkland等人,J.Immunol.[免疫学杂志]137:3614-3619,1986);固相直接标记测定,固相直接标记夹心式测定(参见Harlow和Lane,同上);使用I-125标记的固相直接标记RIA(参见Morel等人,Molec.Immunol.[分子免疫学]25:7-15,1988);固相直接生物素-亲和素EIA(Cheung等人,Virology[病毒学]176:546-552,1990);和直接标记的RIA(Moldenhauer等人,Scand.J.Immunol.[斯堪的纳维亚免疫学杂志]32:77-82,1990)。典型地,这种测定涉及使用结合固体表面或细胞的纯化抗原,该固体表面或细胞携带这些未标记的测试ENTPD2-结合抗体和标记的参考抗体中的任何一种。通过确定在测试抗体存在下结合固体表面或细胞的标签的量来测量竞争性抑制。通常,测试抗体过量存在。通过竞争测定(即,竞争抗体)鉴定的抗体包括与参考抗体结合相同表位的抗体和结合邻近表位的抗体,该邻近表位与参考抗体所结合的表位足够接近以发生位阻。
为了确定所选择的ENTPD2-结合单克隆抗体是否结合唯一的表位,可以使用可商购获得的试剂(例如来自伊利诺伊州罗克福德的皮尔斯公司(Pierce,Rockford,Ill.)的试剂)将每种抗体生物素化。可以使用ENTPD2蛋白包被的ELISA平板来进行使用未标记单克隆抗体和生物素化单克隆抗体的竞争研究。可以用链霉亲和素-碱性磷酸酯酶探针检测生物素化MAb结合。为确定经纯化的ENTPD2-结合抗体的同种型,可以进行同种型ELISA。例如,可用1μg/ml抗人IgG在4℃下过夜包被微量滴定板的孔。在用1%BSA封闭之后,将这些板与1μg/ml或更少的单克隆ENTPD2-结合抗体或经纯化的同种型对照在环境温度下反应1至2个小时。这些孔然后可以与人IgG1或人IgM特异性碱性磷酸酯酶缀合的探针反应。然后将板显色,并对其进行分析,以便确定纯化抗体的同种型。
为证明单克隆ENTPD2-结合抗体与表达ENTPD2蛋白(例如,人ENTPD2蛋白)的肝细胞的结合,可以使用流式细胞术。简言之,可以将表达ENTPD2的细胞系(在标准生长条件下生长)与含0.1%BSA和10%胎牛血清的PBS中各种浓度的ENTPD2-结合抗体混合,并在37℃下孵育1小时。洗涤后,细胞与荧光素标记的抗人IgG抗体在与一级抗体染色相同的条件下反应。可通过FACScan仪器使用光和侧向散射特性门控单个细胞来分析样品。(除了或者替代)流式细胞术测定,还可使用利用荧光显微术的备选测定法。可将细胞如上所述那样染色并且通过荧光显微术检查。该方法允许可视化单个细胞,但可以根据抗原的密度具有降低的灵敏度。
可以通过蛋白质印迹法进一步测试本发明的ENTPD2-结合抗体及其抗原结合片段与ENTPD2蛋白(例如,人ENTPD2蛋白)或抗原片段的反应性。简言之,可以制备经纯化的ENTPD2蛋白(例如,人ENTPD2蛋白)或融合蛋白,或来自表达ENTPD2的细胞的细胞提取物,并且进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳。电泳之后,将分离的抗原转移至硝酸纤维素膜,用10%胎牛血清进行封闭,并且用有待测试的单克隆抗体进行探测。可以使用抗人IgG碱性磷酸酯酶检测人IgG结合,并且用BCIP/NBT底物片剂(密苏里州圣路易斯的西格玛化学公司(Sigma Chem.Co.,St.Louis,Mo.))进行显色。
可以进一步测试本发明的ENTPD2-结合抗体及其抗原结合片段调节一种或多种ENTPD2活性/功能的能力。
还可以使用实例中描述的任何方法或测定测试本发明的ENTPD2-结合抗体及其抗原结合片段。
治疗方法和治疗用途
本发明的这些抗体具有许多体外和体内诊断和治疗用途,涉及诊断和治疗具有ENTPD2依赖性病理生理学的障碍。例如,可以将这些分子给予在培养基、体外或离体的细胞中,或给予人受试者(例如,体内)以用ENTPD2依赖性病理生理学治疗、预防和诊断多种障碍。因此,在一个方面,本文提供了通过向受试者给予治疗有效量的以下各项来治疗对其有需要的受试者的癌症的方法:本文所述的抗体或其抗原结合片段、编码这种抗体或抗原结合片段的核酸、含有编码这种抗体或抗原结合片段的核酸的运载体、包含这种核酸或运载体的细胞、或包含这种抗体或抗原结合片段、核酸、运载体或细胞的药物组合物。在一个方面,本发明提供抑制或减少受试者中肿瘤细胞生长的方法,该方法包括向受试者给予治疗有效量的本文披露的抗人ENTPD2抗体。
在另一个方面,提供了一种治疗受试者,例如减轻或改善受试者的过度增生性病状或障碍(例如,癌症)、例如实体瘤、血液癌、软组织肿瘤或转移性病灶的方法。
因此,在一个实施例中,本发明提供了抑制受试者中肿瘤细胞生长的方法,该方法包括将治疗有效量的一种或多种如本文所述的抗人ENTPD2抗体分子或其功能片段单独地或与其他药剂(例如治疗剂或治疗方式)组合给予受试者。
在一些实施例中,此类方法可以进一步包括测定获得自受试者(例如,受试者的组织活检)的样品中ENTPD2的表达水平的步骤。
术语“癌症”意欲包括所有类型的癌性生长或致癌性过程、转移性组织或恶性转化的细胞、组织或器官,而不考虑组织病理学类型或侵袭的阶段。癌症障碍的实例包括,但不限于实体瘤,软组织肿瘤和转移性病变。实体瘤的实例包括各种器官系统的恶性肿瘤,例如肉瘤、腺癌和癌,如影响肝、肺、乳腺、淋巴、胃肠(例如结肠)、泌尿生殖道(例如,肾、尿路上皮细胞)、前列腺和咽的那些。腺癌包括恶性肿瘤,例如大多数结肠癌、直肠癌、肾细胞癌、肝癌(肝肿瘤,例如晚期肝肿瘤,具有或不具有病毒感染,例如慢性病毒性肝炎)、肺的非小细胞癌、小肠癌和食道癌。鳞状细胞癌包括恶性肿瘤,例如在肺、食管、皮肤、头颈部区域、口腔、肛门和子宫颈中。
还可以使用本发明的方法和组合物治疗或预防前述癌症的转移性病灶。
可以使用本文披露的抗体分子抑制其生长的示例性癌症包括通常对免疫疗法有应答的癌症。用于治疗的优选癌症的非限制性实例包括胃肠癌(例如胃部(胃)癌、结肠直肠癌(CRC))、食管癌(例如食管鳞状细胞癌(ESCC))、胰腺癌和胆管癌。另外,可以使用本文描述的抗体分子来治疗难治性或复发性恶性肿瘤。
可以治疗的其他癌症的实例包括肺癌(例如,非小细胞肺癌(NSCLC)(例如,具有鳞状和/或非鳞状组织学的NSCLC,或NSCLC腺癌))、黑素瘤(例如,晚期黑素瘤)、肾癌(例如,肾细胞癌、例如,透明细胞肾细胞癌)、肝癌、骨髓瘤(例如,多发性骨髓瘤)、前列腺癌、乳腺癌(例如,不表达雌激素受体、孕酮受体、或Her2/neu的一种、两种或所有的乳腺癌,例如,三阴性乳腺癌)、胰腺癌、头颈癌(例如头颈部鳞状细胞癌(HNSCC))、肛门癌、胃食管癌、甲状腺癌、宫颈癌、淋巴增生性疾病(例如,移植后淋巴增生性疾病)或血液癌、T细胞淋巴瘤、非霍奇金氏淋巴瘤、或白血病(例如,骨髓性白血病)、骨癌、胰腺癌、皮肤癌、头癌或颈部癌、皮肤或眼内恶性黑素瘤、子宫癌、卵巢癌、直肠癌、肛门癌、胃食管癌、胃癌、睾丸癌、子宫癌、输卵管癌、子宫内膜癌、宫颈癌、阴道癌、外阴癌、霍奇金病、非霍奇金淋巴瘤、骨髓瘤(例如,多发性骨髓瘤)、食管癌、小肠癌,内分泌系统癌,甲状腺癌,甲状旁腺癌,肾上腺癌,软组织肉瘤,尿道癌、阴茎癌,慢性或急性白血病(包括急性骨髓性白血病、慢性骨髓性白血病、急性淋巴细胞白血病、慢性淋巴细胞性白血病)、儿童实体瘤,淋巴细胞性淋巴瘤,膀胱癌,肾癌(例如肾癌,例如肾细胞癌(RCC)(例如,转移性RCC或透明细胞肾细胞癌))、输尿管癌、肾盂癌、中枢神经系统瘤(CNS)、原发性CNS淋巴瘤、肿瘤血管生成、脊髓轴肿瘤、脑干胶质瘤、垂体腺瘤、卡波西肉瘤、表皮样癌、鳞状细胞癌、T细胞淋巴瘤、环境诱导的癌症(包括由石棉诱导的癌症),和所述癌症的组合。
在一些实施例中,此处的疗法可用于治疗患有(或被鉴定为具有)与感染相关的癌症(例如,病毒或细菌感染)的患者。示例性癌症包括宫颈癌、肛门癌、HPV相关的头颈部鳞状细胞癌、HPV相关的食管乳头状瘤、HHV6相关的淋巴瘤、EBV相关的淋巴瘤(包括伯基特淋巴瘤)、胃MALT淋巴瘤、其他感染相关的MALT淋巴瘤、HCC、和卡波西氏肉瘤。
在其他实施例中,癌症是血液恶性肿瘤或癌症,包括但不限于白血病或淋巴瘤。例如,可以将抗人ENTPD2抗体分子或其抗原结合片段单独地或与其他药剂(例如治疗剂)组合用于治疗癌症和恶性肿瘤,包括但不限于例如,急性白血病,包括但不限于但不限于,例如,B细胞急性淋巴细胞性白血病(“BALL”)、T细胞急性淋巴细胞性白血病(“TALL”)、急性淋巴细胞性白血病(ALL);一种或多种慢性白血病,包括但不限于例如慢性髓细胞性白血病(CML)、慢性淋巴细胞性白血病(CLL);另外的血液癌症或血液病状包括但不限于,例如B细胞幼淋巴细胞性白血病、母细胞性浆细胞样树突细胞肿瘤、伯基特淋巴瘤、弥漫性大B细胞淋巴瘤、滤泡性淋巴瘤、毛细胞白血病、小细胞或大细胞滤泡性淋巴瘤、恶性淋巴组织增生性病状、MALT淋巴瘤、套细胞淋巴瘤、边缘区淋巴瘤、多发性骨髓瘤、骨髓增生异常和骨髓增生异常综合征、非霍奇金淋巴瘤、浆母细胞性淋巴瘤、浆细胞样树突细胞肿瘤、瓦尔登斯特伦巨球蛋白血症、和为由骨髓血细胞的无效产生(或发育异常)联合在一起的各种血液病状集合的“白血病前期”等。
在一个实施例中,癌症选自结肠癌(例如结肠直肠癌(CRC)或结肠直肠腺癌)、胃癌(例如胃腺癌,胃癌)、食道癌(例如食道鳞状细胞癌(ESCC))、胰腺癌、胆管癌、肺癌(例如,小细胞肺癌)、乳腺癌(例如,乳腺腺癌)或卵巢癌。
在一个实施例中,癌症是结肠直肠癌(CRC)或结肠直肠腺癌。
在另一个实施例中,癌症是胃癌。
在又另一个实施例中,癌症是食管鳞状细胞癌(ESCC)。
在又另一个实施例中,癌症过表达ENTPD2(ENTPD2阳性/ENTPD2+),例如ENTPD2+CRC、ENTPD2+胃癌(例如,ENTPD2胃癌)、ENTPD2+食管鳞状细胞癌(ENTPD2+ESCC)。
可以将以下各项通过静脉内、瘤内或皮下途径给予受试者:本文所述的抗体或其抗原结合片段;编码这种抗体或抗原结合片段的核酸;或包含编码这种抗体或抗原结合片段的核酸的运载体或细胞;或包含这种抗体或抗原结合片段、核酸、运载体、或细胞的药物组合物。在一些实施例中,将这种抗体或其片段、核酸、运载体、细胞或药物组合物静脉内给予。
还提供的是用于在治疗癌症中使用的本文所述的抗体或其抗原结合片段、包含这种抗体或抗原结合片段的药物组合物、编码这种抗体或抗原结合片段的核酸、或包含编码这种抗体或抗原结合片段的核酸的运载体。
本披露还包括在生产用于治疗癌症的药物中使用的本文所述的抗体或其抗原结合片段、包含这种抗体或抗原结合片段的药物组合物、编码这种抗体或抗原结合片段的核酸、或包含编码这种抗体或抗原结合片段的核酸的运载体。
上述各种处理可以与另一种处理组合。本披露还涉及药物组合物,该药物组合物包含根据本文所述的本披露的组合,特别是与其在癌症治疗中同时、分别或相继使用(尤其是共同活性)的说明书一起。例如,可以将本文所述的ENTPD2抗体或其抗原结合片段与以下的一种或多种组合:护理治疗的标准品(例如,针对癌症)、另一种抗体分子、免疫调节剂(例如,共刺激性分子的活化剂或共抑制性分子的抑制剂);疫苗,例如治疗性癌症疫苗;或如下所述的其他形式的细胞疗法。
因此,治疗本文所述的癌症的方法可以进一步包括将至少一种另外的治疗剂给予对其有需要的受试者。本文还提供了治疗癌症的方法,该方法包括将至少两种另外的治疗剂给予对其有需要的受试者。
术语“组合”是指一种剂量单位形式的固定组合,或组合给予(其中本发明的化合物与至少一种组合配偶体(partner)(例如下文所解释的至少一种其他的药物,也称为一种或多种“治疗剂”或“共同药剂(co-agent)”)可以在同一时间独立地给予或在时间间隔内分开地给予,特别是在这些时间间隔允许组合配偶体显示协作,例如协同效应的情况下)。单个组分可以包装在一个试剂盒中或分开包装。可在给予之前将一种或两种组分(例如粉末或液体)重构或稀释至所希望的剂量。如本文所用,术语“共同给予”或“组合给予”等意在涵盖将所选择的组合配偶体给予至对其有需要的单个受试者(例如患者),并且旨在包括其中药剂不一定通过相同的给予途径给予或同时给予的治疗方案。如本文所用,术语“药物组合”意指由多于一种治疗剂的混合或组合所产生的产品,并且包括治疗剂的固定和非固定组合两者。术语“固定组合”意指治疗剂(例如,本发明的化合物和组合配偶体)以单一实体或剂量的形式同时地给予至患者。术语“非固定组合”意指治疗剂(例如,本发明的化合物和至少一种组合配偶体)作为分开的实体同时地、并行地或依序地给予至患者(没有特定的时间限制),其中这种给予在患者体内提供治疗有效水平的至少两种化合物。后者也适用于鸡尾酒疗法,例如三种或更多种治疗剂的给予。
如本文所用,术语“药物组合物”是指在一个剂量单位形式中的固定组合或用于组合给予的非固定组合或试剂盒,其中两种或更多种治疗剂可以在同一时间独立地给予或在时间间隔内分开地给予,特别是在这些时间间隔允许组合配偶体显示协作,例如协同效应的情况下。
术语“组合疗法”是指给予两种或更多种治疗剂以治疗在本披露中描述的所治疗的病情或障碍。这种给予涵盖以基本上同时的方式共同给予这些治疗剂,如以具有固定比率活性成分的单个胶囊给予。可替代地,这种给予涵盖在多个容器中或在每种活性成分的独立容器(例如,片剂、胶囊、粉末、和液体)中共同给予。可以将粉末和/或液体在给予之前重构或稀释到所需的剂量。此外,这类给予也涵盖在大致相同的时间或在不同的时间顺序使用每种类型的治疗剂。在任何一种情况下,治疗方案将在治疗本文所述的病症或障碍方面提供药物组合的有益作用。
可以将抗人ENTPD2抗体分子与其他疗法组合使用。例如,组合疗法可包括与一种或多种另外的治疗剂共同配制和/或共同给予的本发明的组合物,例如,一种或多种抗癌剂、细胞毒剂或细胞抑制剂、激素治疗、疫苗和/或其他免疫疗法。在其他实施例中,抗体分子与其他治疗性治疗方式组合给予,包括手术、放射、冷冻手术和/或热疗。此类组合疗法可以有利地使用较低剂量的所给予的治疗剂,从而避免与各种单一疗法相关的可能的毒性或并发症。
“与……组合”并不旨在暗示必需同时给予这些治疗剂或治疗性药剂和/或配制其用于一起递送,尽管这些递送方法也在本文所述的范围内。
抗人ENTPD2抗体分子可以与至少一种或多种其他另外的疗法或治疗剂同时、在其之前或之后给予。可以按任何顺序给予抗人ENTPD2抗体分子和其他至少一种药剂或治疗方案。通常,每种药剂将以针对该药剂确定的剂量和/或日程表给予。还应理解,该组合中使用的至少一种另外的治疗剂可以以单一组合物一起给予或以不同组合物分开给予。通常,预期组合中使用的其他治疗剂的以不超过它们单独使用时的水平使用。在一些实施例中,组合中使用的水平将低于单独使用的水平。
因此,本披露尤其涉及用于同时、分开或顺序使用的组合产品,例如组合制剂或药物固定组合,或这些制剂和组合的组合。
在某些实施例中,将本文所述的这些抗人ENTPD2分子与至少一种腺苷A2A受体(A2AR)拮抗剂组合给予。在某些实施例中,本文所述的这些抗人ENTPD2分子与至少两种腺苷A2A受体(A2AR)拮抗剂组合给予。示例性A2AR拮抗剂包括,但不限于例如,PBF509/NIR178(帕罗生物制药公司/诺华公司(Palobiofarma/Novartis))、CPI444/V81444(卡沃斯公司/基因泰克公司(Corvus/Genentech))、AZD4635/HTL-1071(阿斯利康公司/海普泰公司(AstraZeneca/Heptares))、维帕迪南(Redox/Juno)、GBV-2034(Globavir)、AB928(阿克斯生物科学公司(Arcus Biosciences))、茶碱、伊曲茶碱(协和发酵工业株式会社(KyowaHakko Kogyo))、托扎迪南/SYN-115(Acorda)、KW-6356(协和发酵工业株式会社(KyowaHakko Kogyo))、ST-4206(理地安生物科学公司(Leadiant Biosciences))、和普瑞迪南/SCH 420814(默克公司/谢林公司(Merck/Schering))。
在某些实施例中,该A2AR拮抗剂是PBF509/NIR178。PBF509/NIR178和其他A2AR拮抗剂在US 8,796,284和WO 2017/025918中披露,这些申请通过引用以其全文并入。在某些实施例中,该A2AR拮抗剂是5-溴-2,6-二-(1H-吡唑-1-基)嘧啶-4-胺、或其药学上可接受的盐。在某些实施例中,该A2AR拮抗剂具有以下结构:
在某些实施例中,该A2AR拮抗剂是CPI444/V81444。CPI-444和其他A2AR拮抗剂在WO 2009/156737中披露,该申请通过引用以其全文并入本文。在某些实施例中,该A2AR拮抗剂是(S)-7-(5-甲基呋喃-2-基)-3-((6-(((四氢呋喃-3-基)氧基)甲基)吡啶-2-基)甲基)-3H-[1,2,3]三唑并[4,5-d]嘧啶-5-胺,或其药学上可接受的盐。在某些实施例中,该A2AR拮抗剂是(R)-7-(5-甲基呋喃-2-基)-3-((6-(((四氢呋喃-3-基)氧基)甲基)吡啶-2-基)甲基)-3H-[1,2,3]三唑并[4,5-d]嘧啶-5-胺,或其外消旋物,或其药学上可接受的盐。在某些实施例中,该A2AR拮抗剂是7-(5-甲基呋喃-2-基)-3-((6-(((四氢呋喃-3-基)氧基)甲基)吡啶-2-基)甲基)-3H-[1,2,3]三唑并[4,5-d]嘧啶-5-胺,或其药学上可接受的盐。在某些实施例中,该A2AR拮抗剂具有以下结构:
在某些实施例中,A2AR拮抗剂是AZD4635/HTL-1071。A2AR拮抗剂在WO 2011/095625中披露,该申请通过引用以其全文并入本文。在某些实施例中,该A2AR拮抗剂是6-(2-氯-6-甲基吡啶-4-基)-5-(4-氟苯基)-1,2,4-三嗪-3-胺,或其药学上可接受的盐。在某些实施例中,该A2AR拮抗剂具有以下结构:
在某些实施例中,该A2AR拮抗剂是ST-4206(理地安生物科学公司(LeadiantBiosciences))。在某些实施例中,该A2AR拮抗剂是在US 9,133,197中描述的A2AR拮抗剂,该申请通过引用以其全文并入本文。在某些实施例中,该A2AR拮抗剂具有以下结构:
在某些实施例中,该A2AR拮抗剂是在US 8114845、US 9029393、US 20170015758、或US 20160129108中描述的A2AR拮抗剂,通过引用以其全文并于本文中。
在某些实施例中,该A2AR拮抗剂是伊曲茶碱(CAS登记号:155270-99-8)。伊曲茶碱也称为KW-6002或8-[(E)-2-(3,4-二甲氧基苯基)乙烯基]-1,3-二乙基-7-甲基-3,7-二氢-1H-嘌呤-2,6-二酮。例如,在LeWitt等人,(2008)Annals of Neurology[神经病学年鉴]63(3):295-302)中披露了伊曲茶碱。
在某些实施例中,该A2aR拮抗剂是托扎迪南(Biotie)。托扎迪南也称为SYN115或4-羟基-N-(4-甲氧基-7-吗啉-4-基-1,3-苯并噻唑-2-基)-4-甲基哌啶-1-甲酰胺。托扎迪南阻断在A2a受体上的内源性腺苷的作用,导致多巴胺对D2受体的作用增强,并抑制mGluR5受体上的谷氨酸的作用。在一些实施例中,该A2aR拮抗剂是普瑞迪南(CAS登记号:377727-87-2)。普瑞迪南也称为SCH 420814或2-(2-呋喃基)-7-[2-[4-[4-(2-甲氧基乙氧基)苯基]-1-哌嗪基]乙基]7H-吡唑并[4,3-e][1,2,4]三唑并[1,5-c]嘧啶-5-胺。普瑞迪南被开发为一种药物,可作为腺苷A2A受体的有效和选择性拮抗剂。
在某些实施例中,该A2aR拮抗剂是维帕迪南。维帕迪南也称为BIIB014、V2006、或3-[(4-氨基-3-甲基苯基)甲基]-7-(呋喃-2-基)三唑并[4,5-d]嘧啶-5-胺。
其他示例性A2aR拮抗剂包括例如,ATL-444、MSX-3、SCH-58261、SCH-412,348、SCH-442,416、VER-6623、VER-6947、VER-7835、CGS-15943、或ZM-241,385。
在一些实施例中,A2aR拮抗剂是A2aR途径拮抗剂,例如,CD-73抑制剂,例如,抗CD73抗体。通过CD73靶向腺苷的细胞外产生可降低腺苷的免疫抑制作用。抗CD73抗体具有一系列活性,例如,抑制CD73外核苷酸酶活性,减轻AMP介导的淋巴细胞抑制,以及抑制同基因肿瘤生长。抗CD73抗体可以驱动肿瘤微环境中骨髓和淋巴浸润白细胞群的变化。这些变化包括例如CD8效应细胞和活化的巨噬细胞的增加,以及髓源性抑制细胞(MDSC)和调节性T淋巴细胞的比例的减少。在一个实施例中,抗CD73抗体分子是完整的抗体分子或其抗原结合片段。在一些实施例中,该抗CD73抗体分子选自表2中列出的任何抗体分子。在其他实施例中,抗CD73抗体分子包含如在表2中披露的重链可变结构域序列、轻链可变结构域序列、或二者。在某些实施例中,该抗CD73抗体分子结合CD73蛋白质并减少例如,抑制或拮抗CD73(例如,人CD73)的活性。
在一个实施例中,该抗CD73抗体分子是在WO 2016/075099中披露的抗CD73抗体,该申请通过引用以其全文并入本文。在一个实施例中,该抗CD73抗体分子是MEDI 9447,例如,如披露于WO 2016/075099中。MEDI 9447的可替代的名称包括克隆10.3或73combo3。MEDI 9447是IgG1抗体,该抗体抑制例如,拮抗CD73的活性。MEDI 9447和其他抗CD73抗体分子还披露于WO 2016/075176和US 2016/0129108中,这些申请的全部内容通过引用以其全文并于本文中。
在一个实施例中,抗CD73抗体分子包含MEDI 9477的重链可变结构域、轻链可变结构域、或二者。MEDI 9477的重链可变结构域的氨基酸序列被披露为SEQ ID NO:295(参见表2)。MEDI 9477的轻链可变结构域的氨基酸序列被披露为SEQ ID NO:296(参见表2)。
在一个实施例中,该抗CD73抗体分子是在WO 2016/081748中披露的抗CD73抗体,该申请通过引用以其全文并入本文。在一个实施例中,抗CD73抗体分子是11F11,例如,如披露于WO 2016/081748中。11F11是IgG2抗体,该抗体抑制例如,拮抗CD73的活性。衍生自11F11的抗体,例如,CD73.4和CD73.10;11F11的克隆,例如,11F11-1和11F11-2;和披露于WO2016/081748和US 9,605,080中的其他抗CD73抗体分子,这些申请的全部内容通过引用以其全文并于本文中。
在一个实施例中,抗CD73抗体分子包含11F11-1或11F11-2的重链可变结构域、轻链可变结构域、或二者。11F11-1的重链可变结构域的氨基酸序列被披露为SEQ ID NO:302(参见表2)。11F11-1的轻链可变结构域的氨基酸序列被披露为SEQ ID NO:303(参见表2)。11F11-2的重链可变结构域的氨基酸序列被披露为SEQ ID NO:299(参见表2)。11F11-2的轻链可变结构域的氨基酸序列被披露为SEQ ID NO:300(参见表2)。在一个实施例中,抗CD73抗体分子包含11F11-1或11F11-2的重链、轻链、或二者。11F11-1的重链和轻链氨基酸序列分别被披露为SEQ ID NO:297和SEQ ID NO:301(参见表2)。11F11-2的重链和轻链氨基酸序列分别被披露为SEQ ID NO:294和SEQ ID NO:298(参见表2)。
在一个实施例中,该抗CD73抗体分子是在例如,US 9,605,080中披露的抗CD73抗体,该申请通过引用以其全文并入本文。
在一个实施例中,抗CD73抗体分子是CD73.4,例如,如披露于US 9,605,080。在一个实施例中,抗CD73抗体分子包含CD73.4的重链可变结构域、轻链可变结构域、或二者。CD73.4的重链可变结构域的氨基酸序列被披露为SEQ ID NO:304(参见表2)。11F11-2的轻链可变结构域的氨基酸序列被披露为SEQ ID NO:305(参见表2)。
在一个实施例中,抗CD73抗体分子是CD73.10,例如,如披露于US 9,605,080中。在一个实施例中,抗CD73抗体分子包含CD73.10的重链可变结构域、轻链可变结构域、或二者。CD73.10的重链可变结构域的氨基酸序列被披露为SEQ ID NO:306(参见表2)。CD73.10的轻链可变结构域的氨基酸序列被披露为SEQ ID NO:307(参见表2)。
在一个实施例中,该抗CD73抗体分子是在WO 2009/0203538中披露的抗CD73抗体,该申请通过引用以其全文并入本文。在一个实施例中,抗CD73抗体分子是067-213,例如,如披露于WO 2009/0203538中。
在一个实施例中,抗CD73抗体分子包含067-213的重链可变结构域、轻链可变结构域、或二者。067-213的重链可变结构域的氨基酸序列被披露为SEQ ID NO:308(参见表2)。067-213的轻链可变结构域的氨基酸序列被披露为SEQ ID NO:309(参见表2)。
在一个实施例中,该抗CD73抗体分子是在US 9,090,697中披露的抗CD73抗体,该申请通过引用以其全文并入本文。在一个实施例中,抗CD73抗体分子是TY/23,例如,如披露于US 9,090,697中。在一个实施例中,抗CD73抗体分子包含TY/23的重链可变结构域、轻链可变结构域、或二者。
在一个实施例中,该抗CD73抗体分子是在WO 2016/055609中披露的抗CD73抗体,该申请通过引用以其全文并入本文。在一个实施例中,抗CD73抗体分子包含WO 2016/055609中披露的抗CD73抗体的重链可变结构域、轻链可变结构域、或二者。
在一个实施例中,该抗CD73抗体分子是在WO 2016/146818中披露的抗CD73抗体,该申请通过引用以其全文并入本文。在一个实施例中,抗CD73抗体分子包含在WO 2016/146818中披露的抗CD73抗体的重链可变结构域、轻链可变结构域、或二者。
在一个实施例中,该抗CD73抗体分子是在WO 2004/079013中披露的抗CD73抗体,该申请通过引用以其全文并入本文。在一个实施例中,抗CD73抗体分子包含在WO 2004/079013中披露的抗CD73抗体的重链可变结构域、轻链可变结构域、或二者。
在一个实施例中,该抗CD73抗体分子是在WO 2012/125850中披露的抗CD73抗体,该申请通过引用以其全文并入本文。在一个实施例中,抗CD73抗体分子包含在WO 2012/125850中披露的抗CD73抗体的重链可变结构域、轻链可变结构域、或二者。
在一个实施例中,该抗CD73抗体分子是在WO 2015/004400中披露的抗CD73抗体,该申请通过引用以其全文并入本文。在一个实施例中,抗CD73抗体分子包含在WO 2015/004400中披露的抗CD73抗体的重链可变结构域、轻链可变结构域、或二者。
在一个实施例中,该抗CD73抗体分子是在WO 2007/146968中披露的抗CD73抗体,该申请通过引用以其全文并入本文。在一个实施例中,抗CD73抗体分子包含在WO2007146968中披露的抗CD73抗体的重链可变结构域、轻链可变结构域、或二者。
在一个实施例中,该抗CD73抗体分子是在US 2007/0042392中披露的抗CD73抗体,该申请通过引用以其全文并入本文。在一个实施例中,抗CD73抗体分子包含在US 2007/0042392中披露的抗CD73抗体的重链可变结构域、轻链可变结构域、或二者。
在一个实施例中,该抗CD73抗体分子是在US 2009/0138977中披露的抗CD73抗体,该申请通过引用以其全文并入本文。在一个实施例中,抗CD73抗体分子包含在US 2009/0138977中披露的抗CD73抗体的重链可变结构域、轻链可变结构域、或二者。
在一个实施例中,该抗CD73抗体分子是在Flocke等人,Eur J Cell Biol.[欧洲细胞生物学杂志]1992年6月;58(1):62-70中披露的抗CD73抗体,该文献通过引用以其全文并入本文。在一个实施例中,抗CD73抗体分子包含在Flocke等人,Eur J Cell Biol.[欧洲细胞生物学杂志]1992年6月;58(1):62-70中披露的抗CD73抗体的重链可变结构域、轻链可变结构域、或二者。
在一个实施例中,抗CD73抗体分子是在Stagg等人,PNAS.[美国国家科学院院刊]2010年1月107(4):1547-1552中披露的抗CD73抗体,该文献通过引用以其全文并入本文。在一些实施例中,抗CD73抗体分子是如在Stagg等人中披露的TY/23或TY11.8.在一个实施例中,抗CD73抗体分子包含在Stagg等人中披露的抗CD73抗体的重链可变结构域、轻链可变结构域、或二者。
在一个实施例中,将如本文所述的抗人ENTPD2抗体与例如如本文所述的抗CD73抗体分子和A2AR拮抗剂组合给予,该拮抗剂任选地选自下组,该组由以下各项组成:PBF509/NIR178、CPI444/V81444、AZD4635/HTL-1071、维帕迪南、GBV-2034、AB928、茶碱、伊曲茶碱、托扎迪南/SYN-115、KW-6356、ST-4206、和普瑞迪南/SCH 420814。
表2.示例性抗CD73抗体分子的序列
本文披露的组合疗法中使用的抗CD73抗体分子可以包括表2中公开的任何VH/VL序列,或与其基本上相同的氨基酸序列(例如,与其具有至少80%、85%、90%、95%、99%或更高同一性)。CD73抗体的示例性序列包括:
(i)分别针对MEDI 9447,SEQ ID NO:295-296的VH和VL氨基酸序列,或与其基本上相同的氨基酸序列(例如,与SEQ ID NO:295-296具有至少80%、85%、90%、95%、99%或更高同一性);
(ii)分别针对11F11-2,SEQ ID NO:297-298的HC和LC氨基酸序列,或与其基本上相同的氨基酸序列(例如,与SEQ ID NO:297-298具有至少80%、85%、90%、95%、99%或更高同一性);
(iii)分别针对11F11-2,SEQ ID NO:299-300的VH和VL氨基酸序列,或与其基本上相同的氨基酸序列(例如,与SEQ ID NO:299-300具有至少80%、85%、90%、95%、99%或更高同一性);
(iv)分别针对11F11-1,SEQ ID NO:297和301的HC和LC氨基酸序列,或与其基本上相同的氨基酸序列(例如,与SEQ ID NO:297和301具有至少80%、85%、90%、95%、99%或更高同一性);
(v)分别针对11F11-1,SEQ ID NO:302-303的VH和VL氨基酸序列,或与其基本上相同的氨基酸序列(例如,与SEQ ID NO:302-303具有至少80%、85%、90%、95%、99%或更高同一性);
(vi)分别针对CD73.4,SEQ ID NO:304-305的VH和VL氨基酸序列,或与其基本上相同的氨基酸序列(例如,与SEQ ID NO:304-305具有至少80%、85%、90%、95%、99%或更高同一性);
(vii)分别针对CD73.10,SEQ ID NO:306-307的VH和VL氨基酸序列,或与其基本上相同的氨基酸序列(例如,与SEQ ID NO:306-307具有至少80%、85%、90%、95%、99%或更高同一性);或
(viii)分别针对067-213,SEQ ID NO:308-309的VH和VL氨基酸序列,或与其基本上相同的氨基酸序列(例如,与SEQ ID NO:308-309具有至少80%、85%、90%、95%、99%或更高同一性)。
如本文所述的抗人ENTPD2抗体可以与以下各项组合:共抑制性分子的抑制剂(例如,PD-1抑制剂(例如,抗PD-1抗体分子)、PD-L1抑制剂(例如,抗PD-L1抗体分子)、PD-L2抑制剂(例如,抗PD-L2抗体分子)、LAG-3抑制剂(例如,抗LAG-3抗体分子)、TIM-3抑制剂(例如,抗TIM-3抗体分子))、共刺激性分子的活化剂(例如,GITR激动剂(例如,抗GITR抗体分子))、细胞因子(例如,IL-15与IL-15受体α(IL-15Ra)的可溶形式复合)、或其任何组合。
在某些实施例中,将如本文所述的ENTPD2抗体与PD-1抑制剂组合给予。在一些实施例中,PD-1抑制剂选自PDR001(诺华公司(Novartis))、纳武单抗(百时美施贵宝公司)、派姆单抗(默克公司(Merck&Co))、匹地利珠单抗(CureTech公司)、MEDI0680(医学免疫公司)、REGN2810(再生元公司(Regeneron))、TSR-042(Tesaro公司)、PF-06801591(辉瑞制药公司(Pfizer))、BGB-A317(百济神州公司(Beigene))、BGB-108(百济神州公司)、INCSHR1210(因赛特公司(Incyte))、或AMP-224(Amplimmune公司)。
示例性PD-1抑制剂
在一个实施例中,该PD-1抑制剂是抗PD-1抗体分子。在一个实施例中,PD-1抑制剂是抗PD-1抗体分子,如题为“PD-1的抗体分子及其用途”的2015年7月30日公布的US 2015/0210769中所述,该文献通过引用以其全文并入。
在一个实施例中,抗PD-1抗体分子包含来自重链和轻链可变区的至少一个、两个、三个、四个、五个或六个互补决定区(CDR)(或总体上全部CDR),该重链和轻链可变区包含表3(例如,来自表3中披露的BAP049-克隆-E或BAP049-克隆-B的重链和轻链可变区序列)中所示的氨基酸序列,或由表3中所示的核苷酸序列编码。在一些实施例中,这些CDR根据卡巴特定义(例如,如表3中所列出的)。在一些实施例中,这些CDR根据乔西亚定义(例如,如在表3中所列出的)。在一些实施例中,这些CDR根据卡巴特和乔西亚二者的组合CDR定义(例如,如表3中所列出的)。在一个实施例中,VH CDR1的卡巴特和乔西亚CDR的组合包含氨基酸序列GYTFTTYWMH(SEQ ID NO:541)。在一个实施例中,相对于表3中所示的氨基酸序列,或由表3中所示的核苷酸序列编码的,CDR中的一个或多个(或总体上全部CDR)具有一个、两个、三个、四个、五个、六个或更多个变化,例如氨基酸取代(例如,保守氨基酸取代)或缺失。
在一个实施例中,抗PD-1抗体分子包含:含有SEQ ID NO:501的VHCDR1氨基酸序列、SEQ ID NO:502的VHCDR2氨基酸序列、和SEQ ID NO:503的VHCDR3氨基酸序列的重链可变区(VH);以及含有SEQ ID NO:510的VLCDR1氨基酸序列、SEQ ID NO:511的VLCDR2氨基酸序列、和SEQ ID NO:512的VLCDR3氨基酸序列的轻链可变区(VL),各自披露于表3中。
在一个实施例中,抗体分子包含:含有由SEQ ID NO:524的核苷酸序列编码的VHCDR1、由SEQ ID NO:525的核苷酸序列编码的VHCDR2、和由SEQ ID NO:526的核苷酸序列编码的VHCDR3的VH;以及含有由SEQ ID NO:529的核苷酸序列编码的VLCDR1、由SEQ ID NO:530的核苷酸序列编码的VLCDR2、和由SEQ ID NO:531的核苷酸序列编码的VLCDR3的VL,各自披露于表3中。
在一个实施例中,抗PD-1抗体分子包含VH,该VH含有SEQ ID NO:506的氨基酸序列,或与SEQ ID NO:506具有至少85%、90%、95%、或99%或更高同一性的氨基酸序列。在一个实施例中,抗PD-1抗体分子包含VL,该VL含有SEQ ID NO:520的氨基酸序列,或与SEQID NO:520具有至少85%、90%、95%、或99%或更高同一性的氨基酸序列。在一个实施例中,抗PD-1抗体分子包含VL,该VL含有SEQ ID NO:516的氨基酸序列,或与SEQ ID NO:516具有至少85%、90%、95%、或99%或更高同一性的氨基酸序列。在一个实施例中,抗PD-1抗体分子包含:含有SEQ ID NO:506的氨基酸序列的VH和含有SEQ ID NO:520的氨基酸序列的VL。在一个实施例中,抗PD-1抗体分子包含:含有SEQ ID NO:506的氨基酸序列的VH和含有SEQ ID NO:516的氨基酸序列的VL。
在一个实施例中,抗体分子包含VH,该VH由SEQ ID NO:507的核苷酸序列,或与SEQID NO:507具有至少85%、90%、95%、或99%或更高同一性的核苷酸序列编码。在一个实施例中,抗体分子包含VL,该VL由SEQ ID NO:521或517的核苷酸序列,或与SEQ ID NO:521或517具有至少85%、90%、95%、或99%或更高同一性的核苷酸序列。在一个实施例中,抗体分子包含由SEQ ID NO:507的核苷酸序列编码的VH和由SEQ ID NO:521或517的核苷酸序列编码的VL。
在一个实施例中,抗PD-1抗体分子包含重链,该重链含有SEQ ID NO:508的氨基酸序列,或与SEQ ID NO:508具有至少85%、90%、95%、或99%或更高同一性的氨基酸序列。在一个实施例中,抗PD-1抗体分子包含轻链,该轻链含有SEQ ID NO:522的氨基酸序列,或与SEQ ID NO:522具有至少85%、90%、95%、或99%或更高同一性的氨基酸序列。在一个实施例中,抗PD-1抗体分子包含轻链,该轻链含有SEQ ID NO:518的氨基酸序列,或与SEQ IDNO:518具有至少85%、90%、95%、或99%或更高同一性的氨基酸序列。在一个实施例中,抗PD-1抗体分子包含:含有SEQ ID NO:508的氨基酸序列的重链和含有SEQ ID NO:522的氨基酸序列的轻链。在一个实施例中,抗PD-1抗体分子包含:含有SEQ ID NO:508的氨基酸序列的重链和含有SEQ ID NO:518的氨基酸序列的轻链。
在一个实施例中,抗体分子包含重链,该重链由SEQ ID NO:509的核苷酸序列,或与SEQ ID NO:509具有至少85%、90%、95%、或99%或更高同一性的核苷酸序列编码。在一个实施例中,抗体分子包含轻链,该轻链由SEQ ID NO:523或519的核苷酸序列,或与SEQ IDNO:523或519具有至少85%、90%、95%、或99%或更高同一性的核苷酸序列。在一个实施例中,抗体分子包含由SEQ ID NO:509的核苷酸序列编码的重链和由SEQ ID NO:523或519的核苷酸序列编码的轻链。
本文所述的这些抗体分子可以通过运载体、宿主细胞、和在US2015/0210769中描述的方法制得,该申请通过引用以其全文并入。
表3.示例性抗PD-1抗体分子的氨基酸和核苷酸序列
在一个实施例中,抗PD-1抗体分子是纳武单抗(Bristol-Myers Squibb),也称为MDX-1106、MDX-1106-04、ONO-4538、BMS-936558、或
在一个实施例中,该抗PD-1抗体分子是派姆单抗(默克公司(Merck&Co)),也称为Lambrolizumab、MK-3475、MK03475、SCH-900475、或
在一个实施例中,该抗PD-1抗体分子是匹地利珠单抗(CureTech),也称为CT-011。匹地利珠单抗和其他抗PD-1抗体披露于Rosenblatt,J.等人,(2011)J Immunotherapy[免疫疗法杂志]34(5):409-18;US7,695,715;US 7,332,582;和US 8,686,119中,这些文献通过引用以其全文并入。在一个实施例中,抗PD-1抗体分子包含以下的一种或多种:匹地利珠单抗的CDR序列(或总体上全部CDR序列)、重链或轻链可变区序列、或重链或轻链序列,例如,如表4中所披露的。
在一个实施例中,抗PD-1抗体分子是MEDI0680(医学免疫公司),也称为AMP-514。MEDI0680和其他抗PD-1抗体在US 9,205,148和WO2012/145493中披露,这些文献通过引用以其全文并入。在一个实施例中,抗PD-1抗体分子包含以下中的一个或多个:MEDI0680的CDR序列(或总体上全部CDR序列)、重链或轻链可变区序列、或重链或轻链序列。
在一个实施例中,抗PD-1抗体分子是REGN2810(再生元公司)。在一个实施例中,抗PD-1抗体分子包含以下中的一个或多个:REGN2810的CDR序列(或总体上全部CDR序列)、重链或轻链可变区序列、或重链或轻链序列。
在一个实施例中,抗PD-1抗体分子是PF-06801591(辉瑞公司)。在一个实施例中,抗PD-1抗体分子包含以下中的一个或多个:PF-06801591的CDR序列(或总体上全部CDR序列)、重链或轻链可变区序列、或重链或轻链序列。
在一个实施例中,抗PD-1抗体分子是BGB-A317或BGB-108(百济神州公司)。在一个实施例中,抗PD-1抗体分子包含以下中的一个或多个:BGB-A317或BGB-108的CDR序列(或总体上全部CDR序列)、重链或轻链可变区序列、或重链或轻链序列。
在一个实施例中,抗PD-1抗体分子是INCSHR1210(Incyte公司),也称为INCSHR01210或SHR-1210。在一个实施例中,抗PD-1抗体分子包含以下中的一个或多个:INCSHR1210的CDR序列(或总体上全部CDR序列)、重链或轻链可变区序列、或重链或轻链序列。
在一个实施例中,抗PD-1抗体分子是TSR-042(Tesaro公司),也称为ANB011。在一个实施例中,抗PD-1抗体分子包含以下中的一个或多个:TSR-042的CDR序列(或总体上全部CDR序列)、重链或轻链可变区序列、或重链或轻链序列。
其他已知的抗PD-1抗体包括描述于例如以下中的那些:WO2015/112800、WO 2016/092419、WO 2015/085847、WO 2014/179664、WO 2014/194302、WO 2014/209804、WO 2015/200119、US 8,735,553、US 7,488,802、US 8,927,697、US 8,993,731、和US 9,102,727,这些文献通过引用以其全文并入。
在一个实施例中,抗PD-1抗体是与本文所述的抗PD-1抗体之一竞争与PD-1上的相同表位结合和/或结合PD-1上的相同表位的抗体。
在一个实施例中,PD-1抑制剂是例如如美国8,907,053中所述抑制PD-1信号传导途径的肽,该文献通过引用以其全文并入。在一个实施例中,PD-1抑制剂是免疫粘附素(例如包含融合到恒定区(例如免疫球蛋白序列的Fc区)的PD-L1或PD-L2的细胞外或PD-1结合部分的免疫粘附素)。在一个实施例中,该PD-1抑制剂是AMP-224(B7-DCIg(安普利公司(Amplimmun)),例如,披露于WO 2010/027827和WO2011/066342中,通过引用以其全文并入)。
表4.其他示例性抗PD-1抗体分子的氨基酸序列
在一个实施例中,将如本文所述的抗人ENTPD2抗体与如本文所述的至少一种PD1抑制剂和如本文所述的至少一种A2A受体拮抗剂组合给予。
在某些实施例中,将如本文所述的抗人ENTPD2抗体与PD-L1抑制剂组合给予。该PD-L1抑制剂可以是抗体、其抗原结合片段、免疫黏附素、融合蛋白、或寡肽。在一些实施例中,该PD-L1抑制剂选自FAZ053(诺华公司(Novartis));阿特利珠单抗,也称为
示例性PD-L1抑制剂
在一个实施例中,该PD-L1抑制剂是抗PD-L1抗体分子。在一个实施例中,该PD-L1抑制剂是抗PD-L1抗体分子,如在题为“PD-L1的抗体分子及其用途”的2016年4月21日公开的US 2016/0108123中所披露,该文献通过引用以其全文并入。
在一个实施例中,抗PD-L1抗体分子包含来自重链和轻链可变区的至少一个、两个、三个、四个、五个或六个互补决定区(CDR)(或总体上全部CDR),该重链和轻链可变区包含表5(例如,来自表5中披露的BAP058-克隆O或BAP058-克隆N的重链和轻链可变区序列)中所示的氨基酸序列,或由表5中所示的核苷酸序列编码。在一些实施例中,这些CDR根据卡巴特定义(例如,如表5中所列出的)。在一些实施例中,这些CDR根据乔西亚定义(例如,如在表5中所列出的)。在一些实施例中,这些CDR根据卡巴特和乔西亚二者的组合CDR定义(例如,如表5中所列出的)。在一个实施例中,VH CDR1的卡巴特和乔西亚CDR的组合包含氨基酸序列GYTFTSYWMY(SEQ ID NO:647)。在一个实施例中,相对于表5中所示的氨基酸序列,或由表5中所示的核苷酸序列编码的,CDR中的一个或多个(或总体上全部CDR)具有一个、两个、三个、四个、五个、六个或更多个变化,例如氨基酸取代(例如,保守氨基酸取代)或缺失。
在一个实施例中,该抗PD-L1抗体分子包含:含有SEQ ID NO:601的VHCDR1氨基酸序列、SEQ ID NO:602的VHCDR2氨基酸序列、和SEQ ID NO:603的VHCDR3氨基酸序列的重链可变区(VH);以及含有SEQ ID NO:609的VLCDR1氨基酸序列、SEQ ID NO:610的VLCDR2氨基酸序列、和SEQ ID NO:611的VLCDR3氨基酸序列的轻链可变区(VL),各自披露于表5中。
在一个实施例中,该抗PD-L1抗体分子包含:含有由SEQ ID NO:628的核苷酸序列编码的VHCDR1、由SEQ ID NO:629的核苷酸序列编码的VHCDR2、和由SEQ ID NO:630的核苷酸序列编码的VHCDR3的VH;以及含有由SEQ ID NO:633的核苷酸序列编码的VLCDR1、由SEQID NO:634的核苷酸序列编码的VLCDR2、和由SEQ ID NO:635的核苷酸序列编码的VLCDR3的VL,各自披露于表5中。
在一个实施例中,抗PD-L1抗体分子包含VH,该VH含有SEQ ID NO:606的氨基酸序列,或与SEQ ID NO:606具有至少85%、90%、95%、或99%或更高同一性的氨基酸序列。在一个实施例中,抗PD-L1抗体分子包含VL,该VL含有SEQ ID NO:616的氨基酸序列,或与SEQID NO:616具有至少85%、90%、95%、或99%或更高同一性的氨基酸序列。在一个实施例中,抗PD-L1抗体分子包含VH,该VH含有SEQ ID NO:620的氨基酸序列,或与SEQ ID NO:620具有至少85%、90%、95%、或99%或更高同一性的氨基酸序列。在一个实施例中,抗PD-L1抗体分子包含VL,该VL含有SEQ ID NO:624的氨基酸序列,或与SEQ ID NO:624具有至少85%、90%、95%、或99%或更高同一性的氨基酸序列。在一个实施例中,该抗PD-L1抗体分子包含:含有SEQ ID NO:606的氨基酸序列的VH和含有SEQ ID NO:616的氨基酸序列的VL。在一个实施例中,该抗PD-L1抗体分子包含:含有SEQ ID NO:620的氨基酸序列的VH和含有SEQ ID NO:624的氨基酸序列的VL。
在一个实施例中,抗体分子包含VH,该VH由SEQ ID NO:607的核苷酸序列,或与SEQID NO:607具有至少85%、90%、95%、或99%或更高同一性的核苷酸序列编码。在一个实施例中,抗体分子包含VL,该VL由SEQ ID NO:617的核苷酸序列,或与SEQ ID NO:617具有至少85%、90%、95%、或99%或更高同一性的核苷酸序列编码。在一个实施例中,抗体分子包含VH,该VH由SEQ ID NO:621的核苷酸序列,或与SEQ ID NO:621具有至少85%、90%、95%、或99%或更高同一性的核苷酸序列编码。在一个实施例中,抗体分子包含VL,该VL由SEQ IDNO:625的核苷酸序列,或与SEQ ID NO:625具有至少85%、90%、95%、或99%或更高同一性的核苷酸序列编码。在一个实施例中,该抗体分子包含由SEQ ID NO:607的核苷酸序列编码的VH和由SEQ ID NO:617的核苷酸序列编码的VL。在一个实施例中,该抗体分子包含由SEQID NO:621的核苷酸序列编码的VH和由SEQ ID NO:625的核苷酸序列编码的VL。
在一个实施例中,抗PD-L1抗体分子包含重链,该重链含有SEQ ID NO:608的氨基酸序列,或与SEQ ID NO:608具有至少85%、90%、95%、或99%或更高同一性的氨基酸序列。在一个实施例中,抗PD-L1抗体分子包含轻链,该轻链含有SEQ ID NO:618的氨基酸序列,或与SEQ ID NO:618具有至少85%、90%、95%、或99%或更高同一性的氨基酸序列。在一个实施例中,抗PD-L1抗体分子包含重链,该重链含有SEQ ID NO:622的氨基酸序列,或与SEQ ID NO:622具有至少85%、90%、95%、或99%或更高同一性的氨基酸序列。在一个实施例中,抗PD-L1抗体分子包含轻链,该轻链含有SEQ ID NO:626的氨基酸序列,或与SEQ IDNO:626具有至少85%、90%、95%、或99%或更高同一性的氨基酸序列。在一个实施例中,该抗PD-L1抗体分子包含:含有SEQ ID NO:608的氨基酸序列的重链和含有SEQ ID NO:618的氨基酸序列的轻链。在一个实施例中,该抗PD-L1抗体分子包含:含有SEQ ID NO:622的氨基酸序列的重链和含有SEQ ID NO:626的氨基酸序列的轻链。
在一个实施例中,抗体分子包含重链,该重链由SEQ ID NO:615的核苷酸序列,或与SEQ ID NO:615具有至少85%、90%、95%、或99%或更高同一性的核苷酸序列编码。在一个实施例中,抗体分子包含轻链,该轻链由SEQ ID NO:619的核苷酸序列,或与SEQ ID NO:619具有至少85%、90%、95%、或99%或更高同一性的核苷酸序列编码。在一个实施例中,抗体分子包含重链,该重链由SEQ ID NO:623的核苷酸序列,或与SEQ ID NO:623具有至少85%、90%、95%、或99%或更高同一性的核苷酸序列编码。在一个实施例中,抗体分子包含轻链,该轻链由SEQ ID NO:627的核苷酸序列,或与SEQ ID NO:627具有至少85%、90%、95%、或99%或更高同一性的核苷酸序列编码。在一个实施例中,该抗体分子包含由SEQ IDNO:615的核苷酸序列编码的重链和由SEQ ID NO:619的核苷酸序列编码的轻链。在一个实施例中,该抗体分子包含由SEQ ID NO:623的核苷酸序列编码的重链和由SEQ ID NO:627的核苷酸序列编码的轻链。
本文所述的这些抗体分子可以通过运载体、宿主细胞、和在US2016/0108123中描述的方法制得,该申请通过引用以其全文并入。
表5.示例性抗PD-L1抗体分子的氨基酸和核苷酸序列
其他示例性PD-L1抑制剂
在一个实施例中,该抗PD-L1抗体分子是阿特利珠单抗(基因泰克公司/罗氏公司(Genentech/Roche)),也称为MPDL3280A、RG7446、RO5541267、YW243.55.S70、或TECENTRIQ
在一个实施例中,该抗PD-L1抗体分子是阿维鲁单抗(默克雪兰诺公司(MerckSerono)和辉瑞制药公司(Pfizer)),也称为MSB0010718C或
在一个实施例中,该抗PD-L1抗体分子是度伐鲁单抗(米迪缪尼有限公司/阿斯利康公司(MedImmune/AstraZeneca)),也称为MEDI4736或
在一个实施例中,该抗PD-L1抗体分子是BMS-936559(百时美施贵宝公司(Bristol-Myers Squibb)),也称为MDX-1105或12A4。BMS-936559和其他抗PD-L1抗体披露在US 7,943,743和WO2015/081158中,这些申请通过引起以其全文并入。在一个实施例中,该抗PD-L1抗体分子包含以下的一种或多种:BMS-936559的CDR序列(或总体上全部CDR序列)、重链或轻链可变区序列、或重链或轻链序列,例如,在表6中所披露的。
其他已知的抗PD-L1抗体包括描述于例如以下中的那些:WO2015/181342、WO2014/100079、WO 2016/000619、WO 2014/022758、WO 2014/055897、WO 2015/061668、WO2013/079174、WO 2012/145493、WO 2015/112805、WO 2015/109124、WO 2015/195163、US 8,168,179、US 8,552,154、US 8,460,927、和US 9,175,082,这些文献通过引用以其全文并入。
在一个实施例中,抗PD-1抗体是与本文所述的抗PD-L1抗体之一竞争与PD-L1上的相同表位结合和/或结合PD-L1上的相同表位的抗体。
表6.其他示例性抗PD-L1抗体分子的氨基酸序列
在一个实施例中,如本文所述的抗人ENTPD2抗体与如本文所述的至少一种PD-L1抑制剂和如本文所述的至少一种A2A受体拮抗剂组合给予。
在某些实施例中,将本文所述的抗人ENTPD2抗体与LAG-3抑制剂组合给予。该LAG-3抑制剂可以是抗体、其抗原结合片段、免疫黏附素、融合蛋白、或寡肽。在一些实施例中,该LAG-3抑制剂选自LAG525(诺华公司(Novartis))、BMS-986016(百时美施贵宝公司(Bristol-Myers Squibb)、TSR-033(Tesaro公司)、MK-4280(默克公司(Merck&Co))、或REGN3767(再生元公司(Regeneron))。
示例性LAG-3抑制剂
在一个实施例中,该LAG-3抑制剂是抗LAG-3抗体分子。在一个实施例中,该LAG-3抑制剂是抗LAG-3抗体分子,如在题为“LAG-3的抗体分子及其用途”的2015年9月17日公开的US 2015/0259420中所披露,该文献通过引用以其全文并入。
在一个实施例中,该抗LAG-3抗体分子包含来自重链和轻链可变区的至少一个、两个、三个、四个、五个或六个互补决定区(CDR)(或总体上全部CDR),该重链和轻链可变区包含表7(例如,来自表7中披露的BAP050-克隆I或BAP050-克隆J的重链和轻链可变区序列)中所示的氨基酸序列,或由表7中所示的核苷酸序列编码。在一些实施例中,这些CDR根据卡巴特定义(例如,如表7中所列出的)。在一些实施例中,这些CDR根据乔西亚定义(例如,如表7中所列出的)。在一些实施例中,这些CDR根据卡巴特和乔西亚二者的组合CDR定义(例如,如表7中所列出的)。在一个实施例中,VH CDR1的卡巴特和乔西亚CDR的组合包含氨基酸序列GFTLTNYGMN(SEQ ID NO:766)。在一个实施例中,相对于表7中所示的氨基酸序列,或由表7中所示的核苷酸序列编码的,CDR中的一个或多个(或总体上全部CDR)具有一个、两个、三个、四个、五个、六个或更多个变化,例如氨基酸取代(例如,保守氨基酸取代)或缺失。
在一个实施例中,抗LAG-3抗体分子包含:含有SEQ ID NO:701的VHCDR1氨基酸序列、SEQ ID NO:702的VHCDR2氨基酸序列、和SEQ ID NO:703的VHCDR3氨基酸序列的重链可变区(VH);以及含有SEQ ID NO:710的VLCDR1氨基酸序列、SEQ ID NO:711的VLCDR2氨基酸序列、和SEQ ID NO:712的VLCDR3氨基酸序列的轻链可变区(VL),各自披露于表7中。
在一个实施例中,抗LAG-3抗体分子包含:VH,该VH含有由SEQ ID NO:736或737的核苷酸序列编码的VHCDR1、由SEQ ID NO:738或739的核苷酸序列编码的VHCDR2、和由SEQID NO:740或741的核苷酸序列编码的VHCDR3;以及VL,该VL含有由SEQ ID NO:746或747的核苷酸序列编码的VLCDR1、由SEQ ID NO:748或749的核苷酸序列编码的VLCDR2、和由SEQID NO:750或751的核苷酸序列编码的VLCDR3,这些序列各自披露于表7中。在一个实施例中,抗LAG-3抗体分子包含:VH,该VH含有由SEQ ID NO:758或737的核苷酸序列编码的VHCDR1、由SEQ ID NO:759或739的核苷酸序列编码的VHCDR2、和由SEQ ID NO:760或741的核苷酸序列编码的VHCDR3;以及VL,该VL含有由SEQ ID NO:746或747的核苷酸序列编码的VLCDR1、由SEQ ID NO:748或749的核苷酸序列编码的VLCDR2、和由SEQ ID NO:750或751的核苷酸序列编码的VLCDR3,这些序列各自披露于表7中。
在一个实施例中,抗LAG-3抗体分子包含VH,该VH含有SEQ ID NO:706的氨基酸序列,或与SEQ ID NO:706具有至少85%、90%、95%、或99%或更高同一性的氨基酸序列。在一个实施例中,抗LAG-3抗体分子包含VL,该VL含有SEQ ID NO:718的氨基酸序列,或与SEQID NO:718具有至少85%、90%、95%、或99%或更高同一性的氨基酸序列。在一个实施例中,抗LAG-3抗体分子包含VH,该VH含有SEQ ID NO:724的氨基酸序列,或与SEQ ID NO:724具有至少85%、90%、95%、或99%或更高同一性的氨基酸序列。在一个实施例中,抗LAG-3抗体分子包含VL,该VL含有SEQ ID NO:730的氨基酸序列,或与SEQ ID NO:730具有至少85%、90%、95%、或99%或更高同一性的氨基酸序列。在一个实施例中,抗LAG-3抗体分子包含:含有SEQ ID NO:706的氨基酸序列的VH和含有SEQ ID NO:718的氨基酸序列的VL。在一个实施例中,抗LAG-3抗体分子包含:含有SEQ ID NO:724的氨基酸序列的VH和含有SEQID NO:730的氨基酸序列的VL。
在一个实施例中,抗体分子包含VH,该VH由SEQ ID NO:707或708的核苷酸序列,或与SEQ ID NO:707或708具有至少85%、90%、95%、或99%或更高同一性的核苷酸序列编码。在一个实施例中,抗体分子包含VL,该VL由SEQ ID NO:719或720的核苷酸序列,或与SEQID NO:719或720具有至少85%、90%、95%、或99%或更高同一性的核苷酸序列。在一个实施例中,抗体分子包含VH,该VH由SEQ ID NO:725或726的核苷酸序列,或与SEQ ID NO:725或726具有至少85%、90%、95%、或99%或更高同一性的核苷酸序列编码。在一个实施例中,抗体分子包含VL,该VL由SEQ ID NO:731或732的核苷酸序列,或与SEQ ID NO:731或732具有至少85%、90%、95%、或99%或更高同一性的核苷酸序列。在一个实施例中,抗体分子包含由SEQ ID NO:707或708的核苷酸序列编码的VH和由SEQ ID NO:719或720的核苷酸序列编码的VL。在一个实施例中,抗体分子包含由SEQ ID NO:725或726的核苷酸序列编码的VH和由SEQ ID NO:731或732的核苷酸序列编码的VL。
在一个实施例中,抗LAG-3抗体分子包含重链,该重链含有SEQ ID NO:709的氨基酸序列,或与SEQ ID NO:709具有至少85%、90%、95%、或99%或更高同一性的氨基酸序列。在一个实施例中,抗LAG-3抗体分子包含轻链,该轻链含有SEQ ID NO:721的氨基酸序列,或与SEQ ID NO:721具有至少85%、90%、95%、或99%或更高同一性的氨基酸序列。在一个实施例中,抗LAG-3抗体分子包含重链,该重链含有SEQ ID NO:727的氨基酸序列,或与SEQ ID NO:727具有至少85%、90%、95%、或99%或更高同一性的氨基酸序列。在一个实施例中,抗LAG-3抗体分子包含轻链,该轻链含有SEQ ID NO:733的氨基酸序列,或与SEQ IDNO:733具有至少85%、90%、95%、或99%或更高同一性的氨基酸序列。在一个实施例中,抗LAG-3抗体分子包含:含有SEQ ID NO:709的氨基酸序列的重链和含有SEQ ID NO:721的氨基酸序列的轻链。在一个实施例中,抗LAG-3抗体分子包含:含有SEQ ID NO:727的氨基酸序列的重链和含有SEQ ID NO:733的氨基酸序列的轻链。
在一个实施例中,抗体分子包含重链,该重链由SEQ ID NO:716或717的核苷酸序列,或与SEQ ID NO:716或717具有至少85%、90%、95%、或99%或更高同一性的核苷酸序列编码。在一个实施例中,抗体分子包含轻链,该轻链由SEQ ID NO:722或723的核苷酸序列,或与SEQ ID NO:722或723具有至少85%、90%、95%、或99%或更高同一性的核苷酸序列。在一个实施例中,抗体分子包含重链,该重链由SEQ ID NO:728或729的核苷酸序列,或与SEQ ID NO:728或729具有至少85%、90%、95%、或99%或更高同一性的核苷酸序列编码。在一个实施例中,抗体分子包含轻链,该轻链由SEQ ID NO:734或735的核苷酸序列,或与SEQ ID NO:734或735具有至少85%、90%、95%、或99%或更高同一性的核苷酸序列。在一个实施例中,抗体分子包含由SEQ ID NO:716或717的核苷酸序列编码的重链和由SEQ IDNO:722或723的核苷酸序列编码的轻链。在一个实施例中,抗体分子包含由SEQ ID NO:728或729的核苷酸序列编码的重链和由SEQ ID NO:734或735的核苷酸序列编码的轻链。
本文所述的这些抗体分子可以通过运载体、宿主细胞、和在US2015/0259420中描述的方法制得,该申请通过引用以其全文并入。
表7.示例性抗LAG-3抗体分子的氨基酸和核苷酸序列
其他示例性LAG-3抑制剂
在一个实施例中,该抗LAG-3抗体分子是BMS-986016(百时美施贵宝公司(Bristol-Myers Squibb)),也称为BMS986016。BMS-986016和其他抗LAG-3抗体披露在WO2015/116539和US 9,505,839中,这些申请通过引用以其全文并入。在一个实施例中,该抗LAG-3抗体分子包含以下的一种或多种:BMS-986016的CDR序列(或总体上全部CDR序列)、重链或轻链可变区序列、或重链或轻链序列,例如,在表8中所披露的。
在一个实施例中,该抗LAG-3抗体分子是TSR-033(Tesaro公司)。在一个实施例中,该抗LAG-3抗体分子包含以下的一种或多种:TSR-033的CDR序列(或总体上全部CDR序列)、重链或轻链可变区序列、或重链或轻链序列。
在一个实施例中,该抗LAG-3抗体分子是MK-4280(默克公司(Merck&Co))。在一个实施例中,该抗LAG-3抗体分子包含以下的一种或多种:MK-4280的CDR序列(或总体上全部CDR序列)、重链或轻链可变区序列、或重链或轻链序列。
在一个实施例中,该抗LAG-3抗体分子是REGN3767(再生元公司(Regeneron))。在一个实施例中,该抗LAG-3抗体分子包含以下的一种或多种:REGN3767的CDR序列(或总体上全部CDR序列)、重链或轻链可变区序列、或重链或轻链序列。
在一个实施例中,该抗LAG-3抗体分子是IMP731或GSK2831781(GSK和普瑞马生物医药公司(Prima BioMed))。IMP731和其他抗LAG-3抗体披露在WO 2008/132601和US 9,244,059中,这些文献通过引用以其全文并入。在一个实施例中,该抗LAG-3抗体分子包含以下的一种或多种:IMP731的CDR序列(或总体上全部CDR序列)、重链或轻链可变区序列、或重链或轻链序列,例如,在表8中所披露的。在一个实施例中,该抗LAG-3抗体分子包含以下的一种或多种:GSK2831781的CDR序列(或总体上全部CDR序列)、重链或轻链可变区序列、或重链或轻链序列。
在一个实施例中,该抗LAG-3抗体分子是IMP761(普瑞马生物医药公司(PrimaBioMed))。在一个实施例中,该抗LAG-3抗体分子包含以下的一种或多种:IMP761的CDR序列(或总体上全部CDR序列)、重链或轻链可变区序列、或重链或轻链序列。
其他已知的抗LAG-3抗体可以在例如,WO 2008/132601、WO 2010/019570、WO2014/140180、WO 2015/116539、WO 2015/200119、WO 2016/028672、US 9,244,059、US 9,505,839中描述的那些,这些文献通过引用以其全文并入。
在一个实施例中,抗LAG-3抗体是与本文所述的抗LAG-3抗体之一竞争与LAG-3上的相同表位结合和/或结合LAG-3上的相同表位的抗体。
在一个实施例中,该抗LAG-3抑制剂是可溶性LAG-3蛋白质,例如,IMP321(普瑞马生物医药公司(Prima BioMed)),例如,如披露于WO 2009/044273中,通过引用以其全文并入。
表8.其他示例性抗LAG-3抗体分子的氨基酸序列
在某些实施例中,将如本文所述的抗人ENTPD2抗体与TIM-3抑制剂组合给予。该TIM-3抑制剂可以是抗体、其抗原结合片段、免疫黏附素、融合蛋白、或寡肽。在一些实施例中,该TIM-3抑制剂选自MBG453(诺华公司(Novartis)、TSR-022(Tesaro公司)或LY3321367(礼来制药公司(Eli Lilly))。
示例性TIM-3抑制剂
在一个实施例中,该TIM-3抑制剂是抗TIM-3抗体分子。在一个实施例中,该TIM-3抑制剂是抗TIM-3抗体分子,如在题为“TIM-3的抗体分子及其用途”的2015年8月6日公开的US 2015/0218274中所披露,该文献通过引用以其全文并入。
在一个实施例中,该抗TIM-3抗体分子包含来自重链和轻链可变区的至少一个、两个、三个、四个、五个或六个互补决定区(CDR)(或总体上全部CDR),该重链和轻链可变区包含表9(例如,来自表9中披露的ABTIM3-hum11或ABTIM3-hum03的重链和轻链可变区序列)中所示的氨基酸序列,或由表9中所示的核苷酸序列编码。在一些实施例中,这些CDR根据卡巴特定义(例如,如表9中所列出的)。在一些实施例中,这些CDR根据乔西亚定义(例如,如表9中所列出的)。在一个实施例中,相对于表9中所示的氨基酸序列,或由表9中所示的核苷酸序列编码的,CDR中的一个或多个(或总体上全部CDR)具有一个、两个、三个、四个、五个、六个或更多个变化,例如氨基酸取代(例如,保守氨基酸取代)或缺失。
在一个实施例中,抗TIM-3抗体分子包含:含有SEQ ID NO:801的VHCDR1氨基酸序列、SEQ ID NO:802的VHCDR2氨基酸序列、和SEQ ID NO:803的VHCDR3氨基酸序列的重链可变区(VH);以及含有SEQ ID NO:810的VLCDR1氨基酸序列、SEQ ID NO:811的VLCDR2氨基酸序列、和SEQ ID NO:812的VLCDR3氨基酸序列的轻链可变区(VL),各自披露于表9中。在一个实施例中,该抗TIM-3抗体分子包含:含有SEQ ID NO:801的VHCDR1氨基酸序列、SEQ ID NO:820的VHCDR2氨基酸序列、和SEQ ID NO:803的VHCDR3氨基酸序列的重链可变区(VH);以及含有SEQ ID NO:810的VLCDR1氨基酸序列、SEQ ID NO:811的VLCDR2氨基酸序列、和SEQ IDNO:812的VLCDR3氨基酸序列的轻链可变区(VL),各自披露于表9中。
在一个实施例中,抗TIM-3抗体分子包含VH,该VH含有SEQ ID NO:806的氨基酸序列,或与SEQ ID NO:806具有至少85%、90%、95%、或99%或更高同一性的氨基酸序列。在一个实施例中,抗TIM-3抗体分子包含VL,该VL含有SEQ ID NO:816的氨基酸序列,或与SEQID NO:816具有至少85%、90%、95%、或99%或更高同一性的氨基酸序列。在一个实施例中,抗TIM-3抗体分子包含VH,该VH含有SEQ ID NO:822的氨基酸序列,或与SEQ ID NO:822具有至少85%、90%、95%、或99%或更高同一性的氨基酸序列。在一个实施例中,抗TIM-3抗体分子包含VL,该VL含有SEQ ID NO:826的氨基酸序列,或与SEQ ID NO:826具有至少85%、90%、95%、或99%或更高同一性的氨基酸序列。在一个实施例中,该抗TIM-3抗体分子包含:含有SEQ ID NO:806的氨基酸序列的VH和含有SEQ ID NO:816的氨基酸序列的VL。在一个实施例中,该抗TIM-3抗体分子包含:含有SEQ ID NO:822的氨基酸序列的VH和含有SEQ ID NO:826的氨基酸序列的VL。
在一个实施例中,抗体分子包含VH,该VH由SEQ ID NO:807的核苷酸序列,或与SEQID NO:807具有至少85%、90%、95%、或99%或更高同一性的核苷酸序列编码。在一个实施例中,抗体分子包含VL,该VL由SEQ ID NO:817的核苷酸序列,或与SEQ ID NO:817具有至少85%、90%、95%、或99%或更高同一性的核苷酸序列编码。在一个实施例中,抗体分子包含VH,该VH由SEQ ID NO:823的核苷酸序列,或与SEQ ID NO:823具有至少85%、90%、95%、或99%或更高同一性的核苷酸序列编码。在一个实施例中,抗体分子包含VL,该VL由SEQ IDNO:827的核苷酸序列,或与SEQ ID NO:827具有至少85%、90%、95%、或99%或更高同一性的核苷酸序列编码。在一个实施例中,该抗体分子包含由SEQ ID NO:807的核苷酸序列编码的VH和由SEQ ID NO:817的核苷酸序列编码的VL。在一个实施例中,该抗体分子包含由SEQID NO:823的核苷酸序列编码的VH和由SEQ ID NO:827的核苷酸序列编码的VL。
在一个实施例中,抗TIM-3抗体分子包含重链,该重链含有SEQ ID NO:808的氨基酸序列,或与SEQ ID NO:808具有至少85%、90%、95%、或99%或更高同一性的氨基酸序列。在一个实施例中,抗TIM-3抗体分子包含轻链,该轻链含有SEQ ID NO:818的氨基酸序列,或与SEQ ID NO:818具有至少85%、90%、95%、或99%或更高同一性的氨基酸序列。在一个实施例中,抗TIM-3抗体分子包含重链,该重链含有SEQ ID NO:824的氨基酸序列,或与SEQ ID NO:824具有至少85%、90%、95%、或99%或更高同一性的氨基酸序列。在一个实施例中,抗TIM-3抗体分子包含轻链,该轻链含有SEQ ID NO:828的氨基酸序列,或与SEQ IDNO:828具有至少85%、90%、95%、或99%或更高同一性的氨基酸序列。在一个实施例中,抗TIM-3抗体分子包含:含有SEQ ID NO:808的氨基酸序列的重链和含有SEQ ID NO:818的氨基酸序列的轻链。在一个实施例中,抗TIM-3抗体分子包含:含有SEQ ID NO:824的氨基酸序列的重链和含有SEQ ID NO:828的氨基酸序列的轻链。
在一个实施例中,抗体分子包含重链,该重链由SEQ ID NO:809的核苷酸序列,或与SEQ ID NO:809具有至少85%、90%、95%、或99%或更高同一性的核苷酸序列编码。在一个实施例中,抗体分子包含轻链,该轻链由SEQ ID NO:819的核苷酸序列,或与SEQ ID NO:819具有至少85%、90%、95%、或99%或更高同一性的核苷酸序列编码。在一个实施例中,抗体分子包含重链,该重链由SEQ ID NO:825的核苷酸序列,或与SEQ ID NO:825具有至少85%、90%、95%、或99%或更高同一性的核苷酸序列编码。在一个实施例中,抗体分子包含轻链,该轻链由SEQ ID NO:829的核苷酸序列,或与SEQ ID NO:829具有至少85%、90%、95%、或99%或更高同一性的核苷酸序列编码。在一个实施例中,抗体分子包含:由SEQ IDNO:809的核苷酸序列编码的重链和由SEQ ID NO:819的核苷酸序列编码的轻链。在一个实施例中,抗体分子包含:由SEQ ID NO:825的核苷酸序列编码的重链和由SEQ ID NO:829的核苷酸序列编码的轻链。
本文所述的这些抗体分子可以通过运载体、宿主细胞、和在US2015/0218274中描述的方法制得,该申请通过引用以其全文并入。
表9.示例性抗TIM-3抗体分子的氨基酸和核苷酸序列
其他示例性TIM-3抑制剂
在一个实施例中,该抗TIM-3抗体分子是TSR-022(AnaptysBio/Tesaro)。在一个实施例中,抗TIM-3抗体分子包含以下中的一个或多个:TSR-022的CDR序列(或总体上全部CDR序列)、重链或轻链可变区序列、或重链或轻链序列。在一个实施例中,抗TIM-3抗体分子包含以下中的一个或多个:APE5137或APE5121的CDR序列(或总体上全部CDR序列)、重链或轻链可变区序列、或重链或轻链序列,例如,如表10中所披露的。APE5137、APE5121和其他抗TIM-3抗体在WO 2016/161270中披露,这些抗体通过引用以其全文并入。
在一个实施例中,该抗TIM-3抗体分子是LY3321367(礼来制药公司(Eli Lilly))。在一个实施例中,该抗TIM-3抗体分子包含以下的一种或多种:LY3321367的CDR序列(或总体上全部CDR序列)、重链或轻链可变区序列、或重链或轻链序列。
在一个实施例中,该抗TIM-3抗体分子是抗体克隆F38-2E2。在一个实施例中,该抗TIM-3抗体分子包含以下的一种或多种:F38-2E2的CDR序列(或总体上全部CDR序列)、重链或轻链可变区序列、或重链或轻链序列。
其他已知的抗TIM-3抗体包括例如,在WO 2016/111947、WO2016/071448、WO 2016/144803、US 8,552,156、US 8,841,418、和US9,163,087中描述的那些,这些申请通过引用以其全文并入。
在一个实施例中,该抗TIM-3抗体是与本文所述的抗TIM-3抗体之一竞争与TIM-3上的相同表位结合和/或结合TIM-3上的相同表位的抗体。
表10.其他示例性抗TIM-3抗体分子的氨基酸序列
在某些实施例中,将本文所述的抗人ENTPD2抗体分子与CTLA-4抑制剂组合给予。该CTLA-4抑制剂可以是抗体、其抗原结合片段、免疫黏附素、融合蛋白、或寡肽。在一些实施例中,该CTLA-4抑制剂是艾匹利木单抗(
在某些实施例中,将如本文所述的抗人ENTPD2抗体与GITR激动剂组合给予。该GITR激动剂可以是抗体、其抗原结合片段、免疫黏附素、融合蛋白、或寡肽。在一些实施例中,该GITR激动剂是GWN323(诺华公司(Novartis))、BMS-986156(BMS)、MK-4166或MK-1248(默克公司(Merck))、TRX518(利普治疗公司(Leap Therapeutics))、INCAGN1876(Incyte/Agenus)、AMG 228(美商安进公司(Amgen))或INBRX-110(Inhibrx公司)。
示例性抗GITR抗体分子
在一个实施例中,该GITR激动剂是抗GITR抗体分子。在一个实施例中,该GITR激动剂是抗GITR抗体分子,如题为“用于增强免疫反应和癌症治疗的组合物和方法”的2016年4月14日公布的WO2016/057846中所述,该文献通过引用以其全文并入。
在一个实施例中,该抗GITR抗体分子包含来自重链和轻链可变区的至少一个、两个、三个、四个、五个或六个互补决定区(CDR)(或总体上全部CDR),该重链和轻链可变区包含表11(例如,来自表11中披露的MAB7的重链和轻链可变区序列)中所示的氨基酸序列,或由表11中所示的核苷酸序列编码。在一些实施例中,这些CDR根据卡巴特定义(例如,如表11中所列出的)。在一些实施例中,这些CDR根据乔西亚定义(例如,如表11中所列出的)。在一个实施例中,相对于表11中所示的氨基酸序列,或由表11中所示的核苷酸序列编码的,CDR中的一个或多个(或总体上全部CDR)具有一个、两个、三个、四个、五个、六个或更多个变化,例如氨基酸取代(例如,保守氨基酸取代)或缺失。
在一个实施例中,该抗GITR抗体分子包含:含有SEQ ID NO:909的VHCDR1氨基酸序列、SEQ ID NO:911的VHCDR2氨基酸序列、和SEQ ID NO:913的VHCDR3氨基酸序列的重链可变区(VH);以及含有SEQ ID NO:914的VLCDR1氨基酸序列、SEQ ID NO:916的VLCDR2氨基酸序列、和SEQ ID NO:918的VLCDR3氨基酸序列的轻链可变区(VL),各自披露于表11中。
在一个实施例中,抗GITR抗体分子包含VH,该VH含有SEQ ID NO:901的氨基酸序列,或与SEQ ID NO:901具有至少85%、90%、95%、或99%或更高同一性的氨基酸序列。在一个实施例中,抗GITR抗体分子包含VL,该VL含有SEQ ID NO:902的氨基酸序列,或与SEQID NO:902具有至少85%、90%、95%、或99%或更高同一性的氨基酸序列。在一个实施例中,该抗GITR抗体分子包含:含有SEQ ID NO:901的氨基酸序列的VH和含有SEQ ID NO:902的氨基酸序列的VL。
在一个实施例中,抗体分子包含VH,该VH由SEQ ID NO:905的核苷酸序列,或与SEQID NO:905具有至少85%、90%、95%、或99%或更高同一性的核苷酸序列编码。在一个实施例中,抗体分子包含VL,该VL由SEQ ID NO:906的核苷酸序列,或与SEQ ID NO:906具有至少85%、90%、95%、或99%或更高同一性的核苷酸序列编码。在一个实施例中,该抗体分子包含由SEQ ID NO:905的核苷酸序列编码的VH和由SEQ ID NO:906的核苷酸序列编码的VL。
在一个实施例中,抗GITR抗体分子包含重链,该重链含有SEQ ID NO:903的氨基酸序列,或与SEQ ID NO:903具有至少85%、90%、95%、或99%或更高同一性的氨基酸序列。在一个实施例中,抗GITR抗体分子包含轻链,该轻链含有SEQ ID NO:904的氨基酸序列,或与SEQ ID NO:904具有至少85%、90%、95%、或99%或更高同一性的氨基酸序列。在一个实施例中,该抗GITR抗体分子包含:含有SEQ ID NO:903的氨基酸序列的重链和含有SEQ IDNO:904的氨基酸序列的轻链。
在一个实施例中,抗体分子包含重链,该重链由SEQ ID NO:907的核苷酸序列,或与SEQ ID NO:907具有至少85%、90%、95%、或99%或更高同一性的核苷酸序列编码。在一个实施例中,抗体分子包含轻链,该轻链由SEQ ID NO:908的核苷酸序列,或与SEQ ID NO:908具有至少85%、90%、95%、或99%或更高同一性的核苷酸序列编码。在一个实施例中,该抗体分子包含由SEQ ID NO:907的核苷酸序列编码的重链和由SEQ ID NO:908的核苷酸序列编码的轻链。
本文所述的这些抗体分子可以通过运载体、宿主细胞、和在WO2016/057846中描述的方法制得,该申请通过引用以其全文并入。
表11.示例性抗GITR抗体分子的氨基酸和核苷酸序列
其他示例性抗GITR抗体和激动剂
在一个实施例中,该抗GITR抗体分子是BMS-986156(百时美施贵宝公司(Bristol-Myers Squibb)),也称为BMS 986156或BMS986156。BMS-986156和其他抗GITR抗体披露在例如,US 9,228,016和WO2016/196792中,这些申请通过引用以其全文并入。在一个实施例中,该抗GITR抗体分子包含以下的一种或多种:BMS-986156的CDR序列(或总体上全部CDR序列)、重链或轻链可变区序列、或重链或轻链序列,例如,在
在一个实施例中,该抗GITR抗体分子是MK-4166或MK-1248(默克公司(Merck))。MK-4166、MK-1248、和其他抗GITR抗体披露于例如,US 8,709,424、WO 2011/028683、WO2015/026684、和Mahne等人,Cancer Res.[癌症研究]2017;77(5):1108-1118中,这些申请通过引用以其全文并入。在一个实施例中,该抗GITR抗体分子包含以下的一种或多种:MK-4166或MK-1248的CDR序列(或总体上全部CDR序列)、重链或轻链可变区序列、或重链或轻链序列。
在一个实施例中,该抗GITR抗体分子是TRX518(利普治疗公司(LeapTherapeutics))。TRX518和其他抗GITR抗体披露在例如,US7,812,135、US 8,388,967、US9,028,823、WO 2006/105021、和Ponte J等人,(2010)Clinical Immunology[临床免疫学];135:S96中,这些申请通过引用以其全文并入。在一个实施例中,该抗GITR抗体分子包含以下的一种或多种:TRX518的CDR序列(或总体上全部CDR序列)、重链或轻链可变区序列、或重链或轻链序列。
在一个实施例中,该抗GITR抗体分子是INCAGN1876(Incyte/Agenus)。INCAGN1876和其他抗GITR抗体披露在例如,US2015/0368349和WO 2015/184099中,这些申请通过引用以其全文并入。在一个实施例中,该抗GITR抗体分子包含以下的一种或多种:INCAGN1876的CDR序列(或总体上全部CDR序列)、重链或轻链可变区序列、或重链或轻链序列。
在一个实施例中,该抗GITR抗体分子是AMG 228(美商安进公司(Amgen))。AMG 228和其他抗GITR抗体披露在例如,US 9,464,139和WO 2015/031667中,这些申请通过引用以其全文并入。在一个实施例中,该抗GITR抗体分子包含以下的一种或多种:AMG 228的CDR序列(或总体上全部CDR序列)、重链或轻链可变区序列、或重链或轻链序列。
在一个实施例中,该抗GITR抗体分子是INBRX-110(Inhibrx)。INBRX-110和其他抗GITR抗体披露在例如,US 2017/0022284和WO2017/015623中,这些申请通过引用以其全文并入。在一个实施例中,该GITR激动剂以下的一种或多种:INBRX-110的CDR序列(或总体上全部CDR序列)、重链或轻链可变区序列、或重链或轻链序列。
在一个实施例中,该GITR激动剂(例如,融合蛋白)是MEDI 1873(米迪缪尼有限公司(MedImmune)),也称为MEDI1873。MEDI 1873和其他GITR激动剂披露在例如,US 2017/0073386、WO 2017/025610、和Ross等人,Cancer Res[癌症研究]2016;76(14增刊):摘要nr561中,这些申请通过引用以其全文并入。在一个实施例中,该GITR激动剂包含MEDI 1873的IgG Fc结构域、功能性多聚化结构域、和糖皮质激素诱导的TNF受体配体(GITRL)的受体结合结构域中的一种或多种。
其他已知的GITR激动剂(例如,抗GITR抗体)包括例如,在WO2016/054638中描述的那些,该申请通过引用以其全文并入。
在一个实施例中,该抗GITR抗体是与本文所述的抗GITR抗体之一竞争与GITR上的相同表位结合和/或结合GITR上的相同表位的抗体。
在一个实施例中,该GITR激动剂是活化GITR信号传导途径的肽。在一个实施例中,该GITR激动剂是与恒定区(例如,免疫球蛋白序列的Fc区)融合的免疫黏附素结合片段(例如,包含GITRL的细胞外或GITR的结合部分的免疫黏附素结合片段)。
表12.其他示例性抗GITR抗体分子的氨基酸序列
在某些实施例中,将本文所述的抗人ENTPD2抗体分子与抗CD3多特异性抗体分子(例如,抗CD3双特异性抗体分子)组合给予。在一个实施例中,抗CD3多特异性抗体分子结合CD3合靶肿瘤抗原(TTA)。在一个实施例中,该TTA选自CD19、CD20、CD38、或CD123。在一个实施例中,抗CD3多特异性抗体分子处于在WO 2016/182751中的图1A、1B、1C和125中披露的形式,该申请通过引用以其全文并入本文。
在一个实施例中,该抗CD3多特异性抗体分子是抗CD3 x抗CD123双特异性抗体分子,例如,在WO 2016/086189或WO 2016/182751中披露的XENP14045(例如,如表15中所列出的)或抗CD3 x抗CD123双特异性抗体分子,这些申请通过引用以其全文并入本文中。在一个实施例中,抗CD3 x抗CD123双特异性抗体分子包含一个或多个CDR序列(或总体上全部CDR序列),XENP14045的重链或轻链可变区序列,或重链或轻链序列,或与其基本上相同的氨基酸序列(例如,与其具有至少约85%、90%、或95%序列同一性的序列)。
在一个实施例中,抗CD3多特异性抗体是抗CD3 x抗CD20双特异性抗体分子,例如,XENP13676(例如,如表13中列出的)或在WO2016/086189或WO 2016/182751中披露的抗CD3x抗CD20双特异性抗体分子,通过引用以其全文并于本文中。在一个实施例中,抗CD3 x抗CD20双特异性抗体分子包含一个或多个CDR序列(或总体上全部CDR序列),XENP13676的重链或轻链可变区序列,或重链或轻链序列,或与其基本上相同的氨基酸序列(例如,与其具有至少约85%、90%、或95%序列同一性的序列)。
表13.示例性抗CD3双特异性抗体分子的氨基酸序列
在某些实施例中,将本文所述的抗人ENTPD2抗体与IL-15/IL-15Ra复合物组合给予。在一些实施例中,IL-15/IL-15Ra复合物选自NIZ985(诺华公司(Novartis))、ATL-803(亚拉斯托公司(Altor))或CYP0150(Cytune)。
示例性IL-15/IL-15Ra复合物
在一个实施例中,IL-15/IL-15Ra复合物包含人IL-15与可溶形式的人IL-15Ra复合。该复合物可包含与可溶形式的IL-15Ra共价或非共价结合的IL-15。在一个具体的实施例中,人IL-15非共价地与可溶形式的IL-15Ra结合。在具体的实施例中,组合物的人IL-15包含表14中SEQ ID NO:1001的氨基酸序列,并且可溶形式的人IL-15Ra包含表14中的SEQID NO:1002的氨基酸序列,如在WO 2014/066527中的描述,通过引用以其全文并入。本文所述的这些分子可以通过运载体、宿主细胞、和在WO 2007/084342中描述的方法制得,该申请通过引用以其全文并入。
表14.示例性IL-15/IL-15Ra复合物的氨基酸和核苷酸序列
其他示例性IL-15/IL-15Ra复合物
在一个实施例中,该IL-15/IL-15Ra复合物是ALT-803,IL-15/IL-15Ra Fc融合蛋白(IL-15N72D:IL-15RaSu/Fc可溶性复合物)。ALT-803披露在WO 2008/143794中,通过引用以其全文并入。在一个实施例中,该IL-15/IL-15Ra Fc融合蛋白包含如表15中披露的序列。
在一个实施例中,该IL-15/IL-15Ra复合物包含与IL-15Ra的sushi结构域融合的IL-15(CYP0150,Cytune)。IL-15Ra的sushi结构域是指在IL-15Ra的信号肽之后的第一半胱氨酸残基处开始并且在所述信号肽之后的第四个半胱氨酸残基处结束的结构域。与IL-15Ra的sushi结构域融合的IL-15的复合物披露在WO 2007/04606和WO 2012/175222中,这些申请通过引用以其全文并入。在一个实施例中,该IL-15/IL-15Ra sushi结构域融合物包含如在表15中披露的序列。
在一个实施例中,该IL-15/IL-15Ra复合物包含IL-15和IL-15Ra的融合蛋白,该融合蛋白可以进一步包含接头(特别是甘氨酸-丝氨酸接头)连接如在WO 2014/186469中披露的IL-15和IL-15Ra(评议委员会,德克萨斯大学系统),通过引用以其全文并入。在一个实施例中,该IL-15/IL-15Ra融合蛋白包含如在表15中披露的序列。
在一个实施例中,该IL-15/IL-15Ra复合物包含由甘氨酸-丝氨酸接头连接的IL-15Ra和IL-15的sushi结构域的融合蛋白,如披露中WO2015/109124(卡蒙集团(KadmonCorp.))中,通过引用以其全文并入。在一个实施例中,该IL-15/IL-15Ra融合蛋白包含如在表15中披露的序列。
在一个实施例中,该IL-15/IL-15Ra复合物包含IL-15、IL-15Ra、Fc结构域和RGD肽的融合蛋白,优选地配制为RGD多肽-Fc结构域-IL-15多肽-IL-15Ra多肽,如披露于WO2017/000913(努木生物制药公司(Numab Biopharmaceuticals))中,通过引用以其全文并入。在一个实施例中,该RGD-Fc-IL-15-IL-15Ra融合蛋白包含如表15中披露的序列。
在一个实施例中,该IL-15/IL-15Ra复合物包含异二聚体蛋白,该蛋白含有与第一Fc结构域连接的IL-15和与第二Fc结构域连接的IL-15Ra。IL-15是人IL-15的成熟形式,并且IL-15Ra是人IL-15Ra或其截短变体(如IL-15Ra-sushi)的细胞外结构域。这两个Fc结构域可以包含能够通过“Knob-into-Hole”相互作用形成异二聚体的突变和在WO2015/103928(江苏恒瑞医药公司(Jiangsu Hendrui Medicine Co))中披露的示例性构建体,该申请通过引用以其全文并入。
在一个实施例中,该IL-15/IL-15Ra复合物包含IL-15(含有cys氨基酸突变)和IL-15Ra(细胞外或其sushi结构域)(含有cys突变)的组合以促进多肽之间形成分子内二硫键。具有突变组合的IL-15和IL-15Ra的序列披露在WO 2016/095642(江苏恒瑞医药公司(Jiangsu Hendrui Medicine Co))中,通过引用以其全文并入。
在一个实施例中,该IL-15/IL-15Ra复合物包含异二聚体蛋白,该蛋白含有与第一Fc结构域连接的IL-15和与第二Fc结构域连接的IL-15Ra。第一和第二Fc结构域可以具有如以下所列的一组氨基酸取代:S267K/L368D/K370S;S267K/LS364K/E357Q;S364K/E357Q;L36HD/K370S;L36HD/K370S;S364K;L36HE/K370S;S364K;T411T/E360E/Q362E;D401K;L368D/K370S;S364K/E357L和K370S;S364K/E357Q,根据EU编号,并且另外可以包含其他氨基酸取代和以消除Fcgamma受体结合的取代,如披露在WO 2018/071919(Xencor公司)中,该申请通过引用以其全文并入。
表15.其他示例性IL-15/IL-15Ra复合物的氨基酸序列
在某些实施例中,将本文所述的抗人ENTPD2抗体分子与CSF-1/1R结合剂组合给予。
在一些实施例中,该CSF-1/1R结合剂是巨噬细胞集落刺激因子(M-CSF)的抑制剂。M-CSF有时也称为CSF-1。
在另一个实施例中,该CSF-1/1R结合剂是CSF-1R酪氨酸激酶抑制剂、4-((2-(((1R,2R)-2-羟基环己基)氨基)苯并[d]噻唑-6-基)氧基)-N-甲基吡啶酰胺(化合物A15)、或在PCT公开号WO 2005/073224中披露的化合物。在一些实施例中,该CSF-1/1R结合剂是M-CSF抑制剂、化合物A33、或在PCT公开号WO 2004/045532或PCT公开号WO 2005/068503中披露的CSF-1的结合剂(包括RX1或5H4)(例如,抗体分子或针对M-CSF的Fab片段)。
在一些实施例中,该CSF-1/1R结合剂是CSF1R抑制剂或4-(2-((1R,2R)-2-羟基环己基氨基)苯并噻唑-6-基氧基)-N-甲基吡啶酰胺。4-(2-((1R,2R)-2-羟基环己基氨基)苯并噻唑-6-基氧基)-N-甲基吡啶酰胺被披露为PCT公开号WO 2007/121484在第117页的实例157。
在一些实施例中,CSF-1/1R结合剂是培达替尼(pexidartinib)(CAS登记号1029044-16-3)。培达替尼也称为PLX3397或5-((5-氯-1H-吡咯并[2,3-b]吡啶-3-基)甲基)-N-((6-(三氟甲基)吡啶-3-基)甲基)吡啶-2-胺。培达替尼是KIT、CSF1R和FLT3的小分子受体酪氨酸激酶(RTK)抑制剂。
在一些实施例中,该CSF-1/1R结合剂是依米妥珠单抗(emactuzumab)。依米妥珠单抗也称为RG7155或RO5509554。依米妥珠单抗是人源化IgG1 mAb靶向的CSF1R。
在一些实施例中,该CSF-1/1R结合剂是FPA008。FPA008是抑制CSF1R的人源化mAb。
在某些实施例中,将本文所述的抗人ENTPD2抗体分子与吲哚胺2,3-双加氧酶(IDO)和/或色氨酸2,3-双加氧酶(TDO)的抑制剂组合给予。
在一些实施例中,该IDO/TDO抑制剂选自(4E)-4-[(3-氯-4-氟苯胺基)-亚硝基亚甲基]-1,2,5-噁二唑-3-胺(也称为INCB24360或Epacadostat;CAS登记号:1204669-58-8(因塞特公司(Incyte));英多莫德(Indoximod)(1-甲基-D-色氨酸);α-环己基-5H-咪唑并[5,1-a]异吲哚-5-乙醇(也称为NLG919)或BMS-986205(也称为F001287或ONO-7701)。
在一些实施例中,该IDO/TDO抑制剂是Epacadostat。它是有效的和选择性吲哚胺2,3-双加氧酶(IDO1)抑制剂,其中IC
在一些实施例中,该IDO/TDO抑制剂是英多莫德(纽琳基因公司(New LinkGenetics))。英多莫德,1-甲基-色氨酸的D异构体,是一种口服给予的小分子吲哚胺2,3-双加氧酶(IDO)途径抑制剂,该抑制剂破坏了由肿瘤逃避免疫介导的破坏的机制。NLG919是有效的IDO途径抑制剂,其中在无细胞测定中Ki/EC
在一些实施例中,该IDO/TDO抑制剂是BMS-986205(也称为F001287或ONO-7701)(Flexus/BMS)。BMS-986205是吲哚胺2,3-双加氧酶1(IDO1)的小分子抑制剂。
在某些实施例中,将本文所述的抗人ENTPD2抗体分子与转化生长因子β(TGF-β)抑制剂组合给予。该TGF-β抑制剂可以是抗体、其抗原结合片段、免疫黏附素、融合蛋白、或寡肽。在一些实施例中,该TGF-β抑制剂选自夫苏木单抗(fresolimumab)和XOMA 089(Xoma)。
TGF-β属于结构相关的细胞因子的大家族,包括例如骨形态发生蛋白(BMP)、生长和分化因子、活化素和抑制素。在一些实施例中,本文所述的TGF-β抑制剂可以结合和/或抑制一种或多种TGF-β的同种型(例如,TGF-β1、TGF-β2、或TGF-β3中的一种、两种或全部)。
在一些实施例中,该TGF-β抑制剂是夫苏木单抗(CAS登记号:948564-73-6)。夫苏木单抗也称为GC1008。夫苏木单抗是结合和抑制TGF-β同种型1、2和3的人单克隆抗体。例如,在WO 2006/086469、US 8,383,780、和US 8,591,901中披露了夫苏木单抗。
夫苏木单抗的重链具有以下氨基酸序列:
夫苏木单抗的轻链具有以下氨基酸序列:
在一些实施例中,该TGF-β抑制剂是XOMA 089。XOMA 089也称为XPA.42.089。XOMA089是完全人单克隆抗体,该抗体结合并中和TGF-β1和2配体,同时保留TGF-β3。
XOMA 089的重链可变区具有以下氨基酸序列:QVQLVQSGAEVKKPGSSVKVSCKASGGTFSSYAISWVRQAPGQGLEWMGGIIPIFGTANYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCARGLWEVRALPSVYWGQGTLVTVSS(SEQ ID NO:310)(披露为WO 2012/167143中的SEQ ID NO:6)。
XOMA 089的轻链可变区具有以下氨基酸序列:SYELTQPPSVSVAPGQTARITCGANDIGSKSVHWYQQKAGQAPVLVVSEDIIRPSGIPERISGSNSGNTATLTISRVEAGDEADYYCQVWDRDSDQYVFGTGTKVTVLG(SEQ ID NO:311)(披露为WO 2012/167143中的SEQ ID NO:8)。
在某些实施例中,将本文所述的抗人ENTPD2抗体分子与血管内皮生长因子(VEGF)受体抑制剂(例如,一种或多种VEGFR(例如,VEGFR-1、VEGFR-2、或VEGFR-3)或VEGF的抑制剂)组合给予。
在一些实施例中,该VEGFR抑制剂是琥珀酸伐他拉尼(化合物A47)或在EP 296122中披露的化合物。
在一些实施例中,该VEGFR抑制剂是以下各项中一种或多种的抑制剂:VEGFR-2、PDGFRβ、KIT或Raf激酶C、1-甲基-5-((2-(5-(三氟甲基)-1H-咪唑-2-基)吡啶-4-基)氧基)-N-(4-(三氟甲基)苯基)-1H-苯并[d]咪唑-2-胺(化合物A37)或在PCT公开号WO 2007/030377中披露的化合物。
可以在本文披露的组合中使用的其他示例性VEGFR途径抑制剂包括,例如,贝伐单抗
可以在本文披露的组合中使用的示例性抗VEGF抗体包括例如,结合与由杂交瘤ATCC HB 10709产生的单克隆抗VEGF抗体A4.6.1相同的表位的单克隆抗体;根据Presta等人,(1997)Cancer Res.[癌症研究]57:4593-4599产生的重组人源化抗VEGF单克隆抗体。在一个实施例中,该抗VEGF抗体是贝伐单抗(BV),也称为rhuMAb VEGF或
在一些实施例中,本文所述的抗人ENTPD2抗体分子(例如,抗ENTPD2抗体分子)与酪氨酸激酶抑制剂(例如,受体酪氨酸激酶(RTK)抑制剂)组合使用。示例性酪氨酸激酶抑制剂包括,但不限于表皮生长因子(EGF)途径抑制剂(例如,表皮生长因子受体(EGFR)抑制剂)、血管内皮生长因子(VEGF)途径抑制剂(例如,血管内皮生长因子受体(VEGFR)抑制剂(例如,VEGFR-1抑制剂、VEGFR-2抑制剂、VEGFR-3抑制剂))、血小板衍生生长因子(PDGF)途径抑制剂(例如,血小板衍生生长因子受体(PDGFR)抑制剂(例如,PDGFR-β抑制剂))、RAF-1抑制剂、KIT抑制剂和RET抑制剂。在某些实施例中,将本文所述的抗人ENTPD2抗体分子与表皮生长因子受体(EGFR)的抑制剂组合给予。
在一些实施例中,该EGFR抑制剂是(R,E)-N-(7-氯-1-(1-(4-(二甲基氨基)丁-2-烯酰)氮杂环庚烷-3-基)-1H-苯并[d]咪唑-2-基)-2-甲基异烟酰胺(化合物A40)或在PCT公开号WO 2013/184757中披露的化合物。
在一些实施例中,该EGFR抑制剂选自以下各项的一种或多种:埃罗替尼
可以在本文披露的组合中使用的其他抗癌剂,例如,酪氨酸激酶抑制剂途径抑制剂包括,但不限于所选择的酪氨酸激酶抑制剂选自舒尼替尼
在一些实施例中,与刺猬抑制剂组合使用的抗癌剂选自下组,该组由以下组成:阿西替尼(AG013736)、伯舒替尼(SKI-606)、西地尼布(RECENTIN
在某些实施例中,将本文所述的抗人ENTPD2抗体分子与c-MET的抑制剂组合给予。
在一些实施例中,该c-MET抑制剂是化合物A17或美国专利号7,767,675和8,420,645中描述的化合物。
在一些实施例中,该c-MET抑制剂是JNJ-38877605。JNJ-38877605是口服可用的c-Met的小分子抑制剂。JNJ-38877605选择性结合c-MET,从而抑制c-MET磷酸化并破坏c-Met信号转导途径。
在一些实施例中,该c-Met抑制剂是AMG 208。AMG 208是c-MET的选择性小分子抑制剂。AMG 208抑制c-MET的配体依赖性和配体非依赖性活化,抑制其酪氨酸激酶活性,这可能导致过表达c-Met的肿瘤中的细胞生长抑制。
在一些实施例中,该c-Met抑制剂是AMG 337。AMG 337是c-Met的口服生物可利用的抑制剂。AMG 337选择性结合c-MET,从而破坏c-MET信号转导途径。
在一些实施例中,该c-Met抑制剂是LY2801653。LY2801653是口服可用的c-Met的小分子抑制剂。LY2801653选择性结合c-MET,从而抑制c-MET磷酸化作用并破坏c-Met信号转导途径。
在一些实施例中,c-Met抑制剂是MSC2156119J。MSC2156119J是口服生物可利用的c-Met抑制剂。MSC2156119J选择性结合c-MET,抑制c-MET磷酸化作用并破坏c-Met介导的信号转导途径。
在一些实施例中,该c-MET抑制剂是卡玛替尼(capmatinib)。卡玛替尼也称为INCB028060。卡玛替尼是口服生物可利用的c-MET抑制剂。卡玛替尼选择性结合c-Met,从而抑制c-Met磷酸化作用并破坏c-Met信号转导途径。
在一些实施例中,该c-MET抑制剂是克唑替尼(crizotinib)。克唑替尼也称为PF-02341066。克唑替尼是口服可用的受体酪氨酸激酶间变性淋巴瘤激酶(ALK)和c-Met/肝细胞生长因子受体(HGFR)的基于氨基吡啶的抑制剂。克唑替尼以ATP竞争方式结合并抑制ALK激酶和ALK融合蛋白。此外,克唑替尼抑制c-Met激酶,并破坏c-Met信号传导途径。总之,该药剂抑制肿瘤细胞生长。
在一些实施例中,该c-MET抑制剂是戈伐替尼(golvatinib)。戈伐替尼是口服生物可利用的c-MET和VEGFR-2的双激酶抑制剂,该抑制剂具有潜在的抗肿瘤活性。戈伐替尼结合并抑制c-MET和VEGFR-2的活性,这可能抑制肿瘤细胞生长和过表达这些受体酪氨酸激酶的肿瘤细胞的存活。
在一些实施例中,该c-MET抑制剂是替万替尼(tivantinib)。替万替尼也称为ARQ197。替万替尼是口服生物可利用的c-MET小分子抑制剂。替万替尼结合c-MET蛋白并破坏c-Met信号转导途径,可在过表达c-MET蛋白或表达组成型活化的c-Met蛋白的肿瘤细胞中诱导细胞死亡。
在某些实施例中,将本文所述的抗人ENTPD2抗体分子与细胞凋亡蛋白抑制剂(IAP)的抑制剂组合给予。
在一些实施例中,该IAP抑制剂是(S)-N-((S)-1-环己基-2-((S)-2-(4-(4-氟苯甲酰基)噻唑-2-基)吡咯烷-1-基)-2-氧代乙基)-2-(甲基氨基)丙酰胺(化合物A21)或在美国专利号8,552,003中披露的化合物。
在某些实施例中,将本文所述的抗人ENTPD2抗体分子与哺乳动物雷帕霉素靶蛋白(mTOR)的抑制剂组合给予。
在一些实施例中,该mTOR抑制剂是8-(6-甲氧基-吡啶-3-基)-3-甲基-1-(4-哌嗪-1-基-3-三氟甲基-苯基)-1,3-二氢-咪唑并[4,5-c]喹啉-2-酮(化合物A41)。
在一些实施例中,该mTOR抑制剂是依维莫司(也称为RAD001或
在一些实施例中,该mTOR抑制剂选自以下的一种或多种:替西罗莫司
在某些实施例中,将本文所述的抗人ENTPD2抗体分子与磷脂酰肌醇-4,5-二磷酸3-激酶(PI3K),例如,磷脂酰肌醇-4,5-二磷酸3-激酶γ和/或δ(PI3K-γ,δ)的抑制剂组合给予。
在一些实施例中,该PI3K抑制剂是PI3K的δ和γ同种型的抑制剂。可以在组合中使用的示例性PI3K抑制剂描述于例如,WO 2010/036380、WO 2010/006086、WO 09/114870、WO05/113556中。在一些实施例中,该PI3K抑制剂选自以下的一种或多种:GSK 2126458、GDC-0980、GDC-0941、Sanofi XL147、XL756、XL147、PF-46915032、CAL-101、CAL 263、SF1126、PX-886、和双PI3K抑制剂。
在一些实施例中,该PI3K-γ,δ抑制剂是艾拉利司(idelalisib)(CAS登记号:870281-82-6)。艾拉利司也称为
在一些实施例中,该PI3K-γ,δ抑制剂是8-(6-甲氧基-吡啶-3-基)-3-甲基-1-(4-哌嗪-1-基-3-三氟甲基-苯基)-1,3-二氢-咪唑并[4,5-c]喹啉-2-酮(化合物A41)。
在组合中可以使用的其他示例性PI3K-γ,δ抑制剂包括例如,匹替利司(pictilisib)(GDC-0941)、LY294002、匹雷利司(pilaralisib)(XL147)、PI-3065、PI-103、VS-5584(SB2343)、CZC24832、度维利司(duvelisib)(IPI-145、INK1197)、TG100-115、CAY10505、GSK1059615、PF-04691502、AS-605240、沃他利司(voxtalisib)(SAR245409、XL765)、IC-87114、奥帕利司(omipalisib)(GSK2126458、GSK458)、TG100713、吉托利司(PF-05212384、PKI-587)、PKI-402、XL147类似物、PIK-90、PIK-293、PIK-294、3-甲基腺嘌呤(3-MA)、AS-252424、AS-604850、或阿托利司(apitolisib)(GDC-0980、RG7422)。
在一些实施例中,该PI3K抑制剂是化合物A8或在PCT公开号WO2010/029082中所述的化合物。
在一些实施例中,该PI3K抑制剂是泛-PI3K抑制剂,(4S,5R)-3-(2'-氨基-2-吗啉代-4'-(三氟甲基)-[4,5'-二嘧啶]-6-基)-4-(羟基甲基)-5-甲基噁唑烷-2-酮(化合物A13)或在PCT公开号WO 2013/124826中披露的化合物。
示例性PI3K-γ,-δ抑制剂包括,但不限于度维利司和艾拉利司。艾拉利司(也称为GS-1101或CAL-101;吉利德公司(Gilead))是阻断PI3K的δ同种型的小分子。如下示出艾拉利司(5-氟-3-苯基-2-[(1S)-1-(7H-嘌呤-6-基氨基)丙基]-4(3H)-喹唑啉酮)的结构。
度维利司(也称为IPI-145;无限制药公司(Infinity Pharmaceuticals)和艾伯维公司(Abbvie))是阻断PI3K-δ,γ的小分子。如下示出了度维利司(8-氯-2-苯基-3-[(1S)-1-(9H-嘌呤-6-基氨基)乙基]-1(2H)-异喹啉酮)的结构。
在一个实施例中,抑制剂是双磷脂酰肌醇3-激酶(PI3K)和mTOR抑制剂,选自2-氨基-8-[反式-4-(2-羟基乙氧基)环己基]-6-(6-甲氧基-3-吡啶基)-4-甲基-吡啶并[2,3-d]嘧啶-7(8H)-酮(PF-04691502);N-[4-[[4-(二甲基氨基)-1-哌啶基]羰基]苯基]-N'-[4-(4,6-二-4-吗啉基-1,3,5-三嗪-2-基)苯基]脲(PF-05212384,PKI-587);阿托利司(GDC-0980,RG7422);2,4-二氟-N-{2-(甲氧基)-5-[4-(4-哒嗪基)-6-喹啉基]-3-吡啶基}苯磺酰胺(GSK2126458);8-(6-甲氧基吡啶-3-基)-3-甲基-1-(4-(哌嗪-1-基)-3-(三氟甲基)苯基)-1H-咪唑并[4,5-c]喹啉-2(3H)-酮马来酸(NVP-BGT226);3-[4-(4-吗啉基吡啶并[3',2':4,5]呋喃并[3,2-d]嘧啶-2-基]苯酚(PI-103);5-(9-异丙基-8-甲基-2-吗啉代-9H-嘌呤-6-基)嘧啶-2-胺(VS-5584,SB2343);和N-[2-[(3,5-二甲氧基苯基)氨基]喹喔啉-3-基]-4-[(4-甲基-3-甲氧基苯基)羰基]氨基苯磺酰胺(XL765)。
在某些实施例中,将本文所述的抗人ENTPD2抗体分子与Janus激酶(JAK)的抑制剂组合给予。
在一些实施例中,该JAK抑制剂是2-氟-N-甲基-4-(7-(喹啉-6-基甲基)咪唑并[1,2-b][1,2,4]三嗪-2-基)苯甲酰胺(化合物A17),或其二盐酸盐,或在PCT公开号WO 2007/070514中披露的化合物。
在一些实施例中,该JAK抑制剂是磷酸鲁索替尼(也称为JAKAFI;化合物A18)或在PCT公开号WO 2007/070514中披露的化合物。
在某些实施例中,本文披露的任何组合,可替代地或组合地,进一步包括表16中描述的一种或多种药剂。
表16.可以将所选治疗剂与抗人ENTPD2抗体分子组合给予,例如,作为单一药剂或与本文所述的其他免疫调节剂组合。该表中列出的每个出版物通过引用以其全文并入本文,包括其中的所有结构式。
可以将如本文所述的抗人ENTPD2抗体分子与另外的治疗剂组合给予。在一些实施例中,该另外的治疗剂选自以下的一种或多种:1)蛋白激酶C(PKC)抑制剂;2)热休克蛋白90(HSP90)抑制剂;3)磷酸肌醇3-激酶(PI3K)和/或雷帕霉素靶蛋白(mTOR)的抑制剂;4)细胞色素P450的抑制剂(例如,CYP17抑制剂或17α-羟化酶/C17-20裂解酶抑制剂);5)铁螯合剂;6)芳香酶抑制剂;7)p53抑制剂,例如,p53/Mdm2相互作用的抑制剂;8)细胞凋亡诱导剂;9)血管生成抑制剂;10)醛固酮合酶抑制剂;11)平滑(SMO)受体抑制剂;12)催乳素受体(PRLR)抑制剂;13)Wnt信号传导抑制剂;14)CDK4/6抑制剂;15)成纤维细胞生长因子受体2(FGFR2)/成纤维细胞生长因子受体4(FGFR4)抑制剂;16)巨噬细胞集落刺激因子(M-CSF)的抑制剂;17)组胺释放、Flt3(例如,FLK2/STK1)或PKC中一种或多种的抑制剂;18)VEGFR-2(例如FLK-1/KDR)、PDGFRβ、c-KIT或Raf激酶C中一种或多种的抑制剂;19)生长激素抑制素激动剂和/或生长激素释放抑制剂;20)间变性淋巴瘤激酶(ALK)抑制剂;21)胰岛素样生长因子1受体(IGF-1R)抑制剂;22)P-糖蛋白1抑制剂;23)血管内皮生长因子受体(VEGFR)抑制剂;24)BCR-ABL激酶抑制剂;25)FGFR抑制剂;26)CYP11B2的抑制剂;27)HDM2抑制剂,例如HDM2-p53相互作用的抑制剂;28)酪氨酸激酶的抑制剂;29)c-MET的抑制剂;30)JAK的抑制剂;31)DAC的抑制剂;32)11β-羟化酶的抑制剂;33)IAP的抑制剂;34)PIM激酶的抑制剂;35)博库派恩的抑制剂;36)BRAF(例如BRAF V600E或野生型BRAF)的抑制剂;37)HER3的抑制剂;38)MEK的抑制剂;或39)脂质激酶(例如,如本文所述并在表1中)的抑制剂。
在一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下各项或与以下各项组合使用用于治疗障碍(例如,本文所述的障碍):PKC抑制剂、索曲滔林(化合物A1)或在PCT公开号WO 2005/039549中披露的化合物。在一个实施例中,该PKC抑制剂是索曲滔林(化合物A1)或在PCT公开号WO 2005/039549中披露的化合物。
在一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下各项或与以下各项组合使用用于治疗障碍(例如,本文所述的障碍):BCR-ABL抑制剂、尼罗替尼(化合物A2,
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括HSP90抑制剂或与HSP90抑制剂组合使用以治疗障碍(例如,本文所述的障碍,例如,癌症)。
在另一个实施例中,将组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)与PI3K和/或mTOR的抑制剂,8-(6-甲氧基-吡啶-3-基)-3-甲基-1-(4-哌嗪-1-基-3-三氟甲基-苯基)-1,3-二氢-咪唑并[4,5-c]喹啉-2-酮(化合物A41)组合使用以治疗障碍(例如,本文所述的障碍)。在一个实施例中,PI3K和/或mTOR抑制剂是8-(6-甲氧基-吡啶-3-基)-3-甲基-1-(4-哌嗪-1-基-3-三氟甲基-苯基)-1,3-二氢-咪唑并[4,5-c]喹啉-2-酮(化合物A41)。
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如,本文所述的障碍):FGFR抑制剂、3-(2,6-二氯-3,5-二甲氧基苯基)-1-(6-((4-(4-乙基哌嗪-1-基)苯基)氨基)嘧啶-4-基)-1-甲基脲(化合物A5)或在美国专利8,552,002中披露的化合物。在一个实施例中,该FGFR抑制剂是3-(2,6-二氯-3,5-二甲氧基苯基)-1-(6-((4-(4-乙基哌嗪-1-基)苯基)氨基)嘧啶-4-基)-1-甲基脲(化合物A5)或在美国专利号8,552,002中披露的化合物。化合物A5具有以下结构:
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如,本文所述的障碍):PI3K抑制剂、布帕利司(Buparlisib)(化合物A6)、或在PCT公开号WO 2007/084786中披露的化合物。在一个实施例中,该PI3K抑制剂是布帕利司(化合物A6)或在PCT公开号WO2007/084786中披露的化合物。化合物A6具有以下结构:
a.
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如,本文所述的障碍):FGFR抑制剂、8-(2,6-二氟-3,5-二甲氧基苯基)-N-(4-((二甲基氨基)甲基)-1H-咪唑-2-基)喹喔啉-5-甲酰胺(化合物A7)或在PCT公开号WO 2009/141386中披露的化合物。在一个实施例中,该FGFR抑制剂是8-(2,6-二氟-3,5-二甲氧基苯基)-N-(4-((二甲基氨基)甲基)-1H-咪唑-2-基)喹喔啉-5-甲酰胺(化合物A7)或在PCT公开号WO2009/141386中披露的化合物。
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如,本文所述的障碍):PI3K抑制剂、(S)-N1-(4-甲基-5-(2-(1,1,1-三氟-2-甲基丙烷-2-基)吡啶-4-基)噻唑-2-基)吡咯烷-1,2-二甲酰胺(化合物A8)或在PCT公开号WO 2010/029082中披露的化合物。在一个实施例中,该PI3K抑制剂是(S)-N1-(4-甲基-5-(2-(1,1,1-三氟-2-甲基丙烷-2-基)吡啶-4-基)噻唑-2-基)吡咯烷-1,2-二甲酰胺(化合物A8)或在PCT公开号WO2010/029082中披露的化合物。
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如,本文所述的障碍):细胞色素P450(例如,CYP17抑制剂)的抑制剂或在PCT公开号WO 2010/149755中披露的化合物。在一个实施例中,该细胞色素P450抑制剂(例如,CYP17抑制剂)是在PCT公开号WO2010/149755;US 8,263,635B2;或EP 2445903B1中披露的化合物。
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如,本文所述的障碍):HDM2抑制剂、(S)-1-(4-氯苯基)-7-异丙氧基-6-甲氧基-2-(4-(甲基(((1r,4S)-4-(4-甲基-3-氧代哌嗪-1-基)环己基)甲基)氨基)苯基)-1,2-二氢异喹啉-3(4H)-酮(化合物A10)或在PCT公开号WO2011/076786中披露的化合物。在一个实施例中,该HDM2抑制剂是(S)-1-(4-氯苯基)-7-异丙氧基-6-甲氧基-2-(4-(甲基(((1r,4S)-4-(4-甲基-3-氧代哌嗪-1-基)环己基)甲基)氨基)苯基)-1,2-二氢异喹啉-3(4H)-酮(化合物A10)或在PCT公开号WO 2011/076786中披露的化合物。
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如,本文所述的障碍):铁螯合剂,地拉罗司(也称为EXJADE;化合物A11),或在PCT公开号WO 1997/049395中披露的化合物。在一个实施例中,该铁螯合剂是地拉罗司或在PCT公开号WO 1997/049395中披露的化合物。在一个实施例中,该铁螯合剂是地拉罗司(化合物A11)。
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如,本文所述的障碍):芳香酶抑制剂,来曲唑(也称为FEMARA;化合物A12)或在US 4,978,672中披露的化合物。在一个实施例中,该芳香酶抑制剂是来曲唑(化合物A12)或在美国专利4,978,672中披露的化合物。
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如,本文所述的障碍):PI3K抑制剂,例如,泛-PI3K抑制剂,(4S,5R)-3-(2'-氨基-2-吗啉代-4'-(三氟甲基)-[4,5'-二嘧啶]-6-基)-4-(羟基甲基)-5-甲基噁唑烷-2-酮(化合物A13)或在PCT公开号WO 2013/124826中披露的化合物。在一个实施例中,该PI3K抑制剂是(4S,5R)-3-(2'-氨基-2-吗啉代-4'-(三氟甲基)-[4,5'-二嘧啶]-6-基)-4-(羟基甲基)-5-甲基噁唑烷-2-酮(化合物A13)或在PCT公开号WO 2013/124826中披露的化合物。
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如,本文所述的障碍):p53和/或p53/Mdm2相互作用的抑制剂,(S)-5-(5-氯-1-甲基-2-氧代-1,2-二氢吡啶-3-基)-6-(4-氯苯基)-2-(2,4-二甲氧基嘧啶-5-基)-1-异丙基-5,6-二氢吡咯并[3,4-d]咪唑-4(1H)-酮(化合物A14)或在PCT公开号WO 2013/111105中披露的化合物。在一个实施例中,该p53和/或p53/Mdm2相互作用抑制剂是(S)-5-(5-氯-1-甲基-2-氧代-1,2-二氢吡啶-3-基)-6-(4-氯苯基)-2-(2,4-二甲氧基嘧啶-5-基)-1-异丙基-5,6-二氢吡咯并[3,4-d]咪唑-4(1H)-酮(化合物A14)或在PCT公开号WO 2013/111105中披露的化合物。
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如,本文所述的障碍):CSF-1R酪氨酸激酶抑制剂,4-((2-(((1R,2R)-2-羟基环己基)氨基)苯并[d]噻唑-6-基)氧基)-N-甲基吡啶酰胺(化合物A15)或在PCT公开号WO 2005/073224中披露的化合物。在一个实施例中,该CSF-1R酪氨酸激酶抑制剂是4-((2-(((1R,2R)-2-羟基环己基)氨基)苯并[d]噻唑-6-基)氧基)-N-甲基吡啶酰胺(化合物A15)或在PCT公开号WO2005/073224中披露的化合物。
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如所述障碍):细胞凋亡诱导剂和/或血管生成抑制剂(例如甲磺酸伊马替尼(也称为
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如,本文所述的障碍):JAK抑制剂,2-氟-N-甲基-4-(7-(喹啉-6-基甲基)咪唑并[1,2-b][1,2,4]三嗪-2-基)苯甲酰胺(化合物A17),或其二盐酸盐,或在PCT公开号WO 2007/070514中披露的化合物。在一个实施例中,该JAK抑制剂是2-氟-N-甲基-4-(7-(喹啉-6-基甲基)咪唑并[1,2-b][1,2,4]三嗪-2-基)苯甲酰胺(化合物A17),或其二盐酸盐,或在PCT公开号WO2007/070514中披露的化合物。
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如,本文所述的障碍):JAK抑制剂,磷酸鲁索替尼(也称为JAKAFI;化合物A18)或在PCT公开号WO 2007/070514中披露的化合物。在一个实施例中,该JAK抑制剂是磷酸鲁索替尼(化合物A18)或在PCT公开号WO 2007/070514中披露的化合物。
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如,本文所述的障碍):脱乙酰酶(DAC)抑制剂,帕比司他(化合物A19),或在PCT公开号WO 2014/072493中披露的化合物。在一个实施例中,该DAC抑制剂是帕比司他(化合物A19)或在PCT公开号WO2014/072493中披露的化合物。
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如,本文所述的障碍):细胞色素P450(例如,11B2)、醛固酮或血管生成、奥斯洛左斯特(化合物A20)或在PCT公开号WO 2007/024945中披露的化合物中的一种或多种的抑制剂。
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包含以下项或与以下项组合使用以治疗障碍(例如,本文所述的障碍):IAP抑制剂,(S)-N-((S)-1-环己基-2-((S)-2-(4-(4-氟苯甲酰基)噻唑-2-基)吡咯烷-1-基)-2-氧代乙基)-2-(甲基氨基)丙酰胺(化合物A21)或在US 8,552,003中披露的化合物。在一个实施例中,该IAP抑制剂是(S)-N-((S)-1-环己基-2-((S)-2-(4-(4-氟苯甲酰基)噻唑-2-基)吡咯烷-1-基)-2-氧代乙基)-2-(甲基氨基)丙酰胺(化合物A21)或在美国专利8,552,003中披露的化合物。
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如,本文所述的障碍):平滑(SMO)抑制剂,(R)-2-(5-(4-(6-苄基-4,5-二甲基哒嗪-3-基)-2-甲基哌嗪-1-基)吡嗪-2-基)丙烷-2-醇(化合物A25),或在PCT公开号WO 2010/007120中披露的化合物。在一个实施例中,该SMO抑制剂是(R)-2-(5-(4-(6-苄基-4,5-二甲基哒嗪-3-基)-2-甲基哌嗪-1-基)吡嗪-2-基)丙烷-2-醇(化合物A25),或在PCT公开号WO 2010/007120中披露的化合物。
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如,本文所述的障碍):Alk抑制剂、色瑞替尼(ceritinib)(也称为ZYKADIA;化合物A23)。
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如,本文所述的障碍):JAK和/或CDK4/6抑制剂,7-环戊基-N,N-二甲基-2-((5-(哌嗪-1-基)吡啶-2-基)氨基)-7H-吡咯并[2,3-d]嘧啶-6-甲酰胺(化合物A24),或在美国专利8,415,355或美国专利8,685,980中披露的化合物。在一个实施例中,该JAK和/或CDK4/6抑制剂是7-环戊基-N,N-二甲基-2-((5-(哌嗪-1-基)吡啶-2-基)氨基)-7H-吡咯并[2,3-d]嘧啶-6-甲酰胺(化合物A24),或在美国专利8,415,355或美国专利8,685,980中披露的化合物。
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如,本文所述的障碍):催乳素受体(PRLR)抑制剂、如在美国专利7,867,493中披露的人单克隆抗体分子(化合物A26)。
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如,本文所述的障碍):PIM激酶抑制剂,N-(4-((1R,3S,5S)-3-氨基-5-甲基环己基)吡啶-3-基)-6-(2,6-二氟苯基)-5-氟吡啶酰胺(化合物A27)或在PCT公开号WO 2010/026124中披露的化合物。在一个实施例中,该PIM激酶抑制剂是N-(4-((1R,3S,5S)-3-氨基-5-甲基环己基)吡啶-3-基)-6-(2,6-二氟苯基)-5-氟吡啶酰胺(化合物A27)或在PCT公开号WO 2010/026124中披露的化合物。
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如,本文所述的障碍):Wnt信号传导抑制剂,2-(2',3-二甲基-[2,4'-二吡啶]-5-基)-N-(5-(吡嗪-2-基)吡啶-2-基)乙酰胺(化合物A28)或在PCT公开号WO 2010/101849中披露的化合物。在一个实施例中,该Wnt信号传导抑制剂是2-(2',3-二甲基-[2,4'-二吡啶]-5-基)-N-(5-(吡嗪-2-基)吡啶-2-基)乙酰胺(化合物A28)或在PCT公开号WO 2010/101849中披露的化合物。在一个实施例中,该Wnt信号传导抑制剂是2-(2',3-二甲基-[2,4'-二吡啶]-5-基)-N-(5-(吡嗪-2-基)吡啶-2-基)乙酰胺(化合物A28)。
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括BRAF抑制剂或与BRAF抑制剂组合使用以治疗障碍(例如,本文所述的障碍,例如,癌症)。
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如,本文所述的障碍):CDK4/6抑制剂,7-环戊基-N,N-二甲基-2-((5-((1R,6S)-9-甲基-4-氧代-3,9-二氮杂二环[4.2.1]壬-3-基)吡啶-2-基)氨基)-7H-吡咯并[2,3-d]嘧啶-6-甲酰胺(化合物A30),或在PCT公开号WO 2011/101409中披露的化合物。在一个实施例中,该CDK4/6抑制剂是7-环戊基-N,N-二甲基-2-((5-((1R,6S)-9-甲基-4-氧代-3,9-二氮杂二环[4.2.1]壬-3-基)吡啶-2-基)氨基)-7H-吡咯并[2,3-d]嘧啶-6-甲酰胺(化合物A30)或在PCT公开号WO 2011/101409中披露的化合物。
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如,本文所述的障碍):HER3抑制剂,化合物A31或在PCT公开号WO2012/022814中披露的化合物。在一个实施例中,该HER3抑制剂是化合物A31或在PCT公开WO 2012/022814中披露的化合物。
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如,本文所述的障碍):FGFR2和/或FGFR4抑制剂,化合物A32或在出版物PCT公开号WO 2014/160160中披露的化合物(例如,针对FGFR2和/或FGFR4的抗体分子药物缀合物,例如,mAb 12425)。在一些实施例中,化合物A32是针对FGFR2和/或FGFR4的抗体分子药物缀合物(例如,mAb 12425)。
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如,本文所述的障碍):M-CSF抑制剂,化合物A33或在PCT公开号WO2004/045532中披露的化合物(例如,抗体分子或针对M-CSF的Fab片段)。
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括MEK抑制剂或与MEK抑制剂组合使用以治疗障碍(例如,如本文所述的癌症)。
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如,本文所述的障碍):c-KIT、组胺释放、Flt3(例如,FLK2/STK1)或PKC、米哚妥林(Midostaurin)(化合物A35)或在PCT公开号WO2003/037347中披露的化合物中一种或多种的抑制剂。在一个实施例中,该抑制剂是米哚妥林(化合物A35)或在PCT公开号WO 2003/037347中披露的化合物。
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如,本文所述的障碍):VEGFR-2、PDGFRβ、KIT或Raf激酶C、1-甲基-5-((2-(5-(三氟甲基)-1H-咪唑-2-基)吡啶-4-基)氧基)-N-(4-(三氟甲基)苯基)-1H-苯并[d]咪唑-2-胺(化合物A37)或在PCT公开号WO 2007/030377中披露的化合物中一种或多种的抑制剂。在一个实施例中,VEGFR-2、PDGFRβ、KIT或Raf激酶C的一种或多种的抑制剂是1-甲基-5-((2-(5-(三氟甲基)-1H-咪唑-2-基)吡啶-4-基)氧基)-N-(4-(三氟甲基)苯基)-1H-苯并[d]咪唑-2-胺(化合物A37)或在PCT公开号WO 2007/030377中披露的化合物。
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如,本文所述的障碍):生长激素抑制素激动剂和/或生长激素释放抑制剂、门冬氨酸帕瑞肽(也称为SIGNIFOR;化合物A38)或在PCT公开号WO 2002/010192或美国专利号7,473,761中披露的化合物。在一个实施例中,该生长激素抑制素激动剂和/或生长激素释放抑制剂是门冬氨酸帕瑞肽(化合物A38)或在PCT公开号WO 2002/010192或美国专利号7,473,761中披露的化合物。
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括信号转导调节剂和/或血管生成抑制剂或与其组合使用,例如,以治疗障碍(例如像本文所述的癌症)。
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如,本文所述的障碍):EGFR抑制剂,(R,E)-N-(7-氯-1-(1-(4-(二甲基氨基)丁-2-烯酰)氮杂环庚烷-3-基)-1H-苯并[d]咪唑-2-基)-2-甲基异烟酰胺(化合物A40)或在PCT公开号WO 2013/184757中披露的化合物。在一个实施例中,该EGFR抑制剂是(R,E)-N-(7-氯-1-(1-(4-(二甲基氨基)丁-2-烯酰)氮杂环庚烷-3-基)-1H-苯并[d]咪唑-2-基)-2-甲基异烟酰胺(化合物A40)或在PCT公开号WO 2013/184757中披露的化合物。在一个实施例中,将抗人ENTPD2抗体分子与(R,E)-N-(7-氯-1-(1-(4-(二甲基氨基)丁-2-烯酰)氮杂环庚烷-3-基)-1H-苯并[d]咪唑-2-基)-2-甲基异烟酰胺(化合物A40),或在PCT公开号WO 2013/184757中披露的化合物组合使用以治疗障碍(例如,癌症)。
在一些实施例中,将EGFR抑制剂、(R,E)-N-(7-氯-1-(1-(4-(二甲基氨基)丁-2-烯酰)氮杂环庚烷-3-基)-1H-苯并[d]咪唑-2-基)-2-甲基异烟酰胺(化合物A40)、或在PCT公开号WO 2013/184757中披露的化合物与ENTPD2的抑制剂(例如,抗人ENTPD2抗体分子)组合给予以治疗癌症。
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如,本文所述的障碍):ALK抑制剂,N
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如,所述的障碍):IGF-1R抑制剂、3-(4-(4-((5-氯-4-((5-甲基-1H-吡唑-3-基)氨基)嘧啶-2-基)氨基)-5-氟-2-甲基苯基)哌啶-1-基)硫杂环丁烷1,1-二氧化物(化合物A43)、5-氯-N
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如,本文所述的障碍):P-糖蛋白1抑制剂、戊司泊达(也称为AMDRAY;化合物A46)或在中EP 296122披露的化合物。在一个实施例中,P-糖蛋白1抑制剂是戊司泊达(化合物A46)或在EP 296122中披露的化合物。
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如,本文所述的障碍):VEGFR抑制剂、琥珀酸瓦他拉尼(化合物A47)或在EP 296122中披露的化合物中的一种或多种。在一个实施例中,该VEGFR抑制剂是琥珀酸瓦他拉尼(化合物A47)或在EP 296122中披露的化合物。
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如,本文所述的障碍):IDH抑制剂或在WO2014/141104中披露的化合物。在一个实施例中,IDH抑制剂是在PCT公开号WO 2014/141104中披露的化合物。
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如,本文所述的障碍):BCL-ABL抑制剂或在PCT公开号WO 2013/171639、WO 2013/171640、WO 2013/171641、或WO 2013/171642中披露的化合物。在一个实施例中,BCL-ABL抑制剂是在PCT公开号WO2013/171639、WO 2013/171640、WO 2013/171641、或WO 2013/171642中披露的化合物。
在另一个实施例中,组合(例如,包含如本文所述的抗人ENTPD2抗体分子的组合)包括以下项或与以下项组合使用以治疗障碍(例如,本文所述的障碍):c-RAF抑制剂或在PCT公开号WO 2014/151616中披露的化合物。在一个实施例中,c-RAF抑制剂是化合物A50或在PCT公开号WO 2014/151616中披露的化合物。在一些实施例中,c-RAF抑制剂或化合物A50是具有式的(I)的化合物:
b.
c.或其药学上可接受的盐,其中:
d.Z
e.Z
f.R
g.环B选自苯基、吡啶、嘧啶、吡嗪、哒嗪、吡啶酮、嘧啶酮、吡嗪酮、哒嗪酮、和噻唑,其各自任选地被多达两个基团取代,该基团选自卤素、OH、CN、C
i.其中每个C
ii.环B任选地与含有选自N、O合S的多达两个杂原子的5-6元芳香族或非芳香族环稠和,其中该5-6元环可以被卤素、C
h.每个Y独立地选自C
i.或环A上的两个Y基团任选地一起形成与环A稠和或桥接的环,其中所述稠和或桥接的环任选地包含选自N、O和S的杂原子作为环成员,并且任选地被选自C
j.每个R
k.每个p独立地是0、1、或2;
l.q是0、1或2;
m.Z
n.L是-C(=O)-NR
o.CY是选自苯基、吡啶、嘧啶、吡嗪、哒嗪e、吡啶酮、噻唑、异噻唑、噁唑、吡唑、和异噁唑的芳香族环,其中该环任选地与噻吩、咪唑、噁唑酮、或吡咯环稠和;
p.并且CY被多达两个基团取代,该基团选自卤素、CN、R
i.其中每个R
q.R
r.并且在相同氮原子上的两个R
还可以将抗人ENTPD2抗体分子与细胞疗法组合,例如,嵌合抗原受体(CAR)疗法、T细胞疗法、自然杀伤(NK)细胞疗法、或树突细胞疗法。
与CAR疗法的组合
本文所述的抗人ENTPD2抗体分子可以与第二治疗剂(例如,包含嵌合抗原受体(CAR)的细胞)组合给予。该CAR可以包括i)细胞外抗原结合结构域、ii)跨膜结构域、和iii)细胞内信号传导结构域(可以包含第初级信号传导结构域和共刺激结构域中的一个或两个第一信号传导结构域和共刺激结构域)。该CAR可以进一步包含前导序列和/或铰链序列。在具体的实施例中,CAR构建体包含scFv结构域,其中scFv之前可以是任选的前导序列,并且之后是任选的铰链序列、跨膜区和细胞内信号传导结构域,例如,其中这些结构域与相同的阅读框架邻接并在其中形成单一的融合蛋白。
在一些实施例中,CAR分子包含本文所述的CD19 CAR分子,例如,在US 2015/0283178中所述的CD19 CAR分子(例如,CTL019)。在实施例中,CD19 CAR包含氨基酸,或具有US 2015/0283178中所示的核苷酸序列(通过引用以其全文并入本文),或与其基本上相同的序列(例如,与其具有至少约85%、90%、或95%序列同一性的序列)。
在一个实施例中,结合CD19的CAR T细胞具有USAN名称TISAGENLECLEUCEL-T。CTL019通过T细胞的基因修饰来制备,该CTL019通过用在EF-1α启动子控制下含有CTL019转基因的自身失活、复制缺陷型慢病毒(LV)运载体的转导进行稳定插入来介导。CTL019可以是转基因阳性和阴性T细胞的混合物,其基于转基因阳性T细胞百分比递送至受试者。
在一个实施例中,CD19 CAR包含在PCT公开WO 2012/079000中作为SEQ ID NO:12提供的氨基酸序列。在实施例中,该氨基酸序列是:
或与其基本上同源的序列(例如,与其具有至少约85%、90%、或95%序列同一性的序列),有或没有用大写字母表示的信号肽序列。
在一个实施例中,氨基酸序列是:
或与其基本上同源的序列(例如,与其具有至少约85%、90%、或95%序列同一性的序列)。
嵌合抗原受体(CAR)的抗原结合结构域
抗原结合结构域可以是与抗原结合的任何结构域,包括但不限于单克隆抗体、多克隆抗体、重组抗体、人抗体、人源化抗体、及其功能片段,包括但不限于单结构域抗体(如骆驼来源的纳米抗体的重链可变结构域(VH)、轻链可变结构域(VL)、和可变结构域(VHH)),以及本领域已知的用作抗原结合结构域的可替代支架(如重组纤连蛋白结构域等)、T细胞受体(TCR)或其片段(例如,单链TCR)等。在一些情况下,抗原结合结构域衍生自其中最终将使用CAR的相同物种是有益的。例如,对于在人中使用,CAR的抗原结合结构域包含抗体或抗体片段的抗原结合结构域的人或人源化残基可以是有益的。
在一些实施例中,CAR的抗原结合结构域是scFv抗体片段,该scFv抗体片段与衍生出它的scFv的鼠序列相比是人源化的。
在一些实施例中,抗原结合结构域结合本文所述的肿瘤抗原。在实施例中,肿瘤抗原选自:CD19;CD123;CD22;CD30;CD171;CS-1(也称为CD2亚群1、CRACC、SLAMF7、CD319、以及19A24);C型凝集素样分子-1(CLL-1或CLECL1);CD33;表皮生长因子受体变体III(EGFRvIII);神经节苷脂G2(GD2);神经节苷脂GD3(aNeu5Ac(2-8)aNeu5Ac(2-3)bDGalp(1-4)bDGlcp(1-1)Cer);TNF受体家族成员B细胞成熟(BCMA);Tn抗原((Tn Ag)或(GalNAcα-Ser/Thr));前列腺特异性膜抗原(PSMA);受体酪氨酸激酶样孤儿受体1(ROR1);Fms样酪氨酸激酶3(FLT3);肿瘤相关糖蛋白72(TAG72);CD38;CD44v6;癌胚抗原(CEA);上皮细胞粘附分子(EPCAM);B7H3(CD276);KIT(CD117);白细胞介素-13受体亚基α-2(IL-13Ra2或CD213A2);间皮素;白细胞介素11受体α(IL-11Ra);前列腺干细胞抗原(PSCA);蛋白酶丝氨酸21(睾蛋白或PRSS21);血管内皮生长因子受体2(VEGFR2);Lewis(Y)抗原;CD24;血小板衍生的生长因子受体β(PDGFR-β);阶段特异性胚胎抗原-4(SSEA-4);CD20;叶酸受体α;受体酪氨酸蛋白激酶ERBB2(Her2/neu);黏蛋白1,细胞表面相关的(MUC1);表皮生长因子受体(EGFR);神经细胞粘附分子(NCAM);前列腺酶;前列腺酸性磷酸酶(PAP);突变的延伸因子2(ELF2M);肝配蛋白B2;成纤维细胞活化蛋白α(FAP);胰岛素样生长因子1受体(IGF-I受体),碳酸酐酶IX(CAIX);蛋白酶体(Prosome,Macropain)亚基,β型,9(LMP2);糖蛋白100(gp100);由断裂点簇集区(BCR)和Abelson鼠白血病病毒致癌基因同源物1(Abl)组成的致癌基因融合蛋白(bcr-abl);酪氨酸酶;肝配蛋白A型受体2(EphA2);岩藻糖基GM1;唾液酸Lewis粘附分子(sLe);神经节苷脂GM3(aNeu5Ac(2-3)bDGalp(1-4)bDGlcp(1-1)Cer);转谷氨酰胺酶5(TGS5);高分子量-黑素瘤相关抗原(HMWMAA);o-乙酰基-GD2神经节苷脂(OAcGD2);叶酸受体β;肿瘤内皮标记1(TEM1/CD248);肿瘤内皮标记7相关的(TEM7R);密封蛋白6(CLDN6);促甲状腺激素受体(TSHR);G蛋白偶联受体C类5组,成员D(GPRC5D);染色体X开放阅读框61(CXORF61);CD97;CD179a;间变性淋巴瘤激酶(ALK);聚唾液酸;胎盘特异性1(PLAC1);globoH糖基神经酰胺(GloboH)的六糖部分;乳腺分化抗原(NY-BR-1);尿溶蛋白2(UPK2);甲型肝炎病毒细胞受体1(HAVCR1);肾上腺素受体β3(ADRB3);泛连接蛋白3(PANX3);G蛋白偶联受体20(GPR20);淋巴细胞抗原6复合物,基因座K 9(LY6K);嗅觉受体51E2(OR51E2);TCRγ替代性阅读框蛋白(TARP);肾母细胞瘤蛋白(WT1);癌/睾丸抗原1(NY-ESO-1);癌/睾丸抗原2(LAGE-1a);黑色素瘤相关抗原1(MAGE-A1);ETS易位变异基因6,位于染色体12p上(ETV6-AML);精子蛋白17(SPA17);X抗原家族,成员1A(XAGE1);血管生成素结合细胞表面受体2(Tie 2);黑素瘤癌睾丸抗原-1(MAD-CT-1);黑素瘤癌睾丸抗原-2(MAD-CT-2);Fos相关的抗原1;肿瘤蛋白p53(p53);p53突变体;前列腺特异性蛋白(prostein);存活蛋白(surviving);端粒酶;前列腺癌肿瘤抗原-1(PCTA-1或半乳糖蛋白8)、T细胞1识别的黑色素瘤抗原(MelanA或MART1);大鼠肉瘤(Ras)突变体;人端粒酶逆转录酶(hTERT);肉瘤易位断点;黑素瘤细胞凋亡抑制剂(ML-IAP);ERG(跨膜蛋白酶、丝氨酸2(TMPRSS2)ETS融合基因);N-乙酰葡糖胺基转移酶V(NA17);配对盒蛋白Pax-3(PAX3);雄激素受体;细胞周期蛋白B1;v-myc禽类骨髓细胞瘤病毒致癌基因神经母细胞瘤来源同源物(MYCN);Ras同源物家族成员C(RhoC);酪氨酸酶相关蛋白2(TRP-2);细胞色素P450 1B1(CYP1B1);CCCTC-结合因子(锌指蛋白)样(BORIS或印记位点调节因子样蛋白(Brother of the Regulator ofImprinted Sites)),T细胞3识别的鳞状细胞癌抗原(SART3);配对盒蛋白Pax-5(PAX5);前顶体蛋白结合蛋白sp32(OY-TES1);淋巴细胞特异性蛋白酪氨酸激酶(LCK);激酶锚蛋白4(AKAP-4);滑膜肉瘤,X断点2(SSX2);晚期糖基化终产物受体(RAGE-1);肾遍在蛋白1(RU1);肾遍在蛋白2(RU2);豆荚蛋白;人乳头状瘤病毒E6(HPV E6);人乳头状瘤病毒E7(HPV E7);肠羧酸酯酶;突变的热休克蛋白70-2(mut hsp70-2);CD79a;CD79b;CD72;白细胞相关的免疫球蛋白样受体1(LAIR1);IgA受体的Fc片段(FCAR或CD89);白细胞免疫球蛋白样受体亚家族A成员2(LILRA2);CD300分子样家族成员f(CD300LF);C型凝集素结构域家族12成员A(CLEC12A);骨髓基质细胞抗原2(BST2);含EGF样模块的粘蛋白样激素受体样2(EMR2);淋巴细胞抗原75(LY75);磷脂酰肌醇蛋白聚糖-3(GPC3);Fc受体样5(FCRL5);以及免疫球蛋白λ样多肽1(IGLL1)。
在一个实施例中,该CAR分子包含BCMA CAR分子,例如,在US 2016/0046724或WO2016/014565中所述的BCMA CAR,这些申请通过引用并入本文中。在实施例中,该BCMA CAR包含氨基酸,或具有CAR分子的核苷酸序列,或根据US 2016/0046724、或表1或16、WO 2016/014565(通过引用并入本文中)的SEQ ID NO:271或SEQ ID NO:273的抗原结合结构域,或与前述序列中任一项基本上同一的序列(例如,与前述BCMA CAR序列中的任一项具有至少约85%、90%、或95%序列同一性)。在WO 2016/014565中详细说明了编码BCMA CAR分子和抗原结合结构域(例如,包括根据卡巴特或乔西亚的一个、两个、三个VH CDR和一个、两个、三个VL CDR)的氨基酸和核苷酸序列。
关于跨膜结构域,在各种实施例中,CAR可以设计为包含附接至CAR的细胞外结构域的跨膜结构域。
跨膜结构域可以源自天然来源或来自重组来源。在来源是天然的情况下,该结构域可以源自任何膜结合或跨膜蛋白。在一方面,每当CAR结合靶标时,跨膜结构域能够将信号传导至一个或多个细胞内结构域。跨膜结构域可以至少包括例如T细胞受体的α、β或ζ链、CD28、CD27、CD3ε、CD45、CD4、CD5、CD8、CD9、CD16、CD22、CD33、CD37、CD64、CD80、CD86、CD134、CD137、CD154的一个或多个跨膜区。在一些实施例中,跨膜结构域可以至少包括以下中的一个或多个跨膜区:例如KIRDS2、OX40、CD2、CD27、LFA-1(CD11a、CD18)、ICOS(CD278)、4-1BB(CD137)、GITR、CD40、BAFFR、HVEM(LIGHTR)、SLAMF7、NKp80(KLRF1)、NKp44、NKp30、NKp46、CD160、CD19、IL2Rβ、IL2Rγ、IL7Rα、ITGA1、VLA1、CD49a、ITGA4、IA4、CD49D、ITGA6、VLA-6、CD49f、ITGAD、CD11d、ITGAE、CD103、ITGAL、CD11a、LFA-1、ITGAM、CD11b、ITGAX、CD11c、ITGB1、CD29、ITGB2、CD18、LFA-1、ITGB7、TNFR2、DNAM1(CD226)、SLAMF4(CD244、2B4)、CD84、CD96(Tactile)、CEACAM1、CRTAM、Ly9(CD229)、CD160(BY55)、PSGL1、CD100(SEMA4D)、SLAMF6(NTB-A、Ly108)、SLAM(SLAMF1、CD150、IPO-3)、BLAME(SLAMF8)、SELPLG(CD162)、LTBR、PAG/Cbp、NKG2D或NKG2C。
在一些情况下,跨膜结构域可以通过铰链(例如来自人蛋白质的铰链)附接到CAR的细胞外区域(例如CAR的抗原结合结构域)。例如,在一个实施例中,该铰链可以是人Ig(免疫球蛋白)铰链(例如IgG4铰链、IgD铰链)、GS接头(例如本文描述的GS接头)、KIR2DS2铰链或CD8a铰链。
CAR的细胞质结构域或区包含细胞内信号传导结构域。细胞内信号传导结构域通常负责活化已引入CAR的免疫细胞的至少一种正常效应子功能。
用于在CAR中使用的细胞内信号传导结构域的实例包括T细胞受体(TCR)和共受体的细胞质序列(它们协同作用以在抗原受体接合后启动信号转导)以及这些序列的任何衍生物或变体和任何具有相同功能能力的重组序列。
初级信号传导结构域以刺激方式或以抑制性方式调控TCR复合物的初级活化。以刺激方式起作用的初级细胞内信号传导结构域可以含有被称为基于免疫受体酪氨酸的活化基序或ITAM的信号传导基序。
含有初级细胞内信号传导结构域的ITAM的实例包括以下的那些:CD3ζ、常见FcRγ(FCER1G)、FcγRIIa、FcRβ(FcεR1b)、CD3γ、CD3δ、CD3ε、CD79a、CD79b、DAP10、和DAP12。在一个实施例中,CAR包含细胞内信号传导结构域,例如,CD3-ζ的第一信号传导结构域。
CAR的细胞内信号传导结构域可以包含CD3-ζ信号传导结构域本身,或者它可以与在本发明的CAR的背景中使用的任何其他所需细胞内信号传导结构域组合。例如,CAR的细胞内信号传导结构域可以包含CD3ζ链部分和共刺激信号传导结构域。共刺激信号传导结构域是指CAR的包含共刺激分子的细胞内结构域的部分。共刺激分子是除了抗原受体或其配体之外的细胞表面分子,是淋巴细胞对抗原的有效应答所必需的。此类分子的实例包括CD27、CD28、4-1BB(CD137)、OX40、CD30、CD40、PD-1、ICOS、淋巴细胞功能相关抗原-1(LFA-1)、CD2、CD7、LIGHT、NKG2C、B7-H3和结合CD83的配体等。例如,已证明CD27共刺激可增强体外人CART细胞的扩增、效应子功能、和存活,并增加体内人T细胞持久性和抗肿瘤活性(Song等人Blood.[血液]2012;119(3):696-706)。此类共刺激分子的其他实例包括CDS、ICAM-1、GITR、BAFFR、HVEM(LIGHTR)、SLAMF7、NKp80(KLRF1)、NKp44、NKp30、NKp46、CD160、CD19、CD4、CD8α、CD8β、IL2Rβ、IL2Rγ、IL7Rα、ITGA4、VLA1、CD49a、ITGA4、IA4、CD49D、ITGA6、VLA-6、CD49f、ITGAD、CD11d、ITGAE、CD103、ITGAL、CD11a、LFA-1、ITGAM、CD11b、ITGAX、CD11c、ITGB1、CD29、ITGB2、CD18、LFA-1、ITGB7、TNFR2、TRANCE/RANKL、DNAM1(CD226)、SLAMF4(CD244、2B4)、CD84、CD96(Tactile)、NKG2D、CEACAM1、CRTAM、Ly9(CD229)、CD160(BY55)、PSGL1、CD100(SEMA4D)、CD69、SLAMF6(NTB-A、Ly108)、SLAM(SLAMF1、CD150、IPO-3)、BLAME(SLAMF8)、SELPLG(CD162)、LTBR、LAT、GADS、SLP-76、PAG/Cbp、和CD19a。
免疫效应细胞(如T细胞)通常可以使用如描述于例如以下中的方法进行活化和扩增:美国专利6,352,694;6,534,055;6,905,680;6,692,964;5,858,358;6,887,466;6,905,681;7,144,575;7,067,318;7,172,869;7,232,566;7,175,843;5,883,223;6,905,874;6,797,514;6,867,041;和美国专利申请公开号2006/0121005,通过引用并入本文中。
免疫效应细胞的实例包括T细胞,例如α/βT细胞和γ/δT细胞、B细胞、天然杀伤(NK)细胞、天然杀伤T(NKT)细胞、肥大细胞、和骨髓衍生的吞噬细胞。
制备CAR表达细胞的方法描述于例如,US 2016/0185861中,通过引用并入本文中。
可以将抗人ENTPD2抗体分子与以下项组合:免疫原性剂(例如,癌细胞)、经纯化的肿瘤抗原(包括重组蛋白质、肽、和碳水化合物分子)、细胞和用编码免疫刺激的细胞因子的基因转染的细胞(He等人,(2004)J.Immunol.[免疫学杂志]173:4919-28)。可以使用的肿瘤疫苗的非限制性实例包括黑素瘤抗原的肽,例如gp100、MAGE抗原、Trp-2、MART1和/或酪氨酸酶的肽、转染以表达细胞因子GM-CSF的肿瘤细胞、基于DNA的疫苗、基于RNA的疫苗、和基于病毒转导的疫苗。癌症疫苗可以是预防性或治疗性的。
可以将ENTPD2阻断物与肿瘤中表达的重组蛋白和/或肽的集合结合使用,以便于产生对这些蛋白的免疫应答。
其他肿瘤疫苗可以包括来自与人癌症有关的以下病毒的蛋白质,如人乳头瘤病毒(HPV)、肝炎病毒(HBV和HCV)、卡波西氏疱疹肉瘤病毒(KHSV)和EB病毒(Epstein-Barrvirus,EBV)。可以与ENTPD2阻断物结合使用的另一种形式的肿瘤特异性抗原是从肿瘤组织本身分离的经纯化的热休克蛋白(HSP)。这些热休克蛋白含有来自肿瘤细胞的蛋白质片段,并且这些HSP在递送至抗原递送细胞时具有高效率,可引发肿瘤免疫(Suot,R和Srivastava,P(1995)Science[科学]269:1585-1588;Tamura,Y.等人,(1997)Science[科学]278:117-120)。
树突细胞(DC)是有效的抗原呈递细胞,可用于引发抗原特异性应答。DC可以离体产生并加载各种蛋白质和肽抗原以及肿瘤细胞提取物(Nestle,F.等人,(1998)NatureMedicine[自然医学]4:328-332)。DC也可以通过遗传手段转导以表达这些肿瘤抗原。出于免疫目的,DC也已经直接与肿瘤细胞融合(Kugler,A.等人,(2000)Nature Medicine[自然医学]6:332-336)。作为疫苗接种的方法,DC免疫可以与CD73阻断物有效组合以活化更有效的抗肿瘤反应。
可以将抗人ENTPD2抗体分子与溶瘤病毒组合给予。在实施例中,溶瘤病毒能够选择性地复制并引发癌细胞的死亡或减缓其生长。在一些情况下,溶瘤病毒对非癌细胞没有影响或影响很小。在一些实施例中,将组合用于治疗癌症,例如,本文所述的癌症。溶瘤病毒包括但不限于溶瘤腺病毒、溶瘤性单纯疱疹病毒、溶瘤性逆转录病毒、溶瘤性细小病毒、溶瘤性痘苗病毒、溶瘤性辛奈病毒(oncolytic Sindbis virus)、溶瘤性流感病毒、或溶瘤性RNA病毒(例如,溶瘤性呼肠孤病毒、溶瘤性新城疫病毒(NDV)、溶瘤性麻疹病毒、或溶瘤性水疱性口炎病毒(VSV))。
示例性溶瘤病毒包括但不限于以下:
B组溶瘤腺病毒(ColoAd1)(PsiOxus Therapeutics公司)(参见例如,临床试验标识:;NCT 02053220);
ONCOS-102(以前称为CGTG-102),其是包含粒细胞-巨噬细胞集落刺激因子(GM-CSF)(昂克斯治疗公司(Oncos Therapeutics))的腺病毒(参见例如,临床试验标识符:;NCT01598129);
VCN-01,其是基因修饰的溶瘤人腺病毒,编码人PH20透明质酸酶(VCNBiosciences,S.L.)(参见,例如,临床试验标识符:NCT 02045602和NCT 02045589);
条件复制型腺病毒ICOVIR-5,其是经修饰以在癌细胞中用失调的视网膜母细胞瘤/E2F途径选择性复制的源自野生型人腺病毒血清型5(Had5)的病毒,(Institut Catalàd'Oncologia公司)(参见例如,临床试验标识:NCT 01864759);
Celyvir,其包含用ICOVIR5感染的骨髓来源的自体间充质干细胞(MSC),该ICOVIR5是溶瘤腺病毒(西班牙马德里的小耶稣大学儿童医院(Hospital InfantilUniversitario
CG0070,其是条件性复制的溶瘤血清型5腺病毒(Ad5),其中人E2F-1启动子驱动必需E1a病毒基因的表达,从而限制病毒复制和对Rb途径缺陷型肿瘤细胞的细胞毒性(ColdGenesys公司)(参见例如,临床试验标识:NCT 02143804);或
DNX-2401(以前命名为δ-24-RGD),其是腺病毒,该腺病毒经工程化以在视网膜母细胞瘤(Rb)途径缺陷型细胞中选择性地复制并感染更高效地表达某些RGD结合整联蛋白的细胞(纳瓦拉大学医院(Clinica Universidad de Navarra),纳瓦拉大学(Universidad deNavarra)/德那翠丝有限公司(DNAtrix,Inc.))(参见例如,临床试验标识符:NCT01956734)。
在一些实施例中,将本文所述的溶瘤病毒通过注射(例如,皮下、动脉内、静脉内、肌肉内、鞘内、或腹膜内注射)给予。在实施例中,将本文所述的溶瘤病毒通过肿瘤内、透皮、经粘膜、口服、鼻内、或经由肺部给药给予。
抗人ENTPD2抗体分子(单独地或与其他刺激剂组合)和癌症护理的标准品的示例性组合包括至少以下。在某些实施例中,将抗人ENTPD2抗体分子(例如,本文所述的抗人ENTPD2抗体分子)与癌症护理的化学治疗剂的标准品组合使用,这些化学治疗剂包括但不限于阿那曲唑
在某些实施例中,将抗人ENTPD2抗体分子(例如,本文所述的抗人ENTPD2抗体分子)与烷基化剂组合使用,该烷基化剂包括但不限于氮芥、乙烯亚胺衍生物、烷基磺酸盐、亚硝基脲和三氮烯):乌拉莫司汀(Aminouracil
在某些实施例中,该抗人ENTPD2抗体分子(例如,本文所述的抗人ENTPD2抗体分子)与蒽环类组合使用,包括但不限于例如,阿霉素(
可以与如本文所述的抗人ENTPD2抗体组合使用的示例性蛋白酶体抑制剂包括,但不限于硼替佐米
在某些实施例中,将抗人ENTPD2抗体分子与放射疗法组合给予。放射疗法可以通过若干方法之一或方法的组合来给予,包括但不限于外部束疗法、内部放射疗法、植入物放射、立体定向放射外科手术、全身放射疗法、放射疗法和永久或临时间质近距离放射疗法。术语“近距离放射疗法”是指通过将空间限制的放射性物质插入体内在肿瘤或其他增殖性组织疾病部位处或附近而递送的放射疗法。术语意在但不限于包括暴露于放射性同位素(例如,At-211、I-131、I-125、Y-90、Re-186、Re-188、Sm-153、Bi-212、P-32、和Lu的放射性同位素)。适合用作本发明细胞调节剂的辐射源包括固体和液体。通过非限制性实例,辐射源可以是放射性核素,例如作为固体源的I-125、I-131、Yb-169、Ir-192,作为固体源的I-125,或其他发射光子、β粒子、γ辐射或其他治疗射线的放射性核素。放射性材料也可以是由一种或多种放射性核素的任何溶液(例如I-125或I-131的溶液)制成的流体,或可以使用含有小颗粒的固体放射性核素(如Au-198,Y-90)的合适流体的浆液来生产放射性流体。
ENTPD2阻断物也可以与化学治疗方案有效组合。在这些情况下,可以减少所给予的化学治疗剂的剂量。
可以与抗人ENTPD2抗体分子组合给予的示例性细胞毒性剂包括抗微管剂、拓扑异构酶抑制剂、抗代谢物、有丝分裂抑制剂、烷化剂、蒽环类药物、长春花生物碱、嵌入剂、能够干扰信号转导途径的试剂、促进细胞凋亡的试剂、蛋白酶体抑制剂和辐射(例如局部或全身辐射)。
可以使用本领域已知的任何一种方法(例如通过活检或手术)从受试者获得本文所述方法中使用的样品。样品可以快速冷冻并储存在-80℃以备后用。样品也可以用固定剂(例如甲醛、多聚甲醛或乙酸/乙醇)固定。可以从新鲜、冷冻或固定的样品中提取RNA或蛋白质用于分析。
药物组合物、剂量和给予方法
本文还提供了用于在治疗ENTPD2相关的疾病(例如,如本文所述的癌症)中使用的组合物(例如,药物组合物)。此类组合物包含本文所述的一种或多种抗体或抗原结合片段、编码此类抗体或抗原结合片段的核酸、或包含编码此类抗体或抗原结合片段的核酸的运载体。此类组合物可以进一步包含另一种药剂,例如当前针对待治疗疾病的护理标准。
药物组合物典型地包含药学上可接受的载体。如在此使用,表达“药学上可接受的载体”包括与药物给予可相容的盐、溶剂、分散介质、涂料、抗细菌的和抗真菌的药剂、等渗剂和吸收延迟剂等。典型地,药物组合物被配制成与预期的给予途径相容。给予途径的实例包括肠胃外(例如,静脉内、动脉内、腹膜内)、颅内、鞘内或鼻内(例如,吸入)、皮内、皮下或肿瘤内给予。
本文使用的短语“药学上可接受的”是指在合理的医学判断的范围,适合用于与人类和动物的组织接触而不产生过度毒性、刺激、过敏反应、或其他问题或并发症,同时具有相称的合理受益/风险比的那些化合物、材料、组合物、和/或剂型。
在一些实施例中,这些药物组合物包含一种或多种药学上可接受的载体,包括例如,离子交换剂、氧化铝、硬脂酸铝、卵磷脂、血清蛋白(例如人血清白蛋白)、缓冲物质(例如磷酸盐)、甘氨酸、山梨酸、山梨酸钾、饱和植物脂肪酸的部分甘油酯混合物、水、盐或电解质(例如硫酸鱼精蛋白)、磷酸氢二钠、磷酸氢钾、氯化钠、锌盐、胶体二氧化硅、三硅酸镁、聚乙烯吡咯烷酮、纤维素基物质、聚乙二醇、羧甲基纤维素钠、聚丙烯酸酯、蜡类、聚乙烯-聚氧丙烯-嵌段聚合物、聚乙二醇和羊毛脂。
配制适合的药物组合物的方法在本领域中是已知的,参见,例如,Remington:TheScience and Practice of Pharmacy.[雷明顿:药物科学与实践]第21版,2005;和在Drugsand the Pharmaceutical Sciences:a Series of Textbooks and Monographs[药物和药物科学:一系列教科书和专著](Dekker,NY)系列中的书籍。例如,被用于胃肠外或皮下应用的溶液或悬浮液可以包括以下组分:无菌稀释剂,如注射用水、盐水溶液、固定油、聚乙二醇、甘油、丙二醇或其他合成溶剂;抗细菌剂,如苯甲醇或对羟基苯甲酸甲酯;抗氧化剂,如抗坏血酸或亚硫酸氢钠;螯合剂,如乙二胺四乙酸;缓冲剂如乙酸盐、柠檬酸盐或磷酸盐;并且用于调节渗透压的试剂如氯化钠或葡萄糖。可以用酸或碱(例如盐酸或氢氧化钠)调节pH。制剂可以被封装在由玻璃或塑料制成的安瓿、一次性注射器或多剂量小瓶中。
适合于可注射使用的药物组合物可以包括无菌水溶液(在水溶性的情况下)或分散体、以及用于临时制备无菌可注射溶液或分散液的无菌粉末。对于静脉内的给予,适当的载体包括生理盐水、抑菌水、Cremophor EL
可以通过以下各项来制备无菌可注射溶液:将活性化合物以所需的量,根据需要,与一种以上列举的成分或这些成分的组合并入适当的溶剂中,然后进行过滤灭菌。
总体上,通过将有效化合物掺入无菌媒介物来制备分散体,该无菌媒介物含有基础分散介质以及来自以上列举的所需其他成分。就用于制备无菌可注射溶液的无菌粉末而言,优选制备方法是真空干燥和冷冻干燥,这些方法产生活性成分的粉末以及来自其以前的无菌过滤溶液的任何另外的所希望的成分。
胃肠外配制品可以是单次推注剂量,输注或加载推注剂量,然后是维持剂量。可以按具体的固定或可变的间隔,例如每天一次,或“按需”给予这些组合物。
用于注射的合适的药物组合物可以包含缓冲液(例如,乙酸盐、磷酸盐或柠檬酸盐缓冲液);表面活性剂(例如聚山梨醇酯);任选的稳定剂(例如,人白蛋白)等。外周给予的制剂包括无菌水溶液或非水溶液、悬浮液和乳液。非水溶剂的例子是丙二醇、聚乙二醇、植物油如橄榄油和可注射用有机酯如油酸乙酯。含水载体包括例如水、醇/水溶液、乳剂或悬液,包括盐水和缓冲的介质。在一些实施例中,该药物组合物包含0.01-0.1M磷酸盐缓冲液或0.8%盐水。其他常见的胃肠外媒介物包括磷酸钠溶液、林格氏右旋糖、右旋糖和氯化钠、乳酸林格氏液或不挥发性油。静脉内媒介物可以包括流体和营养补充物、电解质补充物,如基于Ringer右旋糖的那些等。防腐剂和其他添加物也可以存在,如,例如抗微生物药、抗氧化剂、螯合剂、和惰性气体等。
在一个实施例中,将这些治疗性化合物与保护这些治疗性化合物免于从体内快速消除的载体一起制备,如控释配制品,包括植入物和微囊化的递送系统。
药物组合物可以与给药的说明书一起包括在容器、包装、或分配器中。
可以通过细胞培养或实验动物中的标准制药程序来确定治疗性化合物的剂量、毒性和治疗效果,例如,用于确定LD50(使50%的群体致死的剂量)和ED50(在50%的患者群体中治疗有效的剂量)。在毒性和治疗效果之间的剂量比为治疗指数,它可以表示为比率LD50/ED50。表现出高治疗指数的化合物是优选的。尽管可以使用表现出有毒副作用的化合物,但是应该小心设计将此类化合物靶向至受影响的组织的部位的递送系统,从而将对未感染的细胞的潜在损伤最小化,并且由此减少副作用。
从细胞培养测定和动物研究获得的数据可以用于配制一系列的用于在人类中使用的剂量。优选这些化合物的剂量处于包括ED50在内的有很小毒性或没有毒性的循环浓度范围内。该剂量可根据所应用的剂型和所使用的给药途径在该范围内变化。对于用于本发明方法的任何化合物,均可根据细胞培养试验初步估计治疗有效剂量。一种剂量可以在动物模型中被配制以达到在细胞培养中确定的一种循环血浆浓度范围,该范围包括IC50(即该测试化合物的完成半最大症状的抑制的浓度)。该信息可用于更精确地确定在人中有用的剂量。可以例如通过高效液相色谱法来测量血浆中的水平。
试剂盒
本文还提供了试剂盒,该试剂盒包括一种或多种本文提供的组合物和使用说明书。使用说明书可以包括用于诊断或治疗如本文所述的ENTPD2相关疾病(例如癌症)的说明书。本文提供的试剂盒可根据本文所述的任何一种方法使用。本领域技术人员将知道本文提供的试剂盒的其他合适用途,并且将能够针对此类用途使用该试剂盒。本文提供的试剂盒还可以包括邮寄(例如,邮资支付信封或邮寄包),其可以用于将样品返回用于分析,例如,返回实验室。试剂盒可以包括一个或多个用于样品的容器,或样品可以在标准血液收集瓶中。试剂盒还可以包括以下的一种或多种:知情同意书,试验申请表和关于如何在本文所述方法中使用试剂盒的说明。本文还包括使用此类试剂盒的方法。可以对一个或多个表格(例如,测试申请表)和装有样品的容器进行编码,例如,用条形码来鉴定提供样品的受试者。
本领域技术人员将认识到许多类似于或等同于本文所述那些的方法和材料,这些方法和材料可用于实践本发明。实际上,本发明决不限于所描述的方法和材料。
实例
虽然已经讨论了本发明的特定实施例,但上述说明是说明性而非限制性的。在综述本说明书和以下权利要求书之后,本发明的许多修改对于本领域的技术人员将是显而易见的。应当通过参考权利要求书及其等同形式的全范围以及说明书连同此类变化来确定本发明的全范围。在以下实例中进一步描述了本发明,这些实例不限制权利要求中描述的本发明的范围。
外核苷三磷酸二磷酸水解酶2(也称为ENTPD2、NTPD酶2、NTPD酶-2、外-ATP酶2、外-ATPD酶2、CD39抗原样1、CD39L1、外-ATP-二磷酸水解酶2)属于调节嘌呤信号传导(特别地ATP、UTP、以及细胞外空间中的ADP和UDP)的细胞外ATP水解酶家族(关于综述参见Robson等人Purinergic Signaling[嘌呤信号传导]2:409-430(2006))。ATP/ADP水解的终产物5’AMP随后通过外-5’-核苷酸酶(也称为外5’Nt酶或CD73)去磷酸化为腺苷。
ENTPD2在癌症中的功能作用尚未得到很好的描述。早期报道集中在大鼠胶质瘤模型中ENTPD2的过表达,该过表达通过ADP介导的血小板调节和肿瘤微环境导致体内肿瘤生长增强,并促进增强肿瘤扩散的炎症状态(Braganhol等人Cancer Sci[癌症科学]100(8):1434-42(2009);Braganhol等人Purinergic Signal[嘌呤信号]8(2):235-43(2012))。最近报道了在肝细胞癌中ENTPD2的升高的表达,其中该表达与预后较差相关,该预后是由于增强的髓样来源的抑制细胞积累/维持而导致的(Chiu等人Nature Communications[自然通讯]8(1):517(2017))。
尽管ENTPD2在癌症中的功能特征在公共结构域中受到限制,但释放到细胞外空间的嘌呤介质(如ATP和腺苷)已被证明在免疫和炎症中起重要作用。从受压、受损或凋亡的细胞释放的ATP通过活化P2RX和P2RY受体引发快速炎症,这些受体增强免疫细胞的募集,增强T细胞中TCR信号传导并促进树突细胞和巨噬细胞活化。另一方面,腺苷信号传导通过抑制效应T细胞以及单核吞噬细胞的失调而导致免疫抑制性生态位(关于综述,参见Cekic等人Nature Reviews Immunology[自然免疫学综述]16:177-192(2016),Antonioli等人NatureReviews Cancer[自然癌症综述]13:842-857(2013))。在肿瘤部位的临床前腺苷信号传导的阻断物或细胞外ATP的恢复已经证明诱导淋巴细胞募集和抗肿瘤反应(Michaud等人Science[科学]334(6062):1573-7(2011);Allard等人Clinical Cancer Research[临床癌症研究]19(20):5626-35(2013))。
癌细胞中ENTPD2的升高的表达有可能显著改变肿瘤微环境中嘌呤信号传导的平衡,使其转向更具免疫抑制的状态。因此,ENTPD2催化功能的靶向抑制可提供将平衡转向ATP驱动的促炎性Th-1样状态的机会,从而增强抗肿瘤免疫应答。
尚未在不同的肿瘤亚型中仔细检查ENTPD2表达。将抗人ENTPD2mAb1用于评估来自不同适应症的癌细胞系的ENTPD2表达。将细胞用抗人ENTPD2 mAb1按5μg/ml在冰上染色45min,然后与山羊抗人IgG、Fcγ特异性、Alexa Fluor 647或APC缀合的次级Ab(1:400稀释;杰克逊免疫研究实验室公司(Jackson ImmunoResearch Laboratories),西格罗夫,宾夕法尼亚州)孵育。所有的孵育和洗涤均在FACS缓冲液中进行,该缓冲液由以下项组成:1xHyClone磷酸盐缓冲盐水(GE医疗集团(GE Healthcare),匹兹堡,宾夕法尼亚州)、1%HyClone胎牛血清(GE医疗集团,匹兹堡,宾夕法尼亚州)、2mM EDTA(赛默飞世尔公司(ThermoFisher),沃尔瑟姆,马萨诸塞州)。
如图1A所示,在来自结肠直肠癌、食管癌、胃癌、乳腺癌和肺癌适应症的代表性癌细胞系中观察到ENTPD2的表达升高。根据制造商的说明,使用来自班斯实验室(BangsLaboratories)(Fishers,IN)的Quantum Simply Cellular抗人IgG对ENTPD2受体密度进行定量(表20,图1B)。
为了评估原发性肿瘤组织中ENTPD2蛋白表达,从Cureline(布里斯班,加利福尼亚州)获得具有匹配的相邻正常组织的福尔马林固定的石蜡包埋的肿瘤组织微阵列。用抗CD39L1/ENTPD2 IHC Ab(NBP1-85752,诺乌斯,立托顿,科罗拉多州(Novus,Littleton,CO)),使用自动Ventana方案进行IHC染色,其中在95℃下标准高pH CC1抗原修复,并随后与Ventana
在结肠直肠癌、食管癌和卵巢肿瘤样品的亚组中观察到定位于细胞膜的升高的ENTPD2表达。在匹配的正常组织切片中未检测到或检测到非常低的ENTPD2表达背景水平(图2)。
人、大鼠、小鼠和食蟹猴ENTPD2的表达构建体的产生
编码来自人、食蟹猴(cyno)、大鼠和小鼠的全长ENTPD2以及来自人和小鼠的ENTPD1(CD39)的核苷酸序列基于来自
表24.用于生成抗ENTPD2抗体的试剂的序列
来自HEK培养基的重组小鼠ENTPD1以及小鼠和大鼠ENTPD2的表达和纯化
如下产生重组单体小鼠或大鼠ENTPD2以及小鼠ENTPD1:将FreeStyle
来自昆虫细胞的人ENTPD1以及人和食蟹猴ENTPD2的表达和纯化
将
稳定表达ENTPD1或ENTPD2的细胞系的产生
使用逆转录病毒转导产生稳定的ENTPD1或ENTPD2表达细胞系。根据制造商的建议,为产生逆转录病毒,使用
病毒样颗粒(VLP)的产生、表达和纯化
将300.19细胞保持在具有10%FBS的DMEM中。为制备VLP,将细胞交换到具有4%FBS的DMEM中,然后与人ENTPD2表达质粒和逆转录病毒Gag表达质粒按μg比率为3:2共转染。转染后48小时,收集细胞上清液,并在台式离心机中通过以2500×g离心5分钟使上清液澄清,并保持在冰上。在Sorvall
杂交瘤的产生
使用要求在多个位点处的重复免疫(RIMMS)的步骤,将Bcl-2转基因小鼠[C57BL/6-Tgn(bcl-2)22WEHI株]用抗原进行免疫(K.E.Kilpatrick等人,Hybridoma[杂交瘤]1997)。简言之,在邻近外周淋巴结(PLN)的8个特定位点处向小鼠注射22.5μg的His
对于融合,将F0骨髓瘤细胞与淋巴细胞按1:4比率混合。将细胞混合物离心,悬浮在
FACS筛选
融合后10天,使用流式细胞术筛选杂交瘤平板中ENTPD2特异性抗体的存在,以确认使用以下三种细胞系,候选抗体与细胞表面表达的人ENTPD2的特异性结合:亲本NIH/3T3细胞、稳定过表达人ENTPD2的NIH/3T3细胞、和RKO细胞
在二次流式细胞仪筛选中确认来自该基于原代细胞的流式细胞术筛选的命中。将表达与NIH/3T3-hENTPD2和RKO细胞结合的抗体的杂交瘤扩增到杂交瘤无血清介质中的45mL蛋白质生产培养物中,该介质具有在
重组抗体产生
针对由ENTPD2抑制ATP水解,在基于细胞的测定中筛选杂交瘤衍生的mAb。在该测定中鉴定出两种先导抑制性mAb:mAb17和mAb16。
制备由鼠可变区和人恒定区组成的嵌合抗体。获得杂交瘤的可变区(VH和VL)DNA序列用于克隆和抗体优化(人源化,去除潜在的翻译后修饰等)。使用标准方法,通过5’RACE从获自每种所选杂交瘤细胞系的RNA扩增来自鼠单克隆抗体的可变区DNA。分别针对mAb17和mAb16,将每种鼠可变重链/轻链的多肽序列示出在表1中。针对每种杂交瘤的对应可变重链/轻链核苷酸序列示出在SEQ ID NO:234/SEQ ID NO:238和SEQ ID NO:226/SEQ ID NO:230中。为制备嵌合抗体,将编码通过5’RACE-PCR扩增的杂交瘤VL和VH的DNA序列克隆到含有相应人野生型重链和人轻链恒定区序列(IgG1,κ)的表达运载体中。使用QIAprep Spin微量制备试剂盒(凯杰公司,目录号27106)将这些运载体小量制备,并使用Amaxa
人源化
还使用内部软件程序设计可变区构建体用于人源化和序列优化(例如,去除潜在的翻译后修饰位点)。在游标带(Vernier Zones)中选择具有回复突变的每个小鼠VH和VL的一个或多个人框架(Foote和Winter 1992,Journal of Molecular Biology[分子生物学杂志];224(2):487-499)以保持亲和力和所需的功能活性。使用基于三维晶体结构的设计还对mAb17和mAb16人源化。简言之,将晶体结构加载到分子操作环境(MOE
编码来自两种人源化策略的设计的人源化VL和VH结构域的DNA序列从GeneArt(生命技术公司(Life Technologies Inc.),雷根斯堡(Regensburg),德国)订购,其中针对灰仓鼠(Cricetulus griseus)进行密码子优化。使用标准方法将这些可变区亚克隆到含有相应人野生型重链和人轻链恒定区序列(IgG1,κ)的表达载体中。
通过将编码重链和轻链的运载体共转染到FreeStyle
使用MorphoSys HuCAL
进行四种类型的淘选:针对直接包被的重组人ENTPD2(hENTPD2)的固相淘选、针对ENTPD2的溶液淘选、全细胞淘选和亲和力成熟淘选。
基于珠的淘选
在基于珠的淘选之前,将抗原固定在磁性羧酸包被的珠上(Dynabeads
离心后,将感染的细菌沉淀并重悬于2xYT介质中,铺板于LB/氯霉素琼脂平板上并孵育过夜。将菌落从平板上刮下并用于噬菌体拯救、所选克隆的多克隆扩增和噬菌体生产。用经纯化的噬菌体开始下一轮淘选。使用与第一轮相同的方案进行第二轮和第三轮固相淘选,除了使用较少的抗原和更严格的洗涤条件。
溶液淘选
阻断适量的链霉亲和素珠(Dynabeads
全细胞淘选
针对每次淘选,将适量的噬菌体-抗体阻断。同时,针对每个噬菌体库,阻断表达ENTPD2的适量的靶细胞和不表达抗原ENTPD2的适量的吸附细胞。将阻断的靶细胞旋转沉降,重悬于预阻断的噬菌体颗粒中,并允许噬菌体-抗体与细胞上呈递的抗原结合。将噬菌体-细胞复合物洗涤若干次。从靶细胞中洗脱特异性结合的噬菌体。离心后,将上清液(洗脱液)应用于抗原阴性吸附细胞,以去除与除靶抗原以外的细胞表面分子结合的噬菌体(吸附后)。将最终的上清液转移到大肠杆菌TG1培养物中用于噬菌体感染。使用与第一轮淘选相同的方案进行第二轮和第三轮全细胞淘选。
亲和力成熟淘选
HuCAL
选择四种Fab候选物用于亲和力成熟。为增加所选抗体的亲和力和生物活性,使用三核苷酸定向诱变通过盒诱变优化CDR-L3和CDR-H2区,同时框架区保持恒定(
为选择亲和力改善的候选物,将衍生自成熟文库的噬菌体进行2至3轮成熟淘选。通过降低每轮淘选中的抗原浓度来提高淘选的严格性(Low等人,1996,J.Mol.Biol.[分子生物学杂志]260,第359-368页)。除抗原减少外,还进行了解离速率选择(Hawkins等人,1992,J.Mol.Biol.[分子生物学杂志]226(3),第889-896页)。这些策略与延长的洗涤步骤相结合。
表达
针对大肠杆菌从展示运载体亚克隆到Fab-表达运载体中
为促进可溶性Fab的快速表达,将所选择的HuCAL
His加标签的Fab片段的微量生产
在大肠杆菌TG1 F细胞中由细菌表达运载体编码的Fab片段的表达在50mL Falcon管中使用25mL的2xYT介质进行,该介质补充有0.1%葡萄糖、34μg/mL氯霉素和1mM IPTG(异丙基-β-D-硫代半乳糖苷)。将培养物在30℃下振荡18h。收获细胞,并使用溶菌酶和Bug
亚克隆到IgG和FabCys表达运载体中并在HKB11细胞中表达
针对HKB11细胞中的全长IgG表达,将所选候选物或候选库克隆到
用编码IgG的重链和轻链的哺乳动物表达运载体DNA转染真核HKB11细胞。在转染后第3或6天收获细胞培养物上清液,并进行标准蛋白A亲和色谱(MabSelect
通过UV-分光光度法测定蛋白质浓度,并使用CE-SDS(LabChip GXII,珀金埃尔默公司(Perkin Elmer),美国)在变性、还原和非还原条件下分析IgG的纯度。进行HP-SEC以分析处于天然状态的IgG制剂。
抗体汇总
表1列出了衍生自鼠杂交瘤和噬菌体展示的抗人ENTPD2抗体的序列信息。
在以下测定中评估抗人ENTPD2抗体。
Biacore筛选:在Biacore T200或T100与T200灵敏度升级仪器(Biacore,GE医疗集团)上使用表面等离振子共振(SPR)通过测定动力学速率常数来测量亲和力。在与表面偶联的小鼠抗人IgG Fc抗体(赛默飞世尔科技公司目录号05-4200)胺制备的CM5传感器芯片(Biacore,GE医疗集团)上捕获抗体。根据抗体的亲和力,在从0.78nM至500nM的浓度范围内在25℃下检测人和食蟹猴(cyno)ENTPD2 ECD的结合。允许ENTPD2分析物联系180秒并解离长达1800秒,这取决于抗体在30μL/min流速下的解离速率。运行缓冲液是PBS pH 7.2(由Corning 10X储备液制备,目录号46-013-CM)+0.05%Tween 20。通过30秒注射3M或4M的MgCl2完成再生以从表面去除所有捕获的抗体和剩余复合物,之后捕获新鲜抗体。使用Biacore T200评估软件版本1.0分析原始数据并拟合为1:1结合模型,其中所有参数设置为全局拟合(除了RI被设置为局部拟合)。
确认了mAb1-mAb10的抗体特异性。所有克隆显示与人ENTPD2的显著nM与亚nM结合。抗体mAb8、mAb9、和mAb10显示出对小鼠ENTPD2的弱亲和力。所选的抗体均不与大鼠ENTPD2结合。参见表21和表22。
表21:所选抗人ENTPD2抗体的解离常数(K
表22:所选抗人ENTPD2抗体与ENTPD2表达细胞的结合
通过Taqman将H520细胞鉴定为具有ENTPD3(Ct 25)和ENTPD8(Ct 26)表达的癌细胞系,并用于选择性筛选。
用任何测试的抗人ENTPD2抗体均未观察到与任何对照细胞系的显著结合(表25)。
表25.抗人ENTPD2 mAb的交叉反应性。
使用Octet Red96系统的表位分级(Epitope binning)
使用测量生物膜层干涉技术(BLI)的Octet Red96系统(ForteBio公司,美国)进行抗人ENTPD2抗体的表位分级。根据制造商的建议(Avidity,LLC,美国目录号BirA500),通过AviTag
在该实例中,抗人ENTPD2 FAb22与人ENTPD2(Y350A突变体)胞外结构域复合结晶,并测定相应的结构。基于X射线数据分析抗人ENTPD2 FAb22与人ENTPD2的结合,提供了抗原参与的分子细节和对Fab互补位和对所揭示的抗原表位的见解。
材料与方法
Fab片段的表达和纯化
将编码经鉴定的VH和VL结构域的DNA序列亚克隆到含有相应人野生型CH1和人κ轻链恒定区序列的哺乳动物表达运载体中。通过使用转染剂将运载体瞬时共转染到细胞中来产生重组人Fab。转染后,将细胞培养5-6天,并进行抗体纯化。通过离心(2600x g,持续10分钟)沉淀细胞,并通过0.22μm过滤器进行过滤使含有抗体的细胞上清液澄清。通过蛋白质G(GE医疗生命科学公司集团)柱纯化Fab,并使用酸性洗脱缓冲液条件进行洗脱。
人ENTPD2和抗人ENTPD2 FAb22复合物的制备
为制备ENTPD2-FAb22复合物,将1.3倍摩尔过量的FAb22与hENTPD2 Y350A在具有150mM NaCl的20mM Tris pH 7.5中混合以给出终浓度为5.65mg/mL。将复合物样品在冰上孵育2小时,并进行结晶筛选。
结晶和X射线数据收集
通过沉滴式蒸气扩散,使晶体在96孔板(Greiner Bio-One Crystalquick Plusplates)中生长。详细地,将0.2μl蛋白质储备液与0.2μl储库溶液混合,并在20℃下将滴剂与50μl相同的储库溶液平衡。使用Phoenix机器人系统(阿特罗宾斯仪器公司(Art RobbinsInstruments))建立实验,并储存在内部定制工程化晶体成像仪和门架(诺华GNF内部系统)中。
对于X射线数据收集,将单晶直接安装在低温回路中并快速冷却成液氮。使用
结构确定和分析
使用先前在内部确定的人ENTPD2的精修结构和抗RSV Fab B21m(PDB代码3QRG)的坐标作为独立搜索模型,通过用Phaser程序(McCoy等人,2007,J Appl Crystallogr[应用晶体学杂志]40:658-674)的分子置换来确定FAb22-ENTPD2复合物的结构。使用模型构建的迭代循环,随后用以下程序自动结晶细化来精修结构:Coot 0.8.0(结晶目标定向的工具(Crystallographic Object-Oriented Toolkit);Emsley等人,2010,Acta CrystallogrSect D:Biol Crystallogr[晶体学报D辑:生物晶体学];66:486-501)和Autobuster2.11.5(Bricogne等人,2011,BUSTER版本2.11.2.剑桥,英国:全球定相公司(GlobalPhasing Ltd.))。
使用Coot(Emsley等人,2010,Acta Crystallogr Sect D:Biol Crystallogr[晶体学报D辑:生物晶体学];66:486-501)和PyMOL(分子图形系统;DeLano Scientific公司:帕罗奥图,加利福尼亚州)程序进行晶体结构的目视检查。使用Coot和PROCHECK v3.3(Laskowski等人,1992,J Appl Crystallogr[应用晶体学杂志];26:283-291)程序评估最终精修模型的质量。通过CCP4程序套件(协同计算计划(Collaborative ComputationalProject),第4期,1994)的程序AREAIMOL鉴定在抗人ENTPD2 FAb22结合后变得溶剂难以接近的人ENTPD2的残基。使用
结果
与人ENTPD2复合的抗hENTPD2 FAb22的晶体结构
在20℃下,通过沉滴式蒸气扩散的方法,与人ENTPD2 Y350A突变体复合的抗hENTPD2 FAb22在96孔板中结晶。晶体在0.1M HEPES pH 7.5、20%聚乙二醇3350、0.2M氯化镁中生长。在大约6周后出现晶体并在几天内生长至完整尺寸。
FAb22-ENTPD2复合物的晶体在单斜晶系空间群C2中,其中每个不对称单元具有一个复合物。针对复合物收集完整的衍射数据集至2.75埃分辨率。
使用先前确定的人ENTPD2坐标和来自PDB代码3QRG的Fab坐标进行通过分子置换来进行结构确定。用AutoBuster进行精修可以获得良好的精修统计数据和整体几何结构。两个FAb22残基(Ala55L和Tyr33H)和四个ENTPD2残基(Gly120、Thr122、Tyr229、和Ala430)是FAb22-ENTPD2复合物结构中的拉马钱德兰异常值。除Fab残基(Ala55L和Tyr33H)之外的ENTPD2残基(Gly120和Thr122)在电子密度方面限定明确,并可能是真正的几何异常值。值得注意的是,如下所述,Tyr33H是参与ENTPD2结合的CDR残基。ENTPD2残基(Tyr229和Ala430)在电子密度上松散地建模。
图3A提供了抗人ENTPD2 FAb22重链和轻链的氨基酸序列,其中将CDR加下划线(如由卡巴特,1991,Sequences of proteins of immunological interest[免疫目的蛋白的序列],国家卫生研究院出版(NIH Publication)第91-3242期的定义),并且位于Fab-抗原界面的残基用*标记。图6描绘了抗人ENTPD2 FAb22/ENTPD2 Y350A复合物三维结构的整体视图。
图4A提供了该实例中使用的重组人ENTPD2的氨基酸序列(SEQ ID NO:291)。人ENTPD2的可溶性细胞外结构域跨越残基29-462。Y350A的工程化突变存在于构建体中并以灰色斜体突出显示。在此使用的构建体利用N末端GP67分泌信号肽(前38个残基)和C末端6x组氨酸标签(SEQ ID NO:1010)。Asn64、Asn129、Asn294、Asn378、和Asn443是预测的N-连接糖基化位点,其中仅在以灰色斜体中突出显示在晶体结构中观察到糖基化的那些。二级结构元件显示在氨基酸序列下方,其中条形代表α-螺旋,箭头代表β-链。没有标记二级结构元件的残基表示非结构化环和回转区段。
人ENTPD2氨基酸序列与啮齿动物物种和其他哺乳动物具有高度序列同源性,并且该结构具有与对大鼠ENTPD2描述的几乎相同的整体折叠(即,PDB代码3CJA,Zebisch,M.,Strater,N.(2008)Proc.Natl.Acad.Sci.Usa[美国国家科学院院刊]105:6882-6887)。针对Cys75/Cys99、Cys242/Cys284、Cys265/Cys310、Cys323/Cys328和Cys377/Cys399观察到不变和保守的二硫键对。人和大鼠ENTPD2结构之间388个C-α碳的RMSD(均方根偏差)约为
FAb22/ENTPD2复合物的最终模型含有ENTPD2的残基37-448。ATP水解的活性位点位于两个亚结构域(亚结构域1:Pro36-Ser161和Lys427-Phe461;亚结构域2:Gly162-Gln426)之间。从最终模型中省略的ENTPD2残基包括N-末端的残基29-36和对应于连接链β2和β3的环残基的60-65,对应于膜相互作用环(MIL)的残基179-193,以及C-末端Ile448以外的残基。除末端半胱氨酸(Cys228重链/Cys218轻链)外,所有重链和轻链Fab残基都包括在最终精制模型中。
FAb22主要通过涉及参与重链和轻链可变结构域的所有6个CDR的相互作用而预测的膜远端叶的接合来结合ENTPD2抗原。没有FAb22CDR残基似乎明显渗透到ENTPD2活性位点裂缝中以影响ATP底物结合。重链CDR3和CDR2残基隔绝残基,包括和侧翼有由链β10/β11组成的反平行2链β-折叠。末端重链CDR3残基与螺旋α14的N-末端残基以及α8和α13螺旋形成额外的结合接触。与ENTPD2的轻链可变结构域结合相互作用主要涉及CDR1和CDR3残基,这些残基主要结合螺旋α14的N-末端。FAb22/ENTPD2复合物的形成隐藏了总结合溶剂可接触表面总量的约
表17.表位和互补位残基FAb22/hENTPD2
在该实例中,抗人ENTPD2 FAb23与人ENTPD2(Y350A突变体)胞外结构域复合结晶,并测定相应的结构。基于X射线数据分析抗人ENTPD2 FAb23与人ENTPD2的结合,提供了抗原参与的分子细节和对Fab互补位和对所揭示的抗原表位的见解。
材料与方法
人ENTPD2和抗人ENTPD2 FAb23复合物的制备
为制备ENTPD2-FAb23复合物,将1.6倍摩尔过量的ENTPD2与FAb23在20mM Tris pH7.5和100mM NaCl中合并,并通过超滤浓缩至9.08mg/mL,在冰上孵育10分钟,并进行结晶试验建立。
结晶和X射线数据收集
在20℃下,通过沉滴式蒸气扩散的方法,与人ENTPD2 Y350A突变体复合的抗hENTPD2 FAb23在96孔板(Greiner Bio-One)中结晶。详细地,将0.2μl蛋白质储备液与0.2μl储库溶液混合,并在20℃下将滴剂与50μl相同的储库溶液平衡。使用Phoenix机器人系统(阿特罗宾斯仪器公司(Art Robbins Instruments))建立实验,并储存在内部定制工程化晶体成像仪和门架(诺华GNF内部系统)中。
对于X射线数据收集,将单晶直接安装在低温回路中并快速冷却成液氮。使用
结构确定和分析
通过用Phaser程序(McCoy等人,2007,J Appl Crystallogr[应用晶体学杂志]40:658-674)的分子置换,使用先前在内部确定的人ENTPD2的精修坐标和使用MOE软件(分子操作环境(MOE),2013.08;化学计算组(Chemical Computing Group)ULC,1010SherbookeSt.West,Suite#910,Montreal,QC,Canada[加拿大魁北克省蒙特利尔市910号室舍布鲁克西街1010号],H3A 2R7,2018)中的抗体建模工具生成的FAb23的同源模型,来确定FAb23-ENTPD2复合物的结构,该同源模型显示作为独立的搜索模型与ICSM 18-抗PRP的Fab片段具有高的序列相似性(PDB代码4W9D)。使用模型构建的迭代循环,随后用以下程序自动结晶细化来精修结构:Coot 0.8.0(结晶目标定向的工具(Crystallographic Object-OrientedToolkit);Emsley等人,2010,Acta Crystallogr Sect D:Biol Crystallogr[晶体学报D辑:生物晶体学];66:486-501)和Autobuster2.11.5(Bricogne等人,2011,BUSTER版本2.11.2.剑桥,英国:全球定相公司(Global Phasing Ltd.))。
使用Coot(Emsley等人,2010,Acta Crystallogr Sect D:Biol Crystallogr[晶体学报D辑:生物晶体学];66:486-501)和PyMOL(分子图形系统;DeLano Scientific公司:帕罗奥图,加利福尼亚州)程序进行晶体结构的目视检查。使用Coot和PROCHECK v3.3(Laskowski等人,1992,J Appl Crystallogr[应用晶体学杂志];26:283-291)程序评估最终精修模型的质量。通过CCP4程序套件(协同计算计划(Collaborative ComputationalProject),第4期,1994)的程序AREAIMOL鉴定在抗人ENTPD2 MAB17 Fab结合后变得溶剂难以接近的人ENTPD2的残基。使用
结果
抗hENTPD2 FAb23/ENTPD2复合物的晶体结构
在20℃下,通过沉滴式蒸气扩散的方法,与人ENTPD2 Y350A突变体复合的抗hENTPD2 FAb23在96孔板中结晶。晶体在0.08M Bis-Tris丙烷(pH 8.8)、0.02M柠檬酸、16%PEG3350中生长。在大约6周后出现晶体并在几天内生长至完整尺寸。
FAb23-ENTPD2复合物的晶体在单斜晶系空间群P21中,其中每个不对称单元具有一个复合物。针对复合物收集完整的衍射数据集至2.0埃分辨率。使用AutoBuster对与ENTPD2复合的FAb23的最终模型进行了精修,具有良好的精修统计和整体几何形状。在最终模型中总共存在四个拉马钱德兰异常值,其中两个残基来自FAb23轻链(Ser39和Thr50),以及两个来自ENTPD2(Thr122和Ala430)。针对Fab轻链的Ser39的电子密度差并且暂时建模。所有其他残基都在电子密度中得到了充分的定义,并且可能是真正的拉马钱德兰异常值。从最终模型中省略的ENTPD2残基包括N-末端的残基29-34和C-末端448以外的残基。从最终模型中还省略了FAb23链恒定区的残基139-144和末端半胱氨酸(Cys227)。由于无序,FAb23轻链的最后两个残基(Glu212和Cys213)也不存在于最终模型中。
图3B提供了抗人ENTPD2 FAb23重链和轻链的氨基酸序列,其中将CDR加下划线(如由卡巴特,1991,Sequences of proteins of immunological interest[免疫目的蛋白的序列],国家卫生研究院出版(NIH Publication)第91-3242期的定义),并且位于Fab-抗原界面的残基用*标记。图7描绘了FAb23/ENTPD2 Y350A复合物三维结构的整体视图。
与FAb22相反,FAb23与ENTPD2的结合涉及重链和轻链可变结构域对膜近端和远端叶的显著接合。重链可变区环CDR2和CDR3参与ENTPD2结合,其中没有来自CDR1的贡献。来自轻链可变区的所有3个CDR的残基参与ENTPD2结合。与ENTPD2膜远端叶的接触主要由以下项赋予:来自重链CDR3、轻链CDR2的残基;和与α13和α14之间的ENTPD2环区残基的残基结合的轻链FR3残基;以及FR3与反平行链β10/β11和螺旋α9的相互作用。CDR3轻链和CDR2重链残基赋予与α2螺旋的广泛结合以及连接ENTPD2的膜近端叶的β3和α1的环残基。重链CDR3将末端残基Tyr104、Tyr105和Gly106投射到在膜远端叶的螺旋α8、α11和α14的N-末端之间的ENTPD2活性位点裂缝中。来自结合的大鼠ENTPD2晶体结构PDB 3CJA的ATP类似物AMP-PNP的叠加表明Tyr105位于预测ATP的腺嘌呤环结合的位置,可能在空间上阻碍底物结合。重链CDR3末端的Tyr105和Tyr104也可以扰乱ENTPD2活性位点残基,包括针对π-π和阳离子-π堆积与底物ATP的腺嘌呤环的相互作用所必需的Tyr350和Arg394。FAb23与ENTPD2的结合隐藏了大约
表18.表位和互补位残基FAb23/人ENTPD2
在该实例中,抗鼠ENTPD2 Fab MAB13与鼠ENTPD2胞外结构域复合结晶,并测定相应的结构。基于X射线数据分析抗小鼠ENTPD2FAb24与鼠ENTPD2的结合,提供了抗原参与的分子细节和对Fab互补位和对所揭示的抗原表位的见解。
材料与方法
鼠ENTPD2和抗小鼠ENTPD2 FAb24复合物的制备
为制备鼠ENTPD2 FAb24复合物,将经纯化的鼠ENTPD2和FAb24在20mM Tris(pH7.5)和100mM NaCl中按1:1摩尔比合并,在4摄氏度下在冰上孵育过夜。第二天早晨,通过超滤将样品浓缩至9.88mg/mL,并进行结晶试验建立。
结晶和X射线数据收集
在20℃下,通过沉滴式蒸气扩散的方法,与ENTPD2 Y350A突变体复合的抗小鼠ENTPD2 FAb24复合物在96孔板中结晶。详细地,将0.2μl蛋白质储备液与0.2μl储库溶液混合,并在20℃下将滴剂与50μl相同的储库溶液平衡。使用Phoenix机器人系统(阿特罗宾斯仪器公司(Art Robbins Instruments))建立实验,并储存在内部定制工程化晶体成像仪和门架(诺华GNF内部系统)中。
对于X射线数据收集,将单晶直接安装在低温回路中并快速冷却成液氮。使用装备有ADSC Quantum 315r CCD检测器的
结构确定和分析
使用先前在内部确定的鼠ENTPD2和FAb24的精修结构作为独立搜索模型,通过用Phaser程序(McCoy等人,2007,J Appl Crystallogr[应用晶体学杂志]40:658-674)的分子置换来确定FAb24-小鼠ENTPD2复合物的结构。使用模型构建的迭代循环,随后用以下程序自动结晶细化来精修结构:Coot 0.8.0(结晶目标定向的工具(Crystallographic Object-Oriented Toolkit);Emsley等人,2010,Acta Crystallogr Sect D:Biol Crystallogr[晶体学报D辑:生物晶体学];66:486-501)和Autobuster 2.11.5(Bricogne等人,2011,BUSTER版本2.11.2.剑桥,英国:全球定相公司(Global Phasing Ltd.))。
使用Coot(Emsley等人,2010,Acta Crystallogr Sect D:Biol Crystallogr[晶体学报D辑:生物晶体学];66:486-501)和PyMOL(分子图形系统;DeLano Scientific公司:帕罗奥图,加利福尼亚州)程序进行晶体结构的目视检查。使用Coot和PROCHECK v3.3(Laskowski等人,1992,J Appl Crystallogr[应用晶体学杂志];26:283-291)程序评估最终精修模型的质量。通过CCP4程序套件(协同计算计划(Collaborative ComputationalProject),第4期,1994)的程序AREAIMOL鉴定在抗小鼠ENTPD2 FAb24结合后变得溶剂难以接近的鼠ENTPD2的残基。使用
使用先前在内部确定的鼠ENTPD2和FAb24的精修结构作为独立搜索模型,通过用Phaser程序(McCoy等人,2007,J Appl Crystallogr[应用晶体学杂志]40:658-674)的分子置换来确定FAb24-小鼠ENTPD2复合物的结构。使用模型构建的迭代循环,随后用以下程序自动结晶细化来精修结构:Coot 0.8.0(结晶目标定向的工具(Crystallographic Object-Oriented Toolkit);Emsley等人,2010,Acta Crystallogr Sect D:Biol Crystallogr[晶体学报D辑:生物晶体学];66:486-501)和Autobuster 2.11.5(Bricogne等人,2011,BUSTER版本2.11.2.剑桥,英国:全球定相公司(Global Phasing Ltd.))。
结果
抗小鼠ENTPD2 FAb24/小鼠ENTPD2复合物的晶体结构
在20℃下,通过沉滴式蒸气扩散的方法,与鼠ENTPD2复合的抗小鼠ENTPD2 FAb24复合物在96孔板中结晶。晶体在0.2M柠檬酸三铵(pH 7.0),20%PEG3350中生长。在大约1个月后出现晶体并在几天内生长至完整尺寸。
FAb24-小鼠ENTPD2复合物的晶体在单斜晶系空间群P21中,其中每个不对称单元具有一个复合物。针对复合物收集完整的衍射数据集至3.0埃分辨率。使用AutoBuster对与小鼠ENTPD2复合的FAb24的最终模型进行了精修,具有良好的精修统计和整体几何形状。在最终模型中存在两个拉马钱德兰异常值(小鼠ENTPD2的Thr122和FAb24的Ala57),这两个异常值在电子密度中限定明确。Asn129和Asn378仅在观察到N-连接的糖基化处是残基。观察到FAb24重链的Glu1并将其模拟为焦谷氨酸。从最终模型中省略的小鼠ENTPD2残基包括N-末端的残基29-35、对应于连接链β2和β3的环残基的61-66、对应于膜相互作用环(MIL)的残基182-194、α9和β11之间的环残基290-293、以及C-末端Ala450以外的残基。除了重链Cys225的末端半胱氨酸,FAb24的所有的重链和轻链残基包括在最终精修的模型中。
图3C提供了抗小鼠ENTPD2 FAb24重链和轻链的氨基酸序列,其中将CDR加下划线(如由卡巴特,1991,Sequences of proteins of immunological interest[免疫目的蛋白的序列],国家卫生研究院出版(NIH Publication)第91-3242期的定义),并且位于Fab-抗原界面的残基用*标记。图8描绘了FAb24/mENTPD2复合物三维结构的整体视图。
抗小鼠ENTPD2 FAb24主要参与ENTPD2抗原的假定的膜远端叶(残基G162-E426)。针对重链和轻链可变结构域的CDR残基,观察到对ENTPD2结合的相等贡献。
与结合人ENTPD2的FAb22和FAb23相比,FAb24从与FAb22中观察到的方向完全不同的方向接合鼠ENTPD2,并且FAb23与hENTPD2复合。FAb24主要通过广泛的重链CDR相互作用和相对较少的轻链CDR相互作用结合鼠ENTPD2膜远端叶。与轻链CDR1和CDR2残基结合的重链CDR1和CDR3残基与mENTPD2的螺旋α11和α13结合。重链CDR2的残基与α13和α14之间的互连环残基发生相互作用。CDR3重链CDR3在其弯曲接近90度的构象中被观察到并且在其末端采用短的β-转角基序。FR3重链的两个残基通过与5链反平行折叠的β3相互作用而与小鼠ENTPD2近端叶接触。没有观察到MAB13 CDR延伸足够远至小鼠ENTPD2位点,通过直接阻塞底物结合位点而影响ATP水解活性。FAb24与鼠ENTPD2的结合隐藏了大约
表19.表位和互补位残基FAB24/小鼠ENTPD2
在雌性C57BL/6小鼠中通过将0.5x10
将抗PD-1Ab(克隆RMP1-14 Bio X Cell,西黎巴嫩,新罕布什尔州)或非特异性rIgG2a同种型对照(克隆RTK2758,Biolegend公司,圣地亚哥,加利福尼亚)在第1、5、8、12、15天按终剂量为10mg/kg进行腹膜内递送。将所有剂量调整至个体小鼠体重。
所有测试试剂在研究中均耐受,并且在任何治疗组中均未观察到毒性或体重减轻的明显临床症状。抗小鼠ENTPD2 mAb13与抗PD-1Ab治理的组合相对于无治疗(p<0.005)、同种型对照(p<0.05)或抗PD-1Ab(p<0.01)显著延长小鼠的存活期(对数秩(Mantel-Cox)测试用于确定存活曲线是否显著不同))(图9)。
在雌性C57BL/6小鼠中通过将0.5x10
在用抗小鼠ENTPD2 mAb13或单独地抗PD-1Ab治疗之后观察到不显著的抗肿瘤效果,然而相对于无治疗对照,在抗小鼠ENTPD2 mAb13和抗PD-1Ab的组合臂中观察到肿瘤生长的显著降低(p<0.05单向方差分析(One-Way ANOVA)/Tukey多重比较测验(Tukey’sMultiple Comparisons Test))(图10A-10B)。
为理解治疗对肿瘤微环境的影响,在第8天对小鼠实施安乐死,并在HyCloneRPMI1640介质(GE医疗集团,匹兹堡,宾夕法尼亚州)中使用gentleMacs C-管(美天旎生物技术公司(Miltenyi Biotec),奥本,加利福尼亚州)在gentleMacs Octo解离器(美天旎生物技术公司,奥本,加利福尼亚州)中将肿瘤解离。大约2x 10
相对于所有其他治疗组,用抗小鼠ENTPD2 mAb13和抗PD-1Ab组合治疗时观察到活化的CD4 T辅助细胞(定义为CD45+CD8-CD4+FOXP3-CD69+CD25+)(相对于无治疗,7.0倍增加,p<0.0001单向方差分析/Tukey多重比较测验)和CD8 T细胞(定义为CD45+CD4-CD8+CD69+CD25+)(相对于无治疗,5.8倍变化,p<0.05单向方差分析/Tukey多重比较测验)的显著流入(图10C)。
为证明体内抗人ENTPD2 Ab的靶向抗肿瘤活性,开发了人ENTPD2工程化的模型,B16LM3克隆5。该模型衍生自B16LM3黑素瘤模型,其中通过CAS9蛋白的瞬时电穿孔敲除内源性小鼠ENTPD2表达,该蛋白具有针对小鼠ENTPD2的CRISPR指导RNA序列,并且使用逆转录病毒转导方法过表达人ENTPD2。通过FACS用人ENTPD2选择性抗人ENTPD2 mAb17在体外证实模型中的人ENTPD2表达。使用小鼠ENTPD2选择性抗小鼠ENTPD2 mAb13来证明内源性小鼠ENTPD2的完全敲除(图11A)。B16LM3克隆B5显示出与亲本系相当的生长动力学和在同基因宿主中持续的人ENTPD2表达(图11B)。
在雌性C57BL/6小鼠中通过将0.5x10
在用抗人ENTPD2 mAb1或mAb6作为单一药剂或非特异性同种型对照和抗PD-1Ab的组合之后,观察到无显著的抗肿瘤效果。抗人ENTPD2 mAb1与抗PD-1Ab(固定剂量为10mg/kg)的组合方案表明剂量依赖性抗肿瘤效应,其中ΔT/ΔC值为18.4%(10mg/kg)、35.7%(1mg/kg)和33.4%(0.1mg/kg)。抗人ENTPD2 mAb6与抗PD-1Ab(固定剂量为10mg/kg)的类似的组合方案还表明剂量依赖性抗肿瘤效应,其中ΔT/ΔC值为29.2%(10mg/kg)、27.3%(1mg/kg)和41.0%(0.1mg/kg)(表23和图12A-12B)。
表23.在治疗的第7天,在人ENTPD2工程化的B16LM3克隆B5异种移植模型中的抗人ENTPD2 Ab剂量反应效果。
为了从免疫途径参与角度理解ENTPD2阻断的直接影响,在用抗人ENTPD2 mAb1或同种型对照(10mg/kg)治疗后24小时从C57BL/6小鼠中收集血浆和B16LM3克隆B5肿瘤(平均肿瘤体积约170mm
简言之,通过采集血液将血浆分离到Microvette MV-H-300毛细管血浆锂肝素血液收集管(Capillary Plasma Lithium Heparin Blood Collection tube)(赛输注技术公司(Sai Infusion technologies),Lake Villa,IL)中,将其在1000-2000Xg下旋转沉降10分钟。将血浆样品储存在-80℃直至使用。通过外科手术切除肿瘤样品并立即在液氮中冷冻。然后使用TissueLyser(凯杰公司,德国)仪器,将肿瘤组织在T-PER组织蛋白质提取物试剂(赛默飞世尔科技公司,沃尔瑟姆,马萨诸塞州)中匀质化。将肿瘤裂解物样品以11,000rpm旋转沉降15分钟,并且使用Pierce BCA蛋白质测定试剂盒(赛默飞世尔科技公司,沃尔瑟姆,马萨诸塞州)收集上清液用于蛋白质浓度分析。根据制造商的建议,使用V-PLEX小鼠细胞因子29-Plex试剂盒(MSD,罗克维尔市,马里兰州)将200μg蛋白质或25μl未稀释的血浆用于细胞因子分析。
用抗人ENTPD2 mAb1治疗(图13B和13D)观察到血浆MCP1显著降低(p<0.05未配对T检验),伴随肿瘤部位MCP1大约2倍的增加,这可能反映出骨髓细胞接合和肿瘤部位的募集。此外,在来自抗人ENTPD2 mAb1处理的动物的血浆中观察到IL-1β的大约2倍的降低(p=0.05未配对T检验),和表明肿瘤部位处平行减少的趋势(图13A和13C)。
在雌性C57BL/6小鼠中通过将0.5x10
表27.在治疗的第13天,在人ENTPD2工程化的B16LM3克隆B5异种移植模型中抗人ENTPD2 Ab和A2AR拮抗剂的体内效果。
在用非特异性同种型对照和A2AR拮抗剂NIR178的组合按50或200mg/kg处理后未观察到显著的抗肿瘤效果。抗ENTPD2 mAb1(10mg/kg)与NIR178(50mg/kg)的组合方案表明抗肿瘤效应,其中T/ΔC值为61.6%(表27和图14)。这些数据表明,当阻断腺苷途径中的多个节点时,抗肿瘤功效增强。
内部开发了生物化学和基于细胞的功能测定,以理解抗ENTPD2 Ab对ENTPD2经纯化的细胞外结构域(残基29-462)的功能影响,以及在基于天然细胞构象的背景下针对完全完整蛋白质的功能影响。ENTPD2将ATP水解为ADP,随后可以使用HTRF Transcreener ADP2TR-FRET Red测定(贝尔布鲁克实验室(BellBrook Labs),麦迪逊,威斯康星州)检测,其中ENTPD2产生的ADP将与ADP示踪剂竞争结合抗ADP-Tb抗体。所得信号与样品中ADP的浓度成反比。
为评估在ENTPD2生物化学测定中抗ENTPD2 Ab的活性,将抗ENTPD2 Ab和重组ENTPD2(残基29-462)在反应缓冲液(50mM HEPES(pH 7.1)、10mM MgCl
为建立基于细胞的功能测定,将具有内源性ENTPD2表达的人/食蟹猴/小鼠ENTPD2工程化的NIH/3T3细胞或RKO(ATCC,Manassa VA)结肠直肠癌细胞按分别针对NIH/3T3小鼠、食蟹猴和人ENTPD2系的150、200和250个细胞/孔铺板过夜,或针对RKO在384孔组织培养板中1000个细胞/孔以30μl/孔(铂金埃尔默公司,沃尔瑟姆,马萨诸塞州)铺板。在第二天,在37℃,5%CO
使用HTRF模式的Envision读板器(珀金埃尔默公司,沃尔瑟姆,马萨诸塞州)在两种测定中评估HTRF信号(620nm和665nm处的发射)。使用以下公式确定HTRF比率:HTRF比率=R=665nm处的发射/620nm处的发射x 10,000。如下确定之后的%残留活性和%抑制:
其中R
在生物化学人ENTPD2功能测定中抗ENTPD2 Ab的代表性活性
来自杂交瘤和噬菌体展示活动的抗ENTPD2 Ab在生物化学人ENTPD2测定中针对功能活性被分类。抗ENTPD2 Ab的代表性活性和其IC
表28:在人ENTPD2生物化学功能测定中抗ENTPD2 Ab的体外活性谱
在基于细胞的人和食蟹猴ENTPD2功能测定中抗ENTPD2 Ab的活性
在生物化学ENPTD2测定中对Ab的初步分析鉴定了许多对ENTPD2的重组细胞外结构域具有强抑制性活性的有效命中,然而在生物化学和基于细胞的功能测定之间观察到一部分Ab的差异行为特征,表明在经纯化的重组蛋白和基于天然细胞的构象之间可能存在构象差异(数据未显示)。为了确定Ab对天然ENTPD2的有效活性,使用人或食蟹猴-ENTPD2工程化的NIH/3T3细胞或具有内源ENTPD2表达的RKO细胞系分析抗ENTPD2Ab的抑制性活性。表29中捕获了针对人或食蟹猴ENTPD2 NIH/3T3或RKO的基于细胞的测定的抗ENTPD2 Ab活性谱的概述。描述针对抗ENTPD2 Ab亚组的所有三种功能测定的有效活性的代表性图示出在图16中。
表29:在人或食蟹猴ENTPD2 NIH/3T3或RKO的基于细胞的测定中ENTPD2选择性Ab的体外活性谱
抗ENTPD2 mAb13被鉴定为不与人或食蟹猴ENTPD2结合的小鼠ENTPD2选择性Ab(FACS EC
表30:在小鼠ENTPD2的基于细胞的功能测定中小鼠ENTPD2选择性Ab的体外活性谱
除非另有定义,否则本文使用的技术和科学术语具有与熟知本披露所属领域的专业人员通常理解的相同含义。
除非另有说明,否则所有未详细描述的方法、步骤、技术和操作可以以本身已知如本领域技术人员所知的方式执行并且已经以此方式执行。例如,再次参考本文提及的标准手册和一般背景技术以及其中引用的其他参考文献。除非另有说明,否则本文引用的每篇参考文献均通过引用以其全文并入。
本发明的权利要求是非限制性的,并在下文提供。
尽管本文已经详细披露了特定方面和权利要求,但是这仅仅是出于说明的目的通过示例的方式进行的,并且不旨在限制所附权利要求的范围或任何相应的未来申请的权利要求的主题的范围。具体而言,诸位发明人考虑到可以对本披露进行各种替换、改变和修改而不脱离权利要求所限定的本披露的精神和范围。认为核酸起始材料、目标克隆或文库类型的选择对于具有本文所述各方面知识的本领域普通技术人员而言是常规工作。认为其他方面、优点和修改在所附权利要求的范围内。仅使用常规实验,本领域技术人员将认识到或能够确定本文所述的本发明具体方面的许多等同物。这种等同物旨在由以下权利要求涵盖。在后面提交的相应申请中重新起草权利要求范围可能是由于各个国家的专利法的限制,并且不应该被解释为放弃权利要求的主题。
- ENTPD2抗体、组合疗法、以及使用这些抗体和组合疗法的方法
- 与治疗性肿瘤学药剂组合使用抗SSEA-4抗体的组合疗法
