药物组合物及其制备方法和应用
文献发布时间:2023-06-19 09:47:53
技术领域
本发明实施例涉及药物制造领域,特别涉及一种药物组合物及其制备方法和应用。
背景技术
肺部退行性疾病,包括慢性阻塞性肺病(COPD),是全世界发病率和死亡率较高的一类疾病。慢性阻塞性肺病(COPD)是慢性支气管炎和肺气肿的总称,与肺的慢性炎症反应相关,其引起气道异常包括气道收缩和肺实质的结构的扭曲。患者通常经历肺功能的进行性衰退,其特征是咳嗽加剧,呼吸短促和痰液产生。但不仅如此,慢性阻塞性肺病(COPD)患者的全身免疫变化以循环血液中的炎症细胞数量增加、炎症细胞的功能变化、血清细胞因子的增加、氧化应激为特征,其肺外表现包括骨质疏松症、心血管疾病、骨骼肌异常和抑郁症等。
现有技术中对包括慢性阻塞性肺病(COPD)在内的肺退行性疾病加重患者的标准疗法(AECOPD)包括使用皮质类固醇系统治疗。该方法存在明显的局限性,即第一,皮质类固醇的高频治疗会带来明显的副作用,例如抑制下丘脑-垂体-肾上腺轴和骨质疏松症;第二,皮质类固醇并不能有效控制所有的嗜酸性粒细胞增多的慢性阻塞性肺病(COPD)患者。因此,迫切需要一种改进的疗法代替或辅助皮质类固醇标准疗法治疗包括慢性阻塞性肺病(COPD)在内的肺退行性疾病。
间充质干细胞具有增殖并分化为成熟体细胞的特性,可用于机体损伤的修复,某些干细胞还具有免疫调节作用,而慢性阻塞性肺病(COPD)已被证明与自身免疫反应相关。因此,间充质干细胞应用于包括慢性阻塞性肺病(COPD)在内的肺部退行性疾病治疗潜力巨大。目前,尚未有间充质干细胞及其外泌体药物组合物在预防或治疗慢性阻塞性肺病在内的肺部退行性疾病相关记载的公开。
发明内容
本发明的目的在于提供一种药物组合物及其制备方法和应用,以代替或辅助皮质类固醇应用于治疗包括慢性阻塞性肺病(COPD)在内的肺退行性疾病,或预防包括慢性阻塞性肺病(COPD)在内的肺退行性疾病。
为解决上述技术问题,本发明的实施方式提供了一种药物组合物,包括CD31和CD73阳性的间充质干细胞和/或其外泌体。
本发明实施方式相对于现有技术而言,上述包括CD31和CD73阳性的间充质干细胞和/或其外泌体的药物组合物具有抑制炎症细胞因子分泌、促进肺再生细胞因子分泌、抑制肺纤维化、预防肺细胞凋亡的功能,因此可代替或辅助皮质类固醇应用于治疗包括慢性阻塞性肺病(COPD)在内的肺部退行性疾病,或预防包括慢性阻塞性肺病(COPD)在内的肺退行性疾病。
在一实施例中,所述CD31和CD73阳性的间充质干细胞来源于骨髓、脂肪、血液、骨膜、真皮、脐带、胎盘、羊膜、绒毛膜、脱落膜、肌肉、子宫内膜、真皮、牙小囊、牙周膜、牙髓或牙胚。
在一实施例中,所述CD31和CD73阳性的间充质干细胞为胎盘CD31和CD73阳性的间充质干细胞。
在一实施例中,所述CD31和CD73阳性的间充质干细胞是自体性干细胞或是异体性干细胞,优选异体性干细胞。
在一实施例中,所述CD31和CD73阳性的间充质干细胞可根据表面标记表达、核型特征、生长特征、分化特征、细胞因子分泌及基因表达进一步赋予其特征。
在一实施例中,所述CD31和CD73阳性的间充质干细胞传代次数的下限,优选为1次以上,更优选为2次以上,进一步优选为3次以上。
在一实施例中,所述CD31和CD73阳性的间充质干细胞传代次数的上限,优选为25次以下,更优选为15次以下,进一步优选为10次以下,最优选为5次以下。
在一实施例中,所述CD31和CD73阳性的间充质干细胞增值次数优选为5次以上,更优选为10次以上,更优选为15次以上,更优选为20次以上,进一步优选为25次以上,最优选为30次以上。
在一实施例中,所述CD31和CD73阳性的间充质干细胞可分化为脂肪细胞、软骨、心肌、皮肤、造血、血管生成、肌肉、肾、泌尿生成、成骨、心包起源、基质细胞、表皮细胞、神经原细胞、神经胶质细胞、胸膜细胞、肝细胞、肠道内壁细胞、及产生胰腺和松弛细胞的细胞。
在一实施例中,所述CD31和CD73阳性的间充质干细胞可分化为骨细胞、脂肪细胞和软骨细胞、心肌细胞、神经元细胞和/或呼吸道上皮细胞。
在一实施例中,所述CD31和CD73阳性的间充质干细胞分泌的细胞因子包括:MMP1、前列腺素E2(PGE2)、转化因子beta(TGF-beta)、吲哚胺2,3-二加氧酶(IDO)和/或一氧化氮(NO)组成的组中选择的至少一种细胞因子,更优选分泌至少两种细胞因子,更优选分泌至少三种细胞因子,最优选为分泌全部的细胞因子。
在一实施例中,所述CD31和CD73阳性的间充质干细胞表达的基因包括:SG-6、Stro-1和/或CD90,更优选为表达至少两种基因,最优选为表达全部的基因。
在一实施例中,所述CD31和CD73阳性的间充质干细胞为激活的CD31和CD73阳性的间充质干细胞。
在一实施例中,所述外泌体包括CD31和CD73阳性的间充质干细胞或其培养基中一种或多种基因或基因产物。
在一实施例中,所述基因产物包括:蛋白质;和/或mRNA;和/或miRNA。
在一实施例中,所述蛋白质包括:细胞骨架蛋白;和/或细胞内膜融合和运输蛋白;和/或信号转导蛋白;和/或代谢酶;和/或四跨膜蛋白家族中的一种或多种。
在一实施例中,所述细胞骨架蛋白包括:微管蛋白、肌动蛋白和/或中间丝蛋白;
所述细胞内膜融合和运输蛋白包括:膜联蛋白和/或rab蛋白;
所述信号转导蛋白包括:蛋白激酶、14-3-3和/或异源三聚体G蛋白;
所述代谢酶包括:过氧化物酶、丙酮酸激酶和/或烯醇酶-1;
所述四跨膜蛋白家族包括:CD9、CD63、CD81和/或CD82。
在一实施例中,所述药物组合物为液体剂。
在一实施例中,所述药物组合物为非肠道制剂。
在一实施例中,所述药物组合物还包括:注射用生理盐液、5%葡萄糖液、林格液、乳酸林格液、醋酸林格液、重碳酸林格液、氨基酸液、起始液(1号液)、脱水补给液(2号液)、维持输液(3号液)、术后恢复液(4号液)和/或Plaste(4号液)。
在一实施例中,所述药物组合物还包括添加剂,其中添加剂可以是乳化剂、分散剂、缓冲剂、保存剂、润湿剂、抗氧化剂、螯合剂、增稠剂、凝胶剂和/或pH调节剂等用于增强药物组合物的保存期、吸收性、粘性、均一性的各种添加剂。
在一实施例中,所述药物组合物,可部分或全部地为CD31和CD73阳性的间充质干细胞和/或其外泌体,对于CD31和CD73阳性的间充质干细胞的含量优选为50%以上,更优选为75%以上,进一步优选为90%以上,最优选为100%。
本发明的另一个目的是提供一种制备所述的药物组合物的方法,所述方法包括下述步骤:
步骤一:从源组织中获取并培养间充质干细胞;
步骤二:分散步骤一所得间充质干细胞获得单细胞悬液;
步骤三:从步骤二所得单细胞悬液中分选和提取CD31和CD73阳性的间充质干细胞。
在一实施例中,所述方法还包括:
在步骤三后包括步骤四:加入激活剂培养所述CD31和CD73阳性的间充质干细胞获得激活的CD31和CD73阳性的间充质干细胞。
在一实施例中,所述激活剂包括:Toll样受体(TLRs)激活剂。
在一实施例中,所述Toll样受体(TLRs)包括TLR-1、TLR-2、TLR-3、TLR-4、TLR-5、TLR-6、TLR-7、TLR-8和/或TLR-9。
在一实施例中,所述Toll样受体(TLRs)激活剂包括:Pam3CSK4、HKLM、Poly IC、LPS、丁丙诺啡、卡马西平、芬太尼、左啡烷、美沙酮、卡卡因、吗啡、奥卡西平、羟考酮、哌替啶、来自隐球菌的葡萄糖醛酸甘露聚糖、吗啡-3-葡糖苷酸、脂质体酸、β-防御素2、小分子量透明质酸、纤维连接蛋白EDA、snapin、卡介苗(BCG)、生腱蛋白C、鞭毛蛋白、FSL-1、咪喹莫特、ssRNA40、LyoVec、CpG寡核苷酸、ODN2006、活化蛋白C(APC)和/或Agatolimod。
在一实施例中,所述Toll样受体(TLRs)激活剂包括活化蛋白C(APC)和/或卡介苗(BCG)。
本发明的另一个目的是提供所述药物组合物在制备预防或治疗肺部退行性疾病药物的应用。
在一实施例中,所述肺部退行性疾病包括慢性阻塞性肺病、肺气肿、哮喘、支气管炎和/或囊性纤维化。
本发明另一个目的是提供一种预防或治疗肺部退行性疾病的方法,所述方法为向受试者施用所述药物组合物。
在一实施例中,所述方法为肠胃外给药。
在一实施例中,所述方法为静脉注射或皮下注射。
附图说明
图1显示根据本发明CD31和CD73阳性的间充质干细胞形态图;
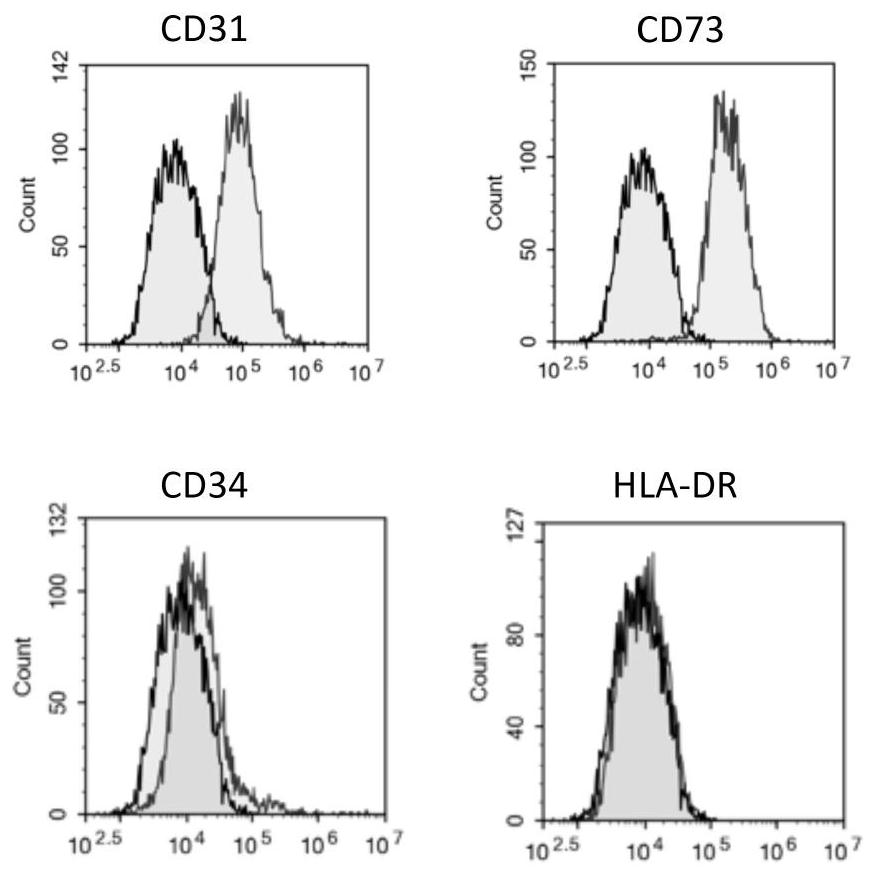
图2显示根据本发明CD31和CD73阳性的间充质干细胞表面标志表达的流式细胞术检测结果图;
图3显示根据本发明CD31和CD73阳性的间充质干细胞分别分化成脂肪细胞、骨细胞、心肌细胞、神经元细胞(巢蛋白Nestin染色和GFAP染色)和呼吸道上皮细胞后染色图,其中:
图3A显示根据本发明CD31和CD73阳性的间充质干细胞分化成脂肪细胞脂质空泡AdipoRed染色图;
图3B显示根据本发明CD31和CD73阳性的间充质干细胞分化成成骨细胞钙茜素红S染色图;
图3C显示根据本发明CD31和CD73阳性的间充质干细胞分化成心肌细胞alpha肌动蛋白染色图;
图3D显示根据本发明CD31和CD73阳性的间充质干细胞分化成神经元细胞巢蛋白Nestin染色染色图;
图3E显示根据本发明CD31和CD73阳性的间充质干细胞分化成神经元细胞GFAP染色图;
图3F显示根据本发明CD31和CD73阳性的间充质干细胞分化成呼吸道上皮细胞表面活性剂蛋白C染色图;
图4显示根据本发明对比例一、实施例一、实施例四所得的CD31和CD73阳性的间充质干细胞进行对人PBMC增值影响的检测图;
图5显示根据本发明比例一、实施例一、实施例五所得的CD31和CD73阳性的间充质干细胞进行对人PBMC增值影响的检测图;
图6显示根据本发明对比例一、实施例一、实施例四所得的CD31和CD73阳性的间充质干细胞所得的CD31和CD73阳性的间充质干细胞施用人肺后做TNF-alpjha含量检测图;
图7显示根据本发明对比例一、实施例一、实施例五所得的CD31和CD73阳性的间充质干细胞施用人肺后做TNF-alpjha含量检测图;
图8显示根据本发明对比例一、实施例一、实施例四所得的CD31和CD73阳性的间充质干细胞施用人肺后做IL-1含量检测图;
图9显示根据本发明对比例一、实施例一、实施例五所得的CD31和CD73阳性的间充质干细胞施用人肺后做IL-1含量检测图。
具体实施方式
本发明提供的药物组合物,包括CD31和CD73阳性的间充质干细胞,具有抑制炎症细胞因子分泌、促进肺再生细胞因子分泌、抑制肺纤维化、预防肺细胞凋亡等功能,因此可应用于预防或治疗包括慢性阻塞性肺病(COPD)在内的肺部退行性疾病。
另外,上述CD31和CD73阳性的间充质干细胞外泌体,也具有与CD31和CD73阳性的间充质干细胞相似的功能,因此也可应用于预防或治疗包括慢性阻塞性肺病(COPD)在内的肺部退行性疾病。
进一步地,激活的CD31和CD73阳性的间充质干细胞及其外泌体可增加上述抑制炎症细胞因子分泌、促进肺再生细胞因子分泌、抑制肺纤维化、预防肺细胞凋亡等功能的作用效果,使其预防或治疗包括慢性阻塞性肺病(COPD)在内的肺部退行性疾病效果显著增加。以下,对本发明中CD31和CD73阳性的间充质干细胞、CD31和CD73阳性的间充质干细胞外泌体、激活的CD31和CD73阳性的间充质干细胞及包括上述成分的药物组合物进行说明。
【CD31和CD73阳性的间充质干细胞】
本发明中,间充质干细胞是指具有向骨细胞,心肌细胞,软骨细胞,腱细胞,脂肪细胞等属于间充质细胞的分化能力,在维持该分化能力的同时能够增殖的细胞。例如骨髓、脂肪、血液、骨膜、真皮、脐带、胎盘、羊膜、绒毛膜、脱落膜、肌肉、子宫内膜、真皮、牙小囊、牙周膜、牙髓或牙胚等来源的间充质干细胞,优选脐带来源,脂肪来源,胎盘来源,骨髓来源的间充质干细胞,更好的是脐带来源,胎盘来源的间充质干细胞。本发明的间充质干细胞是上述间充质干细胞的集合体,可以包括具有相互不同特性的多种间充质干细胞。
本发明中“CD31和CD73阳性”指的是细胞表面标记表达CD31和CD73阳性。CD标记物是细胞表面蛋白,常用于鉴定各种细胞类型。作为本发明的CD31和CD73阳性间充质干细胞,其表现为细胞表面CD31和CD73表达阳性。
作为本发明的CD31和CD73阳性的间充质干细胞表面标记表达鉴定,可选用流式细胞术。以下给出一种参考的方法:
1)原代细胞分离与冻存。获取人胎盘组织,PBS清洗,加入DNA酶及胶原酶消化,收集上清液,过滤去除组织块后移入培养皿,培养24小时后更换液体,待细胞融合至80%以上,优选90%以上进行冻存。
2)原代细胞融化,用0.25%胰蛋白酶消化细胞,将消化后的细胞离心弃上清,PBS清洗后加入含10%胎牛血清的PBS封闭30分钟。
3)收获细胞,分别取2×10
4)流式细胞检测是否有CD31和/或CD73表达。
本发明中的CD31和CD73阳性的间充质干细胞,可以是自体性干细胞、也可以是异体性干细胞。
本发明的CD31和CD73阳性的间充质干细胞,除具有细胞表面标记表达CD31和CD73阳性的特征以外,还可根据以下方法赋予其进一步特征。例如核型特征、生长特征、分化特征、细胞因子分泌、基因表达。
【增殖传代能力】
作为本发明的CD31和CD73阳性的间充质干细胞,可以被增值传代。
作为本发明的CD31和CD73阳性的间充质干细胞,其传代次数的下限,优选为1次以上,更优选为2次以上,进一步优选为3次以上。作为本发明的CD31和CD73阳性的间充质干细胞,其传代次数的上限,优选为25次以下,更优选为15次以下,进一步优选为10次以下,最优选为5次以下。
作为本发明的CD31和CD73阳性的间充质干细胞,其增值次数优选为5次以上,更优选为10次以上,更优选为15次以上,更优选为20次以上,进一步优选为25次以上,最优选为30次以上。
细胞增值次数指的是在一定培养期内细胞分裂的次数。
本发明的CD31和CD73阳性的间充质干细胞的增值能力可选用本领域技术人员已知的方法测定,例如细胞计数法、显微镜观察法。
【分化特征】
作为本发明的CD31和CD73阳性的间充质干细胞,可分化为中胚层、外胚层、内胚层等谱系。分化为中胚层、外胚层或内胚层谱系是指分别变为特定中胚层、外胚层或内胚层谱系的细胞。分化成中胚层谱系的细胞或产生特定的中胚层细胞的例子包括但不限于:脂肪细胞、软骨、心肌、皮肤、造血、血管生成、肌肉、肾、泌尿生成、成骨、心包起源或基质细胞。分化为外胚层谱系的细胞包括但不限于,表皮细胞,神经原细胞和神经胶质细胞。分化成内胚层谱系的细胞的实例包括但不限于胸膜细胞、肝细胞、肠道内壁细胞或产生胰腺及松弛细胞的细胞。
作为本发明的CD31和CD73阳性的间充质干细胞,如本领域技术人员已知,上述分化可通过诱导条件培养获得分化的细胞集团。例如:
作为向骨细胞分化的诱导法,其中一种诱导方法如下:本发明中CD31和CD73阳性的间充质干细胞培养数日后,在添加了胎牛血清等血清、地塞米松、β-甘油磷酸盐及抗坏血酸-2-磷酸盐的培养基中进行继续培养。此外,作为上述培养的培养条件,可参考本领域通常用于骨分化诱导培养的条件;作为上述分化培养基,也可以使用市售的骨细胞分化用培养基;作为培养时间,通常不超过21天,但也可以持续至30~40天左右。具体地,通过以下方法可以诱导骨细胞分化,即将本发明中CD31和CD73阳性的间充质干细胞传代3次后,置于骨细胞分化用培养基中培养,从培养开始24小时~72小时左右后更换培养基,之后每隔3~4天更换一次培养基,持续培养2周~1个月左右。
作为向脂肪细胞分化的诱导方法,其中一种诱导方法如下:本发明中CD31和CD73阳性的间充质干细胞培养数日后,在添加了维甲酸、胰岛素及三碘甲状腺原氨酸(T3)的培养液中继续培养。此外,作为上述培养的培养条件,可参考本领域通常用于脂肪分化诱导培养的条件;作为上述分化培养基,也可以使用市售的脂肪细胞分化用培养基;作为培养时间,通常不超过21天,但也可以持续至30~40天左右。具体地,通过以下方法可以诱导脂肪细胞分化,即将本发明中CD31和CD73阳性的间充质干细胞传代3次后,置于脂肪细胞分化用培养基中培养,从培养开始24小时~72小时左右后更换培养基,之后每隔3~4天更换一次培养基,持续培养2周~1个月左右。
作为对软骨细胞的分化诱导法,其中一种诱导方法如下:将本发明CD31和CD73阳性的间充质干细胞与胶原凝胶等混合进行凝胶化,在添加了地塞米松,抗坏血酸-2-磷酸酯,丙酮酸钠(sodium)的培养基中继续培养。此外,作为上述培养的培养条件;可参考本领域通常用于软骨分化诱导培养的条件;作为上述分化培养基,也可以使用市售的软骨细胞分化用培养基;作为培养时间,通常不超过21天,但也可以持续至30~40天左右。具体地,通过以下方法可以软骨细胞分化,即将本发明中CD31和CD73阳性的间充质干细胞传代3次后,置于软骨细胞分化用培养基中培养,从培养开始24小时~72小时左右后更换培养基,之后每隔3~4天更换一次培养基,持续培养2周~1个月左右。
通过诱导得到的细胞,可通过细胞染色确认分化细胞种类。如本领域技术人员已知,脂肪细胞可通过苏丹III、油红O(Oil red O)、AdipoRed、尼罗蓝等染色确认;骨细胞可通过茜素红(Alizarin red)染色确认;软骨细胞可通过天竺葵(Alcian blue),红花素O,或者甲苯蓝染色确认。
【细胞因子分泌】
作为本发明的CD31和CD73阳性的间充质干细胞,可以根据细胞因子分泌的有无进一步赋予特征。作为本发明的CD31和CD73阳性的间充质干细胞分泌的细胞因子,可以举出例如MMP1、前列腺素E2(PGE2)、转化因子beta(TGF-beta)、吲哚胺2,3-二加氧酶(IDO)和一氧化氮(NO)等。本发明的CD31和CD73阳性的间充质干细胞分泌由MMP1、前列腺素E2(PGE2)、转化因子beta(TGF-beta)、吲哚胺2,3-二加氧酶(IDO)和一氧化氮(NO)组成的组中至少一种细胞因子,更优选为分泌至少两种细胞因子,更优选为分泌三种细胞因子,最优选为分泌全部的细胞因子。
MMP1,可认为其具有参与组织破坏和组织再构建的的作用,进而起到促进炎症部位及损伤部位组织修复效果。
前列腺素E2(PGE2),可认为其具有诱导巨噬细胞的M2表型,进而起到促进炎症部位及损伤部位组织修复效果。
转化因子beta(TGF-beta),可认为其通过抑制自然杀伤细胞(NK细胞)和调节巨噬细胞和中性粒细胞的行为控制先天免疫系统,进而抑制免疫系统多种成分的扩张和功能。
吲哚胺2,3-二加氧酶(IDO),可认为其通过抑制T细胞的效应器功能发挥免疫调节作用,进而上调IDO蛋白水平导致生长的停滞和效应T细胞的凋亡。
一氧化氮(NO),可认为其作用于免疫应答Th1/Th2平衡系统,诱导Th2相关分子IL-4和IL-12(p40)2表达,同时抑制Th1型细胞因子IL-2和IFN-γ表达,进而起到免疫调节作用。
以上细胞因子的分泌测定,可使用本领域人员已知的方法进行,这些方法包括:免疫学检测法,如ELISA、RIA法;生物学测定法,分子生物学测定法,如PCR法等。
【基因表达】
作为本发明的CD31和CD73阳性的间充质干细胞,可以根据特定基因表达进一步赋予特征。这样的特定基因包括:TSG-6、Stro-1、CD90等,。本发明的CD31和CD73阳性的间充质干细胞表达由SG-6、Stro-1和CD90组成的组中至少一种基因,更优选为表达至少两种基因,最优选为表达全部的基因。
TSG-6,可认为其由于基因启动子序列中存在激活蛋白1和核因子白细胞介素1结合的位点,可在被肿瘤坏死因子(TGF-α)刺激后参与各种炎症反应。
Stro-1,可认为其具有增强间充质干细胞免疫抑制效应的作用。
CD90,可认为其具有调节细胞与细胞,细胞与细胞间质间的重要反应,进而在神经再生和转移,炎症及纤维化中起到重要作用。
以上基因表达的检测,可使用本领域人员已知的方法进行,这些方法包括:qRT-PCR法。
【CD31和CD73阳性的间充质干细胞的制备】
作为本发明CD31和CD73阳性的间充质干细胞的制备方法,包括下述步骤:
步骤一:从源组织中获取并培养间充质干细胞;
步骤二:分散步骤一所得间充质干细胞获得单细胞悬液;
步骤三:从步骤二所得单细胞悬液中分选和提取CD31和CD73阳性的间充质干细胞。
下面对这些步骤进行详细说明。
(1)步骤一:从源组织中获取并培养间充质干细胞。即从脐带、脂肪、骨髓、胎盘等组织中,优选为胎盘组织中,按照本领域技术人员已知的方法,分离并培养间充质干细胞,获得的间充质干细胞集合。
作为本发明间充质干细胞培养所用生长培养基是足以培养胎间充质干细胞的培养基,可以为DMEM,优选为DMEM-低葡萄糖(DMEM-LG),进一步优选为含补充剂的DMEM-低葡萄糖,其中补充剂包括下组成分中的一种或多种:胎牛血清、抗生素和2-巯基乙醇。
作为上述补充剂的抗生素,优选为青霉素、链霉素、两性霉素B。
作为上述补充剂的补充量,不作限定。优选为包括体积百分含量15%的胎牛血清和青霉素100mg/mL和/或链霉素100mg/mL和/或两性霉素B 0.25μg/mL和体积百分含量0.001%的2-巯基乙醇。
其中,为获得较高纯度的CD31和CD73阳性的间充质干细胞集,并使后续提取外泌体更加方便,可选用条件培养基进行培养。
条件培养基是将培养过细胞的培养基除细胞取其上清液,直接用于培养其他细胞或作为其他细胞培养基的添加成分,收集培养特定细胞或细胞群的培养基。当细胞在培养基中培养时可以分泌为其他细胞提供营养支持的因子。这些营养因子包括激素、细胞因子、细胞外基质(ECM)、蛋白质、囊泡、抗体和颗粒。优选地,条件培养基为无血清培养基。使用条件培养基培养间充质干细胞,得到的细胞集团中,CD31和CD73阳性占比70%以上、较佳地占比80%以上、更佳的占比90%以上。
上述激素包括胰岛素;
上述细胞因子包括成纤维细胞生长因子(FGFs)或血小板源生长因子AB(PDGFAB);
上述蛋白质包括转铁蛋白或硒蛋白(ITS);
上述成纤维细胞生长因子(FGFs)浓度可以是2ng/mL-10ng/mL,优选为5ng/mL,血小板源生长因子AB(PDGF AB)浓度可以是2ng/mL-10ng/mL,优选为5ng/mL。
作为本发明的间充质干细胞培养条件,没有特别限定,可以是本领域技术人员已知的标准生长条件。例如:37℃,5%的CO
作为本发明间充质干细胞培养时间,至少为1天,优选为至少3天,进一步优选为至少5天。
(2)步骤二:分散步骤一所得间充质干细胞获得单细胞悬液;
作为本发明分散步骤一所得间充质干细胞获得单细胞悬液的方法,没有特别限定。以下给出一种参考的方法。即,将步骤一所得的间充质干细胞在生理盐水中洗涤,后在37℃下,在离解酶存在下消化2小时,后去除杂质细胞,获得单细胞悬液。
上述生理盐水优选为Hanks缓冲盐溶液(HBSS);
上述离解酶是一种或多种可减小或破坏细胞间结合的酶,包括胶原酶、分散酶、胰蛋白酶,优选为多种酶的联合使用,例如脱氧核糖核酸酶I(Dnase-1)和分散酶II(DispaseII);
上述离解酶的使用量,可根据条件在本领域技术人员常识范围内变化。如1mg/mL脱氧核糖核酸酶I(Dnase-1)和75μg/mL分散酶II(DispaseII)。
上述去除杂质细胞,可通过过滤、离心沉降、密度分级等本领域技术人员已知的方式进行,优选的方式为过滤。具体操作为单细胞悬浮液通过100微米筛,并在750×g下旋转5分钟。
(3)步骤三:从步骤二所得单细胞悬液中分选和提取CD31和CD73阳性的间充质干细胞。
作为本发明分选提取CD31和CD73阳性的间充质干细胞的方法,可使用本领域技术人员已知的流氏细胞分选法、免疫磁珠细胞分选法、微流控分选、激光显微切割、密度梯度离心等,优选为流式细胞分选法、免疫磁珠细胞分选法,最优选为免疫磁珠细胞分选法。具体操作可以是:在4℃下,与CD45抗体标记的免疫磁珠标记15分钟,后置于DynaMag
【CD31和CD73阳性的间充质干细胞外泌体】
本发明中,CD31和CD73阳性的间充质干细胞外泌体包括细胞分泌的富含生物活性因子的物质。
上述富含生物活性因子的物质包括CD31和CD73阳性的间充质干细胞或其培养基中一种或多种基因或基因产物。
上述基因产物包括:蛋白质、mRNA和/或miRNA。
上述蛋白质包括下组中的一种或多种:细胞骨架蛋白,例如微管蛋白、肌动蛋白和/或中间丝蛋白;细胞内膜融合和运输蛋白,例如膜联蛋白和/或rab蛋白;信号转导蛋白,例如蛋白激酶、14-3-3和/或异源三聚体G蛋白;代谢酶,例如过氧化物酶、丙酮酸激酶和/或烯醇酶-1;四跨膜蛋白家族,例如CD9、CD63、CD81和/或CD82。优选地,蛋白质包括四跨膜蛋白家族中的一种或多种。
本发明中CD31和CD73阳性的间充质干细胞外泌体,其直径范围可以是40-100nm。
本发明中CD31和CD73阳性的间充质干细胞外泌体,其可由内体膜的向内出芽形成。
本发明中CD31和CD73阳性的间充质干细胞外泌体,其密度范围可以是1.13-1.19g/mL。
【CD31和CD73阳性的间充质干细胞外泌体制备】
作为本发明CD31和CD73阳性的间充质干细胞外泌体的制备方法,可通过收集CD31和CD73阳性的间充质干细胞上清提取。作为CD31和CD73阳性的间充质干细胞上清,可从本发明“CD31和CD73阳性的间充质干细胞的制备”部分步骤三中获取,具体地,分选和提取CD31和CD73阳性的间充质干细胞后,余液取上清即可。
本发明CD31和CD73阳性的间充质干细胞外泌体,包含在上述CD31和CD73阳性的间充质干细胞上清中,但作为优选,可对上述CD31和CD73阳性的间充质干细胞上清进一步提取,以获得更高纯度CD31和CD73阳性的间充质干细胞外泌体。可选择的提取方法有:超速离心法、凝胶色谱法、超滤法、免疫磁珠法、尺寸排阻色谱法和试剂盒提取法,优选为超速离心法和尺寸排阻色谱法。
作为超速离心法提取CD31和CD73阳性的间充质干细胞外泌体的方法,具体操作可以是通过逐步提高离心速度去除细胞上清中的细胞碎片和蛋白质沉淀后,在不少于37300r/min的离心力下至少离心2小时,优选为2.5小时,收获外泌体,经过纯化可获得纯度较高的间充质干细胞外泌体。可选择的纯化方式为蔗糖梯度离心纯化,即预制不同浓度的蔗糖溶液形成连续的梯度体系,以37300r/min离心至少16小时,使外泌体沉降在1.12-1.24g/mL的等密度层,收集该密度层悬液,可得到纯度较高的间充质干细胞外泌体。
本发明中,CD31和CD73阳性的间充质干细胞,可通过抑制促炎细胞因子分泌、促进肺再生细胞因子分泌、抑制肺纤维化和预防肺细胞凋亡作用机制预防或治疗肺部退行性疾病,但应理解,作用机制不限于此。
【促炎细胞因子】
促炎细胞因子是一系列可以促进炎症的细胞因子的总称,是可以引起细胞表型变化的主要介质,尤其是引起内皮细胞的各种形态和基因表达变化。常见的促炎细胞因子为肿瘤坏死因子α(TNF-alpjha)和白细胞介素1-β(IL-1)。
本发明一实施例中,CD31和CD73阳性的间充质干细胞对促炎细胞因子有抑制作用。这里的促炎细胞因子是指能够诱导内皮细胞中基因表达的细胞因子,包括:IL-6、肌球蛋白1、IL-33、缺氧诱导因子-1、鸟苷酸结合蛋白。异构体I、氨基乙酰丙酸盐δ合酶2、AMP脱氨酶、IL-17、DNAJ样2蛋白、组织蛋白酶L、转录因子-20、M31724、吡烯基烷基胺结合蛋白、HEC、GA17、芳基硫酸酯酶D基因、芳基硫酸酯酶E基因、细胞周期蛋白基因、原血小板碱性蛋白基因、PDGFRA、人STS WI12000、甘露糖苷酶、βA、溶酶体MANBA基因、UBE2D3基因、Igγ人类DNA重链、STRL22、BHMT、智人唐氏综合症关键区域、含有FI5613 ZNF基因家族成员、IL-8、ELFR、人类双核苷酸mRNA用于双特异性磷酸酶MKP-5、人类智能调节G蛋白信号10mRNA完整、智人Wnt13 Mma、智人N末端乙酰转移酶复合物ard1亚基、核糖体蛋白L15mRNA、PCNAmRNA、ATRM基因外显子21、无毛蛋白外显子2的HR基因、N末端乙酰转移酶复合物ard1亚基、HSM801431人类智能mRNA、CDNA用于无毛蛋白的DKFZp434N2072、RPL26和HR基因、G蛋白信号传导的调节剂等。
【肺再生细胞因子】
肺再生细胞因子是一系列可促进肺细胞再生的细胞因子。主要包括角质形成细胞生长因子(KGF)和睫状神经营养因子(CNTF)。
本发明一实施例中,CD31和CD73阳性的间充质干细胞对角质形成细胞生长因子(KGF)和睫状神经营养因子(CNTF)的形成有促进作用,实现促进肺细胞再生。
【抑制肺纤维化】
慢阻肺病因相关的一种机制是胶原降解的产物的存在引起中性粒细胞的活化,而中性粒细胞可产生促炎细胞因子,加重炎症反应与肺纤维化。
本发明一实施例中,CD31和CD73阳性的间充质干细胞可减少基质金属蛋白酶(MMP-9)的产生,降低胶原蛋白产生降解产物PGP的过程,实现对肺纤维化的抑制。
【预防肺细胞凋亡】
胰岛素样生长因子-1(IGF-1)是一种细胞凋亡的抑制调控因子,能够抑制多种类型细胞凋亡,促进细胞增殖和分化;血管通透因子或血管内皮生长因子(VEGF)是一种细胞凋亡的抑制调控因子,其可通过诱导内皮细胞中具有抗凋亡作用的基因表达抑制内皮细胞的凋亡。
本发明一实施例中,CD31和CD73阳性的间充质干细胞对类胰岛素一号增长因子(IGF-1)和血管通透因子或血管内皮生长因子(VEGF)的形成有促进作用。
本发明所述的CD31和CD73阳性的间充质干细胞,相对现有技术而言,已具备较优的预防或治疗包括慢性阻塞性肺病(COPD)在内的肺退行性疾病的有益效果。
作为本发明第二实施方式,使用激活的间充质干细胞,即将上述CD31和CD73阳性的间充质干细胞用激活剂激活,可起到显著的增强抑制炎症细胞因子分泌、促进肺再生细胞因子分泌、抑制肺纤维化、预防肺细胞凋亡的有益效果。
【激活的CD31和CD73阳性的间充质干细胞】
作为本发明的激活的CD31和CD73阳性的间充质干细胞,其是将CD31和CD73阳性的间充质干细胞用激活剂激活以表现显著增强CD31和CD73阳性的间充质干细胞抑制促炎细胞因子分泌、促进肺再生细胞因子分泌、抑制肺纤维化、预防肺细胞凋亡的效果。
本发明中用来激活CD31和CD73阳性的间充质干细胞的激活剂是一类先天免疫系统激活试剂,通过调节嗜中性粒细胞、巨噬细胞、肥大细胞及自然杀伤细胞信号传导的作用机制将其激活。符合上述作用机制的试剂可列举:Toll样受体(TLRs)激活剂。
Toll样受体(TLRs)是可以有效识别病原体的一种细胞跨膜蛋白受体,通过与配体结合的方式在先天免疫中发挥重要作用,包括TLR-1、TLR-2、TLR-3、TLR-4、TLR-5、TLR-6、TLR-7、TLR-8、TLR-9等。上述Toll样受体(TLRs)激活剂是指能使Toll样受体(TLRs)激活以使CD31和CD73阳性的间充质干细胞表现抗炎型反应表型一系列物质,可适当列举以下几种:
当Toll样受体(TLRs)是TLR-2时,所述Toll样受体(TLRs)激活剂包括:HKLM和/或卡介苗(BCG);
当Toll样受体(TLRs)是TLR-3时,所述Toll样受体(TLRs)激活剂包括:Poly IC和/或卡介苗(BCG);
当Toll样受体(TLRs)是TLR-4时,所述Toll样受体(TLRs)激活剂包括:LPS、丁丙诺啡、卡马西平、芬太尼、左啡烷、美沙酮、卡卡因、吗啡、奥卡西平、羟考酮、哌替啶、来自隐球菌的葡萄糖醛酸甘露聚糖、吗啡-3-葡糖苷酸、脂质体酸、β-防御素2、小分子量透明质酸、纤维连接蛋白EDA、snapin、卡介苗(BCG)和/或生腱蛋白C;
当Toll样受体(TLRs)是TLR-5时,所述Toll样受体(TLRs)激活剂包括:鞭毛蛋白;
当Toll样受体(TLRs)是TLR-6时,所述Toll样受体(TLRs)激活剂包括:FSL-1;
当Toll样受体(TLRs)是TLR-7时,所述Toll样受体(TLRs)激活剂包括:咪喹莫特;
当Toll样受体(TLRs)是TLR-8时,所述Toll样受体(TLRs)激活剂包括:ssRNA40和/或LyoVec;
当Toll样受体(TLRs)是TLR-9时,所述Toll样受体(TLRs)激活剂包括:CpG寡核苷酸、ODN2006、活化蛋白C(APC)和/或Agatolimod。
作为Toll样受体(TLRs)激活剂,优选卡介苗(BCG)和/或活化蛋白C(APC)。
本领域技术人员应当理解,上述Toll样受体(TLRs)激活剂不限于此,同种Toll样受体(TLRs)激活剂激活的Toll样受体也不限于此。
本发明激活的间充质干细胞可用下述方法制备。即,
步骤一:从源组织中获取并培养间充质干细胞获得间充质干细胞集;
步骤二:加入离解酶离解上述间充质干细胞集以获得单细胞悬液;
步骤三:从上述单细胞悬液中分选和提取CD31和CD73阳性的细胞。
步骤四:加入激活剂培养所述CD31和CD73阳性的细胞获得激活的间充质干细胞。
其中步骤一至三与本发明说明书“CD31和CD73阳性的间充质干细胞的制备”部分所述相同,下面主要对步骤四进行详细说明。
(4)步骤四:加入激活剂培养所述CD31和CD73阳性的细胞获得激活的间充质干细胞。
作为本发明获得激活的间充质干细胞的方法,可以是用一定浓度的激活剂预处理CD31和CD73阳性的细胞。具体的操作为,加入一定浓度激活剂培养CD31和CD73阳性的细胞至少24小时,优选为至少30小时。
上述激活剂的使用浓度范围为20ug/mL-100ug/mL,优选为40ug/mL-80ug/mL,最优选为40ug/mL。
【药物组合物】
作为本发明的药物组合物,其特征为包括CD31和CD73阳性的间充质干细胞;或
包括CD31和CD73阳性的间充质干细胞外泌体;
或包括CD31和CD73阳性的间充质干细胞和其外泌体。
作为优选,上述CD31和CD73阳性的间充质干细胞为激活的CD31和CD73阳性的间充质干细胞。
CD31和CD73阳性的间充质细胞通过抑制促炎细胞因子分泌、促进肺再生细胞因子分泌、抑制肺纤维化、预防肺细胞凋亡作用机制,对肺部退行性疾病有良好的预防或治疗效果。
本发明的药物组合物,除包括CD31和CD73阳性的间充质干细胞和/或其外泌体外,也可含有其他的成分,例如制药上可以容许的介质添加剂等。
上述制药上可以容许的介质,是可以给患者或受试者投药的溶液,但不特别限定。制药上可以容许的介质可以是一种或多种输液制剂,例如注射用水、生理盐液、5%葡萄糖液、林格液、乳酸林格液、醋酸林格液、重碳酸林格液、氨基酸液、起始液(1号液)、脱水补给液(2号液)、维持输液(3号液)、术后恢复液(4号液)或Plaste(4号液)。
上述添加剂,可以是一种或多种乳化剂、分散剂、缓冲剂、保存剂、润湿剂、抗氧化剂、螯合剂、增稠剂、凝胶剂或pH调节剂等用于增强药物组合物的保存期、吸收性、粘性、均一性的各种添加剂。
本发明的药物组合物,可部分或全部地为CD31和CD73阳性的间充质干细胞和/或其外泌体,对于CD31和CD73阳性的间充质干细胞的含量无特殊限定,优选为50%以上,更优选为75%以上,进一步优选为90%以上,最优选为100%。
本发明的药物组合物,其剂型无特别限定。优选为液体剂,更优选为注射用液体剂。
作为本发明药物组合物的给药方法,无特别限定。优选为注射给药,例如皮下注射,淋巴结内注射,静脉内注射,动脉内注射,腹腔内注射,胸腔内注射或者局部直接注射等。
作为本发明药物组合物的给药剂量,可根据患者的年龄,体重,临床评估,嗜酸性粒细胞计数(血液或痰嗜酸性粒细胞,嗜酸性粒细胞阳离子蛋白(ECP)测量,或嗜酸性粒细胞衍生的神经毒素(EDN)测量)等因素改变。可参考剂量为每公斤体重一百万至五百万个间充质干细胞或等量其外泌体,药物组合物的剂量可根据其间充质细胞含量换算。
作为本发明药物组合物的给药间隔,可以是每4周,5周,6周,8周,10周,12周或更长的间隔给药一次,优选为先施用三个四周给药间隔(即,在第0天,第4周和第8周),然后改为8周给药间隔(即,在第16周,第24周,第32周等)。
作为本发明药物组合物的给药次数,向患者施用本发明药物组合物的次数为至少两次,优选为至少七次。疗程不做限定,根据患者情况可以是四周、八周、十二周、二十四周、四十八周、一年或更长。
作为本发明药物组合物的一种优选的使用方式,在受试者出现急性恶化(例如轻度,中度或严重恶化)后不久,将单剂量或首次剂量药物组合物给予受试者。
作为本发明药物组合物的使用效果,使用本发明中的药物组合物改善了慢性阻塞性肺病(COPD)患者的肺功能,具体可通过一秒内用力呼气量(FEV1)的增加和/或通过呼吸困难指数(BDI/TDI)减小和/或慢性肺病工具-呼吸系统症状(E-RS)改善证明。
在本发明一实施例中,使用本发明中的药物组合物与对照组未使用本发明药物组合物的慢性阻塞性肺病(COPD)肺病患者人群相比,可以增加FEV1至少5%,优选地可增加FEV1至少10%,进一步优选地可增加FEV1至少12%。
在本发明一实施例中,在第一次施用本发明中的药物组合物的慢性阻塞性肺病(COPD)患者FEV1一年内可明显增加。
为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合附图对本发明的各实施方式进行详细的阐述。然而,本领域的普通技术人员可以理解,在本发明各实施方式中,为了使读者更好地理解本申请而提出了许多技术细节。但是,即使没有这些技术细节和基于以下各实施方式的种种变化和修改,也可以实现本申请所要求保护的技术方案。
实施例一:CD31和CD73阳性的间充质干细胞制备
取来自进行剖腹产手术的健康孕妇胎盘,并根据道德规范要求签署知情同意声明。收集胎盘后,剥离蜕膜组织膜和脐带,保留子叶。然后将子叶在Hanks缓冲盐溶液(HBSS)中洗涤,然后在37℃下在1mg/mL胶原酶I、1mg/mL Dnase-1和75μg/mL Dispase溶液中消化2小时。消化后,过滤单细胞悬浮液通过100微米筛,并在750×g下旋转5分钟。上清液倒出并随后将细胞沉淀重新悬浮在红细胞裂解缓冲液中并在37℃温育室培养10分钟。然后将悬浮液在510×g下旋转5小时分钟。然后倒出上清液,将细胞沉淀在Hanks缓冲盐溶液(HBSS)中洗涤并在37℃再次旋转510×g持续5分钟。
将细胞重悬于冰冷的MACS缓冲液(含有2mL EDTA,0.5%BSA的磷酸盐缓冲溶液)中,与CD45抗体标记的免疫磁珠标记15分钟,后置于DynaMagTM-2磁力架中分离CD45抗体标记的细胞。剩余细胞悬浮液在510×g下离心5分钟,后重悬于1mL MACS缓冲液中,后加入CD34抗体标记的免疫磁珠,在4℃温育15分钟,后置于DynaMagTM-2磁力架中以分离CD34标记的细胞。剩余细胞悬浮液在510×g离心5分钟,后重悬于3mL MACS缓冲液中,获得纯化表达CD31和CD73的细胞。CD73阳性细胞在含有20%胎牛血清的DMEM中培养并传代3次,获得第三代间充质干细胞,具体形态见图1。
观察细胞形态,呈现梭型、多角形。
实施例二:CD31和CD73阳性的间充质干细胞表面标志检测
取实施例一培养的第三代间充质干细胞,流式细胞术检测CD31、CD73、CD34和HLA-DR的表达。所用流氏试剂美国BD Pharmingen,分别是FITC mouse anti-human CD31(Cat#560984)、PE mouse anti-human CD73(Cat#550257,BD)、FITC mouse anti-human CD34(Cat#555821)、FITC mouse anti-human HLA-DR(Cat#555811)。对照抗体为FICT mouseIgG1、k isotype(Cat#555909)、PE mouse IgG2b,k isotype对照(Cat#559529)。
按照美国BD Pharmingen提供的实验方法进行染色和流式检测,结果见图2。
结果显示:实施例一培养的间充质干细胞上CD31与CD73表达呈阳性、CD34\CD45及HLA-DR的表达呈阴性。
实施例三:CD31和CD73阳性的间充质干细胞诱导分化
骨细胞分化
准备无菌有盖玻片(做细胞爬行片)的6孔细胞培养板、按照4×103个/cm
脂肪细胞分化
准备无菌有盖玻片(做细胞爬行片)的6孔细胞培养板、按照4×103个/cm
心肌细胞分化
准备无菌有盖玻片(做细胞爬行片)的6孔细胞培养板、按照4×10
神经元细胞分化
准备无菌有盖玻片(做细胞爬行片)的6孔细胞培养板、按照4×10
呼吸道上皮细胞分化
准备无菌有盖玻片(做细胞爬行片)的6孔细胞培养板、按照4×10
上述检测结果见图3。
实施例四:BCG激活的CD31和CD73阳性的间充质干细胞的制备
取实施例一制备的CD31和CD73阳性的间充质干细胞,用1.5×10
实施例五:活化蛋白C激活的CD31和CD73阳性的间充质干细胞的制备
取实施例一制备的CD31和CD73阳性的间充质干细胞,用1.5×10
实施例六:CD31和CD73阳性的间充质干细胞外泌体的制备
取实施例一CD31和CD73阳性的间充质干细胞培养上清,逐步提高离心速度去除细胞上清中的细胞碎片和蛋白质沉淀,后在不少于37300r/min的离心力下至少离心2小时,收获外泌体。
对比例一:
取实施例一制备的CD31和CD73阳性的间充质干细胞,用1.5×10
实施例六:PBMC增殖检测
使用CD31和CD73阳性的间充质干细胞,用1.5×10
可得下述结论:
1)使用本发明CD31和CD73阳性的间充质干细胞,可显著降低PBMC增殖水平;
2)使用本发明第二方面所述激活的CD31和CD73阳性的间充质干细胞,可在此基础上,使PBMC增殖水平降低程度进一步增强。
实施例七:PBMC产生的TNF-alpjha检测
使用CD31和CD73阳性的间充质干细胞。将细胞在PBS中洗涤两次,随后加入植物血凝素(PHA)处理的外周血单核细胞(BPMC)。在96孔板中进行培养,每孔100000个PBMC加入5μg/mL的PHA。加入指定数量的CD31和CD73阳性的间充质干细胞或BCG或活化蛋白C处理的CD31和CD73阳性的间充质干细胞。培养24小时,收集上清液采用ELISA试剂盒检测TNF-alpha水平。
分别对比例一、实施例一、实施例四、实施例五所得的CD31和CD73阳性的间充质干细胞施用人肺后做TNF-alpjha含量检测,检测结果见图6和图7。
可得下述结论:
1)使用本发明CD31和CD73阳性的间充质干细胞,可显著减少PBMC产生的TNF-alpjha;
2)使用本发明第二方面所述激活的CD31和CD73阳性的间充质干细胞,可在此基础上,使PBMC产生的TNF-alpjha减少程度进一步提升。
实施例八:PBMC产生的IL-1检测
使用CD31和CD73阳性的间充质干细胞。将细胞在PBS中洗涤两次,随后加入植物血凝素(PHA)处理的外周血单核细胞(BPMC)。在96孔板中进行培养,每孔100000个PBMC加入5μg/mL的PHA。加入指定数量的CD31和CD73阳性的间充质干细胞或BCG或活化蛋白C处理的CD31和CD73阳性的间充质干细胞。培养24小时,收集上清液采用ELISA试剂盒检测IL-1水平。分别对比例一、实施例一、实施例四、实施例五所得的CD31和CD73阳性的间充质干细胞施用人肺后做IL-1含量检测,检测结果见图8和图9。
可得下述结论:
1)使用本发明CD31和CD73阳性的中间充质干细胞,可显著减少PBMC产生的IL-1;
2)使用本发明第二方面所述激活的CD31和CD73阳性的间充质干细胞,可在此基础上,使PBMC产生的IL-1减少程度进一步提升。
本领域的普通技术人员可以理解,上述各实施方式是实现本发明的具体实施例,而在实际应用中,可以在形式上和细节上对其作各种改变,而不偏离本发明的精神和范围。
- SOD在制备治疗皮肤病药物中的应用、其药物组合物、该药物组合物的应用及其制备方法
- 抗抑郁症药物组合物及其制备方法和应用以及包含其的药物或药物组合物
