用于改善的木糖利用或改善的葡萄糖和木糖共利用的XYLR突变体
文献发布时间:2023-06-19 10:36:57
相关申请的参考
本申请要求2018年8月31日提交的美国临时专利申请号62/726,114和2018年9月14日提交的美国临时专利申请号62/731,711的权益和优先权,请通过引用以其整体合并于此。
背景技术
为了满足日益增长的全球人口对能源和资源的需求,并减少对有限化石能源的依赖,必须增加可再生技术的使用来生产能源产品和消费产品。
示例性的可再生技术包括使用微生物系统来生产化学品和燃料。用于生产生物燃料和各种化学品的微生物系统在本领域中是众所周知的(参见例如,美国专利9,133,406;9,340,801;9,200,299;9,068,201;8,999,686;8,658,404;8,597,922;8,535,916;8,530,221;8,372,610;8,323,924;8,313,934;8,283,143;8,268,599;8,183,028;8,110,670;8,110,093;和8,097,439;等等)。然而遗憾的是,微生物系统所带来的全部利益可能会受到可用于生产的原料的性质的限制。
水解产物通常用作生物化学生产化学品的原料。这些原料比纯葡萄糖便宜,潜在地降低生物生产过程的成本。水解产物中最丰富的糖是葡萄糖和木糖。然而遗憾的是,木糖的利用率低于葡萄糖,并且由于两阶段作用,实际上在葡萄糖存在下常常不能有效地利用木糖。
因此,为了使衍生自水解产物原料的生物加工的任何可再生碳基产物的产量更高,本领域需要允许木糖利用率增加并且葡萄糖和木糖的共利用增加的微生物系统。幸运的是,从下面的公开内容中可以清楚地看出,本发明满足了这些和其他需求。
发明内容
本公开的一方面提供了工程改造的XylR变体,其具有改善的利用木糖的能力和改善的共同利用葡萄糖和木糖的能力。
在一方面,本公开提供了XylR蛋白变体,其中所述XylR蛋白变体在与SEQ ID NO:1的选自以下的位置对应的位置处具有至少一个突变:SEQ ID NO:1的位置83、88、89、112、120、141、145、146、147、150、154、155、247、270、280、286、289、295、305、306、313、333、336、337、351、364、365、372、和382。
一方面,本公开提供了包含XylR蛋白变体的重组宿主细胞,其中所述XylR蛋白变体在与SEQ ID NO:1的选自以下的位置对应的位置处具有至少一个突变:SEQ ID NO:1的位置83、89、112、120、141、145、146、147、150、154、155、247、270、280、286、289、295、305、306、313、333、336、337、351、364、365、372、和382。
在一方面,本公开提供了用于增加重组宿主细胞中木糖利用的方法。所述方法包括在包含木糖的培养基中培养包含XylR蛋白变体的重组宿主细胞,其中所述XylR蛋白变体在与SEQ ID NO:1的选自以下的位置对应的位置处具有至少一个突变:SEQ ID NO:1的位置83、89、112、120、141、145、146、147、150、154、155、247、270、280、286、289、295、305、306、313、333、336、337、351、364、365、372、和382。当在木糖存在下培养细胞时,与表达SEQ IDNO:1的宿主细胞的生长相比,重组宿主细胞中XylR蛋白变体的表达赋予重组宿主细胞改善的生长。
在一方面,本公开提供了制备脂肪酸衍生物的方法,所述方法包括在包含木糖的培养基中培养重组宿主细胞,所述重组宿主细胞包含至少一种异源脂肪酸衍生物生物合成酶和XylR蛋白变体,其中所述XylR蛋白变体在与SEQ ID NO:1的选自以下的位置对应的位置处具有至少一个突变:SEQ ID NO:1的位置83、89、112、120、141、145、146、147、150、154、155、247、270、280、286、289、295、305、306、313、333、336、337、351、364、365、372、和382。
在一方面,本公开提供了用于制备C
在上述方面的一些实施方案中,XylR蛋白中的至少一个突变选自由以下组成的组:V83C、L89V、L89K、L112R、N120C、Y141R、Q145R、L146R、V147M、E150W、E150G、G154C、V155E、A247V、A247T、R270E、R280V、A286M、A286F、Q289V、R295C、E305M、Q306K、I313L、M333R、A336M、A336G、E337N、E337H、L351T、S364W、L365T、L365V、F372W和E382K。
在一些实施方案中,XylR蛋白变体在选自与SEQ ID NO:1的位置对应的位置121和363处还包含至少一个另外的突变。在一些实施方案中,在位置121和363处的至少一个另外的突变选自由以下组成的组:选自由R121C、R121S、R121T、R121G、R121H、R121V、R121M、T121Y、R121I、R121A、R121L、R121P、R121P、R121F、R121W和P363S组成的组的至少一个另外的突变。
在上述方面的一些实施方案中,与野生型XylR蛋白相比,XylR蛋白变体可以具有选自下组的两个或更多个氨基酸取代的组合,该组由以下组成:V83C、L89V、L89K、L112R、N120C、Y141R、Q145R、L146R、V147M、E150W、E150G、G154C、V155E、A247V、A247T、R270E、R280V、A286M、A286F、Q289V、R295C、E305M、Q306K、1313L、M333R、A336M、A336G、E337N、E337H、L351T、S364W、L365T、L365V、F372W和E382K。在一些实施方案中,两个或更多个氨基酸取代可以选自由以下组成的组:L89K和L112R;E150G、H88G和A246A;R280V和D305G;A286F和Q306K;Q289V和E305M;S364W和R295C。
在上述方面的一些实施方案中,XylR蛋白变体可以具有两个或更多个氨基酸取代的组合(其中至少一个取代选自由以下组成的组:V83C、H88G、L89V、L89K、L112R、N120C、Y141R、Q145R、L146R、V147M、E150W、E150G、G154C、V155E、A247V、A247T、R270E、R280V、A286M、A286F、Q289V、R295C、E305M、Q306K、I313L、M333R、A336M、A336G、E337N、E337H、L351T、S364W、L365T、L365V、F372W和E382K)以及至少另一个取代(其选自由以下组成的组:R121C、R121S、R121T、R121G、R121H、R121V、R121M、T121Y、R121I、R121A、R121L、R121P、R121P、R121F、R121W和P363S)。
在以上方面的一些实施方案中,XylR蛋白变体与SEQ ID NO:1的50、75、100、125、150、175、200、250、275、300或更多个连续氨基酸具有至少约60%、65%、70%、75%、80%、85%、90%、95%、97.5%、99%序列同一性并且具有XylR活性。在上述方面的一些实施方案中,XylR蛋白变体与SEQ ID NO:1的整个序列具有至少约60%、65%、70%、75%、80%、85%、90%、95%、97.5%、99%序列同一性长度为并具有XylR活性。
在一方面,本公开提供了与SEQ ID NO:1具有至少90%序列同一性的XylR蛋白变体,其中所述XylR蛋白变体在与SEQ ID NO:1的位置382对应的位置处具有至少一个突变,并且,其中所述XylR蛋白变体在与SEQ ID NO:1的位置121对应的位置处没有突变并且在与SEQ ID NO:1的363对应的位置处也没有突变。在实施方案中,XylR蛋白变体与SEQ ID NO:1具有95%序列同一性。在实施方案中,XylR蛋白变体与SEQ ID NO:1具有98%序列同一性。在一些实施方案中,在SEQ ID NO:1的位置382处的至少一个突变是E382K取代突变。
本公开的另一方面提供了重组宿主细胞,其包含与SEQ ID NO:1具有至少90%序列同一性并且在SEQ ID NO:1的位置382处具有至少一个突变的XylR蛋白变体,其中所述XylR蛋白变体在与SEQ ID NO:1的位置121对应的位置处没有突变并且在与SEQ ID NO:1的363对应的位置处也没有突变,其中当在木糖存在下培养细胞时,与表达SEQ ID NO:1的宿主细胞的生长相比,重组宿主细胞中XylR蛋白变体的表达赋予重组宿主细胞改善的生长。在实施方案中,改善的生长归因于木糖利用的增加。在实施方案中,改善的生长在葡萄糖存在下发生。在实施方案中,XylR蛋白变体与SEQ ID NO:1具有95%序列同一性。在实施方案中,XylR蛋白变体与SEQ ID NO:1具有98%序列同一性。在实施方案中,在SEQ ID NO:1的位置382处的至少一个突变是E382K取代突变。
本公开的另一方面提供了制备脂肪酸衍生物的方法,所述方法包括:在包含木糖的培养基中培养重组宿主细胞,所述重组宿主细胞包含至少一种异源脂肪酸衍生物生物合成酶和与SEQ ID NO:1具有至少90%序列同一性并且在SEQ ID NO:1的位置382处具有至少一个突变的XylR蛋白变体,其中所述XylR蛋白变体在与SEQ ID NO:1的位置121对应的位置处没有突变并且在与SEQ ID NO:1的363对应的位置处也没有突变。在实施方案中,XylR蛋白变体与SEQ ID NO:1具有95%序列同一性。在实施方案中,XylR蛋白变体与SEQ ID NO:1具有98%序列同一性。在实施方案中,在SEQ ID NO:1的位置382处具有至少一个突变的XylR蛋白变体具有E382K取代突变。在实施方案中,包含木糖的培养基还包含葡萄糖。在实施方案中,培养基衍生自纤维素生物质。在实施方案中,脂肪酸衍生物是C5-C24脂肪酸衍生物。在实施方案中,至少一种异源脂肪酸衍生物生物合成酶具有酯合酶活性(E.C.3.1.1.67)并且脂肪酸衍生物选自脂肪酸甲酯(FAME)和脂肪酸乙酯(FAEE)或其组合。
本公开的另一方面提供了与SEQ ID NO:1具有至少90%序列同一性的XylR蛋白变体,其中所述XylR蛋白变体在与SEQ ID NO:1的位置382对应的位置处具有至少一个突变并且SEQ ID NO:1的位置382的至少一个突变是E382K取代突变,并且,其中所述XylR蛋白变体在与SEQ ID NO:1的位置121对应的位置处没有突变并且在与SEQ ID NO:1的363对应的位置处也没有突变。
本公开的另一方面提供了制备选自脂肪酸甲酯(FAME)和脂肪酸乙酯(FAEE)或其组合的C5-C24脂肪酸衍生物的方法,所述方法包括:在包含木糖的培养基中培养:重组宿主细胞,其包含至少一种具有酯合酶活性(E.C.3.1.1.67)的异源脂肪酸衍生物生物合成酶和与SEQ ID NO:1具有至少90%序列同一性的XylR蛋白变体,其中所述XylR蛋白变体在SEQID NO:1的位置382处具有至少一个突变并且SEQ ID NO:1的位置382的至少一个突变是E382K取代突变,并且所述XylR蛋白变体在与SEQ ID NO:1的位置121对应的位置处没有突变并且在与SEQ ID NO:1的363对应的位置处也没有突变。在实施方案中,XylR蛋白变体与SEQ ID NO:1具有95%序列同一性。在实施方案中,XylR蛋白变体与SEQ ID NO:1具有98%序列同一性。在实施方案中,包含木糖的培养基还包含葡萄糖。
在一方面,本公开提供了XylR蛋白变体,其中所述XylR蛋白变体在与SEQ ID NO:1的选自以下的位置对应的位置处具有至少一个突变:SEQ ID NO:1的位置83、88、89、112、120、141、145、146、147、150、154、155、247、270、280、286、289、295、305、306、313、333、336、337、351、364、365、372、和382。
在一方面,本公开提供了包含XylR蛋白变体的重组宿主细胞,其中所述XylR蛋白变体在与SEQ ID NO:1的选自以下的位置对应的位置处具有至少一个突变:SEQ ID NO:1的位置83、88、89、112、120、141、145、146、147、150、154、155、247、270、280、286、289、295、305、306、313、333、336、337、351、364、365、372、和382。
在一个方面,本公开提供了用于在重组宿主细胞中增加木糖利用的方法,所述方法包括在包含木糖的培养基中培养包含XylR蛋白变体的重组宿主细胞,其中所述XylR蛋白变体在与SEQ ID NO:1的选自以下的位置对应的位置处具有至少一个突变:SEQ ID NO:1的位置83、88、89、112、120、141、145、146、147、150、154、155、247、270、280、286、289、295、305、306、313、333、336、337、351、364、365、372、和382,其中当在木糖存在下培养细胞时,与表达SEQ ID NO:1的宿主细胞的木糖利用相比,XylR蛋白变体的表达赋予重组宿主细胞改善的木糖利用。
在一些实施方案中,所述方法用于制备脂肪酸衍生物,所述方法包括在包含木糖的培养基中培养重组宿主细胞,所述重组宿主细胞还包含至少一种异源脂肪酸衍生物生物合成酶。
在一些实施方案中,脂肪酸衍生物是:脂肪酸酯并且其中至少一种异源脂肪酸衍生物生物合成酶具有酯合酶活性,并且任选地其中至少一种异源脂肪酸衍生物生物合成酶是硫酯酶;ω-羟基脂肪酸并且其中至少一种异源脂肪酸衍生物生物合成酶具有ω-羟化酶活性(EC 1.14.15.3);脂肪醛并且其中至少一种异源脂肪酸衍生物生物合成酶具有羧酸还原酶(CAR)活性;脂肪胺并且其中至少一种异源脂肪酸衍生物生物合成酶具有羧酸还原酶(CAR)活性,并且另一种异源脂肪酸衍生物生物合成酶具有羧酸还原酶(CAR)活性、氨基转移酶或胺脱氢酶活性;或脂肪醇乙酸酯并且其中至少一种异源脂肪酸衍生物生物合成酶具有羧酸还原酶(CAR)活性,并且另一种异源脂肪酸衍生物生物合成酶具有脂肪醇O-乙酰基转移酶活性(其将脂肪醇转化为脂肪醇乙酸酯)。
在一些实施方案中,所述方法用于制备C
在一些实施方案中,任何实施方案的XylR蛋白变体、重组宿主细胞或方法包含与SEQ ID NO:1具有90%序列同一性的XylR蛋白变体。
在一些实施方案中,任何实施方案的XylR蛋白变体、重组宿主细胞或方法包含与SEQ ID NO:1具有95%序列同一性的XylR蛋白变体。
在一些实施方案中,任何实施方案的XylR蛋白变体、重组宿主细胞或方法包含选自下组的至少一个突变,该组由以下组成:V83C、H88G、L89V、L89K、L112R、N120C、Y141R、Q145R、L146R、V147M、E150W、E150G、G154C、V155E、A247V、A247T、R270E、R280V、A286M、A286F、Q289V、R295C、D305M、Q306K、I313L、M333R、A336M、A336G、E337N、E337H、L351T、S364W、L365T、L365V、F372W和E382K。在一些实施方案中,XylR蛋白变体、重组宿主细胞或方法包含XylR蛋白变体,所述XylR蛋白变体具有多于一个取代突变并且是选自由以下组成的组的成员:具有取代突变L89K并且还包含L112R的XylR蛋白变体;具有取代突变E150G并且还包含H88G的XylR蛋白变体;具有取代突变R280V并且还包含D305G的XylR蛋白变体;具有取代突变A286F并且还包含Q306K的XylR蛋白变体;具有取代突变Q289V并且还包含D305M的XylR蛋白变体;以及具有取代突变S364W并且还包含R295C的XylR蛋白变体。
在一些实施方案中,任何实施方案的XylR蛋白变体、重组宿主细胞或方法还在与SEQ ID NO:1的选自位置121和363的位置对应的位置处包含至少一个另外的突变。在一些实施方案中,至少一个另外的突变选自由以下组成的组:R121C、R121S、R121T、R121G、R121H、R121V、R121M、T121Y、R121I、R121A、R121L、R121P、R121P、R121F、R121W和P363S。
在一些实施方案中,任何实施方案的XylR蛋白变体、重组宿主细胞或方法,当在木糖存在下培养细胞时,与表达SEQ ID NO:1的宿主细胞的生长相比,重组宿主细胞中XylR蛋白变体的表达赋予重组宿主细胞改善的生长。在一些实施方案中,XylR蛋白变体在SEQ IDNO:1的选自以下的位置处具有至少一个突变:SEQ ID NO:1的位置112、141、145、146、247、286、289、336、337、364和365,其中至少一个突变选自由以下组成的组:L112R、Y141R、Q145R、L146R、A247V、A286F、A286M、Q289V、A336G、E337H、S364W和L365V。
在一些实施方案中,任何实施方案的重组宿主细胞表达至少一种异源脂肪酸衍生物生物合成酶,其中XylR蛋白变体在选自SEQ ID NO:1的位置112、145、146、247、286、336、337和365的位置处具有至少一个突变,其中当在木糖存在下培养时,重组宿主细胞与除表达SEQ ID NO:1之外在其他方面相同的等基因宿主细胞相比,产生的脂肪酸种类(FAS)的量增加。在一些实施方案中,XylR蛋白变体在选自SEQ ID NO:1的位置112、145、146、247、286、336、337和365的位置处具有至少一个突变,其中至少一个突变选自由以下组成的组:L112R、Q145R、L146R、A247V、A286M、A336G、E337H和L365V。
在一些实施方案中,任何实施方案的方法包括XylR蛋白变体,所述XylR蛋白变体在选自SEQ ID NO:1的位置112、145、146、247、286、336、337和365的位置处具有至少一个突变,其中至少一个突变选自由以下组成的组:L112R、Q145R、L146R、A247V、A286M、A336G、E337H和L365V。
在一些实施方案中,任何实施方案的方法包括包含木糖、进一步包含葡萄糖的培养基。在一些实施方案中,培养基衍生自纤维素生物质。
在一方面,本公开提供了XylR蛋白变体,其中所述XylR蛋白变体在与SEQ ID NO:1的位置382对应的位置处具有至少一个突变。
在一个方面,本公开提供了重组宿主细胞,其包含在SEQ ID NO:1的位置382处具有至少一个突变的XylR蛋白变体,其中当在木糖存在下培养细胞时,与表达SEQ ID NO:1的宿主细胞的生长相比,重组宿主细胞中XylR蛋白变体的表达赋予重组宿主细胞改善的生长。
在一些实施方案中,任何实施方案的XylR蛋白变体、重组宿主细胞或方法包含XylR蛋白变体,所述XylR蛋白变体还在位置121或363处包含至少一个另外的突变。在一些实施方案中,至少一个另外的突变选自由以下组成的组:R121C、R121S、R121T、R121G、R121H、R121V、R121M、T121Y、R121I、R121A、R121L、R121P、R121P、R121F、R121W和P363S。
在一个方面,本公开提供了用于在重组宿主细胞中增加木糖利用的方法,所述方法包括在包含木糖的培养基中培养包含XylR蛋白变体的重组宿主细胞,其中所述XylR蛋白变体在与SEQ ID NO:1的位置对应的位置382处具有至少一个突变,其中当在木糖存在下培养细胞时,与表达SEQ ID NO:1的宿主细胞的木糖利用相比,XylR蛋白变体的表达赋予重组宿主细胞改善的木糖利用。
在一些实施方案中,所述方法用于制备脂肪酸衍生物,所述方法包括在包含木糖的培养基中培养重组宿主细胞,所述重组宿主细胞还包含至少一种异源脂肪酸衍生物生物合成酶。
在一些实施方案中,脂肪酸衍生物是:脂肪酸酯并且其中至少一种异源脂肪酸衍生物生物合成酶具有酯合酶活性,并且任选地其中至少一种异源脂肪酸衍生物生物合成酶是硫酯酶;ω-羟基脂肪酸并且其中至少一种异源脂肪酸衍生物生物合成酶具有ω-羟化酶活性(EC 1.14.15.3);脂肪醛并且其中至少一种异源脂肪酸衍生物生物合成酶具有羧酸还原酶(CAR)活性;脂肪胺并且其中至少一种异源脂肪酸衍生物生物合成酶具有羧酸还原酶(CAR)活性,并且另一种异源脂肪酸衍生物生物合成酶具有羧酸还原酶(CAR)活性、氨基转移酶或胺脱氢酶活性;或脂肪醇乙酸酯并且其中至少一种异源脂肪酸衍生物生物合成酶具有羧酸还原酶(CAR)活性,并且另一种异源脂肪酸衍生物生物合成酶具有脂肪醇O-乙酰基转移酶活性(其将脂肪醇转化为脂肪醇乙酸酯)。
在一些实施方案中,所述方法用于制备C
在一些实施方案中,任何实施方案的XylR蛋白变体、重组宿主细胞或方法在SEQID NO:1的位置382处包含至少一个突变,所述至少一个突变是E382K取代突变。
在一些实施方案中,任何实施方案的重组宿主细胞包含由于增加的木糖利用而改善的生长结果。在一些实施方案中,改善的生长在葡萄糖存在下发生。
在一些实施方案中,任何实施方案的方法包括包含木糖并且还包含葡萄糖的培养基。在一些实施方案中,培养基衍生自纤维素生物质。
通过下面的详细描述,本发明的其他特征、目的和优点将显而易见。
附图说明
图1是说明与野生型对照相比,E382K XylR突变体(xylR1)对葡萄糖和木糖的改善的共同利用的图。
图2是说明在木糖存在下的改善的生长的图,并且改善的生长是由于改善的木糖利用。
图3是说明在含有木糖的基础培养基中,与WT xylR生长相比,xylR突变体L146R、F372W、N120C、L365V、S364W、V83C、(Q289V、D305M)、Q145R、L89V和Y141R的生长的图。
图4是说明在含有木糖的基础培养基中,与WT xylR相比,xylR突变体(S364W、R295C)、(A286F、Q306K)、E337H、L112R、(R280V、D305G)、A286M和I313L的生长的图。
图5是说明在含有木糖的基础培养基中,与WT xylR相比,xylR突变体A247V、A336M、A336G、(L89K、L112R)、E150W、S130Y、(H88G、E150G、A246A*)和A310L的生长的图。*表示在核酸水平的沉默突变(GCG->GCA)。
图6是说明在含有木糖的基础培养基中,与WT xylR相比,xylR突变体(A247T,S352S*)和G154C的生长的图。*表示在核酸水平的沉默突变(TCG->TCC)。
图7是说明在含有木糖的基础培养基中,与WT xylR相比,xylR突变体L351T、M333R和V155E的生长的图。
图8是说明在含有木糖的基础培养基中,与WT xylR相比,xylR突变体L365T、R270E、E337N和V147M的生长的图。
图9说明了与在含有木糖的基础培养基中生长的WT xylR相比,XylR突变体L365V、Q145R、L146R和(Q289、D305M)对木糖的利用。
图10说明了与在含有木糖的基础培养基中生长的WT xylR相比,XylR突变体L365V、Q145R L146R和(Q289、D305M)在脂肪酸种类(FAS)生产方面的生产力。
图11说明了与在含有木糖的基础培养基中生长的WT xylR相比,XylR突变体F372W、N120C、V83C、S364W、L89V和Y141R对木糖的利用。
图12说明了与在含有木糖的基础培养基中生长的WT xylR相比,XylR突变体R372W、N120C、V83C、S364W、L89V和Y141R在脂肪酸种类(FAS)生产方面的生产力。
图13说明了与在含有木糖的基础培养基中生长的WT xylR相比,XylR突变体E337H、L112R和A286M对木糖的利用。
图14说明了与在含有木糖的基础培养基中生长的WT xylR相比,XylR突变体E337H、L112R和A286M在脂肪酸种类(FAS)生产方面的生产力。
图15说明了与在含有木糖的基础培养基中生长的WT xylR相比,XylR突变体(S364W、R295C)、(A286F、Q306K)、A247V、A336M和A336G对木糖的利用。
图16说明了与在含有木糖的基础培养基中生长的WT xylR相比,XylR突变体(S364W、R295C)、(A286F、Q306K)、A247V、A336M和A336G在脂肪酸种类(FAS)生产方面的生产力。
图17显示了代谢途径中木糖利用的示意性途径。
具体实施方式
定义
如本文和所附权利要求书中所使用,在描述要素的上下文中单数冠词,例如“一个”和“一种”和“所述”以及类似的参考将被解释为涵盖单数和复数二者,除非本文中另外指示或与上下文明显相矛盾。因此,例如,提及“宿主细胞”包括两个或更多个这样的宿主细胞,提及“核酸序列”包括一个或多个核酸序列,提及“酶”包括一种或多种酶,等等。
如本文所用,“约”被本领域普通技术人员所理解,并且在某种程度上可以取决于其使用的上下文而变化。如果所述术语的使用在本领域普通技术人员使用的术语“约”的上下文中是不明确的,则“约”将意味着高达特定术语的正负10%(包括所述特定术语)。因此,约100将表示90到110,并将包括100。
如本领域技术人员将理解,出于任何和所有目的,在此公开的所有范围也包括任何和所有可能的子范围及其子范围的组合。此外,如本领域技术人员将理解,范围包括每个独立成员。因此,例如,具有1-3个原子的组是指具有1、2或3个原子的组。类似地,具有1-5个原子的基团是指具有1、2、3、4或5个原子的基团,依此类推。
除非另有定义,否则本文使用的技术和科学术语通常具有与本领域普通技术人员所理解的相同的含义。特别地,本公开利用重组遗传学、有机化学、发酵和生物化学领域中的常规技术。公开分子生物学和遗传学通用术语的基本文献包括例如,Lackie,Dictionaryof Cell and Molecular Biology[细胞和分子生物学词典],Elsevier[爱思唯尔出版社](2013年第5版)。公开生物化学通用方法和术语的基本文献包括例如,LehningerPrinciples of Biochemistry Sixth edition[列宁格生物化学原理第六版],DavidL.Nelson和Michael M.Cox编辑.W.H.Freeman(2012)。公开发酵的通用方法和术语的基本文献包括例如,Principles of Fermentation Technology[发酵技术原理],第3版,PeterF Stanbury编辑,Allan Whitaker和Stephen J Hall.Butterworth-Heinemann(2016)。公开有机化学通用方法和术语的基本文献包括例如,Favre,Henri A.和Powell,WarrenH.Nomenclature of Organic Chemistry[有机化学命名法].IUPAC Recommendations andPreferred Name 2013[IUPAC建议和首选名称2013].英国剑桥:The Royal Society ofChemistry[皇家化学学会],2013;;Practical Synthetic Organic Chemistry:Reactions,Principles,and Techniques[实用的合成有机化学:反应,原理和技术],Stephane Caron编辑,John Wiley and Sons Inc.[约翰·威利父子公司](2011);OrganicChemistry[有机化学],第9版-Francis Carey和Robert Giuliano,McGraw Hill[麦格劳·希尔公司](2013)。
本说明书全文中的序列登录号是从以下获得的:美国国立卫生研究院维护的NCBI(国家生物技术信息中心)提供的数据库(在本文中称为“NCBI登录号”或替代地“GenBank登录号”或替代地也可以简称为“登录号”),以及瑞士生物信息学研究所提供的UniProt知识库(UniProtKB)和Swiss-Prot数据库(在本文中称为“UniProtKB登录号”)。
酶分类(EC)编号由国际生物化学与分子生物学联合会(IUBMB)命名委员会确定,其说明可在万维网上的IUBMB酶命名网站上找到。EC编号根据酶催化的反应对酶进行分类。例如,硫酯酶的酶活性被分类为E.C.3.1.2.1-3.1.2.27和3.1.2.-。具体分类基于不同硫酯酶对不同底物的活性。
例如,在一些示例性实施方案中,催化C6-C18烷基硫酯(例如酰基-酰基载体蛋白硫酯(酰基-ACP)和酰基-辅酶A硫酯(酰基-CoA))的硫酯键水解的硫酯酶被分类在E.C.3.1.2.-例如3.1.2.14下。硫酯酶存在于大多数原核生物中以及大多数植物和藻类的叶绿体中。在大多数原核生物中从一个物种到另一个物种,硫酯酶的功能都是保守的。因此,不同的微生物物种可以执行在E.C.3.1.2.-下分类的相同的硫酯酶的酶促活性。
如本文所用,术语“脂肪酸”是指具有式RCOOH的脂肪族羧酸,其中R是具有至少4个碳原子,典型地约4至约28个碳原子的脂肪族基团。脂肪族R基团可以是饱和的或不饱和的、支链的或非支链的。不饱和的“脂肪酸”可以是单不饱和的或多不饱和的。
如本文所用的“脂肪酸(fatty acid或fatty acids)”是在细胞内通过脂肪酸生物合成的过程,通过脂肪酸β-氧化的逆转而产生的,或者它们可以被供给到细胞中。如本领域众所周知的,脂肪酸生物合成通常是丙二酰-CoA依赖性的酰基-ACP合成,而β-氧化的逆转产生了酰基-CoA。供给至细胞的脂肪酸被转化为酰基-CoA和酰基-ACP。
脂肪酸的生物合成和降解发生在所有生命形式中,包括原核生物、单细胞真核生物、高级真核生物和古细菌。本文公开的工具和方法可用于生产脂肪酸衍生物,所述脂肪酸衍生物是通过任何自然产生烷基硫酯的生物中的脂肪酸合成、降解或供给中的一种或多种而衍生的。
如本文所用的术语“脂肪酸衍生物”是指衍生自脂肪酸的产物。因此,“脂肪酸衍生物”包括如上定义的“脂肪酸”。通常,“脂肪酸衍生物”包括丙二酰-CoA衍生的化合物,包括酰基-ACP或酰基-ACP衍生物。“脂肪酸衍生物”还包括丙二酰-CoA衍生的化合物,例如酰基-CoA或酰基-CoA衍生物。示例性脂肪酸衍生物包括脂肪酸、脂肪酸酯(蜡、脂肪酸酯、脂肪酸甲酯(FAME)、脂肪酸乙酯(FAEE))、脂肪醇乙酸酯(FACE)、脂肪胺、脂肪醛、脂肪醇、烃(例如烷烃、烯烃等)、酮、末端烯烃、内烯烃、3-羟基脂肪酸衍生物、双官能脂肪酸衍生物(例如ω-羟基脂肪酸、1,3脂肪二醇、α,ω-二醇、α,ω-3-羟基三醇、ω-羟基FAME、ω-OHFAEE等)和不饱和脂肪酸衍生物,包括上述脂肪酸衍生物中每种的不饱和化合物。
如本文所用的表述“脂肪酸衍生物组合物”是指脂肪酸衍生物的组合物,例如由生物体产生的脂肪酸组合物。“脂肪酸衍生物组合物”可包含单一脂肪酸衍生物种类或可包含脂肪酸衍生物种类的混合物。在一些示例性实施方案中,脂肪酸衍生物的混合物包括一种以上类型的脂肪酸衍生物产物(例如,脂肪酸、脂肪酸酯、脂肪醇、脂肪醇乙酸酯、脂肪醛、脂肪胺、双官能脂肪酸衍生物等)。在其他示例性实施方案中,脂肪酸衍生物的混合物包括具有不同链长、饱和度和/或支化特性的脂肪酸酯(或另一种脂肪酸衍生物)的混合物。在其他示例性实施方案中,脂肪酸衍生物的混合物主要包含一种类型的脂肪酸衍生物。在仍其他示例性实施方案中,脂肪酸衍生物的混合物包含一种以上类型的脂肪酸衍生物产物(例如具有不同链长、饱和度和/或支化特性的脂肪酸衍生物)的混合物。在仍其他示例性实施方案中,脂肪酸衍生物的混合物包含脂肪酯和β-羟基酯的混合物。在仍其他示例性实施方案中,脂肪酸衍生物组合物包含脂肪醇和脂肪醛的混合物。在仍其他示例性实施方案中,脂肪酸衍生物组合物包含FAME和/或FAEE的混合物。在仍其他示例性实施方案中,脂肪酸衍生物组合物包含脂肪醇乙酸酯(FACE)的混合物。
如本文所用,术语“核苷酸”具有其本领域已知的惯常含义。除提及自然存在的核糖核苷酸或脱氧核糖核苷酸单体外,术语“核苷酸”还涵盖核苷酸类似物和经修饰的核苷酸,例如氨基修饰的核苷酸。另外,“核苷酸”包括非自然存在的类似物结构。因此,例如,每个含有碱基的肽核酸的单独单元在本文中可以称为核苷酸。
术语“多核苷酸”是指典型地处于磷酸二酯键连的核糖核苷酸(RNA)或脱氧核糖核苷酸(DNA)的聚合物,其可以是单链或双链的并且可以包含天然和/或非天然和/或改变的核苷酸。术语“多核苷酸”、“核酸序列”和“核苷酸序列”在本文可互换使用,是指RNA或DNA的任何长度的核苷酸的聚合形式。这些术语是指分子的一级结构,并且因此包括单链、双链、三链、四链、部分双链、支链、发夹、环状、呈挂锁构象等等的多核苷酸等。所述术语等价地包括由核苷酸类似物和经修饰的多核苷酸(例如但不限于甲基化和/或加帽的多核苷酸)制成的RNA或DNA的类似物。多核苷酸可以是任何形式,包括但不限于质粒、病毒、染色体、EST、cDNA、mRNA和rRNA,并且可以通过任何已知方法来制备,包括合成、重组、离体产生或其组合,以及利用本领域已知的任何纯化方法
如本文所用,术语“多肽”和“蛋白质”可互换使用,是指长度典型地为12个或更多个氨基酸的氨基酸残基聚合物。长度小于12个氨基酸的多肽在本文中称为“肽”。所述术语适用于其中一个或多个氨基酸残基是相应的自然存在的氨基酸的人工化学模拟物的氨基酸聚合物,并且适用于包含自然存在的氨基酸的氨基酸聚合物。术语“重组多肽”是指通过重组技术产生的多肽,例如,其中将编码表达的蛋白质的DNA或RNA插入合适的表达载体中,所述表达载体又用于转化宿主细胞以产生多肽。在一些实施方案中,将编码表达的肽、多肽或蛋白质的DNA或RNA通过同源重组或本领域公知的其他手段插入宿主染色体,并因此用于转化宿主细胞以产生肽或多肽。类似地,术语“重组多核苷酸”或“重组核酸”或“重组DNA”是通过本领域技术人员公知的重组技术产生的(参见例如以下中描述的方法:Sambrook等人,Molecular Cloning--A Laboratory Manual[分子克隆-实验室手册],Cold SpringHarbor Press[冷泉港出版社]第4版(冷泉港纽约州2012)或Current Protocols inMolecular Biology[分子生物学最新方案]第1-3卷,John Wiley&Sons,Inc.[约翰·威利父子公司](1994-1998)和补编1-115(1987-2016))。
术语“氨基酸”是指自然存在的和合成的氨基酸,以及以类似于自然存在的氨基酸的方式起作用的氨基酸类似物和氨基酸模拟物。自然存在的氨基酸是由遗传密码编码的那些氨基酸,以及后来被修饰的那些氨基酸,例如羟脯氨酸、γ-羧基谷氨酸和O-磷酸丝氨酸。氨基酸类似物是指与自然存在的氨基酸具有相同基本化学结构(即与氢结合的α碳、羧基、氨基和R基团)的化合物,例如高丝氨酸、正亮氨酸、甲硫氨酸亚砜、甲基锍甲硫氨酸。此类类似物具有经修饰的R基团(例如,正亮氨酸)或经修饰的肽主链,但是保留了与自然存在的氨基酸相同的基本化学结构。自然编码的氨基酸是20种常见氨基酸(丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酰胺、谷氨酸、甘氨酸、组氨酸,异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸和缬氨酸)以及吡咯赖氨酸和硒代半胱氨酸。在一些示例性实施方案中,下表1中列出的单字母代码用于指代20种常见的自然存在的氨基酸的特定成员。单字母氨基酸代码在本领域中是公知的(参见例如,列宁格(Lehninger),同上)。
表1
当提及两个核苷酸或多肽序列时,通过在比较窗口中比较两个最佳对齐的序列来确定两个序列之间的“序列同一性百分比”,其中与用于两个序列的最佳对齐的参考序列(其不包括添加或缺失)相比,比较窗口中的多核苷酸序列的部分可包含添加或缺失(即空位)。可以通过以下方法计算“序列同一性百分比”:确定在这两个序列中出现相同核酸碱基或氨基酸残基的位置的数目以产生匹配位置数,将该匹配位置数除以该比较窗口中的位置总数,并将结果乘以100,从而得到序列同一性百分比。
因此,在两个或更多个核酸序列或肽或多肽的上下文中,表述“同一性百分比”或等同地“序列同一性百分比”是指两个或更多个相同或具有指定百分比的相同核苷酸或氨基酸(例如,当在比较窗口或指定区域上针对最大对应进行比较并对齐时,在指定区域上约50%同一性,优选55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高同一性)的序列或子序列,例如使用带有默认参数的BLAST或BLAST2.0序列比较算法(参见例如Altschul等人(1990)J.Mol.Biol.[分子生物学杂志]215(3):403-410)和/或ncbi.nlm.nih.gov/BLAST/上的NCBI网站)或通过手动对齐和目视检查进行测量的。也可以使用例如已集成到GCG软件包中的GAP程序中的Needleman和Wunsch算法,使用Blossum 62矩阵或PAM250矩阵,以及16、14、12、10、8、6或4的空位权重,1、2、3、4、5或6的长度权重,来确定两个核酸或氨基酸序列之间的序列同一性百分比(Needleman和Wunsch(1970)J.Mol.Biol.[分子生物学杂志]48:444-453)。也可以使用GCG软件包中的GAP程序,使用NWSgapdna.CMP矩阵,以及40、50、60、70或80的空位权重和1、2、3、4、5或6的长度权重来确定两个核苷酸序列之间的序列同一性百分比。本领域普通技术人员可以执行初始序列同一性计算并相应地调整算法参数。如果从业者不确定应使用哪些参数确定分子是否在权利要求的同源性限制之内,则可以使用一组参数,其是空位罚分为12、空位延伸罚分为4、移码空位罚分为5的Blossum 62评分矩阵。序列比对的另外方法在生物技术领域中是已知的(参见例如,Rosenberg(2005)BMC Bioinformatics[BMC生物信息学]6:278;Altschul等人(2005)FEBSJ.[FEBS杂志]272(20):5101-5109)。
当如上所述对两个或多个核酸或氨基酸序列进行对齐和分析并且发现它们在指定区域内具有约50%的同一性,优选地为55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高的同一性时,所述两个或多个核酸或氨基酸序列被称为“基本相同”。如果两个序列的核苷酸或氨基酸残基的序列在如上所述进行最大对应对齐时分别相同,则两个核酸序列或多肽序列被称为“相同”。该定义也可以指或可以用于对测试序列的补充。典型地在长度至少约25个氨基酸或核苷酸的区域上,或更优选在长度为50-100个氨基酸或核苷酸的区域上,或在给定序列的整个长度上,计算同一性。
表述“在低严格性、中严格性、高严格性或非常高严格性条件下杂交”描述了杂交和洗涤的条件。用于进行杂交反应的指导可见于例如Current Protocols in MolecularBiology[分子生物学最新方案],约翰·威利父子公司,纽约州(1989),6.3.1-6.3.6。在引用的参考文献中描述了水性和非水性方法,并且可以使用任一种方法。本文所指的具体杂交条件如下:(1)低严格性杂交条件--6X氯化钠/柠檬酸钠(SSC),在45℃,然后在0.2X SSC、0.1%SDS中至少50℃下洗涤两次(对于低严格性条件,洗涤的温度可以增加至55℃);(2)中严格性杂交条件--6X SSC,在约45℃,然后在0.2X SSC、0.1%SDS中60℃下洗涤一次或多次;(3)高严格性杂交条件--6X SSC,在约45℃,然后在0.2.X SSC、0.1%SDS中65℃下洗涤一次或多次;以及(4)非常高严格性杂交条件--0.5M磷酸钠、7%SDS,在65℃,然后在0.2XSSC、1%SDS中65℃下洗涤一次或多次。除非另有说明,否则非常高严格性条件(4)是优选条件。
如本文所用,术语“内源”是指从细胞内产生的物质,例如,核酸,蛋白质等。因此,“内源”多核苷酸或多肽是指细胞产生的多核苷酸或多肽。在一些示例性实施方案中,“内源”多肽或多核苷酸由亲代细胞(或宿主细胞)的基因组编码。在其他示例性实施方案中,“内源”多肽或多核苷酸由亲代细胞(或宿主细胞)携带的自主复制质粒编码。在一些示例性实施方案中,“内源”基因是当最初从自然界中分离细胞时存在于细胞中的基因,即,所述基因是“细胞天然的”。在其他示例性实施方案中,“内源”基因已经通过重组技术例如通过改变控制序列和编码序列的关系而被改变。因此,在一些示例性实施方案中,“异源”基因对于宿主细胞可以是“内源”的。
相反,“外源”多核苷酸或多肽或其他物质(例如脂肪酸衍生物、小分子化合物等)是指亲代细胞未产生并因此从细胞外部添加到细胞、细胞培养物或测定中的多核苷酸或多肽或其他物质。
如本文所用,术语“天然的”是指与自然界分离的核酸、蛋白质、多肽或其片段的形式,或者是不意在引入突变的核酸、蛋白质、多肽或其片段的形式。
如本文所用,术语多肽的“片段”是指全长多肽或蛋白质的较短部分,其大小范围从两个氨基酸残基到整个氨基酸序列减去一个氨基酸残基。在本公开的某些实施方案中,片段是指多肽或蛋白质的结构域(例如,底物结合结构域或催化结构域)的整个氨基酸序列。
术语“诱变”是指以稳定的方式改变生物体的遗传信息以产生“突变体”或“变体”的过程。蛋白编码核酸序列诱变以产生突变核酸序列,其产生突变蛋白。诱变还指非编码核酸序列的变化。在一些示例性实施方案中,非编码核酸序列中的突变导致经修饰的蛋白质活性。
因此,如本文所用,“突变”是指相对于对照核酸或氨基酸序列,基因的核酸位置或多肽或蛋白质的氨基酸位置(残基)的变化。在多核苷酸的上下文中,术语“突变”是指对多核苷酸序列的修饰,导致所述多核苷酸序列相对于对照或参考多核苷酸序列发生改变。在一些示例性实施方案中,突变多核苷酸序列是指不改变编码的氨基酸序列的改变,例如出于表达目的优化密码子。在其他示例性实施方案中,多核苷酸序列中的突变以导致对编码的氨基酸序列进行修饰的方式修饰密码子。
在蛋白质的上下文中,术语“突变”或“突变的”是指对氨基酸序列的修饰,导致蛋白质的序列相对于对照或参考蛋白质序列发生改变。突变可以指一个氨基酸被另一个氨基酸取代,或一个或多个氨基酸残基的插入或缺失。在一些示例性实施方案中,“突变”是用非天然氨基酸或化学修饰的氨基酸残基替代氨基酸。在其他示例性实施方案中,“突变”是序列或子序列中相对于前体序列的截短(例如,缺失或中断)或通过从一端或另一端的缺失引起的序列缩短。在其他示例性实施方案中,突变是蛋白质内或蛋白质的任一末端处的氨基酸或子序列(例如,区段中的两个或更多个氨基酸,其插入到前体蛋白序列中的两个连续氨基酸之间)的添加,由此增加蛋白质的长度(或延长)。可以通过本领域普通技术人员已知的认可数量的方法将突变引入多核苷酸中,包括例如随机诱变、位点特异性诱变、寡核苷酸定向诱变、基因改组、定向进化技术、组合诱变、化学合成、位点饱和诱变等。
如本文所用,术语“突变体”或等同地“变体”是指包含至少一个突变的多核苷酸序列或多肽序列。因此,与对照XylR酶相比,工程改造的XylR变体或XylR(具有改善的利用木糖的能力以及改善的共利用葡萄糖和木糖的能力用于生产例如脂肪酸和脂肪酸衍生物)在其多肽序列中将至少具有一个突变。
如本文所用的表述“具有改善的木糖利用或改善的葡萄糖和木糖的共利用的XylR突变体”或“具有改善的木糖利用和/或改善的葡萄糖和木糖共利用的XylR突变体”或等同地“具有改善的木糖利用和/或改善的葡萄糖和木糖共利用的XylR蛋白变体”指大肠杆菌木糖阻遏物(XylR)的经工程改造的多肽/蛋白变体,其具有改善的利用木糖的能力和/或具有改善的共利用葡萄糖和木糖的能力,如例如通过以下所测量的:通过光密度(OD600)读数测量的用木糖生长的速率改善,以及经由如以下实施例1和2中所公开对利用的糖总量的测量,在生物反应器中葡萄糖和木糖的改善的共消耗。因此,“具有改善的木糖利用和/或改善的葡萄糖和木糖共利用的XylR突变体”可显示出改善的木糖利用、改善的葡萄糖和木糖共利用或可同时具有两种特性。
“具有改善的木糖利用和/或改善的葡萄糖和木糖的共利用的XylR突变体”或等同地“具有改善的木糖利用和/或改善的葡萄糖和木糖的共利用的XylR蛋白变体”是与SEQ IDNO:1具有至少90%序列同一性的蛋白,其在对应于SEQ ID NO:1的位置382的位置处具有至少一个突变并且其在对应于SEQ ID NO:1的位置121的位置处没有突变且在对应于SEQ IDNO:1的位置363的位置处没有突变。在实施方案中,SEQ ID NO:1的位置382处的突变是E382K取代突变。在实施方案中,“具有改善的木糖利用和/或改善的葡萄糖和木糖共利用的XylR蛋白变体”具有根据SEQ ID NO:3的氨基酸序列。在实施方案中,“具有改善的木糖利用和/或改善的葡萄糖和木糖共利用的XylR蛋白变体”是与SEQ ID NO:1具有至少91%序列同一性的蛋白,其在对应于SEQ ID NO:1的位置382的位置处具有至少一个突变并且其在对应于SEQ ID NO:1的位置121的位置处没有突变且在对应于SEQ ID NO:1的位置363的位置处没有突变。在其他实施方案中,“具有改善的木糖利用和/或改善的葡萄糖和木糖共利用的XylR蛋白变体”是与SEQ ID NO:1具有至少92%序列同一性、至少93%序列同一性、至少94%序列同一性、至少95%序列同一性、至少96%序列同一性、至少97%序列同一性、至少98%序列同一性、至少99%序列同一性的蛋白,其在对应于SEQ ID NO:1的位置382的位置处具有至少一个突变并且其在对应于SEQ ID NO:1的位置121的位置处没有突变且在对应于SEQ ID NO:1的位置363的位置处没有突变。在实施方案中,可以将具有改善的木糖利用和/或改善的葡萄糖和木糖共利用的XylR蛋白变体引入重组宿主细胞中,以使用例如木质纤维素生物质作为原料有效地产生脂肪酸和脂肪酸衍生物。
如本文所用的术语“基因”是指编码RNA产物或蛋白产物的核酸序列例如,DNA序列,以及影响RNA或蛋白产物表达的可操作地连接的核酸序列(例如,表达控制序列,例如,启动子、增强子、核糖体结合位点、翻译控制序列等)。术语“基因产物”是指从特定基因表达的RNA例如,tRNA、mRNA和/或蛋白质。
如本文所用的关于基因的术语“表达”或“表达的”是指基因的一种或多种转录产物和/或翻译产物的产生。在示例性实施方案中,基于细胞内存在的相应mRNA的量或由细胞产生的DNA编码的蛋白的量来确定细胞中DNA分子的表达水平。术语“表达的基因”是指转录成信使RNA(mRNA)然后再翻译成蛋白的基因,以及转录成其他类型RNA的基因,例如转移RNA(tRNA)、核糖体RNA(rRNA)和调节RNA,它们不翻译成蛋白。
核酸分子在细胞或无细胞系统中的表达水平受“表达控制序列”或等同地“调节序列”的影响。“表达控制序列”或“调节序列”是本领域已知的,并且包括例如启动子、增强子、聚腺苷酸化信号、转录终止子、影响RNA稳定性的核苷酸序列、内部核糖体进入位点(IRES)等,其提供多核苷酸序列在宿主细胞中的表达。在示例性实施方案中,“表达控制序列”与参与转录的细胞蛋白特异性相互作用(参见,例如,Maniatis等人,Science[科学],236:1237-1245(1987);Goeddel,Gene Expression Technology:Methods in Enzymology[基因表达技术:酶学方法],第185卷,Academic Press[学术出版社],圣地亚哥,加利福尼亚州(1990))。在示例性方法中,表达控制序列与多核苷酸序列可操作地连接。“可操作地连接”是指多核苷酸序列和一个或多个表达控制序列功能性连接,以便当适当的分子(例如转录激活蛋白)接触所述一个或多个表达控制序列时允许所述多核苷酸序列表达。在示例性实施方案中,就转录和翻译的方向而言,可操作地连接的启动子位于所选多核苷酸序列的上游。在一些示例性实施方案中,可操作地连接的增强子可以位于所选多核苷酸的上游、内部或下游。
如本文所用,蛋白/多肽(例如工程改造的XylR变体)的“经修饰的活性”或“改变的活性水平”是指与合适的对照蛋白(例如相应的亲本蛋白或相应的野生型蛋白)的特征相比,所述蛋白/多肽活性在一个或多个特征方面的不同。因此,在示例性实施方案中,具有“经修饰的活性”的蛋白与相应的对照蛋白相比的活性差异通过以下来确定:测量重组宿主细胞中经修饰的蛋白的活性,并将其与在其他方面等基因的宿主细胞中的相应对照蛋白的相同活性的测量值进行比较。经修饰的活性可以是以下的结果:例如蛋白与核酸的结合亲和力变化;蛋白结构的变化(例如一级结构的变化,例如比如,蛋白的核苷酸编码序列的变化,这导致底物特异性、DNA结合方面的变化,观察到的动力学参数的变化,溶解度的变化,等);蛋白稳定性的变化(例如,蛋白降解的增加或减少)等。在一些示例性实施方案中,具有“经修饰的活性”的多肽是本文公开的突变体或变体XylR酶。
在示例性实施方案中,本文公开的多肽具有“经修饰的活性”,即例如“改善的活性水平”。如本文所用的表达“改善的活性水平”是指与相同条件下相应对照多肽的生化和/或生物学功能水平相比,具有更高水平的生化或生物学功能(例如,DNA结合或酶促活性)的多肽。活性改善的程度可以是约10%或更多、约20%或更多、约50%或更多、约75%或更多、约100%或更多、约200%或更多、约500%或更多、约1000%或更高、或其中的任何范围。
因此,“改善的活性”可以指多肽的改善的催化活性或改善的催化效率,其中催化效率是指例如这种多肽的酶催化的反应的反应速率的增加。催化活性/催化效率可以例如通过改善反应的一个或多个动力学参数(测量的或计算的)来改善,例如Vmax(反应可以进行的最大速率)、Km(迈克尔斯常数)、kcat(每个酶分子每秒周转的底物分子数量),等等,或此类参数之间的任何比率,例如kcat/Km(酶效率的量度)。因此,可以以多种方式来测量多肽的“改善的催化活性”或“改善的催化效率”。例如,“改善的活性”可以通过以下来测量:滴度(在特定条件下的浓度:g/L,或mg/L,或g/Kg)的增加,生长速度的改善;特定底物例如木糖的改善的利用;组成的变化(在某些条件下,例如在木糖存在下产生的特定脂肪酸种类/总脂肪酸衍生物(FAS)的量)。
“对照”样品,例如“对照”核苷酸序列、“对照”多肽序列、“对照”细胞等或值是指用作参考的样品,通常是已知的参考,用于与测试样品进行比较。例如,在一个示例性实施方案中,测试样品包含“用于改善的木糖利用或改善的葡萄糖和木糖共利用的XylR突变体”,而对照样品包含相应的或指定的未修饰的/非变体的XylR蛋白/酶(例如,SEQ ID NO:1)。技术人员将认识到,可以将对照设计为用于评估任意数量的参数。此外,本领域技术人员将理解哪些对照在给定情况下是有价值的,并且将能够基于与对照值的比较来分析数据。
如本文所用的术语“重组”是指经遗传修饰的多核苷酸、多肽、细胞、组织或生物。术语“重组”同等地适用于第一代经遗传修饰的多核苷酸、多肽、细胞、组织或生物,以及携带遗传修饰的经遗传修饰的多核苷酸、多肽、细胞、组织或生物的后代。
当关于细胞使用时,术语“重组”表示细胞已通过引入异源核酸或蛋白而被修饰,或已通过改变天然核酸或蛋白而被修饰,或该细胞是从如此修饰的细胞中衍生的并且衍生的细胞包含修饰。因此,例如,“重组细胞”或等同地“重组宿主细胞”可以被修饰以表达在细胞的天然(非重组)形式中找不到的基因,或者可以被修饰以异常表达天然基因,例如天然基因可以过表达、表达不足或根本不表达。在示例性实施方案中,“重组细胞”或“重组宿主细胞”被工程改造以表达“用于改善的木糖利用或改善的葡萄糖和木糖共利用的XylR突变体”。重组细胞可以衍生自微生物,例如细菌、病毒或真菌。另外,重组细胞可以衍生自植物或动物细胞。在示例性实施方案中,“重组宿主细胞”或“重组细胞”用于产生一种或多种脂肪酸衍生物,包括但不限于脂肪酸、脂肪酯(例如蜡、脂肪酸酯、脂肪酯、脂肪酸甲酯(FAME)、脂肪酸乙酯(FAEE))、脂肪醇乙酸酯(FACE),脂肪醇、脂肪醛、烃、脂肪胺、末端烯烃、内烯烃、酮、双官能脂肪酸衍生物(例如ω-羟基脂肪酸、ω-羟基二醇、ω-羟基FAME、ω-羟基FAEE)等。因此,在一些示例性实施方案中,“重组宿主细胞”是“生产宿主”或等同地“生产宿主细胞”。在一些示例性实施方案中,重组细胞包括一个或多个多核苷酸,每个多核苷酸编码具有脂肪酸生物合成酶活性的多肽,其中当在碳源存在下在有效表达多核苷酸的条件下培养时,重组细胞产生脂肪酸衍生物组合物。
当关于多核苷酸使用时,术语“重组”或等同地“异源”表示多核苷酸已经通过与该多核苷酸的天然形式或自然存在形式进行比较而被修饰,或者已经通过与该核苷酸的自然存在的变体进行比较而被修饰。在一个示例性实施方案中,重组多核苷酸(或重组多核苷酸的拷贝或互补序列)是已经被人为操纵以不同于其自然存在形式的重组多核苷酸。因此,在一个示例性实施方案中,重组多核苷酸是天然基因的突变形式或天然基因的自然存在的变体的突变形式,其中所述突变是通过有意的人为操作进行的,例如通过使用诱变寡核苷酸的饱和诱变进行,通过使用UV辐射或诱变化学品等进行。相对于基因的天然形式或自然存在的变体形式,这样的重组多核苷酸可以包含一个或多个点突变、取代、缺失和/或插入。类似地,包含与第二多核苷酸(例如,编码序列)可操作连接的启动子的多核苷酸是“重组”多核苷酸。因此,重组多核苷酸包含自然界中未发现的多核苷酸组合。重组蛋白(同上讨论)典型地是从重组多核苷酸表达的蛋白,并且重组细胞、组织和生物是包含重组序列(多核苷酸和/或多肽)的那些。
如本文所用,术语“微生物”通常是指微观生物。微生物可以是原核的或真核的。示例性的原核微生物包括例如,细菌、古细菌、蓝细菌等。示例性的细菌是大肠杆菌。示例性的真核微生物包括例如酵母、原生动物、藻类等。在示例性实施方案中,“重组微生物”是已被遗传改变并因此表达或涵盖异源核酸序列和/或异源蛋白的微生物。
“生产宿主”或等同地“生产宿主细胞”是用于生产产物的细胞。如本文公开的,“生产宿主”典型地被修饰以表达或过表达所选基因,或具有所选基因的减弱的表达。因此,“生产宿主”或“生产宿主细胞”是“重组宿主”或等同地“重组宿主细胞”。生产宿主的非限制性实例包括植物、动物、人、细菌、酵母、蓝细菌、藻类和/或丝状真菌细胞。示例性的“生产宿主”是重组大肠杆菌细胞。
如本文所用,“酰基-ACP”是指在酰基链的羰基碳与酰基载体蛋白(ACP)的磷酸泛酰巯基乙胺部分的巯基基团之间形成的酰基硫酯。在一些实施方案中,酰基-ACP是完全饱和的酰基-ACP的合成中的中间体。在其他示例性实施方案中,酰基-ACP是不饱和酰基-ACP的合成中的中间体。在一些示例性实施方案中,酰基-ACP的酰基基团的碳链具有5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27或28个碳。在其他示例性实施方案中,酰基-ACP的酰基基团的碳链具有12个碳、14个碳或16个碳。在其他示例性实施方案中,酰基-ACP的酰基基团的碳链的长度是8个碳。在其他示例性实施方案中,酰基-ACP的酰基基团的碳链的长度是10个碳。这些酰基-ACP中的每一个都是酶的底物,所述酶是例如将酰基-ACP转化为脂肪酸衍生物的酯合酶、硫酯酶等。
如本文所用,表述“脂肪酸衍生物生物合成途径”是指产生脂肪酸衍生物的生化途径。因此,包含“脂肪酸衍生物生物合成途径”的酶在本文中被称为“脂肪酸衍生物生物合成多肽”或等同地“脂肪酸衍生物酶”。因此,例如,硫酯酶(例如,具有硫酯酶活性的酶EC3.1.2.14)是“脂肪酸衍生物生物合成肽”或等同地“脂肪酸衍生物酶”。因此,术语“脂肪酸衍生物酶”或等同地“脂肪酸衍生物生物合成多肽”共同地和单独地是指可以表达或过表达以产生脂肪酸衍生物的酶。“脂肪酸衍生物酶”或等同地“脂肪酸衍生物生物合成多肽”的非限制性实例包括例如脂肪酸合成酶、硫酯酶、酰基-CoA合成酶、酰基-CoA还原酶、酰基ACP还原酶、醇脱氢酶、醇O-酰基转移酶、形成脂肪醇的酰基CoA还原酶、脂肪酸脱羧酶、脂肪醛脱羰基酶和/或氧化去甲酰酶、羧酸还原酶、脂肪醇O-乙酰基转移酶、酯合酶等。“脂肪酸衍生物酶”或等同地“脂肪酸衍生物生物合成多肽”将底物转化为脂肪酸衍生物。在示例性实施方案中,用于脂肪酸衍生物酶的合适底物可以是第一脂肪酸衍生物,其被脂肪酸衍生物酶转化成不同的第二脂肪酸衍生物。
如本文所用,术语“培养物”是指包含活细胞的液体培养基。在一个实施方案中,培养物包含在受控条件下在预定培养基中生长的细胞,例如,在包含所选碳源和氮的液体培养基中生长的重组宿主细胞的培养物。“进行培养”或“培养”是指在合适的条件下在液体或固体培养基中培养宿主细胞(例如重组宿主细胞)群体。在某些实施方案中,培养是指底物生物转化为终产物。培养基是众所周知的,并且这种培养基的各个组分可从商业来源获得,例如Difco
如本文所用,术语“滴度”是指每单位体积宿主细胞培养物产生的脂肪酸衍生物的量。滴度可以指特定脂肪酸衍生物的量或不同链长或不同官能度的脂肪酸衍生物的组合(比如例如,由给定的重组宿主细胞培养物产生的饱和的和不饱和的脂肪酸衍生物的混合物)的量或脂肪酸衍生物组合物的量。
如本文所用的表述“商业滴度(commercial titers或commercial titer)”是指每单位体积宿主细胞培养物产生的脂肪酸衍生物的量,其使得商业生产在经济上可行。典型地,商业滴度在约10g/L(或等同地10g/Kg)至约200g/L或更高的范围内。因此,商业滴度为是10g/L或更高、20g/L或更高、30g/L或更高、40g/L或更高、50g/L或更高、60g/L或更高、70g/L或更高、80g/L或更高、90g/L或更高、100g/L或更高、110g/L或更高、120g/L或更高、130g/L或更高、140g/L或更高、150g/L或更高、160g/L或更高、170g/L或更高、180g/L或更高、190g/L或更高、200g/L或更高。
如本文所用,“脂肪酸衍生物的产率”是指输入碳源在宿主细胞中转化成产物的效率。因此,表述“脂肪酸衍生物的产率”是指从给定量的碳底物产生的产物的量。产率百分比是理论产率的百分比(在理想条件下合成的产物,无碳或能量损失)。因此,产率百分比=(产物质量/理论产率质量)X100。产率可以指特定的脂肪酸衍生物或脂肪酸衍生物的组合。
如本文所用,术语“生产力”是指每单位时间每单位体积宿主细胞培养物产生的脂肪酸衍生物的量。生产力可以针对由给定宿主细胞培养物产生的一种特定脂肪酸衍生物、或多种脂肪酸衍生物或一种或多种其他化合物的组合。因此,在示例性实施方案中,在重组宿主细胞例如大肠杆菌中具有改善的木糖利用和/或改善的葡萄糖和木糖共利用的XylR突变体的表达导致与表达相应的对照XylR酶或其他合适对照的重组宿主细胞相比,脂肪酸衍生物和/或其他化合物的生产力提高。如本文所用,术语“总脂肪种类”和“总脂肪酸产物”和“总脂肪酸衍生物”在本文中可以关于宿主细胞(例如,XylR突变体具有改善的木糖利用和/或改善的葡萄糖和木糖共利用的宿主细胞)产生的脂肪酸衍生物的量(滴度)互换使用。总脂肪种类等可以通过带有火焰离子化检测器的气相色谱法(GC-FID)进行评估。当提及总脂肪酸衍生物分析时,相同的术语可以用于表示例如总脂肪酯、总脂肪醇、总脂肪醛、总脂肪胺和总游离脂肪酸。特别地,相同的术语可以用于表示总脂肪酸甲酯、脂肪酸乙酯或脂肪醇乙酸酯。
如本文所用,术语“碳源”是指适合用作原核或简单真核细胞生长的碳源的底物或化合物。碳源可以是多种形式,包括但不限于聚合物、碳水化合物、酸、醇、醛、酮、氨基酸、肽和气体(例如CO和CO
如本文所用,术语“生物质”是指衍生碳源的任何生物材料。在一些实施方案中,将生物质加工成适合于生物转化的碳源。在一些实施方案中,生物质被加工成纤维素水解产物。在其他实施方案中,生物质不需要进一步加工成碳源。碳源可以转化为包含脂肪酸衍生物的组合物。
生物质的示例性来源是植物物质或植被,例如衍生自玉米、甘蔗、柳枝稷、水稻、小麦、硬木、软木、棕榈、大麻等。生物质的另一示例性来源是代谢废物,例如动物物质(例如牛粪)。生物质的其他示例性来源包括藻类和其他海洋植物,例如大型藻类和海带。生物质还包括来自工业、农业、林业和家庭的废物,包括但不限于丙三醇、发酵废物、青贮饲料、秸秆、木材、纸浆、污水、垃圾、纤维素城市废物、市政固体废物、油脂化学废物、以及剩余的食物(例如皂、油和脂肪酸)。术语“生物质”也可以指碳源,例如碳水化合物(例如单糖、二糖或多糖)。
如本文所用,关于产物(例如脂肪酸衍生物)的术语“分离的”是指与细胞组分、细胞培养基或化学或合成前体分离的产物。通过本文公开的方法产生的脂肪酸衍生物在发酵液以及细胞质中可以相对不混溶。因此,在示例性实施方案中,脂肪酸衍生物在细胞外聚集在有机相中,并因此被“分离”。
如本文所用,术语“进行纯化”、“纯化的”或“纯化”是指通过例如分离或分开将分子从其环境中除去或分离。“基本上纯化的”分子是至少约60%不含(例如,至少约65%不含、至少约70%不含、至少约75%不含、至少约80%不含、至少约85%不含、至少约90%不含、至少约95%不含、至少约96%不含、至少约97%不含、至少约98%不含、至少约99%不含)与它们相关联的其他组分。如本文所用,这些术语也指从样品中去除污染物。例如,去除污染物可导致样品中脂肪酸衍生物或其他化合物的百分比增加。例如,当在重组宿主细胞中产生脂肪酸衍生物或其他化合物时,可以通过去除宿主细胞生物质或其组分(例如蛋白质、核酸和其他细胞组分)来纯化脂肪酸衍生物或其他化合物。纯化后,样品中包含脂肪酸衍生物或其他化合物的丙二酰-CoA衍生化合物的百分比增加。术语“进行纯化”、“纯化的”或“纯化”是相对术语,不需要绝对纯度。因此,例如,当在重组宿主细胞中产生脂肪酸衍生物时,当该脂肪酸衍生物与其他细胞组分(例如,核酸、多肽、脂质、碳水化合物或其他烃)基本分离时,该脂肪酸衍生物是“纯化的”。
如本文所用,术语“减弱”是指弱化、降低或减小。例如,可以例如通过修饰多肽结构以降低其活性(例如,通过修饰编码多肽的核苷酸序列)来减弱多肽的活性。
I.介绍
水解产物原料的使用可以大大降低通过微生物发酵生产可再生化学品的成本。然而,尽管木质纤维素生物质的水解产物可以通过微生物发酵转化为生物燃料和化学品,但是水解产物原料典型地包含混合糖,例如葡萄糖、木糖、甘露糖等,并且混合糖发酵对于通过微生物发酵经济有效地生产生物燃料和化学品提出了重大挑战。
特别是,生长培养基中葡萄糖的存在会抑制大肠杆菌和其他工业微生物物种利用其它糖。只有当生长培养基中的葡萄糖被完全消耗后,这些微生物才开始消耗其他糖,例如木糖、戊糖。相对于非葡萄糖的糖,葡萄糖的优先利用通常会导致较低的总产率和生产力;被称为分解代谢物阻遏或两阶段生长的现象(参见,例如,Kremling,A.,等人(2015)卷23(2):99-109;BrucknerR,Titgemeyer F.(2002)FEMS Microbiol.Lett.[FEMS微生物学通讯]209:141-14)。
因此,为了使衍生自水解产物原料的生物加工的任何可再生碳基产物的产量更高,本领域需要允许木糖利用率增加并且葡萄糖和木糖的共利用增加的微生物系统。
幸运的是,本公开提供了这些和其他需求。
II.具有改善的木糖利用或改善葡萄糖和木糖共利用的XylR突变体
A.通用方法
本公开利用重组遗传学领域中的常规技术。公开分子生物学和遗传学通用方法和术语的基本文献包括,例如Sambrook等人,Molecular Cloning,a Laboratory Manual[分子克隆-实验室手册],冷泉港出版社第4版(冷泉港,纽约州2012);Current Protocols inMolecular Biology[分子生物学当前方案]第1-3卷,约翰·威利父子公司(1994-1998)和补编1-115(1987-2016)。本公开还利用生物化学领域中的常规技术。公开生物化学通用方法和术语的基本文献包括例如,Lehninger Principles of Biochemistry Sixth edition[列宁格生物化学原理第六版],David L.Nelson和Michael M.Cox编辑.W.H.Freeman(2012)。本公开还利用工业发酵中的常规技术。公开发酵的通用方法和术语的基本文献包括例如,Principles of Fermentation Technology[发酵技术原理],第3版,PeterF.Stanbury编辑,Allan Whitaker和Stephen J.Hall.Butterworth-Heinemann(2016);Fermentation Microbiology and Biotechnology[发酵微生物学和生物技术],第2版,E.M.T.E1-Mansi,C.F.A.Bryce,Arnold L.Demain和A.R.Allman编辑CRC出版社(2007)。本公开还利用有机化学领域中的常规技术。公开有机化学通用方法和术语的基本文献包括例如Practical Synthetic Organic Chemistry:Reactions,Principles,and Techniques[实用的合成有机化学:反应,原理和技术],Stephane Caron编辑,John Wiley and SonsInc.[约翰·威利父子公司](2011);The Synthetic Organic Chemist′s Companion[合成有机化学家手册],Michael C.Pirmng,John Wiley and Sons Inc.[约翰·威利父子公司](2007);Organic Chemistry[有机化学],第9版-Francis Carey和Robert Giuliano,McGraw Hill[麦格劳·希尔公司](2013)。
对于核酸,大小以千碱基(kb)或碱基对(bp)给出。估算值典型地衍生自琼脂糖或丙烯酰胺凝胶电泳、测序的核酸或公开的DNA序列。对于蛋白,大小以千道尔顿(kDa)或氨基酸残基数给出。根据凝胶电泳、测序的蛋白、衍生的氨基酸序列或公开的蛋白序列估算蛋白的大小。
不可商购的寡核苷酸可以例如根据首先由Beaucage&Caruthers,TetrahedronLetts.[四面体通讯]22:1859-1862(1981)描述的固相亚磷酰胺三酯法使用自动合成仪如Van Devanter等人,Nucleic Acids Res.[核酸研究]12:6159-6168(1984)中所述进行化学合成。寡核苷酸的纯化是例如,通过天然丙烯酰胺凝胶电泳或通过阴离子交换HPLC如Pearson&Reanier,J.Chrom.[色谱杂志]255:137-149(1983)中所述进行。
克隆的基因和合成的寡核苷酸的序列可以在克隆后使用例如Wallace等人,Gene[基因]16:21-26(1981)的对双链模板进行测序的链终止方法来验证。
B.具有改善的木糖利用和/或改善的葡萄糖和木糖共利用的XylR突变体
1.通用
野生型大肠杆菌的序列作为SEQ ID NO:1在以下提供。大肠杆菌XylR蛋白还具有Uniprot登录号:UniProtKB-P0ACI3
(SEQ ID NO:1:
已知野生型大肠杆菌木糖阻遏物(XylR)SEQ ID NO:1激活D-木糖应答性基因(参见例如,Song S,Park C.(1998)FEMS Microbiol.Lett.[FEMS微生物学通讯]163:255-264)。特别地,XylR-木糖通过结合到每个操纵子起始附近的特定位点来激活XylAB和XylFGH的转录。xylAB和xylFGH操纵子处于基因组的相反方向。XylR使用连接到两个木糖分子的单个二聚体将RNA聚合酶募集到两个结合位点,这使DNA环化。
还认为CRP-cAMP需要与XylR-木糖一起共同激活xylAB和xylFGH转录。仅当从生长培养基中耗尽葡萄糖时,cAMP才能达到高细胞内浓度。认为cAMP的可用性缺乏会引起两阶段作用,由此葡萄糖的存在有效抑制木糖的摄取(参见例如,Sievert等人(2017)PNAS[美国国家科学院院刊],2017年7月11日.114(28)7349-7354)。
已经分析了线性蛋白序列并且已经确定了大肠杆菌木糖阻遏蛋白(XylR)的3维结构(参见例如,Ni等人(2013)Nuc.Acid.Res.[核酸研究]41(3):1998-2008)。
XylR是392个氨基酸的蛋白,其形成同二聚体,所述同二聚体与两个木糖分子和DNA相互作用。所述蛋白包含由残基275-284形成的接头连接的N末端结构域(残基1-274)和C末端结构域(残基285-392)。
C末端结构域是DNA结合结构域。C末端结构域跨氨基酸285-392,其中氨基酸残基304-323形成螺旋-转角-螺旋结合基序。由于残基304-323直接参与DNA结合,因此该区域的突变可能破坏XylR蛋白的功能。然而,在DNA结合结构域内的螺旋-转角-螺旋区域之外的氨基酸取代(例如,残基285至392)可以具有与XylR1相似的特性,例如参见Sievert等人(2017)同上。
不受理论的束缚,据信映射到XylRDNA结合结构域的XylRE382K(XylR1)突变影响蛋白结合,增加了XylR1蛋白对xylAB和xylFGH上游启动子结合位点的亲和力,因此增加了XylAB和XylFGH的表达。这种更强的相互作用还使得系统对启动子位点需要共激活剂CRP-cAMP结合的敏感性降低,并且由XylR1高速率地同时共利用葡萄糖和木糖的能力所表明,例如参见本文中以下实例1和2。
XylR蛋白的木糖结合结构域包含残基221-229。该区域以反平行模式二聚化,并最终调节DNA结合结构域结构,以允许与木糖相互作用后的DNA结合。因此,预期该区域中的突变会影响蛋白对木糖存在的应答。
其他功能区域包括具有螺旋结构域的区域,例如包含E382K(XylR1)突变的区域。螺旋区域中的突变可影响蛋白功能。具有β-链结构的蛋白区域也是功能结构域,因此这些区域中的突变可导致功能改变。
XylR蛋白的某些区域位于螺旋和/或B链结构区域之外,可能对蛋白功能具有极少影响至没有影响。这些区域中的一些包括例如前五个N末端氨基酸残基、残基40-57、残基74-79、残基126-133、残基158-166和/或残基181-184。
此外,一般而言,对于氨基酸序列,本领域技术人员将认识到对核酸、肽、多肽或蛋白序列的单独取代、缺失或添加(其改变、添加或缺失编码序列中的单个氨基酸或一小部分氨基酸)是“保守修饰的变体”,其中改变导致氨基酸被化学上相似的氨基酸取代。这样的“保守修饰的变体”可能对蛋白功能具有很小影响至没有影响,特别是如果它们出现在螺旋和/或β链结构区域之外的区域中。
提供功能上相似的氨基酸的保守取代表是本领域公知的。此类保守修饰的变体是本发明的多态变体、种间同系物和等位基因的补充,并且不排除其。以下八个组各自包含彼此为保守取代的氨基酸:1)丙氨酸(A)、甘氨酸(G);2)天冬氨酸(D)、谷氨酸(E);3)天冬酰胺(N)、谷氨酰胺(Q);4)精氨酸(R)、赖氨酸(K);5)异亮氨酸(I)、亮氨酸(L)、甲硫氨酸(M)、缬氨酸(V);6)苯丙氨酸(F)、酪氨酸(Y)、色氨酸(W);7)丝氨酸(S)、苏氨酸(T);和8)半胱氨酸(C)、甲硫氨酸(M)(参见例如Creighton,Thomas E.(1992)Proteins:Structures andMolecular Properties[蛋白质:结构和分子特性])。
因此,在示例性实施方案中,本公开提供了具有改善的木糖利用和/或改善的葡萄糖和木糖共利用的工程改造的XylR突变体多肽。与具有SEQ ID NO:1的酶相比,这样的突变体可用于生产例如脂肪酯,例如脂肪酸甲酯(FAME)和脂肪酸乙酯(FAEE)、脂肪醇乙酸酯(FACE),脂肪胺,脂肪醛,脂肪醇,烃,脂肪酮,烷烃,末端烯烃,内烯烃,羟基脂肪酸衍生物,双官能脂肪酸衍生物,例如脂肪二酸、脂肪二醇、不饱和脂肪酸衍生物。
2.具有改善的木糖利用和/或改善的葡萄糖和木糖共利用的XylR突变体的测定
在示例性实施方案中,如下文的实例1和2中所公开通过测量葡萄糖和木糖利用来鉴定具有改善的木糖利用和/或改善的葡萄糖和木糖共利用的XylR突变体。
在一些实施方案中,具有改善的木糖利用或改善的葡萄糖和木糖共利用的XylR突变体通过以下进行鉴定:测量由细菌菌株(其包含具有改善的木糖利用和/或改善的葡萄糖和木糖共利用的XylR突变体)(即测试菌株)产生的脂肪酸衍生物(例如,游离脂肪酸(FFA)、脂肪酸乙酯(FAEE)、脂肪酸甲酯(FAME)等)的滴度,并且将这些脂肪酸衍生物与适当的对照菌株(其除了所包含的XylR蛋白外,与测试菌株是等基因的)产生的脂肪酸衍生物(例如FFA、FAEE、FAME等)的滴度进行比较。当在木糖存在下培养菌株时,具有改善的木糖利用或改善葡萄糖和木糖共利用的XylR突变体将比对照菌株产生更多的脂肪酸衍生物(FFA、FAEE、FAME)。
在一些实施方案中,测量脂肪酸衍生物的总滴度并在测试菌株和对照菌株之间进行比较。在其他实施方案中,测量由测试菌株产生的包含特定脂肪酸衍生物(例如C14脂肪酸衍生物)的脂肪酸衍生物的总滴度的百分比,并将其与由合适的对照菌株(其除了所包含的对照XylR(例如SEQ ID NO:1)外,与测试菌株是等基因的)产生的包含特定脂肪酸衍生物(例如C14脂肪酸衍生物)的脂肪酸衍生物的总滴度的百分比进行比较。
在示例性实施方案中,具有火焰离子化检测的气相色谱法(GC-FID)用于测定脂肪酸衍生物。GC-FID在本领域中是已知的(参见例如,Adlard,E.R.;Handley,Alan J.(2001).Gas chromatographic techniques and applications[气相色谱技术和应用].London:SheffieldAcademic[伦敦:谢菲尔德学术])。但是,可以使用任何适当的定量和分析方法,例如质谱(MS)、气相色谱-质谱(GC-MS)、液相色谱-质谱(LC-MS)、薄层色谱(TLC)等。
C.制造具有改善的木糖利用和/或改善的葡萄糖和木糖共利用的XylR突变体的方法
可以通过本领域已知的任何方法(参见,例如,Current Protocols in MolecularBiology[分子生物学最新方案],同上)制备具有改善的木糖利用或改善的葡萄糖和木糖共利用的工程改造的XylR突变体。因此,在示例性实施方案中,诱变被用于制备编码具有改善的木糖利用或改善的葡萄糖和木糖共利用的XylR突变体/变体的多核苷酸序列,然后可以针对改善的木糖利用或改善的葡萄糖和木糖共利用来筛选该多核苷酸序列。在其他示例性实施方案中,通过化学合成多核苷酸序列制备编码具有改善的木糖利用或改善的葡萄糖和木糖共利用的XylR突变体/变体的多核苷酸序列,该多核苷酸序列然后可以针对改善的木糖利用或改善的葡萄糖和木糖共利用来进行筛选(参见例如M.H.Caruthers等人(1987)Methods in Enzymology[酶学方法]第154卷,第287-313页;Beaucage,S.L.和Iyer,R.P.(1992)Tetrahedron[四面体]48(12):2223-2311)。
诱变方法是本领域公知的。用于制备具有改善的木糖利用或改善的葡萄糖和木糖共利用的工程改造的XylR突变体的示例性诱变技术包括例如位点饱和诱变(参见例如,Chronopoulou EG1,Labrou NE.Curr.Protoc.Protein Sci.[蛋白质科学最新方案]2011年2月;第26章:第26.6单元,John Wiley and Sons,Inc[约翰·威利父子公司];Steffens,D.L.和Williams.,J.G.K(2007)J Biomol Tech.[生物分子技术杂志]18(3):147-149;Siloto,R.M.P和Weselake,R.J.(2012)Biocatalysis and Agricultural Biotechnology[生物催化和农业生物技术]1(3):181-189)。
用于制备具有改善的木糖利用或改善葡萄糖和木糖共利用的XylR突变体的另一种示例性诱变技术包括转移PCR(tPCR)参见例如,Erijman A.,等人(2011)J.Struct.Bi01.[结构生物学杂志]175(2):171-7。
其他示例性诱变技术包括例如易错聚合酶链式反应(PCR)(参见例如,Leung等人(1989)Technique[技术]1:11-15;和Caldwell等人(1992)PCR Methods Applic.[PCR方法应用]2:28-33)。
用于制备具有改善的木糖利用或改善的葡萄糖和木糖共利用的工程改造的XylR变体的另一种示例性诱变技术包括使用寡核苷酸定向诱变(参见例如,Reidhaar-Olson等人(1988)Science[科学]241:53-57)以在任何克隆的目的DNA中产生位点特异性突变。
然后将由如上所述的任何合成或诱变方法产生的诱变多核苷酸克隆到合适的载体中或插入宿主细胞基因组,并如上所公开来评估由诱变多核苷酸编码的受影响多肽的活性。
本领域普通技术人员将认识到,可以修改本文公开的方案和程序,并且这种修改是根据本公开的变型。例如,当以特定顺序描述方法步骤时,可以并行或顺序修改和/或执行步骤的顺序。
III.宿主细胞和宿主细胞培养物
鉴于本公开,本领域普通技术人员将理解,本文考虑的任何实施方案可以用可以通过引入一种或多种核酸序列进行遗传修饰的任何宿主细胞或微生物来实践,所述一种或多种核酸序列编码所公开的具有改善的木糖利用或改善葡萄糖和木糖共利用的XylR突变体。因此,本文公开的重组微生物用作宿主细胞并包含一种或多种多核苷酸序列,所述一种或多种多核苷酸序列包括编码具有改善的木糖利用和/或改善的葡萄糖和木糖共利用的XylR突变体的开放阅读框以及可操作地连接的调节序列(其有助于工程改造的XylR突变多肽在宿主细胞中的表达)。
提供合适的宿主细胞的示例性微生物包括但不限于来自埃希氏杆菌属(Escherichia)、芽孢杆菌属(Bacillus)、乳杆菌属(Lactobacillus)、假单胞菌属(Pseudomonas)、曲霉属(Aspergillus)、海杆菌属(Marinobacter)的细胞。在一些示例性实施方案中,宿主细胞是革兰氏阳性细菌细胞。在其他示例性实施方案中,宿主细胞是革兰氏阴性细菌细胞。在一些实施方案中,宿主细胞是大肠杆菌细胞。在其他示例性实施方案中,宿主细胞是迟缓芽孢杆菌(Bacillus lentus)细胞、短芽孢杆菌(Bacillus brevis)细胞、嗜热脂肪芽孢杆菌(Bacillus stearothermophilus)细胞、地衣芽孢杆菌(Bacilluslichenoformis)细胞、嗜碱芽孢杆菌(Bacillus alkalophilus)细胞、凝结芽孢杆菌(Bacillus coagulans)细胞、环状芽孢杆菌(Bacillus circulans)细胞、短小芽孢杆菌(Bacillus pumilis)细胞、苏云金芽孢杆菌(Bacillus thuringiensis)细胞、克劳氏芽孢杆菌(Bacillus clausii)细胞、巨大芽孢杆菌(Bacillus megaterium)细胞、枯草芽孢杆菌(Bacillus subtilis)细胞、或解淀粉芽孢杆菌(Bacillus amyloliquefaciens)细胞。
在其他示例性实施方案中,宿主细胞是来自蓝细菌、绿硫细菌、绿非硫细菌、紫硫细菌、紫非硫细菌、极端微生物、其工程改造的生物、或合成生物的细胞。在一些示例性实施方案中,宿主细胞是大肠杆菌细胞。在一些示例性实施方案中,大肠杆菌细胞是菌株B、菌株C、菌株K或菌株W大肠杆菌细胞。
在一些示例性实施方案中,取决于宿主细胞中存在什么其他异源酶和什么天然酶途径,宿主细胞包括从一个宿主细胞到另一个宿主细胞可互换使用的任选的遗传操作和改变。在一个示例性实施方案中,宿主细胞任选地包含fadE和/或fhuA缺失。在其他示例性实施方案中,任选地操纵宿主细胞以具有产生超过200mg/L脂肪酸衍生物、超过1000mg/L脂肪酸衍生物、超过1200mg/L脂肪酸衍生物、超过1700mg/L脂肪酸衍生物、超过2000mg/L脂肪酸衍生物、或超过3000mg/L脂肪酸衍生物的能力。
如下文将在本文中详细讨论的,在一些示例性实施方案中,用于表达具有改善的木糖利用或改善的葡萄糖和木糖共利用的XylR突变体/变体的宿主细胞或宿主微生物进一步表达具有酶活性的基因,所述酶活性可以增加一种或多种特定脂肪酸衍生物(比如例如,脂肪酯、脂肪醇、脂肪醇乙酸酯、脂肪酸甲酯、脂肪酸乙酯、脂肪胺、脂肪醛、双官能脂肪酸衍生物、二酸、烷烃、烯烃或链烯烃、酮等)的产生。
在示例性实施方案中,用于表达具有改善的木糖利用或改善葡萄糖和木糖共利用的XylR突变体的宿主细胞或宿主微生物进一步表达酯合酶活性(E.C.2.3.1.75)用于产生脂肪酯。在另一个示例性实施方案中,宿主细胞具有酰基-ACP还原酶(AAR)(E.C.1.2.1.80)活性和/或醇脱氢酶活性(E.C.1.1.1.1.)和/或脂肪醇酰基-CoA还原酶(FAR)(E.C.1.1.1.*)活性和/或羧酸还原酶(CAR)( EC 1.2.99.6)活性用于产生脂肪醇。在另一个示例性实施方案中,宿主细胞具有酰基-ACP还原酶(AAR)(E.C.1.2.1.80)活性用于产生脂肪醛。在另一个示例性实施方案中,宿主细胞具有酰基-ACP还原酶(AAR)(E.C.1.2.1.80)活性和脱羰基酶或脂肪醛氧化去甲酰活性EC 4.1.99.5)用于产生烷烃和烯烃。在另一个示例性实施方案中,宿主细胞具有酰基-CoA还原酶(E.C.1.2.1.50)活性和酰基-CoA合成酶(FadD)(E.C.2.3.1.86)活性用于产生脂肪醇。在另一个示例性实施方案中,宿主细胞具有酯合酶活性(E.C.2.3.1.75)和酰基-CoA合成酶(FadD)(E.C.2.3.1.86)活性用于产生脂肪酯。在另一个示例性实施方案中,宿主细胞具有OleA活性用于产生酮。在另一个示例性实施方案中,宿主细胞具有OleABCD活性用于产生内烯烃。在另一个示例性实施方案中,宿主细胞具有酰基-ACP还原酶(AAR)(E.C.1.2.1.80)活性和醇脱氢酶活性(E.C.1.1.1.1)用于产生脂肪醇。在另一个示例性实施方案中,宿主细胞具有脱羧酶活性用于产生末端烯烃。微生物和微生物细胞中酶活性的表达例如由以下教导:美国专利9,133,406;9,340,801;9,200,299;9,068,201;8,999,686;8,658,404;8,597,922;8,535,916;8,530,221;8,372,610;8,323,924;8,313,934;8,283,143;8,268,599;8,183,028;8,110,670;8,110,093;和8,097,439。
在一些示例性实施方案中,用于表达具有改善的木糖利用或改善的葡萄糖和木糖共利用的XylR突变体的宿主细胞或微生物包含某些天然酶活性,所述天然酶活性被上调或过表达,以产生一种或多种特定的脂肪酸衍生物,比如例如脂肪酯、脂肪酸甲酯、脂肪酸乙酯、脂肪醇,脂肪醇乙酸酯、脂肪胺、脂肪酰胺、脂肪醛、双官能脂肪酸衍生物、二酸等。
在一些示例性实施方案中,重组宿主细胞产生脂肪酯,例如脂肪酸甲酯(FAME)或脂肪酸乙酯(FAEE)、脂肪醇乙酸酯(FACE),脂肪醇(FALC),脂肪胺,脂肪醛,双官能脂肪酸衍生物,二酸,烷烃,烯烃等。
脂肪酸衍生物典型地从培养基中回收和/或从宿主细胞中分离。在一个示例性实施方案中,脂肪酸衍生物从培养基中回收(细胞外)。在另一个示例性实施方案中,脂肪酸衍生物从宿主细胞分离(细胞内)。在另一个示例性实施方案中,脂肪酸衍生物或非脂肪酸化合物从培养基中回收并从宿主细胞中分离。
可以使用本领域已知的方法(例如,具有火焰离子化检测的气相色谱法(GC-FID))分析宿主细胞产生的脂肪酸衍生物组合物,以确定特定脂肪酸衍生物的分布以及脂肪酸衍生物组合物的组分的链长和饱和度。类似地,可以通过本领域公知的方法分析其他化合物。
IV.制备重组宿主细胞和培养物的方法
可以使用本领域已知的任何方法来工程改造宿主细胞以表达具有改善的木糖利用和/或改善的葡萄糖和木糖共利用的XylR突变体,以产生例如脂肪酸衍生物和/或脂肪酸衍生物组合物或其他化合物。示例性方法包括例如使用载体,例如表达载体,其包含编码具有改善的木糖利用和/或改善的葡萄糖和木糖共利用的XylR突变体的多核苷酸序列和/或本文公开的多核苷酸序列。本领域技术人员将理解,多种病毒和非病毒载体可用于本文公开的方法中。
在一些示例性实施方案中,通过重组载体向宿主细胞提供编码具有改善的木糖利用和/或改善的葡萄糖和木糖共利用的XylR突变体的多核苷酸(或基因)序列,所述重组载体包含可操作地连接至编码具有改善的木糖利用和/或改善的葡萄糖和木糖共利用的XylR突变体的多核苷酸序列的启动子。在一些示例性实施方案中,启动子是发育调节的、细胞器特异性的、组织特异性的、诱导型的、组成型的或细胞特异性的启动子。在一些示例性实施方案中,通过添加乳糖或异丙基硫代半乳糖苷(IPTG)来诱导启动子。
一旦已经制备并分离了编码具有改善的木糖利用和/或改善的葡萄糖和木糖共利用的XylR突变体的多核苷酸序列,则可以使用多种方法来构建表达盒、载体和其他DNA构建体。可以以多种方式构建包含编码具有改善的木糖利用或改善的葡萄糖和木糖共利用的XylR突变体/变体的多核苷酸序列的表达盒。技术人员非常了解表达构建体/载体上必须存在的遗传元件,以便成功地在宿主细胞中转化、选择和繁殖表达构建体。用于操纵多核苷酸序列(例如编码具有改善的木糖利用或改善葡萄糖和木糖共利用的XylR突变体/变体的那些)的技术,例如将核酸序列亚克隆进入表达载体,对探针进行标记,DNA杂交等等一般描述于例如Sambrook,等人,同上;Current Protocols in Molecular Biology[分子生物学最新方案],同上。
包含与异源DNA序列例如启动子序列连接的编码具有改善的木糖利用或改善的葡萄糖和木糖共利用的XylR突变体/变体的多核苷酸序列(例如,SEQ ID NO:4)的DNA构建体可以插入到各种载体中。在一些示例性实施方案中,选择的载体是可用于转化细菌例如大肠杆菌的表达载体。表达载体可以是质粒、病毒、粘粒、人工染色体、核酸片段等。通过使用本领域技术人员公知的重组DNA技术可以容易地构建这样的载体(参见例如,Sambrook等人,同上)。然后可以将包含编码突变体或工程改造的XylR变体的多核苷酸序列的表达载体转染/转化到靶宿主细胞中。然后基于合适的标记基因的存在,通过本领域公知的方法选择成功转化的细胞。
本领域技术人员可以使用许多重组载体用于细菌和其他微生物的稳定转化/转染(参见例如,Sambrook等人,同上)。本领域技术人员很容易选择合适的载体。在一个示例性实施方案中,将已知的载体用于产生包含编码突变体或工程改造的XylR变体的多核苷酸序列的表达构建体。
典型地,转化载体包括可操作地连接至例如启动子序列和可选择标记的一个或多个多核苷酸序列,所述多核苷酸序列编码具有改善的木糖利用和/或改善的葡萄糖和木糖共利用的XylR突变体。此类转化载体典型地还在适当情况下包括转录起始开始位点、核糖体结合位点、RNA加工信号、转录终止位点和/或聚腺苷酸化信号。
因此,除了编码具有改善的木糖利用和/或改善的葡萄糖和木糖共利用的XylR突变体的多核苷酸序列外,如本文所公开制备的表达构建体还可以包含其他元件。在示例性实施方案中,包含编码具有改善的木糖利用和/或改善的葡萄糖和木糖共利用的XylR突变体的多核苷酸序列的表达构建体还包含增强子序列,从而可以增强异源蛋白的表达。如本领域已知的,典型地在转录开始的5′发现增强子,它们通常可以以正向或反向方向插入,即在编码序列的5′或3′。
如上所述,转化/表达载体典型地包括可选择和/或可筛选的标记基因,以允许容易地鉴定转化体。示例性可选择标记基因包括但不限于编码抗生素抗性(例如对卡那霉素、氨苄青霉素等的抗性)的那些。示例性的可筛选标记包括例如在重组蛋白的C末端引入的六氨基酸组氨酸标签。
在示例性实施方案中,将可选择或可筛选的标记基因用作特定目的基因或连同特定目的基因一起使用,以提供或增强鉴定转化体的能力。许多可选择标记基因是本领域已知的(参见例如,Sambrook等人,同上)。
在一些示例性实施方案中,表达载体进一步包含与表达的异源核酸的编码序列连接的序列,其在翻译后从初始翻译产物中去除。在一个示例性实施方案中,翻译后去除的序列有助于蛋白运输进入或通过细胞内或细胞外膜,从而有助于蛋白运输进入细胞内部和/或外部的区室。在一个示例性实施方案中,翻译后去除的序列保护新生蛋白免受细胞内蛋白水解降解。在一个示例性实施方案中,在宿主细胞中选择的编码序列的重组表达中使用核酸区段,所述核酸区段编码所述编码序列的上游并与其在阅读框中的前导肽序列。
在另一个示例性实施方案中,表达构建体包含细菌复制起点,例如ColE1起点。在另一个示例性实施方案中,表达构建体/载体包含细菌可选择标记,例如氨苄青霉素、四环素、潮霉素、新霉素或氯霉素抗性基因。
如本领域公知的,表达构建体典型地包含限制性核酸内切酶位点以有助于载体构建。示例性限制性核酸内切酶识别位点包括但不限于例如限制性核酸内切酶NotI、AatII、SacII、PmeI HindIII、PstI、EcoRI和BamHI的识别位点。
DNA构建体(编码突变体或工程改造的XylR变体的可操作地连接至以下的多核苷酸序列和/或编码其他脂肪酸衍生物生物合成途径多肽的连接至以下的多核苷酸序列:异源DNA序列,例如启动子序列,标记序列;纯化部分;与多核苷酸序列可操作地偶联的分泌序列;靶向序列等)用于转化细胞并产生具有改善的木糖利用或改善的葡萄糖和木糖共利用的重组宿主细胞。上面详细讨论了用于用表达构建体转化的示例性宿主细胞,所述表达构建体包含编码具有改善的木糖利用和/或改善的葡萄糖和木糖共利用的XylR突变体的多核苷酸序列。
熟练的技术人员很容易选择合适的转化技术。本领域技术人员可获得的示例性转化/转染方法包括例如电穿孔、氯化钙转化等,这些方法是技术人员公知的(参见例如,Sambrook,同上)。因此,可以将包含编码蛋白的开放阅读框和可操作地连接的调节序列的多核苷酸序列整合到重组宿主细胞的染色体中,掺入驻留在重组宿主细胞中的一个或多个质粒表达系统中,或两者。
本文公开的表达载体典型地以如下形式包括编码具有改善的木糖利用和/或改善的葡萄糖和木糖共利用的XylR突变体的多核苷酸序列,所述形式适合用于在宿主细胞中表达所述多核苷酸序列。如本领域技术人员将理解的,表达载体的设计可取决于诸如以下因素,例如,要转化的宿主细胞的选择,所期望的多肽的表达水平等。
V.评估重组宿主细胞
在示例性实施方案中,通过在木糖存在下培养重组宿主细胞并如本文以下实例1和2中所公开的测量例如改善的木糖和葡萄糖利用的特性,确定具有改善的木糖利用和/或改善的葡萄糖和木糖共利用的XylR突变体的活性。
另一种评估方法是在木糖存在下通过测量光密度(OD 600)来测量重组宿主细胞的生长速率(参见例如,实例2)。另一种评估方法是通过本文公开的分析仪器测量从木糖或葡萄糖和木糖的混合物的碳源合成的所期望生化产物(例如脂肪酸衍生物)的浓度。
IV.从重组宿主细胞衍生的产物
增加木糖利用或改善葡萄糖和木糖共利用的策略可用于利用不同的碳源,以通过重组宿主细胞产生脂肪酸衍生物。木糖可用作碳源。图17显示了利用木糖的示例性代谢途径的示意图。
XylR是调节蛋白,其可诱导XylFGH和XylAB基因(其分别控制木糖的运输和随后的利用途径)的表达。xylB的基因产物,如图17所示,木酮糖-5-磷酸通过充分描述的戊糖磷酸途径进入大肠杆菌的中央代谢。最终,由戊糖磷酸途径产生的乙酰CoA进入脂肪酸生物合成途径以产生脂肪酸衍生物。
因此,在示例性实施方案中,重组宿主细胞经工程改造以除包含具有改善的木糖利用和/或改善的葡萄糖和木糖共利用的XylR突变体之外,还包含编码一种或多种“脂肪酸衍生物生物合成多肽”或等同地“脂肪酸衍生物酶”的一种或多种多核苷酸序列。对脂肪酸衍生物生物合成途径进行代谢工程改造以使用微生物产生脂肪酸衍生物化合物(例如脂肪酸酯、烷烃、烯烃、脂肪酮、脂肪醇、脂肪醇乙酸酯等)以将生物质衍生的糖转化为所期望的产物,这是本领域已知的,参见例如美国专利号9,133,406;9,340,801;9,200,299;9,068,201;8,999,686;8,658,404;8,597,922;8,535,916;8,530,221;8,372,610;8,323,924;8,313,934;8,283,143;8,268,599;8,183,028;8,110,670;8,110,093;和8,097,439。可以在工业规模的生物反应器中培养代谢工程改造的菌株,并使用传统的化学和生物化学工程技术纯化所得产物。
因此,在一些实施方案中,通过在有效表达具有改善的木糖利用和/或改善的葡萄糖和木糖共利用的XylR突变体的条件下在包含木糖的碳源存在下培养包含所述XylR突变体的重组宿主细胞,来产生包含例如脂肪酸酯例如FAME的脂肪酸衍生物组合物。
在一些实施方案中,通过在包含木糖的条件下培养重组宿主细胞(其包含具有改善的木糖利用和/或改善的葡萄糖和木糖共利用的XylR突变体)产生的基本上所有的脂肪酸衍生物是在细胞外产生。因此,在一些示例性实施方案中,从培养基中回收产生的脂肪酸衍生物。在一些示例性实施方案中,使用本领域已知的任何合适方法(例如GC FID)对回收的脂肪酸衍生物组合物进行分析,以便确定和量化特定脂肪酸衍生物的分布以及脂肪酸衍生物组合物的组分的链长和饱和度。
如上所述,包含具有改善的木糖利用或改善的葡萄糖和木糖共利用的工程改造的XylR变体的重组宿主细胞与不包含所述工程改造的XylR变体的合适对照宿主细胞(例如,具有对照XylR酶(例如SEQ ID NO:1)的等基因对照宿主细胞)相比产生增加量的脂肪酸。
在下面将详细讨论的其他示例性实施方案中,除了具有改善的木糖利用或改善的葡萄糖和木糖共利用的工程改造的XylR变体之外,重组宿主细胞进一步包含另外的脂肪酸衍生物生物合成多肽,其有助于特定类型的脂肪酸衍生物的产生。
在一些示例性实施方案中,除了具有改善的木糖利用或改善的葡萄糖和木糖共利用的工程改造的XylR变体之外,重组宿主细胞进一步包含羧酸还原酶(“CAR”)活性,并且因此,所述重组宿主细胞合成脂肪醛和脂肪醇,参见例如,美国专利9,340,801。
因此,在一些示例性实施方案中,通过在重组宿主细胞中表达或过表达编码具有脂肪醛生物合成活性例如羧酸还原酶(CAR)活性的多肽的多核苷酸来产生脂肪醛。示范性的羧酸还原酶(CAR)多肽和编码它们的多核苷酸包括例如FadD9(EC 6.2.1.-,UniProtKBQ50631,GenBank NP_217106)、CarA(GenBank ABK75684)、CarB(GenBank YP889972)和在例如美国专利号8,097,439和美国专利号9,340,801中公开的相关多肽。
在一些示例性实施方案中,然后将重组宿主细胞产生的脂肪醛转化为脂肪醇或烃。因此,在一些示例性实施方案中,除了具有改善的木糖利用或改善的葡萄糖和木糖共利用的XylR变体之外,重组宿主细胞进一步包含酰基-CoA还原酶(“FAR”或“ACR”)活性,并且因此重组宿主细胞合成脂肪醛和脂肪醇(参见例如,美国专利号8,658,404,美国专利号8,268,599,美国专利申请公开2015/0361454)。
在一些实施方案中,重组宿主细胞产生的脂肪醛通过天然或异源脂肪醇生物合成多肽如醛还原酶或醇脱氢酶的活性而转化为脂肪醇(参见例如,美国专利申请公开2011/0250663)。因此,在一些示例性实施方案中,除了具有改善的木糖利用或改善的葡萄糖和木糖共利用的XylR变体之外,重组宿主细胞进一步包含醛还原酶活性或等同地醇脱氢酶活性(EC 1.1.1.1),并且因此重组宿主细胞合成脂肪醇。示例性的脂肪醇生物合成基因包括但不限于例如醇脱氢酶,例如Acenitobacter sp.M-1的AlrA或AlrA同系物;以及内源性大肠杆菌醇脱氢酶,例如DkgA(Np.sub.--417485)、DkgB(NP.sub.--414743)、YjgB(AAC77226)、YdjL(AAC74846)、YdjJ(NP.sub.--416288)、AdhP(NP.sub.--415995)、YhdH(NP.sub.--417719)、YahK(NP.sub.--414859)、YphC(AAC75598)和YqhD(Q46856)。
在一些示例性实施方案中,将重组宿主细胞(其包含具有改善的木糖利用或改善的葡萄糖和木糖共利用的工程改造的XylR变体并且其产生脂肪醛(例如,如本文上文所公开))进一步修饰以包含具有氨基转移酶或胺脱氢酶活性(其将脂肪醛转化为脂肪胺)的异源生物合成酶(参见例如,PCT公开号WO 2015/085271)。
在一些示例性实施方案中,除了具有改善的木糖利用或改善的葡萄糖和木糖共利用的工程改造的XylR变体之外,重组宿主细胞进一步包含编码具有脂肪醇生物合成活性的多肽的多核苷酸,并且因此通过重组宿主细胞产生脂肪醇。因此,在示例性实施方案中,包含中链脂肪醇(例如包含辛醇)的组合物通过以下来制备:在有效表达工程改造的XylR变体(其具有改善木糖利用或改善葡萄糖和木糖的共利用)和脂肪醇生物合成酶的条件下,在碳源存在下培养重组宿主细胞。
因此,在一些示例性实施方案中,除了具有改善的木糖利用或改善的葡萄糖和木糖共利用的工程改造的XylR变体之外,重组宿主细胞进一步包含羧酸还原酶(CAR)活性和醇脱氢酶活性,并且因此,重组宿主细胞合成脂肪醇,例如辛醇(参见例如,美国专利9,340,801)。
在一些示例性实施方案中,天然脂肪醛生物合成多肽,例如存在于宿主细胞中的醛还原酶/醇脱氢酶,将脂肪醛转化为脂肪醇。在其他示例性实施方案中,天然脂肪醛还原酶/醇脱氢酶被过表达以将脂肪醛转化为脂肪醇。在其他示例性实施方案中,将异源醛还原酶/醇脱氢酶引入重组宿主细胞中,并表达或过表达以将脂肪醛转化为脂肪醇。可用于将脂肪醛转化为脂肪醇的示例性醛还原酶/醇脱氢酶多肽在上文和国际专利申请公开号WO2007/136762;WO 2010/062480;美国专利8,110,670;美国专利9,068,201中公开。
在一些示例性实施方案中,除了具有改善的木糖利用或改善的葡萄糖和木糖共利用的工程改造XylR变体之外,重组宿主细胞进一步包含编码具有羧酸还原酶(EC 6.2.1.3或EC 1.2.1.42)活性的多肽的异源多核苷酸,使得重组宿主细胞在具有简单碳源的发酵液中生长时产生1,3脂肪二醇。在其他示例性实施方案中,除了具有改善的木糖利用或改善的葡萄糖和木糖共利用的工程改造的XylR变体之外,重组宿主细胞进一步包含编码具有羧酸还原酶(EC 6.2.1.3或EC 1.2.1.42)活性的多肽的异源多核苷酸和编码具有醇脱氢酶(EC1.1.1)活性的多肽的异源多核苷酸,其中重组宿主细胞在具有简单碳源的发酵液中生长时产生1,3脂肪二醇(参见例如,WO 2016/011430)。
在一些实施方案中,在细胞中产生或在一些实施方案中供给到细胞中的脂肪醇被重组细胞进一步加工以提供脂肪醇乙酸酯(FACE)。在示例性实施方案中,醇O-乙酰基转移酶(EC 2.8.1.14)将脂肪醇加工成脂肪醇乙酸酯(FACE),参见例如,Gabriel M Rodriguez,等人(2014)Nature Chemical Biology[自然化学生物学]10,259-265;Jyun-Liang Lin和Ian Wheeldon(2014)PLoS One.[公共科学图书馆·综合]2014;9(8):PMCID:PMC4122449。
示例性的醇O-乙酰基转移酶是酵母Aftl,例如,GenBank登录号AY242062;GenBank登录号AY242063,参见例如,Kevin J.Verstrepen K.J.,等人(2003)Appl EnvironMicrobiol.[应用和环境微生物学]2003年9月;69(9):5228-5237。
在一个示例性实施方案中,包含具有改善的木糖利用或改善的葡萄糖和木糖共利用的工程改造的XylR变体的重组宿主细胞进一步包含足以产生脂肪醛和脂肪醇的羧酸还原酶活性(EC 1.2.99.6),并且进一步包含脂肪醇O-乙酰基转移酶活性,其将脂肪醇转化为脂肪醇乙酸酯。
在另一个示例性实施方案中,包含具有改善的木糖利用或改善的葡萄糖和木糖共利用的工程改造的XylR变体的重组宿主细胞进一步包含羧酸还原酶活性(EC 1.2.99.6)(其导致产生第一脂肪酸衍生物),并且进一步包含脂肪醇O-乙酰基转移酶活性(其将第一脂肪酸衍生物转化为第二脂肪酸衍生物,其中第二脂肪酸衍生物具有比第一脂肪酸衍生物更高的MIC)。
在另一个示例性实施方案中,包含具有改善的木糖利用或改善的葡萄糖和木糖共利用的工程改造的XylR变体的重组宿主细胞进一步包含羧酸还原酶活性(EC 1.2.99.6)(其导致产生第一脂肪酸衍生物),并且进一步包含脂肪醇O-乙酰基转移酶活性(其将第一脂肪酸衍生物转化为第二脂肪酸衍生物,其中第二脂肪酸衍生物具有比第一脂肪酸衍生物更高的LogP)。
在另一个示例性实施方案中,包含具有改善的木糖利用或改善的葡萄糖和木糖共利用的工程改造的XylR变体的重组宿主细胞进一步包含羧酸还原酶活性(EC 1.2.99.6)(其导致产生第一脂肪酸衍生物),并且进一步包含脂肪醇O-乙酰基转移酶活性(其将第一脂肪酸衍生物转化为第二脂肪酸衍生物,其中在存在第二脂肪酸衍生物的情况下,导致第一脂肪酸衍生物的MIC增加)。
在另一个示例性实施方案中,包含具有改善的木糖利用或改善的葡萄糖和木糖共利用的工程改造的XylR变体的重组宿主细胞进一步包含羧酸还原酶活性(EC 1.2.99.6)(其导致产生第一脂肪酸衍生物),并且进一步包含脂肪醇O-乙酰基转移酶活性(其将第一脂肪酸衍生物转化为第二脂肪酸衍生物,其中第二脂肪酸衍生物的毒性低于第一脂肪酸衍生物)。
在一些实施方案中,除了具有改善的木糖利用或改善的葡萄糖和木糖共利用的工程改造的XylR变体之外,重组宿主细胞进一步包含编码具有脂肪酯生物合成活性的多肽的多核苷酸,并且因此通过重组宿主细胞产生脂肪酯。
如本文所用,术语“脂肪酯”或等同地“脂肪酸酯”是指由脂肪酸制成的任何酯。在示例性实施方案中,脂肪酯包含“A侧”和“B侧”。如本文所用,酯的“A侧”是指连接至酯的羧酸氧的碳链。如本文所用,酯的“B侧”是指包含酯的母体羧酸的碳链。在其中脂肪酯衍生自脂肪酸衍生物生物合成途径的实施方案中,A侧由醇贡献,并且B侧由脂肪酸或烷基硫酯贡献。
任何醇均可用于形成脂肪酯的A侧。在示例性实施方案中,所述醇衍生自脂肪酸衍生物生物合成途径。在其他示例性实施方案中,通过非脂肪酸衍生物生物合成途径生产醇,例如,醇是外源提供的,例如,醇是在发酵液中供应的。
包含A侧或B侧的碳链可以具有任何长度。在一个示例性实施方案中,脂肪酯是脂肪酸甲酯,其中B侧通过脂肪酸生物合成途径提供,并且酯的A侧长度为1个碳。在一个示例性实施方案中,A侧通过脂肪酸O-甲基转移酶(FAMT)(EC 2.1.1.15)的作用提供(参见例如,Applied and Environmental Microbiology[应用和环境微生物学]77(22):8052-8061)。
在另一个示例性实施方案中,脂肪酯是脂肪酸乙酯,其中B侧通过脂肪酸生物合成途径提供,并且酯的A侧长度为2个碳。
在一个示例性实施方案中,A侧是直链的。在另一个示例性实施方案中,A侧是支链的。在一个示例性实施方案中,B侧是直链的。在另一个示例性实施方案中,B侧是支链的。支链可以具有一个或多个分支点。在一个示例性实施方案中,A侧是饱和的。在另一个示例性实施方案中,A侧是不饱和的。在一个示例性实施方案中,B侧是饱和的。在另一个示例性实施方案中,B侧是不饱和的。
在示例性实施方案中,重组宿主细胞包含编码具有酯合酶活性的多肽(EC3.1.1.67)的多核苷酸。酯合酶在本领域中是已知的,参见例如国际专利申请公开WO 2011/038134。
在一些示例性实施方案中,脂肪酸酯由重组宿主细胞产生,所述重组宿主细胞包含具有改善的木糖利用或改善的葡萄糖和木糖共利用的工程改造的XylR变体、以及硫酯酶、酰基-CoA合成酶(fadD)和酯合酶(参见例如,国际专利申请公开WO/201I/038134;国际专利申请公开WO 2007/136762;美国专利8,110,670)。
在一个示例性实施方案中,包含具有改善的木糖利用或改善的葡萄糖和木糖共利用的工程改造的XylR变体的重组宿主细胞进一步包含酯合酶活性(EC 3.1.1.67),其足以产生脂肪酯(例如FAME或FAEE,参见例如美国专利9,879,239)。
在一些实施方案中,除了具有改善的木糖利用或改善的葡萄糖和木糖共利用的工程改造的XylR变体之外,重组宿主细胞进一步包含编码具有脂肪醛生物合成活性的多肽(例如酰基-ACP还原酶多肽(EC 6.4.1.2))的多核苷酸和编码具有烃生物合成活性的多肽(例如脱羰基酶(EC 4.1.99.5)、氧化去甲酰酶或脂肪酸脱羧酶)的多核苷酸,并且因此,重组宿主细胞表现出增强的烃产生(参见例如,美国专利申请公开201I/0124071)。因此,在示例性实施方案中,包含具有改善的木糖利用或改善的葡萄糖和木糖共利用的工程改造的XylR变体的重组宿主细胞产生烃,例如烷烃或烯烃(例如末端烯烃或内烯烃)或酮。
在一些示例性实施方案中,通过脱羰作用转化由包含具有改善的木糖利用或改善的葡萄糖和木糖共利用的工程改造的XylR变体的重组宿主细胞产生的脂肪醛,去除碳原子,以形成烃(参见例如,美国专利8,110,670和WO 2009/140695)。
在其他示例性实施方案中,重组宿主细胞产生的脂肪酸通过脱羧作用转化,除去碳原子,以形成末端烯烃。因此,在一些示例性实施方案中,除了表达具有改善的木糖利用或改善的葡萄糖和木糖共利用的工程改造的XylR变体,重组细胞进一步表达或过表达编码烃生物合成多肽(例如具有脱羧酶活性的多肽,如在例如美国专利8,597,922中公开的)的多核苷酸。
在其他示例性实施方案中,烷基硫酯中间体通过酶促脱羧缩合转化以形成内烯烃或酮。因此,在一些示例性实施方案中,除了表达具有改善的木糖利用或改善的葡萄糖和木糖共利用的工程改造的XylR变体,重组细胞进一步表达或过表达编码烃生物合成多肽(例如比如具有OleA活性的多肽)的多核苷酸,从而产生酮(参见例如,美国专利9,200,299)。在其他示例性实施方案中,除了表达具有改善的木糖利用或改善的葡萄糖和木糖共利用的工程改造的XylR变体,重组细胞进一步表达或过表达编码烃生物合成多肽(例如比如OleCD或OleBCD)连同具有OleA活性的多肽的多核苷酸,从而产生内烯烃(参见例如,美国专利9,200,299)。
一些示例性烃生物合成多肽示于下表2中。
表2.示例性烃生物合成多核苷酸和多肽。
在一些实施方案中,除了具有改善的木糖利用或改善的葡萄糖和木糖共利用的工程改造的XylR变体之外,重组宿主细胞进一步包含编码具有ω-羟化酶活性的多肽(EC1.14.15.3)的多核苷酸。在示例性实施方案中,经修饰的ω-羟化酶具有经修饰的细胞色素P450单加氧酶(P450)的酶活性,并在体内有效地催化烃链的ω-位置的羟基化。因此,当在来自可再生原料的碳源存在下在发酵液中生长时,重组微生物体内产生中链omega-羟基化(ω-羟基化)脂肪酸衍生物(参见例如,PCT申请公开WO 2014/201474)。
在其他示例性实施方案中,除了具有改善的木糖利用或改善的葡萄糖和木糖共利用的工程改造XylR变体之外,重组宿主细胞进一步包含编码烷烃羟化酶(例如alkA、CYP153A-还原酶或CYP153A-还原酶杂合融合多肽变体(参见,例如,WO 2015/195697))的多核苷酸,使得当在有效表达烷烃羟化酶(例如AlkA、CYP153或CYP153A-还原酶杂合融合多肽变体)和具有改善的木糖利用或改善的葡萄糖和木糖共利用的工程改造的XylR变体的条件下,在含有碳源的培养基中培养时,重组宿主细胞产生omega-羟基化(ω-羟基化)的和双官能的脂肪酸衍生物及其组合物(包括ω-羟基化脂肪酸、ω-羟基化脂肪酸酯、α,ω-二酸、α,ω-二酯、α,ω-二醇和由其衍生的化学品,例如大内酯和大环酮)。
V.重组宿主细胞的培养和发酵
如本文所用,发酵广义上是指通过重组宿主细胞将有机材料转化为目标物质。例如,这包括通过在包含碳源的培养基中繁殖重组宿主细胞的培养物,由重组宿主细胞将碳源转化为脂肪酸衍生物,比如例如脂肪酸、脂肪酸酯、脂肪醇、脂肪醇乙酸酯等。允许产生目标物质比如例如脂肪酸,脂肪酯,脂肪醇,脂肪醇乙酸酯等的条件是允许宿主细胞产生所期望产物例如脂肪酸衍生物组合物的任何条件。合适的条件包括例如典型的发酵条件,参见例如,Principles of Fermentation Technology[发酵技术原理],第3版(2016),同上;Fermentation Microbiology and Biotechnology[发酵微生物学和生物技术],第2版,(2007),同上。
发酵条件可以包括本领域众所周知的许多参数,包括但不限于温度范围、pH水平、通气速率、进料速率和培养基组成。这些条件中的每一个单独地或组合地允许宿主细胞生长。发酵可以是需氧的、厌氧的或其变化(例如微需氧)。示例性培养基包括液体培养基(液体)或凝胶(固体)。通常,培养基包括可以被宿主细胞直接代谢的碳源(例如,衍生自可再生原料的简单碳源)。另外,可以在培养基中使用酶来有助于碳源的动员(例如,将淀粉或纤维素解聚为可发酵的糖)以及随后的代谢以产生脂肪酸衍生物。
对于小规模生产,工程改造以产生脂肪酸衍生物组合物的宿主细胞可以例如约100μL、200μL、300μL、400μL、500μL、1mL、5mL、10mL、15mL、25mL、50mL、75mL、100mL、500mL、1L、2L、5L或10L的批次生长;发酵;并诱导以表达所期望的多核苷酸序列,例如编码具有特定酶活性(例如硫酯酶(TE)、酯合酶(ES)、羧酸还原酶(CAR)、醇脱氢酶(ADH)、脂肪酰基CoA/ACP还原酶(FAR)、酰基-CoA还原酶(ACR)、乙酰基CoA羧化酶(ACC)和/或酰基ACP/CoA还原酶(AAR)的酶促活性)的多肽的多核苷酸。为了大规模生产,工程改造的宿主细胞可以在体积为约10L、100L、1000L、10,000L、100,000L、1,000,000L或更大的培养物中生长;发酵,并诱导以表达任何所期望的多核苷酸序列。
本文公开的脂肪酸衍生物组合物通常可以在重组宿主细胞培养物的细胞外环境中发现,并且可以容易地从培养基中分离。脂肪酸衍生物(例如脂肪酸、脂肪酸酯、脂肪醛、脂肪酮、脂肪醇、脂肪醇乙酸酯等)可以由重组宿主细胞分泌,运输到细胞外环境或被动转移到重组宿主细胞培养物的细胞外环境中。可以使用本领域已知的常规方法,包括但不限于离心,从重组宿主细胞培养物中分离脂肪酸衍生物组合物。
适合用作生产宿主细胞的示例性微生物包括例如细菌、蓝细菌、酵母、藻类、丝状真菌等。为了产生脂肪酸衍生物组合物,将生产宿主细胞(或等同地,宿主细胞)工程改造以包含相对于非工程改造的或天然的宿主细胞被修饰的脂肪酸生物合成途径,例如,如上所述以及如例如在美国专利申请公开2015/0064782中公开的那样进行工程改造。工程改造以包含经修饰的脂肪酸生物合成途径的生产宿主能够有效地将葡萄糖或其他可再生原料转化为脂肪酸衍生物。已经建立了用于高密度发酵以生产各种化合物的方案和程序(参见例如,美国专利号8,372,610;8,323,924;8,313,934;8,283,143;8,268,599;8,183,028;8,110,670;8,110,093;和8,097,439)。
在一些示例性实施方案中,生产宿主细胞在包含约20g/L至约900g/L的碳源(简单碳源)的初始浓度的培养基(例如,发酵培养基)中培养。在其他实施方案中,培养基包含约2g/L至约10g/L;约10g/L至约20g/L;约20g/L至约30g/L;约30g/L至约40g/L;或约40g/L至约50g/L的碳源的初始浓度。在一些实施方案中,可以在发酵过程中监测培养基中可用碳源的水平。在一些实施方案中,所述方法进一步包括当培养基中的初始碳源的水平小于约0.5g/L时,向培养基中添加补充碳源。
在一些示例性实施方案中,当培养基中碳源的水平小于约0.4g/L、小于约0.3g/L、小于约0.2g/L、或小于约0.1g/L时,向培养基中添加补充碳源。在一些实施方案中,添加补充碳源以维持约1g/L至约25g/L的碳源水平。在一些实施方案中,添加补充碳源以维持约2g/L或更高(例如,约2g/L或更高,约3g/L或更高,约4g/L或更高)的碳源水平。在某些实施方案中,添加补充碳源以维持约5g/L或更低(例如,约5g/L或更低,约4g/L或更低,约3g/L或更低)的碳源水平。在一些实施方案中,添加补充碳源以维持约2g/L至约5g/L、约5g/L至约10g/L或约10g/L至约25g/L的碳源水平。
在一个示例性实施方案中,用于发酵的碳源衍生自可再生原料。在一些实施方案中,碳源是葡萄糖。在其他实施方案中,碳源是丙三醇。其他可能的碳源包括但不限于果糖、甘露糖、半乳糖、木糖、阿拉伯糖、淀粉,纤维素、半纤维素、果胶,木聚糖、蔗糖、麦芽糖,纤维二糖、松二糖、乙酸、乙烷、乙醇、甲烷、甲醇、甲酸和一氧化碳;纤维素材料及其变体,例如半纤维素、甲基纤维素和羧甲基纤维素钠;饱和的或不饱和的脂肪酸、琥珀酸酯、乳酸酯和乙酸酯;醇,例如乙醇、甲醇和丙三醇,或它们的混合物。在一个实施方案中,碳源衍生自玉米、甘蔗、高粱、甜菜、柳枝稷、青贮饲料、秸秆、木材、纸浆、污水、垃圾、纤维素城市废物、烟气、合成气或二氧化碳。简单碳源也可以是光合作用的产物,例如葡萄糖或蔗糖。在一个实施方案中,碳源衍生自废物,例如丙三醇、烟气或合成气;或衍生自有机材料例如生物质的重整制;或衍生自天然气或甲烷,或衍生自这些材料重整制为合成气;或衍生自通过光合作用固定的二氧化碳,例如,可以通过重组蓝细菌或藻类通过光合作用生长并使用CO
在一些实施方案中,碳源是衍生自生物质的纤维素水解产物。纤维素水解产物在本领域中是已知的(参见例如,Yang,B.,等人(2011)Biofuels[生物燃料]2(4):421)。生物质的示例性来源是植物物质或植被,例如玉米、甘蔗或柳枝稷。生物质的另一示例性来源是代谢废物,例如动物物质(例如牛粪)。生物质的其他示例性来源包括藻类和其他海洋植物。生物质还包括来自工业、农业、林业和家庭的废物,包括但不限于发酵废物、青贮饲料、秸秆、木材、污水、垃圾、纤维素城市废物、市政固体废物、以及剩余的食物。
在一些示例性实施方案中,以约0.5g/L至约40g/L的浓度产生脂肪酸衍生物,例如,脂肪酸、脂肪酸酯、脂肪醇等。在一些实施方案中,以约1g/L或更高(例如,约1g/L或更高,约10g/L或更高,约20g/L或更高,约50g/L或更高,约100g/L或更高)的浓度产生脂肪酸衍生物。在一些实施方案中,以约1g/L至约170g/L、约1g/L至约10g/L、约40g/L至约170g/L、约100g/L至约170g/L、约10g/L至约100g/L、约1g/L至约40g/L、约40g/L至约100g/L或约1g/L至约100g/L的浓度产生脂肪酸衍生物。
在其他示例性实施方案中,以约25mg/L、约50mg/L、约75mg/L、约100mg/L、约125mg/L、约150mg/L、约175mg/L、约200mg/L、约225mg/L、约250mg/L、约275mg/L、约300mg/L、约325mg/L、约350mg/L、约375mg/L、约400mg/L、约425mg/L、约450mg/L、约475mg/L、约500mg/L、约525mg/L、约550mg/L、约575mg/L、约600mg/L、约625mg/L、约650mg/L、约675mg/L、约700mg/L、约725mg/L、约750mg/L、约775mg/L、约800mg/L、约825mg/L、约850mg/L、约875mg/L、约900mg/L、约925mg/L、约950mg/L、约975mg/L、约1000mg/L、约1050mg/L、约1075mg/L、约1100mg/L、约1125mg/L、约1150mg/L、约1175mg/L、约1200mg/L、约1225mg/L、约1250mg/L、约1275mg/L、约1300mg/L、约1325mg/L、约1350mg/L、约1375mg/L、约1400mg/L、约1425mg/L、约1450mg/L、约1475mg/L、约1500mg/L、约1525mg/L、约1550mg/L、约1575mg/L、约1600mg/L、约1625mg/L、约1650mg/L、约1675mg/L、约1700mg/L、约1725mg/L、约1750mg/L、约1775mg/L、约1800mg/L、约1825mg/L、约1850mg/L、约1875mg/L、约1900mg/L、约1925mg/L、约1950mg/L、约1975mg/L、约2000mg/L(2g/L)、3g/L、5g/L、10g/L、20g/L、30g/L、40g/L、50g/L、60g/L、70g/L、80g/L、90g/L、100g/L或由前述值中的任何两个所界定的范围的滴度产生脂肪酸衍生物,例如,脂肪酸、脂肪酸酯、脂肪醇等。在其他实施方案中,以大于100g/L、大于200g/L或大于300g/L的滴度产生脂肪酸衍生物或其他化合物。在示例性实施方案中,根据本文公开的方法由重组宿主细胞产生的脂肪酸衍生物或其他化合物的滴度是5g/L至200g/L、10g/L至150g/L、20g/L至120g/L以及30g/L至100g/L。滴度可以指由给定的重组宿主细胞培养物产生的特定的脂肪酸衍生物或脂肪酸衍生物的组合或另一种化合物或其他化合物的组合。在示例性实施方案中,工程改造的XylR变体在重组宿主细胞例如大肠杆菌中的表达与表达相应野生型多肽的重组宿主细胞相比导致产生更高的滴度。在一个实施方案中,更高的滴度范围是至少约5g/L至约200g/L。
在其他示例性实施方案中,根据本公开的方法经工程改造以产生脂肪酸衍生物(例如,脂肪酸、脂肪酸酯、脂肪醇等)的宿主细胞具有至少1%、至少2%、至少约3%、至少约4%、至少约5%、至少约6%、至少约7%、至少约8%、至少约9%、至少约10%、至少约11%、至少约12%、至少约13%、至少约14%、至少约15%、至少约16%、至少约17%、至少约18%、至少约19%、至少约20%、至少约21%、至少约22%、至少约23%、至少约24%、至少约25%、至少约26%、至少约27%、至少约28%、至少约29%或至少约30%或由前述值中的任何两个所界定的范围的产率。在其他实施方案中,以大于约30%、大于约35%、大于约40%、大于约45%、大于约50%、大于约55%、大于约60%、大于约65%、大于约70%、大于约75%、大于约80%、大于约85%、大于约90%的产率产生一种脂肪酸衍生物或多种脂肪酸衍生物或一种或多种其他化合物。可替代地或另外地,产率是约30%或更低、约27%或更低、约25%或更低或约22%或更低。在另一个实施方案中,产率是约50%或更低、约45%或更低、或约35%或更低。在另一个实施方案中,产率是约95%或更低、或90%或更低、或85%或更低、或80%或更低、或75%或更低、或70%或更低、或65%或更低、或60%或更低、或55%或更低、或50%或更低。因此,产率可以以上两个端点中的任何两个为边界。例如,根据本文公开的方法由重组宿主细胞产生的脂肪酸衍生物的产率可以是约5%至约15%、约10%至约25%、约10%至约22%、约15%至约27%。产率可以指特定的脂肪酸衍生物或脂肪酸衍生物的组合。另外,产率也将取决于所使用的原料。
在一些示例性实施方案中,根据本公开的方法经工程改造以产生脂肪酸衍生物(例如,脂肪酸、脂肪酸酯(例如FAME,FAEE)、脂肪醇等)的宿主细胞的生产力是至少100mg/L/小时、至少200mg/L/小时、至少300mg/L/小时、至少400mg/L/小时、至少500mg/L/小时、至少600mg/L/小时、至少700mg/L/小时、至少800mg/L/小时、至少900mg/L/小时、至少1000mg/L/小时、至少1100mg/L/小时、至少1200mg/L/小时、至少1300mg/L/小时、至少1400mg/L/小时、至少1500mg/L/小时、至少1600mg/L/小时、至少1700mg/L/小时、至少1800mg/L/小时、至少1900mg/L/小时、至少2000mg/L/小时、至少2100mg/L/小时、至少2200mg/L/小时、至少2300mg/L/小时、至少2400mg/L/小时、2500mg/L/小时、或高达10g/L/小时(取决于细胞量)。例如,根据本公开的方法由重组宿主细胞产生的丙二酰-CoA衍生的化合物(包括一种或多种脂肪酸衍生物或一种或多种其他化合物)的生产力可以是500mg/L/小时至2500mg/L/小时,或从700mg/L/小时至2000mg/L/小时。生产力可以指由给定宿主细胞培养物产生的特定14碳和/或16碳脂肪酸衍生物或脂肪酸衍生物或一种或多种其他化合物的组合。例如,工程改造的XylR变体在重组宿主细胞例如大肠杆菌中的表达与表达相应野生型多肽的重组宿主细胞相比导致14碳和/或16碳脂肪酸衍生物或其他化合物的生产力增加。在示例性实施方案中,更高的生产力在约0.3g/L/h至约3g/L/h至约10g/L/h至约100g/L/h至约1000g/L/h的范围内。
VI.分离
生物产物(例如包含本文公开的利用如上所述的重组宿主细胞产生的脂肪酸衍生物的组合物)典型地通过本领域已知的方法从发酵液中分离。在一个示例性实施方案中,组合物(包含本文公开的利用如上所述的重组宿主细胞产生的脂肪酸衍生物)通过重力沉降、离心或倾析从发酵液中分离。
VII.脂肪酸衍生物的组合物和配制品
如上所述,生物产物(例如包含利用如上详述的重组宿主细胞产生的脂肪酸和脂肪酸衍生物的组合物)由可再生来源(例如,由可再生原料衍生的简单碳源)产生,并且因此是新的物质组合物。根据双碳同位素指纹法或
提供以下实例以举例说明,但不限制本发明。
实施例
以下具体实施例旨在说明本公开,并且不应被解释为限制权利要求的范围。
实施例1
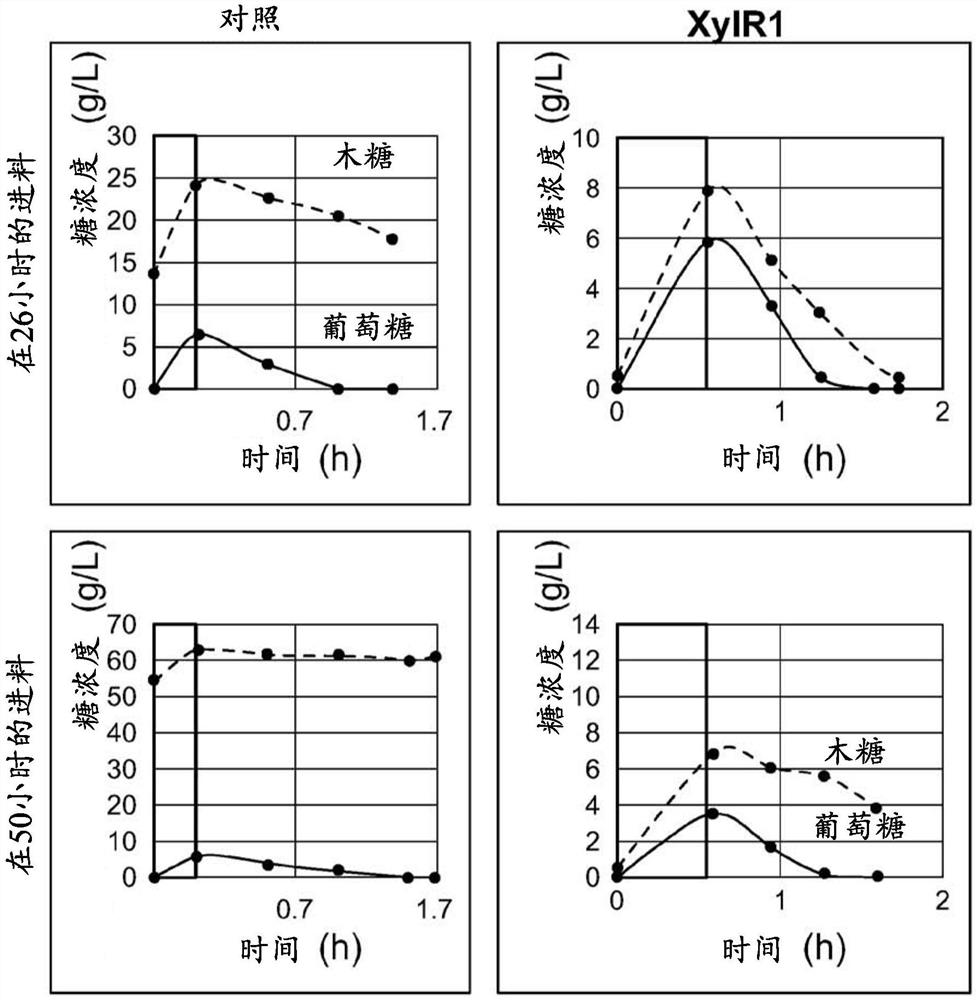
该实施例说明,与野生型xylR对照相比,大肠杆菌XylR中的单个氨基酸取代突变(XylR E382K)增加了木糖利用并增加了木糖共利用。
菌株IC.200(IC.187XylR野生型pSven.037;对照)和sven.938(IC.187 XylR1pSven.037;XylR1)最初在LB培养基中扩增,然后在32℃下于含有基础盐培养基的摇瓶中过夜(2g/L NH
生物反应器以如下运行参数来运行:pH=7.2,温度=30.5℃,气流=0.5v/v/m,溶解氧为30%饱和度。
将葡萄糖和木糖的50∶50混合物(进料中总糖浓度为610g/L)的糖进料(至总初始体积为50g/L)按需通过溶解氧触发的控制器添加到生物反应器中。应答于培养物的代谢活性的减慢(这反映为由于生物反应器中糖浓度降低,残留溶解氧浓度相应上升)而自动添加这些进料中的每一个。一旦残留溶解氧浓度值上升到高于溶解氧设定点的某个预定偏移,进料控制器将触发下一次向生物反应器中添加糖的操作。
在接种生物反应器后约26和50小时,用取得的另外生物反应器样品(以黑点表示)跟踪了其中的两次进料。
典型地在进入发酵10个小时左右诱导培养物,因此选择26小时的时间点,因为这是培养物被完全诱导并在年轻健康细胞中以最大速率产生FAME的时间点。细胞正在以接近其最高能力地使用糖。选择50小时的时间点,因为这是培养物已经诱导并生产持续约40小时的时间点,因此细胞比26小时时更老,并且处于不同的健康状态。细胞有些疲乏,利用率开始正常下降(WT XylR情况下,但不是XylR1情况下)。
进料的持续时间显示在矩形框(图1)中,进料的添加结束是x轴上的零点。使用高效液相色谱法(HPLC)在这些进料中的每次进料的开始和结束时测量样品上清液中残留的葡萄糖(实线)和木糖(虚线)浓度,高效液相色谱法还用于用于在随后的一段时间内测量残留的葡萄糖和木糖,直到下一次进料开始,以定量确定培养物的葡萄糖和木糖消耗水平。
下表中列出了两种菌株在两个测试时间点(26和50小时EFT)的计算的葡萄糖和木糖利用率。所有进料的开始时残留的葡萄糖为零。
如图1和上表所示,对照菌株有效利用葡萄糖,但不利用木糖。在26小时在进料开始时,对照菌株中的残留木糖浓度很高(13.7g/L),但残留葡萄糖为零。这表明尽管每次进料葡萄糖都被充分利用,但木糖并不是这样,因此随着时间的推移木糖在生物反应器中积累。进料后约1.5小时进一步取样显示木糖水平降低,但是到残留葡萄糖水平恢复到零时,木糖水平仍保持升高,增至约17.5g/L。在50小时时,残余葡萄糖水平再次为零,但是木糖水平进一步增加(54.6g/L),表明对照菌株没有有效地利用木糖。进料后约1.5小时进一步取样显示木糖水平未降低,而残留葡萄糖浓度恢复为零。
相反,在表达XylR1突变体(E382K)的菌株中,在26小时在进料开始时,对照菌株中的残留木糖浓度很低(0.5g/L),并且残留葡萄糖为零。进料后约1.5小时进一步取样显示木糖与葡萄糖几乎下降至零。在50小时时,残留葡萄糖浓度再次为零,并且残留木糖浓度基本上也是如此。进料后约1.5个小时进一步取样显示木糖水平从约6.5g/L的高位降至约4g/L水平。因此,即使在葡萄糖存在下,XylR1突变体也表现出增加的木糖利用。
实施例2
该实施例说明表达XylR1突变体的细胞在木糖存在下显示改善的生长,并且改善的生长是由于改善的木糖利用。
IC.187是带有未修饰的xylR基因座的大肠杆菌细胞(XylR WT)。sven.903与IC.187是等基因的,但在xylR基因座中具有点突变E382K。两种菌株都不存在质粒,因此在这种情况下不产生FAME。
IC.187和sven.903以高通量生长。将细胞作为种子培养物在含有10g/L丙三醇或10g/L葡萄糖的种子基础培养基中于32℃以250RPM(每分钟转数)振荡培养过夜。然后将百分之二十的接种物添加到含10g/L木糖的基础培养基中,并在32℃以250RPM振荡培养。然后通过OD600读数在8小时测量生长。种子基础培养基=1X痕量维生素、0.001mg/mL硫胺素、0.1mM CaCl
从图2中可以看出,表达野生型xylR的菌株(IC.187)(无论是从葡萄糖还是丙三醇种子开始)比表达xylR1(E382K)突变体的菌株生长得更慢。因此,表达xylR1突变体的细胞在木糖存在下无论是否从葡萄糖或丙三醇种子培养物转变都显示出改善的生长。
从先前的实验中知道,种子培养物完成生长后,葡萄糖或丙三醇被完全消耗。葡萄糖通过碳分解代谢物阻遏来抑制木糖操纵子,而丙三醇是不抑制木糖操纵子的中性糖。因此,无论是从显示碳分解代谢物阻遏作用的糖转变还是从中性糖转变,在xylR1突变时细胞用木糖生长更快,表明在两种情况下木糖利用率都更高。
实施例3
该实施例说明了具有改善的木糖利用和/或改善的葡萄糖和木糖共利用的新的XylR突变体的构建和测试。
将野生型XylR核酸(SEQ ID NO:2)克隆到模板质粒pSven.178中。使用转移PCR(tPCR)产生突变体,随后测试其允许用木糖生长的能力。使用本领域已知的方法进行转移PCR。
简而言之,构建了模板质粒(pSven.178=p15A-lacI-PxylR-xylR(WT)-KanR)。所述质粒包含与xylR基因组序列的上游和下游同源性,这对于将所得XylR突变体进行基因组整合到大肠杆菌中是必需的。使用模板质粒以及包含所期望的突变的正向(5′-3′)引物和反向引物的组合进行转移PCR。然后使用外部引物(其扩增含有多样性和同源性区域的序列)用PCR从tPCR模板扩增。
用限制酶(Dpn1)切割扩增的突变体,以释放诱变的XylR基因和用于整合的同源区域。包含XylR突变和同源区域的线性DNA产物被整合到大肠杆菌菌株sven.999的xylR基因座中。(参见例如Datsenko和Wanner,2000,PNAS[美国国家科学院院刊],97(12),6640-6645)。
sven.999菌株包含天然XylR基因的缺失并且无法在含有木糖作为唯一碳源的基础培养基上生长。因此,只有已经整合了具有利用木糖的能力的XylR突变体的细菌才能在基本平板上生长。
一旦获得了在ΔxylR基因座中包含xylR突变体的菌落,就可以使用连续传代方法来鉴定xylR变体,所述变体可以支持在含有木糖的基础培养基上生长。
分离并筛选了来自连续传代方法的菌落,用于与含有WT xylR蛋白和xylR2(R121C)的对照菌株进行生长比较。
表3和图3-8说明了在含有木糖的基础培养基中,xylR突变体的生长与WT xylR相比如何。
为了测量用木糖的生长,针对在具有木糖的基础培养基中生长筛选对照菌株KTT.560(WT XylR)、sCR.002(XylR2 R121C)和sven.996(ΔxylR)以及各种xylR突变菌株。菌落最初在LB培养基上生长4-6小时,然后转移到含有有限的磷酸盐和其他营养素以及作为碳源的丙三醇的基础培养基中。培养物生长过夜,并用于继代培养到含有作为碳源的木糖的新鲜磷酸盐限制型基础培养基中。定期在600nm波长(OD600)下测量培养物的光密度(OD),以测量菌株相对于对照的生长。显示的所有数据是每个菌株的3个重复的平均值。
表3:与对照相比,XylR蛋白中的点突变,核苷酸密码子变化以及用木糖生长的突变体的排名
表3注释:μ和FOIC排名标准。+至多提高50%;++提高50%至100%;+++提高100%以上;-至多降低25%;--降低25%至50%;---降低50%以上。μ是以时间单位倒数定义的细胞生长速率。它是每单位时间细胞数量变化的量度。
相对于具有WT XylR的对照菌株KTT.560进行了所有比较。对照是KTT.560=WTxylR;sCR.002=xylR2;sven.996=ΔxylR;sDH.687=KTT.560pDH.138;sven.954=KTT.560xylR2 pDH.138;sVen.1053=KTT.560ΔxylR pDH.138。
FOIC=相比于内部对照的倍数。内部对照=WTXylR(KTT.560)。对数中期过程中的突变菌株的OD600表示为比对照菌株KTT.560高的倍数。所有最终的生产菌株均包含生产质粒pDH.138,其包含除烃海杆菌(Marinobacterhydrocarbonoclasticus)酯合酶。质粒pDH.138是生产质粒,包含SC101复制起点、大观霉素抗性、IPTG诱导型PTrc启动子和酯合酶变体。质粒的基因型描述如下:
ori_SC101、repA、par、aadA1-终止子(B1004)、lacIq-终止子(T22)、Ptrc_接头D_IGR19-ES50_term(rrnB_T1T2)
进一步测试了选择的XylR突变体在木糖基础培养基上的生长,并确定了它们产生各种脂肪酸种类(FAS)的能力。如上所述,通过定期测量OD 600来监测生长。使用本领域已知的标准方法测量FAS产生。
表4和图9-16说明了与在含有木糖的基础培养基中生长的WT xylR相比,各种XylR突变体在FAS产生方面的木糖利用和生产力。
表4:xylR突变体与WT xylR相比的性能指标,以及与对照相比的排名
表4注释:木糖消耗和FAS产生排名。+至多提高10%;++提高10%至20%;+++提高20%以上;-至多降低10%;--降低10%至20%;---降低20%以上。相对于具有WT XylR的对照菌株sDH.687进行了所有比较。
实施例4
该实施例说明了SEQ ID NO:1的位置121处的突变,其在重组宿主细胞中表达时赋予宿主细胞比除表达SEQ ID NO:1之外在其他方面相同的等基因宿主细胞更快消耗木糖的能力。
表5列出了相对于野生型序列在位置121处的特异性取代及其对木糖消耗的影响。通过引用将国际申请号PCT/US2014/027337并入本文。
表5:解除分解代谢物阻遏的氨基酸取代
附录A
SEQ ID NO:1XylR野生型蛋白序列(Genbank#NC_000913;大肠杆菌K-12 MG1655;Blattner和Plunkett,1997;NCBI蛋白ID:NP_418026)
SEQ ID NO:2XylR WT DNA序列(Genbank#NC_000913;大肠杆菌K-12 MG1655;Blattner和Plunkett,1997;NCBI蛋白ID:NP_418026)
SEQ ID NO:3(E382K)蛋白序列:
SEQ ID NO:4XylR1(E382K)DNA序列:
对于本领域技术人员显而易见的是,在不脱离本公开的精神和范围的情况下,可以对上述方面和实施方案进行各种修改和变化。
- 用于改善的木糖利用或改善的葡萄糖和木糖共利用的XYLR突变体
- 共利用葡萄糖和木糖产生木糖醇的工程菌株的构建及应用
