用于治疗B细胞恶性肿瘤的CD22特异性T细胞受体和过继性T细胞疗法
文献发布时间:2023-06-19 11:55:48
技术领域
本发明涉及免疫疗法领域,特别是癌症的过继性T细胞疗法或T细胞受体(TCR)基因疗法。本发明提供了一种核酸,其编码至少一种TCR构建体的TCRα或TCRβ链构建体,该TCR构建体能够与在HLA-A*02:01的情况下、衍生自B细胞谱系特异性抗原CD22的SEQ ID NO:1表示的肽特异性结合。本发明还提供表达所述TCR构建体的相应蛋白质和宿主细胞(优选CD8
背景技术
B细胞衍生的肿瘤仍然是西方世界主要的死亡原因之一。在德国,预计每年约有1,500-2,000例新的高级别B细胞淋巴瘤病例。在这些患者中,多达40%会在初始的标准治疗后复发或一开始就没有应答,这表明迫切需要一些替代的治疗方案。淋巴瘤的发病率随年龄急剧增加。对于许多75岁以上的患者,预后要差得多。大约75%的急性淋巴细胞白血病(ALL)病例源自转化的淋巴细胞(B谱系ALL)。在德国预计每年约有1,000个人患有B谱系ALL。虽然患有ALL儿童可以治愈,但是患有ALL的老年人(该病在80岁左右时有第二个发病高峰)很难治疗,这是由于该病对老年个体的生物侵袭性以及常有的合并症和脆弱造成的。尽管化学疗法在毒性和耐药性发展方面存在局限性,但它仍然是大多数癌种的主要治疗选择。一线治疗后,即使采用大剂量化学疗法辅以干细胞抢救可以挽救低于三分之一的复发性/难治性疾病患者。患有复发性或原发难治性弥漫性大B细胞淋巴瘤的患者不适合进行大剂量化疗,挽救疗法失败,从而几乎没有治愈的选择,这种疾病通常在几个月内导致死亡。
靶向B细胞谱系特异性细胞表面蛋白(例如CD19、CD20或CD22)的抗体(人源化裸抗体或不同的免疫缀合物)或嵌合抗原受体(CARs)已用于消灭恶性淋巴细胞,但其代价是也耗尽了正常B细胞。
CARs是能够识别与TCR域结合的细胞表面抗原的抗体的抗原结合域的嵌合体。经过工程改造以表达CAR的T细胞因此可以靶向表达CAR结合的抗原的细胞,而不受任何HLA限制。
例如,已证明靶向CD19的CAR T细胞在约50%的复发性弥漫性大B细胞淋巴瘤(DLBCL)患者中成功,证明了过继性T细胞疗法的潜力。近来,使用针对B细胞抗原CD19的嵌合抗原受体基因转移的过继性T细胞疗法(ATT)的临床研究取得了显著成功,被称为“突破性癌症疗法”。几个小组正在开发这一相同的策略,主要是通过靶向B细胞谱系的抗原,例如CD19、CD20和CD22。
CD22,也称为淋巴细胞细胞粘附分子或BL-CAM,是一种经过验证的在正常和肿瘤B细胞上强表达的靶抗原。长期以来,人们一直认为抗原具有严格的谱系特异性,最近报道了在体外分化的巨噬细胞和树突状细胞中表达较弱(Jahn等人2016Oncotargets 7:71536-71546)。例如,单克隆抗CD22抗体如epratuzumab(
TCR是免疫球蛋白超级家族的异源二聚体细胞表面蛋白,其与参与介导信号转导的CD3复合体的不变蛋白(invariant protein)关联。TCR以αβ和γδ形式存在,它们在结构上相似,但是具有截然不同的结构位置和可能截然不同的功能。天然异源二聚体αβTCR的α和β链是跨膜蛋白,每个蛋白都包含两个胞外结构域、一个膜近端恒定域和一个膜远端可变域。恒定域和可变结构域中的每一个都包含链内二硫键。可变域包含高多态性的环,这些环具有与抗体的互补决定区(CDR)类似的识别特异性。
每个TCR链的可变区均包含可变片段和连接片段,对于β链,还包含一个多样性片段。每个可变区包括嵌入框架序列中的三个CDR(互补决定区),其中一个是称为CDR3的高变区。通过其框架(CDR1和CDR2序列)以及通过部分定义的CDR3序列,可以区分几种类型的α链可变区(Vα)和几种类型的β链可变区(Vβ)。IMGT(国际ImMunoGeneTics信息系统)命名法为Vα或Vβ赋予唯一的“TRAV”或“TRBV”编号。T细胞受体对抗原表位的特异性主要由CDR3区决定(Danska等人,1990.J.Exp.Med.172:27-33;Garcia等人,2005.Cell122(3):333-336)。
TCR基因疗法的使用可以促使患者自身的T细胞具有所需的特异性,并在短时间内产生大量T细胞,从而避免他们的耗尽。TCR可以被转导到中央记忆T细胞或具有干细胞样特性的T细胞(T
Jahn等人在2016年公开了靶向CD22表位的TCR。(Oncotargets7:71536-71546)。已从HLA-B7阴性个体中分离出该TCR,该个体具有与CD22肽结合的HLA-B7四聚体。由于这种策略,只有HLA-B7 MHC单倍型的个体(约占人口的15-20%)适于使用此TCR进行治疗。
发明内容
鉴于此,本发明人解决了该问题,提供了能够特异性地靶向CD22表位的有利的TCR构建体,该CD22表位适用于治疗百分比更高的B细胞淋巴瘤或B细胞白血病患者。该问题通过权利要求的主题解决。
发明人提供了在HLA-A*02的情况下识别CD22表位的TCR构建体,HLA-A*02是在约45%的白种人/西欧人口中表达的MHC单倍型。特别地,本发明提供的优选的TCR构建体在HLA-A*02的情况下识别SEQ ID NO:1所示的肽,其中TCR α链构建体包括SEQ ID NO:4所示的CDR3序列,和/或TCR β链构建体包括SEQ ID NO:22所示的CDR3序列。本发明提供的其他TCR构建体在HLA-A*02的情况下识别SEQ ID NO:1所示的肽,其中TCR α链构建体包括CDR3序列。SEQ ID NO:4所示的CDR3序列,和/或其中TCR β链构建体包括SEQ ID NO:7所示的CDR3序列。
在本发明的上下文中,HLA-A*02是指HLA-A*02:01、HLA-A*02:04、05、07、10中的任何一种,以及可能的HLA-A*02的其他亚型,但不是HLA-A*02:02和HLA-A*02:08。由于可以通过本领域已知的方法进一步优化亲和力和特异性,如下文更详细地描述,因此本发明还提供了一种编码至少一个TCRα或β链构建体的核酸,所述TCR构建体在HLA-A*02的情况下,能够特异性结合SEQ ID NO:1所示的肽,
其中TCRα链构建体包括氨基酸序列(aa-)与SEQ ID NO:4相比具有至少83%,优选至少90%氨基酸序列同一性的CDR3序列,和/或TCRβ链构建体包括与氨基酸序列相同的CDR3序列。与SEQ ID NO:22相比具有至少83%,优选至少90%的序列同一性或与SEQ IDNO:7相比具有至少83%,优选至少90%序列同一性的CDR3序列。
因此,发明人提供了两个截然不同但高度相似的TCR β链构建体,它们都与相同的TCRα链构建体配对,并形成特异性识别SEQ ID NO:1所示的肽的TCR构建体。优选地,它们对非CD22自身肽没有显著的交叉反应性。本发明的TCRβ链构建体仅在CDR3的两个氨基酸上彼此不同。
有利地,发明人可以显示出本发明的TCR构建体具有高的功能亲和力(avidity),表现为识别和杀死表达不同水平的CD22的靶细胞,包括从患者获得的表达CD22的肿瘤细胞或肿瘤细胞系(参见实施例)。本发明优选的TCR构建体的K
在第一个实施方案中,在本发明的核酸中,被编码的TCR α链构建体包括:
与SEQ ID NO:2相比具有至少83%,优选至少90%序列同一性的CDR1序列;
与SEQ ID NO:3相比具有至少83%,优选至少90%序列同一性的CDR2序列;
以及与SEQ ID NO:4相比具有至少83%,优选至少90%序列同一性的CDR3序列;
和/或TCRβ链构建体包括:
4)与SEQ ID NO:5相比具有至少83%,优选至少90%序列同一性的CDR1序列;
5)与SEQ ID NO:6相比具有至少83%,优选至少90%序列同一性的CDR2序列;
6)以及与SEQ ID NO:7相比具有至少83%,优选至少90%序列同一性的CDR3序列。
优选地,与各自的CDR相比所有氨基酸的同一性至少为90%。
优选地,在本发明的核酸中,被编码的TCR α链构建体包括与SEQ ID NO:2相比具有至少90%序列同一性的CDR1序列、与SEQ ID NO:3相比具有至少90%序列同一性的CDR2序列、以及SEQ ID NO:4所示的CDR3序列;
和/或TCRβ链构建体包括与SEQ ID NO:5相比具有至少90%序列同一性的CDR1序列、与SEQ ID NO:6相比具有至少90%序列同一性的CDR2序列以及SEQ ID NO:7所示的CDR3。
任选地,在本发明的核酸中,被编码的TCRα链构建体包括与SEQ ID NO:2相比具有至少95%序列同一性的CDR1序列、与SEQ ID NO:3相比具有至少95%序列同一性的CDR2序列以及SEQ ID NO:4所示的CDR3序列;和/或TCRβ链构建体包括与SEQ ID NO:5相比具有至少95%序列同一性的CDR1序列、与SEQ ID NO:6相比具有95%序列同一性的CDR2序列以及SEQ ID NO:7所示的CDR3序列。
优选地,在本发明的核酸中,被编码的TCRα链构建体包括SEQ ID NO:2所示的CDR1序列、SEQ ID NO:3所示的CDR2序列和SEQ ID NO:4所示的CDR3序列;和/或TCRβ链构建体包括SEQ ID NO:5所示的CDR1序列,SEQ ID NO:6所示的CDR2序列和SEQ ID NO:7所示的CDR3序列。
在本发明的核酸中,被编码的TCRα链构建体可以包含与SEQ ID NO:16相比具有至少90%序列同一性的可变区(没有前导序列,即,没有aa 1-20),和/或TCR β链构建体可以包括与SEQ ID NO:19相比具有至少90%序列同一性的可变区(没有aa 1-25)。前导序列来自aa 12-25。TCR链通常不包含前导序列。在各个实验中,具有此序列的TCR命名为CD22TCR。
任选地,在本发明的核酸中,TCR α链构建体包括与SEQ ID NO:16相比具有至少95%序列同一性的可变区(没有前导序列,即,没有aa 1-20),和/或TCRβ链构建体包括与SEQ ID NO:19相比具有至少95%序列同一性的可变区(没有aa 1-25)。优选地,在此类核酸中,与所定义的CDR1、CDR2和CDR3区域的序列同一性是100%。
优选地,在本发明的核酸中,被编码的TCRα链构建体包括SED ID NO:16的可变区(没有前导序列,即,没有aa 1-20);和/或TCRβ链构建体包括SEQ ID NO:19所示的可变区(没有aa 1-25)。
TCRα链的可变区可以由SEQ ID NO:14或优选地由SEQ ID NO:15(经密码子优化)编码。TCRβ链的可变区可以由SEQ ID NO:17或优选地由SEQ ID NO:18(经密码子优化)编码。
发明人已经确认本发明的另一种TCR构建体,其命名为CD22 TCR 3225。值得注意的是,α链构建体与第一TCR构建体中所定义的相同。β链构建体包括与SEQ ID NO:7相比具有至少83%序列同一性的CDR3序列,即,它可以被认为是第一TCR构建体的β链构建体的优化变体。除了CDR3中的两个氨基酸差异之外,第二TCR构建体的优选β链构建体与第一TCR构建体的优选β链构建体相同。
因此,在第二个优选的实施方案中,在本发明的核酸中,被编码的TCRα链构建体包括:
1)与SEQ ID NO:2相比具有至少83%,优选至少90%的序列同一性的CDR1序列,
2)与SEQ ID NO:3相比具有至少83%,优选至少90%序列同一性的CDR2序列,
3)以及与SEQ ID NO:4相比具有至少83%,优选至少90%序列同一性的CDR3序列;
和/或TCRβ链构建体包括:
4)与SEQ ID NO:20相比具有至少83%,优选至少90%序列同一性的CDR1序列,
5)与SEQ ID NO:21相比具有至少83%,优选至少90%序列同一性的CDR2序列,
6)以及与SEQ ID NO:22相比具有至少83%,优选至少90%的序列同一性的CDR3序列。
比较本发明的第一和第二TCR构建体,它们在β链构建体的CDR3区域中的2个氨基酸不同,表明CDR的序列,例如CDR3的序列可以最多改变两个氨基酸,同时保持或甚至增加对靶表位的亲和力。任选地,在第一和第二TCRβ链构建体的CDR3之间不同的两个氨基酸(即5位和/或6位)或CDR3序列被突变,优选地被其他氨基酸取代,例如保守取代(例如,带负电荷的氨基酸E和D可以互相替换,或者带正电荷的氨基酸R、H和L可以互相替换,或者可以将具有极性侧链的氨基酸S,T,N或Q替换为彼此(优选地,S和T可以彼此替换,或者N和Q可以彼此替换);或者具有疏水侧链的氨基酸G、A、I、L、M、F、W、Y、V可以彼此替换;或者具有芳香侧链的氨基酸可以彼此替换;或具有疏水性非芳香侧链的氨基酸可以彼此替换。
例如,CDR3的5-位可以选自P、E和D,优选选自E和D,最优选为E。
6-位可以选自A、G、I、L、M、F、W、Y、V、S、T、N或Q,优选地选自A、V、I和L,最优选为A。
因此,本发明还提供了一种β链构建体以及包含该β链构建体的TCR构建体,其中CDR3的5-位和6-位是PA或ES,其中CDR3中的其他位置对应于SEQ ID NO:7和22。
优选地,与各自的CDR相比的所有氨基酸同一性至少为90%。
优选地,在本发明的核酸中,被编码的TCRα链构建体包括与SEQ ID NO:2相比具有至少90%序列同一性的CDR1序列、与SEQ ID NO:3相比具有至少90%序列同一性的CDR2序列,以及SEQ ID NO:4所示的CDR3序列;和/或TCRβ链构建体包括与SEQ ID NO:20相比具有至少90%序列同一性的CDR1序列、与SEQ ID NO:21相比具有至少90%序列同一性的CDR2序列以及SEQ ID NO:23所示的CDR3。
任选地,在本发明的核酸中,被编码的TCRα链构建体包括与SEQ ID NO:2相比具有至少95%序列同一性的CDR1序列、与SEQ ID NO:3相比具有至少95%序列同一性的CDR2序列以及SEQ ID NO:4所示的CDR3序列;和/或TCRβ链构建体包括与SEQ ID NO:20相比具有至少95%序列同一性的CDR1序列、与SEQ ID NO:21相比具有至少95%序列同一性的CDR2序列、以及SEQ ID NO:22所示的CDR3序列。
优选地,在本发明的核酸中,被编码的TCRα链构建体包括SEQ ID NO:2所示的CDR1序列、SEQ ID NO:3所示的CDR2序列和SEQ ID NO:4所示的CDR3序列;和/或TCRβ链构建体包括SEQ ID NO:5所示的CDR1序列、SEQ ID NO:6所示的CDR2序列和SEQ ID NO:7所示的CDR3序列。
在本发明的核酸中,被编码的TCRα链构建体可以包括与SEQ ID NO:16相比具有至少90%序列同一性的可变区(没有前导序列,即,没有aa 1-20),和/或TCRβ链构建体可以包括与SEQ ID NO:25相比具有至少90%序列同一性的可变区(无前导序列,即,没有aa 1-14)。任选地,在本发明的核酸中,TCRα链构建体包括与SEQ ID NO:16相比具有至少95%序列同一性的可变区(没有前导序列,即,没有aa 1-20),和/或TCRβ链构建体包括与SEQ IDNO:25相比具有至少95%序列同一性的可变区(没有前导序列,即,没有aa 1-14)。优选地,在此类核酸中,与所定义的CDR1、CDR2和CDR3区相比的序列同一性为100%。
优选地,在本发明的核酸中,被编码的TCRα链构建体包括SEQ ID NO:16的可变区(没有前导序列,即,没有aa 1-20),和/或TCRβ链构建体包括SEQ ID NO:25所示的可变区(没有前导序列,即,没有aa 1-14)。
β链构建体可以包含人TRBV20-1*01-TRBJ2-1*01-TRBD2*02F。
TCRα链构建体的可变区可以由SEQ ID NO:14或优选由SEQ ID NO:15(经密码子优化)编码。TCRβ链构建体的可变区可以由SEQ ID NO:17或优选地由SEQ ID NO:18(经密码子优化的)编码。TCR β链构建体的CDR3区可以由SEQ ID NO:26或优选地由SEQ ID NO:27(经密码子优化的)编码。
优选地,本发明的核酸编码一种TCRα链构建体和一种TCRβ链构建体。在本发明的上下文中,除非另有明确说明,否则“一个(a)”应理解为是指“一个或多个”。因此,例如,由于本发明的TCR构建体同时包含α和β链构建体,因此它可以由一种或两种核酸编码。α和β链构建体一起能够特异性结合至与HLA-A*02络合的SEQ ID NO:1所示的肽。作为中间产物,α和β链构建体以及编码它们的核酸本身也是本发明的主题。
优选地,在本发明的所有TCRα和/或TCRβ链构建体中,与本文所定义的CDR区的序列同一性为100%。
表1优选TCR的CDR
但是,根据本发明提供的定义的CDR3和可变区序列,可以对TCR序列执行亲和力成熟(Chervin等人,2008.J Immunol Methods.339(2):175–84;Robbins et al.,2008.JImmunol.180:6116)。非同义核苷酸取代导致CDR3序列中的氨基酸交换,可能导致TCR对靶抗原的亲和力增强。此外,可变TRA和TRB区域的其他部分中的TCR序列变化可以改变TCR对肽-MHC复合物的亲和力。这可能会增加TCR对肽-MHC的总体亲和力,但存在非特异性识别和交叉反应性增加的风险(Linette等人,2013.Blood 122(6):863–72)。至关重要的是,与所提供的特异性序列不同的TCR保留了对所提供的靶抗原的排他特异性,即,它们不具有交叉反应性。最重要的是,它们与人自身肽不具有交叉反应性。可以针对载有正确MHC等位基因的细胞上已知的自身肽测试TCR的潜在交叉反应性(Morgan等人,2013,J.Immunother.36,133-151)。因此,重要的是表达本发明的TCR构建体的T细胞的过继转移对健康组织没有影响或不产生显著的负面影响。
本发明的TCRα和/或β链构建体可以包括与其天然对应物相应的所有特征或结构域,但这不是必需的。优选地,TCRα和/或β链构建体包括至少一个可变区,或包括一个可变区和一个恒定区,例如,与人可变或恒定TCR区具有至少60%、至少70%、至少80%、至少90%或至少95%的序列同一性的可变区和/或恒定区。对于过继性TCR疗法,优选的是,TCR构建体包括全长TCRα和β链,TCR α和β链包括可变区、恒定区和跨膜区。TCR构建体优选地基本上是人类来源的,以使免疫原性最小化。它也可能完全是人的。因此,编码TCRα和β链构建体的核酸可以分别包括SEQ ID NO:10和SEQ ID NO:13(均为人类的,经密码子优化)。为了防止与内源性TCR链配对,本发明的构建体优选包括与人序列相比的一个或多个(例如1-5、1-10或1-20个)氨基酸替换、插入或缺失。例如,提供另外的半胱氨酸以能够形成另外的二硫键(Kuball等人,2007,Blood 106(6),2331-8)。此类TCR的恒定区可以是最小的鼠类恒定区,这意味着在TCRβ中的五个氨基酸以及在TCRα中的四个氨基酸被交换为Sommermeyer等人,2010,J.Immunol.184,6223-31所定义。因此,编码TCRα和β链构建体的核酸可以分别包括SEQ ID NO:9和SEQ ID NO:12(至少均为鼠科动物,经密码子优化)。为此,TCRα和β链构建体的恒定区也可以是例如分别由SEQ ID NO:8和SEQ ID NO:11编码(均经密码子优化)的鼠恒定区。
包括单链构建体(scTCR)以及异二聚体TCR构建体。scTCR可以包括第一TCR链构建体的可变区(例如,α链)和完整的(全长)第二TCR链(例如,β链),反之亦然。此外,scTCR可任选地包括一个或多个接头,其将两个或多个多肽连接在一起。如本文所述,接头可以是例如将两条单链连接在一起的肽。还提供了本发明的这种scTCR,其与细胞因子(例如人细胞因子如IL-2、IL-7或IL-15融合)。
本发明的TCR构建体也可以以多聚体复合物的形式提供,其包括至少两个scTCR分子,其中所述scTCR分子各自与至少一个生物素部分融合,并且所述scTCR通过生物素-链霉亲和素的相互作用进行相互连接,以形成所述多聚复合物。还提供了更高阶的多聚体复合物,其包括大于两个(例如四个)本发明的scTCR。
可以对本发明的TCR构建体进行修饰,以包括可检测的标签,例如放射性同位素、荧光基团(例如异硫氰酸荧光素(FITC)、藻红蛋白(PE))、酶(例如碱性磷酸酶、辣根过氧化物酶)以及颗粒(例如金颗粒或磁性颗粒)。
本发明的核酸,特别是如果其编码TCR构建体的至少一种TCRα和β链构建体,则该核酸可以是病毒载体、转座子或适于基于CRISPR/CAS重组的载体,例如自灭活表达Cas9、CD22 TCR蛋白和sgRNA的LentiCrisprV2-CD22 TCR慢病毒载体或适合体外RNA转录的质粒,例如带有T7启动子的pcDNA3.1,或任何适合插入宿主基因组的核酸。
优选地,本发明的TCRα链构建体和/或TCRβ链构建体或TCR构建体是载体。合适的载体包括设计用于繁殖和扩增或表达或两者的载体,例如质粒和病毒。载体可以是适合在宿主细胞中表达的表达载体,所述宿主细胞选自人T细胞或人T细胞前体,优选人T细胞,例如CD8
表达载体包含调控序列,例如转录和翻译起始和终止密码子,其对一些类型的宿主细胞(例如,细菌、真菌、植物或动物细胞,例如上文定义的人CD8
本发明还提供了一种蛋白质,即,α或β链构建体,或优选包括α和β链构建体的TCR受体构建体,其能够特异性结合与SEQ ID NO:1所示的表位组合的HLA-A*02。蛋白质优选地由本发明的核酸编码。其优选地被宿主细胞表达为跨膜蛋白质。在HLA-A*02的情况下,TCR构建体的TCRα和/或β链构建体能够与SEQ ID NO:1所示的肽特异性结合,其中TCRα链构建体包括与SEQ ID NO:4相比具有至少83%序列同一性的CDR3序列,和/或TCRβ链构建体优选包括与SEQ ID NO:22相比具有至少83%序列同一性的CDR3序列。
本发明还提供了包括本发明的核酸或蛋白质的宿主细胞。宿主细胞可以是真核细胞,例如植物、动物、真菌或藻类,或者可以是原核细胞,例如细菌或原生动物。宿主细胞可以是培养的细胞或原代细胞,即直接从生物例如人分离的细胞。宿主细胞可以是贴壁细胞或悬浮细胞,即在悬浮液中生长的细胞。为了产生重组TCR、多肽或蛋白质,宿主细胞优选是哺乳动物细胞。最优选地,宿主细胞是人细胞。尽管宿主细胞可以是任何类型的细胞,可以源于任何类型的组织,并且可以处于任何发育阶段,但是宿主细胞优选是外周血白细胞(PBL)或外周血单核细胞(PBMC)。更优选地,宿主细胞是T细胞或T细胞前体,特别是人T细胞。T细胞可以是任何T细胞,例如经培养的T细胞,例如原代T细胞,或来自经培养的T细胞系的T细胞;或来自哺乳动物的T细胞,优选地,它是来自人类患者的T细胞或T细胞前体。可以从许多来源获得T细胞,例如血液、骨髓、淋巴结、胸腺或其他组织或体液。T细胞也可以被富集或纯化。优选地,T细胞是人T细胞。更优选地,T细胞是从人类例如人类患者或异体移植患者的供体中分离的T细胞。T细胞可以是任何类型的T细胞,但是优选地是CD8
本发明的宿主细胞优选包括本发明的核酸和/或本发明的蛋白质,其中所述宿主细胞优选是CD8
因此,本发明提供了人CD8
本发明还提供了一种药物组合物,其包括:
a)本发明的编码TCR构建体的核酸,该TCR构建体在HLA-A*02的情况下能够特异性结合SEQ ID NO:1所示的肽(如上所指定);或者
b)本发明的蛋白质,其包含在HLA-A*02的情况下能够特异性结合SEQ ID NO:1所示的肽的TCR构建体(如上所指定);或者
c)本发明的宿主细胞,其表达能够在HLA-A*02(如上所指定)中特异性结合SEQ IDNO:1所示的肽的TCR构建体。
优选地,所述药物组合物包括如本文所定义的本发明的人CD8
另外,还可以向患者施用本发明的核酸,特别是表达载体,用于T细胞的体内转导。
药物组合物也可以是试剂盒的一部分,该试剂盒包括其他治疗剂,例如抗体例如利妥昔单抗或CAR,其优选由CD8
本发明的药物组合物或本发明的试剂盒可以用于预防和/或治疗与B细胞或B细胞前体,特别是在患有B细胞淋巴瘤或B细胞白血病患者中的异常增殖和/或活化有关的疾病。在一个优选的实施方案中,已经证实肿瘤细胞表达HLA-A*02。它们进一步表达具有或不具有细胞表面表达的CD22(通过FACS染色或免疫组织学检测)。优选地,该疾病被治疗。
患者可能患有B细胞谱系的非霍奇金淋巴瘤,包括低度B细胞淋巴瘤,例如滤泡性淋巴瘤、套细胞淋巴瘤、免疫细胞性淋巴瘤、
优选地,该疾病已经被治疗并在一种或多种疗法之后复发,或者对于初始治疗是难治的。本发明还提供了一种用于治疗患有上述疾病,特别是本文所述的肿瘤或肿瘤疾病的受试者的方法,其包括施用本发明的核酸、蛋白质或宿主细胞。优选地,受试者是需要这种治疗的受试者,即患者。在优选的实施方案中,所述受试者是患有肿瘤或肿瘤疾病的哺乳动物受试者,优选为人类患者。活性剂以有效量施用。
本发明的优选医学用途涉及免疫疗法,特别是过继性T细胞疗法。本发明的产品和方法用于过继性T细胞疗法的情形中。本发明化合物的施用可以例如包括将本发明的T细胞输注例如所述患者。优选地,此类T细胞是患者的自体T细胞,其在体外用本发明的核酸转导。优选地,患者表达HLA-A*02,例如HLA-A*02:01或HLA-A*02:04、05、07或10。
宿主细胞可以自己表达HLA-A2,例如,通常对于仅被修饰以表达本发明的TCR构建体的自体T细胞就是这种情况。但是,这不是必需的。本发明的宿主T细胞也可以是不表达HLA-A2的T细胞,例如在同种异体或错配(单倍)T细胞疗法的情况下,或以经基因修饰不表达HLA-A的自体T细胞的形式A2,例如,通过CRISPR/Cas通过HLA-A2敲除或用合适的抑制性核酸例如但不限于siRNA/miRNA分子敲除。例如,被修饰为不表达任何HLA的T细胞可以用作宿主细胞,其适合用于任何患者而不会引起免疫应答。
本发明的治疗可以是患者的一线治疗。优选地,本发明的治疗是患者的二线或后一线治疗。例如,如果患者已经复发或对一种或多种替代药物的治疗是难治的(例如化学疗法,包括化学治疗方案与施用B细胞特异性单克隆抗体或基于CAR的疗法(例如针对B细胞谱系抗原(例如CD19,CD20或CD22)的组合所定义的化学免疫疗法)。优选地,患者患有如上所述的复发性或主要是难治性B细胞淋巴瘤或白血病,不适合于进一步的化学疗法,包括自体或异体干细胞移植。
本发明还涉及制备本发明的宿主细胞的方法,该方法包括将编码本发明的TCR构建体的表达载体引入合适的宿主细胞(优选地,所述宿主细胞是从患者分离的人CD8
然而,在以下实施例中将参考附图和序列进一步说明本发明,但不限于此。为了本发明的目的,本文引用的所有参考文献通过引用整体并入本文。
附图说明
图1.CD22 TCR的分离和表征:a)人类TCR基因座转基因小鼠(hTCR基因座-tg)(Li等人,2010,Nat.Med.16,1029-35)通过基因枪接种了DNA包被的金颗粒。疫苗接种一周后,通过与工程化表达CD22(+CD22)或未转导的NIH3T3+HHD细胞(未转化)的NIH3T3+HHD细胞共培养,在血液T细胞和脾细胞中测试了对CD22的反应性。反应性通过细胞内IFNγ染色进行分析(左图)。接下来,采用肽库和计算机预测的肽对脾细胞进行12小时的测试,以鉴定对FLSNDTVQL肽的表位特异性(也称为FLS-肽,SEQ ID NO:1)。细胞内IFNγ染色仅显示有特定肽(+FLS肽)或无肽(阴性对照)的共培养物(右上图)。采用对应的肽在体外对T细胞进行了10天的富集。FLS肽已在前面作了描述。使用NetMHC3.4(http://www.cbs.dtu.dk/services/NetMHC-3.4/)确定其IC50为11nM。在第10天,细胞用FLS肽再次刺激了四个小时,在IFN捕获物分析后,对IFNγ阳性细胞进行FACS分选。作为阴性对照,细胞未与IFN捕获物抗体(阴性对照)一起进行孵育(右下图)。从分选的细胞中分离RNA,并通过RACE PCR鉴定TCR序列。b)将TCR克隆到通过病毒肽接头(p2a)连接的TCRb-p2a-TCR a构型的g-逆转录病毒载体中。整个序列是经过密码子优化的。TCR恒定区衍生自小鼠(mTRBC,mTRAC),但也可以衍生自人或者少量氨基酸衍生自鼠类序列(最小化)。c)采用表达CD22 TCR的γ--逆转录病毒载体MP71逆转录转导人T细胞。对人CD8和鼠TCRβ恒定区染色细胞。d)将TCR转导的T细胞与载有肽的T2细胞孵育以进行肽滴定。18-20小时后,通过ELISA在细胞上清液中检测到IFNγ。10μM载有肽的T2细胞的IFNγ含量设为100%。用最大IFNγ释放的50%计算Kd值。曲线和数据点来自使用4个单独的T细胞供体的4个实验。
图2.CD22 TCR识别a)CD22基因修饰的HLA-A*02:01阳性肾细胞癌细胞系,以及b)表达CD22和HLA-A*02的不同类型的霍奇金淋巴瘤(Hodgkin lymphoma)和Pre-B-ALL,或c)对HLA-A*02:01表达进行基因修饰的Burkitt淋巴瘤细胞系,以及d)弥漫性大B细胞淋巴瘤(DLBCL)系。a-d)采用CD22TCR(黑条)或对照TCR(黑虚线)对人外周血淋巴细胞(hPBLs)进行逆转录病毒转导,或者保持未转导状态(阴性;白色条),并在与靶细胞的共培养试验中进行测试。a-c)18-20小时后,通过ELISA在细胞上清液中检测到IFNγ。所示数据代表至少三个PBL供体。a)用全长CD22或截短的无细胞内和跨膜部分的CD22对肾细胞癌细胞系Kt195+HLA-A*02:01和RCC26进行基因修饰,导致截短的CD22在细胞内表达仍包含表位(+CD22intrac)。下面的FACS点状图显示了未转导或CD22转导的靶细胞Kt195+HLA-A*02:01和RCC26的表达情况。用抗CD22(克隆IS7,Biozol)抗体和抗HLA-A2抗体(克隆BB7.2,BD)进行细胞染色。对具有CD22intrac的细胞进行CD22的细胞内染色。c)逆转录病毒转导Burkitt淋巴瘤细胞系L591和Raji以获得HLA-A*02:01表达。d)与DLBCL系HBL-1(HLA-A*02:01阳性)和OCI-Ly10(HLA-A*02:01阴性)共培养24小时后,对hPBl的CD3(BD)和鼠类恒定TCRb区(mTCRβ)(Biolegend公司)以及胞内IFNγ(BD)表达进行染色。显示了CD8-和mTCRβ-阳性细胞的IFNγ-阳性细胞的百分比。
图3.CD22识别a-b)HLA-A*02:01阳性淋巴母细胞样细胞系(LCL)和c)两名急性淋巴细胞白血病前期白血病患者(1、2;pre-ALL)和一名非霍奇金淋巴瘤患者(3;NHL)的样本。采用CD22 TCR(黑柱)或对照TCR(马赛克柱)逆转录病毒转导人外周血淋巴细胞,或不转导(阴性;白柱),并在与目标细胞的共培养试验中进行测试。a)、c)在18-20小时后,通过ELISA在细胞上清液中检测到IFNγ。所示数据代表至少两个PBL供体。b)LCL在标准的4小时铬释放测定中用作靶标,其效应子(TCR阳性T细胞)与靶标(E:T)的比率不同。所示数据代表两个PBL供体。c)另外向患者样品1-3加载FLS肽。
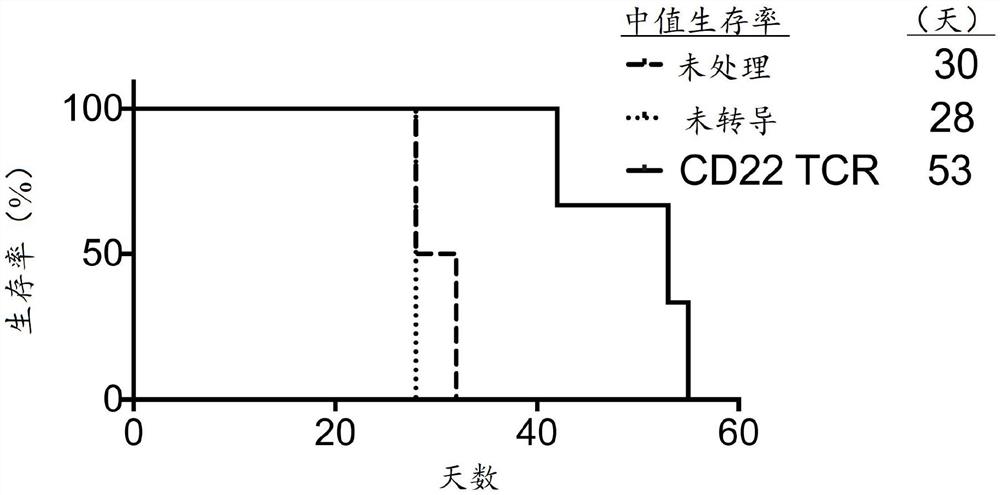
图4.CD22 TCR在异种移植小鼠模型中延缓了肿瘤的生长。向5-6周大的雌性NOG小鼠注射5x 10
图5.测试了CD22 TCR转导的hPBL与一组表达CD22和不同HLA亚型的LCL的同种异体反应性。CD22 TCR不显示与其他HLA类型(HLA-A*XX)的同种异体反应性,但可以识别表达除HLA-A*02:01(HLA-A*02:04、05、07、10,以及可能的HLA-A*02:HAL-A*02:02和08的其他亚型,请参见HLA-A*02:XX)。将CD22 TCR转导的(黑条)或未转导的(阴性;白条)T细胞与LCL孵育,随后在18-20h后通过ELISA测定IFNγ。所示数据代表了三个PBL供体。
图6.CD22 TCR和CD22 TCR 3225都可以识别:a)不同类型的表达CD22和HLA-A*02:01的霍奇金淋巴瘤和Pre-B-ALL,或弥漫性大B细胞淋巴瘤(DLBCL)以及经基因修饰以表达HLA-A*02:01的伯基特(Burkitt)淋巴瘤细胞系;b)表达CD22和HLA-A*02:01的LCL细胞。a和b)采用CD22 TCR(黑柱)、CD22 TCR 3225(条纹柱)或对照TCR(黑点柱)或未转导(阴性;白色柱:阴性对照)逆转录病转导HLA-A*02:01阴性(上图)或阳性(下图)供体的人外周血淋巴细胞(hPBL),并在与靶细胞的共培养试验中进行测试。18-20小时后,通过ELISA在细胞上清液中检测到IFNγ。三个供体之一的代表性数据被示出。
在a)中,伯基特淋巴瘤细胞系Raji通常不表达HLA-A2,因此无法识别这些细胞。同样地,逆转录转导Raji细胞以获得HLA-A*02:01表达,并且这些细胞被识别。KG1细胞既不表达HLA-A2也不表达CD22,因此无法被识别。转导表达HLA-A*02:01的Jurkat T细胞未被识别,因为它们不表达CD22。在b)中,IE3细胞和GOELK表达CD22,但不表达HLA-A2,因此它们未被识别。在上图中,对HLA-A2阴性宿主T细胞进行的实验表明,CD22 TCR和CD22 TCR3225具有相当的功能亲和力。下方的图显示了带有HLA-A2阳性宿主T细胞的第二个CD22 TCR3225的另一个确认实验。
c)将三位供体的TCR转导的hPBL与负载有SEQ ID NO:1所示的被滴定CD22肽的T2细胞以效应子:靶标为1∶1的比率进行孵育。18-20小时后,通过ELISA测定细胞上清液中的IFNγ。载有10μM肽的T2细胞的IFNγ含量设为100%。用最大IFNγ释放的50%计算出TCR3225的K
具体实施方式
实施例1:生成CD22特异性TCR
针对胸腺中的自身抗原,对T细胞进行了阴性选择,以避免自身免疫性疾病。为了获得CD22特异性TCR,我们使用了针对人类TCRa和TCR b基因座进行转基因的小鼠模型(Li等人,2010,Nat.Med.16,1029-35)以及可用于适当的表位表达的人类HLA-A*02:01的转基因来获得鼠T细胞。通过基因枪免疫接种非同源人类CD22 cDNA后,我们获得了针对CD22的特异性免疫反应,该CD22通过将血液或脾细胞与表达人类HLA-A2和CD22的NIH3T3细胞共培养而进行测试。使用跨CD22的肽库和计算机技术对反应性T细胞进一步的评估预测到揭示肽的特异性的九聚体。Hassan等人也描述了该表位并将其从LCL中洗脱出来(2013,MolCell Proteomics 12(7),1829-43)。本文所述的TCR是从用全长CD22 DNA基因枪接种四次的小鼠中分离得到的。将脾细胞与相应的肽培养过夜,以通过细胞内IFNγ染色进行初始反应性测试。去除脾细胞中的CD4 T细胞,将非CD4-T细胞与100nM肽培养10天,以富集特异性T细胞。在第10天,进行IFNγ捕获测定,并测定IFNγ阳性细胞通过FACS分选(图1a)。从分选的细胞中分离出RNA,进行cDNA合成和RACE-PCR,然后对PCR片段进行平末端TOPO克隆。通过Sanger测序并在IMGT网站的帮助下鉴别TCR序列。识别出的可变TCR区被合成为密码子优化序列,并与鼠类恒定区和TCR链之间的2a肽连接子分子克隆到γ-逆转录病毒载体MP71中(图1b)。将CD22 TCR逆转录病毒转导到人外周血单核细胞中,并通过用抗鼠恒定TCRβ链的抗体染色来检查表达(图1c)。或者,可以对其相应的可变TCRβ链(即,根据Arden命名法的vβ2)进行染色。对T2细胞的肽滴定揭示K
实施例2:CD22 TCR赋予对表达CD22的细胞系和原发性肿瘤细胞的反应性。
测试了CD22 TCR对重组和天然CD22表达细胞的反应性。在TCR转导后,将人外周血淋巴细胞(hPBL)与两个表达全长形式的CD22或缺失了跨膜和细胞内序列但仍包含表位的截短分子的两个肾细胞癌细胞系共培养。第二个CD22版本仅在细胞内表达。18-20小时后,通过ELISA测试共培养物的上清液中分泌的IFNγ。CD22 TCR转导的hPBL识别全长或以细胞内形式表达CD22的两种肾细胞癌细胞系(图2a)。为了进一步测试对天然表达CD22的细胞的识别,将CD22 TCR转导的hPBL与一组不同恶性肿瘤的B细胞系共培养(图2b-d)。除了霍奇金淋巴瘤(HDML2,L1236)、Pre-B-ALL细胞(Nalm6,REH),如果通过分泌的IFNγ(图2b和c)或IFNγ的细胞内染色(图2d)也测定为HLA-A*02:01阳性,则非霍奇金淋巴瘤如伯基特淋巴瘤(BJAB,L591,Raji)和DLBCL(HBL-1)也被识别。L591和Raji细胞只有在采用HLA-A*02:01转导后才能被识别。DLBCL系的OCI-Ly10为HLA-A*02:01阴性且未被识别。
另外,来自HLA-A*02:01阳性健康供体的体外永生原代B细胞(淋巴母细胞系,LCL)被CD22 TCR转导的hPBL识别,如INFγ分泌所示(图3a)。它们被以铬释放测定中所示的效应子-靶标比率依赖性方式杀死(图3b)。HLA-A*02:01阴性的LCL未被识别并被杀死。来自两名pre-ALL(1和2)和一名NHL(3)患者的表达CD22和HLA-A*02:01的细胞样品经共培养后诱导IFNγ分泌。作为阳性对照,样品中加载有CD22肽(图3c)。
实施例3:CD22 TCR延缓异种移植小鼠模型中的肿瘤生长
为了测试CD22 TCR转导的hPBL在体内杀死肿瘤细胞的能力,向NOG小鼠注射用萤火虫荧光素酶和同基因标记CD90.1转导的前ALL B细胞系Nalm6,并在四天后用hPBL处理。通过萤火虫荧光素酶信号测量肿瘤生长,并通过CD8和TCRvβ链染色分析血液中肿瘤细胞表达的同基因标记CD90.1以及转移的T细胞。采用CD22 TCR转导的hPBL转移的小鼠的中位生存期为53±7天,而未经处理或未转导的hPBL转移的小鼠分别仅存活30±3天或28±0天(图4)。
实施例4:CD22 TCR识别方法的安全性分析
该CD22 TCR被证明是非常有效的体外和体内的抗CD22-/HLA-A*02:01表达的肿瘤细胞。为了查看CD22 TCR是否能使其他不表达CD22和/或其他HLA类型的正常细胞免受损伤,进行了多次检测。首先,为了分析对除HLA-A*02以外的其他HLA的潜在同种异体反应性,将CD22 TCR转导的hPBL与一组表达多种不同HLA类型的LCL共同培养(表2a和b)。
表2a:被测试的LCL(HLA-A、HLA-B、HLA-C)的HLA表达
表2b:被测试的LCL(DRB1、DQB1、DPB1)的HLA表达
由于LCL是CD22阳性的,因此仅在与HLA-A*02:01和其他某些HLA-A*02亚型(HLA-A*02:04、05、07、10)呈阳性的LCL共同培养时才观察到IFNγ分泌。没有观察到对HLA-A*02:02和08以及所有其他所分析的非HLA-A2类型的识别(图5)。
实施例5:CD22 TCR-3225对表达CD22的细胞系赋予与CD22 TCR类似的反应性。
采用实施例1中所述的同样的方法生成第二TCR。CD22 TCR3225包括作为CD22 TCR的相同的TCR vα链,但TCR的vβ的CDR3区域的两个氨基酸不相同。在TCR转导的hPBL与一组不同恶性肿瘤的B细胞系(图6a)或EBV永生化B细胞(LCL)(图6b)共培养时,显示了对自然加工的CD22表位的识别。
将HLA-A2*02:01阴性(上图)或阳性(下图)供体的TCR转导的hPBL与一组不同恶性肿瘤的B细胞系共培养(图6a)。HLA-A*02:01阳性pre-B-ALL细胞(REH)、非霍奇金淋巴瘤(如Burkitt淋巴瘤)(BJAB)和DLBCL(SU-DHL6)被与CD22 TCR相似的CD22 TCR3225识别,Burkitt淋巴瘤Raji细胞仅在用HLA-A*02:01转导时才被识别。CD22阴性细胞(KG1和Jurkat+HLA-A*02:01)不被识别。来自HLA-A*02:01阳性健康供体的成淋巴细胞细胞系(LCL)被CD22TCR 225转导的hPBL(上图的HLA-A2*02:01
通过在T2细胞上进行肽滴定,进一步测试了CD22 TCR和CD22 TCR 3225对同源肽的亲和力(图6c),计算出CD22 TCR3225的K
通常,在通过ELISA对上清液中的INFγ定量之前,将5×10
序列表
<110> 马克思-德布鲁克-分子医学中心亥姆霍兹联合会
柏林夏瑞蒂医科大学
<120> 用于治疗B细胞恶性肿瘤的CD22特异性T细胞受体和过继性T细胞疗法
<130> 11780 P 6581 EP
<150> EP18213482.5
<160> 27
<170> BiSSAP 1.3.6
<210> 1
<211> 9
<212> PRT
<213> 人类(Homo sapiens)
<220>
<223> FLS肽: CD22表位
<400> 1
Phe Leu Ser Asn Asp Thr Val Gln Leu
1 5
<210> 2
<211> 6
<212> PRT
<213> 人类(Homo sapiens)
<220>
<223> α链CDR1
<400> 2
Val Thr Asn Phe Arg Ser
1 5
<210> 3
<211> 7
<212> PRT
<213> 人类(Homo sapiens)
<220>
<223> α链CDR2
<400> 3
Leu Thr Ser Ser Gly Ile Glu
1 5
<210> 4
<211> 12
<212> PRT
<213> 人类(Homo sapiens)
<220>
<223> α链CDR3
<400> 4
Cys Ala Val Asp Asn Gln Gly Gly Lys Leu Ile Phe
1 5 10
<210> 5
<211> 6
<212> PRT
<213> 人类(Homo sapiens)
<220>
<223> β链CDR1
<400> 5
Asp Phe Gln Ala Thr Thr
1 5
<210> 6
<211> 7
<212> PRT
<213> 人类(Homo sapiens)
<220>
<223> β链CDR2
<400> 6
Ser Asn Glu Gly Ser Lys Ala
1 5
<210> 7
<211> 14
<212> PRT
<213> 人类(Homo sapiens)
<220>
<223> β链CDR3
<400> 7
Cys Ser Ala Arg Pro Ser Gly Val Tyr Asn Glu Gln Phe Phe
1 5 10
<210> 8
<211> 411
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> TCR α的鼠恒定区 - 经密码子优化
<400> 8
aacatccaga accccgagcc cgccgtgtac cagctgaagg accccagaag ccaggacagc 60
accctgtgcc tgttcaccga cttcgacagc cagatcaacg tgcccaagac catggaaagc 120
ggcaccttca tcaccgacaa gacagtgctg gacatgaagg ccatggacag caagagcaac 180
ggcgccattg cctggtccaa ccagaccagc ttcacatgcc aggacatctt caaagagaca 240
aacgccacct accccagcag cgacgtgccc tgcgacgcca ccctgaccga gaagagcttc 300
gagacagaca tgaacctgaa tttccagaac ctgagcgtga tgggcctgcg gatcctgctg 360
ctgaaggtgg ccggcttcaa cctgctgatg accctgcggc tgtggagcag c 411
<210> 9
<211> 423
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 最小的鼠恒定区 - TCR α
<400> 9
aacatccaga accccgaccc cgccgtgtat cagctgagag acagcaagag cagcgacaag 60
tccgtgtgcc tgttcaccga cttcgacagc cagaccaatg tgtcccagtc caaggacagc 120
gacgtgtaca tcaccgacaa gaccgtgctg gacatgcgca gcatggactt caagagcaac 180
tccgccgtgg cctggtccaa caagagcgat ttcgcctgcg ccaacgcctt caacaacagc 240
attatccccg aggacacatt cttcccaagc tcagacgttc cctgcgacgt gaagctggtg 300
gaaaagagct tcgagacaga caccaacctg aacttccaga acctgagcgt gatcggcttc 360
cggatcctgc tgctgaaggt ggccggcttc aacctgctga tgaccctgag actgtggtcc 420
agc 423
<210> 10
<211> 423
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> TCR α的人恒定区 - 经密码子优化
<400> 10
aacatccaga accccgaccc cgccgtgtat cagctgagag acagcaagag cagcgacaag 60
tccgtgtgcc tgttcaccga cttcgacagc cagaccaatg tgtcccagtc caaggacagc 120
gacgtgtaca tcaccgacaa gaccgtgctg gacatgcgca gcatggactt caagagcaac 180
tccgccgtgg cctggtccaa caagagcgat ttcgcctgcg ccaacgcctt caacaacagc 240
attatccccg aggacacatt cttcccaagc cccgagagca gctgcgacgt gaagctggtg 300
gaaaagagct tcgagacaga caccaacctg aacttccaga acctgagcgt gatcggcttc 360
cggatcctgc tgctgaaggt ggccggcttc aacctgctga tgaccctgag actgtggtcc 420
agc 423
<210> 11
<211> 519
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> TCR α的鼠恒定区 - 经密码子优化
<400> 11
gaagatctga ggaacgtgac cccacccaag gtgtccctgt tcgagcccag caaggccgag 60
atcgccaaca agcagaaagc caccctggtc tgcctggcca ggggcttctt ccccgaccac 120
gtggagctgt cttggtgggt gaacggcaaa gaggtgcaca gcggagtcag taccgacccc 180
caggcctaca aagagagcaa ctacagctac tgcctgagca gcaggctgag agtgagcgcc 240
accttctggc acaacccccg gaaccacttc cggtgccagg tgcagttcca cggcctgagc 300
gaagaggaca agtggcctga gggcagcccc aagcccgtga cccagaacat cagcgccgag 360
gcctggggca gagccgactg cggcatcacc agcgccagct accaccaggg cgtgctgtcc 420
gccaccatcc tgtacgagat cctgctgggc aaggccaccc tgtacgccgt gctggtgtcc 480
ggcctggtgc tgatggccat ggtgaagaag aagaacagc 519
<210> 12
<211> 537
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> TCR β的最小的鼠恒定区 - 经密码子优化
<400> 12
gaggatctga agaacgtgtt ccccccagag gtggccgtgt tcgagccttc taaagccgag 60
atcgcacaca cccagaaagc caccctcgtg tgtctggcca ccggcttcta ccccgaccat 120
gtggaactgt cttggtgggt caacggcaaa gaggtgcaca gcggagtgtc caccgacccc 180
cagcctctga aagaacagcc cgccctgaac gacagccggt actgcctgag cagcagactg 240
agagtgtccg ccaccttctg gcagaacccc cggaaccact tcagatgcca ggtgcagttc 300
tacggcctga gcgagaacga cgagtggacc caggacagag ccaagcccgt gacccagatc 360
gtgtctgccg aagcctgggg cagagccgat tgcggcatca ccagcgcaag ctaccatcag 420
ggcgtgctga gcgccacaat cctgtacgag attctgctgg gcaaggccac actgtacgcc 480
gtgctggtgt ctgccctggt gctgatggcc atggtcaagc ggaaggacag cagaggc 537
<210> 13
<211> 537
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> TCR β的人恒定区 - 经密码子优化
<400> 13
gaggatctga agaacgtgtt ccccccagag gtggccgtgt tcgagccttc tgaggccgag 60
atcagccaca cccagaaagc caccctcgtg tgtctggcca ccggcttcta ccccgaccat 120
gtggaactgt cttggtgggt caacggcaaa gaggtgcaca gcggagtgtc caccgacccc 180
cagcctctga aagaacagcc cgccctgaac gacagccggt actgcctgag cagcagactg 240
agagtgtccg ccaccttctg gcagaacccc cggaaccact tcagatgcca ggtgcagttc 300
tacggcctga gcgagaacga cgagtggacc caggacagag ccaagcccgt gacccagatc 360
gtgtctgccg aagcctgggg cagagccgat tgcggcttta ccagcgagag ctaccagcag 420
ggcgtgctga gcgccacaat cctgtacgag attctgctgg gcaaggccac actgtacgcc 480
gtgctggtgt ctgccctggt gctgatggcc atggtcaagc ggaaggacag cagaggc 537
<210> 14
<211> 390
<212> DNA
<213> 人类(Homo sapiens)
<220>
<223> CD22 TCR α链可变区 TRAV36/DV7*04-TRAJ23*01(包括前导序列)
<400> 14
atgaagtgtc cacaggcttt actagctatc ttttggcttc tactgagctg ggtgagcagt 60
gaagacaagg tggtacaaag ccctctatct ctggttgtcc acgagggaga cactgtaact 120
ctcaattgca gttatgaagt gactaacttt cgaagcctac tatggtacaa gcaggaaaag 180
aaagctccca catttctatt tatgctaact tcaagtggaa ttgaaaagaa gtcaggaaga 240
ctaagtagca tattagataa gaaagaactt ttcagcatcc tgaacatcac agccacccag 300
accggagact cggccgtcta cctctgtgct gtggataacc agggaggaaa gcttatcttc 360
ggacagggaa cggagttatc tgtgaaaccc 390
<210> 15
<211> 390
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> CD22 TCR α链可变区TRAV36/DV7*04-TRAJ23*01 - 经密码子优化
<400> 15
atgaagtgcc cacaggccct gctggccatc ttttggctgc tgctgagctg ggtgtccagc 60
gaggacaagg tggtgcagag ccctctgagc ctggtggtgc acgagggcga taccgtgacc 120
ctgaattgca gctacgaagt gaccaacttc cggtccctgc tgtggtacaa gcaggaaaag 180
aaggccccca ccttcctgtt catgctgacc agcagcggca tcgagaagaa gtccggcaga 240
ctgtcctcca tcctggacaa gaaagagctg ttcagcatcc tgaatatcac cgccacccag 300
accggcgaca gcgccgtgta tctgtgcgcc gtggataacc agggcggcaa gctgatcttt 360
ggccagggca cagagctgag cgtgaagccc 390
<210> 16
<211> 130
<212> PRT
<213> 人工序列(Artificial Sequence)
<220>
<221> SIGNAL
<222> 1..20
<223> 前导序列
<220>
<223> DC22 TCR α链可变区TRAV36/DV7*04-TRAJ23*01(包括前导序列)
<400> 16
Met Lys Cys Pro Gln Ala Leu Leu Ala Ile Phe Trp Leu Leu Leu Ser
1 5 10 15
Trp Val Ser Ser Glu Asp Lys Val Val Gln Ser Pro Leu Ser Leu Val
20 25 30
Val His Glu Gly Asp Thr Val Thr Leu Asn Cys Ser Tyr Glu Val Thr
35 40 45
Asn Phe Arg Ser Leu Leu Trp Tyr Lys Gln Glu Lys Lys Ala Pro Thr
50 55 60
Phe Leu Phe Met Leu Thr Ser Ser Gly Ile Glu Lys Lys Ser Gly Arg
65 70 75 80
Leu Ser Ser Ile Leu Asp Lys Lys Glu Leu Phe Ser Ile Leu Asn Ile
85 90 95
Thr Ala Thr Gln Thr Gly Asp Ser Ala Val Tyr Leu Cys Ala Val Asp
100 105 110
Asn Gln Gly Gly Lys Leu Ile Phe Gly Gln Gly Thr Glu Leu Ser Val
115 120 125
Lys Pro
130
<210> 17
<211> 423
<212> DNA
<213> 人类(Homo sapiens)
<220>
<223> CD22 TCR β链可变序列TRBV20-1-TRBJ2-1*01-TRBD2*01(包括前导序列)
<400> 17
atgggggaag gtggtgtgag gccatcacgg aagatgctgc tgcttctgct gcttctgggg 60
ccaggctccg ggcttggtgc tgtcgtctct caacatccga gctgggttat ctgtaagagt 120
ggaacctctg tgaagatcga gtgccgttcc ctggactttc aggccacaac tatgttttgg 180
tatcgtcagt tcccgaaaca gagtctcatg ctgatggcaa cttccaatga gggctccaag 240
gccacatacg agcaaggcgt cgagaaggac aagtttctca tcaaccatgc aagcctgacc 300
ttgtccactc tgacagtgac cagtgcccat cctgaagaca gcagcttcta catctgcagt 360
gctaggccta gcggggtcta caatgagcag ttcttcgggc cagggacacg gctcaccgtg 420
cta 423
<210> 18
<211> 423
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> CD22 TCR β链可变区TRBV20-1-TRBJ2-1*01-TRBD2*01(包括前导序列)- 经密码子优化
<400> 18
atgggagaag gcggagtgcg gcctagccgg aagatgcttc tccttctgct gctgctgggc 60
cctggctctg gactgggagc tgtggtgtct cagcacccct cctgggtcat ctgcaagagc 120
ggcaccagcg tgaagatcga gtgcagaagc ctggacttcc aggccaccac catgttctgg 180
tacagacagt tccccaagca gagcctgatg ctgatggcca cctccaacga gggcagcaag 240
gccacatatg agcagggcgt ggaaaaggac aagttcctga tcaaccacgc cagcctgacc 300
ctgagcaccc tgacagtgac aagcgcccac cccgaggaca gcagcttcta catctgcagc 360
gccagaccca gcggcgtgta caacgagcag ttcttcggcc ctggcacccg gctgaccgtg 420
ctg 423
<210> 19
<211> 141
<212> PRT
<213> 人工序列(Artificial Sequence)
<220>
<221> SIGNAL
<222> 1..25
<223> 前导序列氨基酸aa12-25, TCR始于氨基酸aa26
<220>
<223> CD22 TCR β链可变区TRBV20-1-TRBJ2-1*01-TRBD2*01(包括前导序列)
<400> 19
Met Gly Glu Gly Gly Val Arg Pro Ser Arg Lys Met Leu Leu Leu Leu
1 5 10 15
Leu Leu Leu Gly Pro Gly Ser Gly Leu Gly Ala Val Val Ser Gln His
20 25 30
Pro Ser Trp Val Ile Cys Lys Ser Gly Thr Ser Val Lys Ile Glu Cys
35 40 45
Arg Ser Leu Asp Phe Gln Ala Thr Thr Met Phe Trp Tyr Arg Gln Phe
50 55 60
Pro Lys Gln Ser Leu Met Leu Met Ala Thr Ser Asn Glu Gly Ser Lys
65 70 75 80
Ala Thr Tyr Glu Gln Gly Val Glu Lys Asp Lys Phe Leu Ile Asn His
85 90 95
Ala Ser Leu Thr Leu Ser Thr Leu Thr Val Thr Ser Ala His Pro Glu
100 105 110
Asp Ser Ser Phe Tyr Ile Cys Ser Ala Arg Pro Ser Gly Val Tyr Asn
115 120 125
Glu Gln Phe Phe Gly Pro Gly Thr Arg Leu Thr Val Leu
130 135 140
<210> 20
<211> 6
<212> PRT
<213> 人类(Homo sapiens)
<220>
<223> β链CDR1
<400> 20
Asp Phe Gln Ala Thr Thr
1 5
<210> 21
<211> 7
<212> PRT
<213> 人类(Homo sapiens)
<220>
<223> β链CDR2
<400> 21
Ser Asn Glu Gly Ser Lys Ala
1 5
<210> 22
<211> 14
<212> PRT
<213> 人类(Homo sapiens)
<220>
<223> 3225 TCR β链CDR3
<400> 22
Cys Ser Ala Arg Glu Ala Gly Val Tyr Asn Glu Gln Phe Phe
1 5 10
<210> 23
<211> 390
<212> DNA
<213> 人类(Homo sapiens)
<220>
<223> 3225 TCR β链可变区TRBV20-1*01-TRBJ2-1*01-TRBD2*02 F(包括前导序列)
<220>
<221> sig_peptide
<222> 1..42
<223> /功能="前导肽"
<400> 23
atgctgctgc ttctgctgct tctggggcca ggctccgggc ttggtgctgt cgtctctcaa 60
catccgagct gggttatctg taagagtgga acctctgtga agatcgagtg ccgttccctg 120
gactttcagg ccacaactat gttttggtat cgtcagttcc cgaaacagag tctcatgctg 180
atggcaactt ccaatgaggg ctccaaggcc acatacgagc aaggcgtcga gaaggacaag 240
tttctcatca accatgcaag cctgaccttg tccactctga cagtgaccag tgcccatcct 300
gaagacagca gcttctacat ctgcagtgct agagaagcgg gagtctacaa tgagcagttc 360
ttcgggccag ggacacggct caccgtgcta 390
<210> 24
<211> 390
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 3225 TCR β链可变区经密码子优化TRBV20-1*01-TRBJ2-1*01-TRBD2*02 F
<220>
<221> sig_peptide
<222> 1..42
<223> /功能="前导肽"
<400> 24
atgcttctcc ttctgctgct gctgggccct ggctctggac tgggagctgt ggtgtctcag 60
cacccctcct gggtcatctg caagagcggc accagcgtga agatcgagtg cagaagcctg 120
gacttccagg ccaccaccat gttctggtac agacagttcc ccaagcagag cctgatgctg 180
atggccacct ccaacgaggg cagcaaggcc acatatgagc agggcgtgga aaaggacaag 240
ttcctgatca accacgccag cctgaccctg agcaccctga cagtgacaag cgcccacccc 300
gaggacagca gcttctacat ctgcagcgcc agagaagcgg gcgtgtacaa cgagcagttc 360
ttcggccctg gcacccggct gaccgtgctg 390
<210> 25
<211> 130
<212> PRT
<213> 人类(Homo sapiens)
<220>
<221> SIGNAL
<222> 1..14
<223> 前导肽
<220>
<223> 3225 TCR β链可变区 TRBV20-1*01-TRBJ2-1*01-TRBD2*02 F(包括前导序列)
<400> 25
Met Leu Leu Leu Leu Leu Leu Leu Gly Pro Gly Ser Gly Leu Gly Ala
1 5 10 15
Val Val Ser Gln His Pro Ser Trp Val Ile Cys Lys Ser Gly Thr Ser
20 25 30
Val Lys Ile Glu Cys Arg Ser Leu Asp Phe Gln Ala Thr Thr Met Phe
35 40 45
Trp Tyr Arg Gln Phe Pro Lys Gln Ser Leu Met Leu Met Ala Thr Ser
50 55 60
Asn Glu Gly Ser Lys Ala Thr Tyr Glu Gln Gly Val Glu Lys Asp Lys
65 70 75 80
Phe Leu Ile Asn His Ala Ser Leu Thr Leu Ser Thr Leu Thr Val Thr
85 90 95
Ser Ala His Pro Glu Asp Ser Ser Phe Tyr Ile Cys Ser Ala Arg Glu
100 105 110
Ala Gly Val Tyr Asn Glu Gln Phe Phe Gly Pro Gly Thr Arg Leu Thr
115 120 125
Val Leu
130
<210> 26
<211> 42
<212> DNA
<213> 人类(Homo sapiens)
<220>
<223> 3225 β链构建体CDR3核苷酸
<400> 26
tgcagtgcta gagaagcggg agtctacaat gagcagttct tc 42
<210> 27
<211> 42
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 3225 β链构建体CDR3核苷酸(经密码子优化)
<400> 27
tgcagcgcca gagaagcggg cgtgtacaac gagcagttct tc 42
- 用于治疗B细胞恶性肿瘤的CD22特异性T细胞受体和过继性T细胞疗法
- 用于过继性T细胞疗法的中央记忆T细胞
