Aβ肽的测定方法及在该方法中使用的试剂组合物
文献发布时间:2023-06-19 13:27:45
【技术领域】
本发明涉及淀粉样β(Aβ)肽的测定方法。本发明涉及在此测定方法中使用的试剂组合物。
【背景技术】
已知从受试者采集的生物体试样中的Aβ肽成为阿尔茨海默病的生物标志物。在生物体试样之中,也由于脑脊髓液(CSF)比较多含Aβ肽,从而确立了定量测定CSF中的Aβ肽的方法。例如,在非专利文献1中记载了将CSF中的Aβ肽由液相层析质谱分析法(LC-MS)测定。
【现有技术文献】
【非专利文献】
【非专利文献1】Leinenbach A.等,Mass Spectrometry-Based CandidateReference Measurement Procedure for Quantification of Amyloid-β inCerebrospinal Fluid.Clinical Chemistry 60:7 987-994(2014)
【发明的概要】
【发明要解决的课题】
由于CSF的采集是侵袭性的,对受试者的负担大。因此,近年开发了在生物体试样中使用采集的负担少的血液的Aβ肽的测定方法。但是,由于与CSF相比,血液中所含的Aβ肽少,要求高精度地测定Aβ肽的方法。本发明旨在提供使对血液中的Aβ肽高精度地进行测定变得可能的手段。
【用于解决课题的手段】
本发明提供Aβ肽的测定方法,其包括将含Aβ肽的血液试样和与Aβ肽特异性地结合的抗体混合而形成Aβ肽和上述抗体的复合体的工序,由含有机溶剂的碱性溶液,从复合体游离Aβ肽的工序,和由质谱分析法测定游离的Aβ肽的工序。另外,本发明提供在上述方法中使用的试剂组合物,其为含有机溶剂的碱性溶液。
【发明的效果】
本发明使对血液中的Aβ肽高精度地进行测定变得可能。
【附图的简单的说明】
【图1】是显示收容试剂组合物的容器的一例的图。
【图2】是显示使用LC-MS/MS对Aβ肽进行测定的结果的图。
【图3A】是显示各受试体的血浆中的Aβ40肽的浓度的图。
【图3B】是显示各受试体的血浆中的Aβ42肽的浓度的图。
【图4A】是显示基于使用浓度已知的Aβ40肽检测的测定值而制成的校准曲线的图。
【图4B】是显示基于使用浓度已知的Aβ42肽检测的测定值而制成的校准曲线的图。
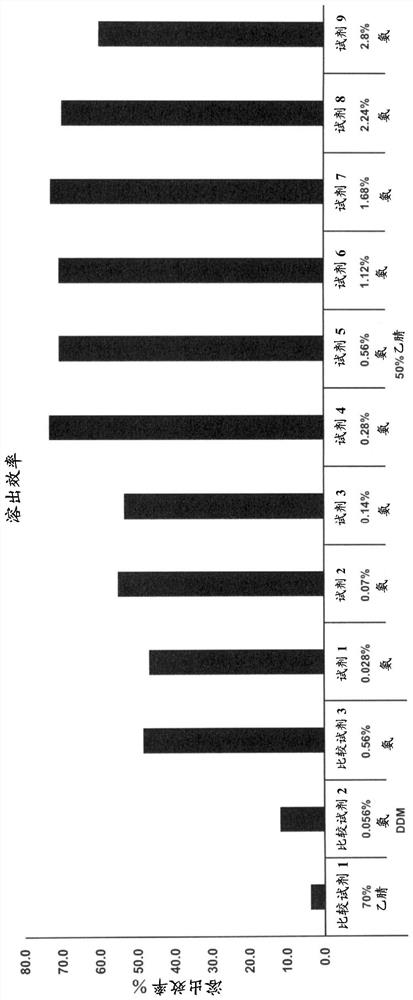
【图5】是显示因游离试剂的组成的差异的Aβ肽的溶出效率的差异的图。
【图6A】是显示因游离试剂的有机溶剂的差异的Aβ40肽的溶出效率的差异的图。
【图6B】是显示因游离试剂的有机溶剂的差异的Aβ42肽的溶出效率的差异的图。
【图7】是显示因游离试剂的组成的差异的遗留量的差异的图。
【图8A】是显示使用碱性溶液溶出190pg/ml Aβ40肽溶液时的Aβ40肽的量的图。
【图8B】是显示使用酸性溶液溶出190pg/ml Aβ40肽溶液时的Aβ40肽的量的图。
【图8C】是显示使用碱性溶液溶出103pg/ml Aβ42肽溶液时的Aβ42肽的量的图。
【图8D】是显示使用酸性溶液溶出103pg/ml Aβ42肽溶液时的Aβ42肽的量的图。
【图9A】是显示使用碱性溶液溶出50pg/ml Aβ40肽溶液时的Aβ40肽的量的图。
【图9B】是显示使用酸性溶液溶出50pg/ml Aβ40肽溶液时的Aβ40肽的量的图。
【图9C】是显示使用碱性溶液溶出26pg/ml Aβ42肽溶液时的Aβ42肽的量的图。
【图9D】是显示使用酸性溶液溶出26pg/ml Aβ42肽溶液时的Aβ42肽的量的图。
【具体实施方式】
本实施方式的Aβ肽的测定方法是将用抗体捕获的Aβ肽由质谱分析法测定的方法(以下,也称为“测定方法”)。此测定方法以由含有机溶剂的碱性溶液,从Aβ肽和抗体的复合体游离Aβ肽,将游离的Aβ肽由质谱分析法测定作为特征。
以往,在从用抗体捕获的受试物质(即,抗体和受试物质的复合体)游离受试物质时,使用酸性溶液。这是因为,酸性溶液一般对于解离受试物质和抗体的结合的作用优良。例如,在特开2018-194374号公报中记载了由任选含有机溶剂的pH1~4的酸性水溶液从复合体游离Aβ肽。但是,如后述的实施例所示,本发明人发现,含游离的Aβ肽的酸性溶液不适宜于与液相层析组合的质谱分析。具体而言,当直接在液相层析中使用含游离的Aβ肽的该酸性溶液时,在液相层析装置的流路及柱残留投入的Aβ肽的一部分,发生残留的Aβ肽遗留在以下的样品的测定的现象(称为遗留)。当发生遗留时,不能进行Aβ肽的正确的测定。为了降低遗留,考虑用酸性溶液游离Aβ肽之后,用碱性溶液进行溶剂更换。但是,即使用此方法可降低遗留,但也由于因溶剂更换而Aβ肽损失,有高灵敏度测定困难的情况。与此相比,在使用含有机溶剂的碱性溶液的本实施方式的测定方法中,遗留的Aβ肽的量显著地降低。从而,直接在液相层析中使用含游离的Aβ肽的碱性溶液也能进行Aβ肽的正确的测定,还无需溶剂更换。如上所述,由于血液试样与CSF相比Aβ肽的含量少,本实施方式的测定方法适宜于血液试样中的Aβ肽的定量测定。
在本实施方式的测定方法中,首先,向含Aβ肽的血液试样混合与Aβ肽特异性地结合的抗体而形成Aβ肽和抗体的复合体。Aβ肽和抗体的复合体可通过将含Aβ肽的血液试样和与Aβ肽特异性地结合的抗体混合来形成。
在本说明书中,“含Aβ肽的血液试样”的用语也可包含疑似含Aβ肽的血液试样。血液试样可举出例如血液(全血)、血浆、血清等。在这些之中,也优选血浆及血清。血液试样也可根据需要用适合的水性介质稀释。这样的水性介质只要是不妨碍后述的测定,就不特别限定,可举出例如水、生理盐水、缓冲液等。缓冲液优选在中性附近的pH(例如6以上8以下的pH)具有缓冲作用的缓冲液。这样的缓冲液可举出例如HEPES、MES、PIPES等的Good缓冲液、Tris缓冲生理盐水(TBS)、磷酸缓冲生理盐水(PBS)等。
血液试样的来源不特别限定,例如,也可为从受试者采集的血液及由其调制的血浆或血清。另外,也可使用市售的混合血浆、健康者血浆等。也可根据需要,向血液试样添加作为内部标准物质的标记Aβ肽。受试者不特别限定,可举出例如,健康者、认知功能有异常者及其疑似有异常者等。认知功能的异常可举出例如,轻度认知功能异常(MCI)、阿尔茨海默型认知症等。
Aβ肽是通过淀粉样β前体蛋白(APP)受由β分泌酶及γ分泌酶的处理而产生的多肽。Aβ肽只要是不特别言及,就含任何长度的多肽,通常为由39~43的氨基酸构成的多肽。作为Aβ肽,优选由40个氨基酸残基构成的Aβ40(DAEFRHDSGY EVHHQKLVFF AEDVGSNKGAIIGLMVGGVV:SEQ ID NO:1)及由42个氨基酸残基构成的Aβ42(DAEFRHDSGY EVHHQKLVFFAEDVGSNKGA IIGLMVGGVV IA:SEQ ID NO:2)。
Aβ肽可为单体,也可为多聚体的形态。多聚体也称为聚合物,由多个单体的Aβ肽物理或化学聚合或凝集而形成。多聚体可含多个单体的Aβ肽,也可含此外的分子。在多聚体中,单体的Aβ肽彼此无由共价键等强固地结合的必要。多聚体中也含因更缓慢的结合而多个单体的Aβ肽集合的凝集体。作为Aβ肽的多聚体,可举出例如Aβ寡聚体等。
在本说明书中,“抗体”的用语包含全长的抗体及其片段。作为抗体的片段,可举出例如Fab、Fab'、F(ab')2、Fd、Fd'、Fv、轻链、重链抗体的重链可变区域(VHH)、还原型IgG(rIgG)、单链抗体(scFv)等。与Aβ肽特异性地结合的抗体也可为单克隆抗体及多克隆抗体之任一者,优选为单克隆抗体。
可与Aβ肽特异性地结合的单克隆抗体本身是公知的,可举出例如,从Aβ肽的N末端的氨基酸残基数起,以第1~16的区域作为表位识别的克隆82E1的抗体(称为82E1抗体)、以第3~8的区域作为表位识别的克隆6E10的抗体(称为6E10抗体)、以第4~10的区域作为表位识别的克隆WO-2的抗体(称为WO-2抗体)、以第1~8的区域作为表位识别的克隆2H4的抗体(称为2H4抗体)、以第36~42的区域作为表位识别的克隆H31L21的抗体(称为H31L21抗体)、以第33~42的区域作为表位识别的克隆G2-11的抗体(称为G2-11抗体)、以第33~42的区域作为表位识别的克隆16C11的抗体(称为16C11抗体)、以第34~42的区域作为表位识别的克隆21F12的抗体(称为21F12抗体)、以第35~40的区域作为表位识别的克隆1A10的抗体(称为1A10抗体)等。这些单克隆抗体有市售。
在本实施方式中,作为与Aβ肽特异性地结合的抗体,优选使用与Aβ40及Aβ42的一方或两方结合的抗体。作为与Aβ40特异性地结合的抗体,可举出例如克隆1A10的抗体。作为与Aβ42特异性地结合的抗体,可举出例如克隆H31L21、G2-11、16C11及21F12的抗体。作为与Aβ40及Aβ42的两方结合的抗体,可举出例如克隆82E1、6E10、WO-2及2H4的抗体。通过使用这些抗体,血液试样中的Aβ肽之中,可选择性地捕获Aβ40及/或Aβ42。此时,在本实施方式的测定方法的游离工序中,可游离Aβ40及Aβ42的至少1种,在测定工序中,可取得Aβ40及Aβ42的至少1种的测定值。
在优选的实施方式中,使用与Aβ40及Aβ42的两方结合的抗体。此时,在本实施方式的测定方法的游离工序中,可游离Aβ40及Aβ42,在测定工序中,可取得Aβ40的测定值及Aβ42的测定值。
在本实施方式的测定方法中,为了选择性地取得由抗体捕获的Aβ肽,优选在固相上形成Aβ肽和抗体的复合体。通过使含复合体的溶液和可固定抗体的固相接触,可在固相上形成复合体。或者,也可预先将与Aβ肽特异性地结合的抗体固定于固相而使用。通过使用固定于固相的抗体,可在固相上形成复合体。具体而言,通过将固定了与Aβ肽特异性地结合的抗体的固相和血液试样混合,在固相上形成了复合体。进而,通过对未反应的成分和固相进行分离,回收固相,可选择性地取得复合体。
固相只要是能固定抗体的不溶性的载体即可。抗体向固相的固定的实施方式不特别限定。例如,可使抗体和固相直接键合,也可使抗体和固相经别的物质间接结合。作为直接的结合,可举出例如物理的吸附等。作为间接的结合,可举出例如,将与抗体特异性地结合的分子固定化于固相上,经该分子和抗体的结合而将抗体固定于固相上。作为与抗体特异性地结合的分子,可举出蛋白A或G、特异性地识别抗体的抗体(第二抗体)等。另外,也可使用介于抗体和固相之间的物质的组合而将抗体固定于固相上。作为这样的物质的组合,可举出生物素类和亲和素类、半抗原和抗半抗原抗体等的组合。生物素类含生物素、以及脱硫生物素及氧基生物素等的生物素类似物。亲和素类含亲和素、以及链霉亲和素及Tamavidin(注册商标)等的亲和素类似物。作为半抗原和抗半抗原抗体的组合,可举出具有2,4-二硝基苯基(DNP)基的化合物和抗DNP抗体的组合。例如,可通过使用预先用生物素类(或者具有DNP基的化合物)修饰的抗体和预先结合亲和素类(或者抗DNP抗体)的固相,经生物素类和亲和素类的结合(或者DNP基和抗DNP抗体的结合)而将抗体固定于固相上。
固相的原料不特别限定,可例如,选自有机高分子化合物、无机化合物、生物体高分子等。作为有机高分子化合物,可举出乳胶、聚苯乙烯、聚丙烯、苯乙烯-甲基丙烯酸共聚物、苯乙烯-缩水甘油基(甲基)丙烯酸共聚物、苯乙烯-苯乙烯磺酸盐共聚物、甲基丙烯酸聚合物、丙烯酸聚合物、丙烯腈丁二烯苯乙烯共聚物、氯乙烯-丙烯酸酯共聚物、聚醋酸乙烯基丙烯酸酯等。作为无机化合物,可举出磁性体(氧化铁、氧化铬、钴及铁素体等)、氧化硅、氧化铝、玻璃等。作为生物体高分子,可举出不溶性琼脂糖、不溶性葡聚糖、明胶、纤维素等。也可将这些中的2种以上组合使用。固相的形状不特别限定,可举出例如粒子、微平板、微管、试管等。在它们之中,也优选粒子,特别优选磁性粒子。在作为固相,使用粒子时,在本实施方式的测定方法中的复合体的形成工序相当于一般的免疫沉降法。
接下来,在本实施方式的测定方法中,由含有机溶剂的碱性溶液(以下,也称为“游离试剂”)从复合体游离Aβ肽。游离试剂被认为具有解离抗体和Aβ肽的结合的作用。在优选的实施方式中,将含在固相上形成的复合体的溶液和游离试剂混合。由此,从复合体游离Aβ肽,在混合液中存在游离的Aβ肽和固定了抗体的固相。例如,在固相是磁性粒子时,可通过由离心分离或磁分离分离固定了抗体的固相和含Aβ肽的溶液来回收含Aβ肽的溶液。
复合体和游离试剂的接触的条件不特别限定,例如,在4℃以上42℃以下的温度,使游离试剂和复合体接触,静置或搅拌1分钟以上10分钟以下的时间即可。游离试剂的使用量不特别限定,例如,可从每1样品10μL以上50μL以下的范围适宜确定。
游离试剂可通过将碱性溶液和有机溶剂混合,或者通过将水、碱性物质和有机溶剂混合而得到。碱性溶液可通过将水和碱性物质混合而得到。也可使用氨水等的市售的碱性溶液。作为碱性物质,可举出例如,提供铵离子的物质等。作为提供铵离子的物质,可举出例如氨、碳酸铵、碳酸氢铵等。游离试剂中的碱性物质可为1种,也可为2种以上。
作为有机溶剂,可举出例如,乙腈、丙酮、1-丙醇、2-丙醇、己烷、乙醇、二甲基亚砜或甲醇等。游离试剂中的有机溶剂可为1种,也可为2种以上。在本实施方式中,游离试剂优选作为有机溶剂而含至少乙腈,更优选作为有机溶剂而仅含乙腈。
溶出试剂中的有机溶剂的浓度不特别限定,优选为20%以上、30%以上或40%以上。另外,优选为65%以下,60%以下或55%以下。再者,在本说明书中,有机溶剂的浓度“%”全部是体积/体积%(v/v%)。
游离试剂的pH只要是本领域技术人员识别为碱性的pH,就不特别限定。游离试剂的pH优选为10.85以上、10.9以上、10.95以上、11.0以上、11.05以上、11.1以上、11.15以上、11.2以上、11.25以上、11.3以上、11.35以上或11.4以上。最优选地,游离试剂的pH是11.4以上。由此,可从复合体特别有效游离Aβ肽。另外,游离试剂的pH优选为14.0以下,13.5以下,13.0以下,12.5以下,12.4以下,12.35以下,12.3以下,12.25以下,12.2以下,12.15以下,12.1以下,12.05以下或12.0以下。
游离试剂的pH可由碱性物质的添加量(或者浓度)调整。在作为碱性物质,使用氨或其盐时,游离试剂中的铵离子的摩尔浓度优选为5.29mM以上、10.57mM以上、26.43mM以上、52.85mM以上、105.71mM以上、或者132.14mM以上。另外,所述摩尔浓度优选为1586mM以下,1533mM以下,或者1480mM以下。例如,在碱性物质是氨时,游离试剂中的氨的浓度优选为0.01%以上、0.02%以上、0.05%以上、0.1%以上、0.2%以上或0.25%以上。另外,所述浓度优选为3%以下,2.9%以下或2.8%以下。再者,在本说明书中,氨的浓度“%”全部是重量/重量%(w/w%)。
本实施方式的测定方法也可在复合体形成工序和游离工序之间,包括除去不形成复合体的未反应的游离成分的清洗工序。此清洗工序含B/F(Bound/Free)分离。未反应的游离成分是指不构成复合体的成分,可举出例如,不与Aβ肽结合的抗体。清洗方法不特别限定,例如,在使复合体在固相上形成时,当固相是粒子时,通过由离心分离或磁分离回收粒子,除去上清,可对复合体和未反应的游离成分进行分离。当固相是微平板或微管等的容器时,通过除去含未反应的游离成分的液,可对复合体和未反应的游离成分进行分离。也可在除去未反应的游离成分之后,将捕获复合体的固相用PBS等的适合的水性介质清洗。
进而,在本实施方式的测定方法中,将游离的Aβ肽由质谱分析法测定。质谱分析法只要是可测定到游离的Aβ肽,就不特别限定,可使用可对Aβ肽进行测定的公知的离子化法。作为这样的离子化法,可举出例如电子喷雾离子化(ESI)法、大气压化学离子化(APCI)法或基质支援激光脱离离子化(MALDI)法等。这些中,特别优选ESI法。
在质谱分析法中使用的质谱分析计不特别限定,可从公知的质谱分析计适宜选择。例如,可举出四重极(Q)型质谱分析计、离子捕获型(IT)型质谱分析计、飞行时间(TOF)型质谱分析计、傅里叶变换离子回旋共振(FTICR)型质谱分析计、IT-TOF型质谱分析计、Q-TOF型质谱分析计、及三重四重极(QqQ)型质谱分析计等。这些中,优选使用能进行MS/MS测定的质谱分析计进行测定,更优选使用三重四重极型质谱分析计进行测定。
在质谱分析法中,优选使用组合了质谱分析计和液相层析装置的液相层析-质谱分析(Liquid Chromatography-Mass Spectrometry:LC-MS),更优选使用组合了能进行液相层析和MS/MS测定的质谱分析计的LC-MS/MS。
作为液相层析装置,只要是可与质谱分析计连接,就不特别限定,可使用市售的HPLC(高效液相层析:High Performance Liquid Chromatography)装置。与液相层析装置连接的柱不特别限定,可使用市售的HPLC用柱。在本实施方式中,可将游离到游离试剂中的Aβ肽供于液相层析装置。因此,无需溶剂更换的任何测定前的处理。
柱不特别限定,例如,可使用逆相柱。作为逆相柱的填充材,可举出例如,氧化硅系的填充材、聚合物系的填充材等。在它们之中,也优选氧化硅系的填充材。作为具有氧化硅系的填充材的逆相柱,更优选耐碱性的ODS柱。
作为在液相层析中使用的溶剂(移动相),可使用与游离试剂相同的组成的溶液、或者在游离试剂中使用的碱性溶液。移动相中的有机溶剂的浓度不特别限定,可对应于测定条件适宜设定。液相层析可使用利用单一浓度的移动相的等度法而进行,也可使用将组成不同的多种移动相组合使用的逐步法或梯度法而进行。
在测定中的移动相的流速可对应于装置及柱的材质、耐压性等的性质适宜设定。移动相的流速优选设定为适合地进行质谱分析的流速。另外,向柱温度或测定装置的试样的导入量等也可适应于测定装置及柱而适宜设定。
在本实施方式中,可用液相层析装置进行测定,也可取得试样相关信息。作为进行测定的检测器,可举出例如,UV检测器、荧光检测器、提示折射率检测器、电导率检测器或电化学检测器等。
用质谱分析法的Aβ肽的测定可根据使用的离子化法及质谱分析计而从公知的技术适合地设定。其中,在使用三重四重极型质谱分析计时,Aβ肽优选由测定模式设为阳性离子测定模式的多重反应监测(MRM)测定测定。
三重四重极型质谱分析计夹碰撞池(Q2)而在其前后具备第1四重极(Q1)及第3四重极(Q3)。测定对象物在离子源离子化而成为前体离子,仅具有用Q1设定的特定的质量电荷比(m/z)的离子通过滤器而导入到Q2。具有导入到Q2的特定的质量电荷比的前体离子与无活性气体冲击而断裂,变得产物离子。从Q2传送到Q3的产物离子在Q3再经过滤器,仅具有特定的质量的离子通过滤器而从Q3向检测器传送,检测到信号。由此,对于特定的前体离子的特定的产物离子用检测器检测。其中,将用Q1设定的特定的质量电荷比和由Q3设定的特定的质量电荷比的组合称为MRM转换。通过在MRM测定设定多个此MRM转换,可同时检测多个产物离子。由此,可对测定对象物中所含的多个物质同时进行测定。例如,可通过对于含Aβ40及Aβ42的试样设定各自的MRM转换而对2种Aβ肽同时进行测定而取得各自的测定值。
在MRM测定中,测定模式不特别限定,优选以阳性离子测定模式使用质谱分析计。另外,在MRM测定中的锥电压及碰撞能也不特别限定,可由本领域技术人员适宜设定为适合的条件。
作为对于Aβ40的MRM转换,可例如设为前体离子/产物离子=1083/1953.6,作为对于Aβ42的MRM转换,可设为前体离子/产物离子=1129/1078.5。通过设定这样MRM转换,可高灵敏度地检测Aβ肽。
在本实施方式的测定方法中,也可将血液试样和被标记的内部标准物质混合,基于内部标准物质的测定值而取得Aβ肽的测定值。作为内部标准物质,只要是能进行Aβ肽的定量的物质,就不特别限定,优选为被稳定同位素标记的Aβ肽。作为被稳定同位素标记的Aβ肽,可举出例如,被N15稳定同位素标记的Aβ40及Aβ42。内部标准物质的添加量只要是测定装置能测定的浓度,就不特别限定,可根据测定装置的分析能力而适宜设定。
与用于检测Aβ肽的MRM转换一同,作为内部标准,对于用稳定同位素标记的Aβ肽也设定MRM转换而进行测定,可取得测定值。作为对于用N15稳定同位素标记的Aβ40的MRM转换,可设为前体离子/产物离子=1096/1066.5,作为对于用N15稳定同位素标记的Aβ42的MRM转换,可设为前体离子/产物离子=1142.5/1091.5。
进一步的的实施方式是在本实施方式的测定方法中使用的试剂组合物。此试剂组合物是含有机溶剂的碱性溶液。对于含有机溶剂的碱性溶液如上所述。通过使用试剂组合物,可从Aβ肽和与Aβ肽特异性地结合的抗体的复合体高效率地游离Aβ肽。
试剂组合物的pH只要是本领域技术人员识别为碱性的pH,就不特别限定。试剂组合物的pH优选为10.85以上、10.9以上、10.95以上、11.0以上、11.05以上、11.1以上、11.15以上、11.2以上、11.25以上、11.3以上、11.35以上或11.4以上。最优选地,试剂组合物的pH是11.4以上。由此,可从复合体特别有效游离Aβ肽。另外,试剂组合物的pH优选为14.0以下,13.5以下,13.0以下,12.5以下,12.4以下,12.35以下,12.3以下,12.25以下,12.2以下,12.15以下,12.1以下,12.05以下或12.0以下。
试剂组合物也可以不影响自复合体的Aβ肽的游离、及由质谱分析法的Aβ肽的测定的程度含稳定化剂等的添加物。作为添加物,可举出牛血清白蛋白(BSA)、人白蛋白、卵清蛋白、葡萄糖等的单糖类、麦芽糖等的二糖类、甘露糖醇、山梨糖醇等的糖醇、或者甘氨酸等的氨基酸等。添加物可为1种,也可为2种以上。优选以相对于含有机溶剂的碱性溶液100重量份而0重量份以上20重量份以下的范围含添加物。另外,试剂组合物也可收容在不影响试剂组合物的组成的适合的容器中。图1是显示收容所述试剂组合物的容器151的一例的图。
以下,由实施例进一步具体性地说明本发明。
【实施例】
【实施例1:将使用含有机溶剂的碱性溶液的免疫沉降和质谱分析法组合使用的血浆Aβ肽的测定】
使用含有机溶剂的碱性溶液,从Aβ肽和与Aβ肽特异性地结合的抗体的复合体游离Aβ肽,使用质谱分析法对Aβ肽进行测定。
(1)使用免疫沉降的Aβ肽的捕获-游离
(1.1)血液试样
作为含Aβ肽的血液试样,使用不同批的5种市售的血浆试样(ProMedeX公司)。
(1.2)与Aβ肽特异性地结合的抗体
作为与Aβ肽特异性地结合的抗体,使用作为市售的小鼠单克隆抗Aβ抗体的6E10抗体(BioLegend公司)。由惯用的方法将6E10抗体固定化于磁性粒子(M-270Epoxy-activatedDynabeads:Thermo Fisher Scientific公司)。
(1.3)Aβ肽
为了校准曲线的制成,Aβ40肽及Aβ42肽从AnaSpec公司购入。作为内部标准物质,使用作为被稳定同位素
(1.4)含有机溶剂的碱性溶液的调制
作为含有机溶剂的碱性溶液(游离试剂),向纯水12.8ml加28%浓氨水(NACALAITESQUE公司)1.2ml和乙腈(关东化学公司)6.0ml而混合,调制1.68%氨/30%乙腈溶液。
(1.5)免疫沉降
向1.5ml的样品管(Eppendorf公司)加250μl的血浆试样或上述(1.3)中调制的各Aβ40肽溶液或Aβ42肽溶液。向含上述溶液的各样品管加含上述(1.3)中调制的15N-Aβ40及15N-Aβ42的溶液250μl,于室温静置30分钟。静置后,向各试样溶液加固定化上述(1.2)中调制的6E10抗体的磁性粒子(4μg抗体/0.4mg磁性粒子)悬浮液40μl,使用旋转器于室温颠倒混合1小时,形成Aβ肽和抗体的复合体。将这些溶液使用磁力架集磁而除上清。
(1.6)清洗工序
除上清之后,向残留在样品管的磁性粒子加含1mL的3%BSA的PBS溶液而混合后,再集磁而除上清。将此操作在1mL的含3%BSA的PBS溶液中持续2次、在1mL的50mM醋酸铵溶液中持续2次、在1mL的超纯水中持续1次而进行,清洗磁性粒子。
自(1.7)复合体的Aβ肽的游离
上述(1.6)中的磁性粒子的清洗后,向除去清洗液而残留的磁性粒子添加25μL的上述(1.4)中调制的游离试剂而混合,静置1分钟。对磁性粒子进行再集磁,以上清作为溶出液回收。
(2)质谱分析法
将上述(1.7)中调制的溶出液供于LC-MS/MS而进行MRM测定,对Aβ肽进行测定。在LC-MS/MS的液相层析部分使用ACQUITY(注册商标)UPLC(注册商标)H-类生物系统(Waters公司:以下也称为UPLC)。作为柱,使用作为逆相柱的ACQUITY(注册商标)UPLC(注册商标)肽BEH C
将各溶出液放置于UPLC的自动采样机,向UPLC导入溶出液10μl,附梯度而进行分级分离。梯度的条件如以下一样进行。
【表1】
供于梯度而从柱溶出的溶离液供于直接与UPLC连接的TQ-XS质谱分析计。TQ-XS质谱分析计使用电子喷雾离子化法,以阳性离子模式测定。MRM测定的条件如以下的表2一样设定。
【表2】
(3)测定结果
使用LC-MS/MS的测定结果示于图2、图3A及图3B。在图2显示对于Aβ40肽、Aβ42肽、15N-Aβ40及15N-Aβ42的MRM测定的结果,在图3A及图3B显示测定的血浆受试体中的Aβ40肽及Aβ42肽浓度。这些结果表明,可使用含有机溶剂的碱性溶液而从复合体游离Aβ肽,使用质谱分析法对Aβ肽进行测定。
图4A及图4B中记载了基于使用上述(1.3)中调制的浓度已知的Aβ肽检测的测定值而制成校准曲线的结果。如图4A及图4B一样,在Aβ40肽及Aβ42肽之任一者中,均可制成R
【实施例2:溶出效率的比较】
变更游离试剂的组成,基于以下的计算式算出因游离试剂的组成的差异的自复合体的Aβ肽的溶出效率而进行比较。
[溶出效率(%)]=[试样C的Aβ肽浓度]/([试样A的Aβ肽浓度]-[试样B的Aβ肽浓度])×100
(1)对于游离试剂中的碱性物质的比较
(1.1)游离试剂的调制
向纯水中以成为以下的表3的组成的方式适宜选择DDM(n-十二烷基-β-D-麦芽糖苷、Sigma-Aldrich公司)、乙腈及/或28%浓氨水而混合,调制各种各样的游离试剂。其中,将不含碱性物质或有机溶剂的溶液简称为游离试剂。调制后,使用pH计(株式会社堀场制作所)测定含碱性物质的溶液的pH。
【表3】
(1.2)试样调制
将实施例1的(1.3)中使用的Aβ40肽以成为1000pg/ml的方式悬浮于含3%BSA的PBS溶液中而调制试样A。试样A的Aβ肽浓度与Aβ40肽的初浓度相对应。
(1.3)免疫沉降
对于上述(1.2)中调制的试样A,与实施例1的(1.5)同样地进行免疫沉降,回收磁性粒子。此时,回收集磁后的上清,作为试样B保存。试样B的Aβ肽浓度与未用与Aβ肽特异性地结合的抗体捕获的Aβ肽的浓度相对应。
(1.4)清洗-溶出
对于上述(1.3)中回收的磁性粒子,与实施例1的(1.6)同样地进行清洗操作,除去清洗液。对于清洗后的磁性粒子添加上述(1.1)中调制的各游离试剂15μl,静置1分钟,使Aβ肽游离。静置后,对磁性粒子进行集磁,回收上清。向回收的上清混合含300mM Tris、300mMNaCl的pH中和液(pH 7.4)而得到试样C。试样C的Aβ肽浓度与通过免疫沉降捕获后游离的Aβ肽的浓度相对应。
(2)由免疫测定的测定
对于上述的试样A、B及C,由使用全自动免疫测定装置HISCL(注册商标)-5000(Sysmex株式会社)的免疫测定测定各试样中的Aβ肽浓度。将82E1抗体由惯用的方法用生物素标记而溶解于pH7.5的含1%BSA、0.1M Tris-HCl、0.15M NaCl、0.1%NaN
由HISCL(注册商标)-5000的测定程序如下。将试样A、B或C(30μL)和R1试剂(110μL)混合,于42℃反应4分钟。反应后,添加R2试剂(30μL),于42℃反应3分钟。对得到的混合液中的磁性粒子进行集磁而除上清,加HISCL(注册商标)清洗液(300μL)而清洗磁性粒子。除上清,向磁性粒子添加R3试剂(100μL)而混合,于42℃反应5分钟。对得到的混合液中的磁性粒子进行集磁而除上清,再加HISCL(注册商标)清洗液(300μL)而清洗磁性粒子。除上清,向磁性粒子添加R4试剂(50μL)及R5试剂(100μL),对化学发光强度进行测定。作为校准物(校准曲线制成用抗原),使用将Aβ40肽以各自成为0pg/ml、8.6pg/ml、33.3pg/ml、99.2pg/ml、319.1pg/ml及1188.1pg/ml的方式悬浮于含0.1%BSA、0.14M三乙醇胺、0.15M NaCl、0.1%NaN
(3)测定结果
对于表3的比较试剂1~3及试剂1~9的溶出效率的测定结果示于图5。如图5中所示,仅用有机溶剂,或仅用碱性溶液的游离试剂则溶出效率低,当作为Aβ肽的游离试剂而使用含有机溶剂及碱性物质的游离试剂时,得到了高的溶出效率。特别是表明,pH是11.4以上12.0以下的试剂得到了超越70%的高的溶出效率。
(4)对于游离试剂的有机溶剂的比较
在上述(1.1)中,代替表3的游离试剂而使用以下的表4的游离试剂,对溶出效率进行测定。在比较试剂5及试样17~23中,作为试样,代替Aβ40肽而使用Aβ42肽。在使用Aβ42肽时,作为检测抗体,代替1A10抗体而使用H31L21抗体,作为校准物,使用将Aβ42肽以各自成为0pg/ml、0.5pg/ml、6.1pg/ml、65.2pg/ml及804.5pg/ml的方式悬浮于含0.1%BSA、0.14M三乙醇胺、0.15M NaCl、0.1%NaN
【表4】
对于比较试剂4及试样10~16的测定结果示于图6A,对于比较试剂5及试样17~23的测定结果示于图6B。从图6A及图6B得知,与不含有机溶剂的比较试剂4及5相比,试样10~16及17~23的方显示优良的溶出效率,通过游离试剂含碱性物质及有机溶剂而得到了优良的溶出效率。
【实施例3:遗留测定】
以往,在从用抗体捕获的Aβ肽和抗体的复合体游离Aβ肽时,使用酸性溶液。其中,对于由使复合体溶出的游离试剂的酸性-碱性条件的Aβ肽向液相层析装置的遗留进行测定。
(1)试样调制
作为酸性的游离试剂,向纯水混合蚁酸(富士胶卷和光纯药株式会社)及乙腈,调制具有0.1%蚁酸、50%乙腈的组成的酸性的游离试剂(其中,将酸性的溶液简也称为游离试剂)。另外,与实施例1的(1.4)同样地调制游离试剂(1.68%氨、50%乙腈)。以成为100fmol/μl的终浓度的方式向这些游离试剂添加与实施例1的(1.3)相同的Aβ40肽(含有Aβ40肽的溶液)。另外,对于酸性的游离试剂、碱性的游离试剂各自,还准备不含Aβ40肽的溶液(未含有Aβ40肽的溶液)。
(2)试样向液相层析的导入
将上述(1)中调制的4种溶液供于LC-MS/MS。LC-MS/MS的装置及使用的柱使用记载在实施例1的(2)的质谱分析法。将各溶液放置于UPLC的自动采样机,向UPLC导入各溶液10μl而分级分离。UPLC的分析条件如以下的表5一样进行。在质谱分析法中的MRM测定的条件如实施例1的表2。
【表5】
向UPLC以未含有Aβ40肽的溶液(背景)、含有Aβ40肽的溶液、未含有Aβ40肽的溶液(遗留测定)的顺序供给上述(1)中调制的2种含有Aβ40肽的溶液及与它们相对应的未含有Aβ40的溶液,对在此时得到的信号强度进行比较的结果示于图7。从图7得知,在使用酸性的游离试剂时,与使用碱性的游离试剂时相比,发生大量的遗留。一方面,当以碱性的游离试剂作为Aβ肽的游离试剂时,可显著地抑制遗留。从而表明,在使用质谱分析法的Aβ肽的连续的分析中,使用碱性的游离试剂是适合的。
【实施例4:对于游离试剂的酸性-碱性的比较】
如上述实施例3一样,当将使用酸性的游离试剂游离的Aβ肽用LC-MS/MS测定时,发生遗留。其中,在Aβ肽自复合体游离时,对于使用碱性的游离试剂时和游离时使用酸性的游离试剂,但在其后取代为碱性的游离试剂而供于LC-MS/MS时检测的Aβ肽量的差异而比较。
(1)试样调制
作为Aβ肽试样,各自准备使用与实施例1的(1.3)相同的Aβ40肽及Aβ42肽,在3%BSA溶液中以Aβ40肽成为50pg/ml或190pg/ml的方式调制的溶液、或者在3%BSA溶液中以Aβ42肽成为26pg/ml或103pg/ml的方式调制的溶液而使用。作为酸性的游离试剂,向纯水混合三氟醋酸(TFA、富士胶卷和光纯药株式会社公司)及乙腈而调制具有0.1%TFA、30%乙腈的组成的酸性溶液。作为碱性的游离试剂,与实施例1的(1.4)同样地调制1.68%氨、50%乙腈溶液。
(2)测定
(2.1)免疫沉降
对于上述(1)中调制的各试样,与实施例1的(1.5)同样地加内部标准,加使6E10抗体固定化的磁性粒子,形成复合体。
(2.2)Aβ肽的溶出
对于上述(2.1)中调制的各复合体进行与实施例1的(1.6)同样的清洗工序之后,添加上述(1.1)中调制的25μL的酸性的游离试剂或碱性的游离试剂而混合,静置1分钟。对磁性粒子进行再集磁,以上清作为溶出液回收。
(2.3)溶剂更换
上述(2.2)中回收的各溶出液之中,对于使用酸性的游离试剂得到的溶出液,使用旋干燥器标准品VC-96R(TAITEC株式会社),以SpinDryer模式,转数:1500r/min、温度:在55℃的条件下进行减压干燥1小时,使溶剂挥发。对于减压干燥后的残留物添加上述(1)中调制的25μL的碱性的游离试剂而使残留物再悬浮。
(2.4)质谱分析法
将上述(2.2)中回收的使用各碱性的游离试剂得到的溶出液(作为溶液X)及上述(2.3)中再悬浮的溶液(作为溶液Y)与实施例1的(2)同样地供于LC-MS/MS,进行MRM测定。
(3)测定结果
溶液A及溶液B的测定结果各自示于图8A~图9D。图8A显示使用190pg/ml的Aβ肽40的溶液X、图8B显示使用190pg/ml的Aβ40肽的溶液Y、图8C显示使用103pg/ml的Aβ42肽的溶液X、图8D显示使用103pg/ml的Aβ42肽的溶液Y、图9A显示使用50pg/ml的Aβ40肽的溶液X、图9B显示使用50pg/ml的Aβ40肽的溶液Y、图9C显示使用26pg/ml的Aβ42肽的溶液X,图9D显示使用26pg/ml的Aβ42的溶液Y的测定结果。这些结果表明,在全部浓度的Aβ肽的例中,与使用溶液Y时相比,使用溶液X时的方的面积值大。在试样处理中,当使用如上述(2.3)一样的过程时,提示发生Aβ肽的损失。
【符号的说明】
151:试剂容器
序列表
<110> SYSMEX CORPORATION
<120> Aβ肽的测定方法及在该方法中使用的试剂组合物
<130> 20-003JP
<160> 2
<170> PatentIn version 3.5
<210> 1
<211> 40
<212> PRT
<213> 智人(Homo sapiens)
<400> 1
Asp Ala Glu Phe Arg His Asp Ser Gly Tyr Glu Val His His Gln Lys
1 5 10 15
Leu Val Phe Phe Ala Glu Asp Val Gly Ser Asn Lys Gly Ala Ile Ile
20 25 30
Gly Leu Met Val Gly Gly Val Val
35 40
<210> 2
<211> 42
<212> PRT
<213> 智人(Homo sapiens)
<400> 2
Asp Ala Glu Phe Arg His Asp Ser Gly Tyr Glu Val His His Gln Lys
1 5 10 15
Leu Val Phe Phe Ala Glu Asp Val Gly Ser Asn Lys Gly Ala Ile Ile
20 25 30
Gly Leu Met Val Gly Gly Val Val Ile Ala
35 40
- 新型二肽分解酶及其制造方法、使用该二肽分解酶对糖化蛋白质等进行测定的方法、以及用于该测定方法的试剂组合物
- 黑腹果蝇中胰岛素样肽ILP系列基因表达水平检测的引物组合物、试剂盒及其使用方法
