一类GLP-1/glucagon/Y2受体三重激动剂及其应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于生物医药技术领域,具体涉及一类GLP-1/glucagon/Y
背景技术
肥胖及其相关代谢综合征已成为全球性的公众健康问题,许多代谢综合征如2型糖尿病(T2DM)、非酒精性脂肪肝病(NAFLD)、非酒精性脂肪肝炎(NASH)、血脂代谢异常的发病率与病程发展都与肥胖密切相关。GLP-1是由小肠L细胞所分泌的一种葡萄糖依赖性降血糖多肽激素,其最主要的功能就是促进胰岛素的分泌。胰高血糖素糖肽-1(GLP-1)可以抑制食欲、延缓胃排空实现降低体重的作用。虽然GLP-1具有优异的降糖作用和一定的减重效果,但是如果需要实现较好的体重减轻作用,一般需要加大给药剂量,而大剂量给予GLP-1类药物容易产生胃肠道副作用、耐受性差而导致治疗窗较窄。因此,仍然需要更为安全耐受的,可有效减轻体重和控制血糖的治疗剂。
胰高血糖素(glucagon)是在胰脏的α细胞中生成的激素,在机体寒冷、饥饿等应激状态下作用于肝脏,将肝脏中的糖原进行分解而提高血糖。另外,glucagon在体内还具有促进脂解、脂肪氧化、发热等作用(Diabetologia,2017,60,1851–1861),长期给药可以通过增加能量代谢量而呈现出体重减轻药效,但glucagon这些对能量代谢的有益作用因其固有的升血糖作用而未能得以应用。在动物和人体内外周给予GLP-1和glucagon可同时实现降血糖和减轻体重的效果,目前已有多种GLP-1/glucagon受体双重激动剂在临床研究阶段,但是GLP-1/glucagon受体双重激动剂存在胃肠道副作用较大的缺陷。
神经肽Y(NPY)是一种36个氨基酸肽的神经递质,是已经显示存在于外周和中枢神经系统两者中的神经递质/神经激素的胰腺多肽类别的成员。NPY是已知的最有效的开胃剂之一,并且显示在调节包括人的动物的食物摄取上具有重要作用。NPY受体共有4种亚型,Y
肽YY
目前,还缺乏能同时整合GLP-1、glucagon和PYY
发明内容
本发明的目的是提供一类具有GLP-1/glucagon/Y
为实现上述发明目的,本发明的技术方案具体如下:
一类GLP-1/glucagon/Y
(1)SEQ ID NO:1
(2)SEQ ID NO:2
(3)SEQ ID NO:3
(4)SEQ ID NO:4
(5)SEQ ID NO:5
(6)SEQ ID NO:6
(7)SEQ ID NO:7
(8)SEQ ID NO:8
(9)SEQ ID NO:9
。
本发明还提供了一类GLP-1/glucagon/Y
优选的,所述盐为GLP-1/glucagon/Y
本发明还提供了GLP-1/glucagon/Y
本发明还提供了含有一类GLP-1/glucagon/Y
本发明还提供了本发明所述的GLP-1/glucagon/Y
与现有技术相比,本发明的有益效果:
本发明提供一类基于GLP-1类似物、glucagon和PYY
附图说明
图1显示的是各受试物单次给药在ICR小鼠上的摄食抑制作用结果示意图;
图2显示的是各受试物单次给药在ICR小鼠上的急性降血糖作用结果示意图;
图3显示的是各受试物在DIO小鼠长期给药21天的体重变化百分比结果示意图。
具体实施方式
以下结合附图和具体实施例对本发明作进一步详细说明。
除非本文另有定义,否则本申请书中所使用的科学和技术术语应具有本领域普通技术人员通常理解的含义。通常,本文所述的与化学、生物学、药理学关联使用的术语和方法是本领域中公知和常用的。
另外,本发明涉及的氨基酸根据IUPAC-IUB的命名规则缩写如下:
丙氨酸(Ala,A);精氨酸(Arg,R);天冬酰胺(Asn,N);天冬氨酸(Asp,D);半胱氨酸(Cys,C);谷氨酸(Glu,E);谷氨酰胺(Gln,Q);甘氨酸(Gly,G);组氨酸(His,H);异亮氨酸(Ile,I);亮氨酸(Leu,L);赖氨酸(Lys,K);甲硫氨酸(Met,M);苯丙氨酸(Phe,F);脯氨酸(Pro,P);丝氨酸(Ser,S);苏氨酸(Thr,T);色氨酸(Trp,W);酪氨酸(Tyr,Y);缬氨酸(Val,V)。
另外,除非明确标明,本发明的多肽化合物中的所有氨基酸残基优选为L构型。
另外,所述序列的C端上的“-NH
另外,本发明序列中除了天然氨基酸以外,还使用了非天然氨基酸右旋丝氨酸(
实施例1
SEQ ID NO:1多肽化合物的合成
(1)树脂的溶胀
称取担载量为0.36mmol/g的Rink Amide MBHA树脂0.278g(0.1mmol当量),放入25mL的反应器中,用7mL的DCM和甲醇交替清洗树脂1次,7mL的DCM清洗树脂2次,然后用7mL的DCM溶胀树脂1h,最后用7mL DMF清洗树脂3次。
(2)树脂Fmoc保护基的脱除
将溶胀后的树脂转入PSI-200多肽合成仪,加入7mL 20%哌啶/DMF(v/v)室温反应5min,滤去脱保护溶液,7mL DMF清洗树脂一次,再加入7mL 20%哌啶/DMF(v/v)脱保护溶剂与树脂反应15min,最后7mL DMF清洗树脂4次,每次2min,得到脱除Fmoc保护基的Rink树脂。
(3)Fmoc-Tyr-Rink amide-MBHAResin的合成
称Fmoc-Tyr(tBu)-OH(0.4mmol),用2mL DMF溶解,加入3mL DIC/HOBt(0.4mmol/0.44mmol)缩合剂,加入反应器中,室温震荡反应2h,滤去反应液后用7mL DMF清洗树脂4次,使用Kaiser试剂检测反应耦合是否完全,如不完全则2次耦合。
(4)PYY部分(右侧部分)肽链的延长
按照PYY部分肽链的序列(IKPEA PGEDA SPEEL NRYYA SLRHY LNLVT RQRY-NH
(5)连接臂的合成
在PYY部分肽链合成完毕后,继续合成连接臂部分,加入0.4mmol的Fmoc-AEEA-OH,0.4mmol的DIC及0.44mmol的HOBt,震荡缩合反应2h。脱除Fmoc保护基后,再次加入0.4mmol的Fmoc-AEEA-OH,0.4mmol的DIC及0.44mmol的HOBt,震荡缩合反应2h。脱除Fmoc保护基后,加入0.4mmol的3-马来酰亚胺基丙酸,0.4mmol的DIC及0.44mmol的HOBt,震荡缩合反应2h。
(6)包含连接臂的PYY部分的裂解
将上述得到的连有多肽的树脂转移至圆底瓶中,使用切割剂Reagent R(TFA/苯甲硫醚/苯酚/EDT,90:5:3:2,V/V)5mL切割树脂,在油浴中恒温30℃反应2h,切割液倾入40mL冰乙醚中,冷冻离心后粗品用15mL冰乙醚洗涤3次,最后用氮气吹干,得到包含连接臂的PYY部分的粗肽。
(7)GLP-1/glucagon部分(左侧部分)序列的合成
称取担载量为0.36mmol/g的Rink Amide MBHA树脂0.278g(0.1mmol当量),放入25mL的反应器中,用10mL的DCM和甲醇交替清洗树脂1次,10mL的DCM清洗树脂2次,然后用10mL的DCM溶胀树脂1h,最后用10mL DMF清洗树脂3次。将溶胀后的树脂转入PSI-200多肽合成仪,加入10mL 20%哌啶/DMF(v/v)室温反应5min,滤去脱保护溶液,10mL DMF清洗树脂一次,再加入10mL 20%哌啶/DMF(v/v)脱保护溶剂与树脂反应15min,最后10mL DMF清洗树脂4次,每次1.5min,得到脱除Fmoc保护基的Rink树脂。称Fmoc-Cys(Trt)-OH(0.4mmol),用2mL10%DMF/DMSO(v/v)溶解,加入3mL DIC/HOBt(0.4mmol/0.44mmol)缩合剂,加入反应器中,室温震荡反应2h,滤去反应液后用10mLDMF清洗树脂4次,使用Kaiser试剂检测反应耦合是否完全,如不完全则2次耦合。
(8)GLP-1/glucagon部分肽链的延长
按照肽链的序列,重复上述脱保护和耦合的步骤依次连接上相应的氨基酸,直至肽链合成完毕。其中侧链修饰位点的Lys采用Fmoc-Lys(Dde)-OH保护策略,同时N末端的His使用的是Boc-His(Boc)-OH。
(9)GLP-1/glucagon部分Lys侧链的修饰
肽链合成完毕后,加入7mL 2%水合肼/DMF(v/v)选择性脱除Lys的Dde保护基,Dde保护基脱除后加入0.4mmol的Fmoc-Glu-OtBu,0.4mmol的DIC及0.44mmol的HOBt,震荡反应2h。脱除Fmoc保护基后,再次加入0.4mmol的Fmoc-Glu-OtBu、0.4mmol的DIC及0.44mmol的HOBt,震荡缩合反应2h。脱除Fmoc保护基后,加入0.4mmol的棕榈酸,0.4mmol的DIC及0.44mmol的HOBt缩合反应2h,反应完全后用7mL DMF清洗树脂4次。
(10)GLP-1/glucagon部分的裂解
将上述得到的连有多肽的树脂转移至圆底瓶中,使用切割剂Reagent R(TFA/苯甲硫醚/苯酚/EDT,90:5:3:2,V/V)5mL切割树脂,在油浴中恒温30℃反应2h,切割液倾入40mL冰乙醚中,冷冻离心后粗品用15mL冰乙醚洗涤3次,最后用氮气吹干,得到GLP-1/glucagon部分的粗肽。
(11)目标多肽的合成
将0.05mmol的包含连接臂的PYY部分的粗肽与0.05mmol的GLP-1/glucagon部分的粗肽溶解于2mL的NMP中,加入0.005mmol的DIPEA催化,反应20分钟后,加入5mL 50%的甲醇/水(0.1%TFA)停止反应,反应液用0.25μm微孔滤膜过滤后进岛津制备型反相HPLC系统纯化。色谱条件为C18反相制备柱(250mm×20mm,12μm);流动相A:0.1%TFA/水(V/V),流动相B:甲醇(V/V);流速为8mL/min;检测波长为214nm。采用线性梯度(20%B~90%B/30min)洗脱,收集目标峰,除去甲醇后冻干得纯品0.012g,纯度大于98%,通过MS确认目标多肽的分子量。理论相对分子质量为9242.3。ESI-MS m/z:计算值[M+8H]
实施例2
SEQ ID NO:2多肽化合物的合成
合成方法同实施例1,收集目标峰冻干得纯品0.014g,纯度大于98%,通过MS确认目标多肽的分子量。理论相对分子质量为9532.7。ESI-MS m/z:计算值[M+8H]
实施例3
SEQ ID NO:3多肽化合物的合成
合成方法同实施例1,收集目标峰冻干得纯品0.016g,纯度大于98%,通过MS确认目标多肽的分子量。理论相对分子质量为10113.2。ESI-MS m/z:计算值[M+9H]
实施例4
SEQ ID NO:4多肽化合物的合成
合成方法同实施例1,收集目标峰冻干得纯品0.011g,纯度大于98%,通过MS确认目标多肽的分子量。理论相对分子质量为9413.4。ESI-MS m/z:计算值[M+7H]
实施例5
SEQ ID NO:5多肽化合物的合成
合成方法同实施例1,收集目标峰冻干得纯品0.015g,纯度大于98%,通过MS确认目标多肽的分子量。理论相对分子质量为9703.8。ESI-MS m/z:计算值[M+10H]
实施例6
SEQ ID NO:6多肽化合物的合成
合成方法同实施例1,收集目标峰冻干得纯品0.013g,纯度大于98%,通过MS确认目标多肽的分子量。理论相对分子质量为10284.4。ESI-MS m/z:计算值[M+9H]
实施例7
SEQ ID NO:7多肽化合物的合成
合成方法同实施例1,收集目标峰冻干得纯品0.010g,纯度大于98%,通过MS确认目标多肽的分子量。理论相对分子质量为9329.3。ESI-MS m/z:计算值[M+9H]
实施例8
SEQ ID NO:8多肽化合物的合成
合成方法同实施例1,收集目标峰冻干得纯品0.014g,纯度大于98%,通过MS确认目标多肽的分子量。理论相对分子质量为9619.7。ESI-MS m/z:计算值[M+9H]
实施例9
SEQ ID NO:9多肽化合物的合成
合成方法同实施例1,收集目标峰冻干得纯品0.015g,纯度大于98%,通过MS确认目标多肽的分子量。理论相对分子质量为10200.3。ESI-MS m/z:计算值[M+9H]
实施例10
多肽化合物对人GLP-1受体、glucagon和Y
通过功能测定法来确定多肽化合物对受体的激动作用,GLP-1受体和glucagon受体激动活性通过测量稳定表达人GLP-1受体或glucagon受体的HEK-293细胞系的cAMP响应。将稳定表达GLP-1受体或glucagon受体的细胞分入T175培养瓶并在培养基(DMEM/10%FBS)中过夜生长至接近汇合状态,然后除去培养基,并用无钙和镁的PBS洗涤细胞,然后用Accutase酶进行蛋白酶处理。洗涤脱离的细胞并将其重悬于测定缓冲液(20mM HEPES,0.1%BSA,2mM IBMX,1×HBSS)中,并确定细胞密度,并将25μL的等分试样分装至96孔板的孔中。为了测量,将25μL的测试多肽化合物在测定缓冲液中的溶液添加到孔中,然后室温温育30分钟。用Cisbio的试剂盒,基于均相时间分辨荧光(HTRF)来确定细胞的cAMP含量。添加稀释于裂解缓冲液(试剂盒组分)中的HTRF试剂后,将平板温育30分钟,然后测量665/620nm处的荧光比。通过检测引起最大响应的50%激活的浓度(EC
使用稳定表达人Y
将本专利申请实施例中的检测数据(nM)显示于下表1中,虽然用一定数量的有效数字来陈述检测数据,但不应该认为表示数据已确定精确为有效数字的数。
表1:多肽化合物对人GLP-1受体、Glucagon受体及Y
如表1所示,所有多肽化合物都显示出了对GLP-1受体、glucagon受体和Y
实施例11
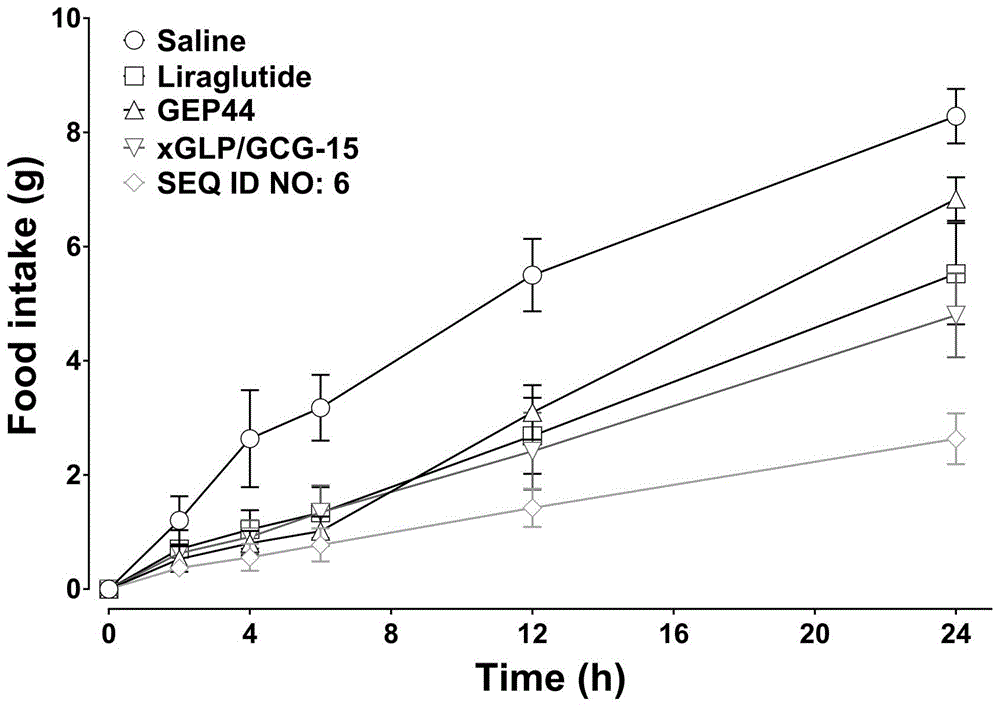
多肽化合物对ICR小鼠进食的影响
雄性ICR小鼠,随机分为5组,每组6只。实验前小鼠禁食12h,空白组皮下注射给予生理盐水(10mg/kg),给药组分为4组,小鼠非空腹状态下分别皮下单次注射30nmol/kg的liraglutide、GEP 44(GLP-1/Y
如图1结果所示,在ICR小鼠体内的摄食实验结果表明,在24小时,SEQ ID NO:6多肽化合物显著的降低了小鼠的进食量,并且其抑制摄食作用明显优于liraglutide、GEP44和xGLP/GCG-15,说明本发明的多肽化合物具有优异的抑制进食效果。
实施例12
多肽化合物在大鼠体内的药代动力学性质
SD大鼠给予50nmol/kg的liraglutide和SEQ ID NO:6皮下(s.c.)注射给药,在给药后0.25h,0.5h,1h,2h,4h,8h,16h和24h收集血样。使用乙腈沉淀蛋白质后,用LC-MS分析血浆样品。用WinonLin 5.2.1(非房室模型)计算药代参数和半衰期(表2)。
表2:多肽化合物在大鼠体内的药代动力学概貌
如表2结果显示,本发明的多肽化合物的体内半衰期显著延长,优于liraglutide,具有支持每天一次给药的药代动力学特征。
实施例13
多肽化合物在小鼠体内急性降血糖活性
雄性ICR小鼠,随机分组,每组6只。只给饮水,禁食过夜。空白组腹腔注射给予生理盐水(10mg/kg),给药组分为4组,小鼠非空腹状态下分别腹腔单次注射30nmol/kg的liraglutide、GEP 44(GLP-1/Y
如图2结果所示,在ICR小鼠体内的急性降糖实验表明,SEQ ID NO:6多肽化合物显著的提高了小鼠的糖耐量水平,具有优异的降血糖作用,其降血糖作用还优于liraglutide和GEP44。
实施例14
多肽化合物对饮食诱导肥胖(DIO)小鼠血酯和体重的影响
雄性C57BL/6J小鼠,体重22g左右,模型组共18只,用Research Diets公司的D12492高脂饲料饲养18周造DIO小鼠模型。在给药开始前,各组DIO小鼠按照体重随机分组,共分为5组,每组6只,分别为生理盐水组(空白对照组)、阳性对照组(liraglutide、GEP44、xGLP/GCG-15)和受试样品组(SEQ ID NO:6)。各组小鼠每天两次皮下注射生理盐水(10mg/kg),liraglutide(30nmol/kg),xGLP/GCG-15(30nmol/kg),SEQ ID NO:6(10nmol/kg),每天三次皮下注射GEP44(30nmol/kg),给药周期21天。每天记录小鼠体重变化。在实验结束后,各组小鼠处死,取血制血清,取肝脏制匀浆,并分别测量肝脏和血清的甘油三酯(TG)和总胆固醇(TC)含量。
如图3结果显示,本发明的多肽化合物SEQ ID NO:6在10nmol/kg的剂量下,在DIO小鼠体内连续给药3周,可以降低36.2%的小鼠体重。而三个阳性对照化合物,在三倍于SEQID NO:6的剂量下(30nmol/kg),liraglutide只能降低15.1%的小鼠体重,GEP44只能降低24.9%的小鼠体重,xGLP/GCG-15只能降低27.0%的小鼠体重。以上结果表明SEQ ID NO:6在低剂量下就可以实现显著高于liraglutide、GEP44和xGLP/GCG-15的减重效果,说明其具有优异的减重作用。
表3:DIO小鼠治疗3周后的血清总胆固醇(TC)和甘油三酯(TG)含量
***
表4:DIO小鼠治疗3周后的肝脏总胆固醇(TC)和甘油三酯(TG)含量
*
如表3和表4结果显示,本发明的多肽化合物SEQ ID NO:6在10nmol/kg剂量下在DIO小鼠体内连续给药3周,可以显著降低小鼠的血清和肝脏的甘油三酯(TG)和总胆固醇(TC)含量,并且SEQ ID NO:6的降低血清和肝脏血脂的作用显著强于高剂量下的阳性对照药liraglutide(30nmol/kg)、GEP44(30nmol/kg)和xGLP/GCG-15(30nmol/kg)。以上结果表明低剂量下的SEQ ID NO:6即可实现显著优于liraglutide、GEP44和xGLP/GCG-15的减重和降低肝脏和血清血脂的效果,说明本发明的多肽化合物具有异常优异的减重、调脂和治疗NAFLD的作用。
- 一类GLP-1/Y2受体双重激动剂及其应用
- 一种定点改造的一类GLP-1/胰高血糖素/胃泌素受体三重激动剂及其应用
