一种原代MDSC的体外基因表达干预方法
文献发布时间:2023-06-19 19:38:38
技术领域
本发明属于MDSC功能研究技术领域,尤其涉及一种原代MDSC的体外基因表达干预方法。
背景技术
20世纪70年代早期,零星发表了一些关于与肿瘤进展相关的免疫抑制性髓系细胞积累的报道。20世纪90年代末,Gr-1
MDSC具有一套独特的表达谱和生化特征,可以通过特定的表面分子来区分。目前研究认为MDSC在小鼠中表型为CD11b
MDSC参与了多种疾病的发生和发展。有证据表明MDSC与肿瘤病程的快速发展相关,在促肿瘤血管生成、耐药、转移等方面发挥突出作用。除了癌症,MDSC还涉及慢性炎症、感染、自身免疫性疾病、创伤、移植物抗宿主病等疾病。
目前基因递送技术发展日益成熟,但大部分技术主要针对细胞系,对原代细胞递送效率却不理想。递送外源基因进入细胞的主要方法分为四类:电击法、磷酸钙法、脂质体介导法和病毒介导法。电击法是通过外加电场,在细胞上制造暂时性的穿孔让外源核酸进入,但对细胞损伤大;磷酸钙法和脂质体法是利用不同的载体物质携带核酸,通过直接穿膜或者膜融合的方法使得外源基因进入细胞,但实验条件控制较严、难度较大、转染试剂毒性较大,常规的转染试剂对MDSC转染效率很低;而病毒法前期准备较复杂,而且病毒本身可能对细胞有较大影响。
发明内容
本发明提供一种原代MDSC的体外基因表达干预方法,借助磁性转染试剂将siRNA转染至原代细胞培养的骨髓源性抑制细胞上,并在转染过程中外加磁性物质,利用磁性物质与磁性转染试剂的吸附作用,提升转染细胞的磁力,从而借助外加磁场进一步富集转染成功的细胞。与脂质体转染试剂相比,本发明大大提高了细胞的存活率和转染效率;和仅由磁性转染试剂介导的转染相比,本发明进一步富集高转染效率的MDSC细胞,便于后续的功能学研究应用。
为了实现上述目的,本发明所采用的技术方案如下:
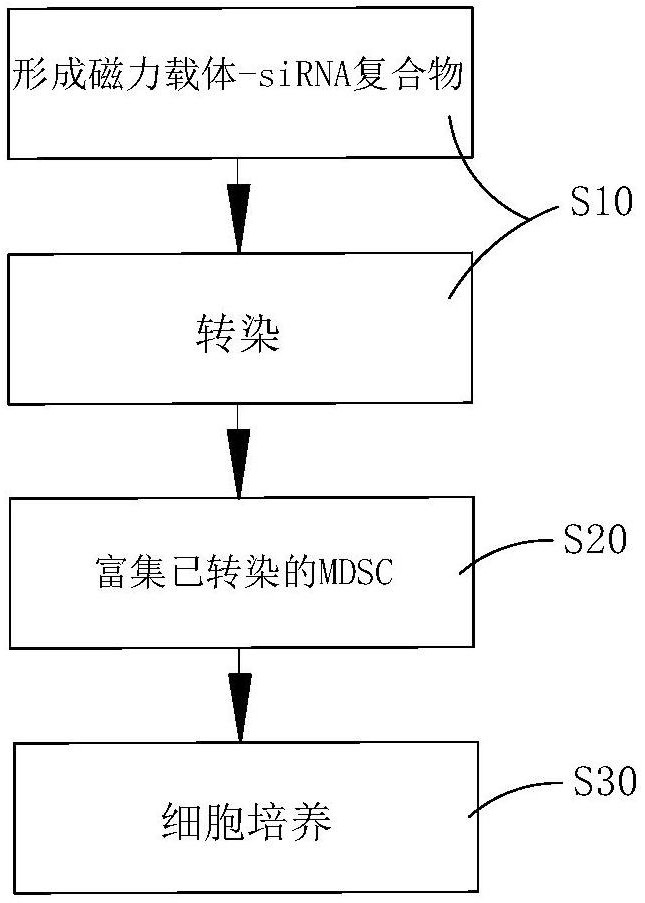
一种原代MDSC的体外基因表达干预方法,包括步骤:
S10、利用磁性转染试剂将siRNA转染至原代细胞培养的骨髓源性抑制细胞上,并在转染过程中添加新的磁性物质,利用新的磁性物质和磁性转染试剂在外加磁场下的吸附作用,使转染成功的MDSC细胞带有更强的磁性;
S20、在转染完成后布置磁场,利用转染成功的MDSC细胞带有更强磁性的特性,富集高磁性细胞。
一些技术方案中,所述磁性物质的额外添加,能提供为与磁性转染试剂相区别的不由自身结构磁力上限所限制的磁性,并能由外加磁场所驱动进行分选操作。
一些技术方案中,所述磁性物质为用于细胞磁性分选的磁珠,选自
一些技术方案中,所述磁性物质通过MDSC细胞所携带的特异性标志物的抗体而吸附于MDSC细胞表面,以便于磁性物质和磁性转染试剂在外加磁场下进行磁性吸附;所述MDSC特异性标志物选自Gr-1、Ly6C、Ly6G、CD11b、LOX-1、S1001A9、CD14、CD15、CD33及CD66b中的至少一种。
一些技术方案中,所述高磁性细胞为转染成功且含有高比例磁性转染试剂和磁性物质的细胞;相对的低磁性细胞为未转染成功或已转染成功但含有低比例磁性转染试剂和磁性物质的细胞。
一些技术方案中,步骤S10具体为:
将纳米级磁珠和siRNA共孵育形成磁转染载体+siRNA复合物,将所述磁转染载体+siRNA复合物加入原代细胞;
加入识别MDSC细胞所携带的特异性标志物的新的磁性物质;
外加磁场,将磁转染载体+siRNA复合物转入细胞,并形成高磁性细胞。。
一些技术方案中,所述的将纳米级磁珠和siRNA共孵育形成磁转染载体+siRNA复合物具体为:
将纳米级磁珠转染试剂与Opti-MEM混匀,加入siRNA-FAM进一步混匀后室温孵育制取所述磁转染载体+siRNA复合物。
一些技术方案中,所述骨髓源性抑制细胞的培养液主要由RPMI1640、FBS(FetalBovine Serum)、PS(Penicillin-Streptomycin)及GM-CSF(Granulocyte-macrophageColony Stimulating Factor)组成。
一些技术方案中,利用流式细胞术检测体外培养的髓系来源抑制性细胞的转染效率。
本发明采用以上技术方案至少具有如下的有益效果:
1.本案针对siRNA转染原代MDSC困难的问题,优化多种转染试剂,选用了一种基于纳米级磁珠转染试剂的方法,该转染方式对MDSC毒性低,转染效率较高;
2.只用纳米级磁珠转染完成后,虽然细胞已带有一定磁性,但是由于磁性转染试剂自身磁力上限的限制,并不能在外加磁场中有效分离;而在添加另外的磁性物质之后,该磁性物质在外加磁场下可通过与磁性转染试剂的磁性吸附作用,增强转染成功细胞的磁性,从而实现在外加磁场作用下的有效分离。其中高磁性细胞的转染效率可由未分选时的30-60%提高到85%左右,尤其适合应用至后续的功能学研究。
附图说明
为了更清楚的说明本发明实施例中的技术方案,下面将对实施例中所需要使用的附图及其标记作简单的介绍,显而易见地,下面描述的附图仅仅是本发明的一些实施例,对于本领域的普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其它的附图。
图1为一种原代MDSC的体外基因表达干预方法的流程图;
图2为多种转染试剂对转染SET后的MDSC转染效率及存活率的比较结果;
图3为转染siRNA时加入新的磁性物质,在转染完成后布置磁场进一步富集转染成功细胞的对照结果示意图;
图4为原代MDSC转染siRNA并分选高磁性细胞的示意图;
图5为流式细胞术检测MDSC存活率和转染效率的示意图。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。实施例中所用到的各种常用试剂,均为市售产品。
本申请涉及的缩略语和关键术语定义为:
MDSC:Myeloid-derived suppressor cells,骨髓源性抑制细胞;
SET:去除红细胞和T细胞的荷瘤小鼠脾脏细胞,含有约65%的MDSC;
GM-CSF:Granulocyte-macrophage Colony Stimulating Factor,粒细胞-巨噬细胞集落刺激因子;
M-MDSC:Monocytic-MDSC,单核细胞来源的MDSC;
G-MDSC:Granulocytic-MDSC,粒细胞来源的MDSC;
PBS:Dulbecco's Phosphate Buffered Saline,磷酸缓冲盐溶液;
FBS:Fetal Bovine Serum,胎牛血清;
PS:Penicillin-Streptomycin,青霉素链霉素双抗。
在本申请一实施例中,提出一种原代MDSC的体外基因表达干预方法,包括步骤:
S10、利用磁性转染试剂将siRNA转染至原代细胞培养的骨髓源性抑制细胞上,并在转染过程中添加新的磁性物质,利用新的磁性物质和磁性转染试剂在外加磁场下的吸附作用,使转染成功的MDSC细胞带有更强的磁性;
在一优选实施方式中,步骤S10具体包括:
将具有高负载量、高表面正电荷的纳米级磁珠和siRNA共孵育形成磁转染载体+siRNA复合物,将磁转染载体+siRNA复合物加入原代细胞;同时
加入识别MDSC细胞所携带的特异性标志物的新的磁性物质;
外加磁场,将磁转染载体+siRNA复合物转入细胞,并形成高磁性细胞。
本申请的实现高磁性细胞与低磁性细胞分离的机理表述如下:在将转染后的原代细胞中悬浮,并布置磁场,高磁性细胞向磁极迁移速度更快,低磁性细胞仍然保持悬浮状态,将悬浮的低磁性细胞去除,即可富集得到高siRNA转染效率的细胞。
S30、细胞培养。
在本申请一比较例中,参见图2,为多种转染试剂对SET的转染效率及细胞存活率的比较,不同转染试剂具体种类包括:Lipofectamine RNAiMAX、Lipofectamine 3000、
本申请针对siRNA转染原代MDSC困难的问题,优化多种转染试剂,选用了一种基于纳米级磁珠转染试剂的方法,该转染方式对MDSC毒性低,转染效率较高。
在本申请另一比较例中,详见图3,为转染siRNA时加入新的磁性物质,并在转染后布置磁场进一步富集转染成功的细胞,所得的转染效率对照示意图。当只使用磁性转染试剂而未添加磁性物质时(图中“-”所示),虽然转染成功的细胞中含有不同比例的磁性转染试剂,由于磁性转染试剂的磁力较弱,不足以在外加磁场的作用下与转染不成功的细胞有效分离。为此本申请额外添加了一定量的磁性物质(图中“+”所示),在外加磁场下其可通过与磁性转染试剂的相互作用增加成功转染的细胞的磁性,有助于在外加磁场作用下进一步富集转染成功的MDSC。如图3所示,磁性转染试剂对MDSC的转染效率约为50%,加入额外的磁性物质对转染效率没有影响;但是在磁性分离后,未加入额外的磁性物质的条件不能有效富集高转染效率的细胞;而在加入额外的磁性物质时,低磁性细胞的转染效率约为20%,高磁性细胞的转染效率约为85%,即外加磁场能有效富集高转染效率的细胞。高磁性细胞可以进行方便的分离操作,便于后续的功能学研究应用。
该实施例在保证转染siRNA后MDSC的存活率的前提下,极大的提高了siRNA转染效率,解决了siRNA转染原代MDSC效率低的问题。
需要指出的是,本案中的高磁性细胞与低磁性细胞不仅来源于转染细胞中所含磁性转染试剂的高低,还因为转染时添加的磁性物质而进一步放大磁性差异,以便于在外加磁场的作用下实现转染成功的细胞和未转染细胞的分离,以此分离出的高磁性细胞具有显著提升的siRNA转染效率。
需要指出的是,转染时添加的磁性物质应具备高磁性和低细胞毒性的特征。在一些场合下,可以是用于细胞磁性分选的磁珠,包括并不限于:
需要指出的是,尽管上述转染方法中将各个步骤按照特定的先后顺序进行了描述,但是本领域技术人员可以理解,为了实现本发明的效果,不同的步骤之间并非必须按照这样的顺序执行,其可以同时(并行)执行或以其他顺序执行,这些变化都在本发明的保护范围之内。
为了充分展示本申请技术方案及明晰本发明技术效果,借助以下一具体示例进行阐述,参考图4,为原代MDSC转染siRNA示意图。
一、髓系抑制细胞转染siRNA试验方案
步骤一、细胞铺板:将原代MDSC体外培养得到的细胞用Opti-MEM(Gibco,31985-070)重悬至4×10
步骤二、以siRNA-FAM(Genewiz)为例,DEPC水稀释siRNA-FAM至10mM。
步骤三、磁性转染试剂-siRNA复合物的形成:0.3ul纳米级磁珠转染试剂(1mg/mL)加至50ul Opti-MEM中,轻柔混匀,加入1ul siRNA-FAM,轻柔混匀,室温孵育15min。
步骤四、转染:向步骤一的细胞中加入磁力载体-siRNA复合物,同时加入生物素标记的anti-Ly6G抗体和抗生物素抗体标记的
步骤五、细胞培养:孵育过夜后,去掉96孔磁力架,继续37℃、5%二氧化碳培养箱内培养至所需时间。
二、磁性分离
步骤六、转染效率的检测:试验方案一中转染24-48h后的细胞取出,移液器反复吹打至细胞完全重悬后,继续将96孔细胞培养板放置96孔磁力架上,室温磁力吸附30min。轻柔缓慢用移液器分多次吸取并收集上清(低磁性细胞)。撤去96孔磁力架,用100ul StainBuffer重悬吸附在板底的组分的高磁性细胞。
三、流式细胞术检测体外培养的髓系来源抑制细胞转染效率
将细胞取出检测存活率,移液器反复吹打96孔培养板中的细胞至完全重悬,转移至96孔V底板,经室温500×g离心5min后去上清,每孔加入100ul Stain Buffer(PBS+2%FBS)+1ul TruStain FcX
需要指出的是,尽管上述控制方法中将各个步骤按照特定的先后顺序进行了描述,但是本领域技术人员可以理解,为了实现本发明的效果,不同的步骤之间并非必须按照这样的顺序执行,其可以同时(并行)执行或以其他顺序执行,这些变化都在本发明的保护范围之内。
- 可应用于基因编辑的小鼠卵巢原代细胞培养基及体外培养方法
- SjADA编码基因、其构建方法及其体外融合表达产物和表达方法
