络合物β-CD-BDP⊃CPT-ss-PEG及其应用
文献发布时间:2024-04-18 19:52:40
技术领域
本发明属于有机合成路线设计及其原料药和中间体制备技术领域,特别涉及一种抗癌光化疗药物
背景技术
在癌症的治疗过程中,化学治疗是一种最重要的治疗手段,但传统的化学治疗往往面临着一系列的挑战,如在生理条件下化疗药物溶解度/稳定性差、容易产生耐药性及对正常组织产生严重的毒副作用等,从而严重阻碍了它们在临床上的应用。此外,大多数的抗癌药没有荧光或呈现很弱的荧光,如紫杉醇、吉西他滨和顺铂等,因此它们在体内的代谢过程很难被监测,从而阻碍了医学工作者对癌症治疗机理的研究。
(1)由于抗癌药物CPT溶解度差,在生理环境中易发生内酯(Lactone)结构向羧酸盐(Carboxylate)结构的转变,因此CPT一直未被应用到癌症的临床治疗中。为了解决这一难题,我们将超分子策略引入进来。在两亲性超分子纳米药物的构建过程中,CPT分子首先被共价连接到具有单线态氧响应性的化疗客体中,接着通过β-CD和CPT之间的主客体反应,CPT被络合到环糊精的疏水大空腔中。因此超分子纳米药物的构建,不仅可以大大增加CPT化疗药物的溶解度,而且可以保持其具有抗癌活性的内酯结构,从而为CPT应用到临床治疗中提供了一条新的思路。
(2)化学治疗虽然是癌症治疗方法中的一种重要的治疗手段,但由于其非特异性和强的系统毒性,化学治疗在临床上的应用已受到严重的限制。为了解决这一难题,我们利用超分子策略将癌症的光动力学治疗和化学治疗结合起来。近红外吸收的光敏剂BDP被连接到大环主体β-CD上,在激光的照射下,BDP可将肿瘤组织部位的氧气转变为具有杀伤作用的单线态氧
发明内容
为了解决现有技术中癌症治疗时CPT溶解度差、化学治疗系统毒性强等缺陷,本发明提供了抗癌光化疗药物
本发明的目的可以通过如下技术方案实现:
第一方面,本发明提供一种络合物
式B中,n=100-10000(优选2000)。
第二方面,本发明提供一种络合物
将式A化合物(β-CD-BDP)和式B化合物(CPT-ss-PEG)加入溶剂中,分散均匀(发生络合作用),所得混合液经后处理H,得到所述络合物
式B中,n=100-10000(优选2000)。
进一步,所述溶剂为二甲亚砜、四氢呋喃、二甲基甲酰胺或水(可以溶解化合物A、B即可,优选为水)。
进一步,所述溶剂的体积以式A化合物和式B化合物的总质量计为5-50mL/g。
进一步,所述后处理H为:将所述混合液冷冻干燥,得到所述络合物
更进一步,本发明还提供一种式A化合物的制备方法,所述式A化合物按如下方法合成:
/>
(1)OTs-CD的制备:将β-环糊精加入到水中,得到(浑浊的)环糊精溶液,缓慢滴加NaOH水溶液(滴加后溶液呈淡黄色澄清状),滴加甲基苯磺酰氯的乙腈溶液(立刻产生沉淀),滴加完将所得混合溶液置室温搅拌2-5h,收集滤液,用饱和氯化铵溶液调节pH至7-8,(有沉淀析出,)离心收集沉淀,所得沉淀经后处理A,得到化合物1(OTs-CD);
所述β-环糊精、NaOH水溶液所含NaOH与甲基苯磺酰氯的乙腈溶液所含甲基苯磺酰氯物质的量比1:1-10:1-5(优选1:3.4:1.1);
(2)NH
所述乙二胺的体积以所述化合物1的质量计为2-10mL/g(优选5mL/g)。
(3)BDP-NHS的制备:将化合物3(BDP-COOH)溶解到二甲基甲酰胺A(DMF)中,接着加入N-羟基琥珀酰亚胺(NHS),1-乙基-(3-二甲基氨基丙基)碳化二亚胺盐酸盐(EDCI)和4-二甲氨基吡啶(DMAP),室温下反应12-36h(优选24h),反应后将溶剂蒸干,粗产物用甲醇洗涤(两次),得到化合物4(BDP-NHS);
所述化合物3、N-羟基琥珀酰亚胺、1-乙基-(3-二甲基氨基丙基)碳化二亚胺盐酸盐与4-二甲氨基吡啶的物质的量比为1:1-5:1-5:1-3,优选1:2:3:1.6。
(4)β-CD-BDP的制备:将步骤(3)所述的化合物4(BDP-NHS)溶解在二甲基甲酰胺B(DMF)中,加入步骤(2)中所述化合物2(NH
所述化合物4、化合物2与三乙胺的物质的量之比为1:0.2-1:0.1-0.5(优选1:0.625:0.25)。
进一步,步骤(1)中所述水的体积以所述β-环糊精的物质的量计为5-10mL/mmol(优选8.6mL/mmol)。
进一步,步骤(1)中所述NaOH水溶液是将NaOH溶解于水A中获得,所述水A的体积以NaOH物质的量计为0.1-0.2mL/mmol(优选0.18mL/mmol)。
进一步,步骤(1)中所述甲基苯磺酰氯的乙腈溶液是将甲基苯磺酰氯溶解于乙腈中获得,所述乙腈的体积以甲基苯磺酰氯的物质的量计为0.1-0.3mL/mmol(优选0.284mL/mmol)。
进一步,步骤(1)中所述后处理A为:将沉淀依次经水(洗一次)、丙酮(洗两次)洗涤,真空干燥,得到式1所示化合物。
进一步,步骤(2)中所述后处理B为:将所述反应液B冷却至室温,加入丙酮A(所述丙酮A的体积以所述化合物1的质量计为10-100mL/g,优选20mL/g)进行沉淀,离心,将所得沉淀溶于水中,用丙酮B(所述丙酮B的体积以所述化合物1的质量计为20-100mL/g,优选20mL/g)再次沉淀,离心,所得沉淀真空干燥,得到化合物2。
进一步,步骤(3)中所述二甲基甲酰胺A的体积以化合物3的质量计为50-200mL/g(优选100mL/g)。
进一步,步骤(4)中所述二甲基甲酰胺B的体积以化合物4的质量计为100-1000mL/g,优选125mL/g。
进一步,步骤(4)中所述后处理D为:将所述混合溶液滴加到丙酮C中进行沉淀,离心,所得沉淀用丙酮洗涤(2-4次)后,真空干燥,得所述式A化合物。
进一步,步骤(4)中所述丙酮C的体积以所述化合物4的质量为0.2-2mL/mg(优选1mL/mg)。
更进一步,所述式B化合物按如下方法制备:
CPT-ss-PEG前体药物合成
将化合物5(mPEG
所述化合物5、1-乙基-(3-二甲基氨基丙基)碳化二亚胺盐酸盐、4-二甲氨基吡啶与化合物6的物质的量之比为1:1-4:0.5-2:0.5-2(优选1:2.4:1.2:1.2)。
式5和式B中,n=100-10000(优选2000)。
进一步,所述二氯甲烷的体积以化合物5的质量计为10-40mL/g,优选28.6mL/g。
进一步,所述后处理F为:向所述反应液F中加入水萃取,取水相加入二氯甲烷萃取,合并有机相,干燥,得到所述式B化合物。
第三方面,本发明还提供一种上述络合物在制备抗肿瘤光疗药物中的应用。
优选地,所述肿瘤为4T1肿瘤。
丙酮A、B、C只是为了区分不同阶段加入的丙酮,方便描述,无其它特殊含义。二甲基甲酰胺A、B只是为了区分不同阶段加入的二甲基甲酰胺,方便描述,无其它特殊含义。水A同样只是为了方便描述,无特殊含义。
与现有技术相比,本发明的有益效果在于:本发明设计合成了一种新颖的红外/近红外BODIPY光敏剂BDP,接着基于β-环糊精(β-CD)和化疗药CPT之间的分子识别反应构建一种两亲性超分子纳米药物
附图说明
图1中间体化学合物OTs-CD的
图2是中间体化合物β-CD-BDP的
图3是中间体化合物CPT-ss-PEG的
图4是β-CD-BDP,CPT-ss-PEG和
图5是
图6是
图7在DMSO和H
图8是
图9.(a)不同浓度β-CD-BDP孵育4T1细胞24h后光照和黑暗条件下的细胞活力(660nm,0.8W cm
图10(a)不同治疗组组小鼠的体重变化;(b)不同治疗组的肿瘤照片;(c)不同治疗组小鼠肿瘤体积变化;(d)不同治疗组小鼠重要器官和肿瘤的重量。
具体实施方式
为便于理解,以下将通过具体的实施例对本发明进行详细地描述。需要特别指出的是,具体实施例仅是为了说明,显然本领域的普通技术人员可以根据本文说明,在本发明范围内对本发明做出各种修正。
实施例1:中间体OTs-CD的制备
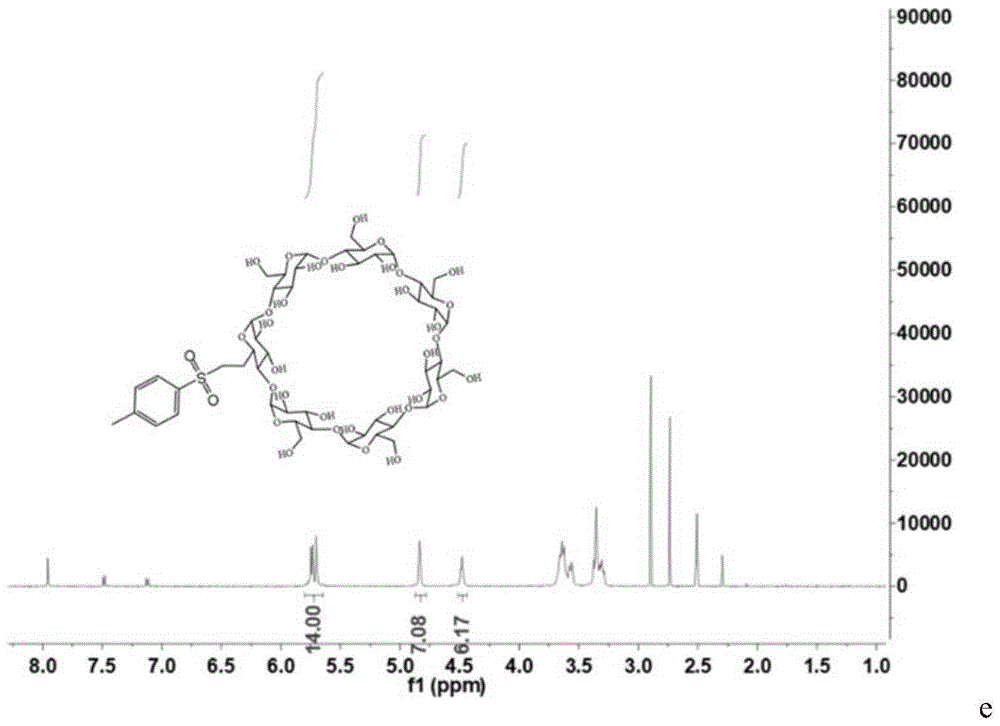
首先将40g(32.6mmol)β-CD加入到280mL水中,得到浑浊的环糊精溶液。接着将4.32g(109.4mmol)NaOH溶解于20mL水,并缓慢滴加到环糊精溶液中,滴加后溶液呈淡黄色澄清状。再将6.72g(35.2mmol)对甲基苯磺酰氯溶解于10mL乙腈中,并缓慢加入到上述混合溶液中。滴加入甲基苯磺酰氯溶液立刻产生沉淀。滴加完后将混合溶液置室温搅拌3h。收集滤液,向其中不断添加入饱和氯化铵溶液,有沉淀析出,调节溶液pH 7-8时停止。离心收集沉淀。沉淀经水洗一次,丙酮洗两次后进行真空干燥,得到固体产物4.2g,收率10%。最后进行核磁表征。
图1是中间体化学合物OTs-CD的
实施例2:中间体NH
将2.0g OTs-CD与过量的EDA(乙二胺)(10mL)在75℃下反应4h,反应后将混合物冷却至室温,加入40mL丙酮进行沉淀。离心(8000r 3min)出沉淀,将沉淀溶于5mL水的中,再次用丙酮沉淀,离心(8000r 3min)出沉淀,50℃下真空干燥得产物1.8g,收率90%。
实施例3:中间体BDP-NHS的合成
将50mg(0.05mmol)BDP-COOH(BDP-COOH参考Triggered In Situ DimorphicTransformation of BF
实施例4:中间体β-CD-BDP的合成
首先将上步反应生成的BDP-NHS 40mg(0.04mmol)溶解在5mL DMF中,接着加入30mg(0.025mmol)NH
图2中间体化学合物β-CD-BDP的
实施例5:CPT-ss-PEG前体药物合成
首先将350mg(0.17mmol)mPEG
图3是CPT-ss-PEG前体药物的
实施例6:
首先将30mg(0.01mmol)β-CD-BDP和26mg(0.01mmol)CPT-ss-PEG溶解在5ml去离子水中,然后冰浴超声1h,最后冷冻干燥48h,获得
实施例7:β-CD-BDP与CPT-ss-PEG络合的研究
为了研究β-CD-BDP和CPT-ss-PEG之间的主客体相互作用,在氘代DMSO中对β-CD-BDP、CPT-ss-PEG和
实施例8:
称取5mg实施例6中的
实施例9:β-CD-BDP的
1,3-二苯基异苯并呋喃(DPBF)与单线态氧反应生成内过氧化物,导致其在417nm处的最大吸收峰降低,因此DPBF滴定法可用于研究光敏剂的
实施例8:
为了评估
实施例10:细胞活力实验
4T1(小鼠乳腺癌细胞)接种量接种于96孔培养板,5%CO2、37℃培养箱中培养24h后,每孔加入(0.1、1、3.12、6.25、12.5、50μM)的药物β-CD-BDP(有/无660nm 0.8或0.5W cm
实施例11:
在Balb/c小鼠腹部种植4T1肿瘤后,(肿瘤大小长到100mm
- 卤代芳基取代的金属络合物,含这些络合物的药物制剂,其在诊断中的应用及络合物和制剂的制备方法
- 一种金属络合物配体、金属络合物及其制备方法和应用、高分子聚合物及其制备方法和应用
