一种番茄褐色皱纹果病毒侵染可视化追踪系统的构建方法及重组载体和应用
文献发布时间:2024-04-18 19:58:21
技术领域
本发明涉及生物技术领域,特别是涉及一种携带绿色荧光蛋白的番茄褐色皱纹果病毒(Tomato brown rugose fruit virus,ToBRFV)侵染可视化追踪系统的构建方法及重组载体和应用。
背景技术
番茄褐色皱纹果病毒是近年来新发的一类烟草花叶病毒属病毒新成员,在自然界中严重威胁番茄等茄科作物的生产,可引起番茄叶片花叶、变窄,果实表面黄斑,严重影响产量和品质,在短短几年已经迅速扩散蔓延至全球至少35个国家。使用抗病品种是控制病毒病最经济有效的手段,例如Tm-1、Tm-2、Tm-2
在目标病毒中插入分子量小、无毒且容易观察的报告系统是观察病毒在植物体内运动以及病毒侵染和扩散的重要途径。然而,病毒的基因组结构非常精细,报告系统的插入位置不合适会破坏病毒基因的表达,从而影响病毒的侵染性和致病性。
发明内容
本发明的目的是提供一种番茄褐色皱纹果病毒侵染可视化追踪系统的构建方法及重组载体和应用。
构建分子量小、无毒、可视化的病毒侵染性克隆有利于进一步研究病毒蛋白的功能、实时观察病毒在植物体内的侵染和扩散部位。因此,构建携带绿色荧光蛋白的番茄褐色皱纹果病毒侵染可视化追踪系统是一种有效研究病毒侵染状态的工具。
番茄褐色皱纹果病毒是一类新发的对番茄等作物的生产具有重大威胁的病原物。本发明产生和获得的番茄褐色皱纹果病毒侵染可视化追踪系统,有利于进一步研究番茄褐色皱纹果病毒编码的蛋白的功能,解析病毒的致病机制,快速直观评估相应基因或药剂/制剂的抗病毒效果,具有重要的生产意义。
具体的,本发明采用的技术方案具体如下:
一种番茄褐色皱纹果病毒侵染可视化追踪系统的构建方法:将番茄褐色皱纹果病毒ToBRFV或同源序列的CP启动子、外源GFP、ToBRFV 3’非编码区以及MP C端的部分序列插入到pCB301-ToBRFV MP的3’端。
具体的,包括以下步骤:
(1)以MP-CP-Pro-F-2和MP-CP-Pro-R-2为引物,以含有ToBRFV序列或同源序列的质粒为模板,利用高保真DNA聚合酶进行PCR扩增,并回收特异的PCR条带,获得PCR1;所述ToBRFV的NCBI登录号:MZ004925.1;
(2)以GFP(NsbI)-F-2和GFP(EheI)-R-2为引物,以含有GFP序列的质粒为模板,利用高保真DNA聚合酶进行PCR扩增,扩增的GFP两端包含引入的2个限制性内切酶NsbI、EheI的酶切位点,回收特异的PCR条带,获得PCR2;
(3)以UTR-F-2和UTR-R-2为引物,以含有ToBRFV序列的质粒为模板,利用高保真DNA聚合酶进行PCR扩增,并回收特异的PCR条带,获得PCR3;
(4)以CP-F-2和CP-R-2为引物,以含有ToBRFV序列的质粒为模板,利用高保真DNA聚合酶进行PCR扩增,并回收特异的PCR条带,获得PCR4;
(5)以pCB-F-2和pCB-R-2为引物,以含有ToBRFV序列的质粒pCB-ToBRFV为模板,利用高保真DNA聚合酶进行PCR扩增,并回收特异的PCR条带,获得PCR5;
(6)pCB-ToBRFV-GFP-2重组载体的构建:利用限制型内切酶ScaI和PmeI酶切pCB-ToBRFV,琼脂糖凝胶电泳回收相应条带;通过同源重组酶将PCR1、PCR2、PCR3、PCR4、PCR5与ScaI和PmeI酶切的pCB-ToBRFV进行同源重组,转化大肠杆菌;利用引物pCB-F和pCB-R筛选,挑选具有全长插入的克隆;通过DNA测序进行验证;验证成功后,提取包含全长质粒的克隆,转化至农杆菌中;所述重组载体pCB-ToBRFV-GFP-2序列如SEQ ID NO:29所示;
(7)培养含pCB-ToBRFV-GFP-2的农杆菌,接种至野生型本氏烟上,白光和手提式紫外灯下观察植物症状以及荧光表达情况,确定改造的病毒具有侵染性并且能够用于追踪ToBRFV的侵染。
其中,所述MP-CP-Pro-F-2和MP-CP-Pro-R-2引物序列如SEQ ID NO:11-12所示,
MP-CP-Pro-F-2:
GAAAAGGCAGTTTGGCAAGTACTAGTTAATATTAGAAATGTTAAAATT;
MP-CP-Pro-R-2:
CCATTGCGCATGCTGATGACAAAAACACAAATTGCGATGGAGTTGCGATTGTGTAAGACGTATTTAATACGAATCTGAATCG。
其中,所述GFP(NsbI)-F-2和GFP(EheI)-R-2引物序列如SEQ ID NO:13-14所示,
GFP-F-2:GTCATCAGCATGCGCAATGGCTAGCAAAGG;
GFP-R-2:CTCGATTATCGGCGCCTTATTTGTAGAGCTC。
其中,所述UTR-F-2和UTR-R-2引物序列如SEQ ID NO:15-16所示,
UTR-F-2:ATAAGGCGCCGATAATCGAGATGCTTAAATAACAG;
UTR-R-2:TCCCGGTCTTTGGGCCCCTACCGGGGGTTC。
其中,所述CP-F-2和CP-R-2引物序列如SEQ ID NO:17-18所示,
CP-F-2:TAGGGGCCCAAAGACCGGGAAAAAGTTTAGTAGT;
CP-R-2:CCGACCCGGGTGGGCCCCTACCGGGGGT。
其中,所述pCB-F-2和pCB-R-2引物序列如SEQ ID NO:19-20所示,
pCB-F-2:TAGGGGCCCACCCGGGTCGGCATGGCAT;
pCB-R-2:CTGTCAAACACTGATAGTTTAAACTGAAGGCGGGAAACGACAATCT。
一种携带GFP的番茄褐色皱纹果病毒侵染可视化追踪系统的pCB-ToBRFV-GFP-2重组载体,序列如SEQ ID NO:29所示。
本发明构建方法得到的番茄褐色皱纹果病毒侵染可视化追踪系统或pCB-ToBRFV-GFP-2重组载体在分析ToBRFV病毒蛋白功能、筛选与ToBRFV侵染相关的寄主因子,或评估寄主因子、药物或制剂对抗病毒效果中的应用。
本发明构建方法得到的携带GFP的番茄褐色皱纹果病毒侵染可视化追踪系统的pCB-ToBRFV-GFP-2重组载体在表达外源蛋白中的应用。
以上述病毒构架的基础之上进行番茄褐色皱纹果病毒不同分离物、不同株系的构建变体,且保留了原有的性质和功能,或者是在构架区部分插入其他蛋白序列,那么,这些变体也落入本发明的保护范围之内。
同现有技术相比,本发明的突出效果在于:
本发明通过3种不同的构建策略,检测不同插入位置以及插入元件对绿色荧光蛋白表达的影响,从而获得了最佳的表达载体,构建出带有绿色荧光蛋白的番茄褐色皱纹果病毒侵染可视化追踪系统,并具有以下特征和优势:
1)该系统产生了有活性且表达绿色荧光蛋白的番茄褐色皱纹果病毒,插入的绿色荧光蛋白不影响番茄褐色皱纹果病毒的侵染性,可用于后续直观分析番茄褐色皱纹果病毒蛋白的功能;
2)由于能够借助病毒的侵染产生大量的绿色荧光蛋白,利用手提式紫外灯就可以直接观察番茄褐色皱纹果病毒在植物体内的侵染和扩散部位,无需剪取植株任何组织,为研究该病毒基因组结构和功能提供了成熟便捷的体系;
3)能够用于快速评估寄主因子或药剂/制剂的抗病毒效果;
4)在绿色荧光蛋白的N端和C端引入了多克隆位点,为后续表达其它蛋白或报告基因提供了便捷有效的工具。
下面结合附图说明和具体实施例对本发明所述的番茄褐色皱纹果病毒侵染可视化追踪系统的构建方法及重组载体和应用作进一步说明。
附图说明
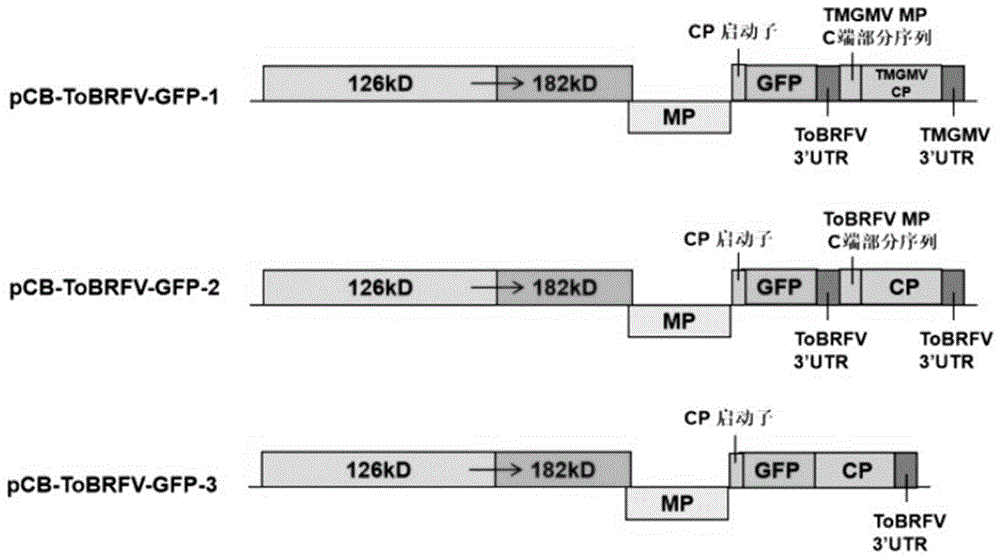
图1为番茄褐色皱纹果病毒可视化追踪系统pCB-ToBRFV-GFP-1/2/3的构建示意图;
图2为pCB-ToBRFV-GFP-1/2/3农杆菌接种野生型本氏烟后的症状表现;其中:
A:pCB载体模拟接种的健康本氏烟对照(接种后12天,自然光下拍摄);
B:pCB-ToBRFV侵染性克隆接种的本氏烟症状(接种后12天,自然光下拍摄);
C:pCB-ToBRFV-GFP-1接种的本氏烟症状(接种后12天,自然光下拍摄);
D:pCB-ToBRFV-GFP-2接种的本氏烟症状(接种后12天,自然光下拍摄);
E:pCB-ToBRFV-GFP-3接种的本氏烟症状(接种后12天,自然光下拍摄);
A1:pCB载体接种的本氏烟对照(接种后12天,紫外灯照射);
B1:pCB-ToBRFV侵染性克隆接种的本氏烟症状(接种后12天,紫外灯照射);
C1:pCB-ToBRFV-GFP-1接种的本氏烟(接种后12天,紫外灯下拍摄);
D1:pCB-ToBRFV-GFP-2接种的本氏烟(接种后12天,紫外灯下拍摄);
E1:pCB-ToBRFV-GFP-3接种的本氏烟(接种后12天,紫外灯下拍摄)。
图3为pCB-ToBRFV-GFP-2接种本氏烟后的系统叶Western blot检测结果。
图4为pCB-ToBRFV-GFP-2接种含有N基因的转基因本氏烟。(A):pCB-ToBRFV-GFP-2接种的野生型本氏烟(接种后7天,紫外灯下拍摄);(B):pCB-ToBRFV-GFP-2接种的含N基因的转基因本氏烟(接种后7天,紫外灯下照射)。
具体实施方式
实施例1携带外源绿色荧光蛋白(GFP)的番茄褐色皱纹果病毒侵染可视化追踪系统的构建及接种验证
设计了3种表达载体,试验不同插入位置及插入元件对GFP表达的影响,以获得最佳表达载体,得到番茄褐色皱纹果病毒侵染可视化追踪系统的构建方法。
方案一:将ToBRFV CP及3’UTR替换为烟草轻绿花叶病毒(TMGMV)CP及3’UTR,并在pCB301-ToBRFV MP的3’端插入ToBRFV的CP启动子、外源GFP、ToBRFV 3’非编码区以及MP C端的部分序列。
方案二:将ToBRFV的CP启动子、外源GFP、ToBRFV 3’非编码区以及MP C端的部分序列插入到pCB301-ToBRFV MP的3’端。
方案三:将ToBRFV的CP启动子、外源GFP插入到pCB301-ToBRFV MP的3’端。
具体构建图谱见图1。
具体包括以下步骤:
方案一:
(1)以MP-CP-Pro-F-1和MP-CP-Pro-R-1(如SEQ ID NO:1-2所示)为引物,以含有ToBRFV序列的质粒为模板,利用高保真DNA聚合酶进行PCR扩增,并回收特异的PCR条带,获得PCR1-1;
MP-CP-Pro-F-1:
GAAAAGGCAGTTTGGCAAGTACTAGTTAATATTAGAAATGTTAAAATT
MP-CP-Pro-R-1:
CCATTGCGCATGCTGATGACAAAAACACAAATTGCGATGGAGTTGCGATTGTGTAAGACGTATTTAATACGAATCTGAATCG;
(2)以GFP(NsbI)-F-1和GFP(EheI)-R-1(如SEQ ID NO:3-4所示)为引物,以含有GFP序列的质粒为模板,利用高保真DNA聚合酶进行PCR扩增,扩增的GFP两端包含引入的2个限制性内切酶NsbI、EheI的酶切位点,回收特异的PCR条带,获得PCR1-2;
GFP(NsbI)-F-1:GTCATCAGCATGCGCAATGGCTAGCAAAGG;
GFP(EheI)-R-1:CTCGATTATCGGCGCCTTATTTGTAGAGCTC;
(3)以UTR-F-1和UTR-R-1(如SEQ ID NO:5-6所示)为引物,以含有ToBRFV序列的质粒为模板,利用高保真DNA聚合酶进行PCR扩增,并回收特异的PCR条带,获得PCR1-3;
UTR-F-1:ATAAGGCGCCGATAATCGAGATGCTTAAATAACAG;
UTR-R-1:TTTCACAGCCTGGGCCCCTACCGGGGGTTC;
(4)以TMGMV-F和TMGMV-R(如SEQ ID NO:7-8所示)为引物,以含有TMGMV序列的质粒为模板,利用高保真DNA聚合酶进行PCR扩增,并回收特异的PCR条带,获得PCR1-4;
TMGMV-F:TAGGGGCCCAGGCTGTGAAACTCGAAAAGGTTCC;
TMGMV-R:CCGACCCGGGTGGGCCGCTACCCGCGGTTAGG;
(5)以pCB-F-1和pCB-R-1(如SEQ ID NO:9-10所示)为引物,以含有ToBRFV序列的质粒pCB-ToBRFV为模板,利用高保真DNA聚合酶进行PCR扩增,并回收特异的PCR条带,获得PCR1-5;
pCB-F-1:TAGCGGCCCACCCGGGTCGGCATGGCAT;
pCB-R-1:CTGTCAAACACTGATAGTTTAAACTGAAGGCGGGAAACGACAATCT;
所述步骤(1-5)中每个相邻的PCR扩增片段之间含有15bp同源序列。
(6)pCB-ToBRFV-GFP-1重组载体的构建:利用限制型内切酶ScaI和PmeI酶切pCB-ToBRFV,琼脂糖凝胶电泳回收相应条带;通过同源重组酶将PCR1-1、PCR1-2、PCR1-3、PCR1-4、PCR1-5与ScaI和PmeI酶切的pCB-ToBRFV进行同源重组,转化大肠杆菌;利用引物pCB-F-1和pCB-R-1筛选,挑选具有全长插入的克隆;通过DNA测序进行验证;验证成功后,提取包含全长质粒的克隆,转化至农杆菌中。
(7)培养含pCB-ToBRFV-GFP全长的农杆菌,接种至野生型本氏烟上,白光和手提式紫外灯下观察植物症状以及荧光表达情况,确定改造的病毒是否具有侵染性并且能够用于追踪ToBRFV的侵染;
(8)提取本氏烟植株系统叶上的总蛋白,利用Western blot分析,观察ToBRFV的侵染以及GFP的表达。
方案二:
(1)以MP-CP-Pro-F-2和MP-CP-Pro-R-2(如SEQ ID NO:11-12所示)为引物,以含有ToBRFV序列的质粒为模板,利用高保真DNA聚合酶进行PCR扩增,并回收特异的PCR条带,获得PCR2-1;
MP-CP-Pro-F-2:
GAAAAGGCAGTTTGGCAAGTACTAGTTAATATTAGAAATGTTAAAATT;
MP-CP-Pro-R-2:
CCATTGCGCATGCTGATGACAAAAACACAAATTGCGATGGAGTTGCGATTGTGTAAGACGTATTTAATACGAATCTGAATCG;
(2)以GFP(NsbI)-F-2和GFP(EheI)-R-2(如SEQ ID NO:13-14所示)为引物,以含有GFP序列的质粒为模板,利用高保真DNA聚合酶进行PCR扩增,扩增的GFP两端包含引入的2个限制性内切酶NsbI、EheI的酶切位点,回收特异的PCR条带,获得PCR2-2;
GFP(NsbI)-F-2:GTCATCAGCATGCGCAATGGCTAGCAAAGG;
GFP(EheI)-R-2:CTCGATTATCGGCGCCTTATTTGTAGAGCTC;
(3)以UTR-F-2和UTR-R-2(如SEQ ID NO:15-16所示)为引物,以含有ToBRFV序列的质粒为模板,利用高保真DNA聚合酶进行PCR扩增,并回收特异的PCR条带,获得PCR2-3;
UTR-F-2:ATAAGGCGCCGATAATCGAGATGCTTAAATAACAG;
UTR-R-2:TCCCGGTCTTTGGGCCCCTACCGGGGGTTC;
(4)以CP-F-2和CP-R-2(如SEQ ID NO:17-18所示)为引物,以含有ToBRFV序列的质粒为模板,利用高保真DNA聚合酶进行PCR扩增,并回收特异的PCR条带,获得PCR2-4;CP-F-2:TAGGGGCCCAAAGACCGGGAAAAAGTTTAGTAGT;
CP-R-2:CCGACCCGGGTGGGCCCCTACCGGGGGT;
(5)以pCB-F-2和pCB-R-2(如SEQ ID NO:19-20所示)为引物,以含有ToBRFV序列的质粒pCB-ToBRFV为模板,利用高保真DNA聚合酶进行PCR扩增,并回收特异的PCR条带,获得PCR2-5;
pCB-F-2:TAGGGGCCCACCCGGGTCGGCATGGCAT;
pCB-R-2:CTGTCAAACACTGATAGTTTAAACTGAAGGCGGGAAACGACAATCT;
所述步骤(1-5)中每个相邻的PCR扩增片段之间含有15bp同源序列。
(6)pCB-ToBRFV-GFP重组载体的构建:利用限制型内切酶ScaI和PmeI酶切pCB-ToBRFV,琼脂糖凝胶电泳回收相应条带;通过同源重组酶将PCR2-1、PCR2-2、PCR2-3、PCR2-4、PCR2-5与ScaI和PmeI酶切的pCB-ToBRFV进行同源重组,转化大肠杆菌;利用引物pCB-F-2和pCB-R-2筛选,挑选具有全长插入的克隆;通过DNA测序进行验证;验证成功后,提取包含全长质粒的克隆,转化至农杆菌中。
(7)后续步骤同方案一(7-8)
方案三:
(1)以MP-CP-Pro-F-3和MP-CP-Pro-R-3(如SEQ ID NO:21-22所示)为引物,以含有ToBRFV序列的质粒为模板,利用高保真DNA聚合酶进行PCR扩增,并回收特异的PCR条带,获得PCR3-1;
MP-CP-Pro-F-3:
GAAAAGGCAGTTTGGCAAGTACTAGTTAATATTAGAAATGTTAAAATT;
MP-CP-Pro-R-3:
CCATTGCGCATGCTGATGACAAAAACACAAATTGCGATGGAGTTGCGATTGTGTAAGACGTATTTAATACGAATCTGAATCG;
(2)以GFP(NsbI)-F-3和GFP(EheI)-R-3(如SEQ ID NO:23-24所示)为引物,以含有GFP序列的质粒为模板,利用高保真DNA聚合酶进行PCR扩增,扩增的GFP两端包含引入的2个限制性内切酶NsbI、EheI的酶切位点,回收特异的PCR条带,获得PCR3-2;
GFP(NsbI)-F-3:GTCATCAGCATGCGCAATGGCTAGCAAAGG;
GFP(EheI)-R-3:TGTAAGACATGGCGCCTTATTTGTAGAGCTC;
(3)以CP-F-3和CP-R-3(如SEQ ID NO:25-26所示)为引物,以含有ToBRFV序列的质粒为模板,利用高保真DNA聚合酶进行PCR扩增,并回收特异的PCR条带,获得PCR3-3;
CP-F-3:ATAAGGCGCCATGTCTTACACAATCGCAACTCCA;
CP-R-3:CCGACCCGGGTGGGCCCCTACCGGGGGT;
(4)以pCB-F-3和pCB-R-3(如SEQ ID NO:27-28所示)为引物,以含有ToBRFV序列的质粒pCB-ToBRFV为模板,利用高保真DNA聚合酶进行PCR扩增,并回收特异的PCR条带,获得PCR3-4;
pCB-F-3:TAGGGGCCCACCCGGGTCGGCATGGCAT;
pCB-R-3:CTGTCAAACACTGATAGTTTAAACTGAAGGCGGGAAACGACAATCT;
所述步骤(1-4)中每个相邻的PCR扩增片段之间含有15bp同源序列。
(5)pCB-ToBRFV-GFP-3重组载体的构建:利用限制型内切酶ScaI和PmeI酶切pCB-ToBRFV,琼脂糖凝胶电泳回收相应条带;通过同源重组酶将PCR3-1、PCR3-2、PCR3-3、PCR3-4与ScaI和PmeI酶切的pCB-ToBRFV进行同源重组,转化大肠杆菌;利用引物pCB-F-3和pCB-R-3筛选,挑选具有全长插入的克隆;通过DNA测序进行验证;验证成功后,提取包含全长质粒的克隆,转化至农杆菌中。
(6)后续步骤同方案一(7-8)
通过3种方案结果比对发现:
接种pCB301空载的本氏烟植株没有明显症状,并且在紫外灯下均无荧光。
方案一接种pCB-ToBRFV-GFP-1的本氏烟植株未出现黄化、卷叶等ToBRFV典型症状,在紫外灯下也未观察到明显荧光。
方案二接种pCB-ToBRFV-GFP-2的本氏烟症状与接种侵染性克隆pCB-ToBRFV的症状相似,并且在接种叶及系统叶都能观察到明显的荧光,荧光强度十分强烈,始终保持至上部系统叶。
方案三接种pCB-ToBRFV-GFP-3的本氏烟植株前期不能观察到ToBRFV的症状,紫外灯下能观察到接种叶出现明显荧光,但GFP不能系统表达(如图2)。
由此可见,外源GFP蛋白的插入位置及前后连接序列对其正常表达是至关重要的,ToBRFV 3’UTR序列及MP的C端部分序列是前期CP正常表达及系统扩散所必须的。只有将GFP插入到MP及CP中间,保留一段MP的C端序列、3’UTR及ToBRFV CP才能使重组载体在系统叶中既保留原始症状表型又保持荧光蛋白的持续积累。pCB-ToBRFV-GFP-2无论在症状还是荧光强度方面都有很好的表现,可供后续实验使用。
提取本氏烟植株系统叶上的总蛋白,利用Western blot分析,结果表明,接种了pCB-ToBRFV-GFP-2的本氏烟系统叶能检测到GFP及ToBRFV-CP蛋白积累(如图3)。
实施例2ToBRFV侵染可视化追踪系统用于评估候选基因的抗病毒效果
培养含pCB-ToBRFV-GFP-2的农杆菌,接种至含N基因的转基因本氏烟上,以pCB-ToBRFV-GFP-2接种的野生型本氏烟作为对照,定期对接种植株进行观察,在手提式紫外灯下观察植物症状以及荧光表达情况,如图4所示,确定N基因对ToBRFV具有抗病毒效果。
以上所述的实施例仅仅是对本发明的优选实施方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案作出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
- 番茄褐色皱纹果病毒的侵染性克隆载体及其构建方法和应用
- 番茄褐色皱纹果病毒的侵染性克隆载体及其构建方法和应用
