用于递送核酸的植入式医疗器件
文献发布时间:2024-04-18 19:58:26
相关申请的交叉引用
本申请要求于2021年3月30日提交的美国临时专利申请序列号63/167,728和于2021年4月26日提交的美国临时专利申请序列号63/179,637的申请权益,其通过引用以其整体并入本文。
背景技术
核酸,如mRNA和siRNA,最近已成为大量基因治疗疗法的焦点,如肿瘤治疗、疫苗等。例如,与DNA相比,核糖核酸(如,mRNA)不能稳定整合到转染细胞的基因组中,从而消除了所导入基因材料会破坏必需基因的正常功能的顾虑。进行编码蛋白质的有效翻译也不需要外部启动子序列,再次避免可能的有害副作用。然而,基于核糖核酸的基因治疗的一个问题是核糖核酸远不如DNA稳定,尤其是当它到达细胞的细胞质并且暴露于降解酶时。例如,mRNA中糖部分的第二个碳上存在的羟基会导致空间位阻,阻止mRNA形成更稳定的DNA双螺旋结构,从而使mRNA更容易水解降解。鉴于此,通常将核糖核酸包封在脂质颗粒(如,脂质体、固体脂质颗粒等)中,以保护它们免受细胞外RNase降解,同时促进细胞摄取和内体逃逸。然而,遗憾的是,它们在许多应用中仍然存在问题。例如,难以在持续的时间段内可控地递送包封核酸的脂质颗粒。造成这种困难的原因之一在于,颗粒中使用的脂质往往具有相对较低的熔点,使得难以将脂质并入用于形成大多数常规植入式医疗器件的工艺和聚合物材料中。
因此,仍然需要能够在持续的时间段内递送核酸的植入式递送器件。
发明内容
根据本发明的一种实施方式,公开了一种植入式医疗器件。该器件包括药物释放层,其中所述药物释放层包括分散在聚合物基质中的裸核酸。该聚合物基质包括乙烯-乙酸乙烯酯共聚物,所述聚合物基质具有根据ASTM D3418-15测定的约20℃至约100℃的熔融温度,以及根据ASTM D1238-20在190℃的温度和2.16千克的载荷下测定的约0.2克/10分钟至约100克/10分钟的熔体流动指数。
下面将更详细地阐述本发明的其他特征和方面。
附图说明
参考附图,包括对本领域普通技术人员而言最佳模式的本发明的全面且能够实现的公开内容在说明书的其余部分更具体地进行阐述,附图中:
图1为本发明的植入式医疗器件的一个实施方式的透视图;
图2为图1的植入式医疗器件的截面图;
图3为本发明的植入式医疗器件的另一个实施方式的透视图;以及
图4为图3的植入式医疗器件的截面图。
本说明书和附图中重复使用的附图标记意在表示本发明的相同或类似的特征或元件。
具体实施方式
本领域普通技术人员应当理解,本文仅是对示例性实施方式的描述,并不打算限制本发明的更广泛方面。
一般而言,本发明涉及一种植入式医疗器件,其能够在持续的时间段内向患者(如,人、宠物、农场动物、比赛用马等)递送核酸,以帮助预防和/或治疗患者的病症、疾病和/或美容状态。所述植入式医疗器件包括分散在聚合物基质内的“裸”核酸,所述聚合物基质包括一种或多种乙烯-乙酸乙烯酯共聚物。如本文所使用,“裸”核酸通常指无包膜的核酸,其没有周围载体,例如脂质、肽、蛋白质、碳水化合物(如,糖)等。聚合物基质与核酸的重量比通常为约1至约10,在一些实施方式中为约1.1至约8,在一些实施方式中为约1.2至约6,以及在一些实施方式中为约1.5至约4。例如,在一个实施方式中,植入式医疗器件可包括药物释放层。核酸可占药物释放层的约1wt.%至约60wt.%,在一些实施方式中约5wt.%至约50wt.%,在一些实施方式中约10wt.%至约45wt.%,而聚合物基质可占药物释放层的约40wt.%至约99wt.%,在一些实施方式中约50wt.%至约95wt.%,在一些实施方式中约55wt.%至约90wt.%。值得注意的是,选择具有一定的熔融温度和熔体流动指数的聚合物基质中使用的乙烯-乙酸乙烯酯共聚物,以有助于最大限度地降低加工期间核酸降解的风险。例如,如根据ASTM D3418-15所测定的,乙烯-乙酸乙烯酯共聚物和所得聚合物基质的熔融温度可为约20℃至约100℃,在一些实施方式中为约25℃至约80℃,在一些实施方式中为约30℃至约70℃,在一些实施方式中为约35℃至约65℃,以及在一些实施方式中为约40℃至约60℃。如根据ASTM D1238-20在190℃的温度和2.16千克的载荷下所测定的,乙烯-乙酸乙烯酯共聚物和所得聚合物基质的熔体流动指数可为约0.2g/10min至约100g/10min,在一些实施方式中为约5g/10min至约90g/10min,在一些实施方式中为约10g/10min至约80g/10min,以及在一些实施方式中为约30g/10min至约70g/10min。
现在将更详细地描述本发明的各种实施方式。
I.
如上所述,聚合物基质至少包括乙烯-乙酸乙烯酯共聚物,其通常衍生自至少一种乙烯单体和至少一种乙酸乙烯酯单体。本发明人已发现,可选择性地控制共聚物的某些方面以有助于实现期望的释放特性。例如,可选择性地将共聚物的乙酸乙烯酯含量范围控制为该共聚物的约10wt.%至约60wt.%,在一些实施方式中为约20wt.%至约60wt.%,在一些实施方式中为约25wt.%至约55wt.%,在一些实施方式中为约30wt.%至约50wt.%,在一些实施方式中为约35wt.%至约48wt.%,以及在一些实施方式中为约38wt.%至约45wt.%。反过来说,共聚物的乙烯含量范围类似地可为约40wt.%至约80wt.%,在一些实施方式中为45wt.%至约75wt.%,在一些实施方式中为约50wt.%至约80wt.%,在一些实施方式中为约52wt.%至约65wt.%,在一些实施方式中为约55wt.%至约62wt.%。除了其他方面,这样的共聚单体含量可帮助实现核酸的可控持续释放特性,同时还具有本质上与乙烯-乙酸乙烯酯共聚物的熔融温度更相似的相对较低的熔融温度。如根据ASTM D1505-18所测定的,乙烯-乙酸乙烯酯共聚物的密度范围也可为约0.900克/立方厘米至约1.00克/立方厘米(g/cm
在某些实施方式中,还可期望采用乙烯-乙酸乙烯酯共聚物和疏水性聚合物(如,如下所述的(如,乙烯-乙酸乙烯酯共聚物))的共混物,使得共混物和聚合物基质整体具有在上述范围内的熔融温度和/或熔体流动指数。例如,聚合物基质可包括第一乙烯共聚物和第二乙烯共聚物,其中第二乙烯共聚物的熔融温度大于第一乙烯共聚物的熔融温度。类似地,第二乙烯共聚物可具有与第一乙烯共聚物的相应熔体流动指数相同、更低或更高的熔体流动指数。例如,第一乙烯-乙酸乙烯酯共聚物可具有例如根据ASTM D3418-15所测定的约20℃至约60℃,在一些实施方式中约25℃至约55℃,以及在一些实施方式中约30℃至约50℃的熔融温度,和/或根据ASTM D1238-20在190℃的温度和2.16千克的载荷下所测定的约40g/10分钟至约900g/10分钟,在一些实施方式中为约50g/10分钟至约500g/10分钟,以及在一些实施方式中为约55g/10分钟至约250g/10分钟的熔体流动指数。类似地,第二乙烯-乙酸乙烯酯共聚物可具有例如根据ASTM D3418-15所测定的约50℃至约100℃,在一些实施方式中为约55℃至约90℃,以及在一些实施方式中为约60℃至约80℃的熔融温度,和/或根据ASTM D1238-20在190℃的温度和2.16kg的载荷下所测定的约0.2g/10min至约55g/10min,在一些实施方式中为约0.5g/10min至约50g/10min,以及在一些实施方式中为约1g/10min至约40g/10min的熔体流动指数。第一乙烯共聚物可占聚合物基质的约20wt.%至约80wt.%,在一些实施方式中约30wt.%至约70wt.%,以及在一些实施方式中约40wt.%至约60wt.%,并且类似地,第二乙烯共聚物可占聚合物基质的约20wt.%至约80wt.%,在一些实施方式中约30wt.%至约70wt.%,以及在一些实施方式中约40wt.%至约60wt.%。乙烯-乙酸乙烯酯共聚物与诸如下文所述的其他疏水性聚合物的共混物也可在聚合物基质中使用。
通常可将各种技术中的任一种用于形成具有所期望性质的乙烯-乙酸乙烯酯共聚物,如本领域所知的。在一个实施方式中,聚合物通过在高压反应中使乙烯单体和乙酸乙烯酯单体共聚来制备。乙酸乙烯酯可这样制备,丁烷氧化生成乙酸酐和乙醛,乙酸酐和乙醛可一起反应形成二乙酸亚乙基酯。然后,二乙酸亚乙基酯可在酸催化剂存在下热分解,形成乙酸乙烯酯单体。合适的酸催化剂的实例包括芳香族磺酸(如,苯磺酸、甲苯磺酸、乙苯磺酸、二甲苯磺酸和萘磺酸)、硫酸和链烷磺酸,如Oxley等的美国专利号2,425,389;Schnizer的美国专利号2,859,241;以及Isshiki等的美国专利号4,843,170所述。乙酸乙烯酯单体还可通过在催化剂而非乙醛存在下使乙酸酐与氢气反应来制备。该工艺直接由乙酸酐和氢气转化为乙酸乙烯酯,而无需产生二乙酸亚乙基酯。在又一个实施方式中,乙酸乙烯酯单体可由乙醛和烯酮在合适的固体催化剂(如,全氟磺酸树脂或沸石)存在下进行反应来制备。
在某些情况下,乙烯-乙酸乙烯酯共聚物构成聚合物基质的全部聚合物含量。然而,在其他情况下,可能期望包括其他聚合物,例如,如下文所述的其他疏水性聚合物和/或亲水性聚合物。使用时,通常期望这类其他聚合物占聚合物基质的聚合物含量的约0.001wt.%至约30wt.%,在一些实施方式中约0.01wt.%至约20wt.%,以及在一些实施方式中约约0.01wt.%至约10wt.%。在这类情况下,乙烯-乙酸乙烯酯共聚物可占聚合物基质的聚合物含量的约70wt.%至约99.999wt.%,在一些实施方式中约80wt.%至约99.99wt.%,以及在一些实施方式中约90wt.%至约99.9wt.%。
如果需要,聚合物基质还可包括一种或多种增塑剂以帮助降低加工温度,从而允许使用较高熔点的共聚物而不会导致核酸热变性。合适的增塑剂可包括,例如脂肪酸、脂肪酸酯(如,甘油三酯)、脂肪酸盐、脂肪酸酰胺、有机磷酸酯、烃蜡等以及它们的混合物。脂肪酸通常可为碳链长度为约8至22个碳原子,并且在一些实施方式中为约10至约18个碳原子的任何饱和酸或不饱和酸。如果需要,酸可以是取代的。合适的脂肪酸可包括,例如月桂酸、肉豆蔻酸、山萮酸、油酸、棕榈酸、硬脂酸、蓖麻油酸、癸酸、新癸酸、氢化牛脂脂肪酸、羟基硬脂酸、氢化蓖麻油的脂肪酸、芥酸、椰子油脂肪酸等,以及其混合物。还可使用脂肪酸衍生物,例如,脂肪酸酰胺,如油酸酰胺、芥酸酰胺、硬脂酰胺、亚乙基双(硬脂酰胺)等;脂肪酸盐(如,金属盐),例如硬脂酸钙、硬脂酸锌、硬脂酸镁、硬脂酸铁、硬脂酸锰、硬脂酸镍、硬脂酸钴等;脂肪酸酯,例如脂肪族醇(如,2-乙基己醇、单乙二醇、异十三烷醇、丙二醇、季戊四醇等)的脂肪酸酯、甘油的脂肪酸酯(如,蓖麻油、芝麻油等)、多元酚的脂肪酸酯、糖脂肪酸酯等;以及上述的任意的混合物。还可使用烃蜡,包括石蜡、聚烯烃和氧化聚烯烃蜡,以及微晶蜡。特别合适的是硬脂酸的酸、盐或酰胺,例如硬脂酸、硬脂酸钙、季戊四醇四硬脂酸酯或N,N’-亚乙基双硬脂酸酰胺。使用时,增塑剂通常占聚合物基质的约0.05wt.%至约1.5wt.%,以及在一些实施方式中约0.1wt.%至约0.5wt.%。
II.
如上所述,裸核酸分散在聚合物基质内。如本文所使用,术语“核酸”通常指包含核碱基和酸性部分的化合物,例如核苷、核苷酸、多核苷酸或其组合。“核苷”通常指含有与有机碱(如,嘌呤或嘧啶)或其衍生物(本文又称为“核碱基”)结合的糖分子(如,戊糖或核糖)或其衍生物的化合物。术语“核酸”通常指含有磷酸基团的核苷。经修饰的核苷酸可通过任何有用的方法合成,例如,如化学法、酶法或重组法,以包括一个或多个经修饰的或非天然的核苷。多核苷酸可包含连接的核苷的一个或多个区域。这样的区域可具有可变的主链键。所述键可以是标准的磷酸二酯键,在这种情况下,多核苷酸包含多个核苷酸区域。例如,多核苷酸可包含三个或更多的核苷酸,它们是线性分子,其中相邻的核苷酸通过磷酸二酯键相互连接。术语“核酸”还包括RNA以及单链和/或双链DNA。更具体地,核酸可为或可包括,例如,核糖核酸(RNA)、脱氧核糖核酸(DNA)、苏糖核酸(TNA)、乙二醇核酸(GNA)、肽核酸(PNA)、锁核酸(LNA,包括具有β-D-核糖构型的LNA、具有α-L-核糖构型的α-LNA((LNA的非对映体)、具有2’-氨基官能化的2’-氨基-LNA、以及具有2’-氨基官能化的2’-氨基-c-LNA)、乙烯核酸(ENA)、环己烯核酸(CeNA)或其嵌合体或组合。
核酸可以是天然存在的,例如在基因组、转录物、mRNA、tRNA、rRNA、siRNA、snRNA、质粒、粘粒、染色体、染色单体或其他天然存在的核酸分子的背景下。另一方面,核酸分子可为非天然存在的分子,例如,重组DNA或RNA、人工染色体、工程化基因组、或其片段、或合成DNA、RNA、DNA/RNA杂合体,或包含非天然存在的核苷酸或核苷。核酸可从天然来源纯化,使用重组表达系统产生并任选纯化,化学合成等。核酸还可包括核苷类似物,例如具有化学修饰的碱基或糖以及骨架修饰的类似物。在一些实施方式中,核酸为或包含天然核苷(如,腺苷、胸苷、鸟苷、胞苷、尿苷、脱氧腺苷、脱氧胸苷、脱氧鸟苷和脱氧胞苷);核苷类似物(如,2-氨基腺苷、2-硫代胸苷、肌苷、吡咯并嘧啶、3-甲基腺苷、5-甲基胞苷、2-氨基腺苷、C5-溴尿苷、C5-氟尿苷、C5-碘尿苷、C5-丙炔基-尿苷、C5-丙炔基-胞苷、C5-甲基胞苷、2-氨基腺苷、7-脱氮腺苷、7-脱氮鸟苷、8-氧代腺苷、8-氧代鸟苷、O(6)-甲基鸟嘌呤和2-硫代胞苷);化学修饰的碱基;生物修饰的碱基(如,甲基化碱基);经插入的碱基;经修饰的糖(如,2’-氟核糖、核糖、2’-脱氧核糖、阿拉伯糖和己糖);和/或经修饰的磷酸基团(如,硫代磷酸酯和5’-N-亚磷酰胺键)。
可采用修饰核苷酸碱基配对,其不仅涵盖标准的腺苷-胸腺嘧啶、腺苷-尿嘧啶或鸟苷-胞嘧啶碱基对,而且还涵盖在核苷酸和/或包括非标准或修饰碱基的修饰核苷酸之间形成的碱基对,其中氢键供体和氢键受体的排列允许在非标准碱基和标准碱基之间或在两个互补的非标准碱基结构之间形成氢键。这种非标准碱基配对的一个实例是经修饰的核苷酸肌苷与腺嘌呤、胞嘧啶或尿嘧啶之间的碱基配对。碱/糖或接头的任何组合可掺入本公开的多核苷酸中。
在某些实施方式中,核酸可为其中一个或更多个核碱基经修饰用于治疗目的的多核苷酸(如,RNA多核苷酸,例如mRNA多核苷酸)。事实上,在某些实施方式中,可使用包括至少两种(如,2、3、4或更多种)修饰核碱基的组合的多核苷酸(如,RNA多核苷酸,例如mRNA多核苷酸)。例如,多核苷酸中合适的修饰核碱基可为经修饰的胞嘧啶,例如,5-甲基胞嘧啶、5-甲基胞苷(m5C)、N4-乙酰基胞苷(ac4C)、5-卤代胞苷(如,5-碘代胞苷)、5-羟甲基胞苷(hm5C)、1-甲基-假异胞苷、2-硫代胞苷(s2C)、2-硫代-5-甲基胞苷等;经修饰的尿苷,如5-氰基尿苷、4’-硫代尿苷、假尿苷(ψ)、N1-甲基假尿苷(m1ψ)、N1-乙基假尿苷、2-硫代尿苷(s2U)、4’-硫代尿苷、2-硫代-1-甲基-1-脱氮-假尿苷、2-硫代-1-甲基-假尿苷、2-硫代-5-氮杂-尿苷、2-硫代-二氢假尿苷、2-硫代-二氢尿苷、2-硫代-假尿苷、4-甲氧基-2-硫代-假尿苷、4-甲氧基-假尿苷、4-硫代-1-甲基-假尿苷、4-硫代-假尿苷、5-氮杂-尿苷、二氢假尿苷、5-甲基尿苷(mo5U)、5-甲氧基尿苷、2'-O-甲基尿苷等;经修饰的鸟苷,如α-硫代鸟苷、肌苷(I)、1-甲基-肌苷(m1I)、怀俄苷(imG)、甲基怀俄苷(mimG)、7-脱氮鸟苷、7-氰基-7-脱氮鸟苷(preQO)、7-氨甲基-7-脱氮-鸟苷(preQ1)、7-甲基-鸟苷(m7G)、1-甲基-鸟苷(m1G)、8-氧代鸟苷、7-甲基-8-氧代鸟苷等;经修饰的腺嘌呤,如α-硫代腺苷、7-脱氮腺嘌呤、1-甲基-腺苷(m1A)、2-甲基-腺嘌呤(m2A)、N6-甲基-腺苷(m6A)、2,6-二氨基嘌呤等;以及其组合。在一些实施方式中,多核苷酸(如,RNA多核苷酸,例如mRNA多核苷酸)包含至少两种(如,2、3、4或更多种)前述经修饰的核碱基的组合。
在一些实施方式中,多核苷酸(如,RNA多核苷酸,例如mRNA多核苷酸)可针对特定修饰进行均匀修饰(如,完全修饰,在整个序列中修饰)。例如,可用5-甲基-胞苷(m5C)对多核苷酸进行均匀修饰,这意味着用5-甲基-胞苷(m5C)替换mRNA序列中的所有胞嘧啶残基。类似地,对于序列中存在的任何类型的核苷残基,可通过用经修饰的残基(如上文所述的任何残基)替换来对多核苷酸进行均匀修饰。
在一些实施方式中,多核苷酸用作信使RNA(mRNA)。“信使RNA”(mRNA)通常指编码(至少一种)多肽(氨基酸的天然存在、非天然存在或经修饰的聚合物),并且可以在体外、体内、原位或离体翻译产生经编码的多肽的任何多核苷酸。mRNA分子的基本组分通常包括至少一个编码区、5’非翻译区(UTR)、3’UTR、5’帽子和多聚A尾巴。多核苷酸可起mRNA的作用,但与野生型mRNA在功能和/或结构设计特征方面不同,这样的功能和/或结构设计特征用于克服使用基于核酸的疗法中有效多肽表达的现存问题。mRNA可包含至少一种(一种或多种)核糖核酸(RNA)多核苷酸,其具有编码至少一种感兴趣的多肽的开放阅读框。在一些实施方式中,mRNA的RNA多核苷酸编码2-10、2-9、2-8、2-7、2-6、2-5、2-4、2-3、3-10、3-9、3-8、3-7、3-6、3-5、3-4、4-10、4-9,4-8、4-7、4-6、4-5、5-10、5-9、5-8、5-7、5-6、6-10、6-9、6-8、6-7、7-10、7-9、7-8、8-10、8-9或9-10种多肽。在一些实施方式中,mRNA的RNA多核苷酸编码至少10、20、30、40、50、60、70、80、90或100种多肽。在一些实施方式中,mRNA的RNA多核苷酸编码至少100或至少200种多肽。
在一些实施方式中,核酸是治疗性mRNA。如本文所用,术语“治疗性mRNA”是指编码治疗性蛋白质的mRNA。治疗性蛋白质介导宿主细胞或受试者的多种效应,以治疗疾病或改善疾病的病征和症状。例如,治疗性蛋白质可以替代缺陷或异常的蛋白质,增强内源性蛋白质的功能,为细胞提供新的功能(如,抑制或激活内源性细胞活性,或充当其他治疗性化合物(如,抗体-药物缀合物)的递送剂)。治疗性mRNA可用于治疗各种疾病和病症,如细菌感染、病毒感染、寄生虫感染、细胞增殖障碍、遗传性疾病和自身免疫性疾病。可将mRNA设计为编码选自数种目标类别中的任何一种的感兴趣的多肽,包括但不限于:生物制剂、抗体、疫苗、治疗性蛋白质或肽、细胞渗透肽、分泌蛋白质、质膜蛋白质、细胞质或细胞骨架蛋白质、细胞内膜结合蛋白质、核蛋白质、与人类疾病相关的蛋白质、靶向部分或由人类基因组编码尚未确定治疗适应症但在研究和发现领域具有实用性的那些蛋白质。
特别适合的治疗性mRNA是包括具有编码至少一种抗原多肽的开放阅读框的至少一个核糖核酸(RNA)多核苷酸的那些mRNA,其中RNA的RNA多核苷酸包括至少一种化学修饰。化学修饰例如可以为假尿苷、N1-甲基假尿苷、N1-乙基假尿苷、2-硫代尿苷、4’-硫代尿苷、5-甲基胞嘧啶、2-硫代-1-甲基-1-脱氮-假尿苷、2-硫代-1-甲基-假尿苷、2-硫代-5-氮杂-尿苷、2-硫代-二氢假尿苷、2-硫代-二氢尿苷、2-硫代-假尿苷、4-甲氧基-2-硫代-假尿苷、4-甲氧基-假尿苷、4-硫代-1-甲基-假尿苷、4-硫代-假尿苷、5-氮杂-尿苷、二氢假尿苷、5-甲基尿苷、5-甲氧基尿苷、以及2’-O-甲基尿苷。
虽然绝不是必需的,但是还可以选择核酸的特定性质以帮助提高其分散在聚合物基质中且在不显著降解的情况下递送至患者的能力。例如,可能期望将常规RNA(如,mRNA)与自扩增RNA共同递送。例如,常规mRNA通常包括靶抗原的开放阅读框,该开放阅读框的两侧有非翻译区域,并带有末端多聚A尾巴。转染后,它们驱动瞬时抗原表达。另一方面,自扩增mRNA能够通过RNA依赖性RNA聚合酶复合物的合成来引导它们的自我复制,产生多个抗原编码mRNA的拷贝,并在导入宿主细胞的细胞质时表达高水平的异源基因。还可以采用环状RNA(circRNA),其是头尾连接的单链RNA。可将靶RNA环化,例如通过非哺乳动物外源性内含子的反向剪接或线性RNA的5’端和3’端夹板连接。例如,合适的circRNA的实例描述于美国专利公开号2019/0345503中,其通过引用并入本文。还可以采用反义RNA,其通常具有携带在由吗啉基主链基团组成的主链亚基上的碱基,其中主链基团通过(带电荷和不带电荷的)亚基间键连接,使化合物中的碱基通过沃森-克里克碱基配对与RNA中的靶序列杂交,从而在靶序列内形成RNA:寡核苷酸异源双链核酸分子。例如,在美国专利号5,698,685、5,217,866、5,142,047、5,034,506、5,166,315、5,185,444、5,521,063和5,506,337中详细描述了具有不带电荷的主链键的吗啉基寡核苷酸,包括反义寡核苷酸,这些文献通过引用并入本文。其他示例性反义寡核苷酸描述于美国专利号9,464,292,10,131,910,10,144,762和10,913,947,其通过引用并入本文。
在某些情况下,核酸可以是适体,例如RNA适体。RNA适体可以是任何合适的RNA分子,其可以作为独立分子单独使用,或者可以作为具有多种功能的较大RNA分子(如RNA干扰分子)的一部分而被整合。例如,RNA适体可位于shRNA分子的暴露区域(如,shRNA分子的环状区域),以允许shRNA或miRNA分子结合靶细胞的表面受体。内化后,可通过靶细胞的RNA干扰途径进行加工。形成核酸适体的核酸可包括天然存在的核苷、经修饰的核苷、具有在一个或多个核苷之间插入的烃接头(如,亚烷基)和/或聚醚接头(如,PEG接头)的天然存在的核苷、具有在一个或多个核苷之间插入的烃接头或PEG接头的经修饰的核苷,或其组合。在一些实施方式中,核酸适体的核苷酸或经修饰的核苷酸可用烃接头或聚醚接头替代。合适的适体可描述于例如美国专利号9,464,293,其通过引用并入本文。
蛋白质融合的核酸也可适用于本发明。例如,蛋白质(如,抗体)可共价连接到RNA(如,mRNA)。这类RNA-蛋白质融合体可通过体外或原位翻译包含连接到其3’端的肽受体的mRNA库来合成。在一个实施方式中,在通读信息的开放阅读框之后,核糖体在到达设计的暂停位点时暂停,并且受体部分占据核糖体A位点并接受来自P位点的肽基-tRNA的新生肽链,以产生RNA-蛋白质融合体。蛋白质和RNA之间的共价连接(以mRNA的3’端和其编码的蛋白质的C端之间为酰胺键的形式)允许在通过RNA的逆转录选择后回收和扩增(如,通过PCR)蛋白质中的遗传信息。一旦形成融合体,基于mRNA-蛋白质融合体的特性进行选择或富集,或可选择地,当mRNA模板附着在蛋白质上时,可以使用mRNA模板进行逆转录,以避免单链RNA对选择的影响。这类蛋白质融合的核酸的实例描述于例如美国专利号6,518,018,其通过引用并入本文。还可以采用与具有催化裂解RNA的序列的核酸缀合的核酶(如,DNAse和/或RNAase),如美国专利号10,155,946所述,其通过引用并入本文。
除了诸如如上所述的单链核酸之外,还可以采用各种特定类型的双链核酸来帮助改善稳定性。在某些实施方式中,可以采用环状DNA(cDNA)和质粒核酸(如,pDNA),其是DNA的封闭环状形式。这类核酸的实例描述于例如WO 2004/060277,其通过引用并入本文。还可以采用长双链DNA。例如,使用支架DNA折纸术(DNA origami),通过在包含支架互补性序列的片段或区域的较短寡核苷酸(“订书钉(staple)”)存在下使支架退火,将长单链DNA折叠成特定形状。这类结构的实例描述于例如美国专利公开号2019/0142882和2018/0171386,其通过引用并入本文。
II.
药物释放层还可任选地包含一种或多种赋形剂,例如,细胞渗透性增强剂(如,脂肪酸,如油酸)、核糖核酸降解抑制剂(如,RNAase和/或DNAse抑制剂)、放射性造影剂、亲水性化合物、增体剂、增塑剂、表面活性剂、交联剂、助流剂、着色剂(如,叶绿素、亚甲基蓝等)、抗氧化剂、稳定剂、润滑剂、其他类型的抗微生物剂、防腐剂等,以提高性能和加工性。使用时,任选的赋形剂通常占药物释放层的约0.01wt.%至约20wt.%,在一些实施方式中约0.05wt.%至约15wt.%,以及在一些实施方式中约0.1wt.%至约10wt.%。例如,在一个实施方式中,可采用放射性造影剂来帮助确保可在基于X射线的成像技术(如,计算机断层摄影术、投射放射摄影术、荧光透视术等)中检测到该器件。这类试剂的实例包括,例如基于钡的化合物、基于碘的化合物、基于锆的化合物(如,二氧化锆)等。这类试剂的一个特定实例是硫酸钡。还可采用其他已知的抗微生物剂和/或防腐剂来帮助防止细菌的表面生长和附着,例如金属化合物(如,银、铜或锌)、金属盐、季铵化合物等。
还可采用细胞渗透性增强剂来帮助递送核酸。这类渗透性增强剂的实例可包括,例如紧密连接改性剂、环糊精、三羟基盐(如,胆汁盐,如甘氨胆酸钠或夫西地酸钠)、表面活性剂(如,月桂醇硫酸钠、十二烷基硫酸钠、十六烷基三甲基溴化铵、月桂基甜菜碱、聚氧乙烯山梨醇酐单棕榈酸酯等)、皂苷、夫西地酸及其衍生物、脂肪酸及其衍生物(如,油酸、单油酸甘油酯、癸酸钠、月桂酸钠等)、吡咯烷酮(如,2-吡咯烷酮)、醇(如,乙醇)、二醇(如,丙二醇)、氮酮(如,月桂氮酮)、萜烯、螯合剂(如,EDTA)、树枝状聚合物、噁唑烷、二氧戊环(如,2-正壬基-1,3-二氧戊环)、脂质(如,磷脂质)等。
为帮助使核酸降解风险最小化,可采用核糖核酸抑制剂。用于此目的的代表性抑制剂可包括,例如抗核酸酶抗体和/或非抗体抑制剂。合适的核酸酶抗体可以是抗核糖核酸酶抗体或抗脱氧核糖核酸酶抗体。抗核糖核酸酶抗体可以是抑制以下一种或多种核糖核酸酶或脱氧核糖核酸酶的抗体:RNase A、RNase B、RNase C、RNase 1、RNase T1、微球菌核酸酶、S1核酸酶、哺乳动物核糖核酸酶1家族、核糖核酸酶2家族、哺乳动物血管生成素、RNaseH家族、RNase L、嗜酸性粒细胞RNase、信使RNA核糖核酸酶(5’-3’外切核糖核酸酶、3’-5’外切核糖核酸酶)、脱帽酶、脱腺苷酶、大肠杆菌内切核糖核酸酶(RNase P、RNase III、RNaseE、RNase I,I*、RNase HI、RNase HII、RNase M、RNase R、RNase IV、F;RNase P2、O、PIV、PC、RNase N)、大肠杆菌外切核糖核酸酶(RNase II、PNPase、RNase D、RNase BN、RNase T、RNase PH、OligoRNase、RNase R)、RNase Sa、RNase F1、RNase U2、RNase Ms、RNase St、DNase1、S1核酸酶以及微球菌核酸酶。类似地,合适的非抗体核酸酶抑制剂可包括但不限于,焦碳酸二乙酯、乙醇、甲酰胺、硫氰酸胍、氧钒核糖核苷复合物、硅藻土(Macaloid)、十二烷基硫酸钠(SDS)、蛋白酶K、肝素、羟胺-氧-铜离子、膨润土、硫酸铵、二硫苏糖醇(DTT)、β-巯基乙醇、半胱氨酸、二硫赤藓糖醇、尿素、多胺(亚精胺、精胺)、去污剂(如,十二烷基硫酸钠)、三(2-羰乙基)膦盐酸盐(TCEP)等。螯合剂也是合适的非抗体核酸酶抑制剂,因为这类化合物有助于结合阳离子(如,钙、铁等),否则阳离子会导致降解。螯合剂可包括,例如氨基羧酸(如,乙二胺四乙酸)及其盐、羟基羧酸(如,柠檬酸、酒石酸、抗坏血酸等)及其盐、多聚磷酸(如,三聚磷酸、六偏磷酸等)及其盐等。期望地,螯合剂是多齿的,因为其能够与金属离子形成多个配位键以降低任何游离金属离子的可能性。例如,在一个实施方式中,可使用包含两个或更多个氨基二乙酸(有时称为亚氨基二乙酸)基团或其盐的多齿螯合剂。这种螯合剂的一个实例是乙二胺四乙酸(EDTA)。合适的EDTA盐的实例包括EDTA二钠钙、EDTA二铵、EDTA二钠和二钾、EDTA三钠和三钾、EDTA四钠和四钾。还有其他类似的氨基二乙酸螯合剂,包括但不限于丁亚丁基二胺四乙酸、1,2-亚环己基二胺四乙酸(CyDTA)、二亚乙基三胺五乙酸(DTPA)、亚乙基二胺四丙酸、(羟乙基)亚乙基二胺三乙酸(HEDTA)、三乙醇胺EDTA、三亚乙基四胺六乙酸(TTHA)、1,3-二氨基-2-羟基丙烷-N,N,N’,N’-四乙酸(DHPTA)、甲基亚氨基二乙酸、亚丙基二胺四乙酸、亚乙基二亚氨基二丙二酸(EDDM)、2,2’-双(羧甲基)亚氨基二乙酸(ISA)、亚乙基二亚氨基二丁二酸(EDDS)等。其他合适的多齿螯合剂还包括N,N,N’,N’-亚乙基二胺四亚甲基膦酸(EDTMP)、次氮基三甲基膦酸、2-氨基乙基磷酸二氢、2,3-二羧基丙烷-1,1-二膦酸、内消旋氧双(丁二酸)(ODS)等。
为了帮助进一步控制来自可植入医疗器件的释放速率,例如,还可将在水中可溶解和/或可溶胀的亲水性化合物掺入至药物释放层中。使用时,药物释放层内亲水性化合物与乙烯-乙酸乙烯酯共聚物的重量比范围可为约0.25至约200,在一些实施方式中为约0.4至约80,在一些实施方式中为约0.8至约20,在一些实施方式中为约1至约16,以及在一些实施方式中为约1.2至约10。例如,这类亲水性化合物可占药物释放层的约1wt.%至约60wt.%,在一些实施方式中约2wt.%至约50wt.%,以及在一些实施方式中约5wt.%至约40wt.%,而乙烯-乙酸乙烯酯共聚物通常占药物释放层的约40wt.%至约99wt.%,在一些实施方式中约50wt.%至约98wt.%,以及在一些实施方式中约60wt.%至约95wt.%。合适的亲水性化合物可包括例如,聚合物,非聚合材料,如脂肪酸或其盐(如,硬脂酸、柠檬酸、肉豆蔻酸、棕榈酸、亚油酸等,以及其盐)、生物相容性盐(如,氯化钠、氯化钙、磷酸钠等)、如下所述的羟基官能化化合物等。合适的亲水性聚合物的实例包括,例如海藻酸钠、海藻酸钾、海藻酸钙、纤维素化合物(如,羟甲基纤维素、羧甲基纤维素、乙基纤维素、甲基纤维素等)、琼脂、明胶、聚乙烯醇、聚亚烷基二醇(如,聚乙二醇)、胶原、果胶、甲壳质、壳聚糖、聚-1-己内酯、聚乙烯吡咯烷酮、聚(乙烯吡咯烷酮-共-乙酸乙烯酯)、多糖、亲水性聚氨酯、聚羟基丙烯酸酯、右旋糖酐、黄原胶、蛋白质、乙烯-乙烯醇共聚物、水溶性聚硅烷和硅酮、水溶性聚氨酯等,以及其组合。特别合适的亲水性聚合物是聚亚烷基二醇,例如分子量为约100克/摩尔至500,000克/摩尔,在一些实施方式中为约500克/摩尔至200,000克/摩尔,以及在一些实施方式中为约1,000克/摩尔至100,000克/摩尔的那些聚亚烷基二醇。这类聚亚烷基二醇的具体实例包括,例如聚乙二醇、聚丙二醇、聚四亚甲基二醇、聚表氯醇等。
还可以使用一种或多种非离子、阴离子和/或两性表面活性剂来帮助形成均匀的分散。使用时,这类表面活性剂通常占膜层的约0.05wt.%至约8wt.%,在一些实施方式中约0.1wt.%至约6wt.%,以及在一些实施方式中约0.5wt.%至约3wt.%。通常具有疏水基(如,长链烷基或烷基化芳基)和亲水链(如,含乙氧基和/或丙氧基部分的链)的非离子表面活性剂是特别合适的。可使用的一些合适的非离子表面活性剂包括但不限于,乙氧基化烷基酚、乙氧基化和丙氧基化脂肪醇、甲基葡萄糖的聚乙二醇醚、山梨糖醇的聚乙二醇醚、环氧乙烷-环氧丙烷嵌段共聚物、脂肪酸(C
III.
A.
如上所述,药物释放层可由聚合物基质、核酸和任选的赋形剂形成。药物释放层和/或可植入医疗器件可具有多种不同的几何形状,例如圆柱形(杆)、圆盘形、环形、圆环形、螺旋形、椭圆形、三角形、卵形等。例如,在一个实施方式中,药物释放层和/或可植入医疗器件可具有大致圆形的截面形状,使得整体结构为圆柱体(杆)或圆盘形的形式。在这类实施方式中,药物释放层和/或可植入医疗器件通常具有的直径为约0.5毫米至约50毫米,在一些实施方式中为约1毫米至约40毫米,以及在一些实施方式中为约5毫米至约30毫米。药物释放层和/或可植入医疗器件的长度可以变化,但范围通常为约1毫米至约25毫米。例如,圆柱形器件可具有约5毫米至约50毫米的长度,而圆盘形器件可具有约0.5毫米至约5毫米的长度。
药物释放层可通过多种已知的技术来形成,例如通过热熔挤出、注射成型、溶剂浇铸、浸涂、喷涂、微挤出、凝聚等。在一个实施方式中,可采用热熔挤出技术。热熔挤出通常为无溶剂工艺,其中药物释放层的组分(如,乙烯-乙酸乙烯酯共聚物、核酸、任选的赋形剂等)可熔融共混并任选地以连续制造过程成形,以实现高生产率下一致的输出质量。该技术特别适合乙烯-乙酸乙烯酯共聚物,因为它们通常表现出相对较高的长链支化度和宽分子量分布。这些特性组合可导致共聚物在挤出过程中剪切稀释,这有助于促进热熔挤出。此外,极性乙酸乙烯酯共聚用单体单元可通过抑制聚乙烯链段的结晶而充当“内部”增塑剂。这可导致共聚物的熔点降低,从而进一步增强其与核酸一起加工的能力。
在热熔挤出过程中,熔融共混通常在类似或略高于乙烯-乙酸乙烯酯共聚物的熔融温度的温度下发生。例如,熔融共混温度可为约30℃至约100℃,在一些实施方式中为约40℃至约80℃,以及在一些实施方式中为约50℃至约70℃。通常可采用各种熔融共混技术中的任何一种。例如,可将组分单独或组合地供应至挤出机,该挤出机包括至少一个可旋转地安装并容纳在机筒(如,圆柱形机筒)内的螺杆。挤出机可以是单螺杆或双螺杆挤出机。例如,单螺杆挤出机的一个实施方式可包括壳体或机筒和在一端由合适的驱动器(通常包括马达和变速箱)可旋转地驱动的螺杆。如果需要,可采用包括两个单独螺杆的双螺杆挤出机。螺杆的配置并非特别关键,它可包括本领域已知的任何数量和/或取向的螺纹和通道。例如,螺杆通常包括螺纹,该螺纹形成围绕螺杆中心径向延伸的大致螺旋形的通道。可沿螺杆的长度限定进料段和熔融段。进料段是机筒的输入部分,在其中添加乙烯-乙酸乙烯酯共聚物和/或核酸。熔融段是将共聚物从固态变为类液态的相变部分。虽然在制造挤出机时没有对这些段的轮廓进行精确限定,但是可靠地确定进料段和在其中发生从固态到液态相变的熔融段在本领域技术人员的技术范围内。虽然不一定是必需的,但挤出机也可具有混合段,该混合段邻近机筒的输出端且位于熔融段的下游。如果需要,可在挤出机的混合段和/或熔融段内使用一个或多个分配和/或分散混合元件。适用于单螺杆挤出机的分配混合器可包括,例如Saxon、Dulmage、腔穴传递式(Cavity Transfer)混合器等。类似地,合适的分散混合器可包括Blister环、Leroy/Maddock、CRD混合器等。如本领域公知的,可通过在机筒中使用使聚合物熔体折叠和重新取向的销钉来进一步改善混合,例如在布斯混炼(BussKneader)挤出机、腔穴传递式搅拌器和涡旋交错销(Vortex Intermeshing Pin)搅拌器中使用的那些销钉。
如果需要,可选择螺杆的长度(“L”)与直径(“D”)之比,以实现生产量与组分共混之间的最佳平衡。例如,L/D值可为约10至约50,在一些实施方式中为约15至约45,以及在一些实施方式中为约20至约40。例如,螺杆的长度可为约0.1米至约5米,在一些实施方式中为约0.4米至约4米,以及在一些实施方式中为约0.5米至约2米。类似地,螺杆的直径可为约5毫米至约150毫米,在一些实施方式中为约10毫米至约120毫米,以及在一些实施方式中为约20毫米至约80毫米。除了长度和直径之外,还可选择挤出机的其他方面以帮助实现期望的共混程度。例如,可以选择螺杆的速度以实现期望的停留时间、剪切速率、熔融加工温度等。例如,螺杆速度范围可为约10转/分钟至约800转/分钟(“rpm”),在一些实施方式中为约20rpm至约500rpm,以及在一些实施方式中为约30rpm至约400rpm。熔融共混期间的表观剪切速率范围也可为约100秒
一旦熔融共混在一起,所得聚合物组合物可通过孔口(如,模头)挤出并形成粒料、片材、纤维、细丝等,之后可使用各种已知的成形技术使其成形为药物释放层,例如注射成型、压缩成型(如,真空压缩成型)、纳米成型、包覆成型、吹塑成型、三维打印等。例如,注射成型可以两个主要阶段进行,即注射阶段和保持阶段。在注射阶段期间,用熔融聚合物组合物填充模腔。在注射阶段完成后开始保持阶段,其中控制保持压力,以将额外材料装入腔中并补偿冷却期间发生的体积收缩。注射完成后,接着冷却。一旦冷却完成,当模具打开并且部件弹出(如,借助模具内的弹出销)时,完成成型周期。本发明一般可采用任何合适的注射成型设备。在一个实施方式中,可采用包括第一模架和第二模架的注射成型设备,第一模架和第二模架一起限定具有药物释放层形状的模腔。成型设备包括从第一半模的外表面延伸经过浇口至模腔的树脂流道。可使用各种技术将聚合物组合物供应至树脂流道。例如,可将组合物(如,以粒料形式)供应至附接到包含旋转螺杆的挤出机机筒的进料斗(未示出)。随着螺杆旋转,粒料向前移动并经受压力和摩擦,从而产生热量来熔化该粒料。还可提供冷却机构以在模腔内使树脂固化成药物释放层所需的形状(如,圆盘形、杆等)。例如,模架可包括一个或多个冷却管道,冷却介质流过该冷却管道以赋予模架表面所需的模具温度以固化熔融材料。模具温度(如,模具表面的温度)范围可为约50℃至约120℃,在一些实施方式中为约60℃至约110℃,以及在一些实施方式中为约70℃至约90℃。
如上所述,用于形成所需形状和尺寸的药物释放层的另一种合适的技术是三维打印。在此过程中,可将聚合物组合物掺入易于适合与打印机系统一起使用的打印机盒中。例如,打印机盒可包含承载聚合物组合物的卷轴或其他类似装置。例如,当以细丝形式供应时,卷轴可具有缠绕细丝的大致圆柱形边缘。类似地,卷轴可以限定孔或轴,使其在使用过程中易于安装至打印机。本发明中可采用各种三维打印机系统中的任何一种。特别适合的打印机系统是基于挤出的系统,通常被称为“熔融沉积建模”系统。例如,可将聚合物组合物供应至包含辊筒和台架的打印头的构建室。辊筒可基于计算机操作的控制器提供的信号沿竖直z轴移动。台架是一个导轨系统,其可被配置为基于控制器提供的信号在构建室内在水平x-y平面上移动打印头。打印头由台架支撑,并且被配置为基于控制器提供的信号在辊筒上以逐层的方式打印构建结构。例如,打印头可以是双头挤出头。
还可采用压缩成型(如,真空压缩成型)。在这种方法中,可通过在真空下加热并压缩聚合物压缩物成所需形状来形成器件的层。更具体地,该方法可包括将聚合物组合物形成装在压缩模具腔的前体,加热该前体,以及在加热该前体的同时将该前体压缩成型成所需的层。聚合物组合物可通过各种技术形成前体,例如通过干粉混合、挤出等。压缩期间的温度范围可为约50℃至约120℃,在一些实施方式中为约60℃至约110℃,以及在一些实施方式中为约70℃至约90℃。真空源还可在成型期间向前体施加负压,以帮助确保其保持精确的形状。这种压缩成型技术的实例描述于例如Treffer等的美国专利号10,625,444,其通过引用以其整体并入本文。
B.
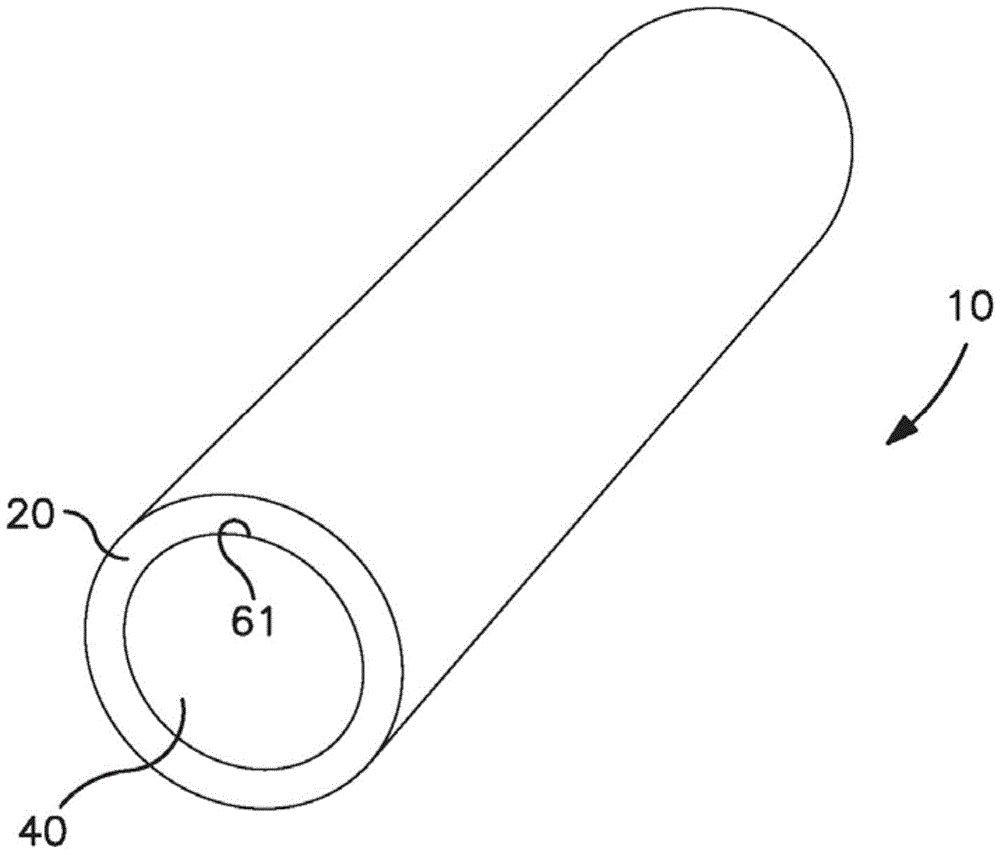
在一些情况下,可植入医疗器件可以是多层的,因为其包含紧邻药物释放层(即,“芯体”)的外表面设置的至少一个膜层。膜层的数量可根据器件的具体配置、核酸的性质和期望的释放曲线而变化。例如,器件可能仅包含一个膜层。例如,参考图1至图2,示出了可植入医疗器件10的一个实施方式,其包含具有大致圆形截面形状的芯体40,并且该芯体40被拉伸,以使得所得器件实际上大致为圆柱形。芯体40限定外周表面61,膜层20围绕外周表面61周向设置。与芯体40类似,膜层20也具有大致圆形的截面形状,并且膜层20被拉伸以覆盖芯体40的整个长度。在使用器件10期间,核酸能够从芯体40释放并穿过膜层20,使得核酸从器件的外表面21出来。
当然,在其他实施方式中,器件可包含多个膜层。例如,在图1至图2的器件中,可在膜层20上设置一个或多个额外的膜层(未示出)以帮助进一步控制核酸的释放。在其他实施方式中,器件可被配置成使得芯体位于或夹在不同的膜层之间。例如,参见图3和图4,示出了可植入医疗器件100的一个实施方式,其包含芯体140,该芯体具有大致圆形截面形状并且并被拉伸,以使得所得器件实际上大致为圆盘形。芯体140限定上外表面161和下外表面163,上外表面161上设置有第一膜层120,下外表面163上设置有第二膜层122。与芯体140类似,第一膜层120和第二膜层122也具有大体上覆盖芯体140的大致圆形的截面形状。如果需要,膜层120和122的边缘也可延伸超过芯体140的外周,使得膜层可密封在一起以覆盖芯体140的外圆周表面170的任何暴露区域。在器件100使用期间,核酸能够从芯体140释放并穿过第一膜层120和第二膜层122,使得核酸从器件的外表面121和123出来。当然,如果需要,还可在第一膜层120和/或第二膜层122上设置一个或多个额外的膜层(未示出),以帮助进一步控制核酸的释放。
无论所采用的具体配置如何,膜层通常包含含有疏水性聚合物的膜聚合物基质。膜聚合物基质通常占膜层的约30wt.%至100wt.%,在一些实施方式中约40wt.%至约99wt.%,以及在一些实施方式中约50wt.%至约90wt.%。当采用多个膜层时,通常期望每个膜层包含含有这种疏水性聚合物的膜聚合物基质。例如,第一膜层可包含第一膜聚合物基质,而第二膜层可包含第二膜聚合物基质。在这些实施方式中,第一膜聚合物基质和第二膜聚合物基质各自包含可相同或不同的疏水性聚合物。
膜聚合物基质中使用的聚合物本质上通常是疏水的,因此将其置于水性环境(如,哺乳动物身体)时,它们可在一定时间内保持其结构完整性,并且足够稳定以在使用前储存较长时间。用于此目的的合适的疏水性聚合物的实例可包括,例如硅酮聚合物、聚烯烃、聚氯乙烯、聚碳酸酯、聚砜、苯乙烯-丙烯腈共聚物、聚氨酯、硅酮-聚醚-聚氨酯、聚碳酸酯-聚氨酯、硅酮聚碳酸酯-聚氨酯等,及其组合。当然,用疏水性聚合物涂覆或以其它方式包封的亲水性聚合物也适合用于膜聚合物基质中。在某些实施方式中,膜聚合物基质可包含半结晶烯烃共聚物。例如,如根据ASTM D3418-15所测定的,这样的烯烃共聚物的熔融温度范围可为约20℃至约100℃,在一些实施方式中为约25℃至约80℃,在一些实施方式中为约30℃至约70℃,在一些实施方式中为约35℃至约65℃,以及在一些实施方式中为约40℃至约60℃。这类共聚物通常衍生自接枝到聚合物骨架上和/或作为聚合物(如,嵌段或无规共聚物)成分掺入的至少一种烯烃单体(如,乙烯、丙烯等)和至少一种极性单体。合适的极性单体包括,例如乙酸乙烯酯、乙烯醇、马来酸酐、马来酸、(甲基)丙烯酸(如,丙烯酸、甲基丙烯酸等)、(甲基)丙烯酸酯(如,丙烯酸酯、甲基丙烯酸酯、丙烯酸乙酯、甲基丙烯酸甲酯、甲基丙烯酸乙酯等)等。通常可将多种这类共聚物用于聚合物组合物中,如乙烯-乙酸乙烯酯共聚物、乙烯(甲基)丙烯酸聚合物(如,乙烯-丙烯酸共聚物和这些共聚物的部分中和离聚物、乙烯-甲基丙烯酸共聚物和这些共聚物的部分中和离聚物等)、乙烯(甲基)丙烯酸酯聚合物(如,乙烯-甲基丙烯酸酯共聚物、乙烯-丙烯酸乙酯共聚物、乙烯-丙烯酸丁酯共聚物等)等。无论选择何种特定单体,本发明人已发现,可选择性地控制共聚物的某些方面以帮助实现所需的释放特性。例如,可选择性地将共聚物的极性单体含量范围控制为共聚物的约20wt.%至约60wt.%,在一些实施方式中为约25wt.%至约55wt.%,在一些实施方式中为约30wt.%至约50wt.%,在一些实施方式中为约35wt.%至约48wt.%,以及在一些实施方式中为约38wt.%至约45wt.%。反过来说,类似地,共聚物的烯烃单体含量范围可为约40wt.%至约80wt.%,在一些实施方式中为45wt.%至约75wt.%,在一些实施方式中为约50wt.%至约80wt.%,在一些实施方式中为约52wt.%至约65wt.%,以及在一些实施方式中为约55wt.%至约62wt.%。
膜聚合物基质中使用的疏水性聚合物也可与药物释放层中使用的乙烯-乙酸乙烯酯共聚物相同或不同。例如,在一个实施方式中,药物释放层(芯体)和膜层均采用相同的聚合物(如,乙烯-乙酸乙烯酯共聚物)。在另一些实施方式中,膜层可采用疏水性聚合物(如,α-烯烃共聚物),其具有比药物释放层中所用的乙烯-乙酸乙烯酯共聚物更低的熔体流动指数。此外,这可进一步有助于控制核酸从器件的释放。例如,药物释放层中采用的乙烯-乙酸乙烯酯共聚物的熔体流动指数与膜层中使用的疏水性聚合物的熔体流动指数之比可为约1至约20,在一些实施方式中为约2至约15,以及在一些实施方式中为约4至约12。例如,如根据ASTM D1238-13在190℃的温度和2.16kg的载荷下所测定的,膜层中的疏水性聚合物的熔体流动指数可为约1g/10min至约80g/10min,在一些实施方式中为约2g/10min至约70g/10min,以及在一些实施方式中为约5g/10min至约60g/10min。可采用的合适的乙烯-乙酸乙烯酯共聚物的实例包括可获自Celanese的商品名为
器件中使用的膜层可任选包含核酸,例如如以上所述的核酸,其分散在膜聚合物基质中。膜层中的核酸可与芯体中使用的核酸相同或不同。无论如何,在膜层中使用核酸时,通常期望膜层通常包含的核酸量使得芯体中核酸浓度(wt.%)与膜层中核酸浓度(wt.%)之比大于1,在一些实施方式中为约1.5或更大,以及在一些实施方式中为约1.8至约4。使用时,核酸通常仅占膜层的约1wt.%至约40wt.%,在一些实施方式中约5wt.%至约35wt.%,以及在一些实施方式中为约10wt.%至约30wt.%。当然,在其他实施方式中,在核酸从药物释放层释放之前膜层通常不含核酸。采用多个膜层时,每个膜层通常可包含的核酸量使得药物释放层中的核酸重量百分比与该膜层中的核酸重量百分比之比大于1,在一些实施方式中为约1.5或更大,以及在一些实施方式中为约1.8至约4。
任选地,膜层还可包含如上所述的一种或多种赋形剂,例如放射性造影剂、亲水性化合物、增体剂、增塑剂、表面活性剂、交联剂、助流剂、着色剂(如,叶绿素、亚甲基蓝等)、抗氧化剂、稳定剂、润滑剂、其他类型的抗微生物剂、防腐剂等,以提高性能和加工性。使用时,任选的赋形剂通常占膜层的约0.01wt.%至约60wt.%,在一些实施方式中约0.05wt.%至约50wt.%,以及在一些实施方式中约0.1wt.%至约40wt.%。
例如,为了帮助进一步控制从植入式医疗器件的释放速率,例如如上所述的亲水性化合物也可掺入膜层中。使用时,膜层内疏水性聚合物与亲水性化合物的重量比范围为约0.25至约200,在一些实施方式中为约0.4至约80,在一些实施方式中为约0.8至约20,在一些实施方式中为约1至约16,以及在一些实施方式中为约1.2至约10。例如,这类亲水性化合物可占膜层的约1wt.%至约50wt.%,在一些实施方式中约2wt.%至约40wt.%,以及在一些实施方式中约5wt.%至约30wt.%,而疏水性聚合物通常占膜层的约50wt.%至约99wt.%,在一些实施方式中约60wt.%至约98wt.%,以及在一些实施方式中约70wt.%至约95wt.%。
在一个特定实施方式中,膜层可包含分布在膜聚合物基质内的多个水溶性颗粒形式的亲水性化合物。在这类实施方式中,可控制水溶性颗粒的颗粒尺寸以帮助实现所需递送速率。更具体地,例如使用激光散射粒度分布分析仪(如,来自Horiba的LA-40)所测定的,颗粒的中值直径(D50)可为约100微米或更小,在一些实施方式中为约80微米或更小,在一些实施方式中为约60微米或更小,以及在一些实施方式中为约1微米至40微米。颗粒也可具有窄的尺寸分布,使得90%或更多的颗粒按体积计(D90)具有在上述范围内的直径。可采用各种不同材料来形成这类颗粒,例如脂肪酸或其盐(如,硬脂酸、柠檬酸、肉豆蔻酸、棕榈酸、亚油酸等,以及其盐)、纤维素化合物(如,羟甲基纤维素、羧甲基纤维素、乙基纤维素、甲基纤维素等),生物相容性盐(如,氯化钠、氯化钙、磷酸钠等),羟基官能化的化合物等。在特别合适的实施方式中,水溶性颗粒通常包含非聚合的羟基官能化的化合物。术语“羟基官能化的”通常意指该化合物包含至少一个羟基,且在某些情况下包含多个羟基,例如2个或更多个,在一些实施方式中为3个或更多个,在一些实施方式中为4至20个,以及在一些实施方式中为5至16个羟基。术语“非聚合的”同样通常意指化合物不包含大量重复单元,例如不多于10个重复单元,在一些实施方式中不多于5个重复单元,在一些实施方式中不多于3个重复单元,以及在一些实施方式中不多于2个重复单元。在某些情况下,这类化合物没有任何重复单元。因而,这类非聚合化合物具有相对较低的分子量,例如约1克/摩尔至约650克/摩尔,在一些实施方式中约5克/摩尔至约600克/摩尔,在一些实施方式中约10克/摩尔至约550克/摩尔,在一些实施方式中约50克/摩尔至约500克/摩尔,在一些实施方式中约80克/摩尔至约450克/摩尔,以及在一些实施方式中约100克/摩尔至约400克/摩尔。可用于本发明的特别合适的非聚合的羟基官能化的化合物包括,例如糖类及其衍生物,如单糖(如,右旋糖、果糖、半乳糖、核糖、脱氧核糖等);二糖(如,蔗糖、乳糖、麦芽糖等);糖醇(如,木糖醇、山梨糖醇、甘露糖醇、麦芽糖醇、赤藓糖醇、半乳糖醇、异麦芽糖醇、肌醇、乳糖醇等)等,以及它们的组合。
还可以采用一种或多种例如如上文所述的非离子、阴离子和/或两性表面活性剂,以帮助形成均匀的分散。使用时,这类表面活性剂通常占膜层的约0.05wt.%至约8wt.%,在一些实施方式中约0.1wt.%至约6wt.%,以及在一些实施方式中约0.5wt.%至约3wt.%。
可使用与形成芯体相同或不同的技术形成膜层,例如通过热熔挤出、注射成型、溶剂浇铸、浸涂、喷涂、微挤出、凝聚等。在一个实施方式中,可采用热熔挤出技术。芯体和膜层也可单独形成或同时形成。例如,在一个实施方式中,分别形成芯体和膜层,然后使用已知的粘合技术组合在一起,例如通过冲压、热密封、粘合剂粘合等。也可采用压缩成型(如,真空压缩成型)来形成植入式器件。如上所述,可通过在真空下加热并压缩相应聚合物,压缩成所需形状,来各自分别形成药物释放层和膜层。一旦形成,药物释放层和膜层可层叠在一起以形成多层前体,并随后以上述方式压缩成型形成最终的植入式器件。
IV.
通过对器具的特定性质和形成方式进行选择性控制,所得器件可在延长的时间段内有效地持续释放核酸。例如,植入式医疗器件可在约5天或更长的时间段内释放核酸,在一些实施方式中约10天或更长,在一些实施方式中约20天至约60天,以及在一些实施方式中约25天至约50天(如,约30天)。此外,可在释放时间段期间以受控方式(如,零级或接近零级)释放核酸。例如,在15天的时间段之后,植入式医疗器件的累积释放率可为约20%至约70%,在一些实施方式中为约30%至约65%,且在一些实施方式中为约40%至约60%。类似地,在30天的时间段之后,植入式医疗器件的累积释放率仍可为约40%至约85%,在一些实施方式中为约50%至约80%,以及在一些实施方式中为约60%至约80%。“累积释放率”可通过将在特定时间间隔释放的核酸量除以最初存在的核酸总量,然后将该数值乘以100来确定。
当然,递送的核酸的实际剂量水平将根据所采用的特定核酸及其预期释放的时间段而变化。剂量水平通常足够高以提供治疗有效量的核酸来产生期望的治疗结果,即有效减少或减轻为此施用该核酸的病症的症状的水平或量。所需的确切量将根据以下因素而变化:接受治疗的受试者、待递送核酸至其的受试者的年龄和一般状况、受试者的免疫系统能力、期望的效果程度、所治疗病症的严重程度、所选的特定核酸以及组合物的施用方式等。本领域技术人员可以容易地确定适当的有效量。例如,有效量通常为每天约5μg至约200mg,在一些实施方式中为每天约5μg至约100mg,在一些实施方式中为每天约10μg至约1mg递送的核酸。
可使用标准技术经皮下、经口、经粘膜等植入器件。递送途径可以是经肺内、胃肠内、皮下、肌内、进入中枢神经系统(如,鞘内)、腹膜内、器官内等。在一个实施方式中,植入式器件可特别适合于递送用于癌症治疗的核酸。在这类实施方式中,可将器件放置于患者的肿瘤内、肿瘤上、邻近肿瘤或接近肿瘤的组织部位中,例如胰腺、胆道系统、胆囊、肝脏、小肠、结肠、脑、肺、眼等的肿瘤。器件也可与当前的全身化疗、外部放疗和/或手术一起使用。器件还可经鞘内递送以治疗和/或预防多种不同病症,例如癌症、神经疾病(如,神经退行性疾病,如脊髓性肌萎缩症或肌萎缩侧索硬化症)等,和/或用于疼痛管理。在这类实施方式中,可将器件植入椎管中或直接植入容纳脑脊液的鞘内间隙(蛛网膜下隙)。例如,鞘内施用可通过将器件植入Ommaya储液囊(在手术期间放置在头皮下的圆顶形容器;当药物通过小管流入脑部时该容器容纳药物)或直接植入脊柱下部的脑脊液来完成。
如果需要,可在使用前将器件密封在包装(如,无菌吸塑包装)内。密封包装的材料和方式可如本领域已知的变化。例如,在一个实施方式中,该包装可包括基材,该基材包含实现期望保护性能水平所需的任何数量的层,例如1层或更多层,在一些实施方式中为1层至4层,以及在一些实施方式中为1层至3层。一般地,基材包含聚合物膜,例如由聚烯烃(如,乙烯共聚物、丙烯共聚物、丙烯均聚物等)、聚酯(如,聚对苯二甲酸乙二醇酯、聚萘二甲酸乙二醇酯、聚对苯二甲酸丁二酯等)、氯乙烯聚合物、乙烯基乙胺嘧啶聚合物、离聚物等,以及其组合。可将膜的一个或多个面密封在一起(如,热密封),例如在外围边缘处密封,以形成可存储器件的腔体。例如,单个膜可在一个或多个点处折叠并沿其周边密封来限定放置器件的腔体。为了使用器件,可以打开包装,例如通过破坏密封,然后可取出器件并将其植入患者体内。
测试方法
可使用体外方法测定核酸(如,mRNA)的释放。更具体地,植入式器件样品可置于150毫升叠氮化钠水溶液中。溶液可封闭于防紫外线的250ml
本领域普通技术人员可在不脱离本发明的精神和范围的情况下实践本发明的这些和其他修改和变化。此外,应理解,不同实施方式的各方面可全部或部分互换。此外,本领域普通技术人员将理解,上述描述仅作为示例,而不打算限制所附权利要求中进一步描述的本发明。
- 用于递送植入式或插入式医疗设备的递送设备
- 用于将医疗电引线递送到心外膜植入位置的介入式医疗系统及方法
