一种全能核酸酶稳定性保护剂、液体酶制剂及其制备方法
文献发布时间:2024-04-18 19:58:30
技术领域
本发明涉及生物技术领域,尤其涉及一种全能核酸酶稳定性保护剂、液体酶制剂及其制备方法。
背景技术
生物制品领域迎来空前的发展机遇,越来越多的生物制品进入治疗领域,质量控制日趋严格,由于重组蛋白疫苗、Vero细胞疫苗、细胞治疗/基因治疗药物等生物制品大多来自连续传代的菌株或细胞株,如细菌、酵母、动物细胞或人源细胞。这些复杂的表达或生产系统虽然经过严格的纯化工艺,但产品中还有可能残留宿主细胞的核酸片段,而这些生物制品应用到人类疾病预防和治疗时,会带来不可控的危险因素。因此从生物制品安全角度和有效性需求考虑,核酸残留一项是各类质控标准的重中之重。
全能核酸酶,是一种来自于粘质沙雷氏菌(Serratia marcescens)并经基因工程改造的核酸内切酶,可将核酸降解成3~5个碱基的5’单磷酸寡核苷酸,能高效降解任何形式(双链,单链,线状,环状、超螺旋)的DNA和RNA而没有蛋白裂解活性。全能核酸酶迅速水解核酸的能力,因此广泛应用于去除疫苗类产品外源性核酸,降低核酸残留毒性风险,同时降低细胞/细菌裂解时核酸释放产生的黏度,缩短处理时间,提高病毒/蛋白产量。
全能核酸酶作为一种非特异性的广谱核酸酶,可用于各类需要去除核酸的场景,考虑不同的应用场景中溶液温度、极端pH值的复杂情况,因此对全能核酸酶的稳定性提出挑战。
现有技术公开了一种全能核酸内切酶的表达纯化方法,通过大肠杆菌原核表达包涵体、变复性及纯化等步骤获得高纯度的全能核酸酶,可以有效降低全能核酸内切酶的生产成本,缩短纯化时间,有利于该全能核酸内切酶在科研和工业领域的应用。现有技术公开了一种全能核酸酶的蛋白制备方法,主要解决了现有全能核酸酶制备过程中工艺复杂且复性过程不易控制的问题,其提供了一种新的制备方法,具有纯化工艺简单、无需变性复性过程、蛋白产品活性高的优点。现有技术公开了一种全能核酸酶的高密度发酵表达及分离纯化的方法,主要解决了如何提高全能核酸酶的分泌表达及高纯度分离的问题,提供的制备方法具备可以显著提高全能核酸酶的生产效率与蛋白纯度,缩短生产时间,降低成本,有利于全能核酸酶的工业化生产及应用的优点。然而上述现有技术开的多是关于全能核酸酶的表达纯化方法。
关于全能核酸酶制剂相关技术信息,如现有技术公开了一种核酸污染清除液,其配方包括全能核酸酶、缓冲盐、镁离子,还含有Tween-80、氯化钠、维生素C、防腐剂、甘油,其提供的核酸污染清除液,可用于分子生物学实验室、PCR检测室核酸污染的去除,但其提供的配方仅能保证全能核酸酶在pH 8.0左右保持活性稳定,偏离pH 8.0后酶活性逐渐降低,时间越长酶活性下降越明显。现有技术还公开了一种消除性能好、无强氧化性和腐蚀性、安全无毒消除核酸污染的生物酶清除剂及其制备方法。其生物酶清除剂组分包括全能核酸酶、缓冲液、辅助因子和稳定剂,可以在常温下高效发挥作用,还可以应用在低温环境,能够快速清除物体表面的核酸及气溶胶污染,但其在高温如50℃状态下的应用效果未知。
如前所述,全能核酸酶多应用于生物制品包括疫苗、蛋白类药物生产的前处理过程中,不可避免的遭受极端pH、温度的影响,因此急需寻找一种新的全能核酸酶的保护剂来提升其稳定性。
发明内容
有鉴于此,本发明提出了一种全能核酸酶稳定性保护剂、液体酶制剂及其制备方法,以解决现有技术中存在的技术问题。
第一方面,本发明提供了一种全能核酸酶稳定性保护剂,包括糖类物质、糖醇、氨基酸中的至少一种。
优选的是,所述的全能核酸酶稳定性保护剂,所述糖类物质包括二糖类物质和/或多糖类物质,所述氨基酸为碱性氨基酸。
优选的是,所述的全能核酸酶稳定性保护剂,所述二糖类物质包括海藻糖、蔗糖中的至少一种;
所述多糖类物质包括葡聚糖;
所述碱性氨基酸包括包括赖氨酸、精氨酸中的至少一种。
优选的是,所述的全能核酸酶稳定性保护剂,所述糖醇包括甘露醇、山梨醇、木糖醇中的至少一种。
优选的是,所述的全能核酸酶稳定性保护剂,还包括缓冲液、盐类物质、Mg
优选的是,所述的全能核酸酶稳定性保护剂,所述缓冲液为缓冲能力在pH为4.0~10.0的缓冲液;
和/或,所述盐类物质包括NaCl、KCl中的至少一种;
和/或,所述Mg
和/或,所述表面活性剂为非离子表面活性剂。
优选的是,所述的全能核酸酶稳定性保护剂,所述缓冲液包括乙酸-乙酸钠缓冲液、柠檬酸-柠檬酸钠缓冲液、柠檬酸-氢氧化钠-盐酸缓冲液、磷酸氢二钠-柠檬酸缓冲液、磷酸氢二钠-磷酸二氢钠缓冲液、甘氨酸-氢氧化钠缓冲液、Tris-盐酸缓冲液、HEPES缓冲液中的至少一种;
和/或,所述Mg盐包括氯化镁、醋酸镁、硫酸镁、柠檬酸镁、甘氨酸镁中至少的一种;
和/或,所述非离子表面活性剂包括吐温20、吐温80、曲拉通X-100、辛基苯氧基聚乙醇中的至少一种;
和/或,所述全能核酸酶稳定性保护剂中缓冲液的浓度为20~100mM,盐类物质的浓度为40~200mM,Mg
第二方面,本发明还提供了一种全能核酸酶液体酶制剂,包括:全能核酸酶和所述的全能核酸酶稳定性保护剂。
优选的是,所述的全能核酸酶液体酶制剂,包括糖类物质、糖醇、氨基酸中的至少一种,全能核酸酶,缓冲液,盐类物质,Mg
其中,所述缓冲液的浓度为20~50mM,所述盐类物质的浓度为20~100mM,所述Mg
第三方面,本发明还提供了一种所述的全能核酸酶液体酶制剂的制备方法,包括以下步骤:
将盐类物质,Mg
将全能核酸酶加入至保护剂混合液,得到全能核酸酶液体酶制剂。
本发明的一种全能核酸酶稳定性保护剂现有技术具有以下有益效果:
1、本发明的全能核酸酶稳定性保护剂,包括糖类物质、糖醇、氨基酸中的至少一种,本发明的全能核酸酶稳定性保护剂能使全能核酸酶在高温(50~80℃)或极端pH(pH为4.0~10.0)下稳定,保持良好的生物活性;
2、本发明的全能核酸酶液体酶制剂,包括:全能核酸酶和全能核酸酶稳定性保护剂,全能核酸酶稳定性保护剂能够使全能核酸酶在50-80℃和pH 4.0~10.0下的稳定,能够在60~80℃下处理1h保持较好的活性稳定,在50℃处理下12h保持较好的活性稳定,在pH4.0或10.0条件下处理12h保持较好活性稳定,同时能够提升酶的储存稳定性,在常温储存30天保持较好的活性稳定,4℃储存1年保持较好的活性稳定。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单的介绍。显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
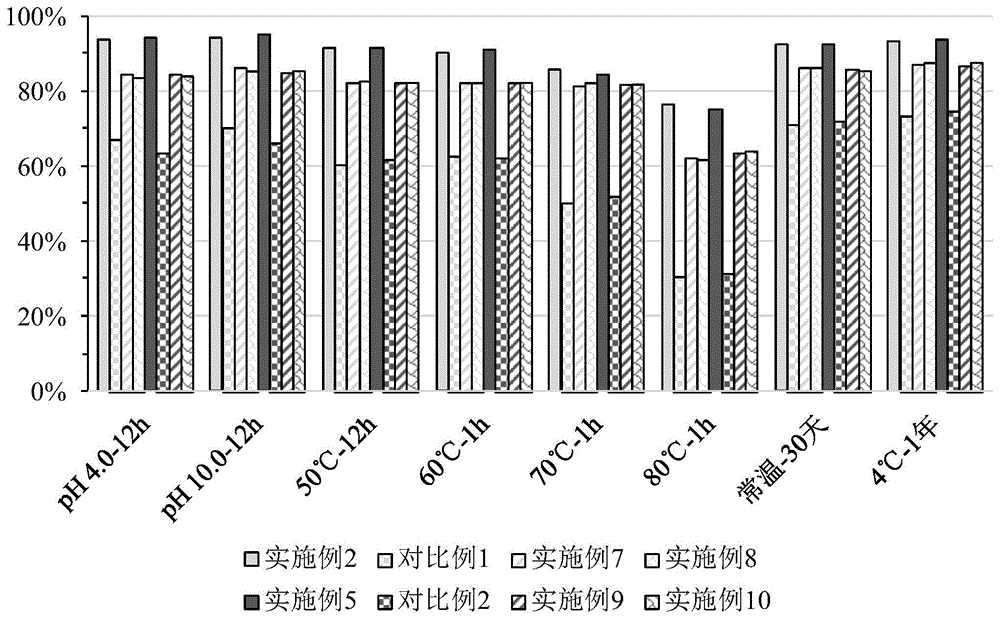
图1为实施例2、5、7~10以及对比例1~2中全能核酸酶液体酶制剂在不同处理条件下的酶活保存率。
具体实施方式
下面将结合本发明实施方式,对本发明实施方式中的技术方案进行清楚、完整的描述,显然,所描述的实施方式仅仅是本发明一部分实施方式,而不是全部的实施方式。基于本发明中的实施方式,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施方式,都属于本发明保护的范围。
为了更好地理解本发明而不是限制本发明的范围,在本申请中所用的表示用量、百分比的所有数字、以及其他数值,在所有情况下都应理解为以词语“大约”所修饰。因此,除非特别说明,否则在说明书和所附权利要求书中所列出的数字参数都是近似值,其可能会根据试图获得的理想性质的不同而加以改变。各个数字参数至少应被看作是根据所报告的有效数字和通过常规的四舍五入方法而获得的。
需说明的是,以下实施例的描述顺序不作为对实施例优选顺序的限定。另外,在本申请的描述中,术语“包括”是指“包括但不限于”。本发明的各种实施例可以以一个范围的型式存在;应当理解,以一范围型式的描述仅仅是因为方便及简洁,不应理解为对本发明范围的硬性限制;因此,应当认为所述的范围描述已经具体公开所有可能的子范围以及该范围内的单一数值。例如,应当认为从1到6的范围描述已经具体公开子范围,例如从1到3,从1到4,从1到5,从2到4,从2到6,从3到6等,以及所数范围内的单一数字,例如1、2、3、4、5及6,此不管范围为何皆适用。另外,每当在本文中指出数值范围,是指包括所指范围内的任何引用的数字(分数或整数)。
本申请实施例提供了一种全能核酸酶稳定性保护剂,包括糖类物质、糖醇、氨基酸中的至少一种。
需要说明的是,本发明的全能核酸酶稳定性保护剂,包括糖类物质、糖醇、氨基酸中的至少一种,申请人发现糖类物质、糖醇或氨基酸中的一种或几种物质,可以使全能核酸酶在高温或极端pH下稳定,保持良好的生物活性。
具体的,糖类物质包括二糖类物质和/或多糖类物质,氨基酸为碱性氨基酸。
其中,二糖类物质是指在被酸或酶水解后产生两个可以相同或不同的单糖分子的碳水化合物;多糖类物质一般由8到10个以上的单糖组成的复合物。
碱性氨基酸指具有两个氨基和一个羧基的氨基酸,在中性pH时具有净正电荷,如赖氨酸、精氨酸、组氨酸等。
在一些实施例中,二糖类物质包括海藻糖、蔗糖中的至少一种。
在一些实施例中,多糖类物质包括葡聚糖;葡聚糖是由数个葡萄糖分子聚合而成的多糖。
在一些实施例中,碱性氨基酸包括包括赖氨酸、精氨酸中的至少一种。
在一些实施例中,糖醇包括甘露醇、山梨醇、木糖醇中的至少一种。
进一步的,为了使得全能核酸酶更加稳定,本发明的全能核酸酶稳定性保护剂还包括缓冲液、盐类物质、Mg
具体的,本发明所述的全能核酸酶(Benzonase)是来自粘质沙雷氏菌(Serratiamarcescens),经基因工程改造的核酸内切酶,能降解所有的DNA(包括单链,双链,线性和环状)和RNA而不会使蛋白降解,具有很高的特异性。
优选的,本发明的全能核酸酶来源于粘质沙雷氏菌(Serratia marcescens)经基因工程改造在Escherichia coli(E.coli)中发酵表达纯化并制备。
具体的,上述的高温是指50-80℃环境,在一些实施例中,高温实验由水浴处理实现。
具体的,上述的极端pH是指pH为4.0~10.0。出于本发明的目的,pH稳定性实验使用缓冲能力在pH为4.0~10.0的缓冲体系,包括但不限于乙酸-乙酸钠缓冲液、柠檬酸-柠檬酸钠缓冲液、柠檬酸-氢氧化钠-盐酸缓冲液、磷酸氢二钠-柠檬酸缓冲液、磷酸氢二钠-磷酸二氢钠缓冲液、甘氨酸-氢氧化钠缓冲液、Tris-盐酸缓冲液、HEPES缓冲液。
在一些实施例中,缓冲液为缓冲能力在pH为4.0~10.0的缓冲液。
在一些实施例中,盐类物质包括NaCl、KCl中的至少一种。
在一些实施例中,Mg
在一些实施例中,表面活性剂为非离子表面活性剂。
在一些实施例中,全能核酸酶稳定性保护剂也可选用上述缓冲体系,用以维持全能核酸酶在相对稳定的pH中储存,但并不影响其在各pH条件下的应用。即全能核酸酶稳定性保护剂中缓冲液包括乙酸-乙酸钠缓冲液、柠檬酸-柠檬酸钠缓冲液、柠檬酸-氢氧化钠-盐酸缓冲液、磷酸氢二钠-柠檬酸缓冲液、磷酸氢二钠-磷酸二氢钠缓冲液、甘氨酸-氢氧化钠缓冲液、Tris-盐酸缓冲液、HEPES缓冲液中的至少一种。
在一些实施例中,Mg盐包括氯化镁、醋酸镁、硫酸镁、柠檬酸镁、甘氨酸镁中至少的一种。
在一些实施例中,非离子表面活性剂包括吐温20、吐温80、曲拉通X-100(TritonX-100)、辛基苯氧基聚乙醇(即辛基苯基-聚乙烯二醇、4-壬基苯基-聚乙二醇,
基于同一发明构思,本发明还提供了一种全能核酸酶液体酶制剂,包括:全能核酸酶和上述的全能核酸酶稳定性保护剂。
在一些实施例中,全能核酸酶液体酶制剂,包括糖类物质、糖醇、氨基酸中的至少一种,全能核酸酶,缓冲液,盐类物质,Mg
其中,缓冲液的浓度为20~50mM,盐类物质的浓度为20~100mM,Mg
优选的,缓冲液的浓度为30~50mM,盐类物质的浓度为20~60mM,Mg
具体的,缓冲液的浓度可以为20mM、30mM、40mM、50mM,盐类物质的浓度可以为20mM、30mM、40mM、50mM、60mM、70mM、80mM、90mM、100mM,Mg
需要说明的是,本发明的全能核酸酶液体酶制剂,对于全能核酸酶的浓度并无限定,可以是任意浓度,例如全能核酸酶的浓度可为100~1000U/μL,具体可以为100U/μL、200U/μL、300U/μL、400U/μL、500U/μL、600U/μL、700U/μL、800U/μL、900U/μL、1000U/μL。
本发明提供的全能核酸酶液体酶制剂,包括:全能核酸酶和上述的全能核酸酶稳定性保护剂,全能核酸酶稳定性保护剂能够使全能核酸酶具有在50-80℃和pH 4.0~10.0下的稳定性,能够在60~80℃下处理1h保持较好的活性稳定,在50℃处理下12h保持较好的活性稳定,在pH 4.0或10.0条件下处理12h保持较好活性稳定,同时能够提升酶的储存稳定性,在常温储存30天保持较好的活性稳定,4℃储存1年保持较好的活性稳定。
基于同一发明构思,本发明还提供了一种上述的全能核酸酶液体酶制剂的制备方法,包括以下步骤:
将盐类物质,Mg
将全能核酸酶加入至保护剂混合液,得到全能核酸酶液体酶制剂。
具体的,将全能核酸酶加入至保护剂混合液之前,还包括:将全能核酸酶经缓冲液进行超滤置换(即将全能核酸酶置换于缓冲液中),得到全能核酸酶酶液;再将全能核酸酶酶液,加入至保护剂混合液,得到全能核酸酶液体酶制剂。
在一些实施例中,将盐类物质,Mg
在一些实施例中,盐类物质,Mg
需要说明的是,本发明中全能核酸酶稳定性保护剂中各组分的浓度可以理解为初始浓度,而全能核酸酶液体酶制剂中各组分的浓度可以理解为终浓度,全能核酸酶稳定性保护剂中各组分初始浓度的设定是为了更方便的配制出目标终浓度的全能核酸酶液体酶制剂;本发明对全能核酸酶稳定性保护剂各组分的初始浓度并无要求,只要全能核酸酶稳定性保护剂各组分的初始浓度大于全能核酸酶液体酶制剂中各组分的终浓度即可。
以下进一步以具体实施例说明本申请的全能核酸酶稳定性保护剂、液体酶制剂及其制备方法。本部分结合具体实施例进一步说明本发明内容,但不应理解为对本发明的限制。如未特别说明,实施例中所采用的技术手段为本领域技术人员所熟知的常规手段。除非特别说明,本发明采用的试剂、方法和设备为本领域常规试剂、方法和设备。
技术术语:
纯化:本发明所提及的纯化是指从含目标组分的样品中去除杂质或污染物,以获得具有更高的绝对或相对浓度的目标组分。
保护剂:是指生物制品保存过程中,未防止活性组分变性,添加的保持生物活性的辅料。酶稳定性是指酶保持活性的能力,通过测定处理前后的酶活性来计算酶在处理过程中损失的活性来确定。
酶活保存率(%):指酶在处理过程中残余酶活性的百分比。即酶经处理后,测得处理后的酶活力与处理前的酶活力的比值。
实施例1
全能核酸酶活力检测方法
酶活定义:37℃,pH 8.0反应条件下,在30分钟内使△A260值降低1.0(相当于完全消化37μg鲑鱼精DNA成为寡核苷酸)所用的酶量定义为一个活性单位(U)。
操作步骤:配制1mM MgCl
实施例2
本申请实施例提供了一种全能核酸酶稳定性保护剂,包括pH为8.0的Tris-HCl缓冲液、NaCl、Mg
本申请实施例还提供了一种全能核酸酶液体酶制剂,包括:全能核酸酶、pH为8.0的Tris-HCl缓冲液、NaCl、Mg
其中,全能核酸酶的活力浓度为400U/μL,Tris-HCl缓冲液的浓度为20mM、pH为8.0,NaCl的浓度为100mM、Mg
本申请实施例还提供了一种上述的全能核酸酶液体酶制剂的制备方法,包括以下步骤:
S1、将全能核酸酶以800U/μL的活力浓度超滤置换于20mM pH为8.0Tris-HCl缓冲液中,得到全能核酸酶酶液;
S2、将NaCl、氯化镁、吐温20、海藻糖、精氨酸加入至20mM pH为8.0Tris-HCl缓冲液中,充分溶解,使用0.22μm滤膜过滤后得到保护剂混合液;
S3、将S1中全能核酸酶酶液与S2中保护剂混合液混合,使得最终各物料浓度与上述配方一致,得到全能核酸酶液体酶制剂。
实施例3
本申请实施例提供了一种全能核酸酶稳定性保护剂,包括pH为8.0的HEPES缓冲液、NaCl、KCl、Mg
本申请实施例还提供了一种全能核酸酶液体酶制剂,包括:全能核酸酶、pH为8.0的HEPES缓冲液、NaCl、KCl、Mg
其中,全能核酸酶的活力浓度为400U/μL,HEPES缓冲液的浓度为50mM、pH为8.0,NaCl的浓度为20mM、KCl的浓度为50mM、Mg
本申请实施例还提供了一种上述的全能核酸酶液体酶制剂的制备方法,包括以下步骤:
S1、将全能核酸酶以800U/μL的活力浓度超滤置换于50mM pH 8.0HEPES缓冲液中,得到全能核酸酶酶液;
S2、将NaCl、KCl、氯化镁、辛基苯氧基聚乙醇、蔗糖、赖氨酸加入至50mM pH8.0HEPES缓冲液中,充分溶解,使用0.22μm滤膜过滤后得到保护剂混合液;
S3、将S1中全能核酸酶酶液与S2中保护剂混合液混合,使得最终各物料浓度与上述配方一致,得到全能核酸酶液体酶制剂。
实施例4
本申请实施例提供了一种全能核酸酶稳定性保护剂,包括pH为8.0的磷酸氢二钠-磷酸二氢钠缓冲液、KCl、Mg
本申请实施例还提供了一种全能核酸酶液体酶制剂,包括:全能核酸酶、pH为8.0的磷酸钠缓冲缓冲液、KCl、Mg
其中,全能核酸酶的活力浓度为400U/μL,磷酸钠缓冲缓冲液的浓度为50mM、pH为8.0,KCl的浓度为100mM、Mg
本申请实施例还提供了一种上述的全能核酸酶液体酶制剂的制备方法,包括以下步骤:
S1、将全能核酸酶以800U/μL的活力浓度超滤置换于50mM pH 8.0磷酸钠缓冲缓冲液中,得到全能核酸酶酶液;
S2、将KCl、氯化镁、吐温80、海藻糖、山梨醇、精氨酸加入至50mM pH8.0磷酸钠缓冲缓冲液中,充分溶解,使用0.22μm滤膜过滤后得到保护剂混合液;
S3、将S1中全能核酸酶酶液与S2中保护剂混合液混合,使得最终各物料浓度与上述配方一致,得到全能核酸酶液体酶制剂。
实施例5
本申请实施例提供了一种全能核酸酶稳定性保护剂,包括pH为8.0的Tris-HCl缓冲液、NaCl、Mg
本申请实施例还提供了一种全能核酸酶液体酶制剂,包括:全能核酸酶、pH为8.0的Tris-HCl缓冲液、NaCl、Mg
其中,全能核酸酶的活力浓度为400U/μL,Tris-HCl缓冲液的浓度为30mM、pH为8.0,NaCl的浓度为50mM、Mg
本申请实施例还提供了一种上述的全能核酸酶液体酶制剂的制备方法,包括以下步骤:
S1、将全能核酸酶以800U/μL的活力浓度超滤置换于30mM pH 8.0Tris-HCl缓冲液中,得到全能核酸酶酶液;
S2、将NaCl、氯化镁、曲拉通X-100、甘露醇、赖氨酸加入至30mM pH 8.0Tris-HCl缓冲液中,充分溶解,使用0.22μm滤膜过滤后得到保护剂混合液;
S3、将S1中全能核酸酶酶液与S2中保护剂混合液混合,使得最终各物料浓度与上述配方一致,得到全能核酸酶液体酶制剂。
实施例6
本申请实施例提供了一种全能核酸酶稳定性保护剂,包括pH为8.0的HEPES缓冲液、KCl、Mg
本申请实施例还提供了一种全能核酸酶液体酶制剂,包括:全能核酸酶、pH为8.0的HEPES缓冲液、KCl、Mg
其中,全能核酸酶的活力浓度为400U/μL,HEPES缓冲液的浓度为50mM、pH为8.0,KCl的浓度为60mM、Mg
本申请实施例还提供了一种上述的全能核酸酶液体酶制剂的制备方法,包括以下步骤:
S1、将全能核酸酶以800U/μL的活力浓度超滤置换于50mM pH 8.0HEPES缓冲液中,得到全能核酸酶酶液;
S2、将KCl、氯化镁、曲拉通X-100、木糖醇、精氨酸加入至50mM pH 8.0HEPES缓冲液中,充分溶解,使用0.22μm滤膜过滤后得到保护剂混合液;
S3、将S1中全能核酸酶酶液与S2中保护剂混合液混合,使得最终各物料浓度与上述配方一致,得到全能核酸酶液体酶制剂。
实施例7
本实施例提供了一种全能核酸酶液体酶制剂,同实施例2,不同在于,不添加精氨酸,具体而言,该全能核酸酶液体酶制剂包括:全能核酸酶、pH为8.0的Tris-HCl缓冲液、NaCl、Mg
其中,全能核酸酶的活力浓度为400U/μL,Tris-HCl缓冲液的浓度为20mM、pH为8.0,NaCl的浓度为100mM、Mg
本实施例还提供了一种上述的全能核酸酶液体酶制剂的制备方法,包括以下步骤:
S1、将全能核酸酶以800U/μL的活力浓度超滤置换于20mM pH为8.0Tris-HCl缓冲液中,得到全能核酸酶酶液;
S2、将NaCl、氯化镁、吐温20、海藻糖加入至20mM pH为8.0Tris-HCl缓冲液中,充分溶解,使用0.22μm滤膜过滤后得到保护剂混合液;
S3、将S1中全能核酸酶酶液与S2中保护剂混合液混合,使得最终各物料浓度与上述配方一致,得到全能核酸酶液体酶制剂。
实施例8
本实施例提供了一种全能核酸酶液体酶制剂,同实施例2,不同在于,不添加海藻糖,具体而言,该全能核酸酶液体酶制剂包括全能核酸酶、pH为8.0的Tris-HCl缓冲液、NaCl、Mg
其中,全能核酸酶的活力浓度为400U/μL,Tris-HCl缓冲液的浓度为20mM、pH为8.0,NaCl的浓度为100mM、Mg
本实施例还提供了一种上述的全能核酸酶液体酶制剂的制备方法,包括以下步骤:
S1、将全能核酸酶以800U/μL的活力浓度超滤置换于20mM pH为8.0Tris-HCl缓冲液中,得到全能核酸酶酶液;
S2、将NaCl、氯化镁、吐温20、精氨酸加入至20mM pH为8.0Tris-HCl缓冲液中,充分溶解,使用0.22μm滤膜过滤后得到保护剂混合液;
S3、将S1中全能核酸酶酶液与S2中保护剂混合液混合,使得最终各物料浓度与上述配方一致,得到全能核酸酶液体酶制剂。
实施例9
本实施例提供了一种全能核酸酶液体酶制剂,同实施例5,不同在于,不添加赖氨酸,具体而言,该全能核酸酶液体酶制剂包括:全能核酸酶、pH为8.0的Tris-HCl缓冲液、NaCl、Mg
其中,全能核酸酶的活力浓度为400U/μL,Tris-HCl缓冲液的浓度为30mM、pH为8.0,NaCl的浓度为50mM、Mg
本实施例还提供了一种上述的全能核酸酶液体酶制剂的制备方法,包括以下步骤:
S1、将全能核酸酶以800U/μL的活力浓度超滤置换于30mM pH 8.0Tris-HCl缓冲液中,得到全能核酸酶酶液;
S2、将NaCl、氯化镁、曲拉通X-100、甘露醇加入至30mM pH 8.0Tris-HCl缓冲液中,充分溶解,使用0.22μm滤膜过滤后得到保护剂混合液;
S3、将S1中全能核酸酶酶液与S2中保护剂混合液混合,使得最终各物料浓度与上述配方一致,得到全能核酸酶液体酶制剂。
实施例10
本实施例提供了一种全能核酸酶液体酶制剂,同实施例5,不同在于,不添加甘露醇,具体而言,该全能核酸酶液体酶制剂包括:全能核酸酶、pH为8.0的Tris-HCl缓冲液、NaCl、Mg
其中,全能核酸酶的活力浓度为400U/μL,Tris-HCl缓冲液的浓度为30mM、pH为8.0,NaCl的浓度为50mM、Mg
本实施例还提供了一种上述的全能核酸酶液体酶制剂的制备方法,包括以下步骤:
S1、将全能核酸酶以800U/μL的活力浓度超滤置换于30mM pH 8.0Tris-HCl缓冲液中,得到全能核酸酶酶液;
S2、将NaCl、氯化镁、曲拉通X-100、赖氨酸加入至30mM pH 8.0Tris-HCl缓冲液中,充分溶解,使用0.22μm滤膜过滤后得到保护剂混合液;
S3、将S1中全能核酸酶酶液与S2中保护剂混合液混合,使得最终各物料浓度与上述配方一致,得到全能核酸酶液体酶制剂。
对比例1
本对比例提供了一种全能核酸酶液体酶制剂,同实施例2,不同在于,不添加海藻糖及精氨酸,具体而言,该全能核酸酶液体酶制剂包括:全能核酸酶、pH为8.0的Tris-HCl缓冲液、NaCl、Mg
其中,全能核酸酶的活力浓度为400U/μL,Tris-HCl缓冲液的浓度为20mM、pH为8.0,NaCl的浓度为100mM、Mg
本对比例还提供了一种上述的全能核酸酶液体酶制剂的制备方法,包括以下步骤:
S1、将全能核酸酶以800U/μL的活力浓度超滤置换于20mM pH为8.0Tris-HCl缓冲液中,得到全能核酸酶酶液;
S2、将NaCl、氯化镁、吐温20加入至20mM pH为8.0Tris-HCl缓冲液中,充分溶解,使用0.22μm滤膜过滤后得到保护剂混合液;
S3、将S1中全能核酸酶酶液与S2中保护剂混合液混合,使得最终各物料浓度与上述配方一致,得到全能核酸酶液体酶制剂。
对比例2
本对比例提供了一种全能核酸酶液体酶制剂,同实施例5,不同在于,不添加甘露醇及赖氨酸,具体而言,该全能核酸酶液体酶制剂包括:全能核酸酶、pH为8.0的Tris-HCl缓冲液、NaCl、Mg
其中,全能核酸酶的活力浓度为400U/μL,Tris-HCl缓冲液的浓度为30mM、pH为8.0,NaCl的浓度为50mM、Mg
本对比例还提供了一种上述的全能核酸酶液体酶制剂的制备方法,包括以下步骤:
S1、将全能核酸酶以800U/μL的活力浓度超滤置换于30mM pH 8.0 Tris-HCl缓冲液中,得到全能核酸酶酶液;
S2、将NaCl、氯化镁、曲拉通X-100加入至30mM pH 8.0 Tris-HCl缓冲液中,充分溶解,使用0.22μm滤膜过滤后得到保护剂混合液;
S3、将S1中全能核酸酶酶液与S2中保护剂混合液混合,使得最终各物料浓度与上述配方一致,得到全能核酸酶液体酶制剂。
性能测试
将实施例2~6获得的全能核酸酶液体酶制剂,分别加入至pH 4.0乙酸-乙酸钠缓冲液、pH 10.0甘氨酸-氢氧化钠缓冲液中,常温下处理12h,根据实施例1提及的方法测定全能核酸酶处理前后的活力,将处理前的活力记为100%,结果如表1所示。
表1-全能核酸酶液体酶制剂在pH 4.0及pH 10.0的活力稳定性
根据表1所示的实验结果,实施例2~6提供的保护剂配方,均能够保证全能核酸酶在pH 4.0和pH 10.0的稳定性,在处理12h时间内,能维持90%以上活力。
将实施例2~6获得的全能核酸酶液体酶制剂,分别置于50℃及60℃、70℃、80℃水浴中处理,根据实施例1提及的方法测定全能核酸酶处理前后的活力,将处理前的活力记为100%。
具体的,实施例2~6获得的全能核酸酶液体酶制剂在50℃下分别处理4h、8h、12h的活力稳定性,结果如下表2所示。
表2-全能核酸酶液体酶制剂在50℃的活力稳定性
具体的,将实施例2~6获得的全能核酸酶液体酶制剂,分别置于60℃、70℃、80℃水浴中处理1h,测试其活力稳定性,结果如下表3所示。
表3-全能核酸酶在60℃、70℃、80℃的活力稳定性
根据表2及表3所示的实验结果,实施例2~6提供的保护剂配方,能够保证全能核酸酶在50~80℃下的稳定性,在50℃处理12h,能维持90%以上活力,60℃处理1h维持90%以上活力,70℃处理1h维持85%活力,80℃处理1h维持75%以上活力。
将实施例2~6获得的全能核酸酶液体酶制剂,分别置于常温(25℃)和4℃储存,根据实施例1提及的方法测定全能核酸酶储存前后的活力,将初始活力记为100%。测试其在常温下储存7天、15天、30天的活力稳定性,结果如表4所示;测试其在常温下储存4个月、8个月、1年的活力稳定性,结果如表5所示。
表4-全能核酸酶液体酶制剂在常温储存下的活力稳定性
表5-全能核酸酶液体酶制剂在4℃储存下的活力稳定性
根据表4及表5所示的实验结果,实施例2~6提供的保护剂配方,能够保证全能核酸酶在常温及4℃下的稳定性,在常温储存30天活性稳定,4℃储存1年活性稳定。
按照上述方法,将实施例7~10、对比例1~2获得的全能核酸酶液体酶制剂,分别加入至pH 4.0乙酸-乙酸钠缓冲液、pH 10.0甘氨酸-氢氧化钠缓冲液中,常温下处理12h,测试实施例7~10、对比例1~2中的全能核酸酶液体酶制剂的活力稳定性;将实施例7~10、对比例1~2获得的全能核酸酶液体酶制剂,分别置于50℃及60℃、70℃、80℃水浴中处理,其中,50℃下处理12h,60℃下处理1h、70℃处理1h、80℃处理1h,测试实施例7~10、对比例1~2中的全能核酸酶液体酶制剂的活力稳定性;将实施例7~10、对比例1~2获得的全能核酸酶液体酶制剂,分别置于常温(25℃)和4℃储存,其中,常温储存30天,4℃存储1年,测试实施例7~10、对比例1~2的全能核酸酶液体酶制剂的活力稳定性;根据实施例1提及的方法测定全能核酸酶各条件处理前后的酶活保存率,将初始活力记为100%,结果如图1所示。
由图1所示的实验结果,相较于优选配方的实施例2、5在各条件下的稳定性,对比例1、2大幅度下降,实施例7~10略微降低。在pH 4.0及pH 10.0处理12h,实施例2、5酶活保存率为90%以上,对比例1、2酶活保存率约为65%,实施例7~10酶活保存率为80%~85%。在50℃处理12h,实施例2、5酶活保存率为90%以上,对比例1、2酶活保存率约为60%,实施例7~10酶活保存率约为82%。在60℃处理1h,实施例2、5酶活保存率约为90%,对比例1、2酶活保存率约为62%,实施例7~10酶活保存率约为82%。在70℃处理1h,实施例2、5酶活保存率约为85%,对比例1、2酶活保存率约为50%,实施例7~10酶活保存率约为82%。在80℃处理1h,实施例2、5酶活保存率约为75%,对比例1、2酶活保存率约为30%,实施例7~10酶活保存率约为62%。在常温储存30天,实施例2、5酶活保存率为90%以上,对比例1、2酶活保存率约为70%,实施例7~10酶活保存率约为85%。在4℃储存1年,实施例2、5酶活保存率为90%以上,对比例1、2酶活保存率约为72%,实施例7~10酶活保存率约为86%。
以上所述仅为本发明的较佳实施方式而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 一种液体酶制剂及其制备方法和应用
- 一种具有改善稳定性的液体复合维生素制剂及其制备方法
- 一种利用咪唑类离子液体协同生物酶制剂降解木质纤维素的方法
- 一种果树枝干保护剂及制备方法
- 一种汽油直喷发动机油泵保护剂及其制备方法
- 一种全能核酸酶的单克隆抗体及其制备方法
- 一种全能核酸酶的单克隆抗体及其制备方法
