一种基于荧光素酶报告基因法的RIG-I抑制剂筛选体系
文献发布时间:2024-04-18 19:58:53
技术领域
本发明涉及一种基于荧光素酶报告基因法的RIG-I抑制剂筛选体系,属于生物医药技术领域。
背景技术
维甲酸诱导基因I(retinoic acid-induced gene I,RIG-I又命名Ddx58)最早由上海血液学研究所1998年在急性早幼粒细胞白细胞病细胞分化中分离鉴定;2004年RIG-I被发现在先天性免疫过程中作为模式识别受体直接识别病毒RNA,在抗病毒的免疫、炎症反应中存在重要的作用,从此RIG-I作为先天性免疫的明星分子和重要的信号识别受体被深入研究。设计RIG-I拮抗剂,可以调节RIG-I的活性,并潜在地治疗与RIG-I过度刺激相关的疾病。这些疾病包括慢性阻塞性肺疾病(COPD)和自身免疫性疾病等。通过控制RIG-I的活性,可以减少炎症反应和免疫系统的过度激活,从而改善疾病症状和预防疾病进展。这为治疗自身免疫性疾病、炎症性疾病和感染疾病提供了新的治疗策略。因此,设计RIG-I抑制剂,可以为该化学生物学领域的研究提供了新的机会,为开发更多的免疫调节剂和药物提供帮助。抑制RIG-I通路可能会影响多个下游通路,包括以下几个方面:干扰素(Interferon)信号通路:RIG-I通路的激活会导致干扰素的产生和释放,从而引发干扰素信号通路的激活。抑制RIG-I通路可能会减少干扰素的产生和干扰素信号通路的激活。NF-κB信号通路:RIG-I通路的激活可以通过激活IKK复合物和降解IκB蛋白来激活NF-κB信号通路。抑制RIG-I通路可能会减少NF-κB的激活和下游基因的表达。MAPK信号通路:RIG-I通路的激活可以通过激活MAPK家族成员(如ERK、JNK和p38)来激活MAPK信号通路。抑制RIG-I通路可能会减少MAPK的激活和下游基因的表达。PI3K/Akt信号通路:RIG-I通路的激活可以通过激活PI3K/Akt信号通路来促进细胞存活和增殖。抑制RIG-I通路可能会减少PI3K/Akt的激活和细胞增殖的促进。因此,本领域迫切需要对位于这些信号传导途径的汇合点处的RIG-I蛋白具有选择性抑制作用的化合物和高效筛选抑制RIG-I的化合物的方法。RIG-I已经成为国内外药物研发的热点之一,然而目前仍缺乏成熟应用的RIG-I抑制剂,国内外生物制药行业和无生化水平筛选RIG-I抑制剂的方法。
发明内容
本发明的目的是:为了解决如何筛选抑制RIG-I的化合物的技术问题,本发明提供一种基于荧光素酶报告基因法的RIG-I抑制剂筛选体系。
为了实现上述目的,本发明采取了以下技术方案:
本发明的第一方面,提供一种稳定表达RIG-I的293T细胞,所述细胞于2023年08月11日在中国典型培养物保藏中心保藏,保藏名称为稳转RIG-I基因的人胚肾细胞293T-pRIGI-LUC2,保藏编号为CCTCC NO:C2021275。
本发明的第二方面,提供一种用于构建本发明第一方面所述的稳定表达RIG-I的293T细胞的质粒,所述质粒为pCDH-CMV-MCS-EF1-coGFP-T2A-Puro-hRIG-I质粒和LVpuro-pRIGI-LUC2质粒中的至少一种;
所述pCDH-CMV-MCS-EF1-coGFP-T2A-Puro-hRIG-I质粒包含RIG-I基因片段;
所述LVpuro-pRIGI-LUC2质粒包含NFkB顺式作用元件和β干扰素刺激响应元件(ISRE)基因片段,还包含分别与NFkB顺式作用元件和ISRE片段相连的luciferase基因片段。
优选地,所述的NFkB顺式作用元件基因片段的序列如SEQ ID NO:1;所述的β干扰素刺激响应元件基因片段的序列如SEQ ID NO:2所示。
优选地,所述的luciferase基因片段的序列如SEQ ID NO:3所示。
优选地,所述的RIG-I基因片段的序列如SEQ ID NO:4所示。
本发明的第三方面,提供本发明第一方面所述的稳定表达RIG-I的293T细胞在筛选针对RIG-I的分子靶向药物中的应用。
优选地,所述应用包括在筛选RIG-I抑制剂中的应用。
本发明的第四方面,提供本发明第二方面所述的所述的质粒在筛选针对RIG-I的分子靶向药物中的应用。
优选地,所述应用包括在筛选RIG-I抑制剂中的应用。
本发明的第五方面,提供一种筛选RIG-I抑制剂的方法,包括:将本发明第二方面所述的质粒转染到工具细胞中并进行培养或者将本发明第一方面所述的293T细胞培养后,加入RIG-I激动剂和待筛选药物,继续培养;之后加入luciferin,检测Luciferase酶活性,根据候选RIGI抑制剂的加入对Luciferase酶活性的影响判断所加入的待筛选药物是否为RIGI的抑制剂,以实现对RIG-I抑制剂的筛选。
优选地,所述RIG-I激动剂为Inarigivir。
优选地,所述工具细胞为293T、H9C2或其它工具细胞。
优选地,可通过检测荧光强度实现对Luciferase酶活性的检测。
本发明将受RIG-I间接调控的NFkB顺式作用元件(cis-acting element)和IFN-stimulated response element(ISRE)定向克隆在Luciferase基因编码区上游,构建慢病毒,感染稳定表达RIG-I的293T细胞,筛选稳定转染细胞株。在筛选出的细胞培养体系中加入RIG-I激动剂(Inarigivir),使得RIG-I报告基因信号得到放大。当化合物、蛋白或者抗体等RIG-I的候选抑制剂加入该检测系统时,顺式作用元件的活性被间接抑制,从而导致报告基因表达和活性减少,加入底物荧光素(luciferin)后荧光素酶催化luciferin氧化的过程中发出的生物荧光(bioluminescence)减少。候选抑制剂对RIG-I的抑制能力与生物荧光减少呈正相关,因此可以用于筛选RIG-I抑制剂。
本发明与现有技术相比,具有如下有益效果:
本发明构建了含多个拷贝的IFN-β启动子的荧光素酶报告基因质粒载体和慢病毒报告载体,进一步构建上述载体的H9C2或293T稳转细胞株,通过在靶细胞H9C2或293T中转染入RIG-I激动剂(Inarigivir,是一种新型小分子核酸杂交化合物)激活胞内RIG-I的活性进一步放大检测信号值,然后筛选抑制RIG-I活性的化合物;本发明为RIG-I抑制剂的筛选提供了灵敏度高、重复性好的高通量解决方案,对于新药筛选具有重要的意义。
附图说明
图1为pCDH-CMV-MCS-EF1-coGFP-T2A-Puro-hRIG-I质粒构建示意图;
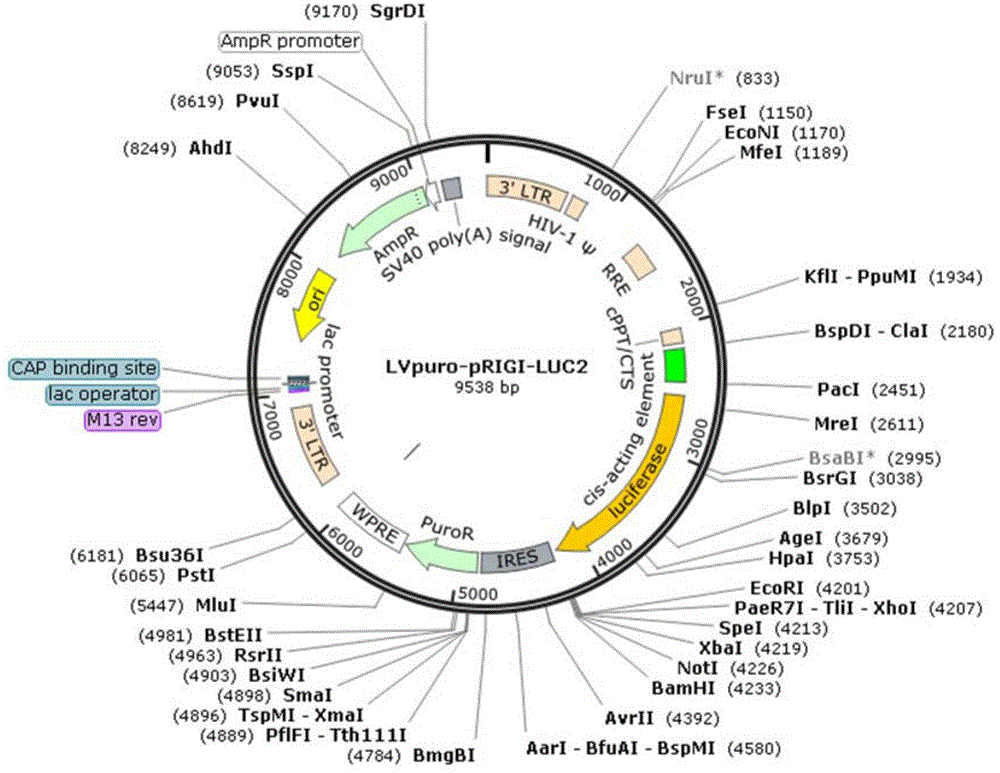
图2为LVpuro-pRIGI-LUC2质粒构建示意图;
图3为本发明中细胞明视场图;
图4为本发明筛选RIG-I小分子抑制剂的结果展示。
保藏说明
稳定表达RIG-I的293T细胞(293T-RIG-I)于2023年08月11日在中国典型培养物保藏中心保藏,保藏名称为稳转RIG-I基因的人胚肾细胞293T-pRIGI-LUC2,保藏编号为CCTCCNO:C2021275,保藏地址为中国武汉武汉大学。
具体实施方式
为使本发明更明显易懂,兹以优选实施例,并配合附图作详细说明如下。
本发明基于RIG-I能被单链RNA激活之后,可激活下游IFN-β基因启动而设计的荧光素酶报告基因检测体系,通过一系列的DNA序列设计与验证,在转染本发明的细胞高表达RIG-I,RIG-I作用NFkB顺式作用元件和IFN-β基因启动的ISRE,从而促进细胞中IFN-β的启动子会启动萤火虫荧光素酶(Luciferase)的表达;在本发明的细胞培养体系中加入RIG-I激动剂(Inarigivir),使得RIG-I报告基因信号得到放大,Luciferase的表达水平增加。而当向细胞中加入RIG-I抑制剂后,RIG-I作用受到抑制,Luciferase的表达水平减少。Luciferase可作用于底物荧光素(luciferin)并产生荧光信号并可由化学发光检测仪定量检测。通过一系列实验证实本发明能通过报告基因如实反映RIG-I的活性变化,例如:Luciferase读数较高的实验组中RIG-I的表达量明显高于Luciferase读数较低的实验组。
本发明下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
本发明下述实施例中所用的材料如下:
293T细胞为实验室按照常规培养,VSV病毒由中国科学院武汉病毒研究所提供,真核表达载体pEGFP-N1购自Clontech公司,各种限制性内切酶、Ex-Taq酶、T4DNA连接酶和质粒提取试剂盒购自Takara公司,转染试剂Fugen6购自Promega公司,Opti-MEM、DMEM培养基和FBS购自Invitrogen公司,各种规格细胞培养板购自Corning公司,多功能酶标仪购自MD公司,荧光素酶检测试剂盒购自Promega公司;
本发明下述实施例中涉及的基因片段序列如下:
NFkB顺式作用元件基因片段(SEQ ID NO:1):
GGGAATTTCCGGGGACTTTCCGGGGACTTTCCACT;
β干扰素刺激响应元件基因片段(SEQ ID NO:2):
TAGTTTCACTTTCCCGCTTCTTTCAGTTTCCCTCCTTTCCAACGAATGCCTCGGGAAAGGGAAACCGAAACTGAAGCCA;
luciferase基因片段(SEQ ID NO:3)
ATGGAGACCGACACCTTACTGCTGTGGGTGCTGCTGTTATGGGTGCCCGGTAGCACCGGCGACGAAGATGCCAAAAACATTAAGAAGGGCCCAGCGCCATTCTACCCACTCGAAGACGGGACCGCCGGCGAGCAGCTGCACAAAGCCATGAAGCGCTACGCCCTGGTGCCCGGCACCATCGCCTTTACCGACGCACATATCGAGGTGGACATTACCTACGCCGAGTACTTCGAGATGAGCGTTCGGCTGGCAGAAGCTATGAAGCGCTATGGGCTGAATACAAACCATCGGATCGTGGTGTGCAGCGAGAATAGCTTGCAGTTCTTCATGCCCGTGTTGGGTGCCCTGTTCATCGGTGTGGCTGTGGCCCCAGCTAACGACATCTACAACGAGCGCGAGCTGCTGAACAGCATGGGCATCAGCCAGCCCACCGTCGTATTCGTGAGCAAGAAAGGGCTGCAAAAGATCCTCAACGTGCAAAAGAAGCTACCGATCATACAAAAGATCATCATCATGGATAGCAAGACCGACTACCAGGGCTTCCAAAGCATGTACACCTTCGTGACTTCCCATTTGCCACCCGGCTTCAACGAGTACGACTTCGTGCCCGAGAGCTTCGACCGGGACAAAACCATCGCCCTGATCATGAACAGTAGTGGCAGTACCGGATTGCCCAAGGGCGTAGCCCTACCGCACCGCACCGCTTGTGTCCGATTCAGTCATGCCCGCGACCCCATCTTCGGCAACCAGATCATCCCCGACACCGCTATCCTCAGCGTGGTGCCATTTCACCACGGCTTCGGCATGTTCACCACGCTGGGCTACTTGATCTGCGGCTTTCGGGTCGTGCTCATGTACCGCTTCGAGGAGGAGCTATTCTTGCGCAGCTTGCAAGACTATAAGATTCAATCTGCCCTGCTGGTGCCCACACTATTTAGCTTCTTCGCTAAGAGCACTCTCATCGACAAGTACGACCTAAGCAACTTGCACGAGATCGCCAGCGGCGGGGCGCCGCTCAGCAAGGAGGTAGGTGAGGCCGTGGCCAAACGCTTCCACCTACCAGGCATCCGCCAGGGCTACGGCCTGACAGAAACAACCAGCGCCATTCTGATCACCCCCGAAGGGGACGACAAGCCTGGCGCAGTAGGCAAGGTGGTGCCCTTCTTCGAGGCTAAGGTGGTGGACTTGGACACCGGTAAGACACTGGGTGTGAACCAGCGCGGCGAGCTGTGCGTCCGTGGCCCCATGATCATGAGCGGCTACGTTAACAACCCCGAGGCTACAAACGCTCTCATCGACAAGGACGGCTGGCTGCACAGCGGCGACATCGCCTACTGGGACGAGGACGAGCACTTCTTCATCGTGGACCGGCTGAAGAGCCTGATCAAATACAAGGGCTACCAGGTAGCCCCAGCCGAACTGGAGAGCATCCTGCTGCAACACCCCAACATCTTCGACGCCGGGGTCGCCGGCCTGCCCGACGACGATGCCGGCGAGCTGCCCGCCGCAGTCGTCGTGCTGGAACACGGTAAAACCATGACCGAGAAGGAGATCGTGGACTATGTGGCCAGCCAGGTTACAACCGCCAAGAAGCTGCGCGGTGGTGTTGTGTTCGTGGACGAGGTGCCTAAAGGACTGACCGGCAAGTTGGACGCCCGCAAGATCCGCGAGATTCTCATTAAGGCCAAGAAGGGCGGCAAGATCGCCGTGTAG;RIG-I基因片段(SEQ ID NO:4):
ATGACCACCGAGCAGCGACGCAGCCTGCAAGCCTTCCAGGATTATATCCGGAAGACCCTGGACCCTACCTACATCCTGAGCTACATGGCCCCCTGGTTTAGGGAGGAAGAGGTGCAGTATATTCAGGCTGAGAAAAACAACAAGGGCCCAATGGAGGCTGCCACACTTTTTCTCAAGTTCCTGTTGGAGCTCCAGGAGGAAGGCTGGTTCCGTGGCTTTTTGGATGCCCTAGACCATGCAGGTTATTCTGGACTTTATGAAGCCATTGAAAGTTGGGATTTCAAAAAAATTGAAAAGTTGGAGGAGTATAGATTACTTTTAAAACGTTTACAACCAGAATTTAAAACCAGAATTATCCCAACCGATATCATTTCTGATCTGTCTGAATGTTTAATTAATCAGGAATGTGAAGAAATTCTACAGATTTGCTCTACTAAGGGGATGATGGCAGGTGCAGAGAAATTGGTGGAATGCCTTCTCAGATCAGACAAGGAAAACTGGCCCAAAACTTTGAAACTTGCTTTGGAGAAAGAAAGGAACAAGTTCAGTGAACTGTGGATTGTAGAGAAAGGTATAAAAGATGTTGAAACAGAAGATCTTGAGGATAAGATGGAAACTTCTGACATACAGATTTTCTACCAAGAAGATCCAGAATGCCAGAATCTTAGTGAGAATTCATGTCCACCTTCAGAAGTGTCTGATACAAACTTGTACAGCCCATTTAAACCAAGAAATTACCAATTAGAGCTTGCTTTGCCTGCTATGAAAGGAAAAAACACAATAATATGTGCTCCTACAGGTTGTGGAAAAACCTTTGTTTCACTGCTTATATGTGAACATCATCTTAAAAAATTCCCACAAGGACAAAAGGGGAAAGTTGTCTTTTTTGCGAATCAGATCCCAGTGTATGAACAGCAGA
AATCTGTATTCTCAAAATACTTTGAAAGACATGGGTATAGAGTTACAGGCAT
TTCTGGAGCAACAGCTGAGAATGTCCCAGTGGAACAGATTGTTGAGAACA
ATGACATCATCATTTTAACTCCACAGATTCTTGTGAACAACCTTAAAAAGGG
AACGATTCCATCACTATCCATCTTTACTTTGATGATATTTGATGAATGCCACA
ACACTAGTAAACAACACCCGTACAATATGATCATGTTTAATTATCTAGATCA
GAAACTTGGAGGATCTTCAGGCCCACTGCCCCAGGTCATTGGGCTGACTGC
CTCGGTTGGTGTTGGGGATGCCAAAAACACAGATGAAGCCTTGGATTATAT
CTGCAAGCTGTGTGCTTCTCTTGATGCGTCAGTGATAGCAACAGTCAAACA
CAATCTGGAGGAACTGGAGCAAGTTGTTTATAAGCCCCAGAAGTTTTTCAG
GAAAGTGGAATCACGGATTAGCGACAAATTTAAATACATCATAGCTCAGCT
GATGAGGGACACAGAGAGTCTGGCAAAGAGAATCTGCAAAGACCTCGAA
AACTTATCTCAAATTCAAAATAGGGAATTTGGAACACAGAAATATGAACAA
TGGATTGTTACAGTTCAGAAAGCATGCATGGTGTTCCAGATGCCAGACAAA
GATGAAGAGAGCAGGATTTGTAAAGCCCTGTTTTTATACACTTCACATTTGC
GGAAATATAATGATGCCCTCATTATCAGTGAGCATGCACGAATGAAAGATGC
TCTGGATTACTTGAAAGACTTCTTCAGCAATGTCCGAGCAGCAGGATTCGA
TGAGATTGAGCAAGATCTTACTCAGAGATTTGAAGAAAAGCTGCAGGAACT
AGAAAGTGTTTCCAGGGATCCCAGCAATGAGAATCCTAAACTTGAAGACCT
CTGCTTCATCTTACAAGAAGAGTACCACTTAAACCCAGAGACAATAACAAT
TCTCTTTGTGAAAACCAGAGCACTTGTGGACGCTTTAAAAAATTGGATTGA
AGGAAATCCTAAACTCAGTTTTCTAAAACCTGGCATATTGACTGGACGTGG
CAAAACAAATCAGAACACAGGAATGACCCTCCCGGCACAGAAGTGTATATT
GGATGCATTCAAAGCCAGTGGAGATCACAATATTCTGATTGCCACCTCAGTT
GCTGATGAAGGCATTGACATTGCACAGTGCAATCTTGTCATCCTTTATGAGT
ATGTGGGCAATGTCATCAAAATGATCCAAACCAGAGGCAGAGGAAGAGCA
AGAGGTAGCAAGTGCTTCCTTCTGACTAGTAATGCTGGTGTAATTGAAAAA
GAACAAATAAACATGTACAAAGAAAAAATGATGAATGACTCTATTTTACGC
CTTCAGACATGGGACGAAGCAGTATTTAGGGAAAAGATTCTGCATATACAG
ACTCATGAAAAATTCATCAGAGATAGTCAAGAAAAACCAAAACCTGTACCT
GATAAGGAAAATAAAAAACTGCTCTGCAGAAAGTGCAAAGCCTTGGCATG
TTACACAGCTGACGTAAGAGTGATAGAGGAATGCCATTACACTGTGCTTGG
AGATGCTTTTAAGGAATGCTTTGTGAGTAGACCACATCCCAAGCCAAAGCA
GTTTTCAAGTTTTGAAAAAAGAGCAAAGATATTCTGTGCCCGACAGAACTG
CAGCCATGACTGGGGAATCCATGTGAAGTACAAGACATTTGAGATTCCAGT
TATAAAAATTGAAAGTTTTGTGGTGGAGGATATTGCAACTGGAGTTCAGAC
ACTGTACTCGAAGTGGAAGGACTTTCATTTTGAGAAGATACCATTTGATCCAGCAGAAATGTCCAAATGA。
实施例1
稳定表达hRIG-I的293T细胞构建,步骤如下:
(1)根据Genebank中已公布的人RIG-I基因序列,人工合成该基因序列,合成的RIG-I基因序列如SEQ ID NO:4所示;在两端增加EcoRI和BamHI酶切位点的粘性末端;
(2)采用EcoRI和BamHI双酶切法对pCDH-CMV-MCS-EF1-coGFP-T2A-Puro质粒进行线性化;
(3)通过T4DNA连接酶将人工合成RIG-I基因片段与线性化的pCDH-CMV-MCS-EF1-coGFP-T2A-Puro连接,转化DH5α感受态细胞,摇菌,筛选出阳性克隆后提取质粒,即为pCDH-CMV-MCS-EF1-coGFP-T2A-Puro-hRIG-I质粒,通过DNA测序验证RIG-I基因序列的正确性,其构建示意图如图1所示。
(4)用含10% FBS的DMEM培养基于37℃、5% CO
(5)待10cm皿中细胞融合度到80%左右,用0.25%胰酶消化293T细胞,分到两个6cm皿中,使细胞在接种之后的18-24h达到90~95%融合度。
(6)应用500μl Optimum和20μl PEI混匀于室温静置5min,将500μlOptimum、1.7μgpCDH-CMV-MCS-EF1-coGFP-T2A-Puro-hRIG-I、1.13μg psPAX2和0.57μg MD2.G混匀配制成DNA mixture,将静置5min后的Optimum/PEI混合物加入到Optimum/质粒混合物中轻轻混匀,于室温静置20min后,将混匀后的mixture加入到培养基中;
(7)6h之后将培养基更换为含10% FBS的H-DMEM完全培养基;
(8)分别收集48h、72h和96h的细胞上清液。
(9)上清2000r离心10min,然后通过0.22μm滤头过滤以去除残留的293T细胞,即为包装好的慢病毒。
(10)将过滤好的病毒上清置于超滤管中,3000r离心20min。
(11)用含10% FBS的DMEM培养基于37℃、5% CO
(12)待6cm皿中细胞融合度到80%左右,用0.25%胰酶消化293T细胞,离心弃上清,用新的完全培养基重悬,在6孔板的每个孔中接种约2×10
(13)感染前两个实验组换不含抗生素新鲜培养基900μl,一个对照组换液1ml。实验组两个孔中分别加入病毒100μl,并加入终浓度为8μg/ml的Polybrene,感染24h后,根据细胞状态补液或换液。48h加药筛选。
(14)在病毒感染细胞之后的48h向每个孔中加入终浓度为1μg/ml的puromycin筛选,当未感染病毒的细胞完全死亡后,即得到稳定整合外源基因的阳性细胞。
实施例2
稳定表达LVpuro-pRIGI-LUC2的293T细胞构建,步骤如下:
(1)根据NFkB的顺式作用元件、β干扰素刺激响应元件(IFN-stimulated responseelement,ISRE)、TRAIL基因ISRE、ISG15基因ISRE和Luciferase基因片段,人工合成一段含有NFkB的顺式作用元件和ISRE的重叠序列作为启动子的Luciferase基因,在两端增加ClaI和EcoRI酶切位点的粘性末端;其中,所述的NFkB顺式作用元件基因片段的序列如SEQ IDNO:1所示;所述的β干扰素刺激响应元件基因片段的序列如SEQ ID NO:2所示;所述的luciferase基因片段的序列如SEQ ID NO:3所示;
(2)采用ClaI和EcoRI双酶切法对pLVX-IRES-puro质粒进行线性化;
(3)通过T4DNA连接酶将人工合成基因片段与线性化的pLVX-IRES-puro连接,转化DH5α感受态细胞,摇菌,筛选出阳性克隆后提取质粒,即为LVpuro-pRIGI-LUC2质粒,通过DNA测序验证基因序列的正确性,其构建示意图如图2所示。
(4)用含10% FBS的DMEM培养基于37℃、5% CO
(5)待10cm皿中细胞融合度到80%左右,用0.25%胰酶消化293T细胞,分到两个6cm皿中,使细胞在接种之后的18-24h达到90~95%融合度。
(6)应用500μl Optimum和20μl PEI混匀于室温静置5min,将500μlOptimum、1.7μgLVpuro-pRIGI-LUC2、1.13μg psPAX2和0.57μg MD2.G混匀配制成DNA mixture,将静置5min后的Optimum/PEI混合物加入到Optimum/质粒混合物中轻轻混匀,于室温静置20min后,将混匀后的mixture加入到培养基中;
(7)6h之后将培养基更换为含10% FBS的DMEM完全培养基;
(8)分别收集48h、72h和96h的细胞上清液。
(9)上清2000r离心10min,然后通过0.22μm滤头过滤以去除残留的293T细胞,即为包装好的慢病毒。
(10)将过滤好的病毒上清置于超滤管中,3000r离心20min。
(11)用含10% FBS的DMEM培养基于37℃、5% CO
(12)待6cm皿中细胞融合度到80%左右,用0.25%胰酶消化293T细胞,离心弃上清,用新的完全培养基重悬,在6孔板的每个孔中接种约2×105个细胞,使细胞在接种之后的18-24h达到70%融合度,共接种3孔细胞。
(13)感染前两个实验组换不含抗生素新鲜培养基900μl,一个对照组换液1ml。实验组两个孔中分别加入病毒100μl,并加入终浓度为8μg/ml的Polybrene,感染24h后,根据细胞状态补液或换液。48h加药筛选。
(14)在病毒感染细胞之后的48h向每个孔中加入终浓度为1μg/ml的puromycin筛选,当未感染病毒的细胞完全死亡后,即得到稳定整合外源基因的阳性细胞,命名为293T-RIG-I细胞。该293T-RIG-I细胞于2023年08月11日在中国典型培养物保藏中心保藏,保藏名称为稳转RIG-I基因的人胚肾细胞293T-pRIGI-LUC2,保藏编号为CCTCC NO:C2021275。
实施例3
在293T-RIG-I细胞中筛选RIG-I抑制剂的方法:
(1)用含10% FBS的DMEM培养基于37℃、5% CO
(2)待6cm皿中细胞融合度到80%左右,用0.25%胰酶消化293T细胞,在96孔板的每个孔中接种1×10
(3)接种后的24h加入50nmol的Inarigivir和候选RIGI抑制剂,继续培养24h后,向每个孔中加入100μl萤火虫荧光素酶检测底物,快速在多功能酶标仪上读取化学发光值,根据候选RIGI抑制剂的加入对化学发光值大小的影响判断所加入的化合物是否为RIGI的抑制剂。
综上所述,本发明实施例利用基于荧光素酶报告基因法的RIG-I抑制剂筛选体系,只需培养该细胞,并用Inarigivir和候选RIGI抑制剂处理24h后在特定的仪器下检测荧光强度即可完成RIG-I抑制剂检测,极大地简化了筛选过程,缩短筛选时间,更具有实用性,适合在规模化生产中应用。
以上所述,仅为本发明的较佳实施例,并非对本发明任何形式上和实质上的限制,应当指出,对于本技术领域的普通技术人员,在不脱离本发明的前提下,还将可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。
- 基于荧光素酶报告基因法的高通量二噁英自动检测装置
- 基于荧光素酶报告基因法的高通量二噁英自动检测装置
