一种重组菌及其在合成4-羟基-3-甲氧基苯甲酸中的应用
文献发布时间:2024-04-18 20:00:50
技术领域
本发明涉及生物技术领域,具体而言,涉及一种重组菌及其在合成4-羟基-3-甲氧基苯甲酸中的应用。
背景技术
4-羟基-3-甲氧基苯甲酸,又称香草酸、香荚兰酸,广泛存在于自然界中,如在香荚兰豆、香子兰荚、秘鲁香膏等许多植物中均有发现,具有较强的抗氧化、抗菌活性,具有粉香、奶油香,可用于调配椰子、坚果、奶油等实用香精。
4-羟基-3-甲氧基苯甲酸的制备方法主要有提取法、化学合成法及生物转化法。提取法主要以香荚兰豆等植物为原料,经浸提、蒸发等步骤提取获得4-羟基-3-甲氧基苯甲酸,这种方法的高成本、原料来源有限、低效率限制了其工业化应用。化学合成法具有环境污染严重、产品质量低等缺点,限制了其应用范围。生物转化法具备特异性高、绿色环保、反应条件温和及无需多步分离纯化等优点,目前已经受到了广泛的关注。
目前,国内外学者报道了多种4-羟基-3-甲氧基苯甲酸的生物法制备路线,中国专利CN100429317通过黑曲霉菌水解米糠油皂脚中的阿魏酸酯产生阿魏酸,并将其转化为4-羟基-3-甲氧基苯甲酸,发酵72h,4-羟基-3-甲氧基苯甲酸的浓度仅为2.24g/L。许美玲等选育一株链霉菌,能够将阿魏酸转化为4-羟基-3-甲氧基苯甲酸,并对其发酵转化条件进行优化,经12h转化,可将1g/L阿魏酸转化为0.261g/L的4-羟基-3-甲氧基苯甲酸。PriyaUpadhyay等通过菌Pseudomonas putida KT2440发酵转化阿魏酸制备4-羟基-3-甲氧基苯甲酸,经24h发酵,4-羟基-3-甲氧基苯甲酸的产量不超过2g/L。
以上报道的4-羟基-3-甲氧基苯甲酸生物合成路线具有生产效率低,反应周期长等缺点。因此,创建一条效率高、成本低的4-羟基-3-甲氧基苯甲酸制备方法迫在眉睫。
鉴于此,特提出本发明。
发明内容
本发明的目的在于提供一种重组菌及其在合成4-羟基-3-甲氧基苯甲酸中的应用,该重组菌同时表达扁桃酸脱氢酶(MDH)、α-酮酸脱羧酶(KDC)和乙醛脱氢酶(ALDH),通过扁桃酸脱氢酶、α-酮酸脱羧酶和乙醛脱氢酶的催化,可将4-羟基-3-甲氧基扁桃酸转化为4-羟基-3-甲氧基苯甲酸。
本发明是这样实现的:
第一方面,本发明提供了一种合成4-羟基-3-甲氧基苯甲酸的重组菌,其包含编码扁桃酸脱氢酶、α-酮酸脱羧酶和乙醛脱氢酶的基因;
其中,扁桃酸脱氢酶包括ErMDH和BcMDH;ErMDH的氨基酸序列如SEQ ID NO.1所示,BcMDH的氨基酸序列如SEQ ID NO.2所示;
α-酮酸脱羧酶包括BrKDC和SaKDC;BrKDC的氨基酸序列如SEQ ID NO.3所示,SaKDC的氨基酸序列如SEQ ID NO.4所示;
乙醛脱氢酶包括TtALDH和AoALDH;TtALDH的氨基酸序列如SEQ ID NO.5所示,AoALDH的氨基酸序列如SEQ ID NO.6所示。
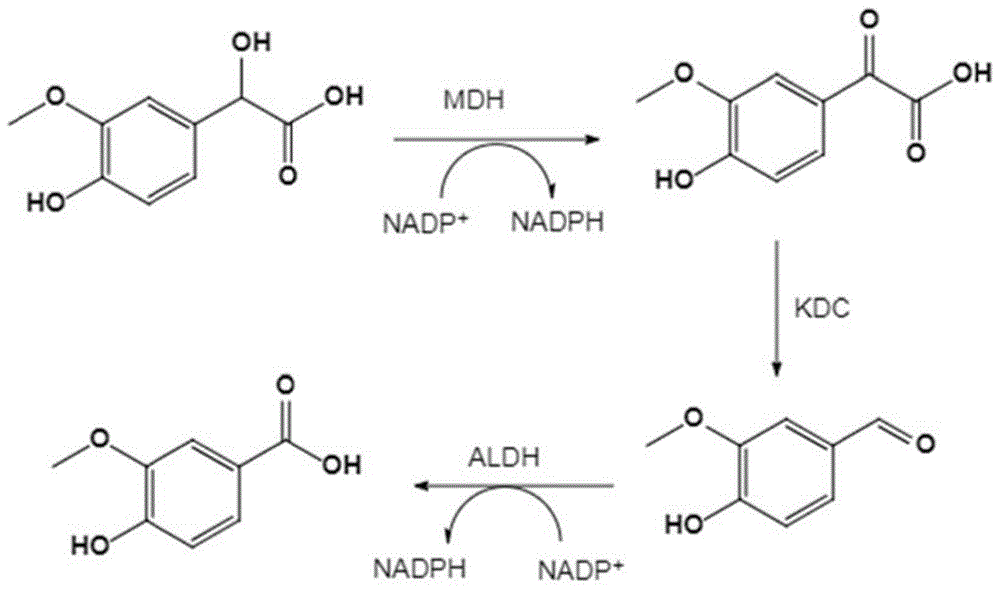
本发明首次以4-羟基-3-甲氧基扁桃酸为底物,合成4-羟基-3-甲氧基苯甲酸。具体地,利用上述重组菌表达的扁桃酸脱氢酶、α-酮酸脱羧酶和乙醛脱氢酶,将底物4-羟基-3-甲氧基扁桃酸依次转化为4-羟基-3-甲氧基苯乙醛酸和4-羟基-3-甲氧基苯甲醛后再进一步转化为4-羟基-3-甲氧基苯甲酸,反应过程中所需辅酶均可由菌体代谢葡萄糖来提供。具体的合成路线如图1所示。
在一些实施例中,上述扁桃酸脱氢酶ErMDH源自Enterobacter roggenkampii,Genbank编号KLP24925.1,其氨基酸序列如SEQ ID NO.1所示,核苷酸序列如SEQ ID NO.7所示。
在一些实施例中,上述扁桃酸脱氢酶BcMDH源自Burkholderia cepacia,Genbank编号KWD87456.1,其氨基酸序列如SEQ ID NO.2所示,核苷酸序列如SEQ ID NO.8所示。
发明人在获得扁桃酸脱氢酶ErMDH和BcMDH的氨基酸序列后,依据大肠杆菌偏好性进行密码子优化,以全合成的方法合成两条优化后的核苷酸序列。
在一些实施例中,上述α-酮酸脱羧酶BrKDC源自Bacillus rhizoplanae,Genbank编号CAG9613710.1,其氨基酸序列如SEQ ID NO.3所示,核苷酸序列如SEQ ID NO.9所示。
在一些实施例中,上述α-酮酸脱羧酶SaKDC源自Salinispora arenicola,Genbank编号GIM84875.1,其氨基酸序列如SEQ ID NO.4所示,核苷酸序列如SEQ ID NO.10所示。
发明人在获得α-酮酸脱羧酶BrKDC和RfLTA的氨基酸序列后,依据大肠杆菌偏好性进行密码子优化,以全合成的方法合成两条优化后的核苷酸序列。
在一些实施例中,上述乙醛脱氢酶TtALDH源自Thermanaeromonas toyohensis,Genbank编号SMB99042.1,其氨基酸序列如SEQ ID NO.5所示,核苷酸序列如SEQ ID NO.11所示。
在一些实施例中,上述乙醛脱氢酶AoALDH源自Azoarcus olearius,Genbank编号CAL95049.1,其氨基酸序列如SEQ ID NO.6所示,核苷酸序列如SEQ ID NO.12所示。
发明人在获得乙醛脱氢酶TtALDH和AoALDH的氨基酸序列后,依据大肠杆菌偏好性进行密码子优化,以全合成的方法合成两条优化后的核苷酸序列。
在一些实施例中,上述重组菌的构建方法为:将扁桃酸脱氢酶、α-酮酸脱羧酶和乙醛脱氢酶的基因连接到表达载体上,然后将获得的重组表达载体导入至宿主菌株中,即获得上述重组菌。
在一些实施例中,上述表达载体包括pACYCDuet-1和pETDuet-1。
在一些实施例中,上述重组菌的宿主为大肠杆菌。
在一些实施例中,上述大肠杆菌包括Escherichia coli BL21(DE3)、Escherichiacoli DH5α和Escherichia coli XL-Blue。
本发明重组的大肠杆菌通过双质粒共表达3个酶的编码基因,可选地,pACYCDuet-1装载扁桃酸脱氢酶,pETDuet-1装载α-酮酸脱羧酶和乙醛脱氢酶,然后将两个重组质粒转化到宿主菌株,得到重组工程菌。
第二方面,本发明提供了一种全细胞催化剂,其含有上述的重组菌。
第三方面,本发明提供了一种核酸分子,其编码具有将4-羟基-3-甲氧基扁桃酸转化为4-羟基-3-甲氧基苯甲酸功能的蛋白,上述核酸分子包括编码扁桃酸脱氢酶、α-酮酸脱羧酶和乙醛脱氢酶的基因;
其中扁桃酸脱氢酶包括ErMDH和BcMDH;ErMDH的核苷酸序列如SEQ ID NO.7所示,BcMDH的核苷酸序列如SEQ ID NO.8所示;
α-酮酸脱羧酶包括BrKDC和SaKDC;BrKDC的核苷酸序列如SEQ ID NO.9所示,SaKDC的核苷酸序列如SEQ ID NO.10所示;
乙醛脱氢酶包括TtALDH和AoALDH;TtALDH的核苷酸序列如SEQ ID NO.11所示,AoALDH的核苷酸序列如SEQ ID NO.12所示。
第四方面,本发明提供了一种表达载体,该表达载体携带上述核酸分子。
第五方面,本发明提供了含有权利要求上述核酸分子或表达载体的微生物细胞。
第六方面,本发明提供了上述重组菌、全细胞催化剂、核酸分子、表达载体或微生物在合成4-羟基-3-甲氧基苯甲酸及其下游产物中的应用。
第七方面,本发明提供了一种合成4-羟基-3-甲氧基苯甲酸的方法,其包括将上述重组菌加入含4-羟基-3-甲氧基扁桃酸的溶液中进行全细胞转化,获得4-羟基-3-甲氧基苯甲酸。
在一些实施例中,在进行全细胞转化前对重组菌进行诱导培养,该诱导培养过程为:将重组菌接种至含30-60mg/L氯霉素和30-60mg/L氨苄霉素的LB培养基中,培养后获得种子液,然后将种子液接种至新鲜的LB培养基中,至菌浓OD
在一些实施例中,上述重组菌的培养条件为:温度为32-38℃,转速为150-250rpm,培养时间为10-16h。
在一些实施例中,上述种子液的培养条件为:温度为32-38℃,转速为150-250rpm。
在一些实施例中,上述诱导条件为:诱导剂0.2-0.6mM IPTG,温度为25-30℃,时间为10-16h。
在一些实施例中,全细胞转化的生产体系中包括:4-羟基-3-甲氧基苯甲酸1-70g/L,葡萄糖10-100g/L,重组菌体量1-20g/L。
在一些实施例中,全细胞转化的生产体系的pH为6.0-9.0,温度为15-40℃,反应时间为6-24h。
本发明具有以下有益效果:
(1)本发明利用重组大肠杆菌底物4-羟基-3-甲氧基扁桃酸等转化为4-羟基-3-甲氧基苯甲酸,既避免了化学合成可能导致的环境污染严重、产品质量低等问题,又区别于行业常规的阿魏酸转化方式,减少了生物合成步骤,一定程度上降低了生产成本;
(2)本发明重组的大肠杆菌工程菌表达双质粒的三酶体系,在基因重组工艺上更为简单,且重组后的菌种筛选也较为容易,间接降低了生产成本;且本发明选择的酶具有活性高、光学专一性强等优势,提高了生产效率;
(3)重组菌发酵工艺简单,且反应过程不产生有害物质,既不会对后续提取纯化工艺和环境造成影响,也不会导致工程菌受损,绿色环保的同时提高了生产效率,具有良好的工业化应用前景;
(4)本发明利用重组大肠杆菌产4-羟基-3-甲氧基苯甲酸的平均摩尔转化率较高,最高可达98%以上。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1为本发明4-羟基-3-甲氧基苯甲酸的合成路线。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
本发明合成4-羟基-3-甲氧基苯甲酸的关键在于构建了一种同时表达扁桃酸脱氢酶(MDH)、α-酮酸脱羧酶(KDC)及乙醛脱氢酶(ALDH)的重组菌。该反应原理是通过MDH将4-羟基-3-甲氧基扁桃酸转化为4-羟基-3-甲氧基苯乙醛酸,再利用KDC将4-羟基-3-甲氧基苯乙醛酸转化为4-羟基-3-甲氧基苯甲醛,最后在ALDH的作用下生成4-羟基-3-甲氧基苯甲酸,反应过程中所需辅酶由菌体代谢葡萄糖来提供。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
1.菌及质粒的选择
购自Novagen公司的pACYCDuet-1质粒、pETDuet-1质粒、Escherichia coli BL21(DE3)、Escherichia coli DH5α、Escherichia coli XL-Blue。
2.酶的选择
(1)扁桃酸脱氢酶的选择
从NCBI数据库中获得扁桃酸脱氢酶ErMDH及BcMDH的氨基酸序列,依据大肠杆菌偏好性进行密码子优化,通过基因工程常规操作以全合成的方法合成一条核苷酸序列如SEQID NO.7、SEQ ID NO.8所示。编码酶的氨基酸序列如SEQ ID NO.1、SEQ ID NO.2所示。在核苷酸序列两端加入酶切位点NdeI及XhoI。
(2)α-酮酸脱羧酶的选择
从NCBI数据库中获得α-酮酸脱羧酶BrKDC及SaKDC的氨基酸序列,依据大肠杆菌偏好性进行密码子优化,通过基因工程常规操作以全合成的方法合成一条核苷酸序列如SEQID NO.9、SEQ ID NO.10所示。编码酶的氨基酸序列如SEQ ID NO.3、SEQ ID NO.4所示。在核苷酸序列两端加入酶切位点EcoRI及HindIII。
(3)乙醛脱氢酶的选择
从NCBI数据库中获得乙醛脱氢酶TtALDH及AoALDH的氨基酸序列,依据大肠杆菌偏好性进行密码子优化,通过基因工程常规操作以全合成的方法合成一条核苷酸序列如SEQID NO.11、SEQ ID NO.12所示。编码酶的氨基酸序列如SEQ ID NO.5、SEQ ID NO.6所示。在核苷酸序列两端加入酶切位点NdeI及XhoI。
3.三酶共表达体系的构建及菌体培养
将以上选择的扁桃酸脱氢酶、α-酮酸脱羧酶及乙醛脱氢酶中每类任选一个酶,进行三酶组合共表达。采用pACYCDuet-1及pETDuet-1双质粒共表达3个酶的编码基因:pACYCDuet-1装载扁桃酸脱氢酶,pETDuet-1装载α-酮酸脱羧酶及乙醛脱氢酶。得到共表达重组质粒后,将两种重组质粒同时转入大肠杆菌Escherichia coli BL21(DE3)感受态细胞中,利用含有氯霉素及氨苄霉素平板筛选得到阳性转化子,即得到重组大肠杆菌。将获得的重组菌接种至新鲜的液体培养基中,诱导培养,离心,获得湿菌体。
4.全细胞转化4-羟基-3-甲氧基扁桃酸制备4-羟基-3-甲氧基苯甲酸
转化体系:4-羟基-3-甲氧基扁桃酸浓度为1-70g/L,葡萄糖浓度10-100g/L,调节pH在6.0-9.0之间,新鲜菌体量为1-20g/L,然后于15-40℃,200rpm,转化6-24h。转化结束后液相色谱测定4-羟基-3-甲氧基苯甲酸产量。
5.样品的检测分析
通过岛津2030C高效液相色谱仪(HPLC)分析转化液,色谱条件为:流动相是甲醇:水(V/V=1:1)、采用Inertsustain C18色谱柱(4.6×250mm,5μm),流速1mL/min,柱温30℃,进样量20μL,检测波长280nm。
实施例1:重组大肠杆菌的构建
通过限制性内切酶NdeI及XhoI对全合成的MDH重组质粒及pACYCDuet-1载体分别进行酶切,通过T4DNA连接酶将MDH连接至pACYCDuet-1载体上,获得重组质粒1;通过限制性内切酶EcoRI及HindIII对全合成的KDC重组质粒及pCDFDuet-1载体分别进行双酶切、通过限制性内切酶NdeI及XhoI对全合成的ALDH重组质粒及pETDuet-1载体分别进行双酶切,通过T4DNA连接酶将不同来源的KDC及ALDH两两组合连接至pETDuet-1载体上,获得重组质粒2;将不同重组质粒1、2分别组合转化至E.coli BL21(DE3)感受态中,获得重组大肠杆菌。
实施例2:重组大肠杆菌的诱导培养
将重组大肠杆菌接种至含50mg/L氯霉素及50mg/L氨苄霉素的LB培养基中,37℃、200rpm培养12h,获得种子液。将种子液以2%的接种量接种至新鲜的LB培养基中,37℃、200rpm培养至菌浓OD
实施例3:各种重组大肠杆菌转化能力的比较
将收集完的重组大肠杆菌重悬于50mL体系中,细胞终浓度为20g/L,4-羟基-3-甲氧基扁桃酸70g/L,葡萄糖100g/L,pH8.0,于30℃条件下反应,摇床转速200rpm,转化时间为24h。转化结束后通过HPLC测定4-羟基-3-甲氧基苯甲酸的产量。
表1各种重组菌对应4-羟基-3-甲氧基苯甲酸产量的比较
根据上述表1数据可知,最优酶组的重组工程菌为E.coli BL21(DE3)/pACYCDuet-BcMDH+pETDuet-SaKDC-AoALDH。
实施例4
根据实施例2所述的诱导表达方法,将E.coli BL21(DE3)/pACYCDuet-BcMDH+pETDuet-SaKDC-AoALDH诱导表达完成后收集菌体,于50mL体系中,细胞湿重1g/L,4-羟基-3-甲氧基扁桃酸1g/L,葡萄糖10g/L,pH8.0,温度30℃,摇床转速200rpm,转化时间24h。HPLC测定结果,4-羟基-3-甲氧基苯甲酸产量为0.83g/L,平均摩尔转化率为98.16%。
实施例5
根据实施例2所述的诱导表达方法,将E.coli BL21(DE3)/pACYCDuet-BcMDH+pETDuet-SaKDC-AoALDH诱导表达完成后收集菌体,于50mL体系中,细胞湿重3g/L,4-羟基-3-甲氧基扁桃酸10g/L,葡萄糖20g/L,pH8.0,温度35℃,摇床转速200rpm,转化时间24h。HPLC测定结果,4-羟基-3-甲氧基苯甲酸产量为8.24g/L,平均摩尔转化率为97.13%。
实施例6
根据实施例2所述的诱导表达方法,将E.coli BL21(DE3)/pACYCDuet-BcMDH+pETDuet-SaKDC-AoALDH诱导表达完成后收集菌体,于50mL体系中,细胞湿重5g/L,4-羟基-3-甲氧基扁桃酸16g/L,葡萄糖30g/L,pH8.0,温度30℃,摇床转速200rpm,转化时间24h。HPLC测定结果,4-羟基-3-甲氧基苯甲酸产量为13.13g/L,平均摩尔转化率为96.71%。
实施例7
根据实施例2所述的诱导表达方法,将E.coli BL21(DE3)/pACYCDuet-BcMDH+pETDuet-SaKDC-AoALDH诱导表达完成后收集菌体,于50mL体系中,细胞湿重8g/L,4-羟基-3-甲氧基扁桃酸27g/L,葡萄糖40g/L,pH8.0,温度30℃,摇床转速200rpm,转化时间24h。HPLC测定结果,4-羟基-3-甲氧基苯甲酸产量为22.63g/L,平均摩尔转化率为98.80%。
实施例8
根据实施例2所述的诱导表达方法,将E.coli BL21(DE3)/pACYCDuet-BcMDH+pETDuet-SaKDC-AoALDH诱导表达完成后收集菌体,于50mL体系中,细胞湿重10g/L,4-羟基-3-甲氧基扁桃酸35g/L,葡萄糖50g/L,pH8.0,温度30℃,摇床转速200rpm,转化时间24h。HPLC测定结果,4-羟基-3-甲氧基苯甲酸产量为29.20g/L,平均摩尔转化率为98.32%。
实施例9
根据实施例2所述的诱导表达方法,将E.coli BL21(DE3)/pACYCDuet-BcMDH+pETDuet-SaKDC-AoALDH诱导表达完成后收集菌体,于50mL体系中,细胞湿重15g/L,4-羟基-3-甲氧基扁桃酸50g/L,葡萄糖70g/L,pH8.0,温度30℃,摇床转速200rpm,转化时间24h。HPLC测定结果,4-羟基-3-甲氧基苯甲酸产量为41.35g/L,平均摩尔转化率为97.46%。
实施例10
根据实施例2所述的诱导表达方法,将E.coli BL21(DE3)/pACYCDuet-BcMDH+pETDuet-SaKDC-AoALDH诱导表达完成后收集菌体,于50mL体系中,细胞湿重18g/L,4-羟基-3-甲氧基扁桃酸60g/L,葡萄糖80g/L,pH8.0,温度30℃,摇床转速200rpm,转化时间24h。HPLC测定结果,4-羟基-3-甲氧基苯甲酸产量为49.68g/L,平均摩尔转化率为97.58%。
实施例11
根据实施例2所述的诱导表达方法,将E.coli BL21(DE3)/pACYCDuet-BcMDH+pETDuet-SaKDC-AoALDH诱导表达完成后收集菌体,于50mL体系中,细胞湿重20g/L,4-羟基-3-甲氧基扁桃酸35g/L,葡萄糖50g/L,pH8.0,温度30℃,摇床转速200rpm,转化时间12h。HPLC测定结果,4-羟基-3-甲氧基苯甲酸产量为29.49g/L,平均摩尔转化率为99.31%。
实施例12
根据实施例2所述的诱导表达方法,将E.coli BL21(DE3)/pACYCDuet-BcMDH+pETDuet-SaKDC-AoALDH诱导表达完成后收集菌体,于50mL体系中,细胞湿重20g/L,4-羟基-3-甲氧基扁桃酸15g/L,葡萄糖30g/L,pH8.0,温度30℃,摇床转速200rpm,转化时间6h。HPLC测定结果,4-羟基-3-甲氧基苯甲酸产量为12.35g/L,平均摩尔转化率为97.00%。
实施例13
根据实施例2所述的诱导表达方法,将E.coli BL21(DE3)/pACYCDuet-BcMDH+pETDuet-SaKDC-AoALDH诱导表达完成后收集菌体,于50mL体系中,细胞湿重15g/L,4-羟基-3-甲氧基扁桃酸15g/L,葡萄糖30g/L,pH8.0,温度30℃,摇床转速200rpm,转化时间8h。HPLC测定结果,4-羟基-3-甲氧基苯甲酸产量为12.54g/L,平均摩尔转化率为98.54%。
实施例14
根据实施例2所述的诱导表达方法,将E.coli BL21(DE3)/pACYCDuet-BcMDH+pETDuet-SaKDC-AoALDH诱导表达完成后收集菌体,于50mL体系中,细胞湿重12g/L,4-羟基-3-甲氧基扁桃酸25g/L,葡萄糖50g/L,pH8.0,温度30℃,摇床转速200rpm,转化时间15h。HPLC测定结果,4-羟基-3-甲氧基苯甲酸产量为20.77g/L,平均摩尔转化率为97.93%。
实施例15
根据实施例2所述的诱导表达方法,将E.coli BL21(DE3)/pACYCDuet-BcMDH+pETDuet-SaKDC-AoALDH诱导表达完成后收集菌体,于50mL体系中,细胞湿重10g/L,4-羟基-3-甲氧基扁桃酸15g/L,葡萄糖35g/L,pH6.0,温度35℃,摇床转速200rpm,转化时间12h。HPLC测定结果,4-羟基-3-甲氧基苯甲酸产量为12.44g/L,平均摩尔转化率为97.77%。
实施例16
根据实施例2所述的诱导表达方法,将E.coli BL21(DE3)/pACYCDuet-BcMDH+pETDuet-SaKDC-AoALDH诱导表达完成后收集菌体,于50mL体系中,细胞湿重15g/L,4-羟基-3-甲氧基扁桃酸25g/L,葡萄糖40g/L,pH7.0,温度35℃,摇床转速200rpm,转化时间12h。HPLC测定结果,4-羟基-3-甲氧基苯甲酸产量为20.48g/L,平均摩尔转化率为96.54%。
实施例17
根据实施例2所述的诱导表达方法,将E.coli BL21(DE3)/pACYCDuet-BcMDH+pETDuet-SaKDC-AoALDH诱导表达完成后收集菌体,于50mL体系中,细胞湿重13g/L,4-羟基-3-甲氧基扁桃酸20g/L,葡萄糖35g/L,pH7.5,温度35℃,摇床转速200rpm,转化时间12h。HPLC测定结果,4-羟基-3-甲氧基苯甲酸产量为16.56g/L,平均摩尔转化率为97.58%。
实施例18
根据实施例2所述的诱导表达方法,将E.coli BL21(DE3)/pACYCDuet-BcMDH+pETDuet-SaKDC-AoALDH诱导表达完成后收集菌体,于50mL体系中,细胞湿重7g/L,4-羟基-3-甲氧基扁桃酸10g/L,葡萄糖20g/L,pH8.5,温度35℃,摇床转速200rpm,转化时间12h。HPLC测定结果,4-羟基-3-甲氧基苯甲酸产量为8.42g/L,平均摩尔转化率为99.23%。
实施例19
根据实施例2所述的诱导表达方法,将E.coli BL21(DE3)/pACYCDuet-BcMDH+pETDuet-SaKDC-AoALDH诱导表达完成后收集菌体,于50mL体系中,细胞湿重4g/L,4-羟基-3-甲氧基扁桃酸5g/L,葡萄糖10g/L,pH9.0,温度35℃,摇床转速200rpm,转化时间12h。HPLC测定结果,4-羟基-3-甲氧基苯甲酸产量为4.14g/L,平均摩尔转化率为97.54%。
实施例20
根据实施例2所述的诱导表达方法,将E.coli BL21(DE3)/pACYCDuet-BcMDH+pETDuet-SaKDC-AoALDH诱导表达完成后收集菌体,于50mL体系中,细胞湿重16g/L,4-羟基-3-甲氧基扁桃酸50g/L,葡萄糖75g/L,pH7.5,温度15℃,摇床转速200rpm,转化时间24h。HPLC测定结果,4-羟基-3-甲氧基苯甲酸产量为41.65g/L,平均摩尔转化率为98.16%。
实施例21
根据实施例2所述的诱导表达方法,将E.coli BL21(DE3)/pACYCDuet-BcMDH+pETDuet-SaKDC-AoALDH诱导表达完成后收集菌体,于50mL体系中,细胞湿重10g/L,4-羟基-3-甲氧基扁桃酸30g/L,葡萄糖60g/L,pH7.5,温度25℃,摇床转速200rpm,转化时间24h。HPLC测定结果,4-羟基-3-甲氧基苯甲酸产量为24.79g/L,平均摩尔转化率为97.39%。
实施例22
根据实施例2所述的诱导表达方法,将E.coli BL21(DE3)/pACYCDuet-BcMDH+pETDuet-SaKDC-AoALDH诱导表达完成后收集菌体,于50mL体系中,细胞湿重11g/L,4-羟基-3-甲氧基扁桃酸35g/L,葡萄糖60g/L,pH7.5,温度40℃,摇床转速200rpm,转化时间24h。HPLC测定结果,4-羟基-3-甲氧基苯甲酸产量为28.91g/L,平均摩尔转化率为97.33%。
对比例1
根据实施例2所述的诱导表达方法,将E.coli BL21(DE3)/pACYCDuet-BcMDH+pETDuet-SaKDC-AoALDH诱导表达完成后收集菌体,于50mL体系中,细胞湿重30g/L,4-羟基-3-甲氧基扁桃酸80g/L,葡萄糖110g/L,pH7.5,温度35℃,摇床转速200rpm,转化时间36h。HPLC测定结果,4-羟基-3-甲氧基苯甲酸产量为8.92g/L,平均摩尔转化率为13.14%。
对比例2
根据实施例2所述的诱导表达方法,将E.coli BL21(DE3)/pACYCDuet-BcMDH+pETDuet-SaKDC-AoALDH诱导表达完成后收集菌体,于50mL体系中,细胞湿重25g/L,4-羟基-3-甲氧基扁桃酸40g/L,葡萄糖100g/L,pH5.5,温度35℃,摇床转速200rpm,转化时间36h。HPLC测定结果,4-羟基-3-甲氧基苯甲酸产量为3.72g/L,平均摩尔转化率为10.97%。
对比例3
根据实施例2所述的诱导表达方法,将E.coli BL21(DE3)/pACYCDuet-BcMDH+pETDuet-SaKDC-AoALDH诱导表达完成后收集菌体,于50mL体系中,细胞湿重15g/L,4-羟基-3-甲氧基扁桃酸55g/L,葡萄糖110g/L,pH9.5,温度35℃,摇床转速200rpm,转化时间36h。HPLC测定结果,4-羟基-3-甲氧基苯甲酸产量为8.23g/L,平均摩尔转化率为17.64%。
对比例4
根据实施例2所述的诱导表达方法,将E.coli BL21(DE3)/pACYCDuet-BcMDH+pETDuet-SaKDC-AoALDH诱导表达完成后收集菌体,于50mL体系中,细胞湿重20g/L,4-羟基-3-甲氧基扁桃酸40g/L,葡萄糖100g/L,pH7.5,温度10℃,摇床转速200rpm,转化时间36h。HPLC测定结果,4-羟基-3-甲氧基苯甲酸产量为4.21g/L,平均摩尔转化率为12.41%。
对比例5
根据实施例2所述的诱导表达方法,将E.coli BL21(DE3)/pACYCDuet-BcMDH+pETDuet-SaKDC-AoALDH诱导表达完成后收集菌体,于50mL体系中,细胞湿重30g/L,4-羟基-3-甲氧基扁桃酸50g/L,葡萄糖110g/L,pH8.0,温度45℃,摇床转速200rpm,转化时间36h。HPLC测定结果,4-羟基-3-甲氧基苯甲酸产量为6.67g/L,平均摩尔转化率为15.71%。
对比例6
根据实施例2所述的诱导表达方法,将E.coli BL21(DE3)/pACYCDuet-BcMDH+pETDuet-SaKDC-AoALDH诱导表达完成后收集菌体,于50mL体系中,细胞湿重0.5g/L,4-羟基-3-甲氧基扁桃酸0.5g/L,葡萄糖5g/L,pH8.0,温度30℃,摇床转速200rpm,转化时间36h。HPLC测定结果,4-羟基-3-甲氧基苯甲酸产量为0.07g/L,平均摩尔转化率为16.17%。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 一种双切圆两段式干煤粉加压气化炉及其气化方法
- 一种气化煤灰在煤粉炉掺烧的方法及系统
- 一种煤粉炉掺烧气化煤灰工艺及系统
