1-4-(4-(4-丙基环己基))-1-烯-环己基-4-三氟甲基苯的制备方法
文献发布时间:2024-04-18 20:00:50
技术领域
本发明涉及有机合成技术领域,具体而言,涉及一种1-[4-(4-(4-丙基环己基))-1-烯-环己基]-4-三氟甲基苯的制备方法。
背景技术
液晶技术在生活中的应用日益增多,对于液晶材料的需求也日益增加。目前制备1-[4-(4-(4-丙基环己基))-1-烯-环己基]-4-三氟甲基苯液晶单体的类似技术路线如下所示,此路线以4-(4-(4-丙基环己基))-1-环己酮为原料,经格氏偶联制得中间体醇,再经过脱水制得目标产物,总收率约为80%,GC纯度约为99.2%,收率和纯度较低,且会产生大量的酸性废水需要进行无害化处理,环境污染较大。
发明内容
本发明的主要目的在于提供一种1-[4-(4-(4-丙基环己基))-1-烯-环己基]-4-三氟甲基苯的制备方法,以解决现有技术中1-[4-(4-(4-丙基环己基))-1-烯-环己基]-4-三氟甲基苯的制备路线复杂、收率和纯度较低、环境污染较大的问题。
为了实现上述目的,根据本发明的一个方面,提供了一种1-[4-(4-(4-丙基环己基))-1-烯-环己基]-4-三氟甲基苯的制备方法,将4-三氟甲基苯硼酸与4-(4-(4-丙基环己基))-1-环己酮在镍催化剂的作用下进行偶联反应,得到1-[4-(4-(4-丙基环己基))-1-烯-环己基]-4-三氟甲基苯。
进一步地,4-三氟甲基苯硼酸与4-(4-(4-丙基环己基))-1-环己酮的摩尔比为(1.05~1.15):1,优选为(1.08~1.12):1。
进一步地,偶联反应还使用镍催化剂配体;优选地,镍催化剂为3-[3-(3-二苯基膦酰丙基亚氨基)丁-2-亚基氨基]丙基二苯基膦镍;优选地,镍催化剂配体为1,1-双(二苯基膦)二茂铁。
进一步地,按摩尔百分比计,镍催化剂为4-(4-(4-丙基环己基))-1-环己酮的0.5~1.5mol%;和/或镍催化剂配体为4-(4-(4-丙基环己基))-1-环己酮的1.5~2.5mol%。
进一步地,镍催化剂与镍催化剂配体的摩尔比为(0.4~0.6):1。
进一步地,偶联反应在溶液环境中进行,溶剂为甲苯;优选地,溶剂与4-(4-(4-丙基环己基))-1-环己酮的摩尔比为(9.5~10):1;优选地,溶液环境的pH为6~8。
进一步地,溶液环境还包括水;优选地,水与4-(4-(4-丙基环己基))-1-环己酮的摩尔比为(0.05~0.15):1。
进一步地,偶联反应在惰性气体环境中进行,惰性气体包括氮气、氦气和氩气的一种或多种。
进一步地,偶联反应的温度为100~120℃,时间为1~3h;优选地,偶联反应的温度为105~115℃,时间为1.5~3h。
进一步地,在偶联反应完成之后,制备方法还包括纯化步骤,纯化步骤包括:将反应体系降温至20~30℃,依次进行水洗、柱吸附和减压浓缩,得到粗品;将粗品依次进行醇洗、过滤和烘干,得到1-[4-(4-(4-丙基环己基))-1-烯-环己基]-4-三氟甲基苯。
应用本发明的技术方案,以4-三氟甲基苯硼酸为原料,在镍催化剂的作用下,直接与4-(4-(4-丙基环己基))-1-环己酮发生偶联反应,即得1-[4-(4-(4-丙基环己基))-1-烯-环己基]-4-三氟甲基苯。本发明的“一锅法”制备方法的原料廉价易得,操作简单,反应条件相对温和,制备得到的产物总收率和纯度较高,而且不会产生大量的酸性废水,是一种环境友好的新型制备方法。
附图说明
构成本申请的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
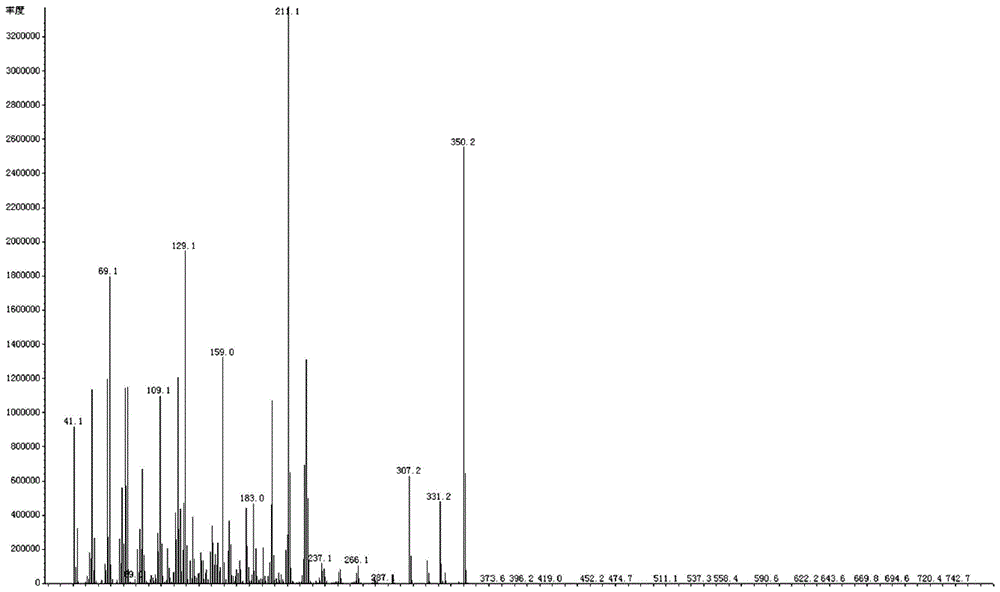
图1示出了根据本发明实施例1的产物GC-MS谱图。
具体实施方式
需要说明的是,在不冲突的情况下,本申请中的实施例及实施例中的特征可以相互组合。下面将参考附图并结合实施例来详细说明本发明。
正如本发明背景技术中所述,现有技术中存在1-[4-(4-(4-丙基环己基))-1-烯-环己基]-4-三氟甲基苯的制备路线复杂、收率和纯度较低、环境污染较大的问题。为了解决上述问题,在本发明一种典型的实施方式中,提供了一种1-[4-(4-(4-丙基环己基))-1-烯-环己基]-4-三氟甲基苯的制备方法,将4-三氟甲基苯硼酸与4-(4-(4-丙基环己基))-1-环己酮在镍催化剂的作用下进行偶联反应,得到1-[4-(4-(4-丙基环己基))-1-烯-环己基]-4-三氟甲基苯。
本发明的反应不需要在酸性条件下进行,一种可能的反应机理是镍催化剂与环己酮中的氧原子络合活化,苯硼酸作为亲核试剂进攻活性中间体,发生亲核取代反应,再脱去一分子硼酸后得到偶联产物1-[4-(4-(4-丙基环己基))-1-烯-环己基]-4-三氟甲基苯。上述“一锅法”制备方法使用的4-(4-(4-丙基环己基))-1-环己酮与4-三氟甲基苯硼酸为容易购得的常用化学品,价格低廉,其成本与供应上具有优势。在实际操作中,本发明的方法操作相对简单,反应条件相对温和,制备得到的产物总收率可以达到79%甚至85%以上,纯度可以达到98%甚至99.5%以上,可以作为液晶单体进行应用。而且本发明的制备方法不会产生大量的酸性废水,对环境更加友好。
在一种优选的实施方式中,4-三氟甲基苯硼酸与4-(4-(4-丙基环己基))-1-环己酮的摩尔比(摩尔数之比)为(1.05~1.15):1,优选为(1.08~1.12):1。4-三氟甲基苯硼酸与4-(4-(4-丙基环己基))-1-环己酮的摩尔比包括但不限于上述范围,而将其限定在上述范围内有利于提高4-(4-(4-丙基环己基))-1-环己酮的反应活性和利用率,从而进一步提高目标产物的收率。
为进一步提高催化效果,在一种优选的实施方式中,偶联反应还使用镍催化剂配体;优选地,镍催化剂为3-[3-(3-二苯基膦酰丙基亚氨基)丁-2-亚基氨基]丙基二苯基膦镍;优选地,镍催化剂配体为1,1-双(二苯基膦)二茂铁,以实现与镍催化剂的最佳配合。上述镍催化剂和配体具有更加优异的催化活性、催化选择性,有利于亲核取代反应的速率的提高,且副产物得以进一步减少,从而高效选择性合成目标化合物,提高产物纯度。
考虑到成本、催化效率等综合因素,在一种优选的实施方式中,按摩尔百分比计,镍催化剂为4-(4-(4-丙基环己基))-1-环己酮的0.5~1.5mol%,镍催化剂与4-(4-(4-丙基环己基))-1-环己酮的摩尔数之比包括但不限于上述范围,而将其限定在上述范围内有利于提供足够量的镍催化剂,以高效地利用4-三氟甲基苯硼酸和4-(4-(4-丙基环己基))-1-环己酮合成1-[4-(4-(4-丙基环己基))-1-烯-环己基]-4-三氟甲基苯,从而提高产率,又不至于催化剂过多导致催化剂的浪费。基于相似的理由,进一步优选镍催化剂配体为4-(4-(4-丙基环己基))-1-环己酮的1.5~2.5mol%。
为进一步充分发挥镍催化剂的催化活性,在一种优选的实施方式中,镍催化剂与镍催化剂配体的摩尔比为(0.4~0.6):1。
在一种优选的实施方式中,偶联反应在溶液环境中进行,溶剂为甲苯,对原料的溶解性更佳;优选地,溶剂与4-(4-(4-丙基环己基))-1-环己酮的摩尔比为(9.5~10):1,从而可以提供更适宜的液体环境,使得反应原料更充分接触发生反应,提高产物收率。优选地,溶液环境的pH为6~8,可以进一步避免制备方法产生酸性废水污染环境,提高制备方法的环境友好性。
在一种优选的实施方式中,溶液环境还包括水,水的存在可以加速反应的进行,进一步提高反应速率;实际过程中发现微量的水就可以起到较好的加速效果,优选地,水与4-(4-(4-丙基环己基))-1-环己酮的摩尔比为(0.05~0.15):1。
为进一步减少副反应的发生,从而进一步提高产物纯度,在一种优选的实施方式中,偶联反应在惰性气体环境中进行,惰性气体包括氮气、氦气和氩气的一种或多种。
在一种优选的实施方式中,偶联反应的温度为100~120℃,时间为1~3h;该温度下原料和镍催化剂的活性较高,有利于使得4-三氟甲基苯硼酸和4-(4-(4-丙基环己基))-1-环己酮充分转化成1-[4-(4-(4-丙基环己基))-1-烯-环己基]-4-三氟甲基苯,同时可以更好地避免高温下的激烈反应难以控制,又尽可能地提高了反应效率,从而提高产物收率。为了进一步精确控制亲核取代偶联反应的效率,优选地,偶联反应的温度为105~115℃,时间为1.5~3h。
出于进一步提高产物纯度的目的,在一种优选的实施方式中,在偶联反应完成之后,制备方法还包括纯化步骤,纯化步骤包括:将反应体系降温至20~30℃,依次进行水洗、柱吸附和减压浓缩,得到粗品;将粗品依次进行醇洗、过滤和烘干,得到1-[4-(4-(4-丙基环己基))-1-烯-环己基]-4-三氟甲基苯,同时能够进一步实现溶剂回收利用,减少物料浪费和环境污染。
典型的但非限定性的,4-三氟甲基苯硼酸与4-(4-(4-丙基环己基))-1-环己酮的摩尔比为1.05:1、1.06:1、1.07:1、1.08:1、1.09:1、1.10:1、1.11:1、1.12:1、1.13:1、1.14:1、1.15:1或其任意两个数值组成的范围值。
典型的但非限定性的,按摩尔百分比计,镍催化剂为4-(4-(4-丙基环己基))-1-环己酮的0.5mol%、0.6mol%、0.7mol%、0.8mol%、0.9mol%、1.0mol%、1.1mol%、1.2mol%、1.3mol%、1.4mol%、1.5mol%或其任意两个数值组成的范围值;镍催化剂配体为4-(4-(4-丙基环己基))-1-环己酮的1.5mol%、1.6mol%、1.7mol%、1.8mol%、1.9mol%、2.0mol%、2.1mol%、2.2mol%、2.3mol%、2.4mol%、2.5mol%或其任意两个数值组成的范围值。
典型的但非限定性的,镍催化剂与镍催化剂配体的摩尔比为0.4:1、0.45:1、0.5:1、0.55:1、0.6:1或其任意两个数值组成的范围值。
典型的但非限定性的,溶剂与4-(4-(4-丙基环己基))-1-环己酮的摩尔比为9.5:1、9.6:1、9.7:1、9.8:1、9.9:1、10:1或其任意两个数值组成的范围值;水与4-(4-(4-丙基环己基))-1-环己酮的摩尔比为0.05:1、0.06:1、0.07:1、0.08:1、0.09:1、0.10:1、0.11:1、0.12:1、0.13:1、0.14:1、0.15:1或其任意两个数值组成的范围值。
典型的但非限定性的,偶联反应的温度为100℃、105℃、110℃、115℃、120℃或其任意两个数值组成的范围值,时间为1h、1.5h、2h、2.5h、3h或其任意两个数值组成的范围值。
以下结合具体实施例对本申请作进一步详细描述,这些实施例不能理解为限制本申请所要求保护的范围。
实施例1
向1L三口瓶中加入123.3g 4-(4-(4-丙基环己基))-1-环己酮,116.2g 4-三氟甲基苯硼酸,500g甲苯,1g纯水,惰性气体保护下,加入3.33g 3-[3-(3-二苯基膦酰丙基亚氨基)丁-2-亚基氨基]丙基二苯基膦镍,6.17g 1,1-双(二苯基膦)二茂铁,加入完毕,中性体系在110℃回流搅拌反应1.5小时至中控合格。合格后体系降至室温,170g水洗两次,经过30g硅胶柱吸附,减压浓缩得到粗品,粗品加入600g乙醇冷冻洗涤,过滤烘干得目标产物166.3g,收率85.5%,GC纯度99.6%,mp 116.8~121.1℃,产物GC-MS谱图见图1。
实施例2
向2L三口瓶中加入222g 4-(4-(4-丙基环己基))-1-环己酮,209g 4-三氟甲基苯硼酸,900g甲苯,1.8g纯水,惰性气体保护下,加入5.98g 3-[3-(3-二苯基膦酰丙基亚氨基)丁-2-亚基氨基]丙基二苯基膦镍,11.09g 1,1-双(二苯基膦)二茂铁,加入完毕,中性体系在110℃回流搅拌反应2小时至中控合格。合格后体系降至室温,300g水洗两次,经过50g硅胶柱吸附,减压浓缩得到粗品,粗品加入1000g乙醇冷冻洗涤,过滤烘干得目标产物301.7g,收率86.2%,GC纯度99.7%。
实施例3
向5L三口瓶中加入500g 4-(4-(4-丙基环己基))-1-环己酮,470.5g 4-三氟甲基苯硼酸,2000g甲苯,4g纯水,惰性气体保护下,加入13.44g 3-[3-(3-二苯基膦酰丙基亚氨基)丁-2-亚基氨基]丙基二苯基膦镍,25g 1,1-双(二苯基膦)二茂铁,加入完毕,中性体系在110℃回流搅拌反应3小时至中控合格。合格后体系降至室温,600g水洗两次,经过120g硅胶柱吸附,减压浓缩得到粗品,粗品加入2350g乙醇冷冻洗涤,过滤烘干得目标产物682.3g,收率86.6%,GC纯度99.6%。
实施例4
与实施例1的区别在于,4-三氟甲基苯硼酸与4-(4-(4-丙基环己基))-1-环己酮的摩尔比为1.05:1。
实施例5
与实施例1的区别在于,4-三氟甲基苯硼酸与4-(4-(4-丙基环己基))-1-环己酮的摩尔比为1.08:1。
实施例6
与实施例1的区别在于,4-三氟甲基苯硼酸与4-(4-(4-丙基环己基))-1-环己酮的摩尔比为1.12:1。
实施例7
与实施例1的区别在于,4-三氟甲基苯硼酸与4-(4-(4-丙基环己基))-1-环己酮的摩尔比为1.15:1。
实施例8
与实施例1的区别在于,3-[3-(3-二苯基膦酰丙基亚氨基)丁-2-亚基氨基]丙基二苯基膦镍为4-(4-(4-丙基环己基))-1-环己酮的0.5mol%,1,1-双(二苯基膦)二茂铁为4-(4-(4-丙基环己基))-1-环己酮的1.5mol%。
实施例9
与实施例1的区别在于,3-[3-(3-二苯基膦酰丙基亚氨基)丁-2-亚基氨基]丙基二苯基膦镍为4-(4-(4-丙基环己基))-1-环己酮的1.5mol%,1,1-双(二苯基膦)二茂铁为4-(4-(4-丙基环己基))-1-环己酮的2.5mol%。
实施例10
与实施例1的区别在于,3-[3-(3-二苯基膦酰丙基亚氨基)丁-2-亚基氨基]丙基二苯基膦镍与1,1-双(二苯基膦)二茂铁的摩尔比为0.4:1。
实施例11
与实施例1的区别在于,3-[3-(3-二苯基膦酰丙基亚氨基)丁-2-亚基氨基]丙基二苯基膦镍与1,1-双(二苯基膦)二茂铁的摩尔比为0.6:1。
实施例12
与实施例1的区别在于,甲苯与4-(4-(4-丙基环己基))-1-环己酮的摩尔比为9.5:1;水与4-(4-(4-丙基环己基))-1-环己酮的摩尔比为0.05:1。
实施例13
与实施例1的区别在于,甲苯与4-(4-(4-丙基环己基))-1-环己酮的摩尔比为10:1;水与4-(4-(4-丙基环己基))-1-环己酮的摩尔比为0.15:1。
实施例14
与实施例1的区别在于,偶联反应的温度为100℃,时间为3h。
实施例15
与实施例1的区别在于,偶联反应的温度为105℃,时间为3h。
实施例16
与实施例1的区别在于,偶联反应的温度为115℃,时间为1.5h。
实施例17
与实施例1的区别在于,偶联反应的温度为120℃,时间为1h。
对比例1
用300ml干燥的四氢呋喃溶解33.3g的4-(4-(4-丙基环己基))-1-环己酮备用;用350ml干燥的四氢呋喃溶解37.3g的4-三氟甲基溴苯备用;1L三口瓶中加入镁条4.4g,2~3粒碘,干燥的四氢呋喃50ml,充分氮气置换后,先加入约30ml的4-三氟甲基溴苯的四氢呋喃溶液室温20~25℃引发,成功引发后,控温20~25℃缓慢滴加剩余的4-三氟甲基溴苯的四氢呋喃溶液,加完后保温10反应10分钟,滤去体系中剩余的镁;控温40~45℃,向体系中滴加4-(4-(4-丙基环己基))-1-环己酮的四氢呋喃溶液,中控合格后,在80~90℃常压蒸馏四氢呋喃,蒸馏出大部分四氢呋喃。将反应液冷却至室温(20~30℃),将反应液慢慢倒入0.2L盐酸与1L冰水配好的稀盐酸溶液中水解,控温15~25℃。倒完后搅拌、静置、分液。水相用500ml×2甲苯萃取两次,合并有机层,有机层用500ml×2饱和食盐水洗两遍至中性。
向2L三口瓶中加入1L浓缩液、5g对甲苯磺酸、0.5g BHT,升温至110℃,反应液回流,用分水器分水。控制回流速度,3h后开始取样,约分出2g水,搅拌至温度降到室温。搅拌下向反应液中加入300ml纯水,搅拌,静置后分出下层水相,上层有机相再加入300ml纯水搅拌,静置后分液,合并水相用300mL甲苯萃取一次,将两次所得有机相合并用300ml×3饱和盐水洗3遍,弃去水相。有机相经过50g硅胶柱吸附,减压浓缩得到粗品,粗品加入100g乙醇冷冻洗涤,过滤烘干得目标产物38g,收率75.1%,GC纯度98.0%。
上述实施例和对比例制备得到的1-[4-(4-(4-丙基环己基))-1-烯-环己基]-4-三氟甲基苯的收率和纯度数据见表1。
表1
由上可知,与对比例相比,本发明各实施例以4-三氟甲基苯硼酸为原料,在镍催化剂的作用下,直接与4-(4-(4-丙基环己基))-1-环己酮发生偶联反应,即得1-[4-(4-(4-丙基环己基))-1-烯-环己基]-4-三氟甲基苯。本发明的“一锅法”制备方法的原料廉价易得,操作简单,反应条件相对温和,制备得到的产物总收率和纯度较高,而且不会产生大量的酸性废水,是一种环境友好的新型制备方法。此外可以看出,当各工艺参数均在本发明优选范围之内时,制备得到的产物收率和纯度更佳。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 纤维集合体,使用此集合体作为吸油材料以及纤维集合体的制造方法
- 碳纤维集合体及其制造方法
- 碳纤维集合体及其制造方法
