一株发酵粘液乳杆菌DACN8320及其在预防/治疗相关神经退行性病变中的应用
文献发布时间:2024-05-31 01:29:11
技术领域
本发明涉及微生物技术领域,具体涉及一株发酵粘液乳杆菌DACN8320及其在预防/治疗相关神经退行性病变中的应用。
背景技术
人的一生大约三分之一都在睡觉。随着现代生活的快节奏,睡眠剥夺已成为困扰全球健康的问题,睡眠不足会导致各种疾病,例如记忆力减退、认知障碍和免疫力下降等。睡眠剥夺(sleep deprivation,SD)是指个体睡眠时间未能满足机体为了保持清醒和警觉所需的睡眠时间。造成睡眠剥夺的原因非常多,比如不良的睡眠习惯、昼夜紊乱、睡眠障碍、使用药物或者电子设备的使用等。值得注意的是,睡眠剥夺与心血管疾病、呼吸系统疾病、神经系统疾病、胃肠疾病、遗传与免疫反应、皮肤病和肌肉骨骼疾病、代谢和内分泌紊乱内分泌和生殖健康等疾病有着密切的联系,甚至妊娠晚期的睡眠剥夺还会诱发后代高血压以及子代菌群紊乱和神经炎症。
睡眠剥夺对认知功能的严重不良影响是一个备受关注的领域。认知障碍是指各种认知功能下降,包括但不限于记忆力、学习能力和视空间能力等,属于一种神经系统逐渐衰退的病变。研究普遍认为,睡眠剥夺会导致反应速度减缓、警觉性和注意力减弱,而这些因素都是清醒认知的基本要素。此外,睡眠剥夺还会影响高级认知功能,如情感调节、记忆巩固和执行功能等。张如意等指出,睡眠剥夺可降低T细胞、B细胞和淋巴细胞亚群功能,改变免疫球蛋白水平,从而广泛影响免疫系统。睡眠剥夺能通过激活中枢和外周免疫炎症细胞(如小胶质细胞、星形胶质细胞、巨噬细胞等)而增加炎症因子水平,加重神经损伤。而外周炎症因子(如IL-1β、IL-6、TNF-α)可通过受损的血脑屏障主动渗入中枢神经系统加剧神经炎症,加重认知功能损害。Tancredi等也指出,炎症因子IL-6的升高可损害突触可塑性,进一步影响认知功能。
根据联合国粮食及农业组织(FAO)和世界卫生组织(WHO)的说法,益生菌被定义为活的微生物,当以足够的量施用时,会给宿主带来健康益处。益生菌具有重要的功能属性,可以满足我们大部分基本的营养和临床补充要求。大量的研究表明益生菌具有调节肠道菌群、抗炎、保护肠道屏障以及对大脑相关功能(认知、记忆以及学习)也有保护作用。所以,使用益生菌来缓解睡眠剥夺导致的危害是有理论支撑的。目前用于睡眠剥夺干预或者改善睡眠的菌株主要包括双歧杆菌、副干酪乳杆菌、植物乳杆菌、短乳杆菌等。但是很少调查益生菌补充剂对缓解睡眠剥夺造成的危害的影响,尤其是益生菌对睡眠剥夺认知障碍的影响方面。因此,益生菌对睡眠剥夺认知障碍的缓解作用这一方面值得深入研究。
发明内容
本发明的目的是针对上述问题,提供一株发酵粘液乳杆菌DACN8320及其在预防/治疗相关神经退行性病变中的应用。
本发明为了实现其目的,采用的技术方案是:
一株发酵粘液乳杆菌(Limosilactobacillusfermentun)DACN8320,在中国典型培养物保藏中心进行保藏,其保藏编号为CCTCCNO:M 20232332。
一种菌剂,其活性成分包含上述的发酵粘液乳杆菌DACN8320或DACN8320的发酵液。
优选地,所述菌剂为冷冻干燥粉剂。
上述的发酵粘液乳杆菌DACN8320或上述的菌剂在制备用于预防和/或治疗神经退行性病变的药品中的应用。
上述的发酵粘液乳杆菌DACN8320或上述的菌剂作为功能性益生菌在制备食品、食品添加剂、保健品或饲料中的应用。
在上述的应用技术方案中,所述功能性益生菌预防和/或缓解神经退行性病变。
在上述的应用技术方案中,所述神经退行性病变包括认知障碍。
在上述的应用技术方案中,所述认知障碍指睡眠剥夺所致的认知障碍。
一种产品,其活性成分为上述的发酵粘液乳杆菌DACN8320或权上述的菌剂,所述产品的用途为如下任意一种:
(1)预防和/或缓解和/或治疗神经退行性病变;
(2)作为功能性益生菌应用到食品、食品添加剂、保健品、药品或饲料中。
在上述的产品技术方案中,所述神经退行性病变包括认知障碍,优选睡眠剥夺所致的认知障碍。
本发明的有益效果是:经本发明实验研究证实,发酵粘液乳杆菌DACN8320是一株具有耐酸、胆盐和体外抗氧化活性等较好的益生特性以及体外生物安全性的益生菌菌株。在睡眠剥夺小鼠模型试验中,服用补充DACN8320能够显著缓解睡眠剥度小鼠的认知障碍,评估指标包括旷场实验、新物体识别、莫斯利水迷宫实验;补充DACN8320能缓解结肠的损伤,缓解结肠炎症,能够显著降低肠道通透性,增加结肠紧密连接蛋白ZO-1、Claudin-1的表达的表达;补充DACN8320能显著改善睡眠剥夺小鼠外周炎症的发生,能够减少TNF-α、IL-1β、IL-6的表达,增加IL-10的表达;补充DACN8320能够减少血脑屏障的损伤,增加Claudin-5、ZO-1、MUC2、Occludin的表达,同时补充DACN8320可减轻海马组织的病理损伤、减少小胶质细胞的活化、增加小胶质细胞M2极化体征指标Ym1、Arg1和Klf4的表达,尤其是Ym1、Arg1的表达。因此,可以将发酵粘液乳杆菌DACN8320用于预防和/或治疗睡眠剥夺的认知障碍及相关神经退行性疾病,或者作为药物,或者作为功能性益生菌应用到食品、食品添加剂、保健品或饲料中。
附图说明
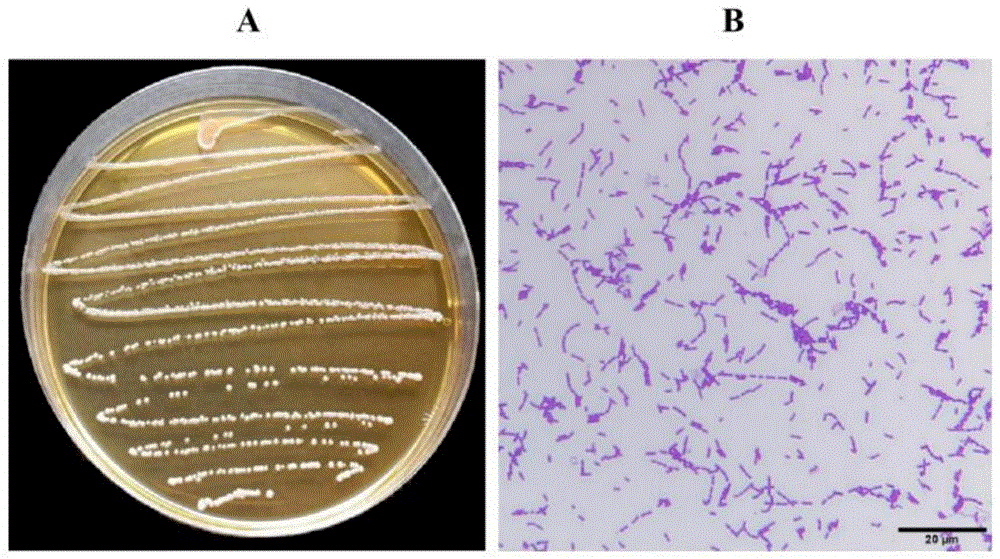
图1为发酵粘液乳杆菌DACN8320分离菌株菌落形态(A)及革兰氏染结果(B)。
图2为发酵粘液乳杆菌DACN8320的系统发育树的构建结果。
图3为发酵粘液乳杆菌DACN8320的API 50CH反应结果。
图4为发酵粘液乳杆菌DACN8320对人工胃酸、胆盐的耐受性结果。
图5为发酵粘液乳杆菌DACN8320体外抗氧化能力(DPPH、ABTS)的实验结果。
图6为发酵粘液乳杆菌DACN8320菌溶血活性实验结果:金黄色葡萄球菌ATCC25923(A);发酵粘液乳杆菌DACN8320(B)。
图7显示了旷场实验结果:旷场实验轨迹图(A);旷场实验行进的总距离(B);旷场实验小鼠进入中心区域的时间(C)。
图8显示了新物体实验识别指数。
图9显示了MWM试验中,各组小鼠连续5天的逃避潜伏期。
图10为在MWM实验中小鼠的轨迹图(A),第一次到达平台的逃避潜伏期(B),穿越平台的次数(C),在平台象限的时间百分比(D)。
图11显示了补充DACN8320对肠道屏障的影响:小鼠结肠病理组织变化(A);肠道屏障相关基因表达情况(B)。
图12显示了补充DACN8320对血清TNF-α、IL-1β、IL-6及IL-10的影响。
图13显示了补充DACN8320对血脑屏障的影响:小鼠海马病理组织变化(A);血脑屏障相关基因表达情况(B)。
图14显示了补充DACN8320对血脑屏障的影响:海马小胶质细胞活化标志物Iba1免疫荧光(A-B);M2极化特征指标的表达(C)。
图7-14中,CON--对照组、SD--睡眠剥夺组、DACN8320--DACN8320干预组。
具体实施方式
下面结合实施例对本发明作进一步说明,但并不因此而限制本发明。
下述实施例中的实验方法,如无特别说明,均为常规方法;所用材料、试剂等如无特殊说明均从商业途径所得到。
实施例1:菌种的培养及体外益生特性分析
1实验材料
发酵粘液乳杆菌DACN8320菌株:来源于西南大学食品科学学院索化夷实验室菌种库。
本申请用到的发酵粘液乳杆菌DACN8320的保藏信息如下:
将发酵粘液乳杆菌DACN8320菌株于2023年11月送中国典型培养物保藏中心(简称CCTCC)进行保藏,地址为湖北省武汉市武昌区八一路299号武汉大学校内,保藏日期:2023年11月27日,保藏编号:CCTCCNO:M 20232332,分类命名为:发酵粘液乳杆菌DACN8320Limosilactobacillusfermentun DACN8320。
2实验方法
2.1乳酸菌的形态学鉴定
按照革兰氏染色试剂盒的说明书对乳酸菌进行染色,然后调节双目显微镜于100倍油镜下观察其形态。
2.2PCR扩增16S rDNA序列
采用细菌基因组DNA提取试剂盒提取菌株的DNA。采用25μL反应体系进行PCR扩增,反应结束后利用琼脂糖凝胶电泳进行检测。合格样品送华大基因科技有限公司测序,测序结果通过NCBI中的BLAST程序进行同源性比对分析。
2.3系统发育树的构建
从GeneBank中选取与所得乳酸菌16S rDNA基因序列同源性大于98%的乳酸菌以及Genome中的标准菌株作为参考的序列,然后使用MEGA5.05程序中Neighbor-Joining方法构建所获菌株的系统发育树。
2.4乳酸菌API 50CH试剂盒的生化鉴定
分离菌株在37℃培养18h,于3000r/min、15min的条件下离心收集菌体,用无菌生理盐水洗涤菌体后重悬为菌悬液。参考梅里埃(法国)API 50CH试剂盒说明书进行操作。
2.5模拟胃肠液耐受能力的测定
益生菌对人工胃液耐受性的测定:取5mL菌株培养液,4℃,8000rpm离心6min收集其菌体,用0.9%灭菌生理盐水4℃,8000rpm,6min清洗3遍,加入5mL灭菌的0.9%生理盐水(0.9%)混匀制成菌悬液,取1mL菌悬液与9mLpH 3.0的人工胃液混合,摇匀,置于恒温振荡器中培养(37℃,100r),并分别在0h和3h取样(10μl),采用平板计数法测定活菌数,计算其存活率(%),存活率大于60%再进行胆盐实验。
人工胃液存活率=3h的活菌数/0h的活菌数×100%
胆盐生长率测定:将活化的菌株按2%的接种量接种在含0.3%和0.0%猪胆盐的液体培养基中,放在37℃摇床培养24h,采用多功能酶标仪测定其OD 600,分别以不接菌的培养基作为空白对照。
0.3%的胆盐生长率=(0.3%接菌OD值-0.3%空白OD值)/0.0%接菌OD值-0.0%空白OD值)×100%
2.6体外抗氧化能力(DPPH、ABTS)测定
菌株在MRS培养基中培养24h连续传代三次,吸取5mL菌株培养液于4℃、8000r/min,离心6min,吸取上清液于10mL离心管,用0.22μm的滤头过滤备用。菌体用1×PBS洗涤三次,最后用PBS将菌液浓度为1.0×109CFU/mL。
DPPH(1-二苯基-2-三硝基苯肼)清除试验:将等量样品(500μL)与0.1mmol/L的DPPH溶液(溶于95%乙醇)振荡混匀后,室温避光静置30min,于4℃、8000r/min,离心3min取上清液测定波长517nm处的吸光度,每个样品做三个平行。
计算公式如下:
式中:Ai-待测样品+DPPH溶液在517nm处吸光度;
Aj-待测样品+95%乙醇溶液在517nm处吸光度;
Ac-DPPH溶液+PBS在517nm处吸光度。
ABTS(2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐)自由基清除试验:将7mM的ABTS与2.45mM的过硫酸钾(1:1v/v)混合,在室温黑暗中放置24h,制备自由基阳离子。孵育后,用蒸馏水稀释ABTS溶液,直到在734nm处的初始吸光度值为0.7±0.005。然后,将50μL菌液与100μL的ABTS溶液混合,室温孵育10min。在734nm处测定了混合物的吸光度,每个样品做三个平行。
计算公式如下:
式中:As-样品的吸光度在734nm处吸光度;
Ac-对照在517nm处吸光度;
2.7菌株溶血试验
将菌株培养24h后,采用平板划线的方法接种含5%无菌脱纤维羊血的MRS平板上,阳性对照选择的是溶血性强大的金黄色葡萄球菌ATCC25923(Staphylococcus aureusATCC25923),然后置于37℃培养箱培养48h,观察菌落周围是否出现溶血现象。若菌落周围出现草绿色环,则为α溶血;若菌落周围出现完全透明的溶血环,则为β溶血;若菌落周围培养基没有变化,则为γ溶血,即不溶血。
2.8数据统计与分析
所有数据均以平均值±标准差(SD)表示。采用SPSS25.0软件中one-way ANOVA和Duncan分析进行显著性分析,当P<0.05时,差异被认为是显着的。每个实验3次生物学重复。
3结果与分析
3.1菌株鉴定形态学鉴定
发酵粘液乳杆菌DACN8320在MRS平板上呈乳白色、圆形;显微镜下菌体呈短杆状排列、无芽孢、无鞭毛,为一类革兰氏阳性菌(图1)。
3.2菌株16S rDNA序列分析
16S rDNA同源性分析结果显示,与GeneBank数据库中已知发酵粘液乳杆菌的同源性达100%,将分离得到的发酵粘液乳杆菌命名为DACN8320,DACN8320的16S rDNA基因扩增产物的双向序列如下(SEQ ID NO.1)所示:
CGGGGGGCGATTGCCTATACATGCAGTCGAACGCGTTGGCCCAATTGATTGATGGTGCTTGCACCTGATTGATTTTGGTCGCCAACGAGTGGCGGACGGGTGAGTAACACGTAGGTAACCTGCCCAGAAGCGGGGGACAACATTTGGAAACAGATGCTAATACCGCATAACAACGTTGTTCGCATGAACAACGCTTAAAAGATGGCTTCTCGCTATCACTTCTGGATGGACCTGCGGTGCATTAGCTTGTTGGTGGGGTAACGGCCTACCAAGGCGATGATGCATAGCCGAGTTGAGAGACTGATCGGCCACAATGGGACTGAGACACGGCCCATACTCCTACGGGAGGCAGCAGTAGGGAATCTTCCACAATGGGCGCAAGCCTGATGGAGCAACACCGCGTGAGTGAAGAAGGGTTTCGGCTCGTAAAGCTCTGTTGTTAAAGAAGAACACGTATGAGATTAACTGTTCATACGTTGACGGTATTTAACCAGAAAGTCACGGCTAACTACGTGCCAGCAGCCGCGGTAATACGTAGGTGGCAAGCGTTATCCGGATTTATTGGGCGTAAAGAGAGTGCAGGCGGTTTTCTAAGTCTGATGTGAAAGCCTTCGGCTTAACCGGAGAAGTGCATCGGAAACTGGATAACTTGAGTGCAGAAGAGGGTAGTGGAACTCCATGTGTAGCGGTGGAATGCGTAGATATATGGAAGAACACCAGTGGCGAAGGCGGCTACCTGGTCTGCAACTGACGCTGAGACTCGAAAGCATGGGTAGCGAACAGGATTAGATACCCTGGTAGTCCATGCCGTAAACGATGAGTGCTAGGTGTTGGAGGGTTTCCGCCCTTCAGTGCCGGAGCTAACGCATTAAGCACTCCGCCTGGGGAGTACGACCGCAAGGTTGAAACTCAAAGGAATTGACGGGGGCCCGCACAAGCGGTGGAGCATGTGGTTTAATTCGAAGCTACGCGAAGAACCTTACCAGGTCTTGACATCTTGCGCCAACCCTAGAGATAGGGCGTTTCCTTCGGGAACGCAATGACAGGTGGTGCATGGTCGTCGTCAGCTCGTGTCGTGAGATGTTGGGTTAAGTCCCGCAACGAGCGCAACCCTTGTTACTAGTTGCCAGCATTAAGTTGGGCACTCTAGTGAGACTGCCGGTGACAAACCGGAGGAAGGTGGGGACGACGTCAGATCATCATGCCCCTTATGACCTGGGCTACACACGTGCTACAATGGACGGTACAACGAGTCGCGAACTCGCGAGGGCAAGCAAATCTCTTAAAACCGTTCTCAGTTCGGACTGCAGGCTGCAACTCGCCTGCACGAAGTCGGAATCGCTAGTAATCGCGGATCAGCATGCCGCGGTGAATACGTTCCCGGGCCTTGTACACACCGCCCGTCACACCATGAGAGTTTGTAACACCCAAAGTCGGTGGGGTAACCTTTTAGGAGCCAGCCGCTAAGTGACAGAGTGG。
3.3菌株系统发育树的构建结果
将菌株DACN8320的16S rRNA基因序列提交至NCBI数据库,通过BLAST构建的系统发育树,DACN8320与Lactobacillusfermentum 6654同源性99%,说明DACN8320为发酵粘液乳杆菌(图2)。
3.4API 50CH试剂盒的生化鉴定结果
实验菌株的API 50CH反应结果(阳性呈黄色、阴性呈蓝色)。表1示出了该菌株对49种碳水化合物发酵试验结果。由图3和表1可知,在供试的49种碳源中,该菌株可以利用其中29种碳水化合物。经API lab plus系统最终鉴定,实验菌株为发酵粘液乳杆菌(Limosilactobacillusfermentun)。
表1发酵粘液乳杆菌DACN8320对49种碳水化合物发酵试验结果
注:“+”代表反应阳性;“-”代表反应阴性。
3.5模拟胃肠液耐受能力的测定结果
胃肠道内的胃液和胆盐可以抑制和终止微生物的生长。在本实验中,发酵粘液乳杆菌DACN8320对pH值为3的胃液和0.3%的胆盐具有良好的耐受性,具有潜在的对人体有益功能(图4)。
3.6体外抗氧化能力(DPPH、ABTS)测定结果
睡眠剥夺导致的包括认知障碍、记忆衰退等大都是与炎症有关,因此,本实验对菌株的体外抗氧化特性进行测试,发酵粘液乳杆菌DACN8320对DPPH、ABTS自由基的清除能力分别达到了59.04±0.60、38.39±4.85,这表明发酵粘液乳杆菌DACN8320具有较好的体外抗氧化能力(图5)。
3.7菌株溶血活性测定结果
左图为金黄色葡萄球菌ATCC25923的结果,菌落周围出现完全透明的溶血环,为β溶血,右图为发酵粘液乳杆菌DACN8320的结果,菌落周围培养基没有变化,为γ溶血。表明菌株DACN8320在溶血方面显示出较高的安全性(图6)。
3.8其它发酵粘液乳杆菌的检测结果
在进行本实施例时,按照上述方法同时检测了多株发酵粘液乳杆菌的相关性能以进行预实验筛选,表2中的8株发酵粘液乳杆菌均为发明人所在实验室筛选到的发酵粘液乳杆菌菌株,相关性能指标结果见表2中所示,基于此结果,挑选了菌株DACN8320用于后续实验。
表28株发酵粘液乳杆菌耐胃酸胆盐以及体外抗氧化活性结果
实施例2:发酵粘液乳杆菌DACN8320对睡眠剥夺小鼠认知障碍的缓解作用1实验材料
实验菌株为发酵粘液乳杆菌DACN8320,保藏编号CCTCC M 20232332。
实验动物为8周龄雄性C57BL/6J小鼠,购自于湖南斯莱克景达实验动物有限公司,动物实验设施许可证编号:SYXK(渝)2020-0006,实验单位使用许可证编号:SYXK(渝)2020-0006。饲养于室温22±2℃、相对湿度50±5%、12h光照/12h黑暗的标准化实验室中,适应性喂养一周后开始实验。
2实验方法
2.1菌株的活化与灌胃制剂的制备
将甘油管中发酵粘液乳杆菌DACN8320以2%的接种量接种于MRS肉汤培养基中,于37℃恒温培养箱培养24h,活化两代之后,取5ml于离心管中,8000r/min,4℃离心5分钟,弃去上清,用0.9%生理盐水洗3遍,最后用生理盐水将菌悬液浓度调整至10
2.2动物模型的构建与分组
将小鼠随机分为对照组(CON)、睡眠剥夺组(SD)、DACN8320组(DACN8320),每组8只。为了减少对环境的影响,小鼠在正式实验前将适应实验室条件1周,适应期期间,CON组放在睡眠剥夺仪中不转动金属棒,SD组和DACN8320组每天打开仪器使小鼠适应旋转2h。采用的是南京卡尔文生物科技有限公司的KW-BD大小鼠睡眠剥夺仪建立睡眠剥夺模型,睡眠剥夺仪底部有一根旋转的金属棒,睡眠剥夺期间金属杆以顺时针/逆时针随机旋转,连续28天保持小鼠每天清醒20小时(中午12点至第二天早上8点),运行速度5圈/分钟,共28天,在实验过程中,定期观察仪器是否正常运行,以确保SD组和DACN8320组小鼠保持清醒。CON组小鼠在同一个仪器里,在整个实验过程中保持静止,并保持正常睡眠。在造模期间,CON组和SD组灌胃生理盐水,DACN8320组按照10ml/kg的剂量采用前面步骤2.1中制备的灌胃制剂进行灌胃,每天上午十点进行灌胃,3天称一次小鼠体重,实验期间小鼠自由饮水。
28天造模结束后,进行行为学实验,包括旷场实验(OFT)、新物体识别(NOR)、莫斯利水迷宫(MWM)。在第28天,用无菌离心管收集小鼠粪便,-80℃保存;小鼠禁食不禁水12h,采用摘眼球取血,于4℃、3000r/min离心15min收集血清,-80℃保存备用;取血后脱颈椎处死,立即收集小鼠下丘脑、海马、大脑皮层、十二指肠、空肠、回肠、盲肠以及结肠组织;取大脑全脑和1cm左右结肠组织,立即放入10%福尔马林溶液中固定;最后将所有组织置于液氮中冷冻,最终放入-80℃保存备用。
2.3小鼠行为学测试
旷场实验(OFT):实验在安静的环境下进行。将动物放入40cm×40cm箱内底面中心,同时进行摄像和计时。观察5min后停止摄像,实验计算后5min小鼠行进旷场中心停留时间和总路程。
新物体识别(NOR):该测试由三个阶段组成:习惯化、训练和测试。习惯化,将小鼠单独适应一个测试箱5min。训练,两个完全相同的物体被放置在该区域中心的一侧,让小鼠探索物体和区域5min。测试,用一个熟悉的物体和一个新的物体代替第二个物体小鼠自由探索这些物体5min。记录并分析探索熟悉物体(TF)和探索新物体的时间(TN)。识别指数(RI)的计算方法如下:RI=[TN/(TN+TF)]×100%。
莫斯利水迷宫(MWM):水迷宫是一个圆柱形的水箱(直径120厘米,高度40厘米),里面装满了水(水深30厘米,温度21±1℃)。水箱被人工划分为四个象限,在整个测试过程中,一个隐藏在水面下1.0厘米的透明圆形平台被放置在一个恒定的象限内。在采集实验中,训练小鼠连续5天以60秒的截止时间定位隐藏平台。每天,老鼠从不同的位置伪随机地慢慢地放入水中,面对水箱壁。如果鼠标在60秒内没有找到平台,则将手动引导其到平台,并允许其在平台上停留15秒。通过视频捕捉系统记录了小鼠的逃逸潜伏期和游泳路径。在第6天,进行空间探针试验,以确定记忆保留情况。这些小鼠在平台被移出的水箱中自由游泳60秒。并记录了在目标象限所花费的时间和跨越平台的次数。
2.4H&E染色
将新鲜的结肠和海马组织在4%多聚甲醛中固定24小时以上,一系列乙醇溶液中脱水,石蜡包埋,切成4μm厚的切片。脱蜡脱水后,切片用苏木精和伊红染色进行形态学检查。用光学显微镜观察染色组织,并取图像进行组织病理学分析。最后在荧光正置显微镜下进行观察,采集图像。
2.5血清TNF-α、IL-1β、IL-6、IL-10的测定
将冻存的血清置于冰上使其缓慢解冻。根据制造商的说明,测定TNF-α,IL-1β,IL-6和IL-10的浓度。随后,在450nm处读取光密度(OD)值,并以ug/ml表示浓度。
2.6补充DACN8320对小鼠炎症、肠道屏障/血脑屏障以及小胶质细胞活化的影响
取少量结肠、海马组织,使用TRIzol试剂法提取总RNA并进行纯度与浓度检测。按照cDNA合成试剂盒RevertAidFirstStrandcDNASynthesisKit说明书将总RNA反转录成cDNA,随后使用20μL PCR体系进行序列扩增,PCR程序为:95℃预变性10min;之后在95℃变性15s,60℃退火1min,72℃延伸30s条件下循环40次。实验采用
表1目的基因及对应的扩增引物序列
2.7免疫荧光
海马组织用4%多聚甲醛固定,用0.3%Triton X-100浸润。非特异性结合位点被5%牛血清白蛋白(BSA)阻断。组织与一抗Iba1孵育,然后与荧光素异硫氰酸酯偶联的二抗孵育。细胞核用DAPI染色,并使用共聚焦显微镜拍摄图像。
2.8数据统计与分析
所有数据均以平均值±平均值的标准误差(SEM)表示。采用SPSS25.0软件中one-way ANOVA和Duncan分析进行显著性分析,当P<0.05时,差异被认为是显著的,Graphpad.Prism.8.4作图。每个实验3次生物学重复。
3结果与分析
3.1行为学实验结果
旷场实验(OFT):旷场实验可反映小鼠对陌生环境的好奇心和探索行为。与CON组小鼠相比,SD组小鼠进入中心区域的时间较短,补充DACN8320之后延长了小鼠进入中心区域的时间,轨迹图能够更加清晰地呈现。补充DACN8320可以一定程度缓解这一现象(图7)。
新物体识别(NOR):新物体识别可用来评估小鼠的识别记忆缺陷。与CON组相比,睡眠剥夺组小鼠的识别指数显著降低(p<0.05),补充DACN8320后,新物体实验识别指数增加,与CON组相比无显著差异(p>0.05)(图8)。这表明,睡眠剥夺会导致小鼠识别记忆缺陷,补充DACN8320可缓解这一情况。
莫斯利水迷宫(MWM):水迷宫通常用于评价小鼠的空间学习和记忆能力,也是评价小鼠认知障碍的经典方法。在定位航行训练过程中,与CON组相比,SD组小鼠的逃避潜伏期显著降低(p<0.0001),随着训练天数的增加,除了SD组变化不大,CON组和DACN8320组小鼠到达隐藏平台的时间缩短(图9)。与CON组相比睡眠剥夺后的小鼠第一次到达平台的逃避潜伏期延长和穿越平台的次数减少(p<0.05)、增加穿越平台的次数(p<0.05)、小鼠在在平台象限的时间百分比也会一定程度下降,补充DACN8320会减轻这些情况(图10)。综上所述,MWM试验数据表明,睡眠剥夺会影响小鼠的空间学习记忆能力,导致小鼠认知障碍,而补充DACN8320可以缓解睡眠剥夺导致的认知障碍。
3.2结肠H&E染色及Claudin-1、ZO-1、Occludin表达情况
H&E染色可直观的展示组织的损伤情况,与CON组相比,SD组结肠隐窝损伤,炎症浸润现象严重,而DACN8320可改善小鼠结肠的损伤情况(图11A)。
肠道通透性与肠屏障功能有关,其正常的肠道通透性取决于肠黏膜屏障的完整性。肠道通透性的增加使得许多不应该进入血液的物质进入血液循环,这使得炎症以及相关疾病的产生。实验结果表明,补充DACN8320能够逆转睡眠剥夺造成的结肠组织中ZO-1、Occludin和Claudin-1基因水平的表达降低。其中DACN8320对结肠Claudin-1、ZO-1的表达的具有一定改善作用(图11B)。
3.3血清TNF-α、IL-1β、IL-6及IL-10变化结果
肠道屏障损坏,相关炎症会通过其进入血液,本实验采用酶联免疫吸附测定(ELISA)测定小鼠血清的炎症因子变化情况。实验结果表明,睡眠剥夺后,血清中促炎因子TNF-α、IL-1β、IL-6增加,抗炎因子IL-10下降,补充DACN8320可以降低抗炎因子,增加促炎因子的表达,对炎症有改善作用(图12)。
3.3海马H&E染色及Claudin-5、ZO-1、MUC2、Occludin的表达情况
实验结果显示,与CON组相比,SD组脑组织结构重度异常,整体结构疏松水肿,组织间隙增大,海马DG区神经元排列紊乱,大量神经元变性,胞体皱缩深染,CA1、CA3区域可见少量神经元变性。而补充DACN8320能够有效改善小鼠海马各区神经元(CA1、DG、CA3)的退行性病变。绿色箭头所示CA1,黑色箭头所示CA3,红色箭头所示DG区(图13A)。
血脑屏障的保护大脑的重要屏障,能够组织有害物质进入大脑引起损伤。实验结果表明,补充DACN8320能够逆转睡眠剥夺造成的海马组织中Claudin-5、ZO-1、MUC2、Occludin基因水平的表达降低。其中DACN8320对海马Claudin-5、ZO-1的表达的具显著改善作用(图13B)。
3.4小胶质细胞活化标志物Iba1以及M2极化特征指标的表达
中枢神经系统(CNS)中主要的免疫细胞类型是小胶质细胞,在大脑中,小胶质细胞进行稳态监测,作为病理变化的传感器。研究表明,表达炎症表型的小胶质细胞可以改变海马神经源性生态位,减少细胞增殖和新神经元的存活和功能,这些损伤会导致认知障碍。实验结果表明,补充DACN8320可减少小胶质细胞的活化,从而减轻神经炎症(图14A-B)。
CD68也是小胶质细胞活化标志物,补充DACN8320后能够显著降低CD68的表达;Ym1、Arg1和Klf4是小胶质细胞的M2极化特征指标,小胶质细胞发生M2极化会释放抗炎因子保护大脑,补充DACN8320后能够升高Ym1、Arg1和Klf4的表达,尤其是Ym1、Arg1的表达(图14C)。
- 一株发酵粘液乳杆菌JF5及其在制备减脂和助消化食品药品中的应用
- 一株发酵粘液乳杆菌及其在改善面部泛红和I型玫瑰痤疮中的应用
